Similar presentations:
Лекция 12. Биологически активные гетерофункциональные производные ароматического и гетероциклического рядов
1.
Лекция 12Биологически активные
гетерофункциональные
производные ароматического и
гетероциклического рядов
2.
План12.1.
Биологически
ароматического ряда
активные
производные
12.2. Пятичленные гетероциклы с одним атомом
азота
12.3. Шестичленные гетероциклы с одним атомом
азота
12.4. Пятичленные гетероциклы с двумя атомами
азота
12.5. Шестичленные гетероциклы с двумя атомами
азота
12.6. Понятие об алкалоидах
3.
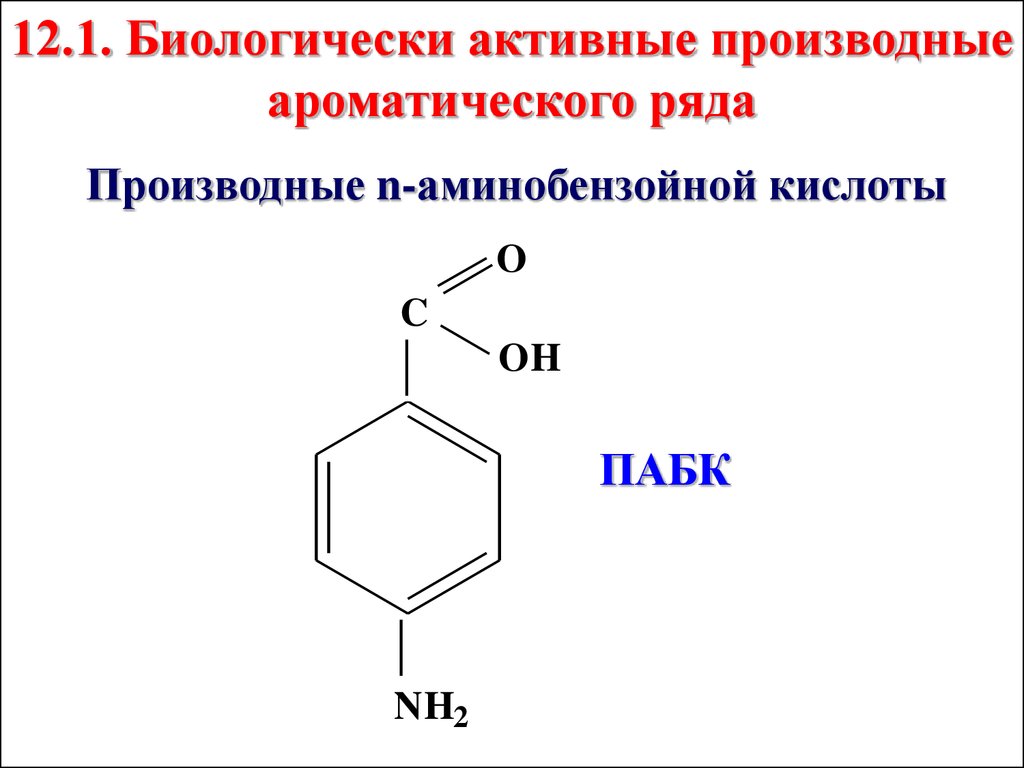
12.1. Биологически активные производныеароматического ряда
Производные n-аминобензойной кислоты
O
C
OH
ПАБК
NH2
4.
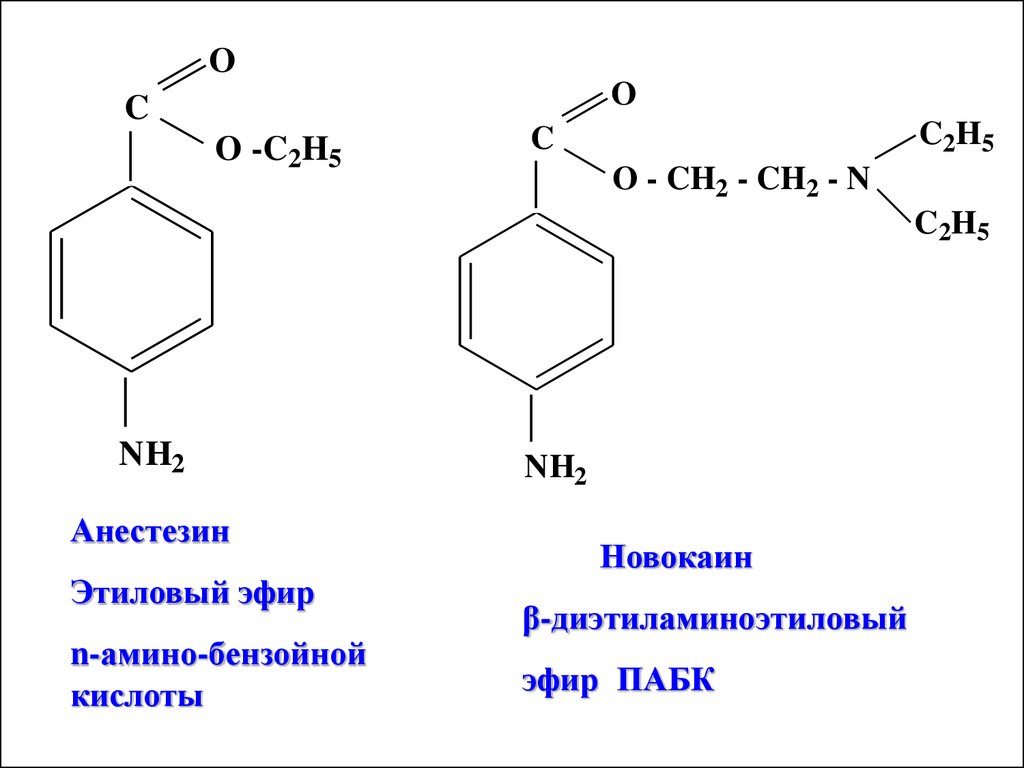
OO
C
O -C2H5
C2H5
C
O - CH2 - CH2 - N
C2H5
NH2
Анестезин
Этиловый эфир
n-амино-бензойной
кислоты
NH2
Новокаин
β-диэтиламиноэтиловый
эфир ПАБК
5.
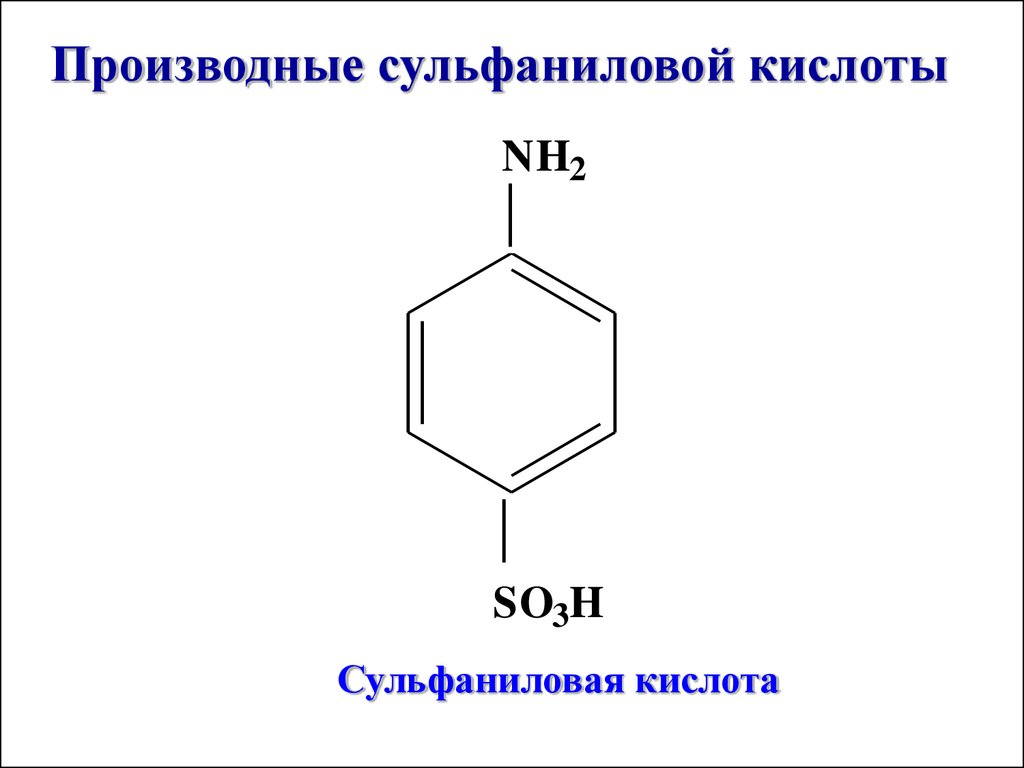
Производные сульфаниловой кислотыNH2
SO3H
Сульфаниловая кислота
6.
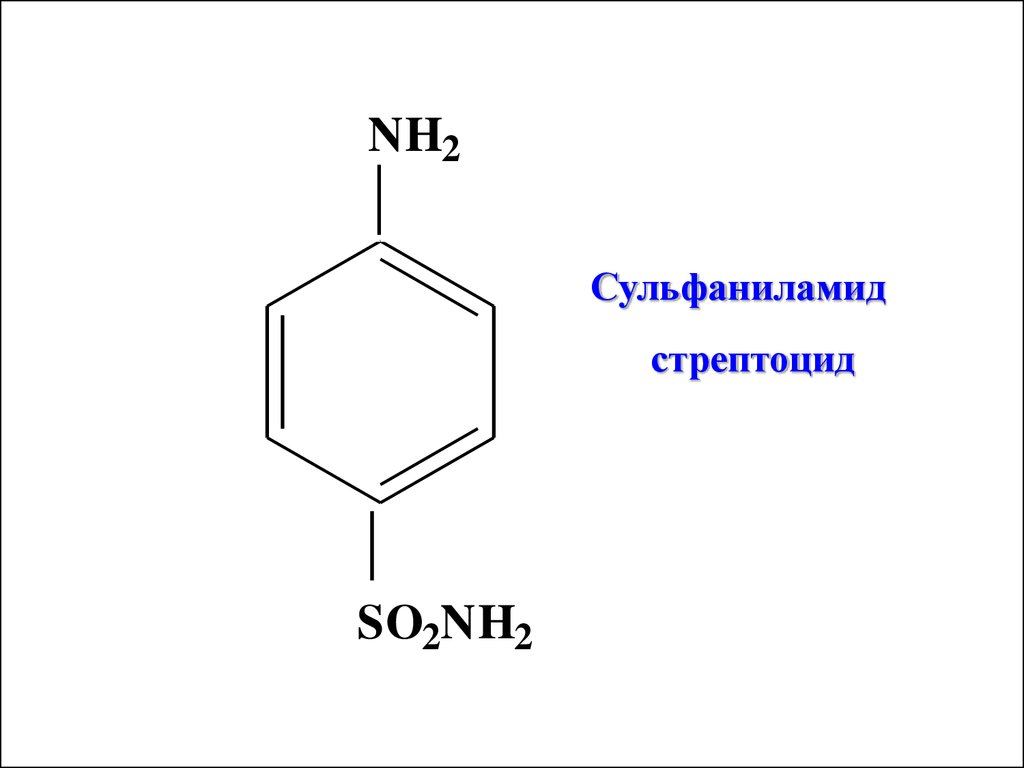
NH2Сульфаниламид
стрептоцид
SO2NH2
7.
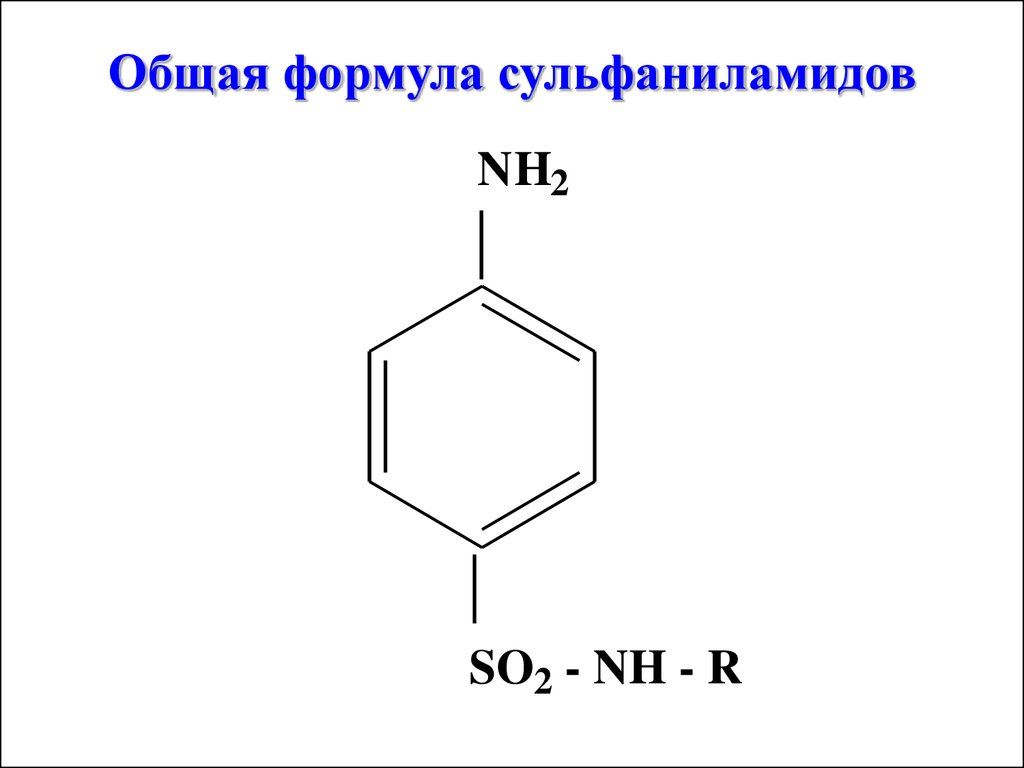
Общая формула сульфаниламидовNH2
SO2 - NH - R
8.
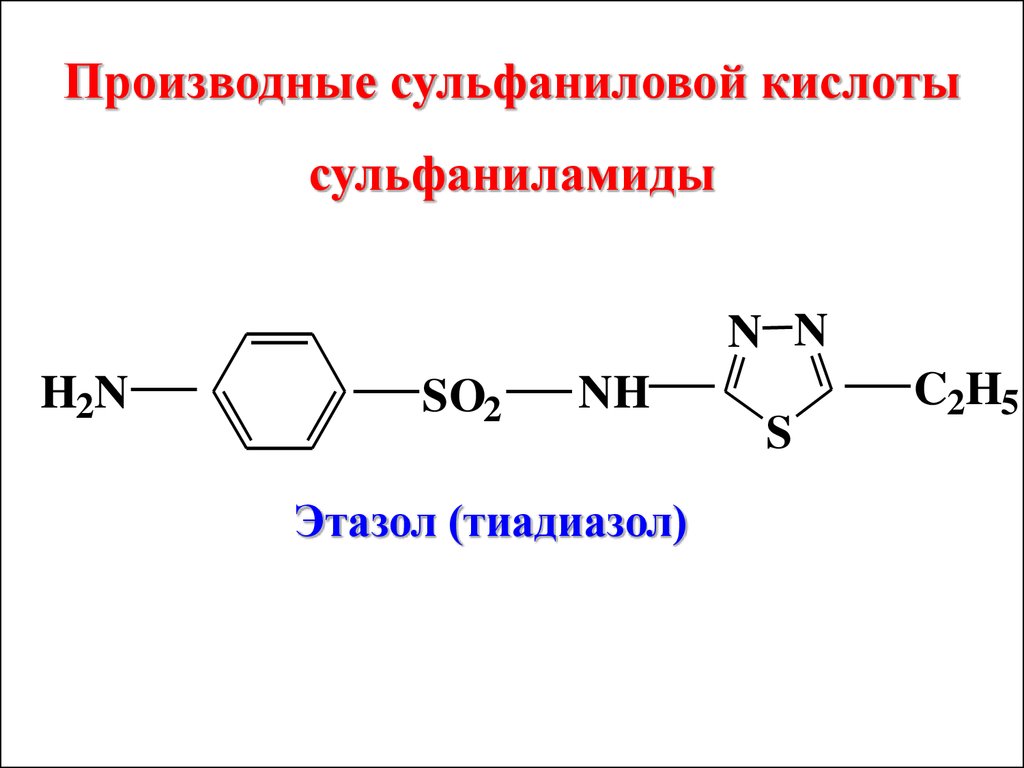
Производные сульфаниловой кислотысульфаниламиды
N N
H2N
SO2
NH
Этазол (тиадиазол)
S
C2H5
9.
Производные сульфаниловой кислотысульфаниламиды
N
H2N
SO2
NH
Норсульфазол (тиазол)
S
10.
Производные сульфаниловой кислотысульфаниламиды
Сульфадиметоксин
11.
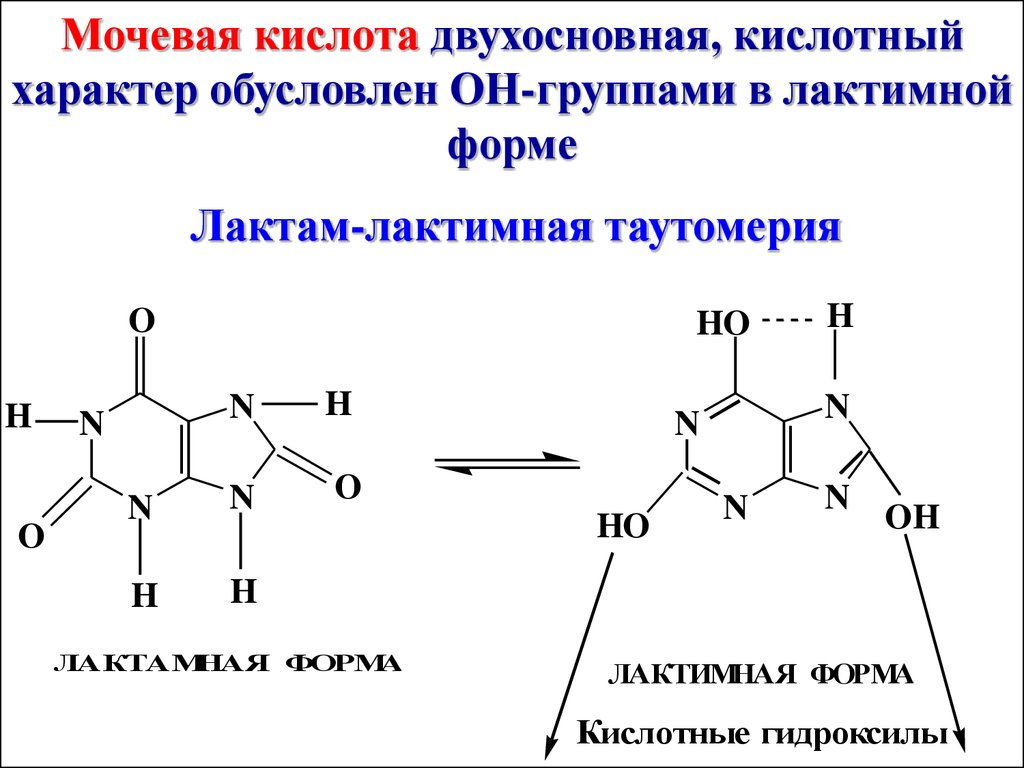
Антибактериальное действие:сульфаниламиды являются
антагонистами по отношению
к n-аминобензойной кислоте,
участвующей в биосинтезе
фолиевой кислоты,которая
является фактором роста для
микроорганизмов
12.
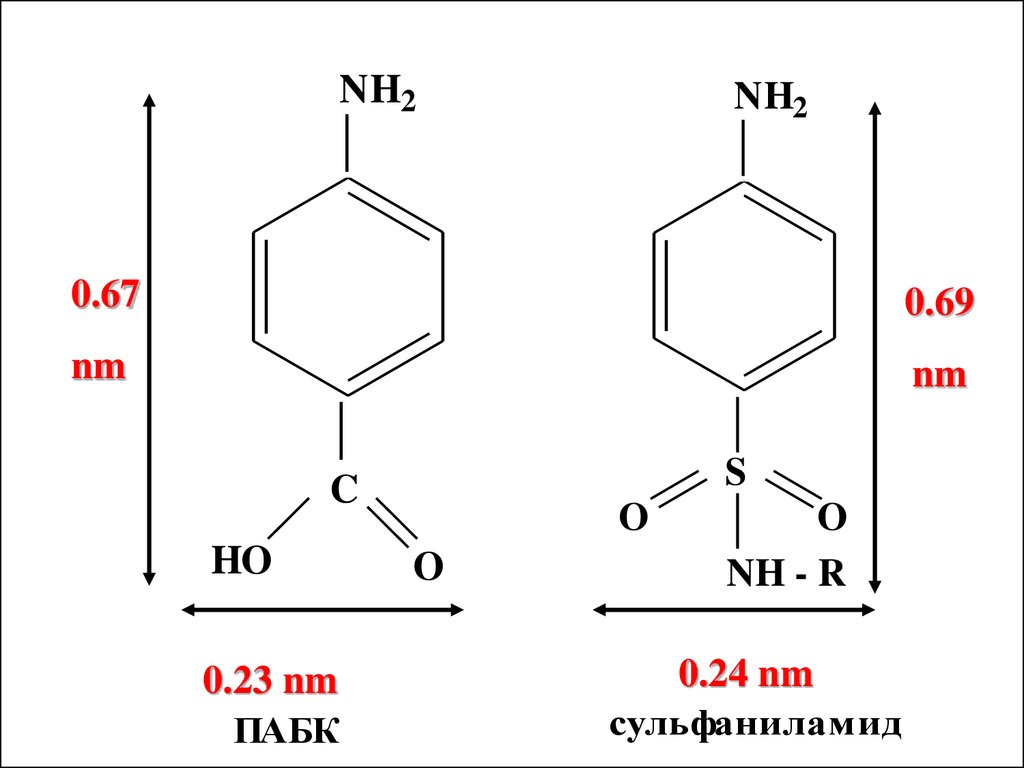
NH2NH2
0.67
0.69
nm
nm
S
C
HO
0.23 nm
ПАБК
O
O
O
NH - R
0.24 nm
сульфаниламид
13.
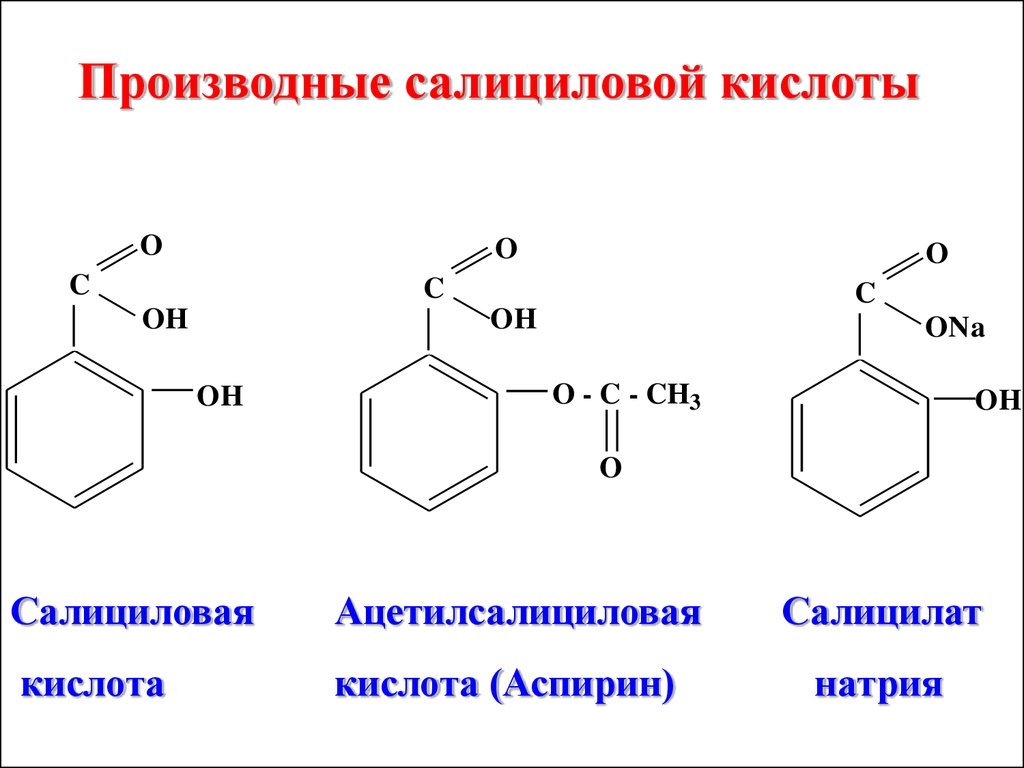
Производные салициловой кислотыO
O
C
O
C
OH
C
OH
OH
ONa
O - C - CH3
OH
O
Салициловая
Ацетилсалициловая
кислота
кислота (Аспирин)
Салицилат
натрия
14.
Ацетилсалициловая кислотаАспирин обладает анальгетическим, жаропонижающим,
противовоспалительным
действием, улучшает реологические свойства крови
15.
Производные салициловой кислотыO
O
O
C
C
OH
C
OCH3
OC6H5
OH
OH
OH
NH2
Метилсалицилат
Фенилсалицилат
n-аминосалициловая
Салол
кислота
16.
Метилсалицилат – жаропонижающеесредство, применяется наружно, в
мазях
Фенилсалицилат применяется как
дезинфицирующее
средство
при
кишечных заболеваниях
n-аминосалициловая кислота
дает
противотуберкулезным
ствием
обладей-
17.
12.2. Пятичленные гетероциклы содним атомом азота
Преимущественное положение
среди биологически активных
веществ занимают соединения,
структурную основу которых
составляют азотсодержащие
гетероциклы
18.
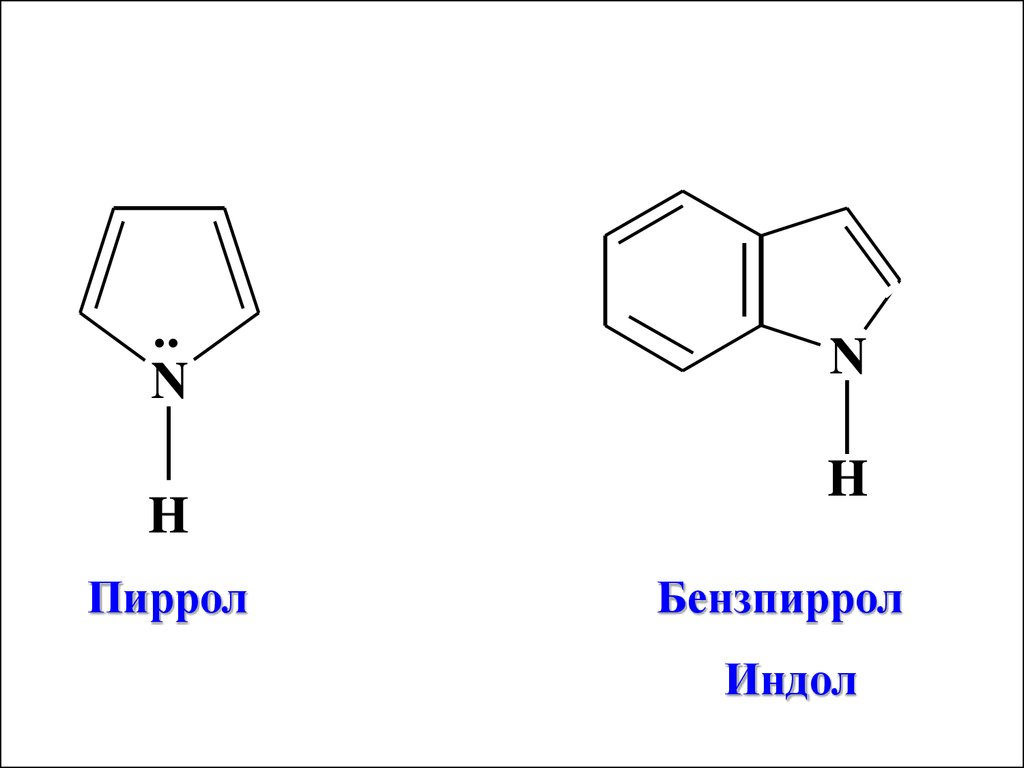
..N
H
Пиррол
N
H
Бензпиррол
Индол
19.
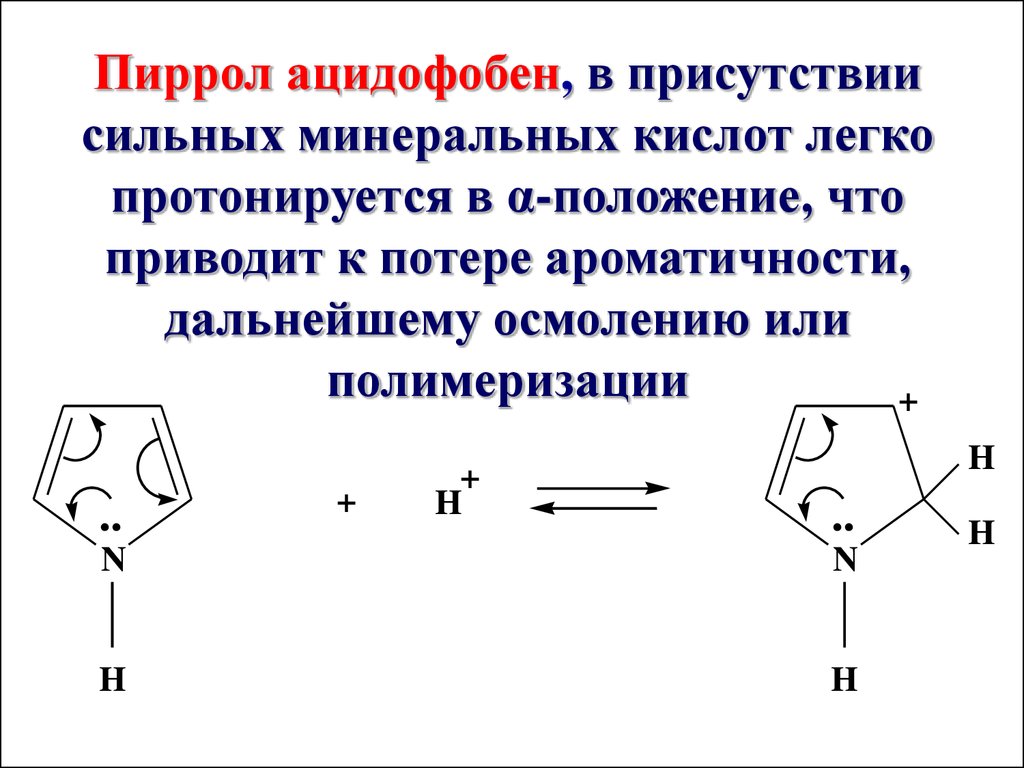
Пиррол ацидофобен, в присутствиисильных минеральных кислот легко
протонируется в α-положение, что
приводит к потере ароматичности,
дальнейшему осмолению или
полимеризации
+
..
+
+
H
H
..
N
N
H
H
H
20.
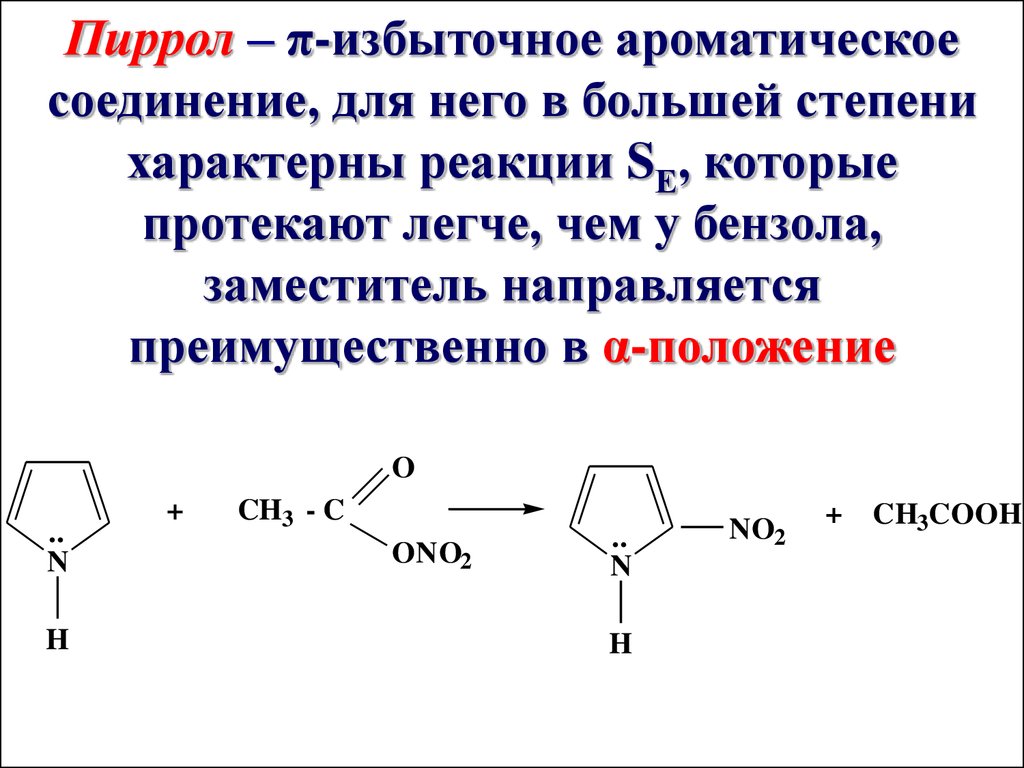
Пиррол – π-избыточное ароматическоесоединение, для него в большей степени
характерны реакции SЕ, которые
протекают легче, чем у бензола,
заместитель направляется
преимущественно в α-положение
O
..
N
H
+
CH3 - C
ONO2
..
N
H
NO2
+ CH3COOH
21.
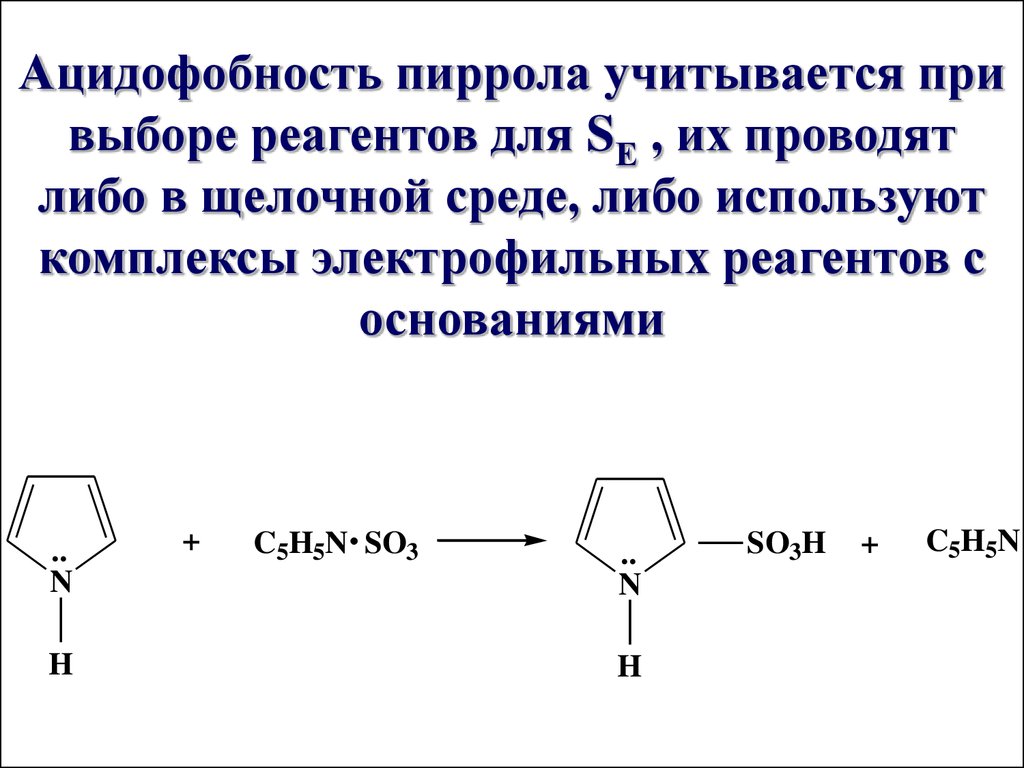
Ацидофобность пиррола учитывается привыборе реагентов для SЕ , их проводят
либо в щелочной среде, либо используют
комплексы электрофильных реагентов с
основаниями
..
N
H
+
C5H5N SO3
..
N
H
SO3H
+
C5H5N
22.
Пиррол и его производныесинтезируются в процессе
жизнедеятельности
животных и растений,
применяются в медицине и
фармацевтической
промышленности
23.
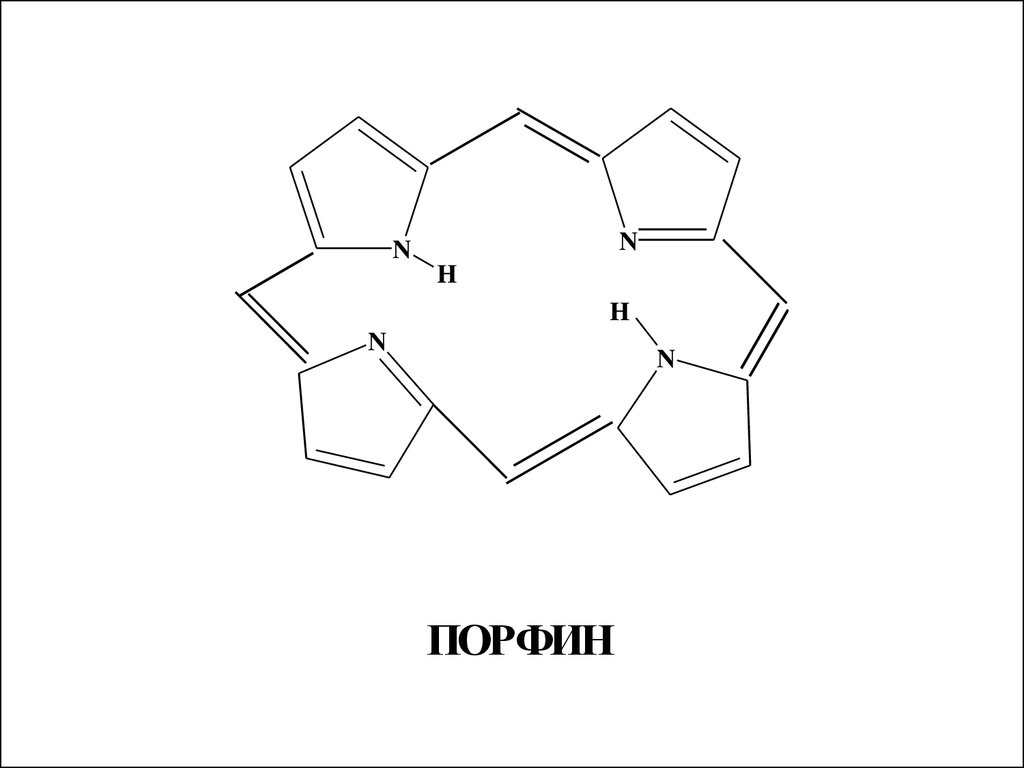
4 пиррольных кольца образуютциклическую сопряженную систему
порфин, которая входит в состав
хлорофилла, гемоглобина и
цитохромов. Порфиновое кольцо
обладает высокой
термодинамической устойчивостью,
его энергия сопряжения ≈ 840
кДж/моль. Порфиновый цикл может
содержать различные заместители
24.
NN
H
H
N
N
ПОРФИН
25.
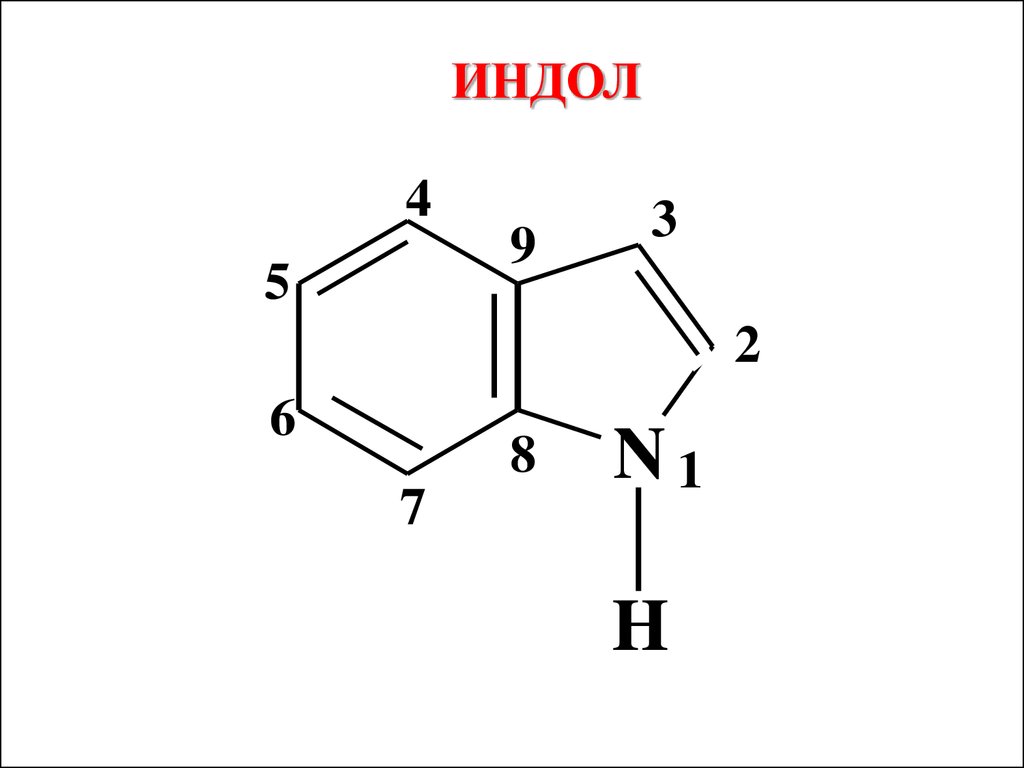
ИНДОЛ4
5
9
3
2
6
8
7
N1
H
26.
Индол – б/ц кристаллическое вещество,его циклическая система входит в состав
многих природных веществ –
аминокислот, алкалоидов
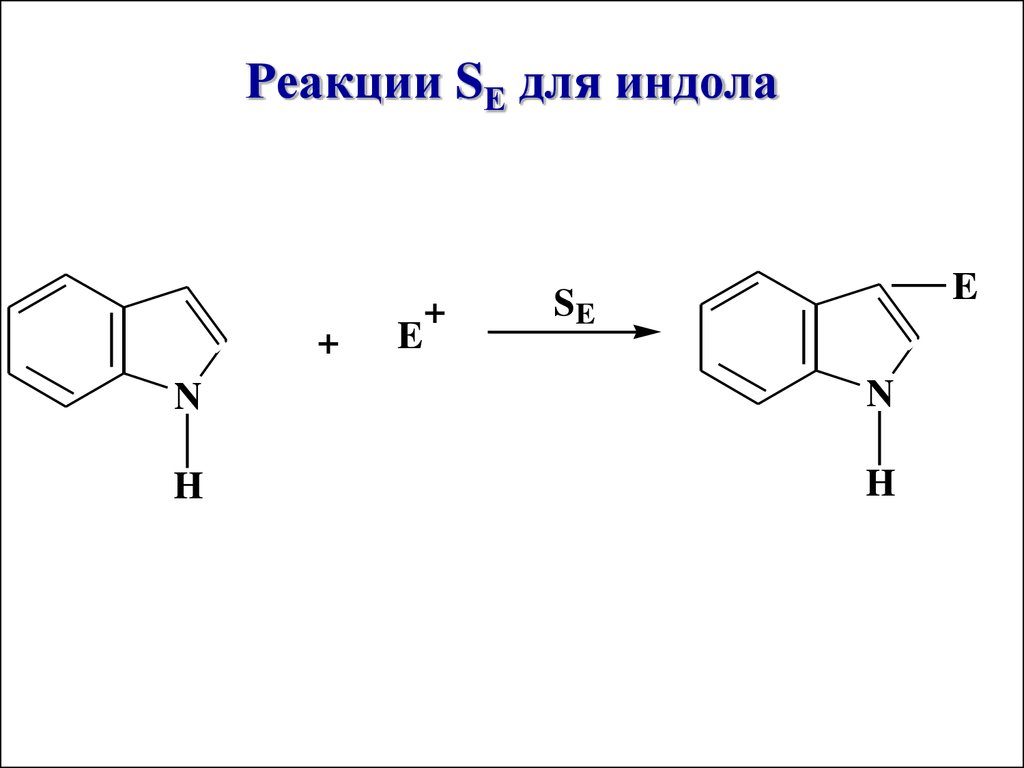
Индол – ароматическое соединение,
содержит 10 π-электронов, по
химическим свойствам сходен с
пирролом, но в отличие от него, реакции
SЕ протекают по β-положению
27.
Реакции SЕ для индола+
E
+
E
SE
N
N
H
H
28.
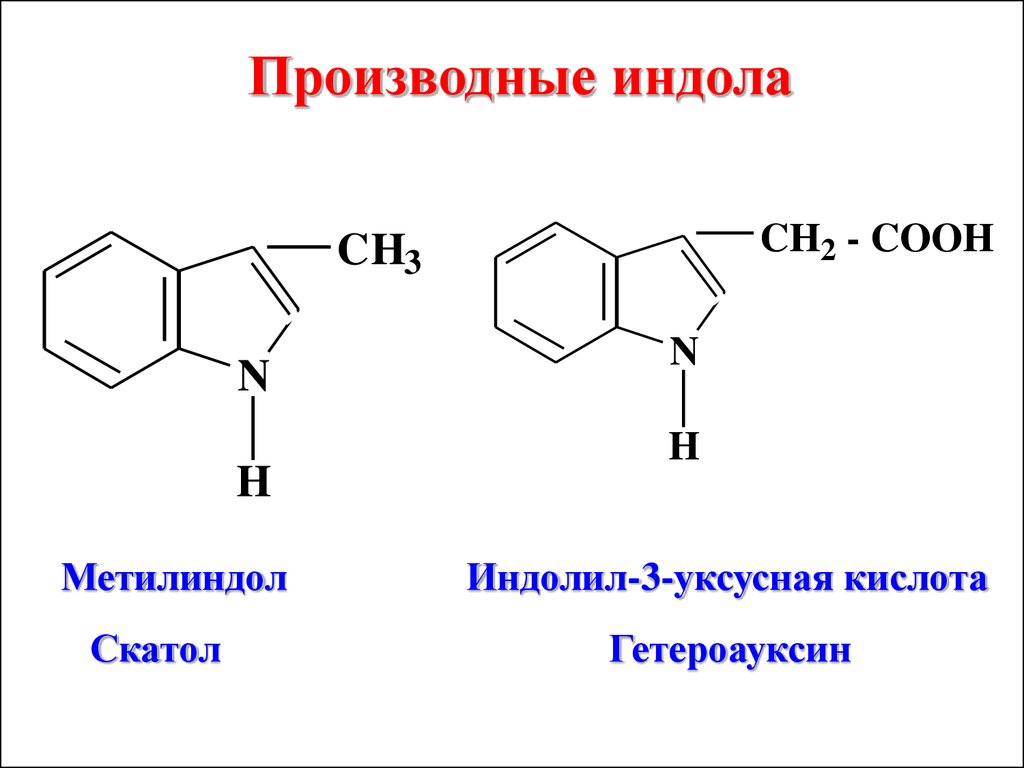
Производные индолаCH2 - COOH
CH3
N
H
Метилиндол
Скатол
N
H
Индолил-3-уксусная кислота
Гетероауксин
29.
Скатол образуется в живоморганизме как конечный продукт
азотистого обмена веществ
Гетероауксин - кристаллическое
вещество – природный гормон,
стимулятор роста растений,
оказывает стимулирующий
эффект в малых дозах
30.
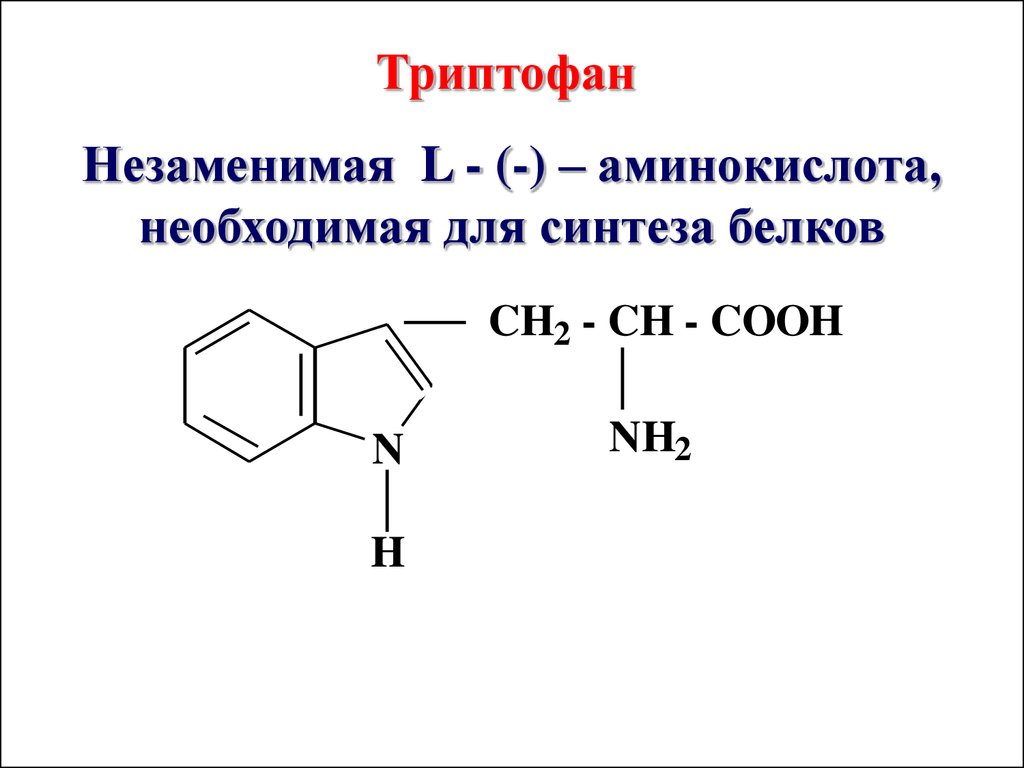
ТриптофанНезаменимая L - (-) – аминокислота,
необходимая для синтеза белков
CH2 - CH - COOH
N
H
NH2
31.
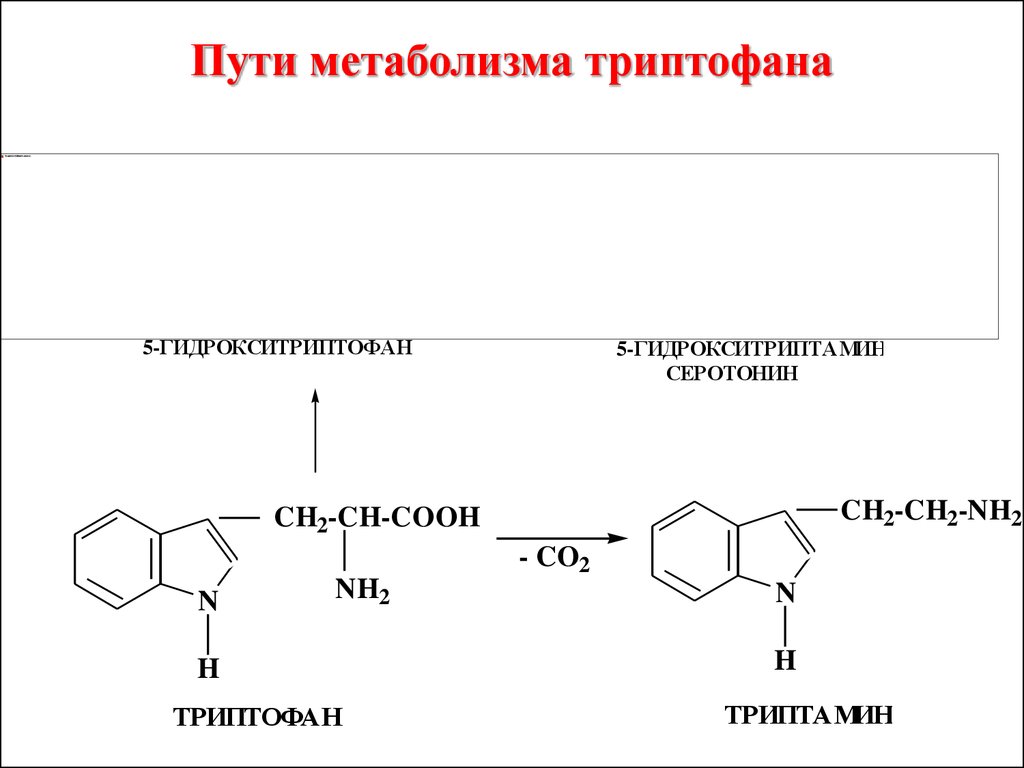
Продукты биологическогорасщепления триптофана:
скатол, гетероауксин,
триптамин – биогенный амин,
серотонин – нейромедиатор
головного мозга, нарушение его
обмена приводит к шизофрении
и другим психическим
заболеваниям
32.
Пути метаболизма триптофана5-ГИДРОКСИТРИПТОФАН
5-ГИДРОКСИТРИПТАМИН
СЕРОТОНИН
CH2-CH2-NH2
CH2-CH-COOH
- CO2
N
NH2
H
ТРИПТОФАН
N
H
ТРИПТАМИН
33.
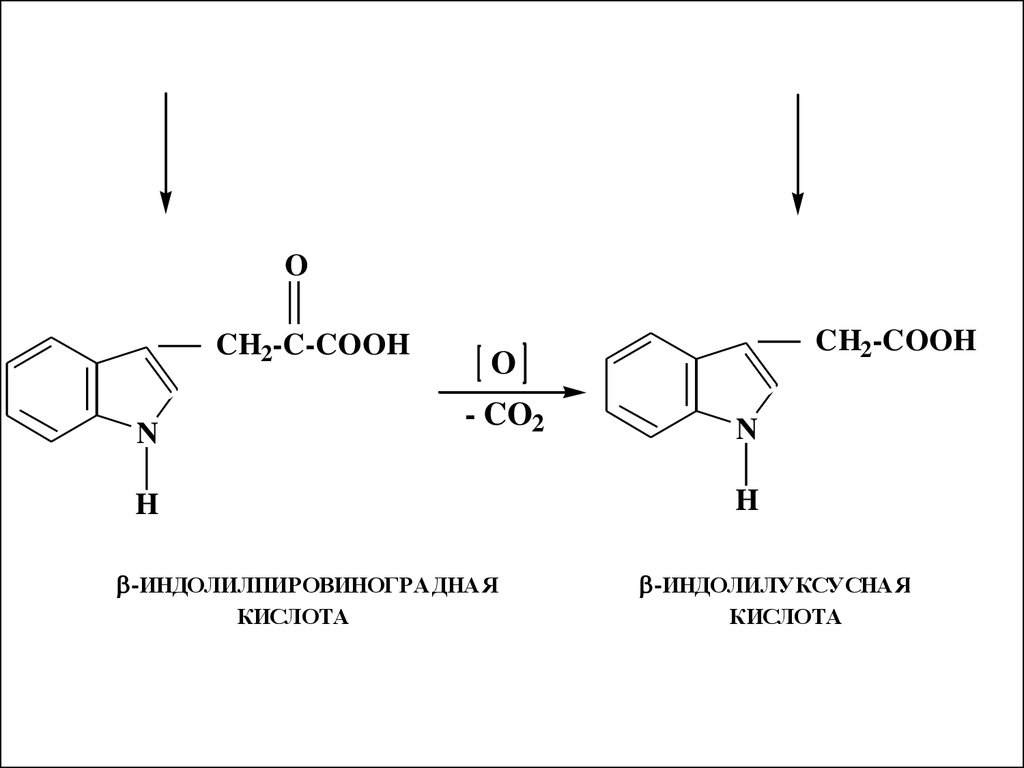
OCH2-C-COOH
O
- CO2
N
CH2-COOH
N
H
H
-ИНДОЛИЛПИРОВИНОГРАДНАЯ
КИСЛОТА
-ИНДОЛИЛУКСУСНАЯ
КИСЛОТА
34.
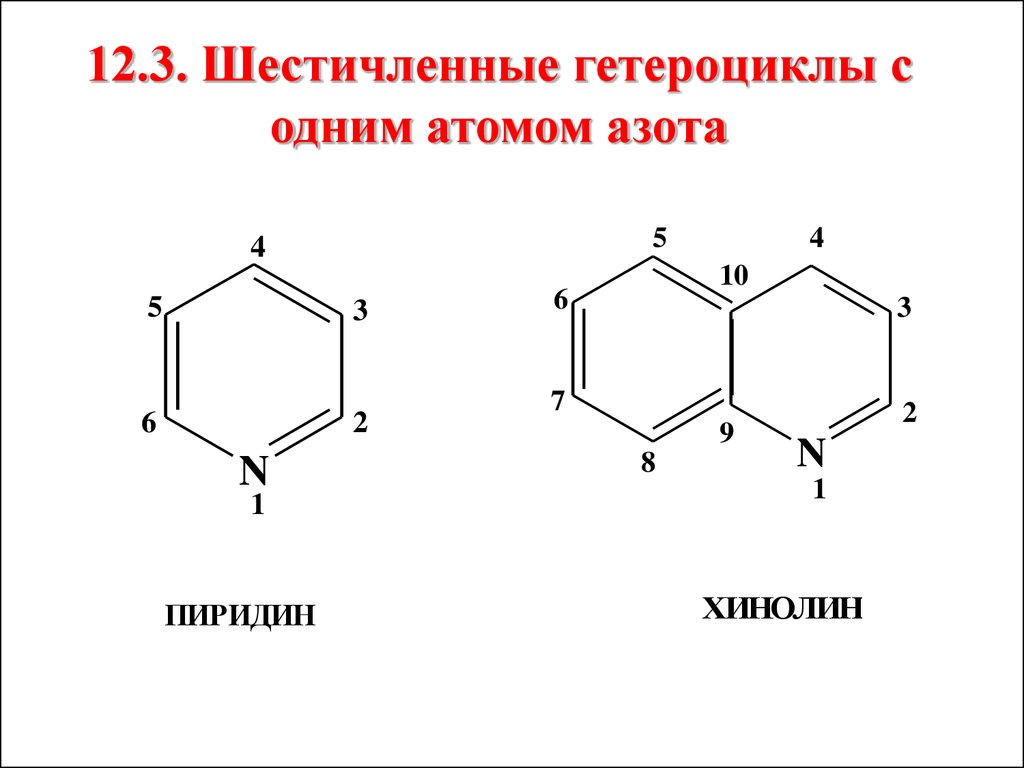
12.3. Шестичленные гетероциклы содним атомом азота
5
4
5
3
6
2
N
1
ПИРИДИН
4
10
6
3
7
9
8
2
N
1
ХИНОЛИН
35.
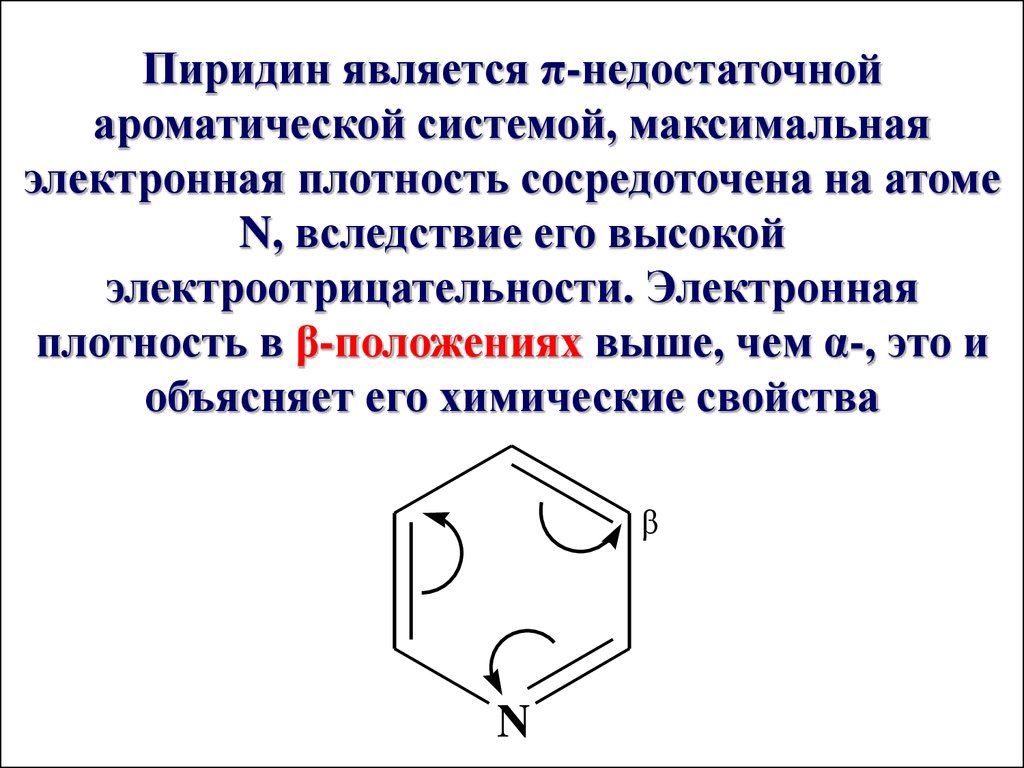
Пиридин является π-недостаточнойароматической системой, максимальная
электронная плотность сосредоточена на атоме
N, вследствие его высокой
электроотрицательности. Электронная
плотность в β-положениях выше, чем α-, это и
объясняет его химические свойства
β
N
36.
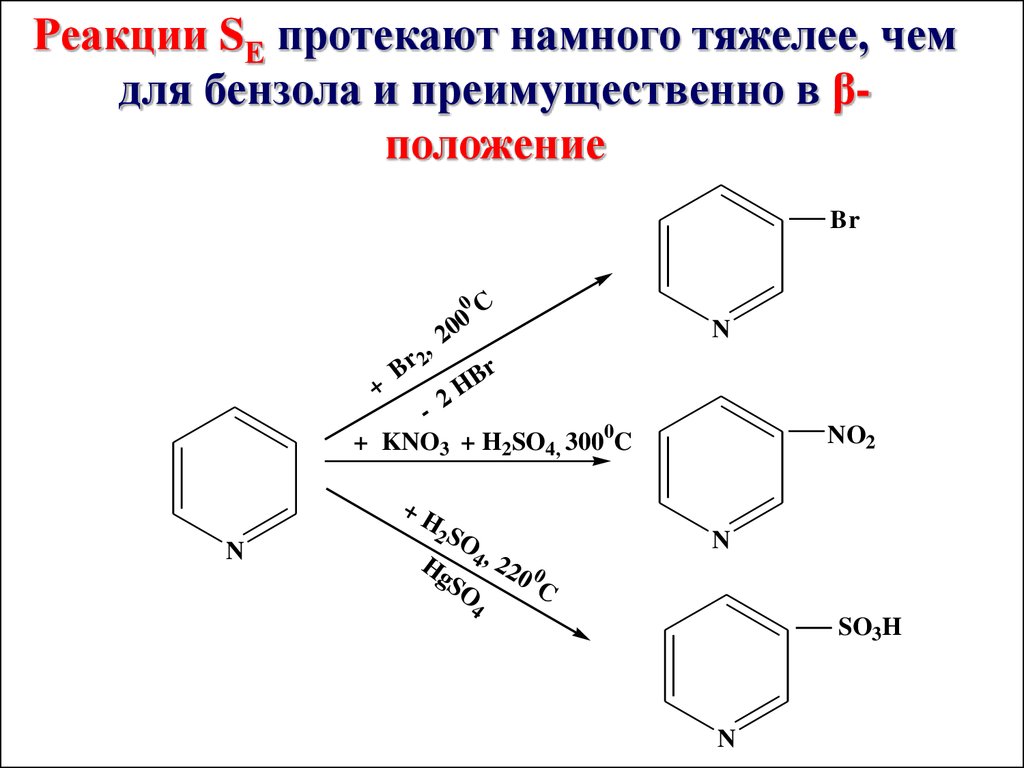
Реакции SЕ протекают намного тяжелее, чемдля бензола и преимущественно в βположение
Br
0
+
B
0
20
r 2,
C
N
Br
H
2
+ KNO3 + H2SO4, 3000C
NO2
+H
N
2 SO
H 4, 2
gS
O
N
20 0
C
4
SO3H
N
37.
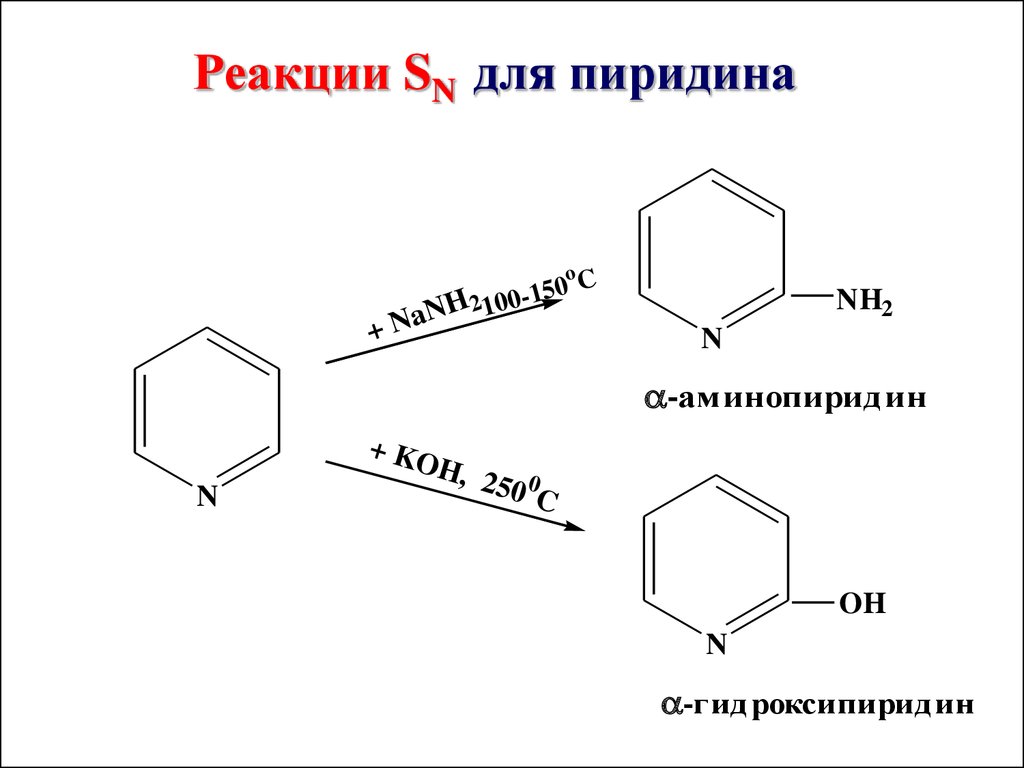
Реакции SN для пиридина+
NaN
oC
0
5
H 2100-1
NH2
N
-аминопиридин
N
+ KO
H, 2 0
50 C
OH
N
-гидроксипиридин
38.
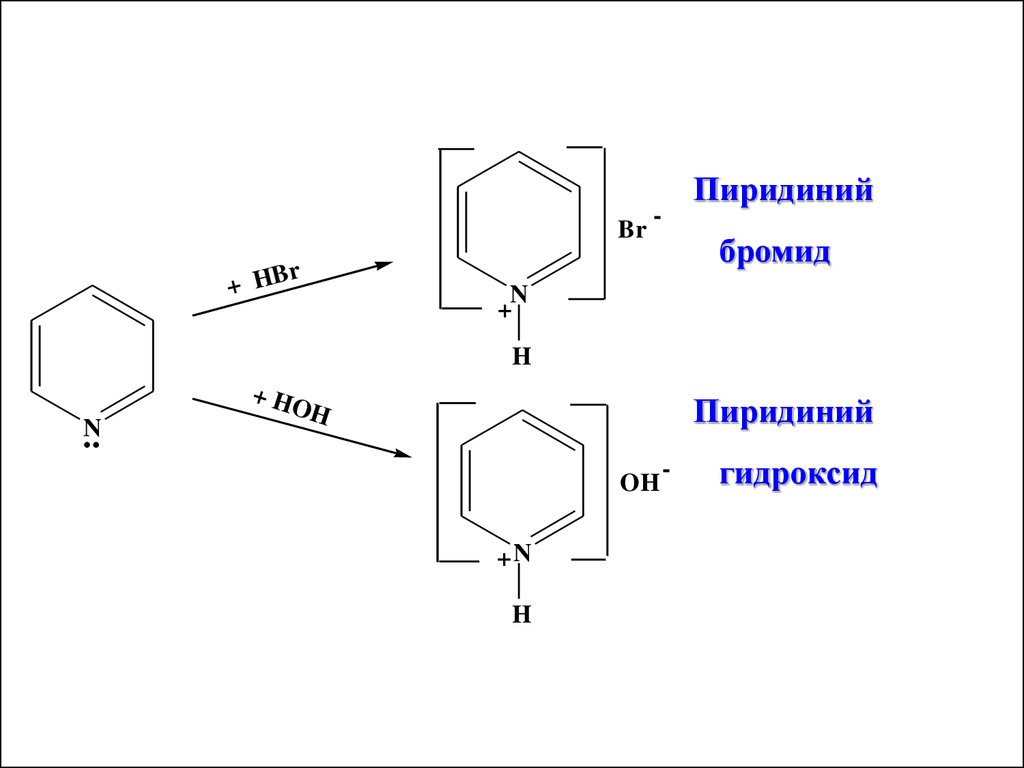
Пиридин и его гомологипроявляют слабые основные
свойства (близки по основным
свойствам к третичным аминам).
Это связано с наличием атома
азота как аммониевого центра. Он
образует четвертичные соли с
сильными кислотами
39.
Brr
+ HB
Пиридиний
-
бромид
N
+
H
N
+ HO
H
Пиридиний
OH
+N
H
-
гидроксид
40.
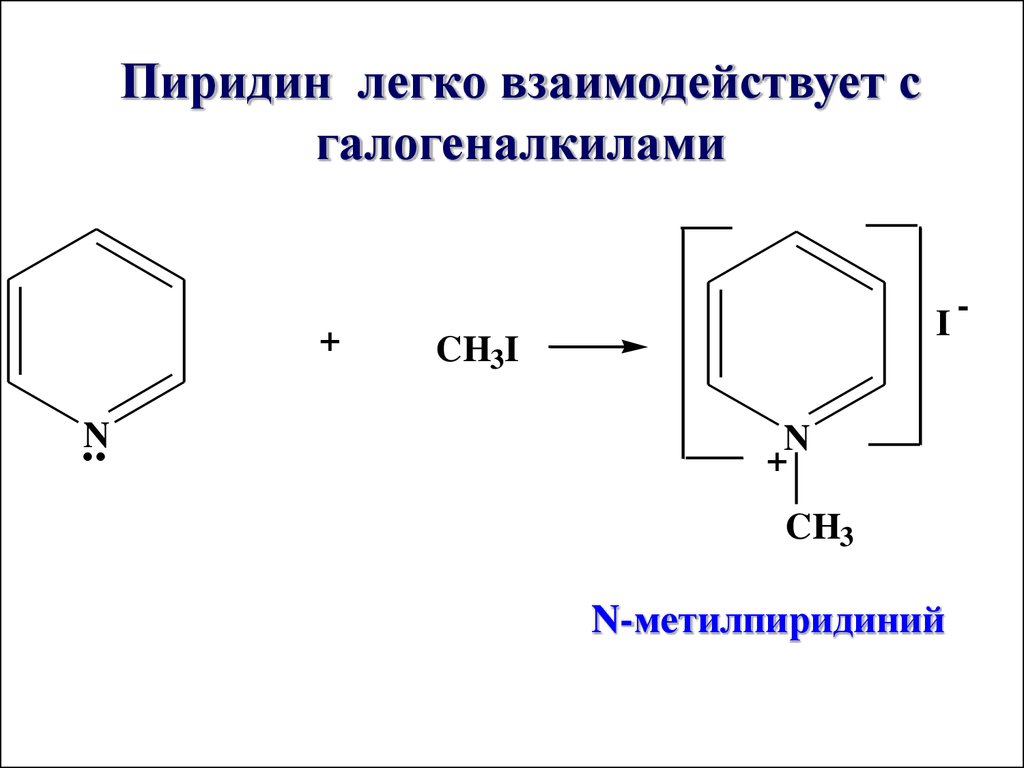
Пиридин легко взаимодействует сгалогеналкилами
+
N
I
CH3I
N
+
CH3
N-метилпиридиний
-
41.
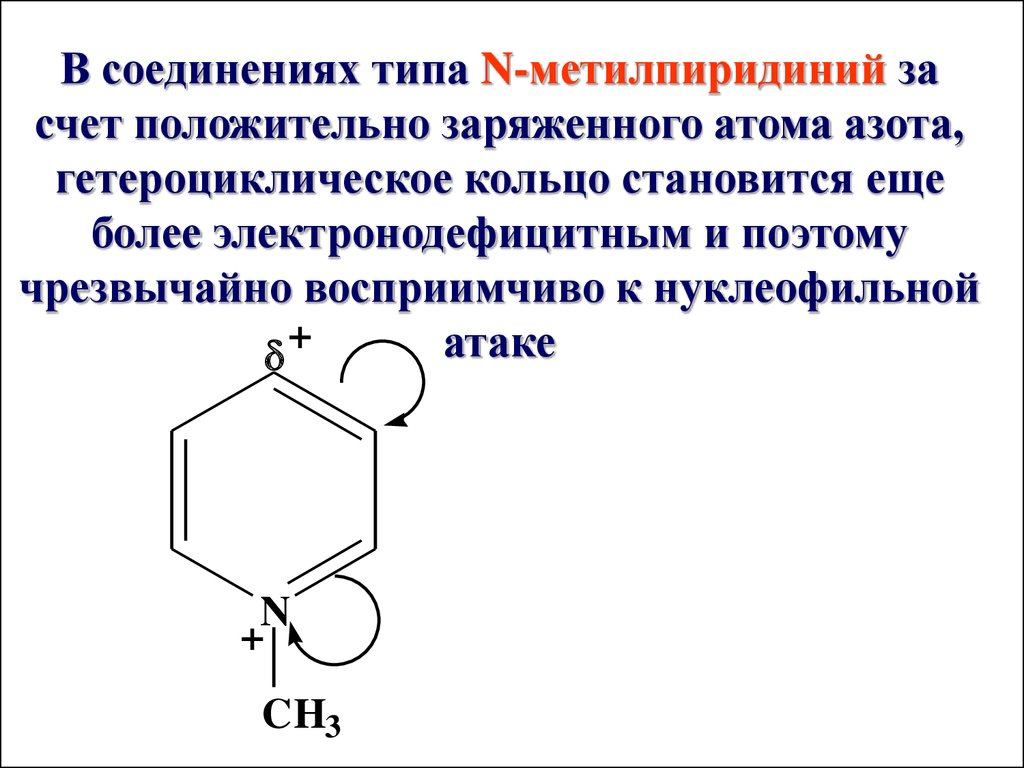
В соединениях типа N-метилпиридиний засчет положительно заряженного атома азота,
гетероциклическое кольцо становится еще
более электронодефицитным и поэтому
чрезвычайно восприимчиво к нуклеофильной
+
атаке
N
+
CH3
42.
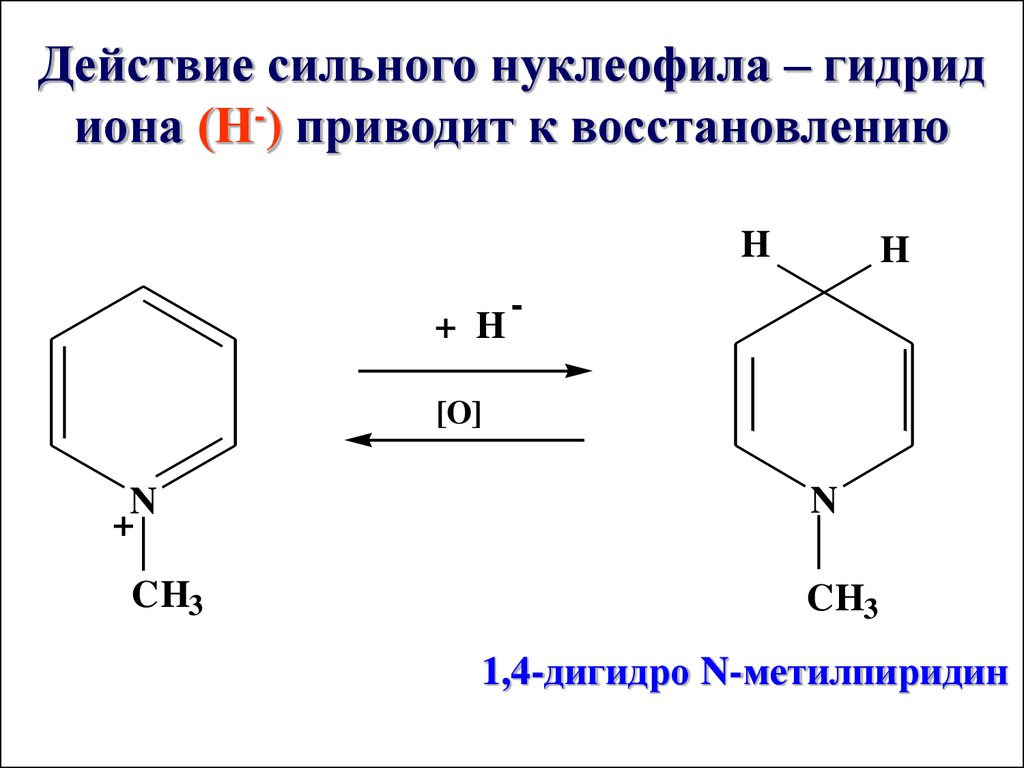
Действие сильного нуклеофила – гидридиона (Н-) приводит к восстановлению
H
+ H
H
-
[O]
N
+
CH3
N
CH3
1,4-дигидро N-метилпиридин
43.
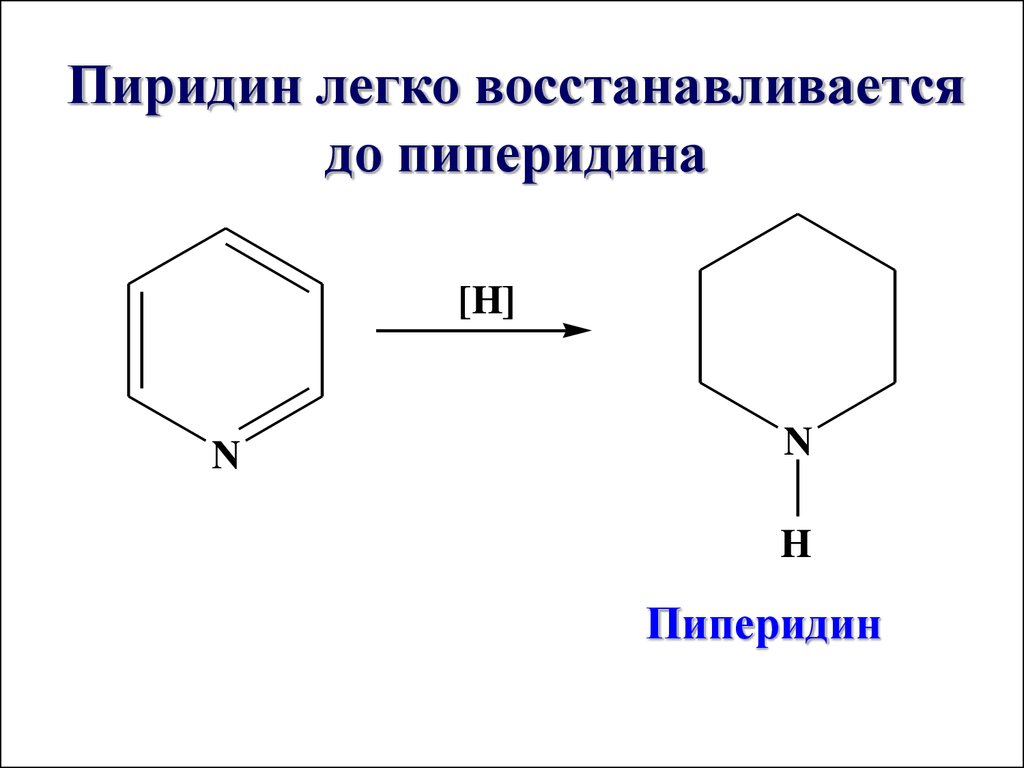
Пиридин легко восстанавливаетсядо пиперидина
[H]
N
N
H
Пиперидин
44.
Пиперидиновое кольцо входит в составодного из наиболее эффективных
анальгетиков – промедола
Промедол
45.
Пиридин и пиперидин входят в состав алкалоидов,пиридиновое кольцо входит в состав витаминов В6 и
кофермента – пиридоксальфосфата
H
H
O
O
C
C
O
HO
HO
CH2 - O - P - OH
CH2OH
OH
H3C
N
Пиридоксаль
H3C
N
Пиридоксальфосфат
46.
Пиридин входит в составникотиновой кислоты и ее амида
(витамин РР), который является
структурной единицей коферментов
НАД+ и НАДФ+
Известны 3 кислоты, содержащие
пиридин. Они образуются
окислением соответствующих
пиколинов
47.
[O]CH3
N
α-пиколин
COOH
N
Пиколиновая кислота
48.
CH3N
β-пиколин
COOH
[O]
N
Никотиновая кислота
49.
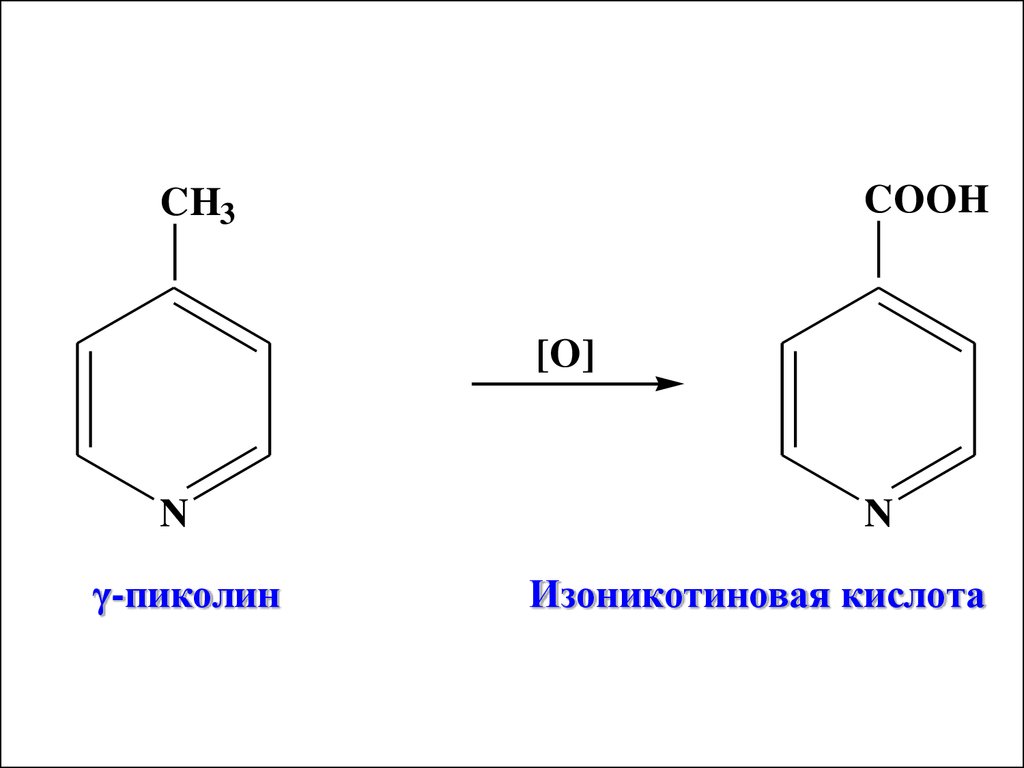
COOHCH3
[O]
N
γ-пиколин
N
Изоникотиновая кислота
50.
Никотиновая кислота относится кслабым ОН-кислотам, по свойствам
напоминает бензойную кислоту:
образует сложные эфиры,
галогенангидриды, амиды, при
нагревании декарбоксилируется.
Никотиновая кислота и ее амид –
витамин РР (Реlаgrа рreventive),
предупреждающий пеллагру средство для лечения пеллагры
51.
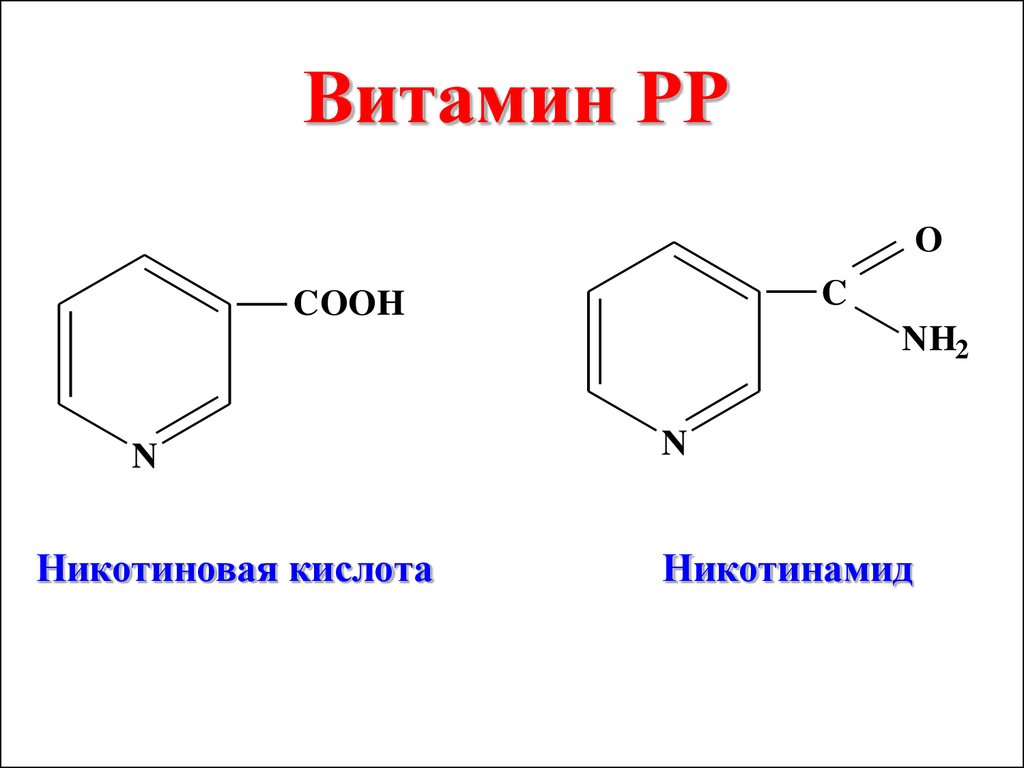
Витамин РРO
C
COOH
NH2
N
Никотиновая кислота
N
Никотинамид
52.
Никотинамид синтезируют из никотиновой кислотыO
C
NH2
N
N
l
C
-H
O
C
OH
O
C
SOCl2
Cl
N
(C
N
H3
) 2N
H5
2
H
O
C
Кордиамин
Диэтиламидникотиновой
кислоты
N(C2H5)2
N
53.
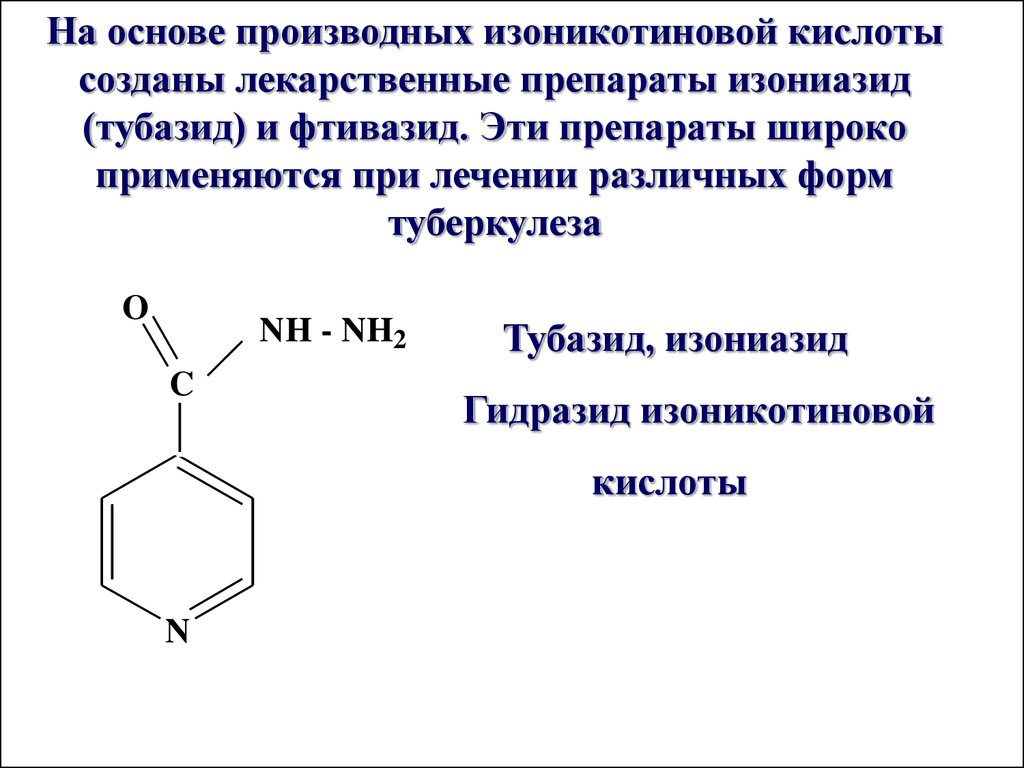
На основе производных изоникотиновой кислотысозданы лекарственные препараты изониазид
(тубазид) и фтивазид. Эти препараты широко
применяются при лечении различных форм
туберкулеза
O
NH - NH2
C
Тубазид, изониазид
Гидразид изоникотиновой
кислоты
N
54.
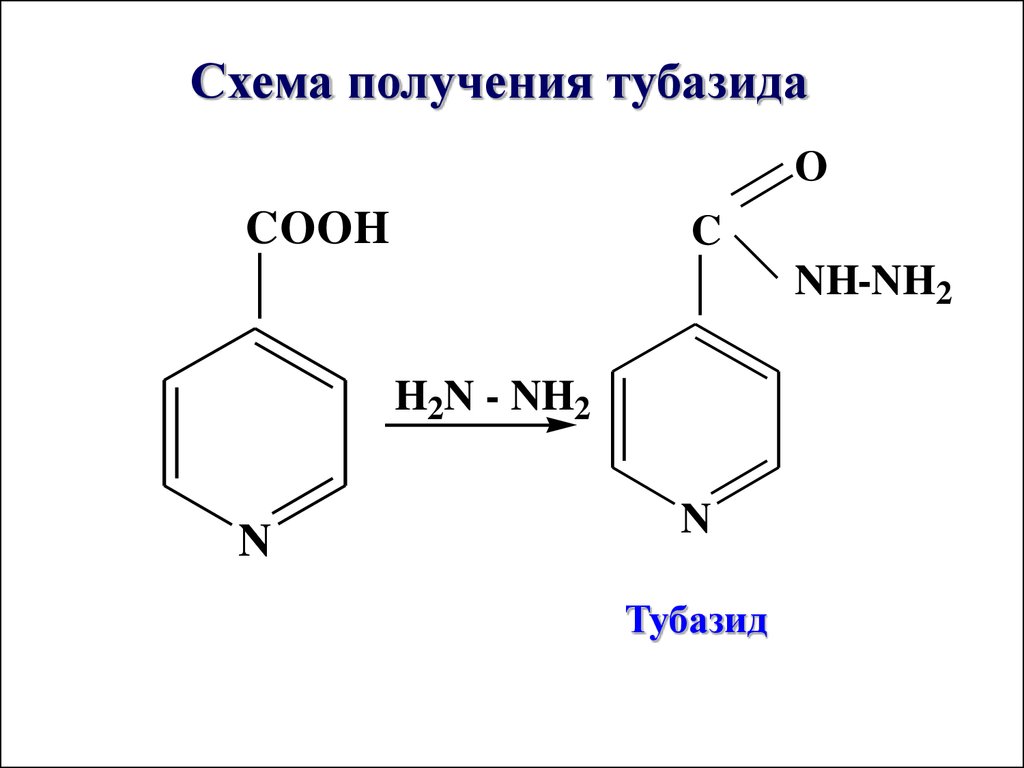
Схема получения тубазидаO
COOH
C
NH-NH2
H2N - NH2
N
N
Тубазид
55.
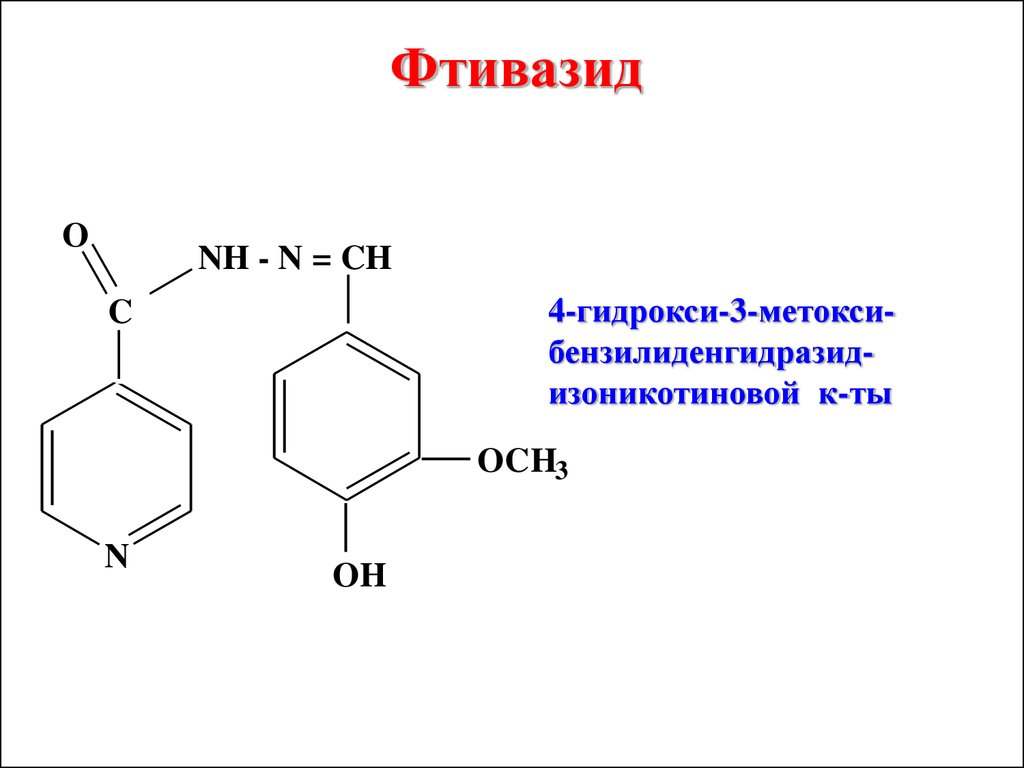
ФтивазидO
NH - N = CH
4-гидрокси-3-метоксибензилиденгидразидизоникотиновой к-ты
C
OCH3
N
OH
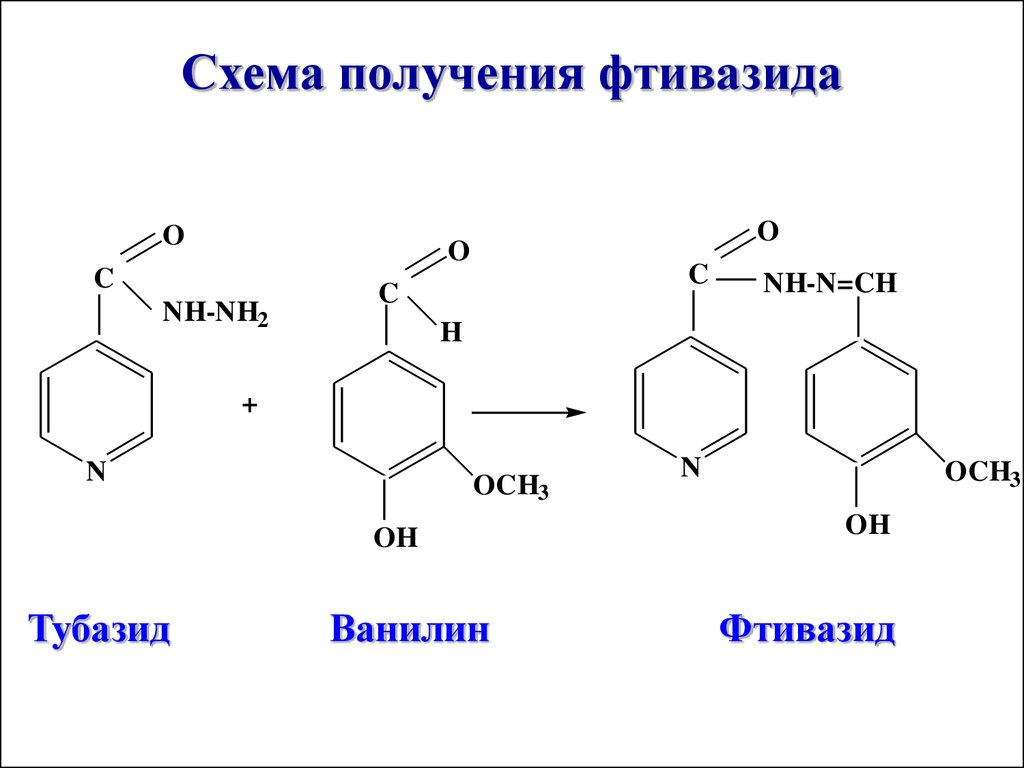
56.
Схема получения фтивазидаO
O
O
C
NH-NH2
C
C
NH-N=CH
H
+
N
OCH3
OH
Тубазид
Ванилин
N
OCH3
OH
Фтивазид
57.
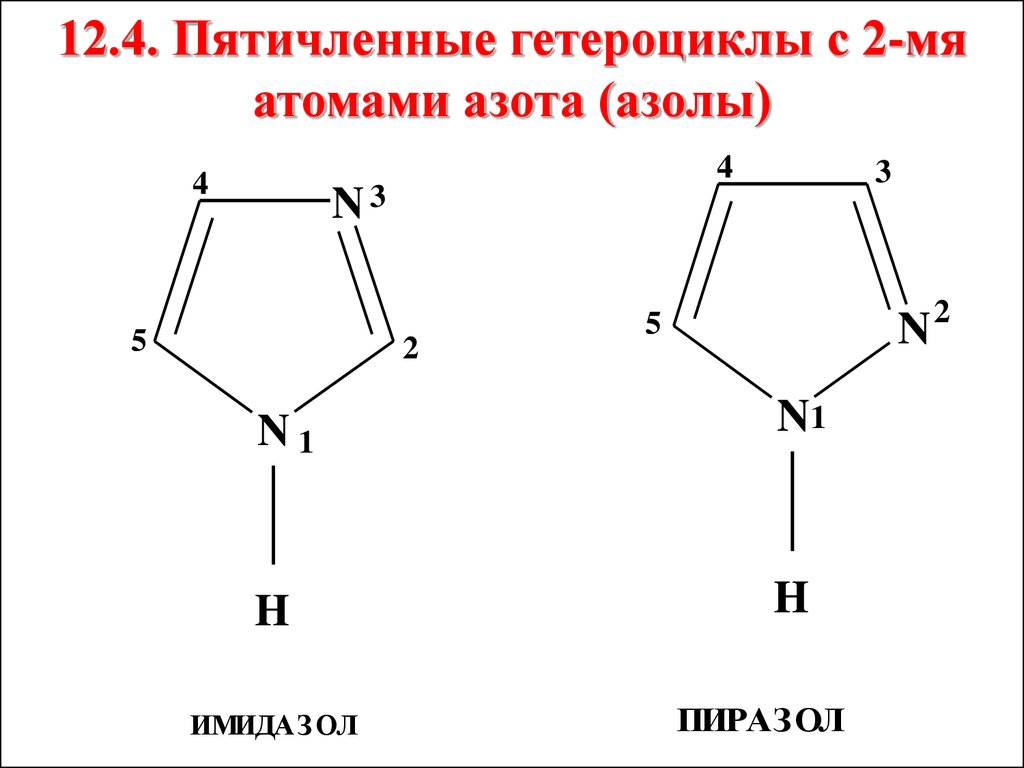
12.4. Пятичленные гетероциклы с 2-мяатомами азота (азолы)
4
4
3
N3
5
2
5
N
N1
N1
H
H
ИМИДАЗ ОЛ
ПИРАЗОЛ
2
58.
В молекулах этих соединений имеются разные атомыазота: пиридиновый (основный центр) и пиррольный
(кислотный центр), т.е. эти соединения проявляют
амфотерные свойства
ПИРИДИНОВЫЙ АЗОТ
ОСНОВНЫЕ ЦЕНТРЫ
N
..
..
N
N
H
КИСЛОТНЫЕ ЦЕНТРЫ
ПИРРОЛЬНЫЙ АЗОТ
H
N
59.
Пиразол и имидазол существуют в видеассоциатов за счет образования
межмолекулярных водородных связей
N
NH
N
NH
N
NH
60.
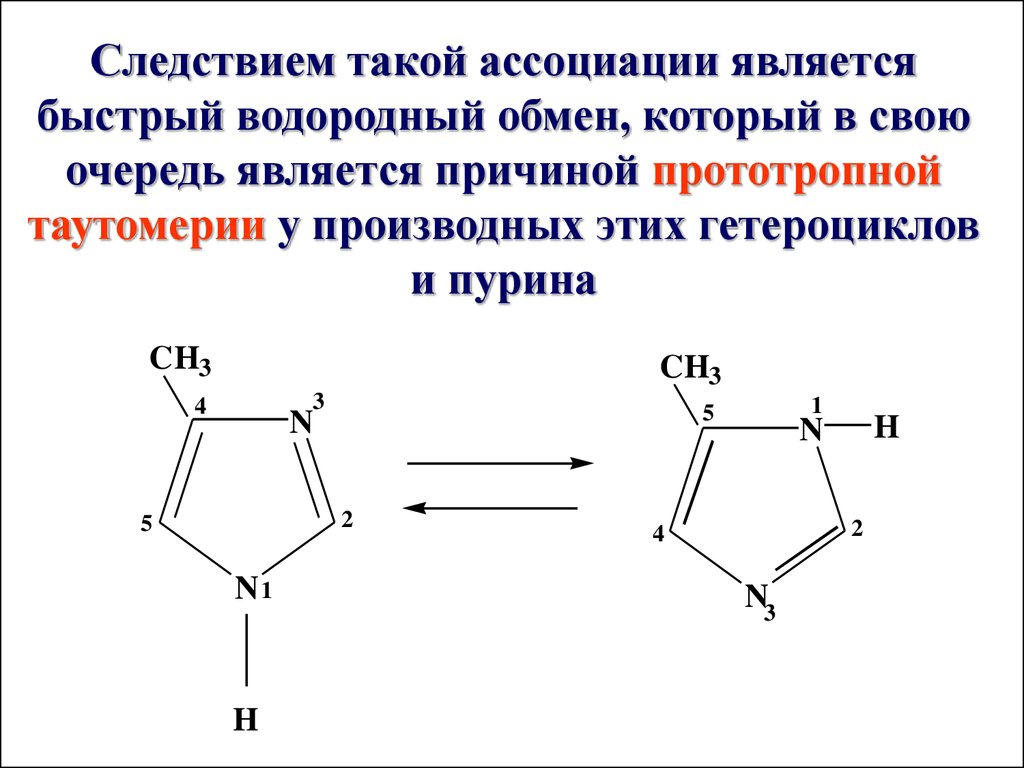
Следствием такой ассоциации являетсябыстрый водородный обмен, который в свою
очередь является причиной прототропной
таутомерии у производных этих гетероциклов
и пурина
CH3
CH3
3
4
N
2
5
N1
H
1
5
H
N
2
4
N3
61.
Переход водорода осуществляется очень быстро (10 разв секунду)
Выделить индивидуальные 4- или 5-монозамещенные
производные имидазола невозможно
Из биологически активных производных имидазола
большое значение имеет α-АМК-гистидин
Гистидин
62.
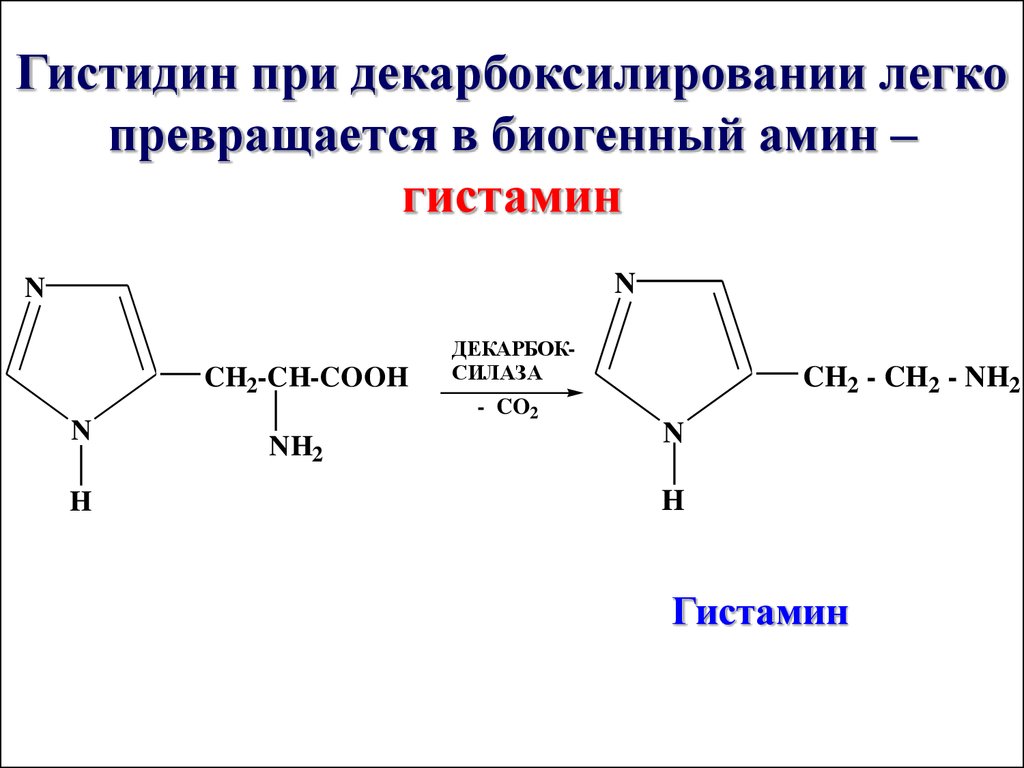
Гистидин при декарбоксилировании легкопревращается в биогенный амин –
гистамин
N
N
CH2-CH-COOH
N
H
ДЕКАРБОКСИЛАЗА
- CO2
NH2
CH2 - CH2 - NH2
N
H
Гистамин
63.
Гистамин – гормоноподобное вещество,участвующее в регуляции жизненно-важных
функций организма: вызывает расширение
капилляров, понижение АД, сокращение
гладкой мускулатуры, усиление секреции
желудочного сока, усиливает перистальтику.
Повышение содержания гистамина в крови –
один из симптомов аллергических
заболеваний. Широкий спектр
физиологического действия обусловил его
применение в качестве лекарственного
препарата
64.
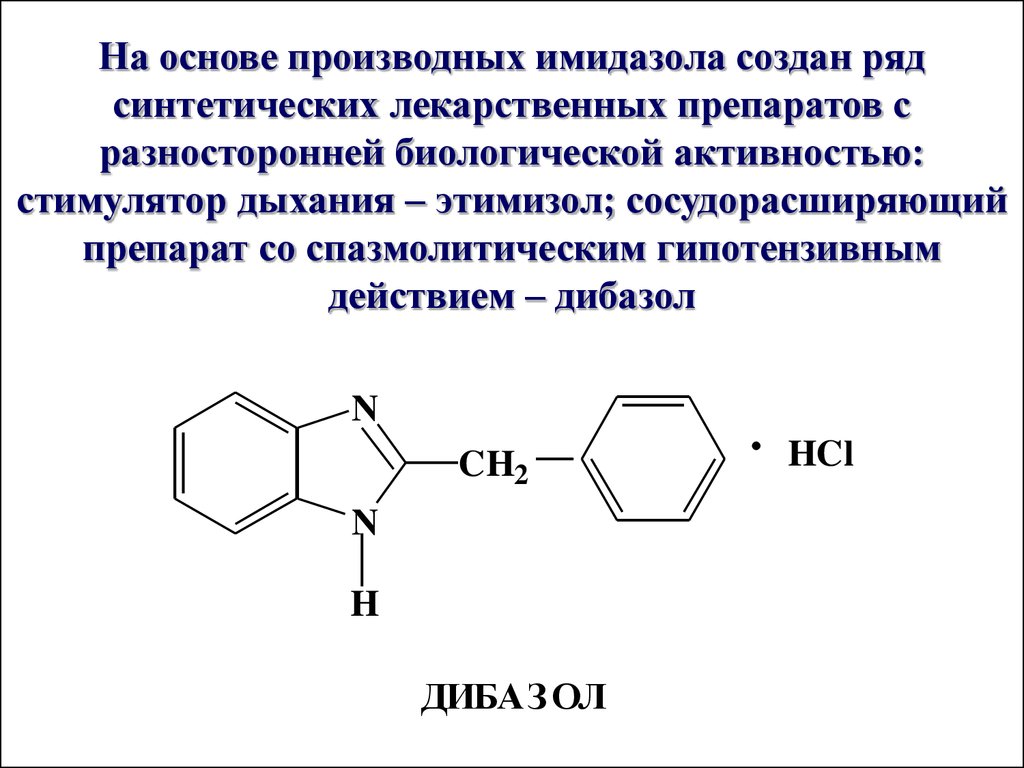
На основе производных имидазола создан рядсинтетических лекарственных препаратов с
разносторонней биологической активностью:
стимулятор дыхания – этимизол; сосудорасширяющий
препарат со спазмолитическим гипотензивным
действием – дибазол
N
CH2
N
H
ДИБАЗ ОЛ
HCl
65.
Пиразол и его производные вприроде не встречаются, но на
основе пиразола синтезирована
группа известных
анальгетических средств антипирина, амидопирина,
анальгина
66.
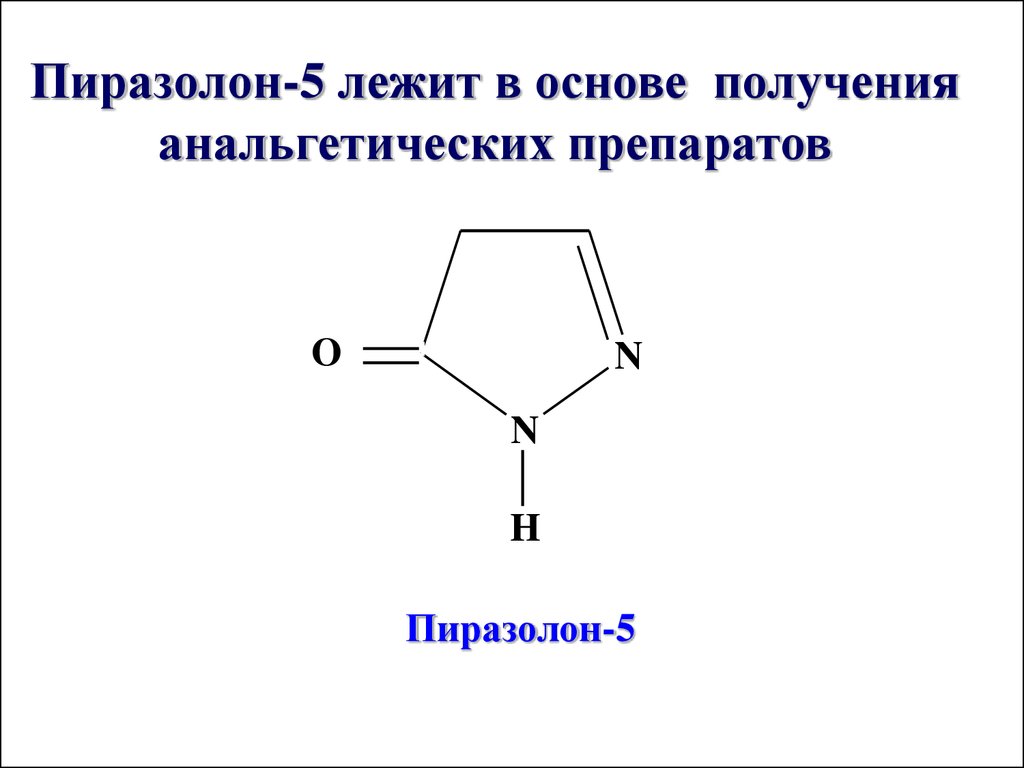
Пиразолон-5 лежит в основе полученияанальгетических препаратов
O
N
N
H
Пиразолон-5
67.
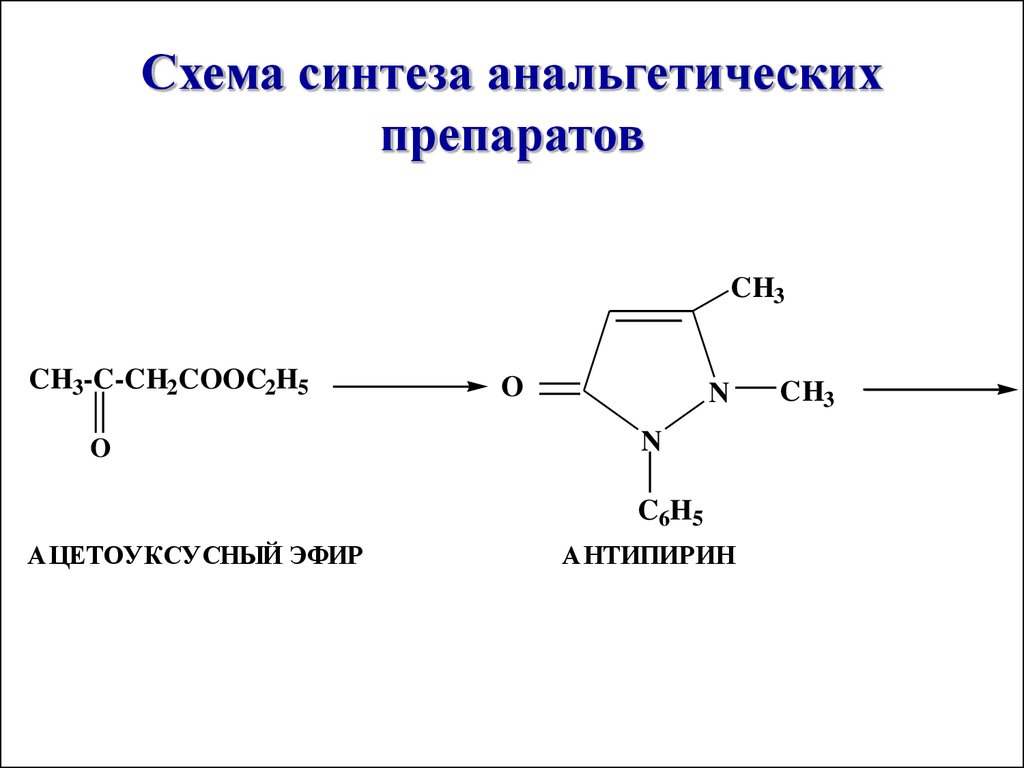
Схема синтеза анальгетическихпрепаратов
CH3
CH3-C-CH2COOC2H5
O
O
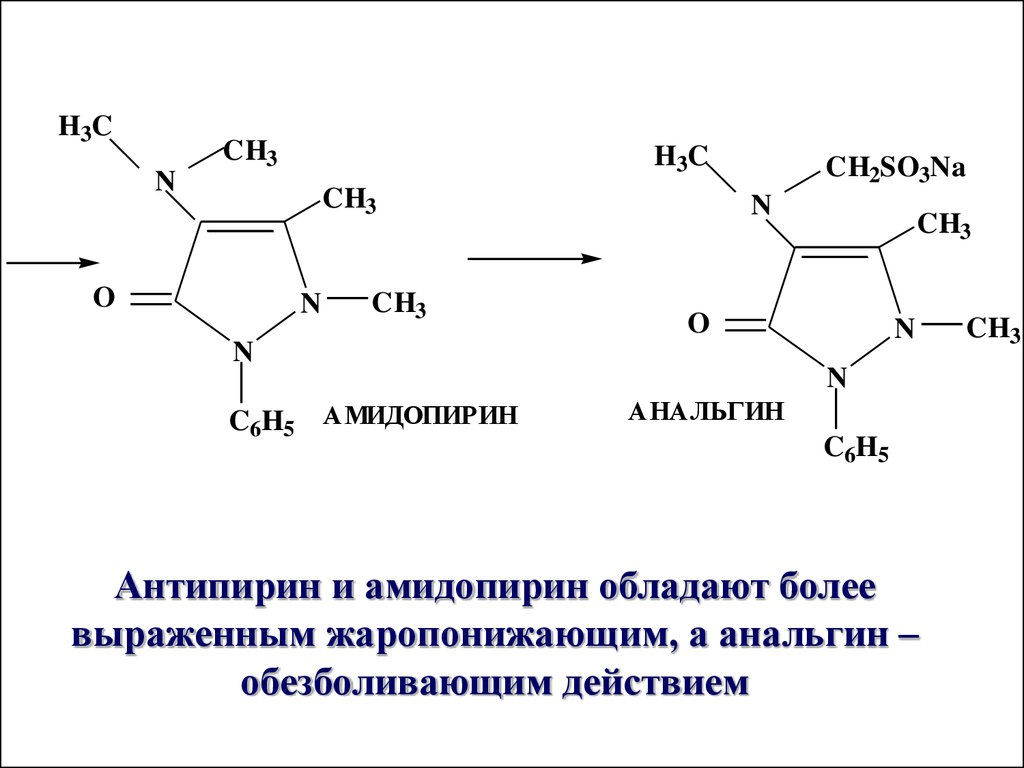
N
N
C6H5
АЦЕТОУКСУСНЫЙ ЭФИР
АНТИПИРИН
CH3
68.
H3CCH3
H3C
N
CH3
O
N
CH3
CH2SO3Na
N
O
N
C6H5 АМИДОПИРИН
CH3
N
N
АНАЛЬГИН
C6H5
Антипирин и амидопирин обладают более
выраженным жаропонижающим, а анальгин –
обезболивающим действием
CH3
69.
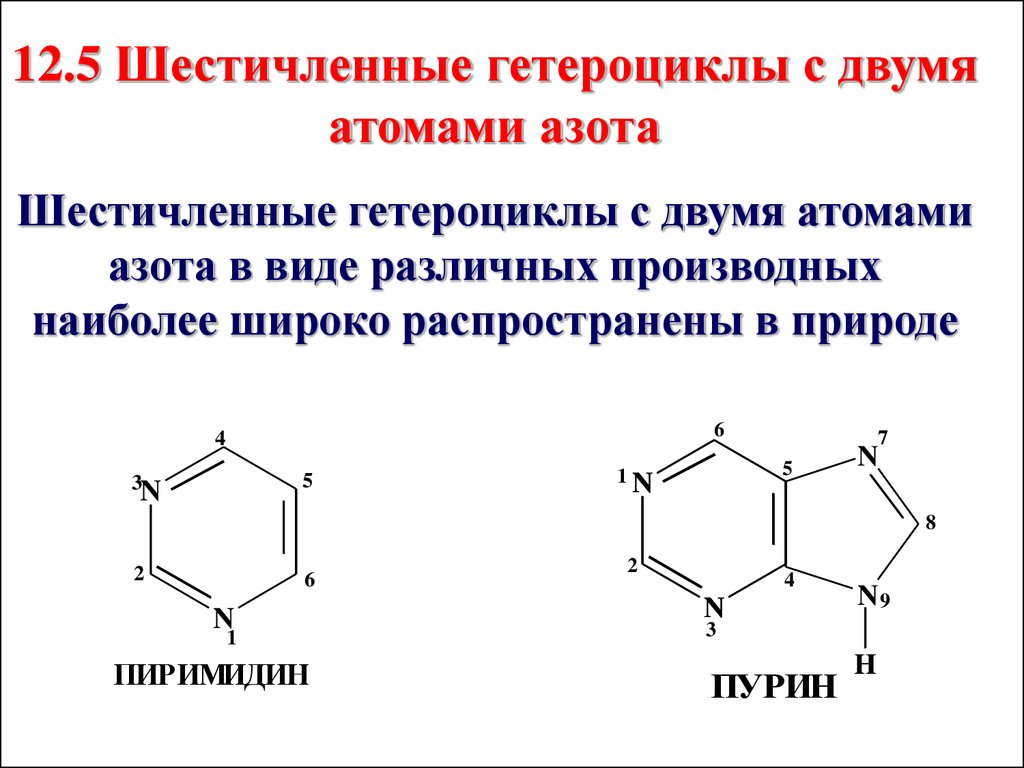
12.5 Шестичленные гетероциклы с двумяатомами азота
Шестичленные гетероциклы с двумя атомами
азота в виде различных производных
наиболее широко распространены в природе
6
4
5
3
N
7
5
1N
N
8
2
6
N
1
ПИРИМИДИН
2
4
N
N9
ПУРИН
H
3
70.
Пиримидиновое ядро лежит в основевходящих в состав нуклеиновых
кислот гетероциклических оснований
(урацил, тимин, цитозин).
Пиримидиновое кольцо является
структурной единицей пурина (лежит
в основе – аденина и гуанина), входит
в состав ферментов, алкалоидов,
лекарственных препаратов,
витамина В1
71.
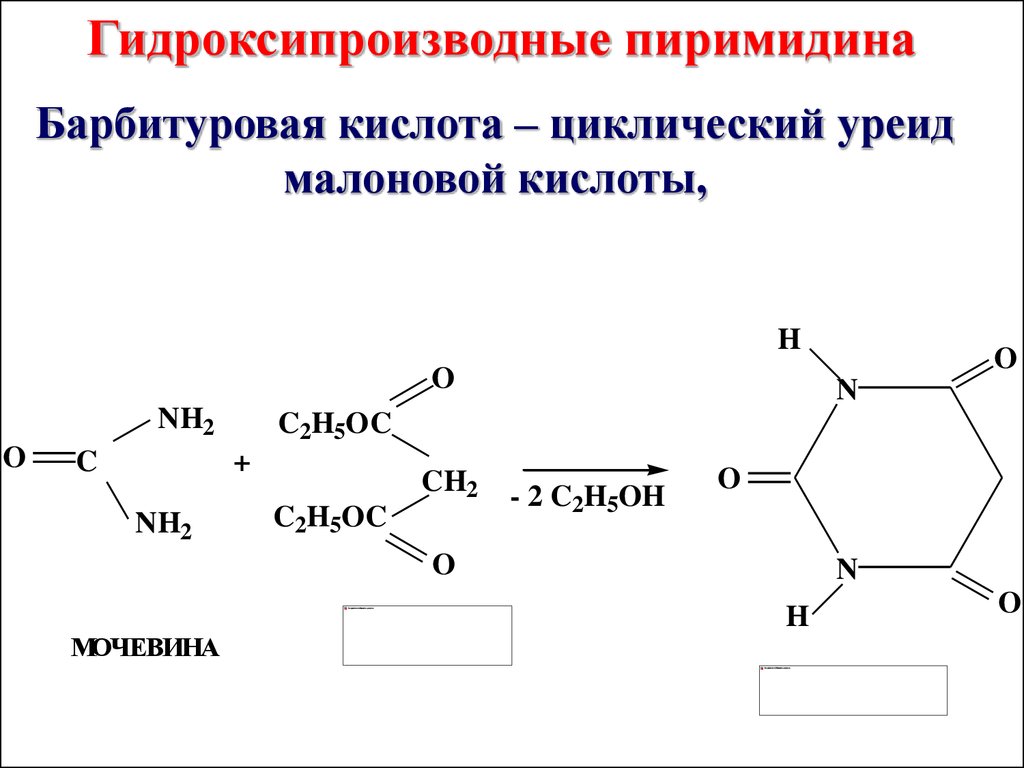
Гидроксипроизводные пиримидинаБарбитуровая кислота – циклический уреид
малоновой кислоты,
H
O
NH2
O
C
N
C2H5OC
+
NH2
CH2
C2H5OC
- 2 C2H5OH
O
O
МОЧЕВИНА
O
N
H
O
72.
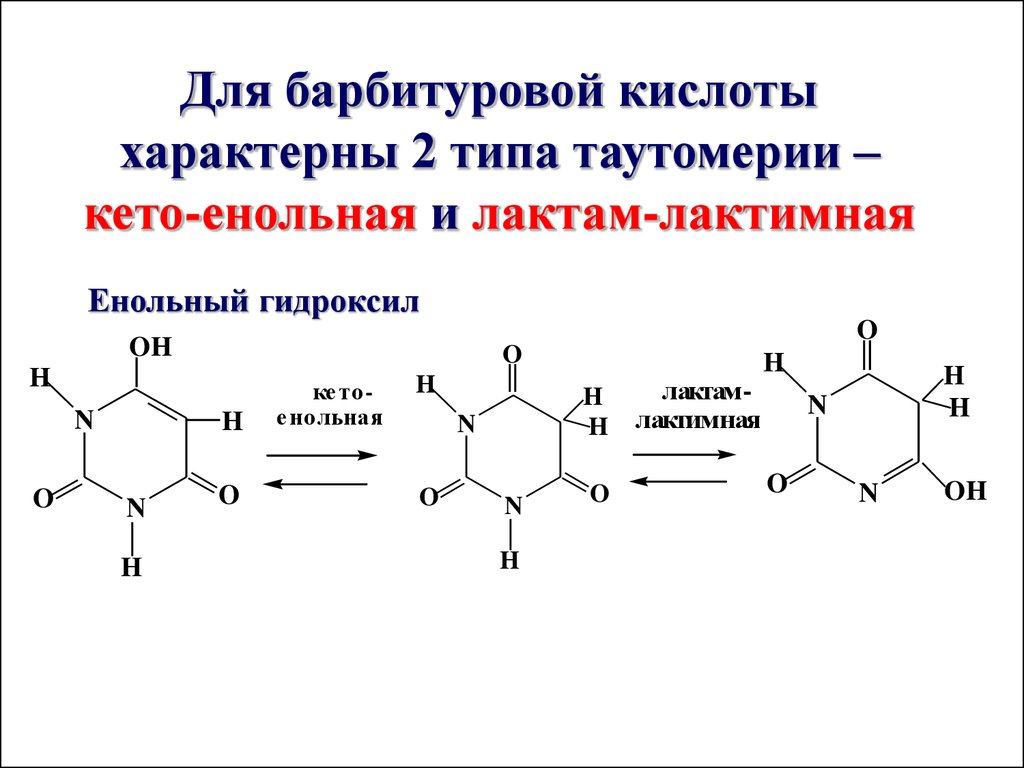
Для барбитуровой кислотыхарактерны 2 типа таутомерии –
кето-енольная и лактам-лактимная
Енольный гидроксил
O
OH
O
H
N
O
H
N
H
O
ке тое нольная
H
H
H
N
O
N
H
O
лактамлактимная
H
H
H
N
O
N
OH
73.
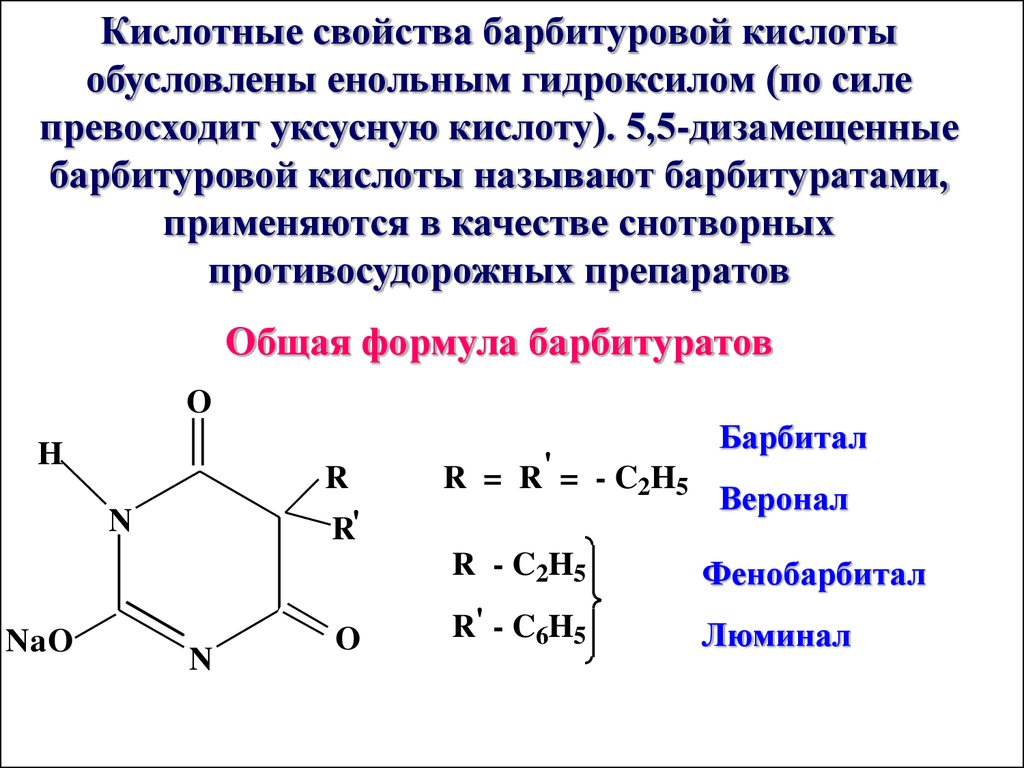
Кислотные свойства барбитуровой кислотыобусловлены енольным гидроксилом (по силе
превосходит уксусную кислоту). 5,5-дизамещенные
барбитуровой кислоты называют барбитуратами,
применяются в качестве снотворных
противосудорожных препаратов
Общая формула барбитуратов
O
H
R
N
NaO
R = R' = - C2H5
R'
N
O
Барбитал
Веронал
R - C2H5
Фенобарбитал
R' - C6H5
Люминал
74.
Гидрокси-производных пуринаO
H
N
N
N
N
H
ГИПОКСАНТИН
6 - ОКСОПУРИН
6 - ГИДРОКСИПУРИН
75.
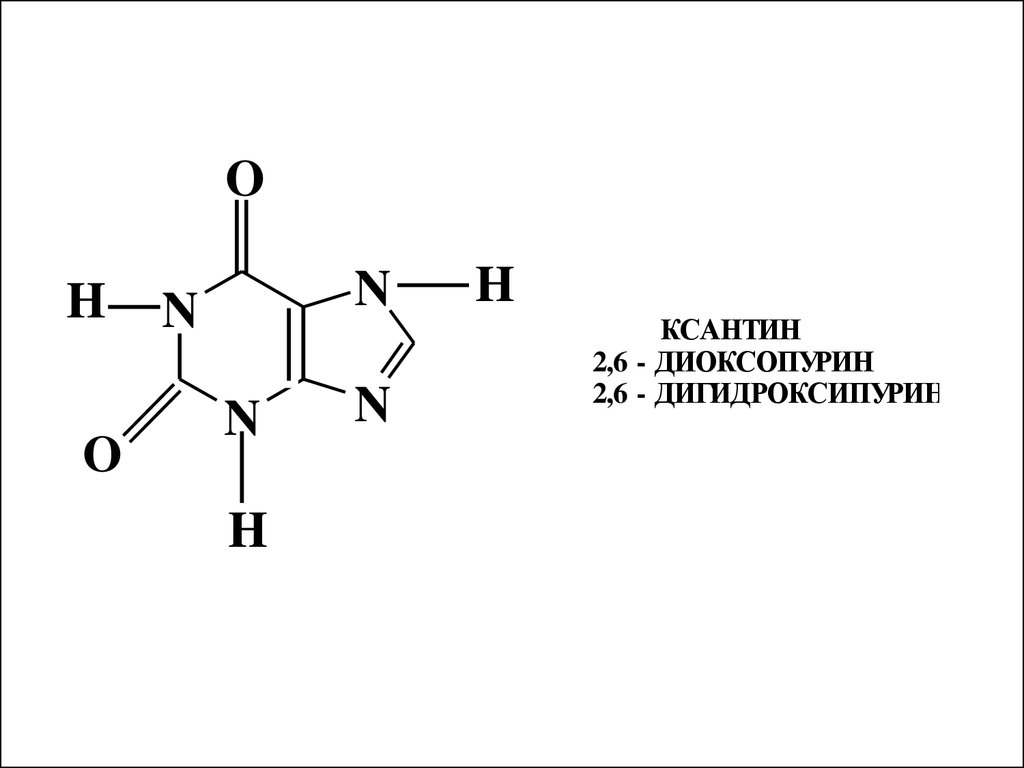
OH
O
N
N
N
H
N
H
КСАНТИН
2,6 - ДИОКСОПУРИН
2,6 - ДИГИДРОКСИПУРИН
76.
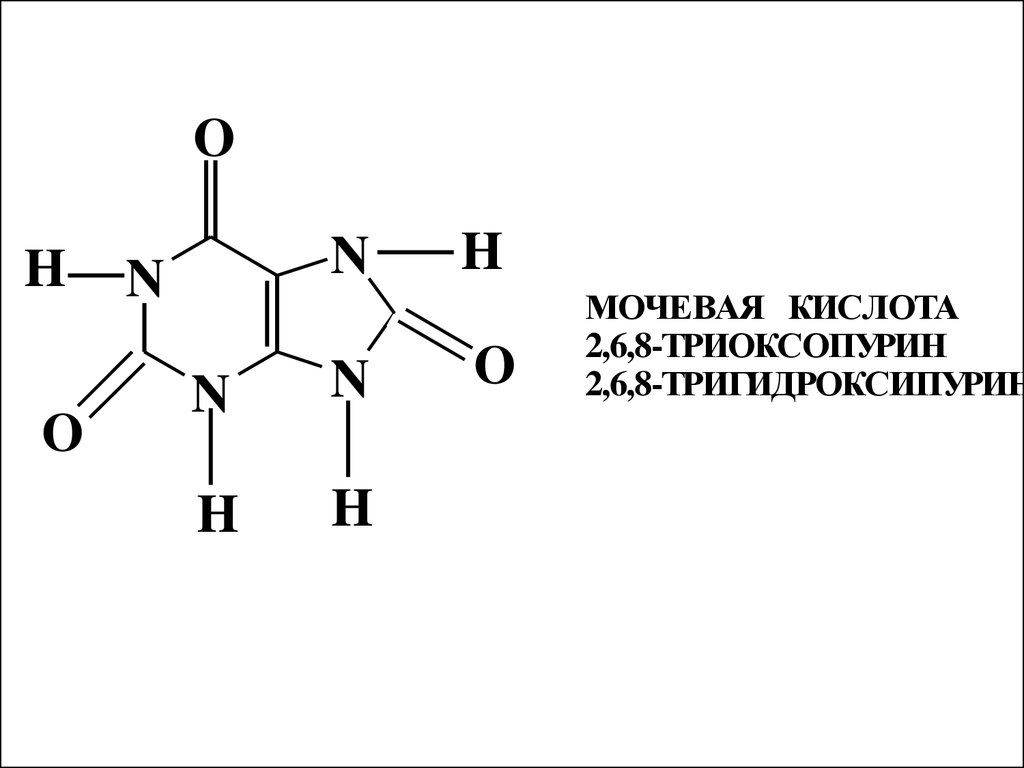
OH
O
N
N
N
N
H
H
H
O
МОЧЕВАЯ КИСЛОТА
2,6,8-ТРИОКСОПУРИН
2,6,8-ТРИГИДРОКСИПУРИН
77.
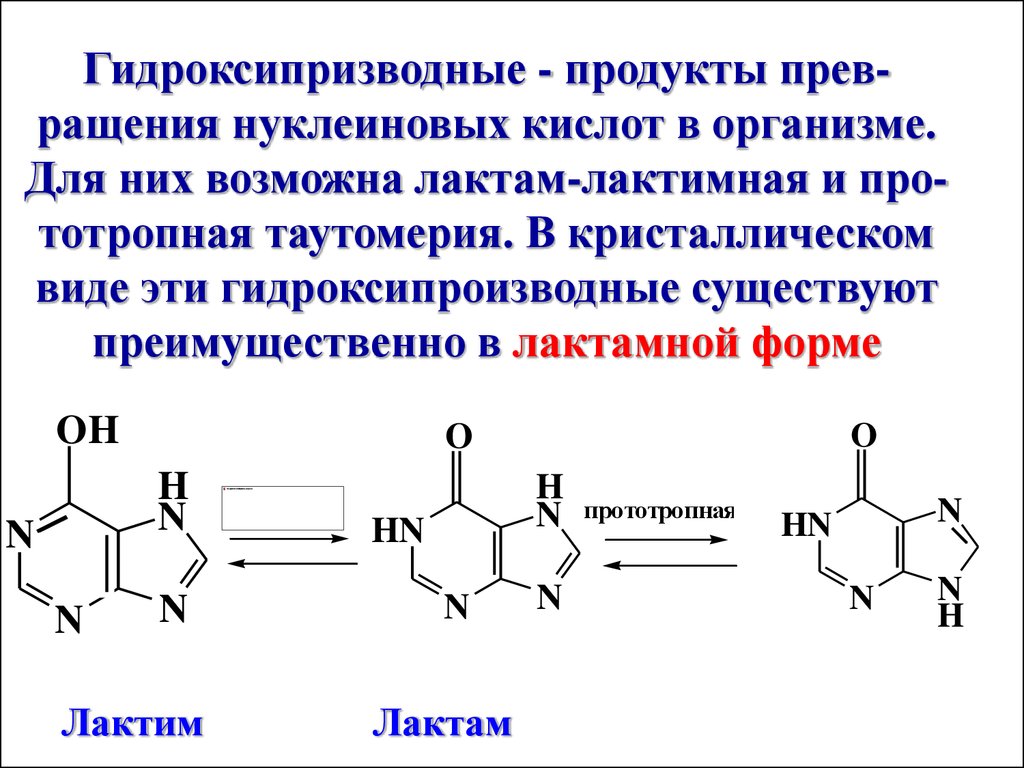
Гидроксипризводные - продукты превращения нуклеиновых кислот в организме.Для них возможна лактам-лактимная и прототропная таутомерия. В кристаллическом
виде эти гидроксипроизводные существуют
преимущественно в лактамной форме
OH
H
N
N
N
O
O
N
Лактим
H
N
HN
N
Лактам
N
прототропная
N
HN
N
N
H
78.
Мочевая кислота – конечный продуктметаболизма пуриновых соединений в
организме. Впервые была открыта
Шееле (1776 г) в камнях мочевого
пузыря, т.к. она является продуктом
азотистого обмена в организме. Это
бесцветное кристаллическое
вещество, труднорастворимое в воде,
легко не плавясь при нагревании
разлагается
79.
Мочевая кислота двухосновная, кислотныйхарактер обусловлен ОН-группами в лактимной
форме
Лактам-лактимная таутомерия
O
H
O
HO
N
H
N
N
O
H
H
N
ЛАКТАМНАЯ ФОРМА
N
N
HO
H
N
N
OH
ЛАКТИМНАЯ ФОРМА
Кислотные гидроксилы.
80.
ОН-группа в 6-положении непроявляет кислотных свойств из-за
наличия внутримолекулярной
водородной связи
Соли мочевой кислоты называют
уратами, при нарушениях обмена
могут откладываться в суставах и в
виде почечных камней
81.
12.6. Понятие об алкалоидахАлкалоиды – гетероциклические
азотсодержащие соединения
растительного происхождения, для
которых характерна высокая
физиологическая активность
82.
Метилированные ксантинысоставляют группу пуриновых
алкалоидов. К ним относят:
теофиллин, теобромин, кофеин,
они находят широкое применение
в медицине, которое основано на
их стимулирующем действии на
ЦНС и сердце
83.
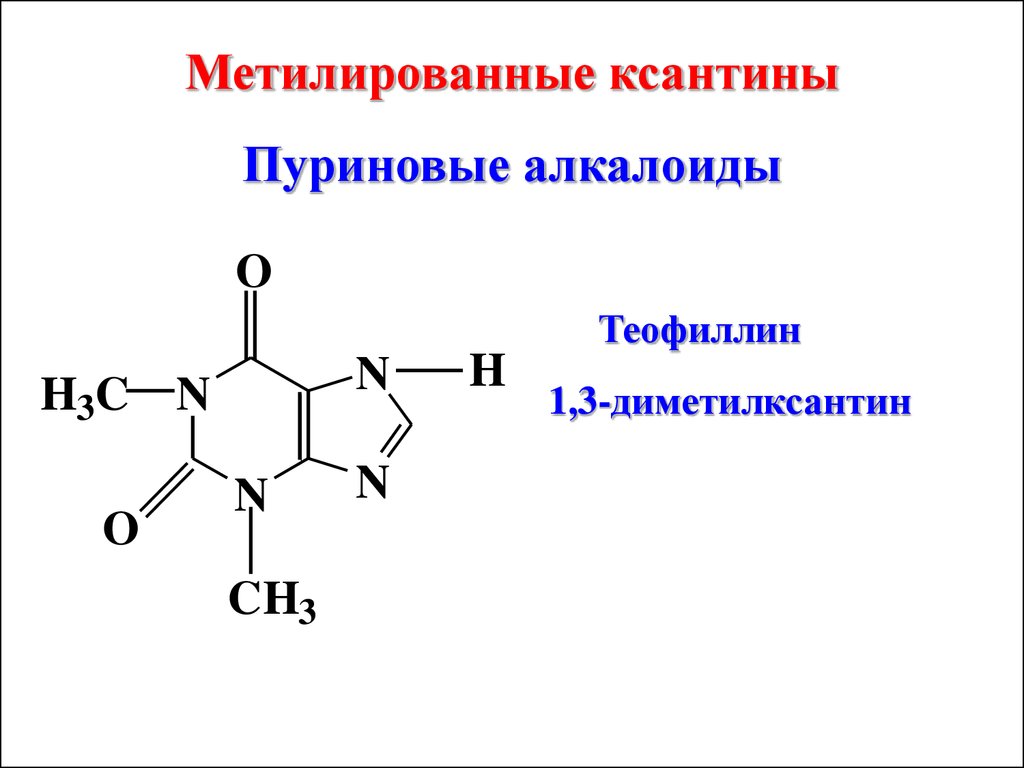
Метилированные ксантиныПуриновые алкалоиды
O
Теофиллин
N
H3C N
O
N
CH3
N
H
1,3-диметилксантин
84.
Метилированные ксантиныПуриновые алкалоиды
O
H
O
N
N
N
CH3
N
CH3
Теобромин
3,7-диметилксантин
85.
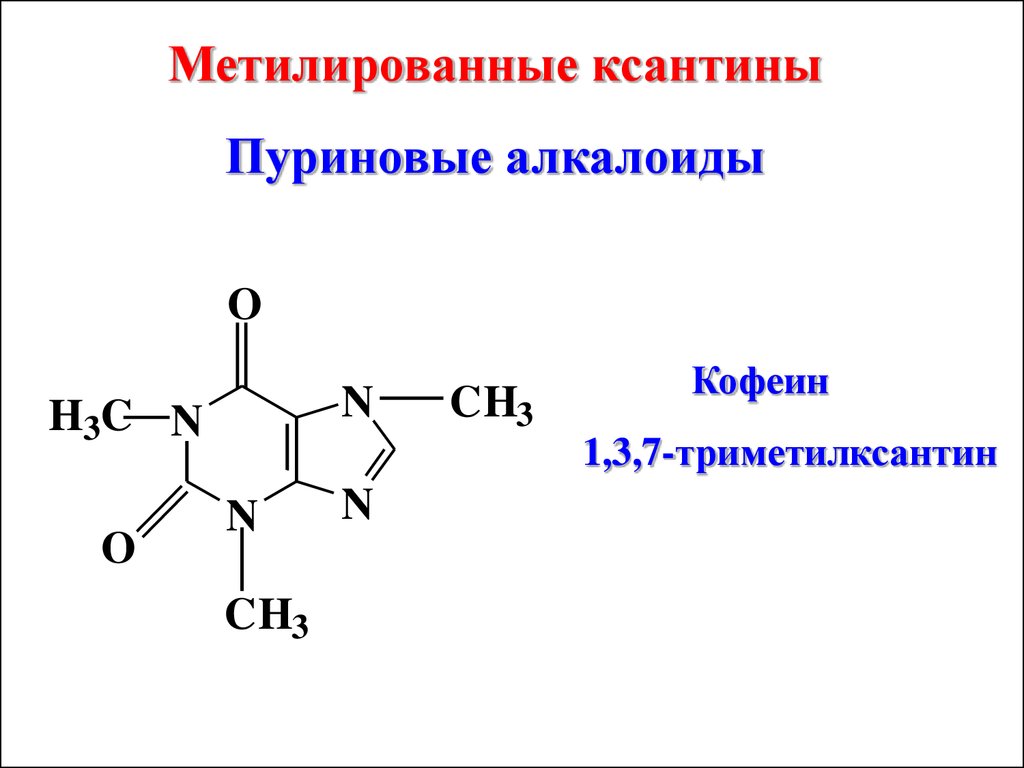
Метилированные ксантиныПуриновые алкалоиды
O
N
H3C N
O
CH3
Кофеин
1,3,7-триметилксантин
N
CH3
N
86.
Теофиллин содержится в листьяхчая, теобромин – в бобах какао,
кофеин – в кофе
Теофиллин и теобромин обладают в
большей степени мочегонным и
расширяющим сосуды действием
Кофеин обладает наиболее сильным
возбуждающим действием
87.
Благодаримза внимание !




































 biology
biology chemistry
chemistry








