Similar presentations:
Лекарственные средства – производные пиримидин 2,4,6-триона
1. Лекарственные средства – производные пиримидин 2,4,6-триона
• К лекарственным средствам даннойгруппы относятся ЛВ полученные при
взаимодействии полного амида
угольной кислоты (мочевины) с
производными малоновой кислоты.
Циклический уреид, полученный таким
образом, называют барбитуровой
кислотой, а ЛВ называют
барбитуратами.
2.
• Различают кислотные и солевые (натриевые)формы барбитуратов.
• Для всех ЛВ характерна лактим-лактамная
таутомерия т.е. все вещества обладают
кислотными свойствами и вступают в реакции
комплексообразования с солями тяжелых
металлов.
• По физическим свойствам – это белые
кристаллические вещества. Солевые
(натриевые) формы растворимы в воде,
кислотные формы растворимы в спирте и
щелочах.
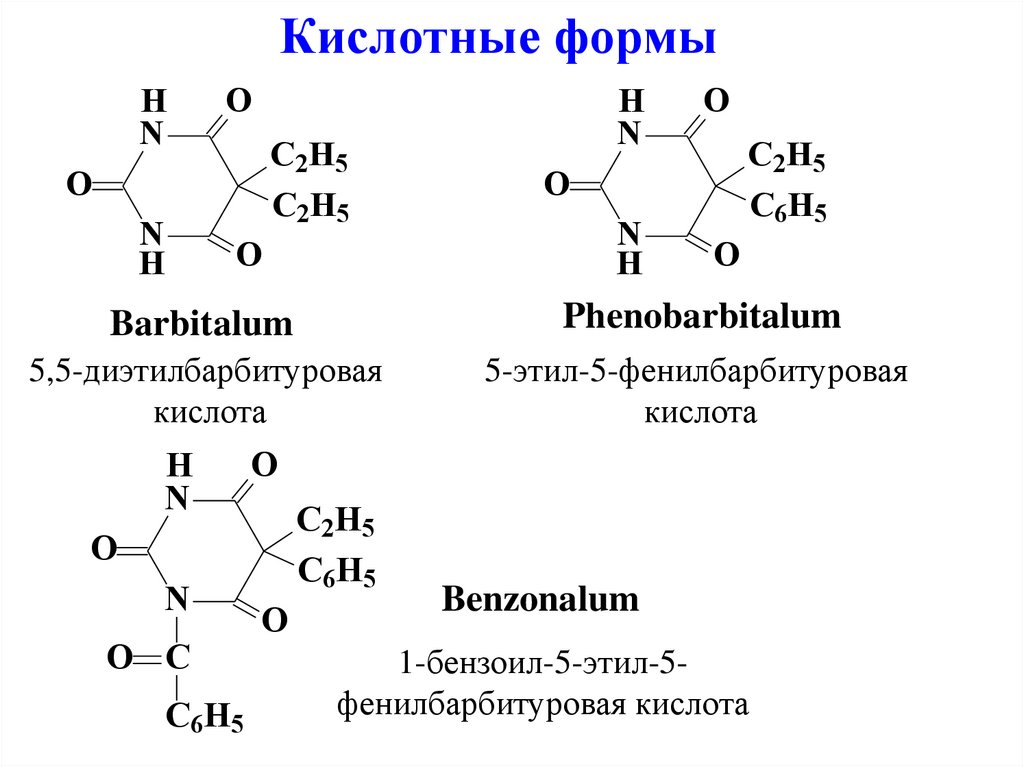
3.
Кислотные формыH
N
O
C2H5
C2H5
O
N
H
O
H
N
O
C2H5
C6H5
O
N
H
O
Barbitalum
Phenobarbitalum
5,5-диэтилбарбитуровая
кислота
5-этил-5-фенилбарбитуровая
кислота
H
N
O
C2H5
C6H5
O
N
O C
C6H5
O
Benzonalum
1-бензоил-5-этил-5фенилбарбитуровая кислота
4.
Солевые (натриевые) формыN
O
N
N
C2H5
N
H
CH3
O
5,5-диэтилбарбитурат
натрия
NaS
N
H
O
Hexenalum
Barbitalum-natrium
N
CH3
NaO
C2H5
NaO
O
1,5-диметил-5(циклогексен-1-ил)
барбитурат натрия
O
C2H5
+ Na2CO3
CH CH2 CH2 CH3
O CH
3
Thiopentalum-natrium
5-этил-5(2'-амил)-тиобарбитурат натрия
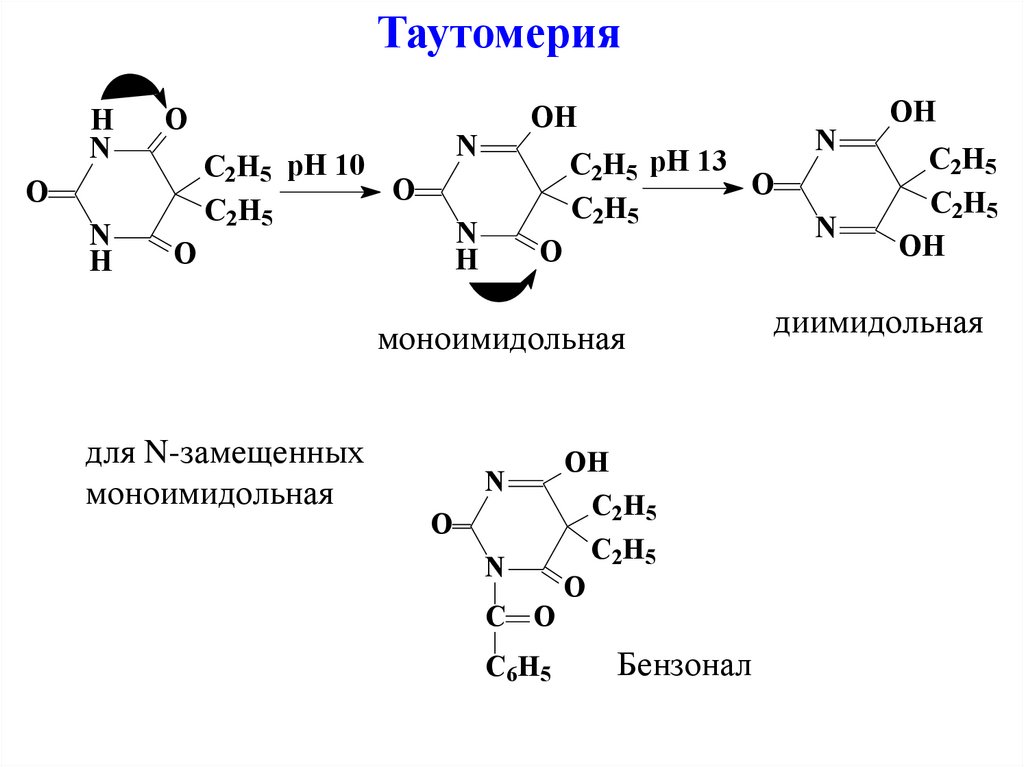
5.
ТаутомерияH
N
O
N
H
N
C2H5 pH 10
O
C2H5
O
OH
C2H5 pH 13
O
C2H5
N
H
O
O
моноимидольная
для N-замещенных
моноимидольная
N
O
N
C O
C6H5
OH
C2H5
C2H5
O
Бензонал
N
N
OH
C2H5
C2H5
OH
диимидольная
6.
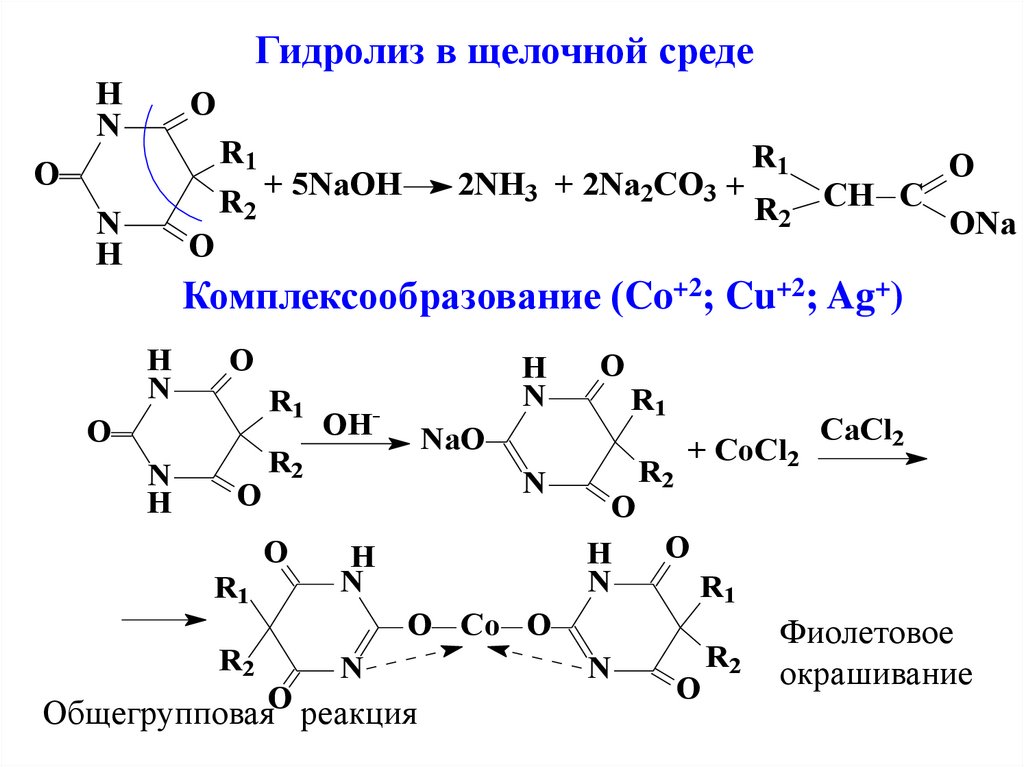
• Реакции подлинности.• 1. При гидролизе в щелочной среде
образуется аммиак и натриевая соль
диалкилуксусной кислоты. При последующем
подкислении выпадает в осадок кислотная
форма диалкилуксусной кислоты.
• 2.Реакции комплексообразования протекают
с солями меди, серебра и кобальта.
Специфической является реакция с меди
сульфатом. При этом образуются осадки и
окрашивание характерное для каждого
барбитурата. Реакция с солями кобальта
является общегрупповой – фиолетовое
окрашивание.
7.
Гидролиз в щелочной средеH
N
O
R1
+ 5NaOH
R2
O
N
H
2NH3 + 2Na2CO3 +
O
R1
O
R2 CH C ONa
Комплексообразование (Co+2; Cu+2; Ag+)
H
N
O
R1
O
N
H
O
H
N
-
OH
R1
R1
NaO
R2
O
O
N
O
H
N
H
N
R2
+ CoCl2
O
R1
O Co O
R2
O
N
Общегрупповая реакция
N
CaCl2
O
R2
Фиолетовое
окрашивание
8.
Взаимодействие с AgNO3 в среде Na2CO3H
N
O
O
N
H
N
R1
O
R2
Na2CO3
N
H
O
R1 Ag+
AgO
N
R1
O
+ Na2CO3
N
O
R2
O
+
Ag
R2
O
N
AgO
N
N
O
R1
AgO
N
H
O
R2
O
R1
R2
OAg
дизамещенная
Реакция проводится в присутствии
серебряная соль
натрия карбоната для увеличения
ионизации барбитуратов
Реакция используется в количественном определении
(метод аргентометрии титруют до помутнения раствора)
9.
• Барбитураты могут быть обнаружены спомощью цветных реакций на цикл
пиримидина, основанных на окислении.
В качестве реактивов применяют конц.
серную кислоту и калия дихромат,
резорцин и конц. серную кислоту и др.
Отличающиеся по окраске продукты
образуются при взаимодействии
барбитуратов с формальдегидом и пдиметиламинобензальдегидом в
присутствии конц. серной кислоты.
10.
Конденсация с альдегидамиO
O
R1
NH
R2
O
N
H
HN
O
O H
C
H
O
O
R1
O
O
H
N
H
O
C
O
O
N
R2
O
N
H
N CH2 N
R2
R1
N
H
CH3
CH3
H2SO4
R1
R2
O
окрашивание
n-ДМБА
11.
• Для отличия барбитуратов друг от другаприменяются реакции на ФГ:
• 1. Фенильный радикал (фенобарбитал,
бензобарбитал) – образование
азокрасителя после нитрования и
восстановления нитро-группы.
• 2. Циклогексен (гексенал) обесцвечивание бромной воды.
• 3. Ковалентно-связанная сера
(тиопентал-натрия) – образование
сульфида свинца.
12.
• 4. Присутствие иона натрия –определяют реакцией с пикриновой
кислотой и окраске пламени в желтый
цвет.
• 5. Амидная группа (бензобарбитал) –
гидроксамовая проба.
• 6. Бензойная кислота (бензобарбитал) –
после щелочного гидролиза,
обнаруживается с железа (III)
хлоридом.
13.
Фенобарбитал.Фенильный радикал. Образование азокрасителя
H
N
O
C2H5
O
N
H
NaNO3
H2SO4
H
N
O
N
H
O
H
N
O
C2H5
O
Соль диазония
фенобарбитала
N
H
NH2
NO2
ONa
NaNO2
HCl
[H]
C2H5
O
O
C2H5
ONa
O
N
Вишнево-красное
окрашивание
N
14.
Гексеналостаток циклогексена
1.
N
O
N
H
ONa
CH3
O
+ Br2
N
ONa
CH3 Br
Br
N
H
O
O
обесцвечивание бромной воды
2. Выделение кислотной формы при взаимодействии с
минеральными кислотами. Кислотную форму отделяют
и определяют температуру плавления.
Выделение кислотной формы проводится для всех
барбитуратов солей.
15.
Тиопентал-натрияОбнаружение серы
N
O
C2H5
Na S
N
H
Сплавление со щелочью в
присутствии ацетата свинца
+ 6NaOH +(CH3COO)2Pb
C5H11
O
O
C
ONa
PbS + 2NH3 + 2Na2CO3 + 2CH3COONa + CH
C2H5
C5H11
Осадок черного цвета
PbS + HCl
H2S + PbCl2
При подкислении осадок растворяется и ощущается запах
сероводорода.
16.
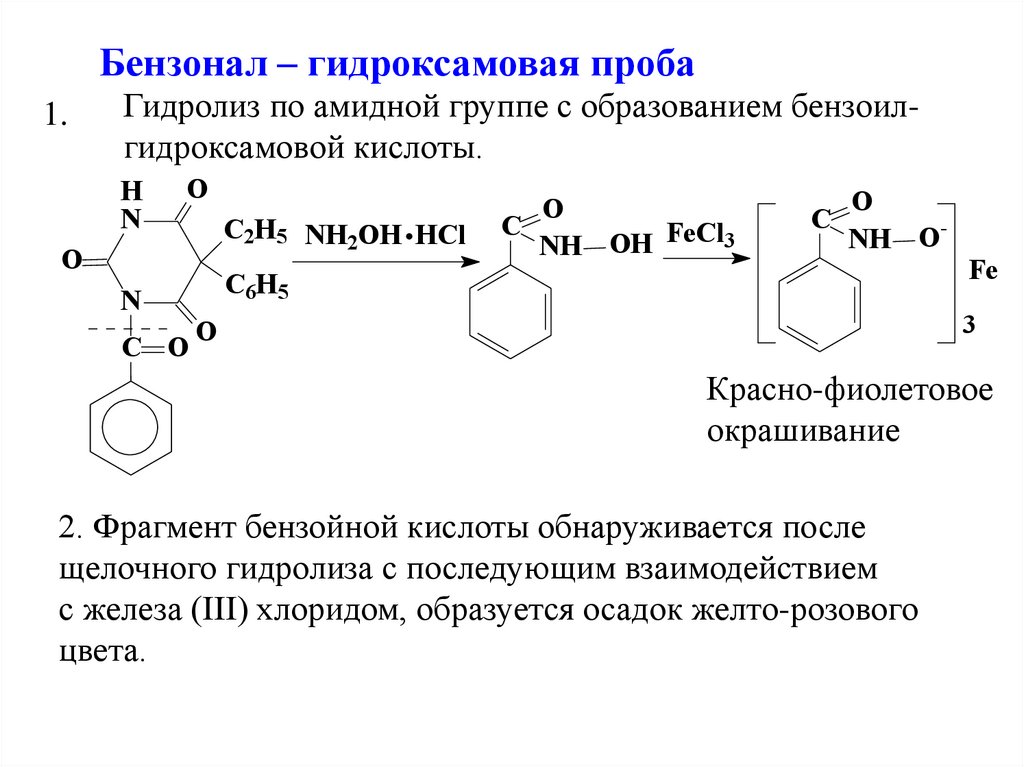
Бензонал – гидроксамовая проба1.
Гидролиз по амидной группе с образованием бензоилгидроксамовой кислоты.
H
N
O
C2H5 NH2OH HCl
O
C
O
NH O-
C6H5
N
C O
O
C
NH OH FeCl3
Fe
3
O
Красно-фиолетовое
окрашивание
2. Фрагмент бензойной кислоты обнаруживается после
щелочного гидролиза с последующим взаимодействием
с железа (III) хлоридом, образуется осадок желто-розового
цвета.
17.
• Физико-химические методы.• ИК-спектроскопия в области 4000-400 см-1
• ИК-спектры, снятые после прессования в таблетках
с калия бромидом, должны иметь полное совпадение
полос поглощения с прилагаемым к ФС рисунком
спектра или спектра сравнения.
• УФ-спектры в области 220-280 нм имеют
соответствующие максимумы и минимумы
поглощения. Для бензобарбитала применяется
отношение максимума к минимуму (2,2).
• Дифференциальная СФМ – барбитураты имеют
разные спектры абсорбции при рН 10 и 13.
• Метод ВЭЖХ – по параметрам удерживания.
18.
• Определение примесей.• Для субстанций – общие показатели чистоты
(хлориды, сульфаты, ионы тяжелых металлов)
эталонным способом.
• Примесь этилбарбитуровой кислоты (барбитал) и
фенилбарбитуровой кислоты (фенобарбитал) –
потенциометрически.
• Посторонние примеси в бензобарбитале,
тиопентале-натрии методом ТСХ. В УФ-свете д.быть
только одно пятно.
• При испытании натриевых солей барбитуратов
устанавливают предельное содержание примеси
свободной щелочи. Количество щелочи учитывается
при расчете количественного содержания ЛВ в
субстанции.
19.
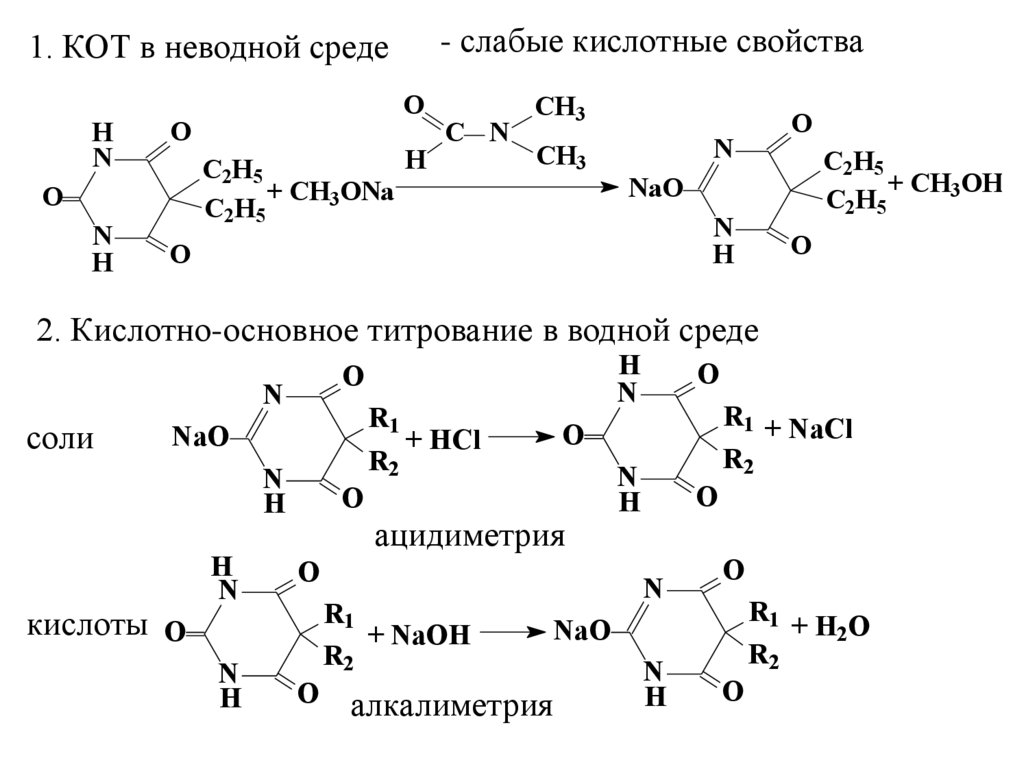
• Количественное определение.• Кислотно-основное титрование в среде
протофильного растворителя диметилформамида
(ДМФА) или смеси ДМФА и бензола применяют для
кислотных форм (бензонал, бензобарбитал и др.).
Титруют 0,1М раствором натрия гидроксида (в смеси
метанола и бензола). Индикатор тимоловый синий.
• Кислотные формы барбитуратов в условиях аптеки
количественно определяю титрованием в среде
этанола или ацетона 0,1М раствором NaOH
Индикатор тимолфталеин.
• Натриевые соли барбитуратов определяют методом
ацидиметрии 0,1М HCI. Индикатор метиловый оранж.
• Метод аргентометрии в присутствии натрия
карбоната. Титруют до образования дизамещенной
20.
• серебряной соли (помутнение раствора).• Метод гравиметрии применяется для натриевых
солей барбитуратов. При этом осаждают кислотную
форму , извлекают эфиром или хлороформом. Эфир
(хлороформ) отгоняют. Остаток высушивают и
взвешивают.
• Метод меркуриметрии основан на реакции
взаимодействия с ртути нитратом. При этом
образуется нерастворимое соединение. Осадок
отфильтровывают, а в растворе избыток ртути
нитрата определяют комплексонометрически.
• Метод СФМ – расчет по стандарту или закону
Бугера-Ламберта-Бера.
21.
- слабые кислотные свойства1. КОТ в неводной среде
H
N
O
C2H5
+ CH3ONa
C2H5
O
N
H
O
H
C N
CH3
CH3
O
N
C2H5
+ CH3OH
C2H5
NaO
N
H
O
O
2. Кислотно-основное титрование в водной среде
O
N
соли
R1
+ HCl
R2
NaO
N
H
кислоты O
H
N
N
H
ацидиметрия
O
O
O
N
H
O
R1 + NaCl
R2
O
O
R1
+ NaOH
R2
H
N
N
O
R1
+ H2O
R2
NaO
алкалиметрия
N
H
O
22.
• Применение.• Производные барбитуровой кислоты
применяют как успокаивающие и снотворные
средства. Бензобарбитал –
противоэпилептическое средство. Гексенал и
тиопентал-натрия применяют для
кратковременного наркоза внутривенно.
• Хранение.
• Список Б. В хорошо укупоренной таре.
Защищенном от света месте в склянках
темного стекла. Склянки заполнены доверху
т.к возможно взаимодействие с углекислотой
воздуха.

















 chemistry
chemistry








