Similar presentations:
Влияние условий хранения на качество лекарственных средств
1.
Государственное образовательное учреждение высшего профессионального образованияНИЖЕГОРОДСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
Федерального агентства по здравоохранению и социальному развитию
КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ И ФАРМАКОГНОЗИИ
Влияние условий хранения на
качество лекарственных средств
2.
Критерии качества ЛСБезопастность ЛС
Одним из критериев безопасности ЛС является отсутствие
побочных реакций при его использовании
а) HgO, амидохлорид, каломель Hg2Cl2 и др.
Hg2+ + 2RSH
белок (фермент)
б) производные пиразола
(RS)2Hg + 2H+
влияют на функцию кроветворения,
вызывают аллергические реакции,
увеличивают риск возникновения
злокачественных новообразований
Пример: метамизол натрия – производят только в Болгарии, Индии, России
Эффективность ЛС
Характеризуется уровнем лечебного эффекта, достигаемого
минимальной дозой
Соответствие ЛС нормативной документации
2
3. Испытания на пирогенность инъекционных препаратов
«+» и «-» м/о, грибы, вирусы, эндотоксины!!!Жар, озноб, тошнота, иногда летальный исход
Эндотоксины – т/стабильны и состоят из
липополисахаридов внешней плазматической
мембраны «-» м/о.
Тесты:
in vivo на кроликах;
in vitro с использованием ЛАЛ-реактивов,
приготовленных из крови мечехвостов (ЛАЛ-тест).
3
4. Испытания на пирогенность инъекционных препаратов
Испытания на кроликахI
3 кролика
∑ ∆t не более 1,2 оС → ЛС апирогенно
II
6 кроликов ∑ ∆t > 3,0 оС → пироген
III
9 кроликов ∑ ∆t > 4,5 оС → пироген
IV
12 кроликов ∑ ∆t > 5,4 оС → пироген
Недостатки:
у кроликов чувствительность к пирогенам в 3-4 раза ниже,
чем у человека → увеличение тест-дозы.
многие ЛВ токсичны и могут вызвать гибель животных →
используется заниженная величина тест-доз (инфузионные
растворы глюкозы, антибиотики);
τ min около 5 ч (для одной серии опыта).
4
5. Испытания на пирогенность инъекционных препаратов ЛАЛ-тест (Limulus Amebocyte Lysate) ТАЛ – тест (Tachypleus tridentatus)
ОФС 42-0062-07 «Бактериальные эндотоксины» ГФ РФXII, часть I, стр. 128-136
в США с 1980 г.
ЛАЛ-реактив – сублимированный порошок
(лизированная кровь мечехвостов), стабильный в
течение 4 лет.
Порошок растворяют в определенном количестве воды:
0,5; 0,25; 0,125; 0,030; 0,015 мл.
Контрольный стандарт эндотоксинов (CSE) –
лиофильно высушенные клетки E/coli с ПЭГ,
содержащие 500 нг эндотоксина.
5
6.
Испытания на пирогенностьинъекционных препаратов
ЛАЛ-тест (Limulus Amebocyte Lysate)
Эндотоксины + лизат клеток (амебоцитов) крови мечехвостов
в результате
Гель («гель-тромб тест»)
«+» гель-тромб тест
«-» гель-тромб тест
образуется гель, не
вытекающий из лунки
планшета при
переворачивании
гель не образуется, т.к.
эндотоксины
ингибируют процесс
гелеобразования
Преимущества:
высокая чувствительность к пирогенам (в 100 раз);
оценка ЛВ, которые невозможно проверить на животных;
быстрота выполнения τ min около 1,5 ч (для одного испытания);
испытания проводит один человек.
6
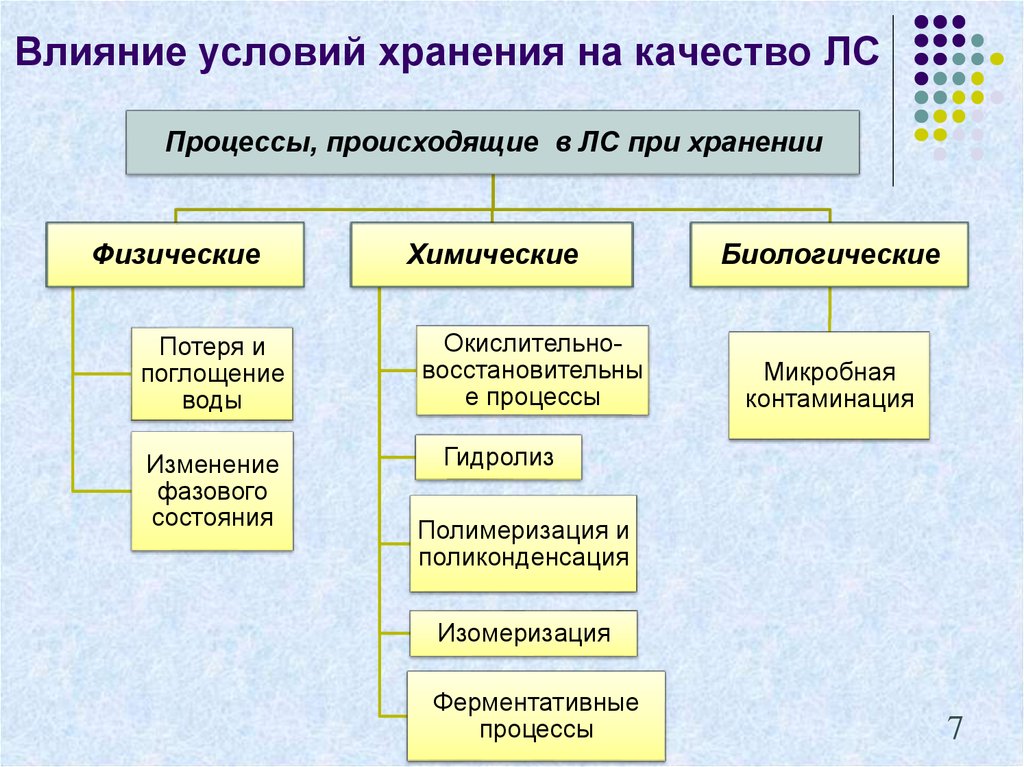
7. Влияние условий хранения на качество ЛС
Процессы, происходящие в ЛС при храненииФизические
Потеря и
поглощение
воды
Изменение
фазового
состояния
Химические
Окислительновосстановительны
е процессы
Биологические
Микробная
контаминация
Гидролиз
Полимеризация и
поликонденсация
Изомеризация
Ферментативные
процессы
7
8. Факторы, влияющие на ЛС при хранении
Действие света;Несоответствие температуры;
Нарушение режима (оттаивание – замораживание);
Повышенная влажность;
Наличие сапрофитов и др.
Классификация ЛС по приказу № 377
1.
2.
3.
4.
5.
6.
7.
8.
9.
ЛС, требующие защиты от:
Влаги;
Улетучивания;
Повышения температуры;
Понижения температуры;
Света (прямых солнечных лучей);
Пахучие, красящие ЛС;
Дезинфицирующие ЛС;
Взрывоопасные ЛС;
Легковоспламеняющиеся ЛС.
8
9.
Физические процессы1. Поглощение воды, приводящее к отсыреванию
(АК+NaHCO3, АК+рутин, АК+эуфиллин)
Гигроскопические соли: NaNO3, CaCl2 ∙ 6 H2O, KI, NaI
CH3COOK + CO2 + H2O ↔ CH3COOH + KHCO3 (pH ≈ 7-8)
2. Изменение фазового состояния за счет:
₪ расслаивания;
₪ изменения состава ЛС, содержащих эвтектические смеси;
₪ укрупнения частиц дисперсной фазы (в т.ч. коагуляция)
(Ag – Ag2O) – колларгол, протаргол и др.;
₪ сублимации (камфора, бромкамфора, йод);
₪ испарения легколетучих соединений (NH3, I2, CHI3, HCOH,
хлоралгидрат, фенолы (тимол), терпены (камфора,
бромкамфора, ментол, валидол).
9
10.
Физические процессы3. Потеря воды – выветривание
Неорганические кристаллогидраты
ZnSO4 ∙ 7 H2O,
Na2HAsO4 ∙ 7 H2O,
Na2SO4 ∙ 10 H2O,
кальция лактат ∙ 5 H2O,
CuSO4 ∙ 5 H2O,
Na2S2O3 ∙ 5 H2O,
MgSO4 ∙ 7 H2O,
Na2B4O2 ∙ 10 H2O,
Na-цитрат ∙ 5,5 H2O,
CH2COONa
HO
Органические кристаллические соли
C
COONa 5,5 H2O
CH2COONa
Атропина сульфат, морфина г/хл, кофеин и др.
10
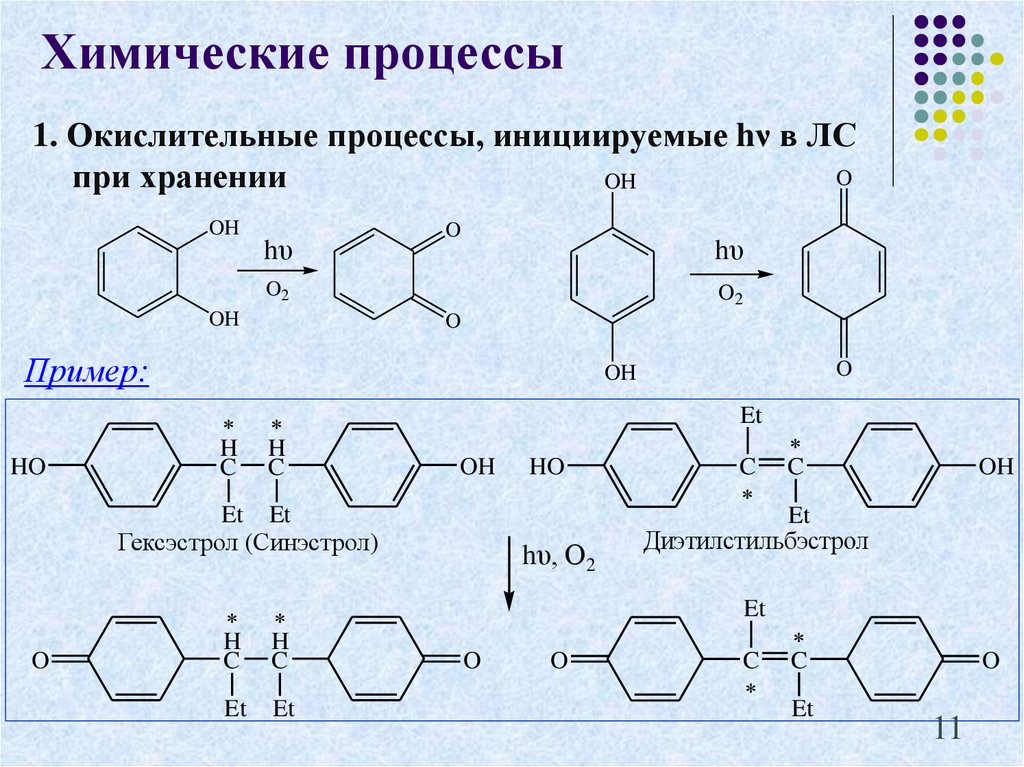
11. 1. Окислительные процессы, инициируемые hν в ЛС при хранении
Химические процессы1. Окислительные процессы, инициируемые hν в ЛС
O
при хранении
OH
OH
hυ
O
hυ
O2
OH
O2
O
Пример:
HO
H
C
H
C
Et
OH
Et Et
Гексэстрол (Синэстрол)
O
O
OH
H
C
H
C
Et
Et
HO
hυ, О2
C
O
OH
Et
Диэтилстильбэстрол
Et
O
C
C
C
Et
O
11
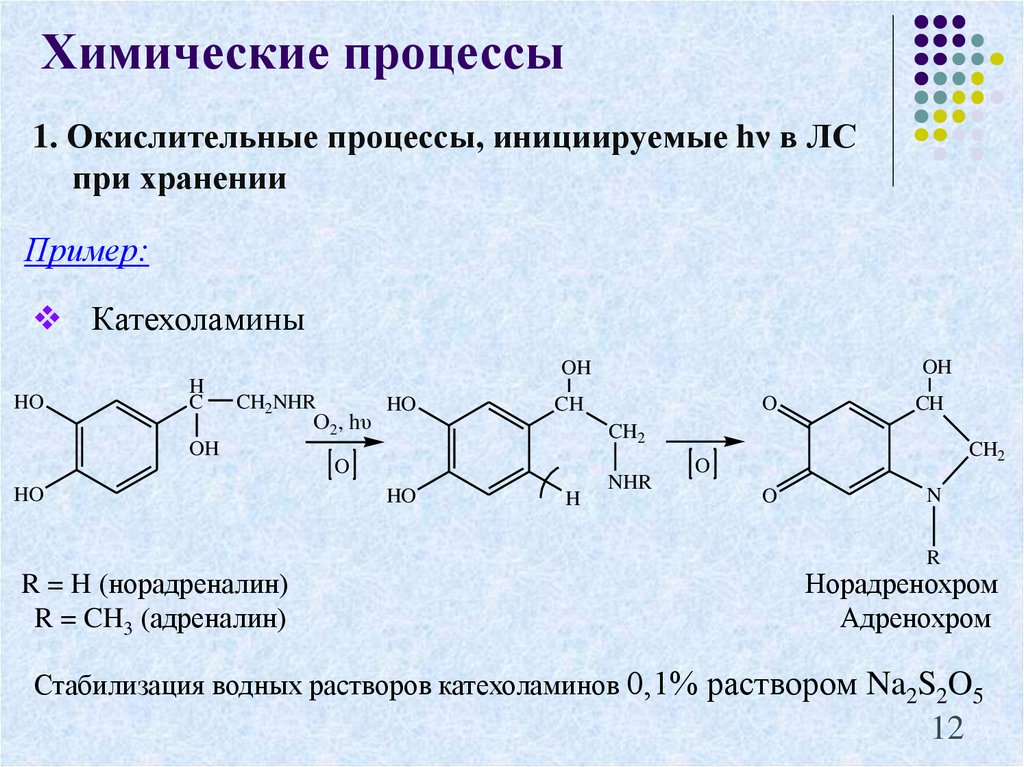
12. 1. Окислительные процессы, инициируемые hν в ЛС при хранении
Химические процессы1. Окислительные процессы, инициируемые hν в ЛС
при хранении
Пример:
Катехоламины
HO
H
C
OH
OH
CH2NHR
OH
HO
R = H (норадреналин)
R = CH3 (адреналин)
О2, hυ
HO
O
CH
CH
CH2
O
HO
H
NHR
CH2
O
O
N
R
Норадренохром
Адренохром
Стабилизация водных растворов катехоламинов 0,1% раствором Na2S2O5
12
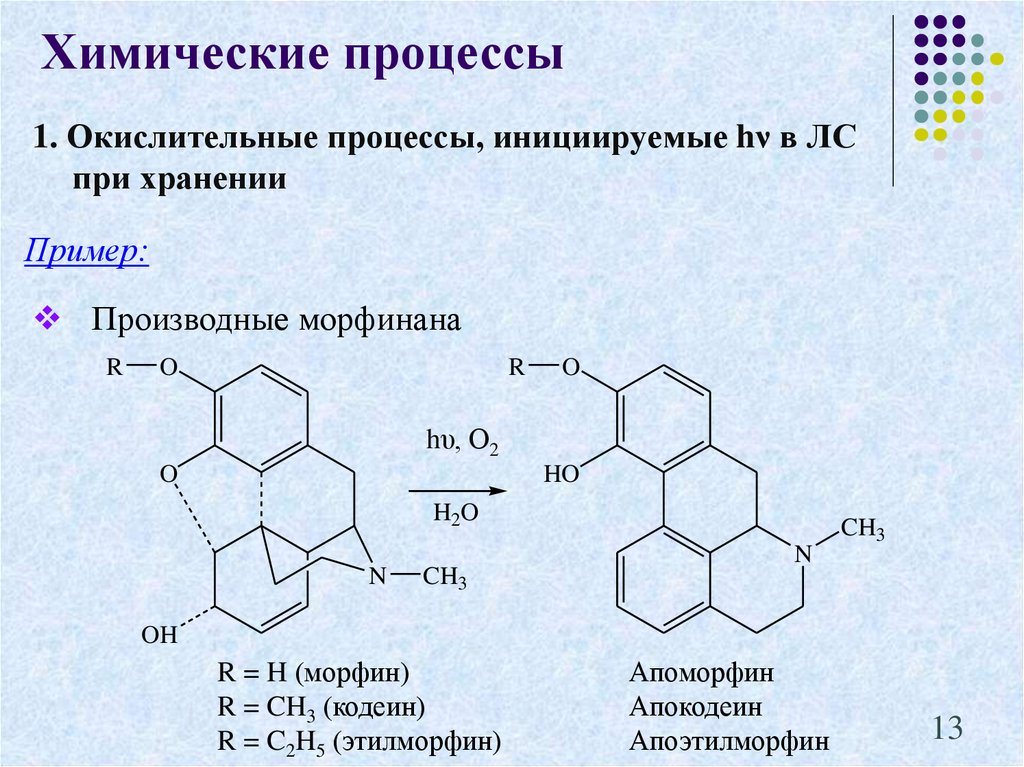
13. 1. Окислительные процессы, инициируемые hν в ЛС при хранении
Химические процессы1. Окислительные процессы, инициируемые hν в ЛС
при хранении
Пример:
Производные морфинана
R
R
O
O
hυ, О2
HO
O
H2O
N
CH3
CH3
N
OH
R = H (морфин)
R = CH3 (кодеин)
R = C2H5 (этилморфин)
Апоморфин
Апокодеин
Апоэтилморфин
13
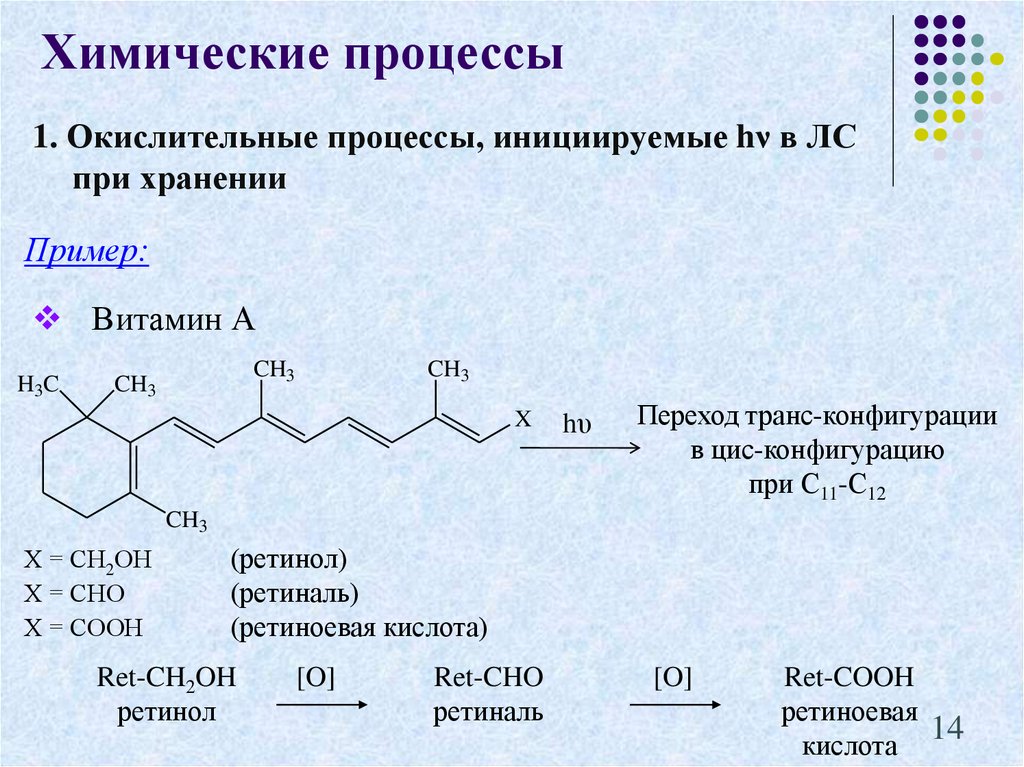
14. 1. Окислительные процессы, инициируемые hν в ЛС при хранении
Химические процессы1. Окислительные процессы, инициируемые hν в ЛС
при хранении
Пример:
Витамин А
H3C
CH3
CH3
CH3
X
hυ
Переход транс-конфигурации
в цис-конфигурацию
при С11-С12
CH3
Х = СН2ОН
Х = СНО
Х = СООН
(ретинол)
(ретиналь)
(ретиноевая кислота)
Ret-CH2OH
ретинол
[O]
Ret-CHO
ретиналь
[O]
Ret-COOH
ретиноевая
14
кислота
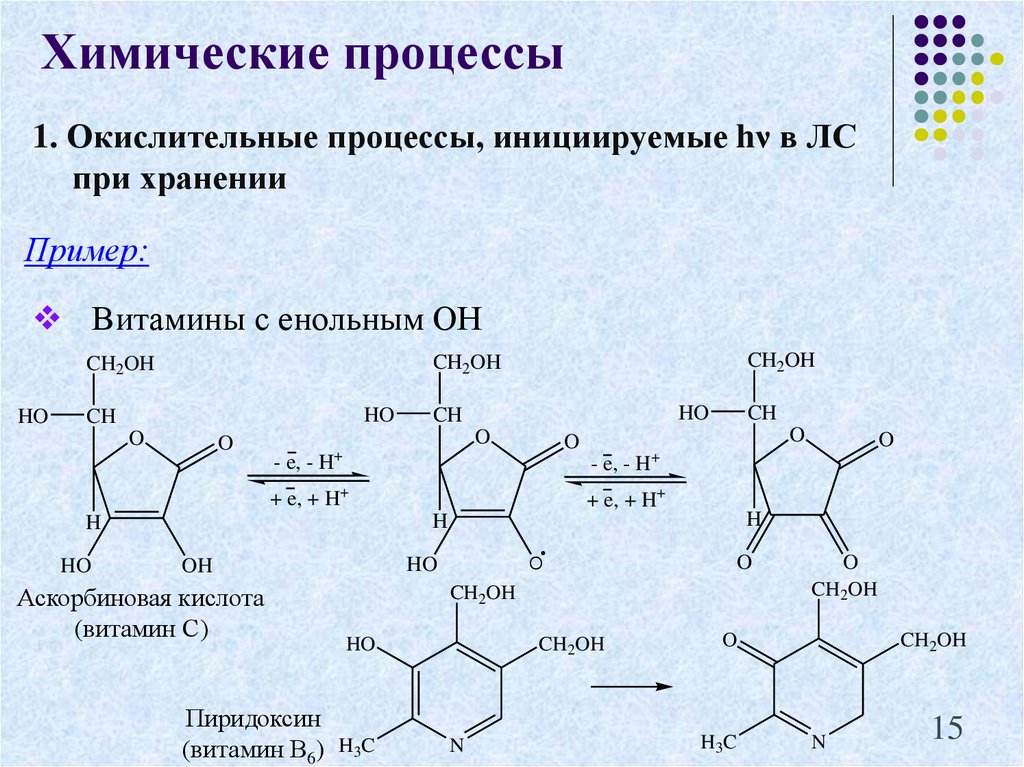
15. 1. Окислительные процессы, инициируемые hν в ЛС при хранении
Химические процессы1. Окислительные процессы, инициируемые hν в ЛС
при хранении
Пример:
Витамины с енольным ОН
HO
CH2OH
CH2OH
CH2OH
HO
CH
O
HO
CH
O
O
- e, - H
+ e, + H+
H
H
H
HO
OH
Аскорбиновая кислота
(витамин С)
Пиридоксин
(витамин В6)
O
+
- e, - H
+ e, + H+
HO
O
O
+
CH
O
O
CH2OH
HO
H3C
CH2OH
N
O
CH2OH
O
H3C
CH2OH
N
15
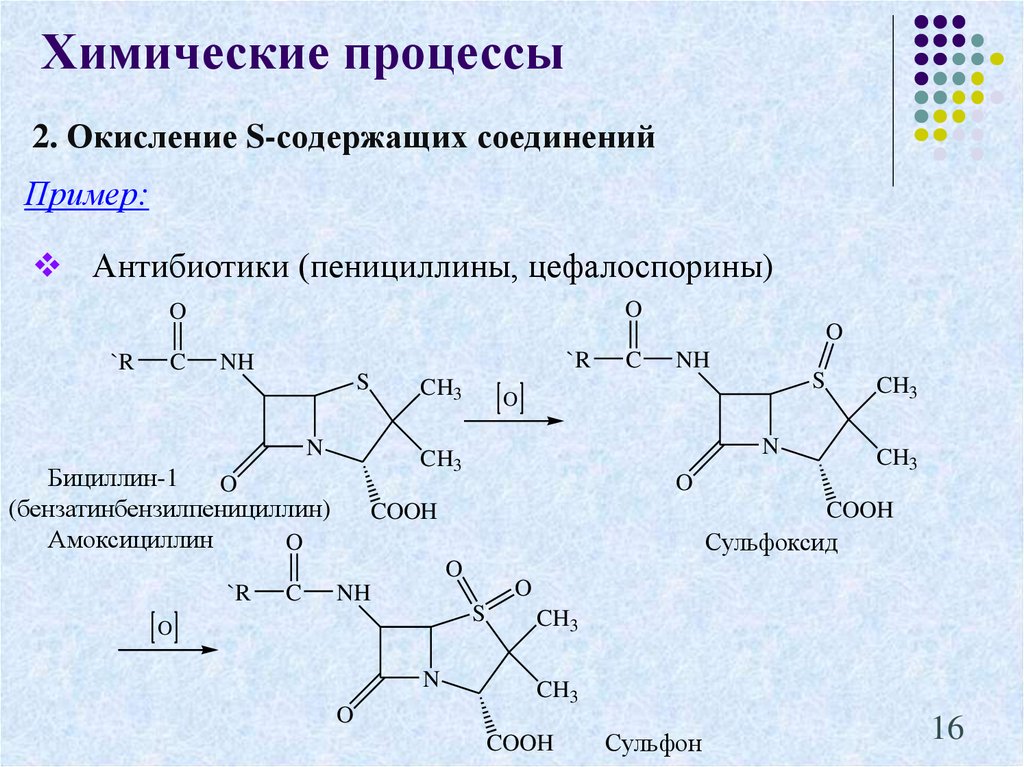
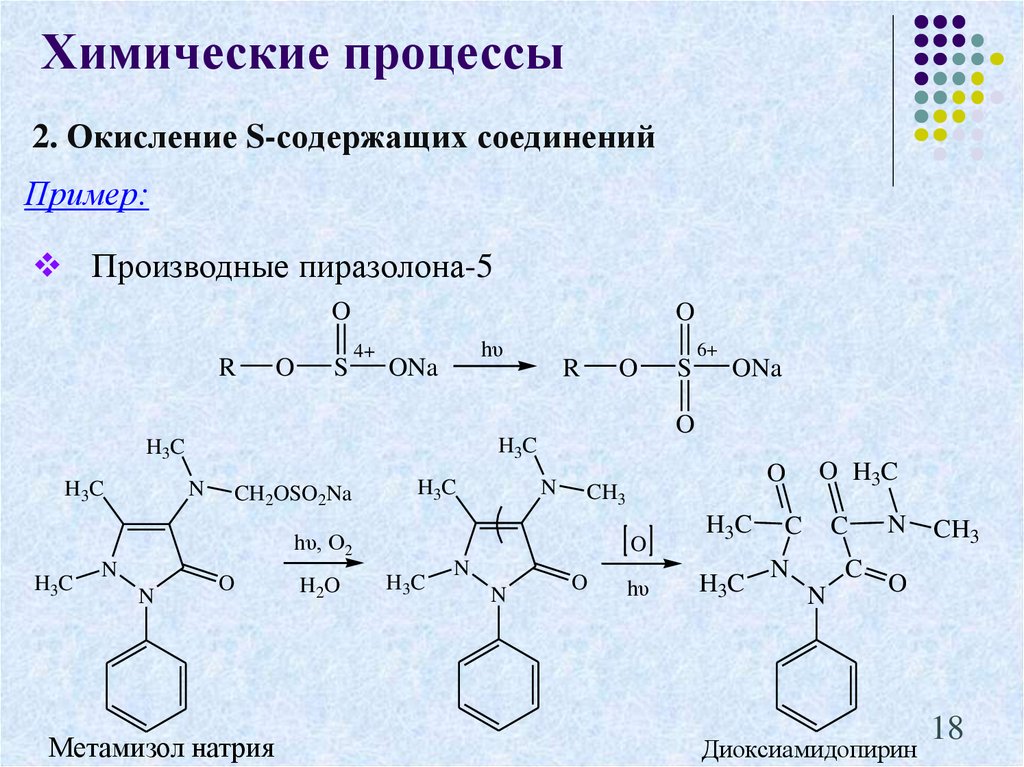
16. 2. Окисление S-содержащих соединений
Химические процессы2. Окисление S-содержащих соединений
Пример:
Антибиотики (пенициллины, цефалоспорины)
O
O
`R
C
O
`R
NH
S
CH3
N
C
S
CH3
N
CH3
O
COOH
COOH
Сульфоксид
O
`R
NH
O
CH3
Бициллин-1
O
(бензатинбензилпенициллин)
Амоксициллин
O
C
NH
O
S
O
N
CH3
CH3
O
COOH
Сульфон
16
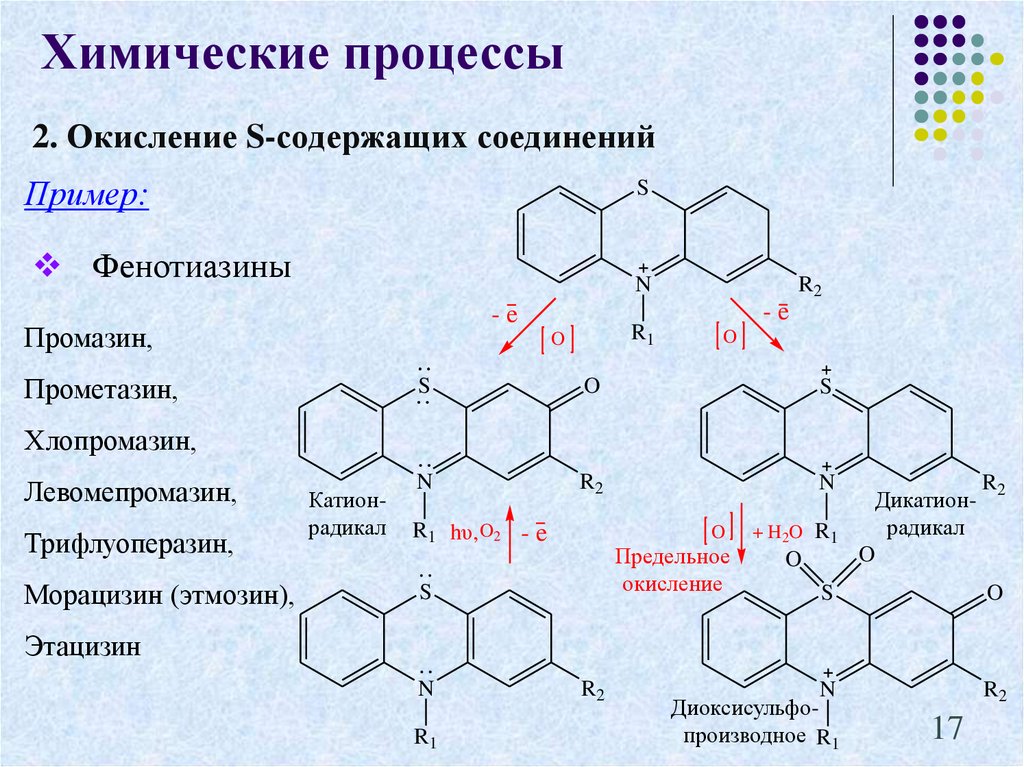
17. 2. Окисление S-содержащих соединений
Химические процессы2. Окисление S-содержащих соединений
Пример:
S
Фенотиазины
N
-e
Промазин,
R1
O
Прометазин,
R2
-e
O
S
O
S
N
R2
N
Хлопромазин,
Левомепромазин,
Трифлуоперазин,
Морацизин (этмозин),
Катионрадикал
R1 hυ, O2 - e
O
Предельное
окисление
S
+ H2 O R 1
O
Дикатионрадикал
O
R2
S
O
N
Диоксисульфопроизводное R1
R2
Этацизин
N
R1
R2
17
18. 2. Окисление S-содержащих соединений
Химические процессы2. Окисление S-содержащих соединений
Пример:
Производные пиразолона-5
O
R
O
S
O
4+
hυ
ONa
O
N
CH2OSO2Na
H3C
N
N
N
O
Метамизол натрия
H2O
O
O
H3C
N
N
ONa
CH3
hυ, О2
H3C
S
O
H3C
H3C
H3C
R
6+
O
hυ
H3C
H3C
O H3C
C
C
N
C
N
N
CH3
O
Диоксиамидопирин
18
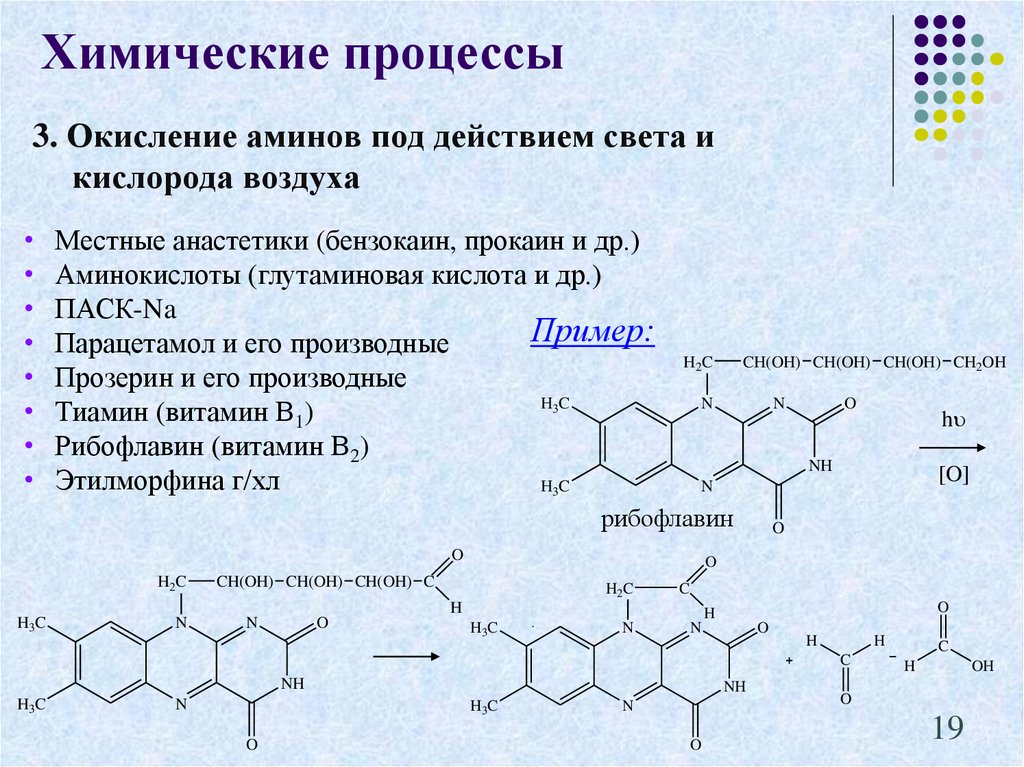
19. 3. Окисление аминов под действием света и кислорода воздуха
Химические процессы3. Окисление аминов под действием света и
кислорода воздуха
Местные анастетики (бензокаин, прокаин и др.)
Аминокислоты (глутаминовая кислота и др.)
ПАСК-Na
Пример:
Парацетамол и его производные
Прозерин и его производные
H3C
Тиамин (витамин В1)
Рибофлавин (витамин В2)
Этилморфина г/хл
H3C
H2C
CH(OH) CH(OH) CH(OH) CH2OH
N
N
CH(OH) CH(OH) CH(OH) C
N
O
O
O
H2C
C
H
N
[O]
N
O
H3C
O
H
H3C
N
N
O
H
H
C
NH
H3C
N
NH
H3C
O
h
NH
рибофлавин
H2C
O
N
O
C
H
OH
O
19
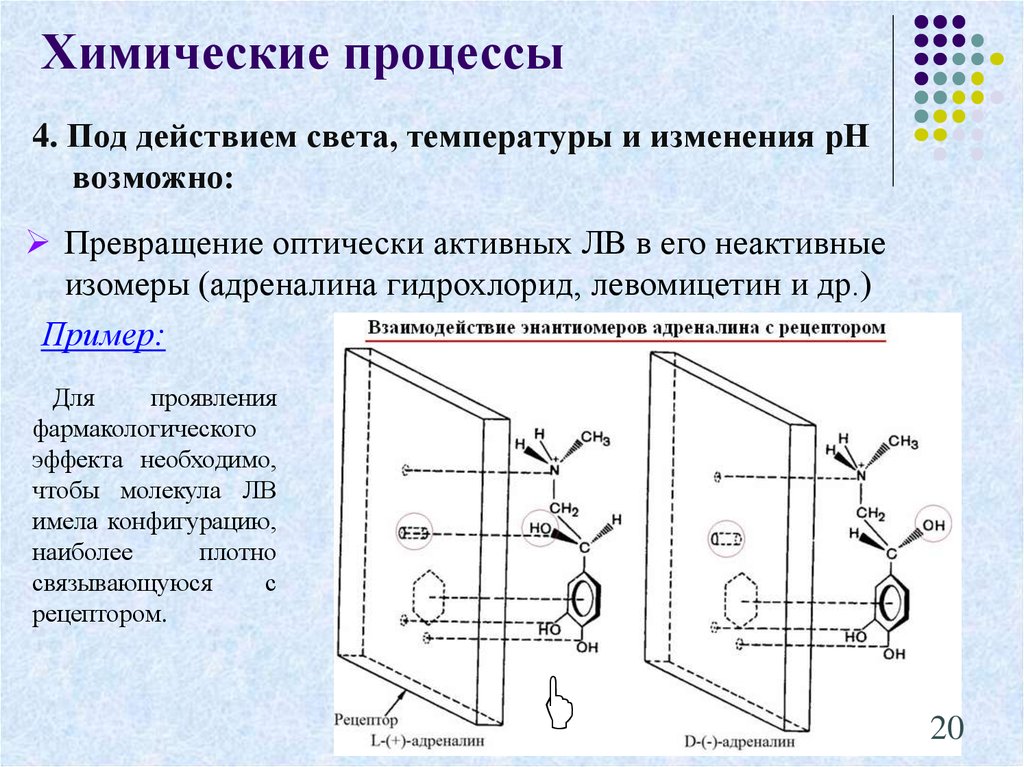
20. 4. Под действием света, температуры и изменения рН возможно:
Химические процессы4. Под действием света, температуры и изменения рН
возможно:
Превращение оптически активных ЛВ в его неактивные
изомеры (адреналина гидрохлорид, левомицетин и др.)
Пример:
Для
проявления
фармакологического
эффекта необходимо,
чтобы молекула ЛВ
имела конфигурацию,
наиболее
плотно
связывающуюся
с
рецептором.
20
21. 4. Под действием света, температуры и изменения рН возможно:
Химические процессы4. Под действием света, температуры и изменения рН
возможно:
Изменение степени окисления
OH
Пример:
1. FeSO4 • H2O
2. AgNO3
h
h
[O], H2O
Fe2(OH)4SO4; H3C
Ag2O + Agо + AgO;
C
H
O
Fe • 3 H2O
C
O- 2
3. Колларгол (70% Ag и 30% белка);
4. Протаргол (8-9% Ag и белок);
5. Сульфаргин – серебряная соль сульфазина (сульфадиазина).
H2N
O2
S
N
Ag2O + Ago
N
Ag
N
21
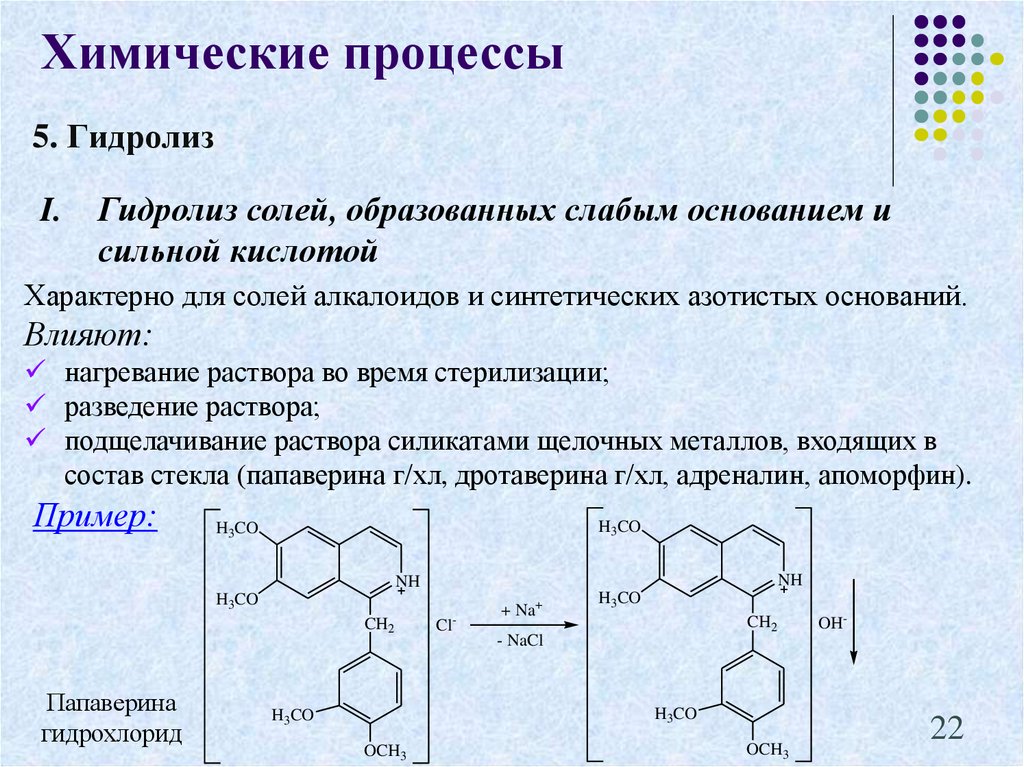
22. 5. Гидролиз
Химические процессы5. Гидролиз
I.
Гидролиз солей, образованных слабым основанием и
сильной кислотой
Характерно для солей алкалоидов и синтетических азотистых оснований.
Влияют:
нагревание раствора во время стерилизации;
разведение раствора;
подщелачивание раствора силикатами щелочных металлов, входящих в
состав стекла (папаверина г/хл, дротаверина г/хл, адреналин, апоморфин).
Пример:
H3CO
H3CO
NH
NH
H3CO
CH2
Папаверина
гидрохлорид
Cl
-
+ Na+
H3CO
CH2
- NaCl
H3CO
H3CO
OCH3
OCH3
OH-
22
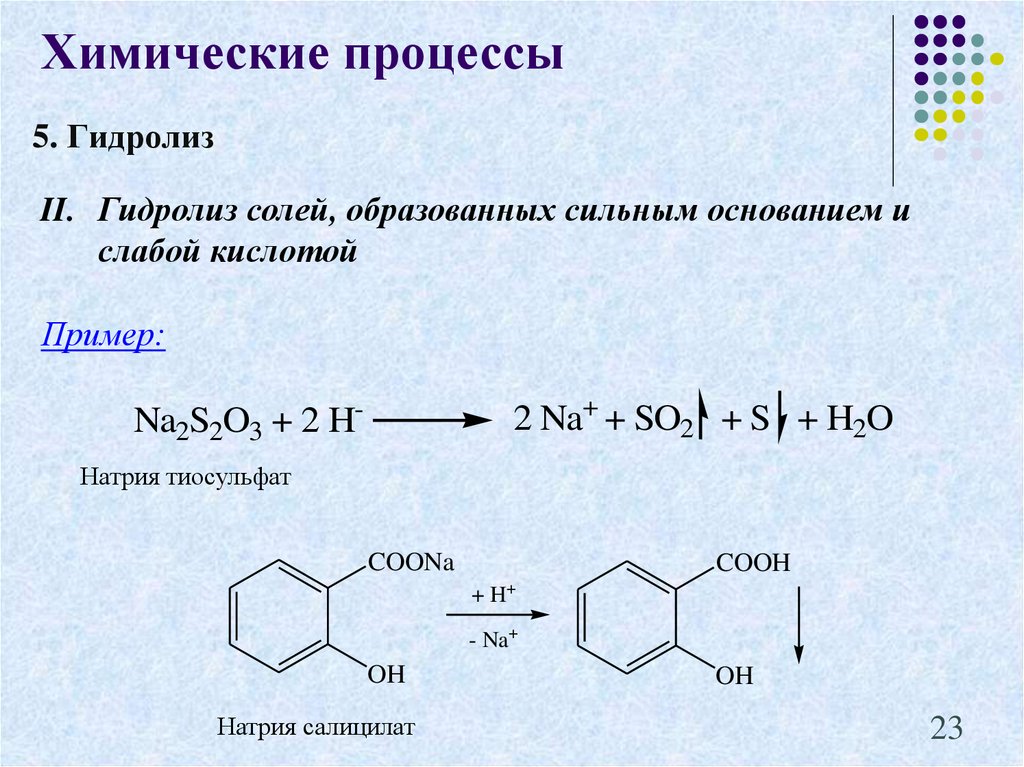
23. 5. Гидролиз
Химические процессы5. Гидролиз
II. Гидролиз солей, образованных сильным основанием и
слабой кислотой
Пример:
2 Na+ + SO2 + S + H2O
Na2S2O3 + 2 HНатрия тиосульфат
COONa
COOH
+ H+
- Na+
OH
Натрия салицилат
OH
23
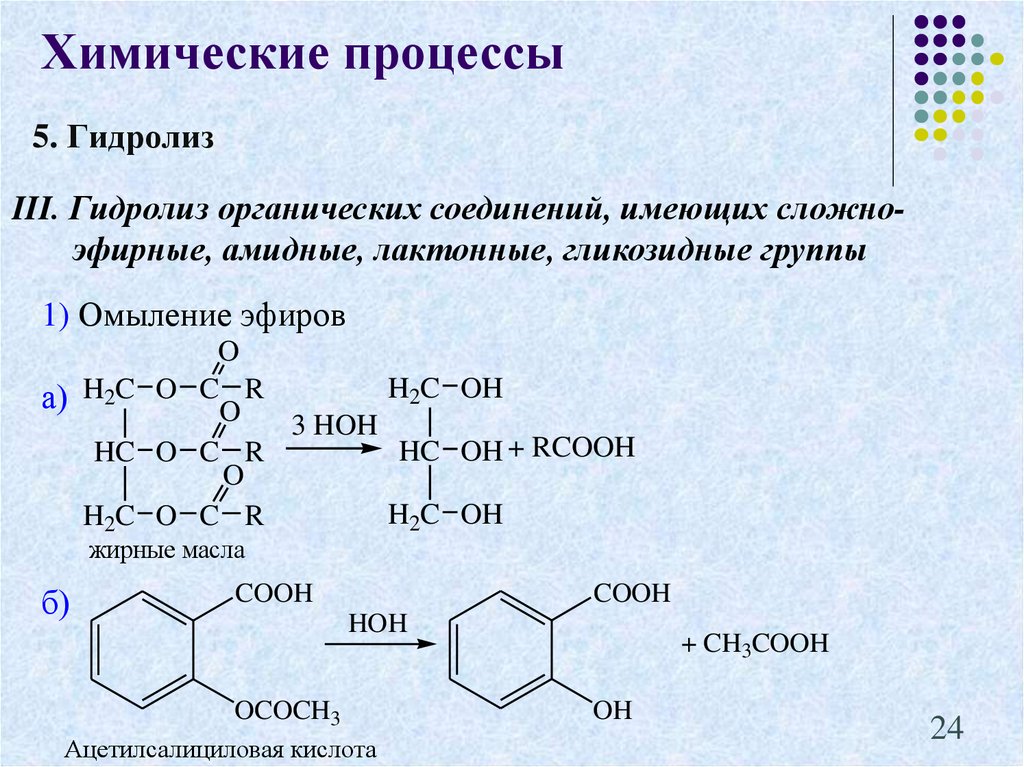
24.
Химические процессы5. Гидролиз
III. Гидролиз органических соединений, имеющих сложноэфирные, амидные, лактонные, гликозидные группы
1) Омыление эфиров
O
H2C OH
а) H2C O CO R
3 HOH
HC OH + RCOOH
HC O C R
O
H2C OH
H2C O C R
жирные масла
б)
COOH
COOH
HOH
OCOCH3
Ацетилсалициловая кислота
+ CH3COOH
OH
24
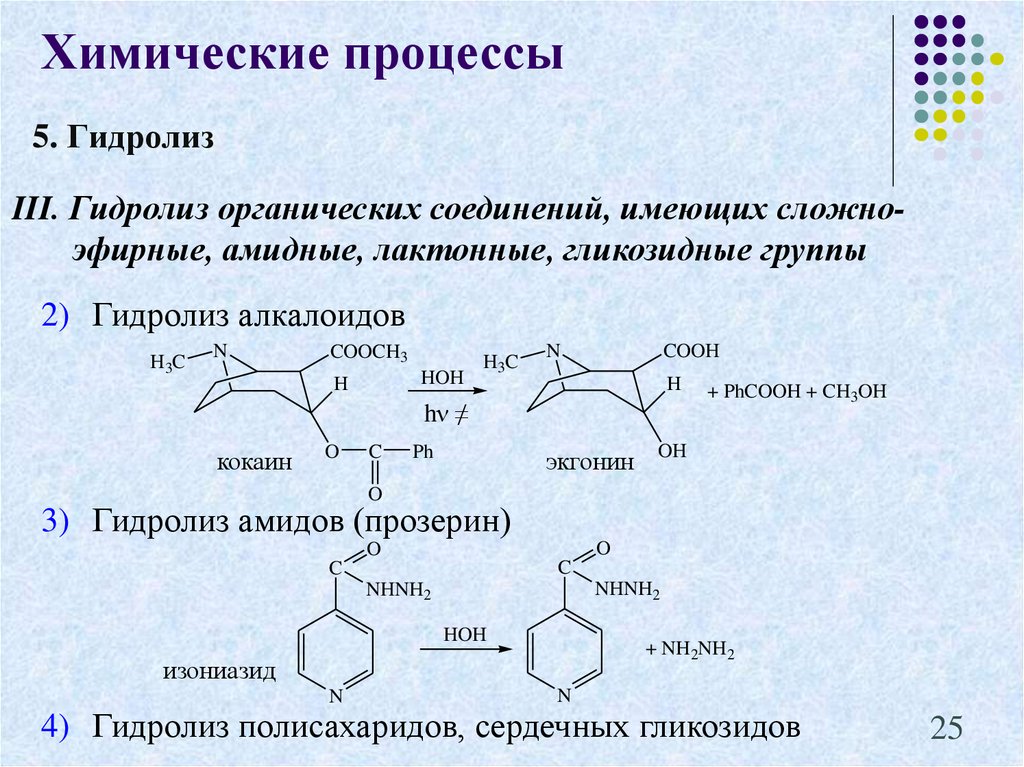
25.
Химические процессы5. Гидролиз
III. Гидролиз органических соединений, имеющих сложноэфирные, амидные, лактонные, гликозидные группы
2) Гидролиз алкалоидов
H3C
N
COOCH3
HOH
H
H3C
N
COOH
H
hν ≠
кокаин
O
C
Ph
экгонин
+ PhCOOH + CH3OH
OH
O
3) Гидролиз амидов (прозерин)
O
O
C
C
NHNH2
NHNH2
HOH
+ NH2NH2
изониазид
N
N
4) Гидролиз полисахаридов, сердечных гликозидов
25
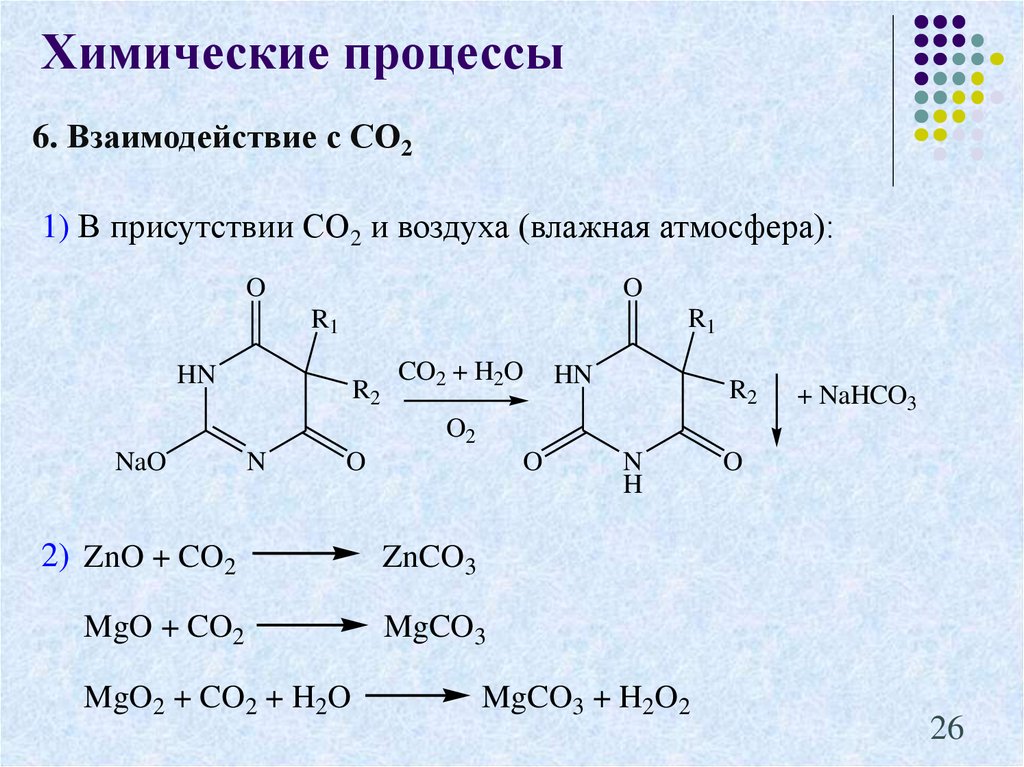
26.
Химические процессы6. Взаимодействие с СО2
1) В присутствии СО2 и воздуха (влажная атмосфера):
O
O
R1
R1
HN
R2
CO2 + H2O
HN
R2
+ NaHCO3
O2
NaO
N
O
2) ZnO + CO2
MgO + CO2
MgO2 + CO2 + H2O
O
N
H
O
ZnCO3
MgCO3
MgCO3 + H2O2
26
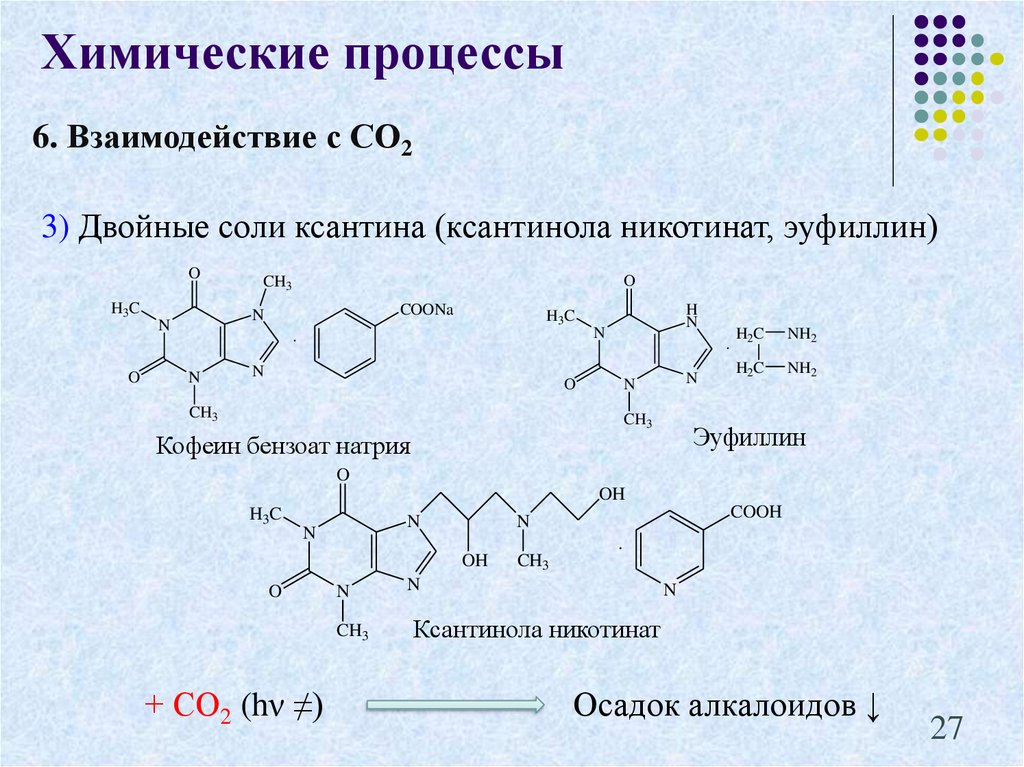
27.
Химические процессы6. Взаимодействие с СО2
3) Двойные соли ксантина (ксантинола никотинат, эуфиллин)
O
H3C
COONa
N
N
O
O
CH3
N
.
N
H
N
H3C
N
.
O
N
N
CH3
CH3
H2C
NH2
H2C
NH2
Эуфиллин
Кофеин бензоат натрия
O
OH
H3C
N
N
.
OH
O
N
CH3
+ СО2 (hν ≠)
COOH
N
CH3
N
N
Ксантинола никотинат
Осадок алкалоидов ↓
27
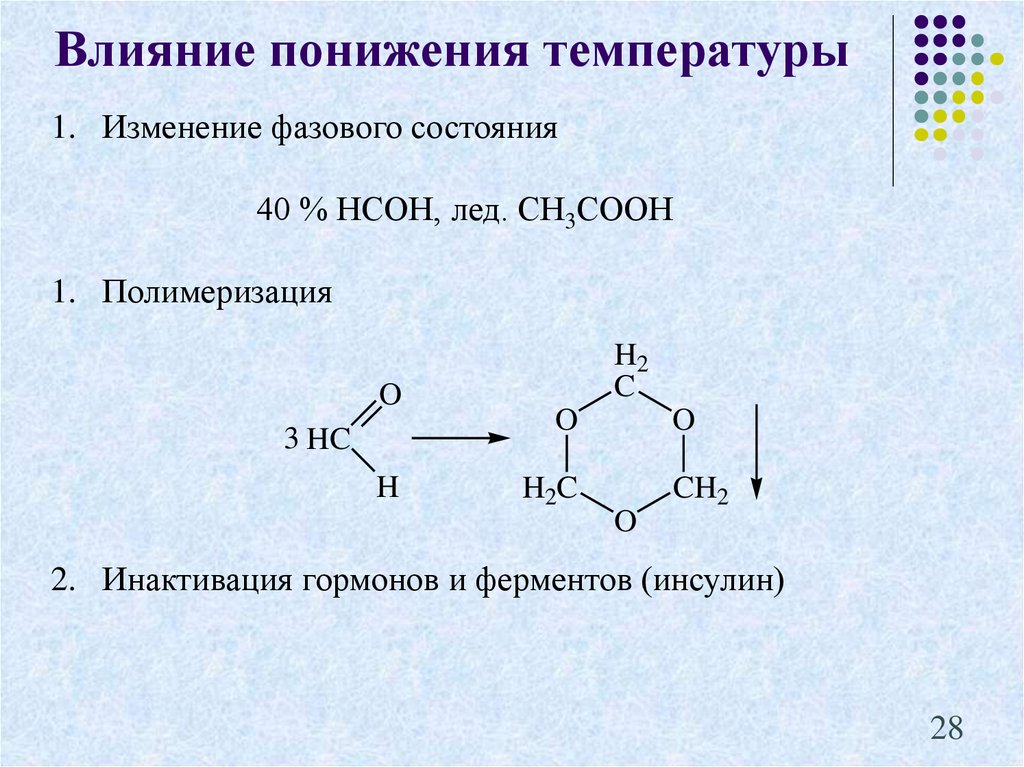
28.
Влияние понижения температуры1. Изменение фазового состояния
40 % НСОН, лед. СН3СООН
1. Полимеризация
O
3 HC
H
H2
C
O
O
H2C
CH2
O
2. Инактивация гормонов и ферментов (инсулин)
28










 chemistry
chemistry








