Similar presentations:
Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром
1. Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром
Сабит Сания ТФП13-004-22. Пенницилины
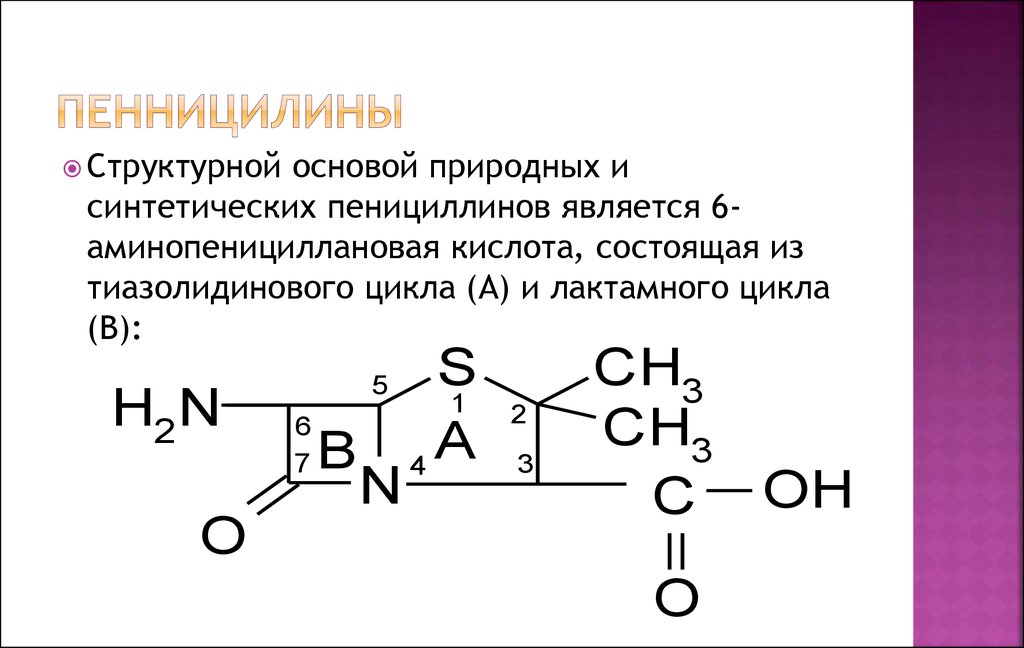
Структурнойосновой природных и
синтетических пенициллинов является 6аминопенициллановая кислота, состоящая из
тиазолидинового цикла (А) и лактамного цикла
(В):
H2N
O
S
1
6
A
7B
4
N
5
2
3
CH3
CH3
C OH
O
3. Пенницилины
Специфическая биологическая активность обусловлена наличиемтиазолидинового и лактамного колец, а также заместителем в 6ом положении.
Биосинтез природных пенициллинов осуществляется отобранными
промышленными штаммами плесени, инкубированными в
питательной среде, содержащей аминокислоты, углеводы, жиры и
обязательно предшественников для формирования радикала в 6ом положении.
Для выделения и очистки пенициллинов используют
хроматографию, ионообменную сорбцию.
Природные пенициллины имеют серьезный недостаток – они легко
разрушаются под действием фермента пенициллиназы (βлактамазы). Это послужило предпосылкой для синтеза
полусинтетических пенициллинов на основе 6-аминопенициллановой кислоты (6-АПК), которую чаще всего ацилируют
по аминогруппе в 6-ом положении.
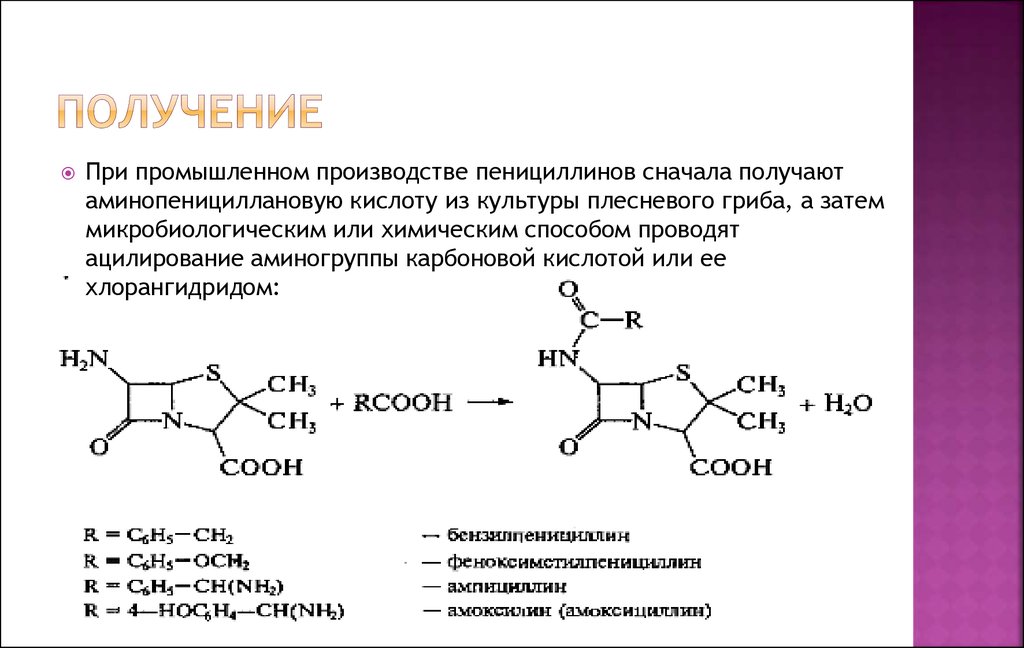
4. Получение
При промышленном производстве пенициллинов сначала получаютаминопенициллановую кислоту из культуры плесневого гриба, а затем
микробиологическим или химическим способом проводят
ацилирование аминогруппы карбоновой кислотой или ее
хлорангидридом:
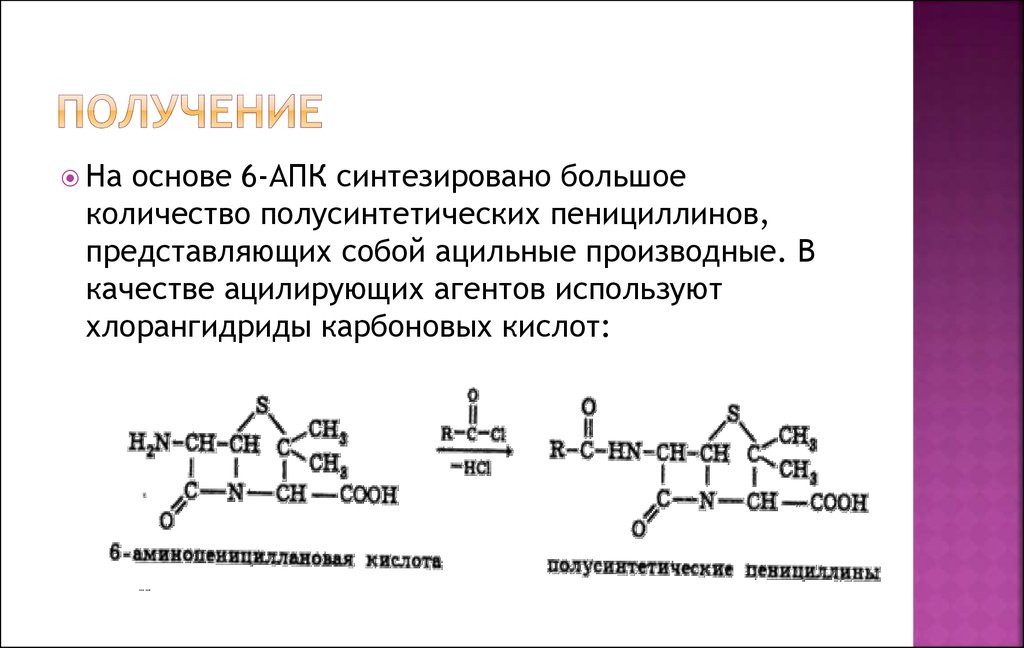
5. Получение
Наоснове 6-АПК синтезировано большое
количество полусинтетических пенициллинов,
представляющих собой ацильные производные. В
качестве ацилирующих агентов используют
хлорангидриды карбоновых кислот:
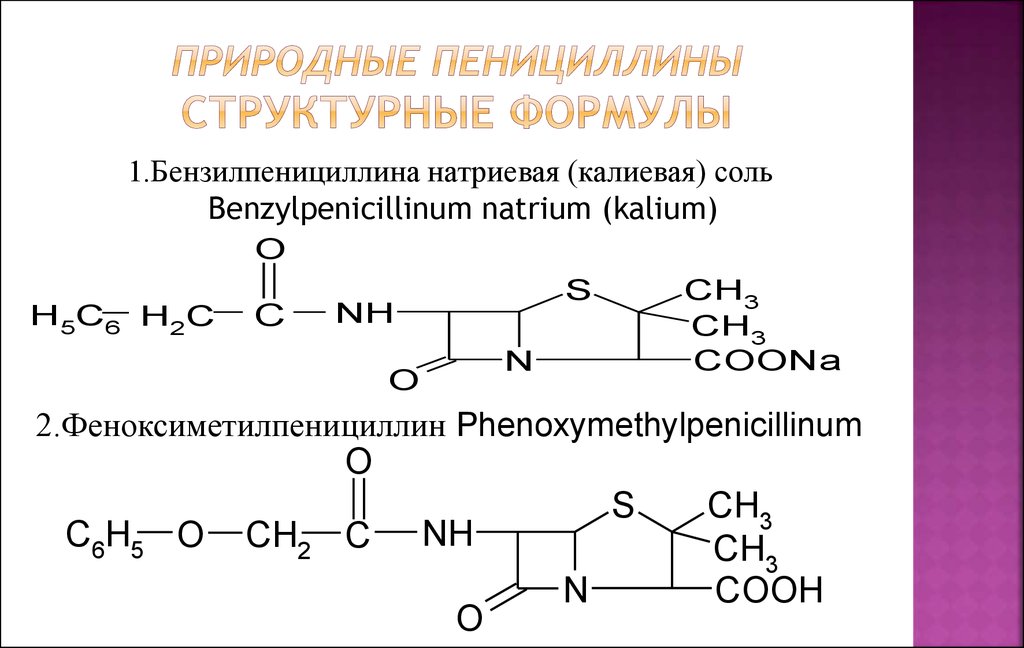
6. Природные пенициллины Структурные формулы
1.Бензилпенициллина натриевая (калиевая) сольBenzylpenicillinum natrium (kalium)
O
H5C6 H2C
C
S
NH
CH3
CH3
COONa
N
O
2.Феноксиметилпенициллин Phenoxymethylpenicillinum
O
C6H5 O
CH2 C
S
NH
O
N
CH3
CH3
COOH
7. Природные пенициллины Структурные формулы
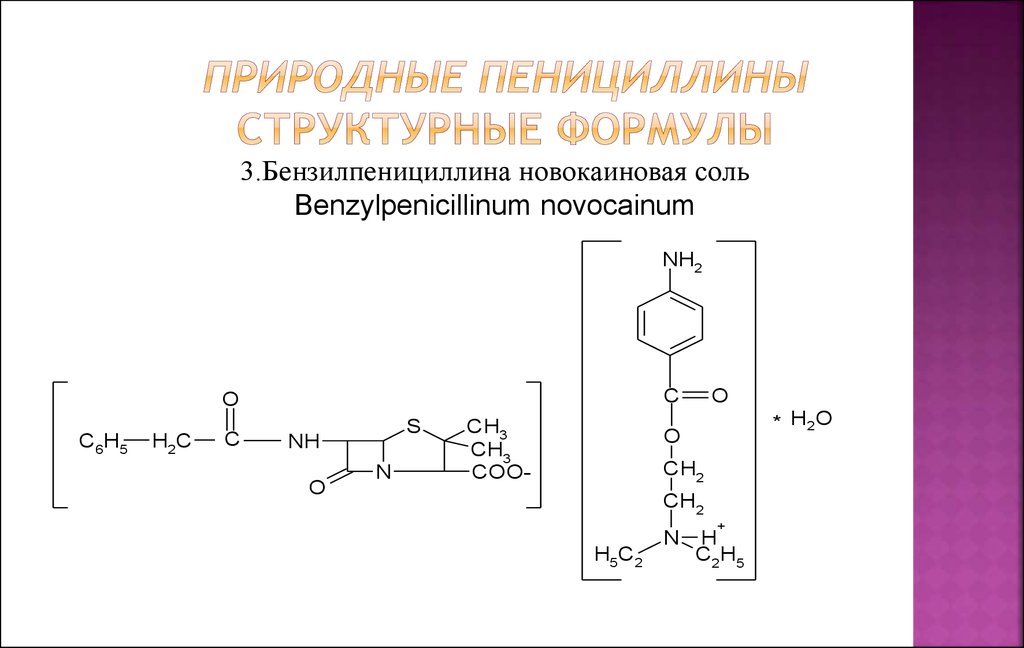
3.Бензилпенициллина новокаиновая сольBenzylpenicillinum novocainum
NH2
C
O
C6H5
H2C
C
S
NH
O
N
CH3
CH3
COO-
O
* H2O
O
CH2
CH2
H5C2
N
+
H
C2H5
8. Природные пенициллины Структурные формулы
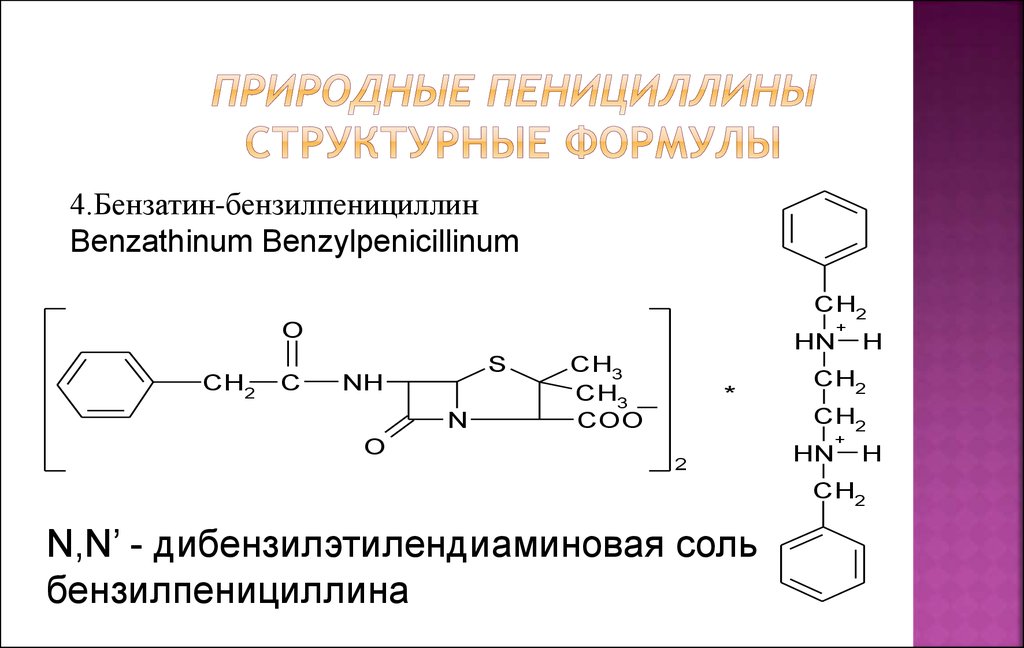
4.Бензатин-бензилпенициллинBenzathinum Benzylpenicillinum
CH2
O
CH2
C
+
HN
S
NH
N
O
CH3
CH3
COO
*
H
CH2
CH2
+
2
HN
H
CH2
N,N’ - дибензилэтилендиаминовая соль
бензилпенициллина
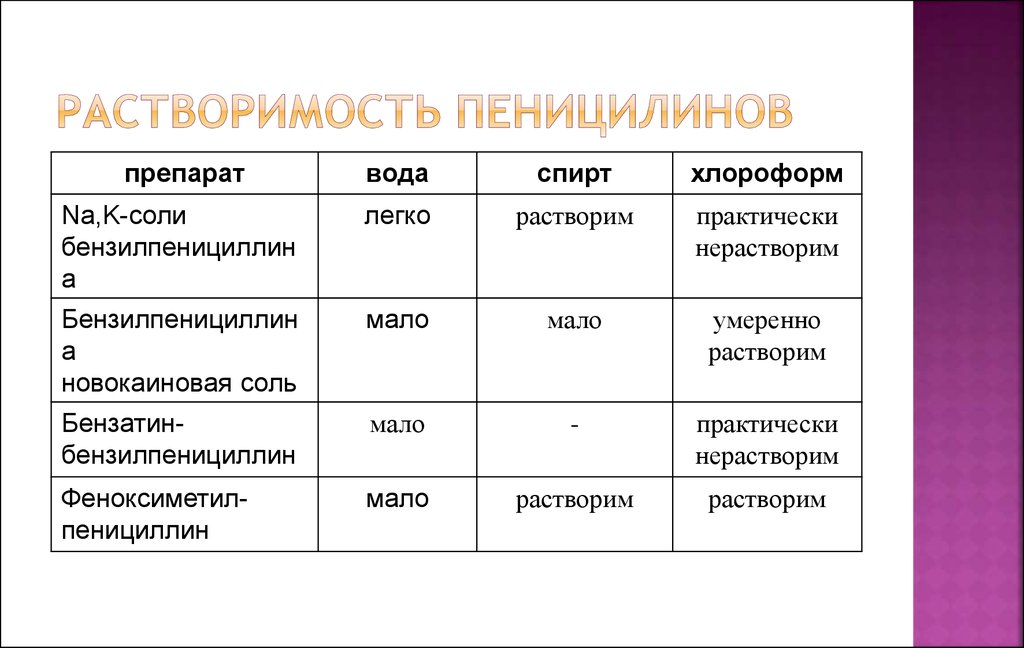
9. Растворимость пеницилинов
препаратвода
спирт
хлороформ
Na,K-соли
бензилпенициллин
а
легко
растворим
практически
нерастворим
Бензилпенициллин
а
новокаиновая соль
мало
мало
умеренно
растворим
Бензатинбензилпенициллин
мало
-
практически
нерастворим
Феноксиметилпенициллин
мало
растворим
растворим
10. Полусинтетические пенициллины
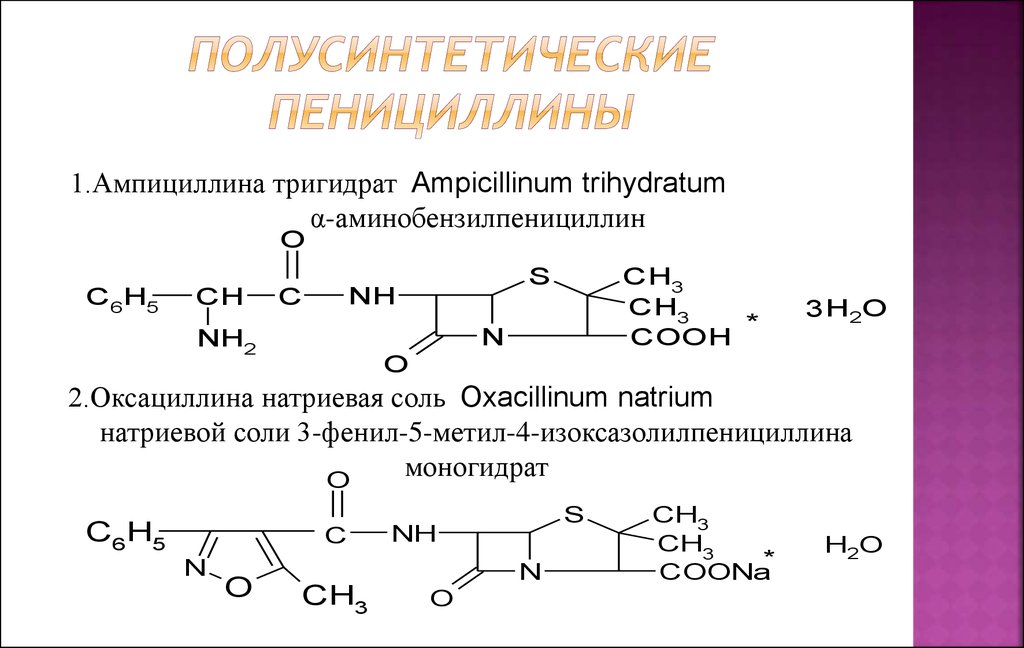
1.Ампициллина тригидрат Ampicillinum trihydratumα-аминобензилпенициллин
O
C6H5
CH
S
NH
C
CH3
CH3
*
COOH
N
NH2
3 H2O
O
2.Оксациллина натриевая соль Oxacillinum natrium
натриевой соли 3-фенил-5-метил-4-изоксазолилпенициллина
моногидрат
O
C6H5
C
N
O
S
NH
N
CH3
O
CH3
CH3
*
COONa
H2O
11. Полусинтетические пенициллины
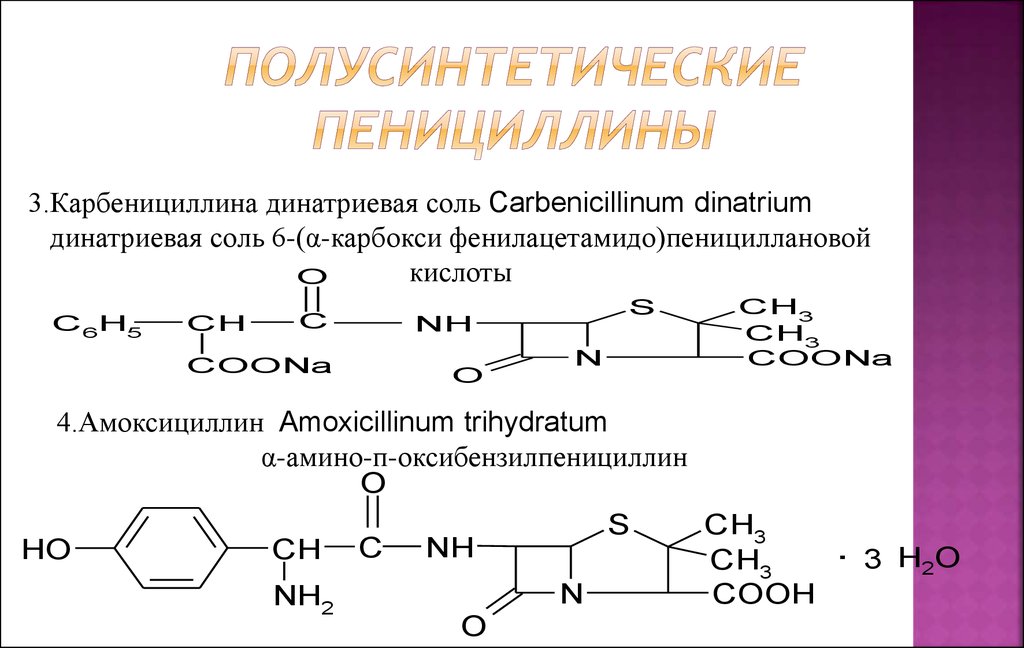
3.Карбенициллина динатриевая соль Carbenicillinum dinatriumдинатриевая соль 6-(α-карбокси фенилацетамидо)пенициллановой
кислоты
O
C6H5
CH
C
COONa
S
NH
O
N
CH3
CH3
COONa
4.Амоксициллин Amoxicillinum trihydratum
α-амино-п-оксибензилпенициллин
O
S
CH3
NH
CH C
HO
CH3
N
COOH
NH2
O
.
3 H2O
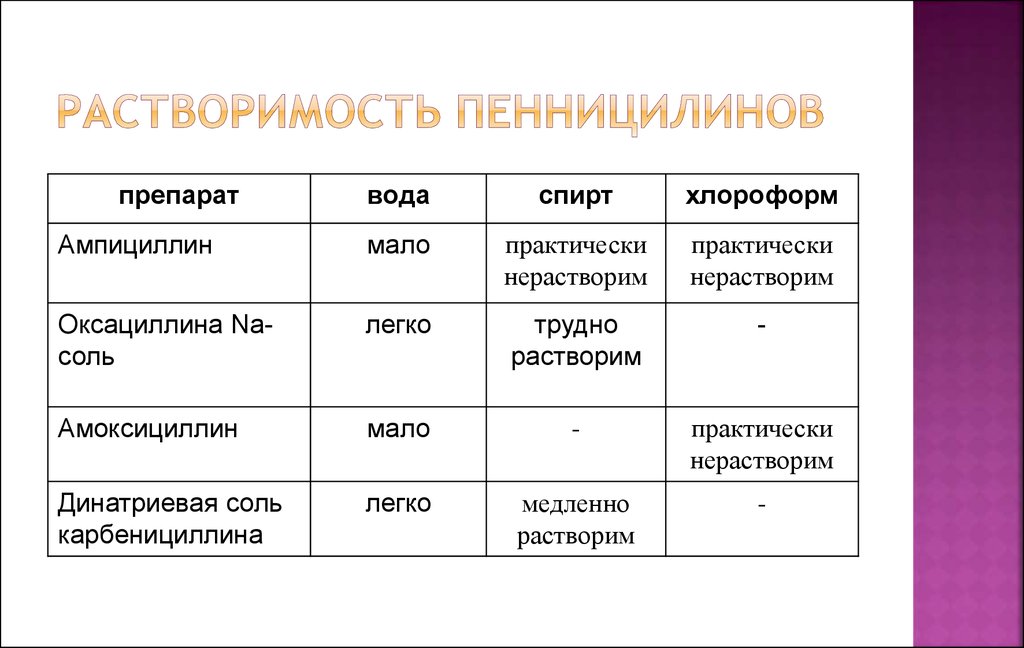
12. Растворимость пенницилинов
препаратвода
спирт
хлороформ
Ампициллин
мало
практически
нерастворим
практически
нерастворим
Оксациллина Naсоль
легко
трудно
растворим
-
Амоксициллин
мало
-
практически
нерастворим
Динатриевая соль
карбенициллина
легко
медленно
растворим
-
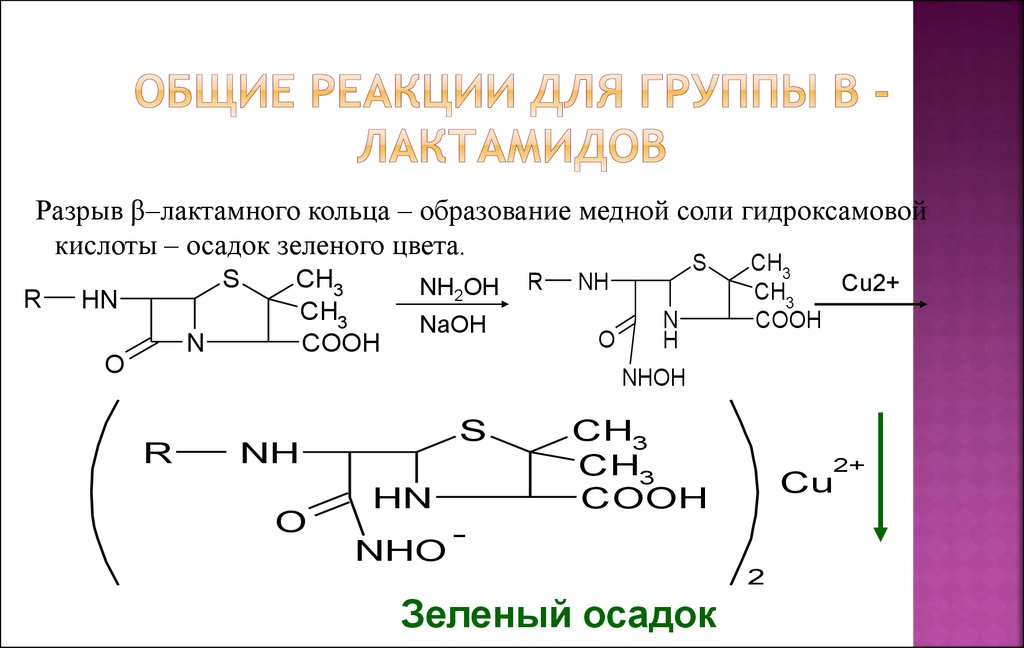
13. Общие реакции для группы β - лактамидов
Разрыв β–лактамного кольца – образование медной соли гидроксамовойкислоты – осадок зеленого цвета.
R
S
HN
N
O
CH3
CH3
COOH
NH2OH
NaOH
R
S
NH
O
N
H
CH3
Cu2+
CH3
COOH
NHOH
R
S
NH
O
HN
NHO
CH3
CH3
COOH
Cu
2
Зеленый осадок
2+
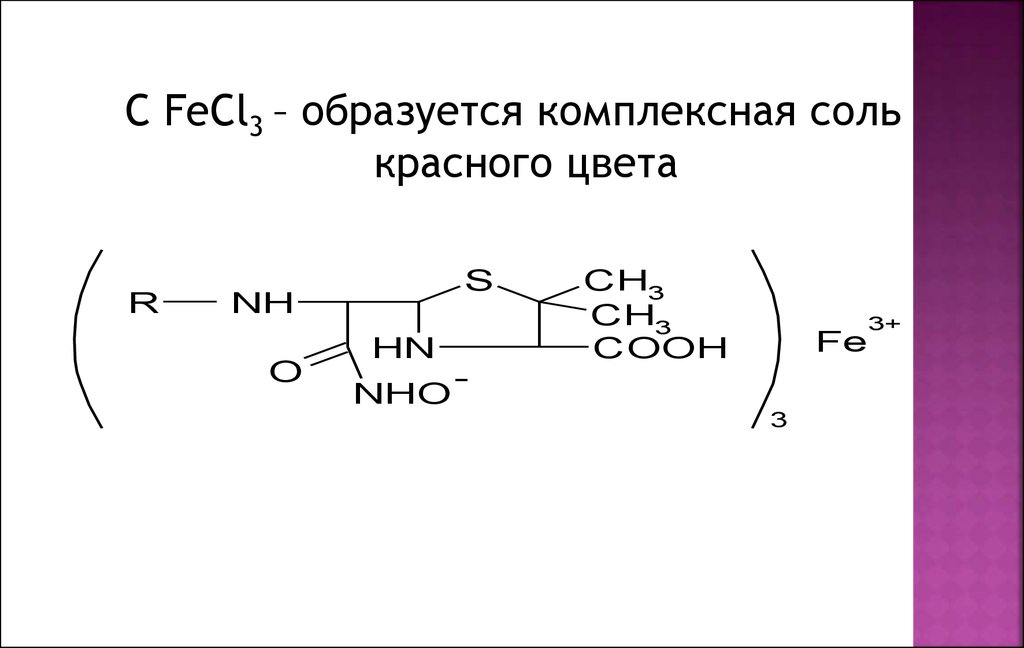
14.
C FeCl3 – образуется комплексная солькрасного цвета
R
S
NH
O
HN
NHO
CH3
CH3
COOH
Fe
3
3+
15. Проба Лассеня для обнаружения N и S
Препарат прокаливают с солями Na, фильтруют:а) к части фильтрата добавляют FeSO4, затем при
подкислении приливают FeCl3. Образуется
синий осадок – берлинская лазурь.
6NaCN + FeSO4 → Na4[Fe(CN)6] + Na2SO4;
3Na4[Fe(CN)6] + 4FeCl3 → Fe4[Fe(CN)6]3 + 12NaCl
б) часть фильтрата нагревают с соляной кислотой,
образуется H2S, который обнаруживается по
почернению бумаги пропитанной Pb(CH3COO)2.
16. Окислительная минерализация
а) сплавление со щелочью с образованиемS2- иона:
S2- + Pb2+ → PbS
или с нитропруссидом Na – краснофиолетовое окрашивание Na4[Fe(CN)5NOS]
б) минерализация в концентрированной
азотной кислоте (HNO3) до сульфат – иона:
SO42- + Ba2+ → BaSO4 ↓
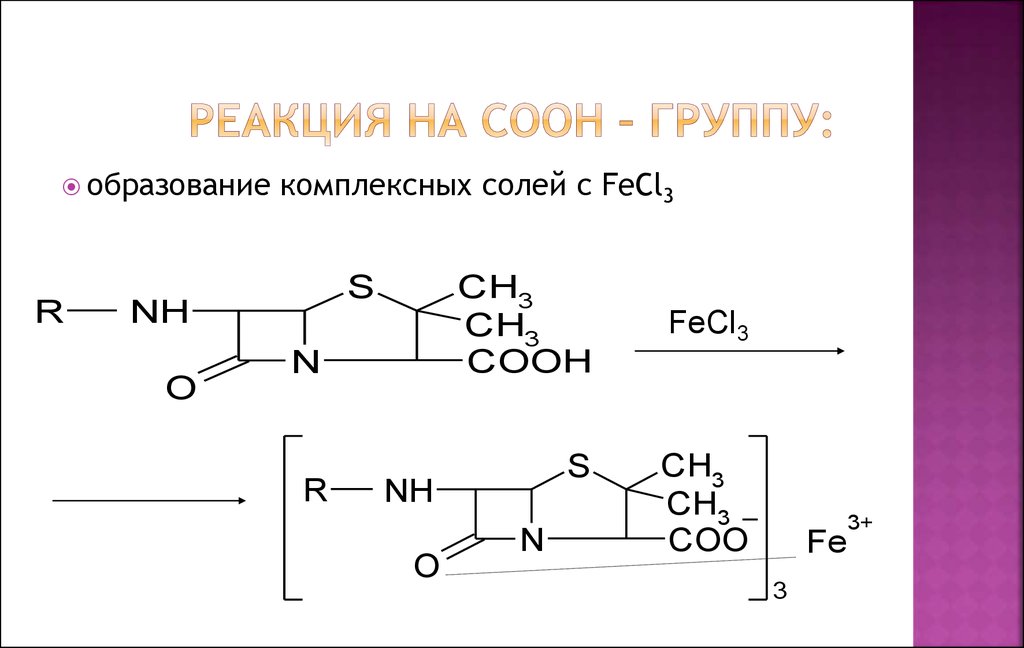
17. Реакция на СООН – группу:
образованиеR
комплексных солей с FeCl3
NH
O
CH3
CH3
COOH
S
N
R
S
NH
O
N
FeCl3
CH3
CH3
COO
Fe
3
3+
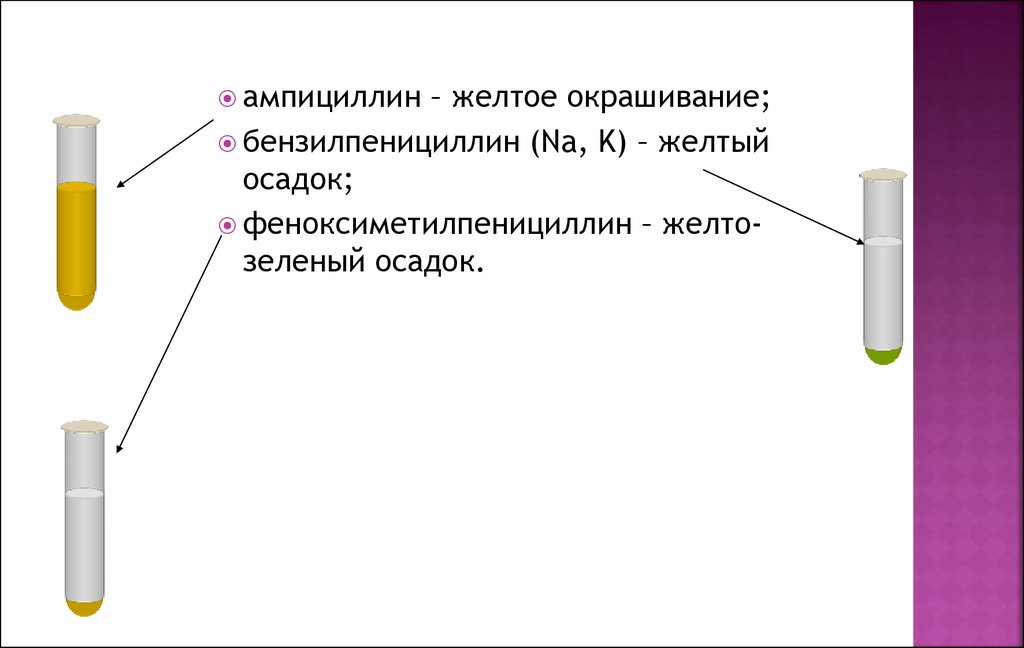
18.
ампициллин– желтое окрашивание;
бензилпенициллин (Na, K) – желтый
осадок;
феноксиметилпенициллин – желтозеленый осадок.
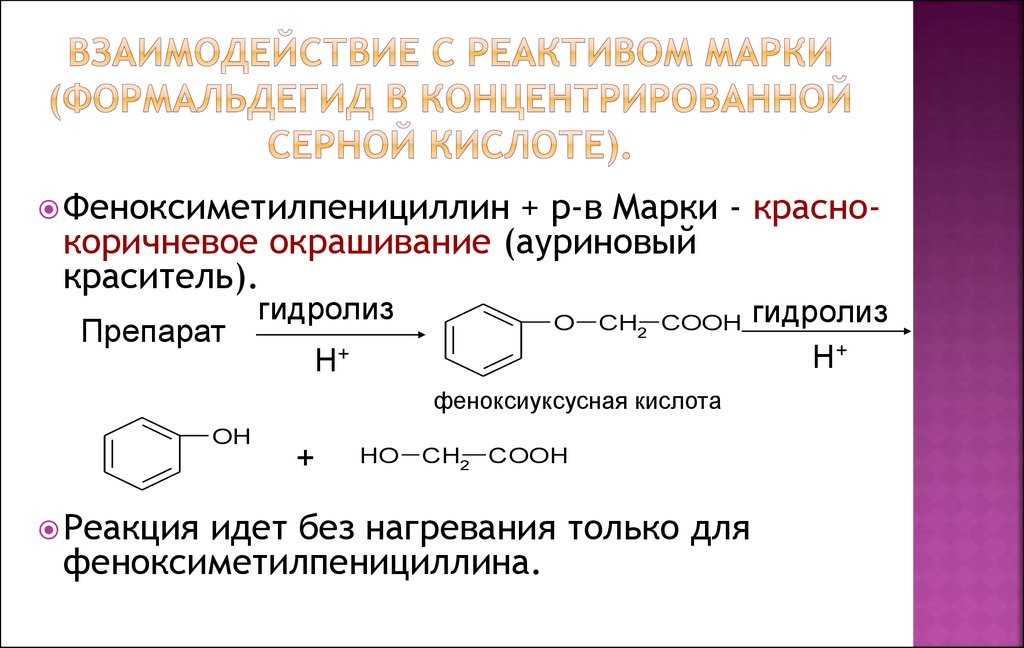
19. Взаимодействие с реактивом Марки (формальдегид в концентрированной серной кислоте).
Феноксиметилпенициллин+ р-в Марки - краснокоричневое окрашивание (ауриновый
краситель).
Препарат
гидролиз
O
CH2 COOH
H+
феноксиуксусная кислота
OH
Реакция
+
HO
CH2 COOH
идет без нагревания только для
феноксиметилпенициллина.
гидролиз
H+
20. Взаимодействие с реактивом Марки (формальдегид в концентрированной серной кислоте).
Солибензилпенициллина + р-в Марки - краснокоричневое окрашивание
Ампициллин + р-в Марки - темно-желтое
окрашивание
Амоксициллин + р-в Марки - темно-желтое
окрашивание
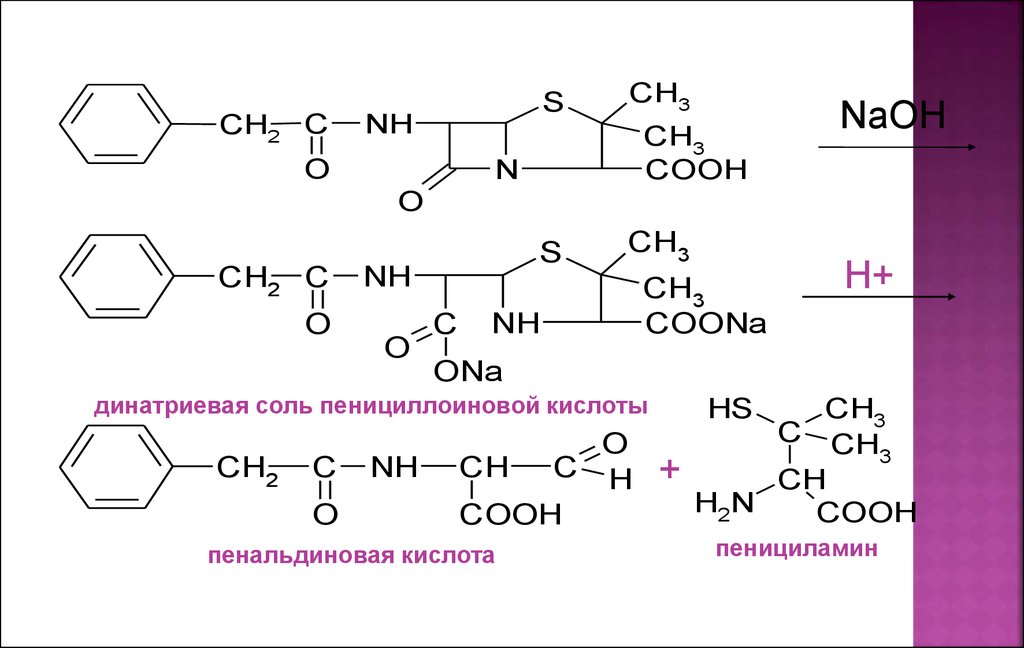
21. Количественное определение
Состоитиз двух этапов: определение
суммы пенициллинов и определение
соответствующего препарата.
1. Обратная йодометрия (ГФХ)
продукты последовательного щелочного,
а
затем кислотного гидролиза
окисляют избытком стандартного
раствора йода J2 при рН 4,5
22.
CH2 CS
NH
O
CH3
CH3
COOH
N
NaOH
O
CH2 C
O
S
NH
O
C
CH3
NH
CH3
COONa
ONa
динатриевая соль пенициллоиновой кислоты
CH2
C
O
NH
H+
O
CH
C H
COOH
пенальдиновая кислота
CH3
C CH
3
CH
H2N
COOH
HS
+
пенициламин
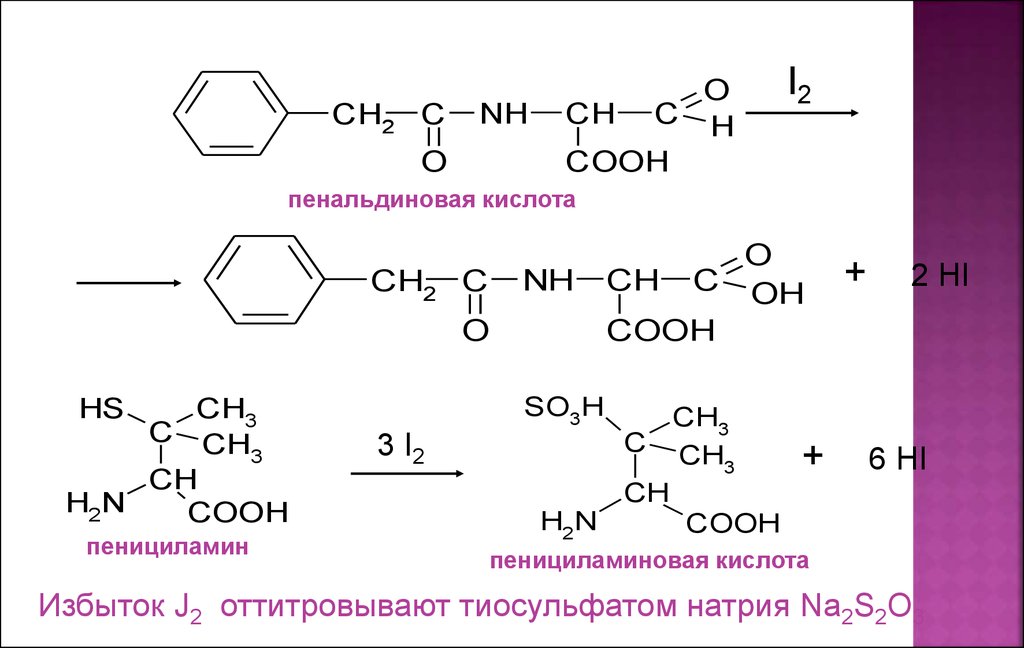
23.
CH2 CNH
O
O
CH C H
COOH
I2
пенальдиновая кислота
NH
CH2 C
O
CH3
C CH
3
CH
H2N
COOH
+
2 HI
SO3H
HS
пенициламин
O
CH C OH
COOH
3 I2
CH3
C CH
3
CH
H2N
COOH
+
6 HI
пенициламиновая кислота
Избыток J2 оттитровывают тиосульфатом натрия Na2S2O3
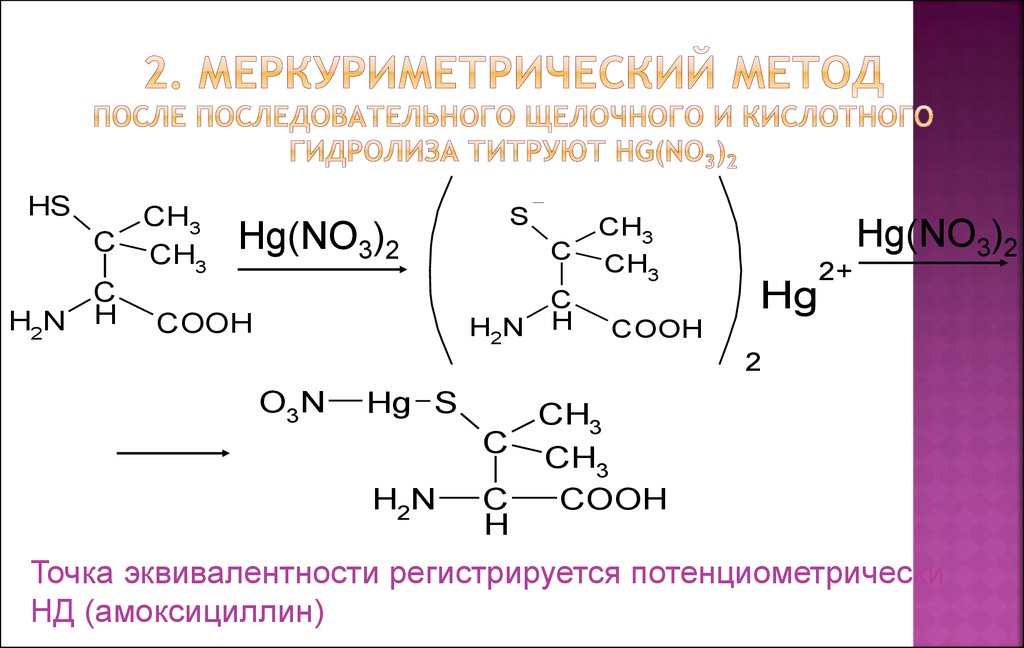
24. 2. Меркуриметрический метод после последовательного щелочного и кислотного гидролиза титруют Hg(NO3)2
HSH2N
CH3
Hg(NO3)2
C CH
3
C
H COOH
S
H2N
CH3
C CH
3
C
H COOH
2+
Hg(NO3)2
Hg
2
O3N
Hg S
H2N
CH3
C CH
3
C
COOH
H
Точка эквивалентности регистрируется потенциометрически
НД (амоксициллин)
25.
Применение:препараты.
антибактериальные
Совместимость:
пенициллины нельзя
объединять с аминогликозидами в
одном шприце, т.к. образующиеся
пенициллоиновые кислоты дают соли с
основными аминогликозидами
Хранение:
в сухом месте при
комнатной температуре, флаконы.
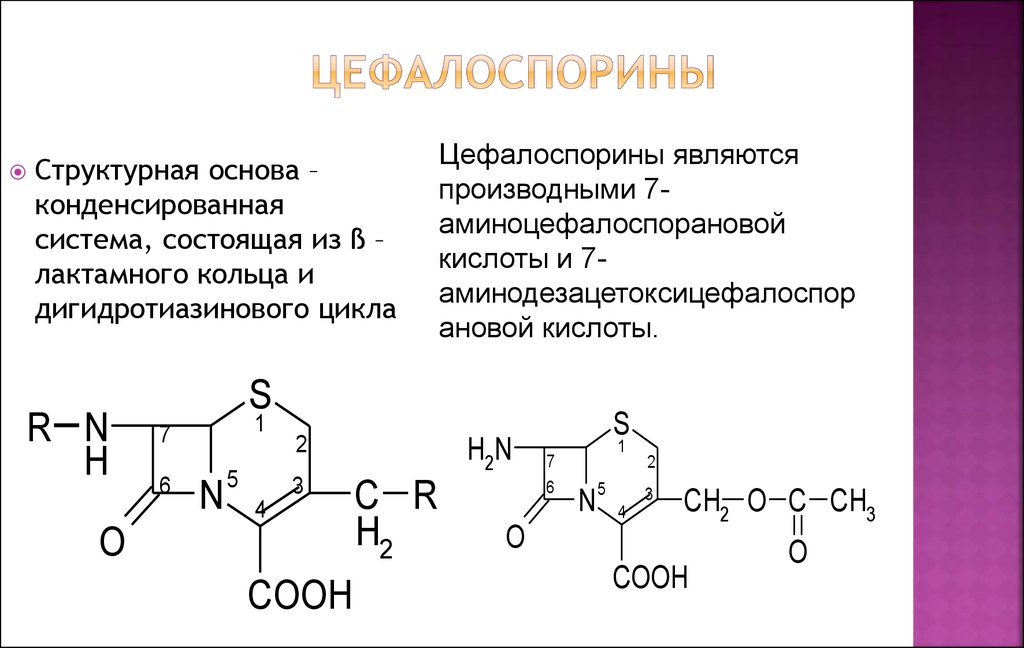
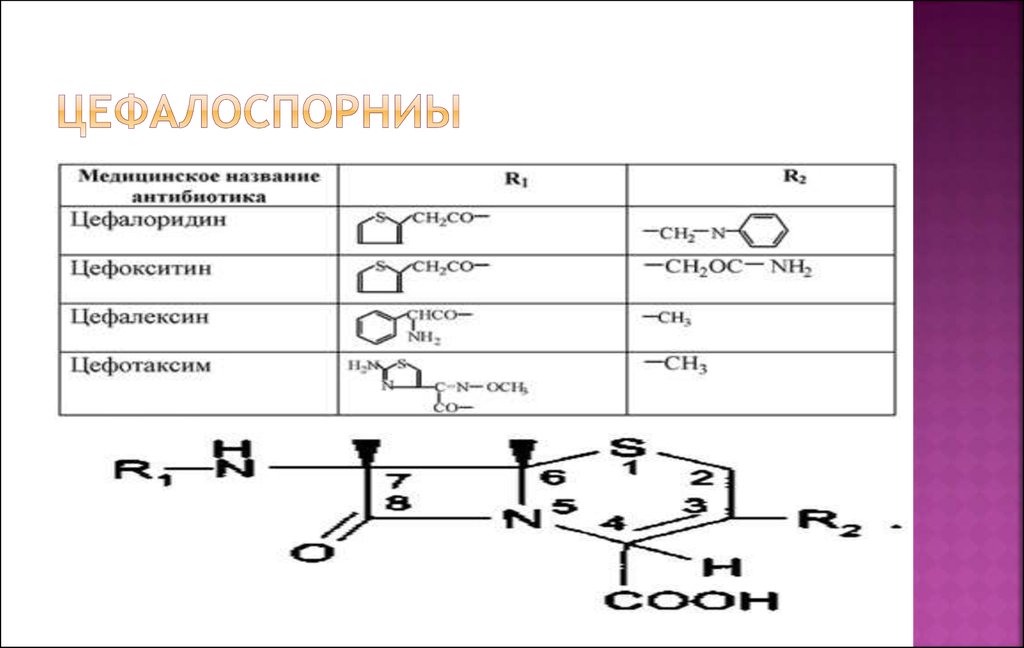
26. Цефалоспорины
Структурная основа –конденсированная
система, состоящая из ß –
лактамного кольца и
дигидротиазинового цикла
R N
H
Цефалоспорины являются
производными 7аминоцефалоспорановой
кислоты и 7аминодезацетоксицефалоспор
ановой кислоты.
S
1
7
6
N
5
2
3
4
O
COOH
H2N
C R
H2
O
S
7
6
1
N
5
2
3
4
CH2 O C CH3
COOH
O
27.
Описание: белые кристаллическиепорошки, практически не
растворимы в хлороформе и эфире.
Цефалотина натриевая соль – легко
растворима в воде, мало растворим
в этаноле. Цефалотин – трудно
растворим в воде, практически не
растворим в этаноле. Цефалексин –
амфотерен (-NH2, -СООН).
Хранение: в хорошо укупоренной
таре.
Применение: антибактериальные
(грамположительные и
грамотрицательные
микроорганизмы).
28. Получение
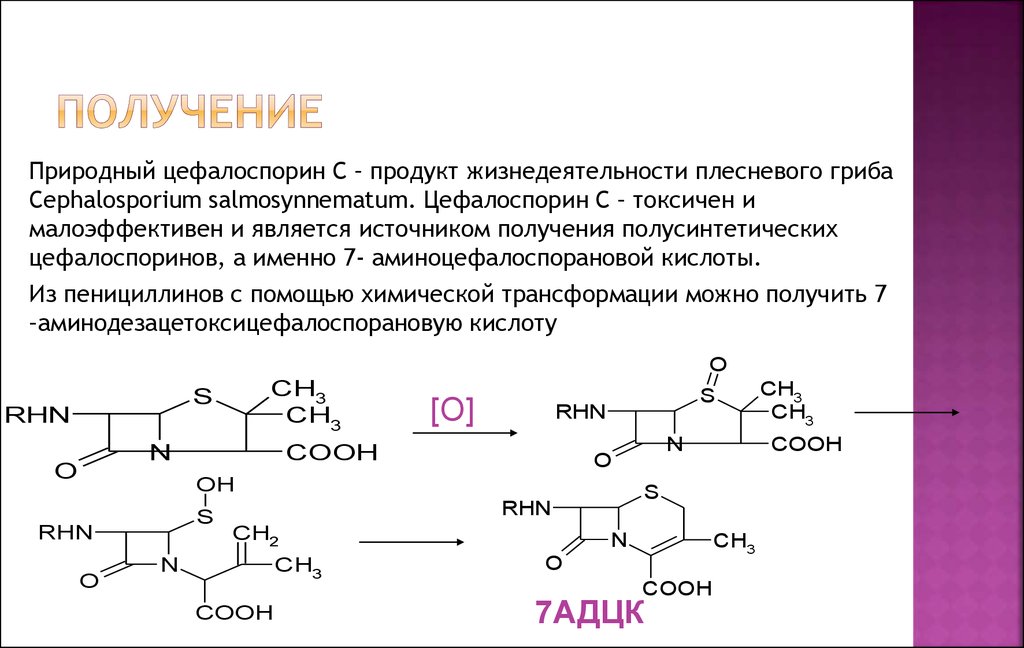
Природный цефалоспорин С – продукт жизнедеятельности плесневого грибаCephalosporium salmosynnematum. Цефалоспорин С – токсичен и
малоэффективен и является источником получения полусинтетических
цефалоспоринов, а именно 7- аминоцефалоспорановой кислоты.
Из пенициллинов с помощью химической трансформации можно получить 7
–аминодезацетоксицефалоспорановую кислоту
O
CH3
CH3
S
RHN
N
O
[O]
S
RHN
COOH
O
OH
S
RHN
O
CH2
CH3
N
CH3
O
COOH
COOH
COOH
S
RHN
N
N
7АДЦК
CH3
CH3
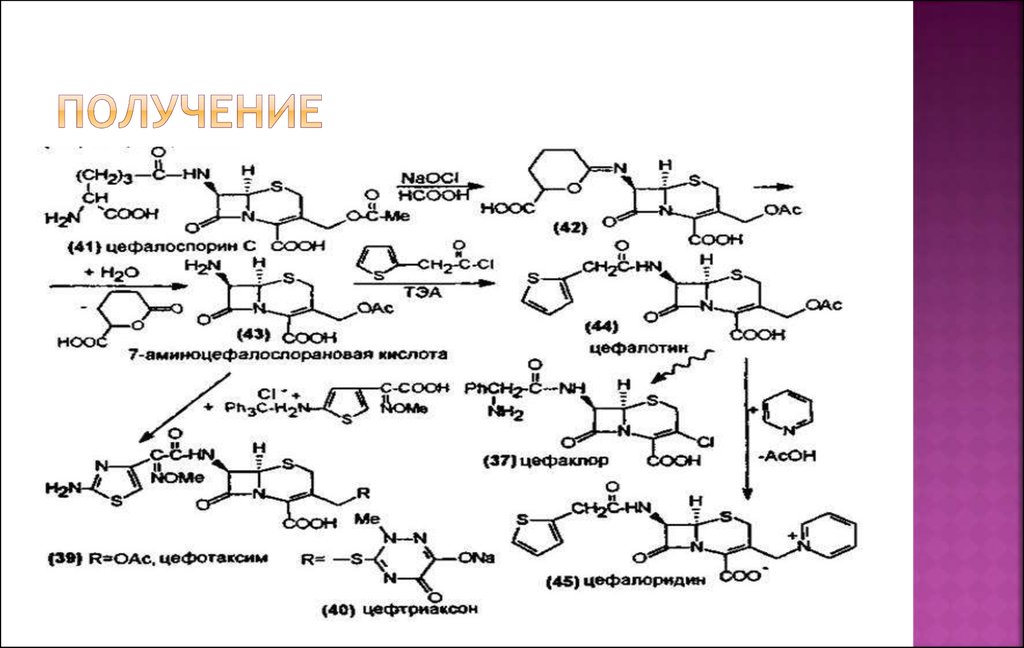
29. Получение
Антибиотики цефалоспориновой группы син-тезируются наоснове цефалоспорина С , получаемого ферментативным
путем. В отличие от пенициллинов, в основном ядре которых
допускается варьирование заместителей только по одному
положению (6-аминогруппе), в случае цефалоспоринов
возможны химические вариации как по 7-аминогруппе, так и
по положению С-3, что позволяет синтезировать значительно
более разнообразный арсенал лекарственных веществ.
Цефалоспорин С окисляют в системе NaOCl/HCOOH до
иминолактона, который затем гидролизуют в 7аминоцефалоспорановую кислоту. Эта кислота в свободном
виде не может быть получена ферментативно, в отличие от
аминопенициллановой кислоты , которую легко производят
при ферментации в отсутствие ацилирующих ее карбоновых
кислот. Далее проводят N-ацилирование аминокислоты и
модификацию ацетилоксиметильной группы в положении 3,
получая различные антибиотики:
30. Получение
31. Цефалоспорниы
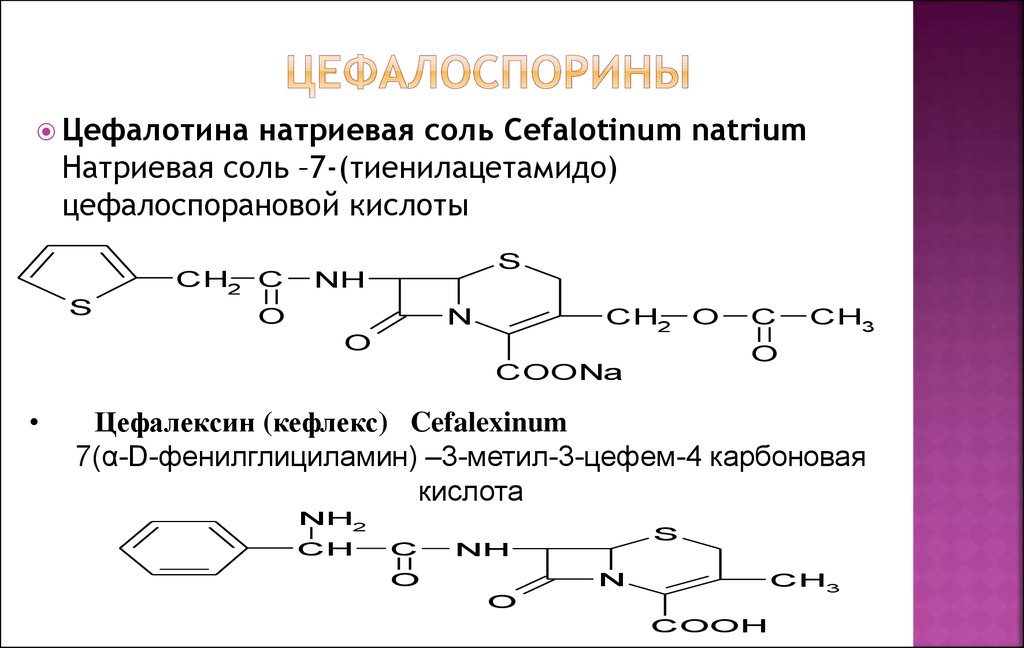
32. Цефалоспорины
Цефалотинанатриевая соль Cefalotinum natrium
Натриевая соль –7-(тиенилацетамидо)
цефалоспорановой кислоты
CH2 C
S
S
NH
O
N
CH2 O
O
CH3
O
COONa
C
Цефалексин (кефлекс) Cefalexinum
7(α-D-фенилглициламин) –3-метил-3-цефем-4 карбоновая
кислота
NH2
CH
C
S
NH
O
N
CH3
O
COOH
33.
1.Цефалексин - на аминокислоту:нингидриновая проба и реакция
комплексообразования с ионами Cu2+ в
среде уксусной кислоты - после
прибавления гидроксида натрия
образуется оливково-зеленое
окрашивание.
2. Со смесью 80% H2SO4 и 1% HNO3:
цефалексин – желтое окрашивание;
цефалотина натриевая соль – оливковозеленое окрашивание.
34. Количественное определение:
1. Обратная йодометрия2. Меркуриметрия.
3. Цефалоспорин – неводное титрование:
растворитель – смесь муравьиной и ледяной
уксусной кислот и ацетона;
титрант – диоксановый раствор HClO4;
точка эквивалентности регистрируется
потенциометрически.
4. СФМ.
5. ВЭЖХ.










 chemistry
chemistry








