Similar presentations:
Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины)
1.
Бета-лактамиды(природные и
полусинтетические
пенициллины и
цефалоспорины)
2. Цель лекции:
Изучить физико-химические ифармакологические свойства,
методы оценки качества
лекарственных средств
указанной группы во
взаимосвязи со структурой.
3. План лекции:
План излагаемой лекциисоответствует всем разделам
фармакопейной статьи.
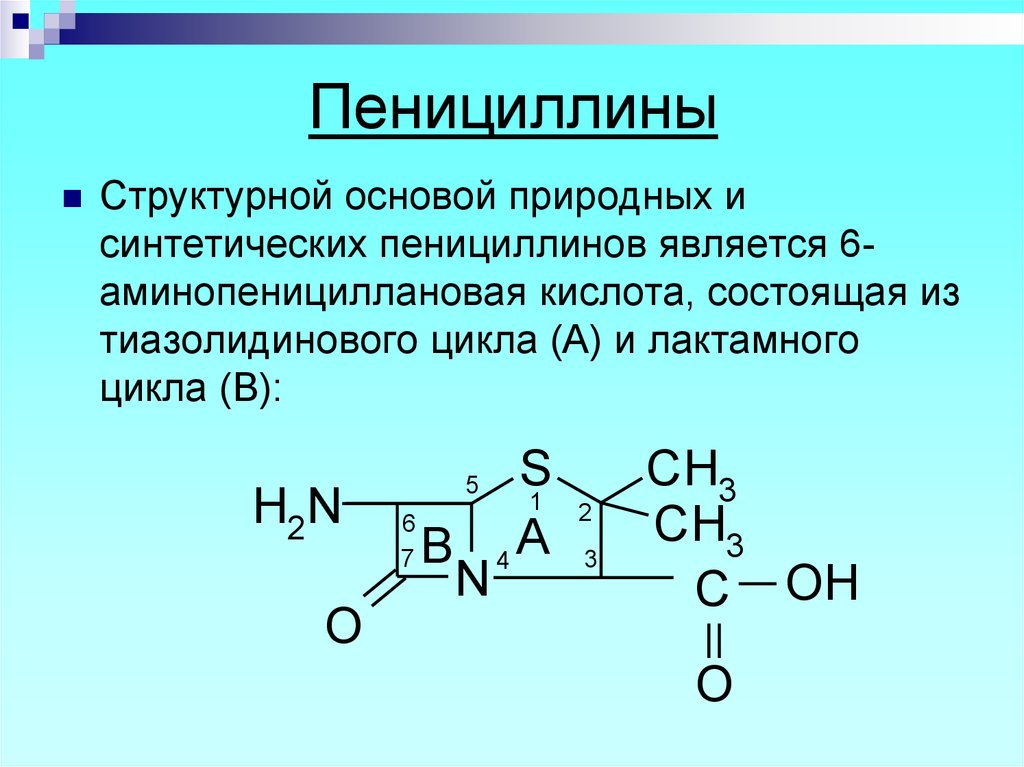
4. Пенициллины
Структурной основой природных исинтетических пенициллинов является 6аминопенициллановая кислота, состоящая из
тиазолидинового цикла (А) и лактамного
цикла (В):
H2N
O
S
1
6
A
7B
4
N
5
2
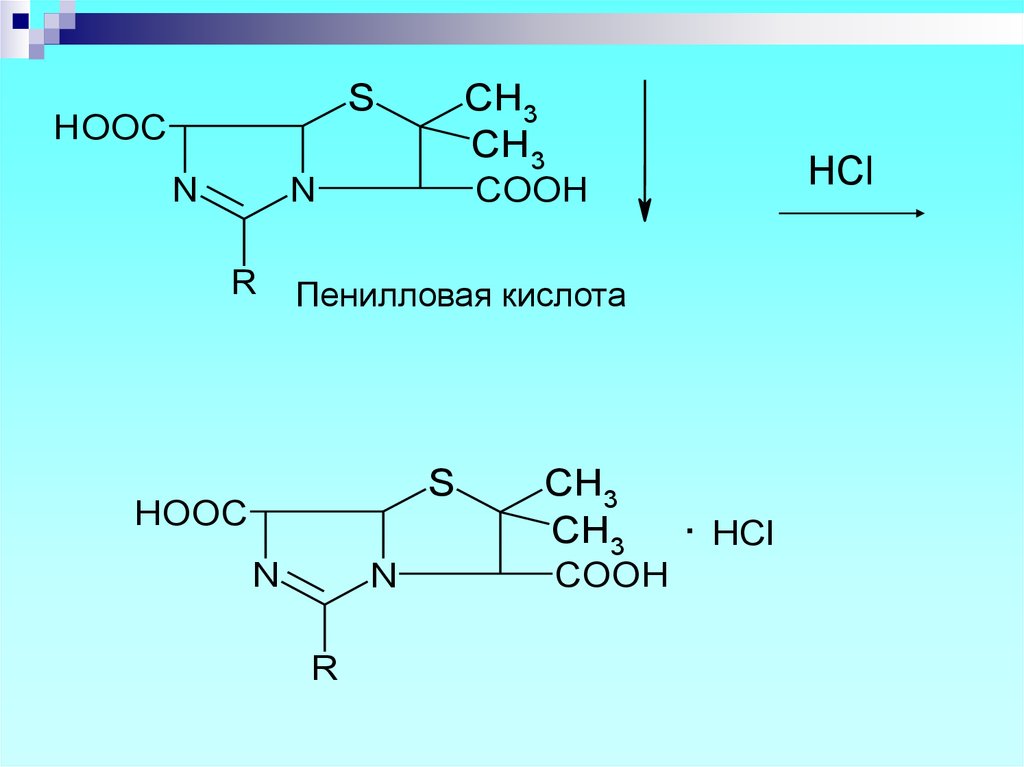
3
CH3
CH3
C OH
O
5.
Специфическая биологическаяактивность обусловлена наличием
тиазолидинового и лактамного колец, а
также заместителем в 6-ом положении.
Биосинтез природных пенициллинов
осуществляется отобранными
промышленными штаммами плесени,
инкубированными в питательной среде,
содержащей аминокислоты, углеводы,
жиры и обязательно предшественников
для формирования радикала в 6-ом
положении.
6.
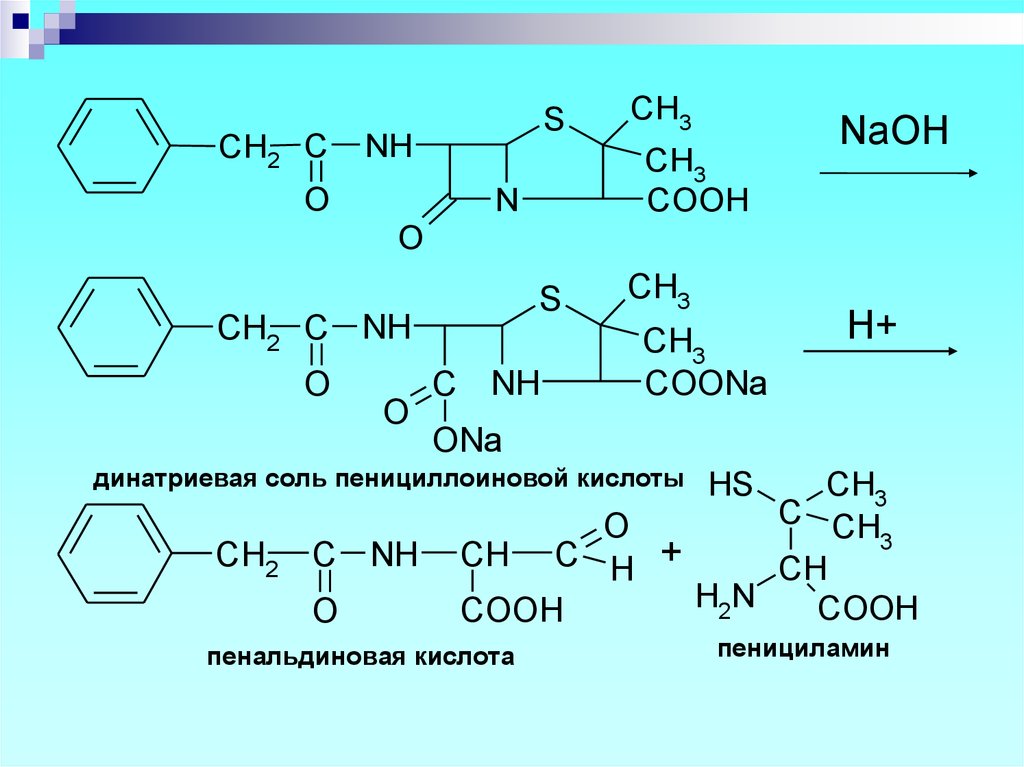
Для выделения и очистки пенициллиновиспользуют хроматографию,
ионообменную сорбцию.
Природные пенициллины имеют
серьезный недостаток – они легко
разрушаются под действием фермента
пенициллиназы (β-лактамазы). Это
послужило предпосылкой для синтеза
полусинтетических пенициллинов на
основе 6-амино-пенициллановой кислоты
(6-АПК), которую чаще всего ацилируют по
аминогруппе в 6-ом положении.
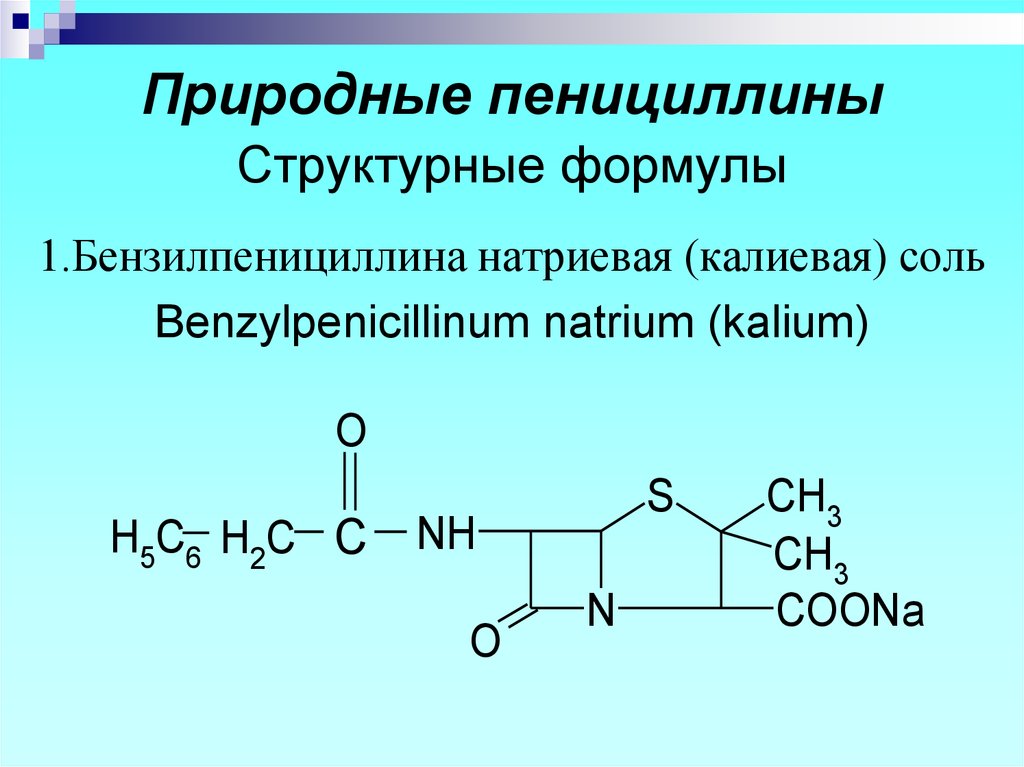
7. Природные пенициллины Структурные формулы
1.Бензилпенициллина натриевая (калиевая) сольBenzylpenicillinum natrium (kalium)
O
H5 C6 H2 C C
S
NH
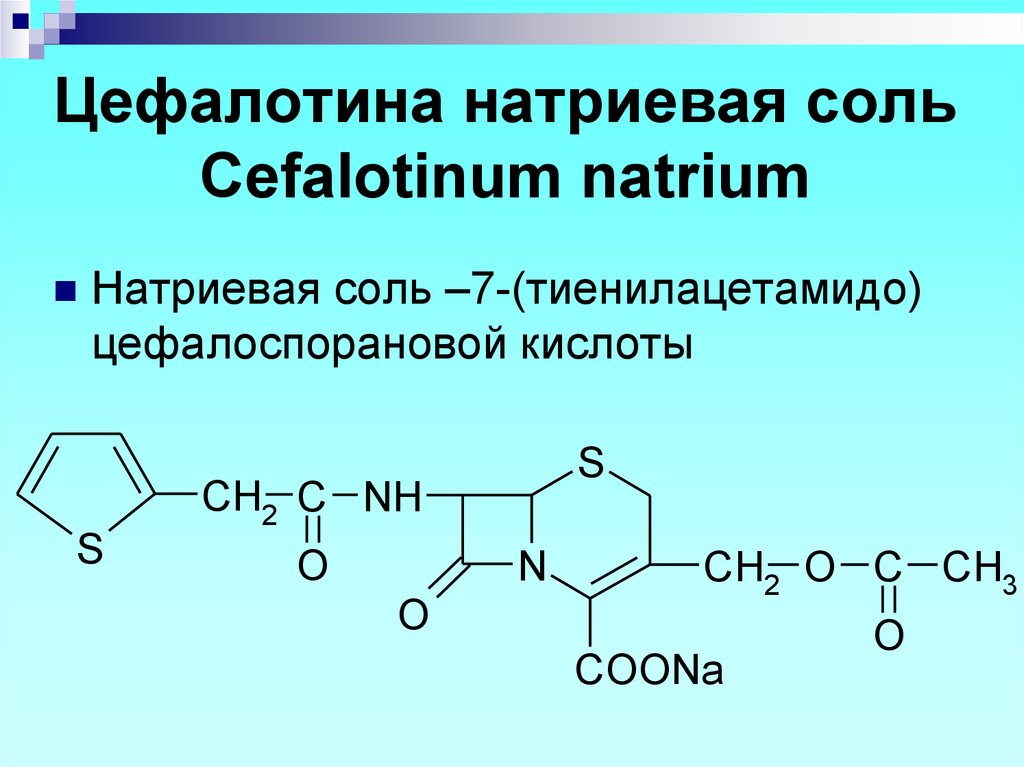
O
N
CH3
CH3
COONa
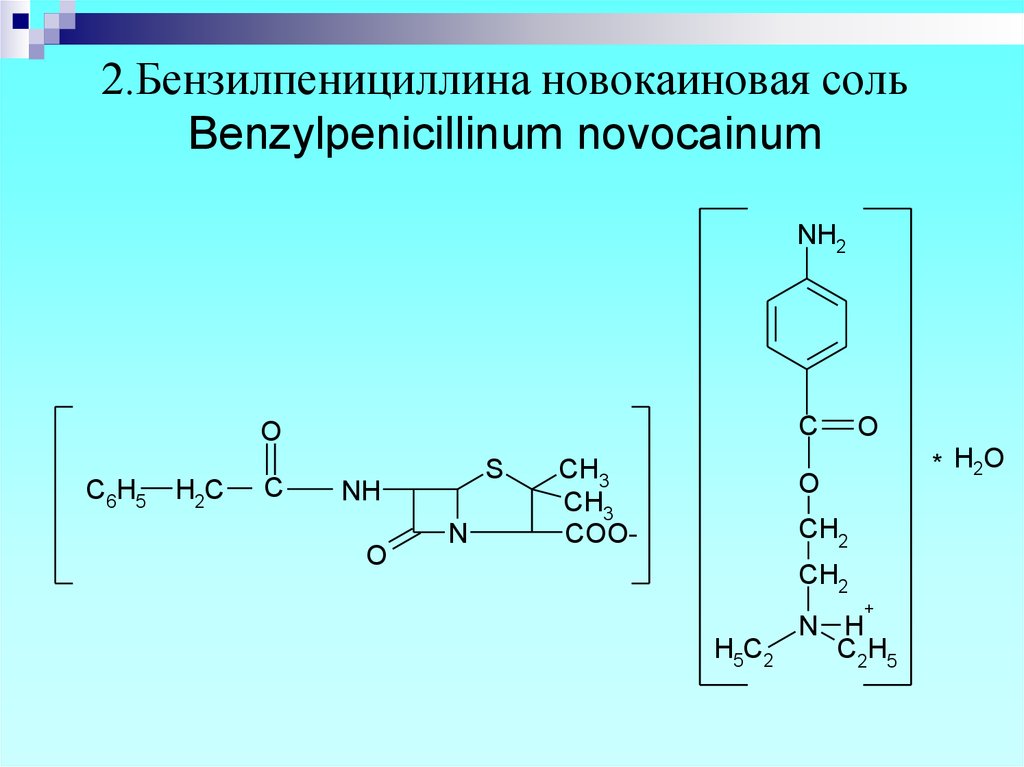
8. 2.Бензилпенициллина новокаиновая соль Benzylpenicillinum novocainum
NH2C
O
C6H5
H2C
C
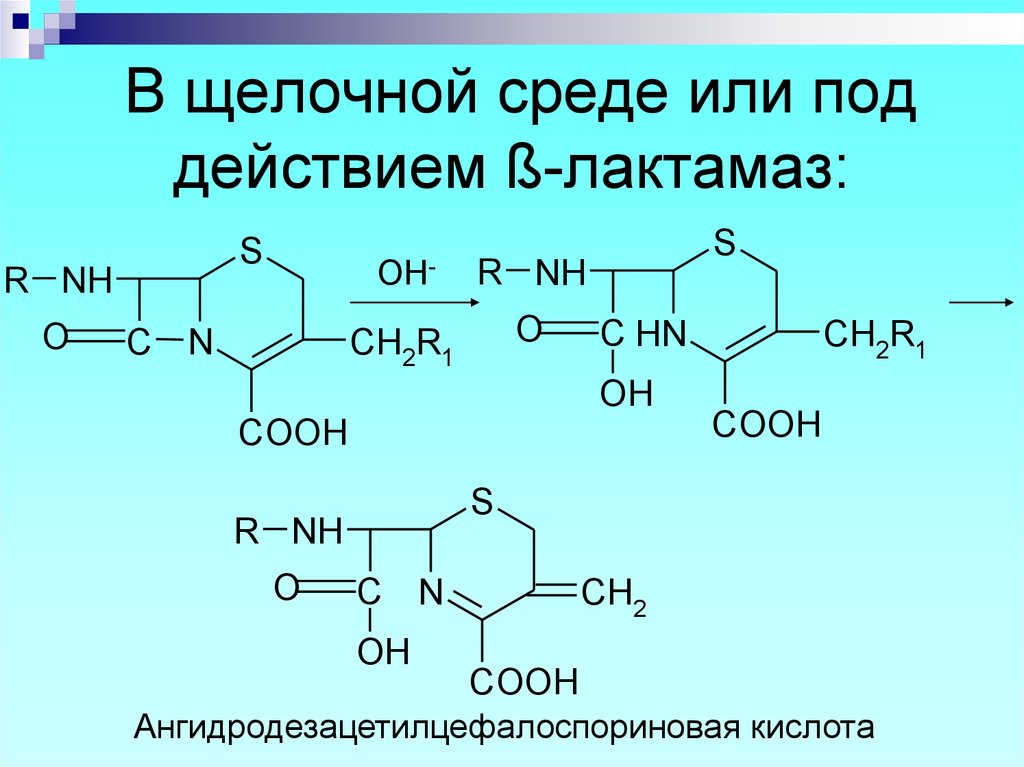
S
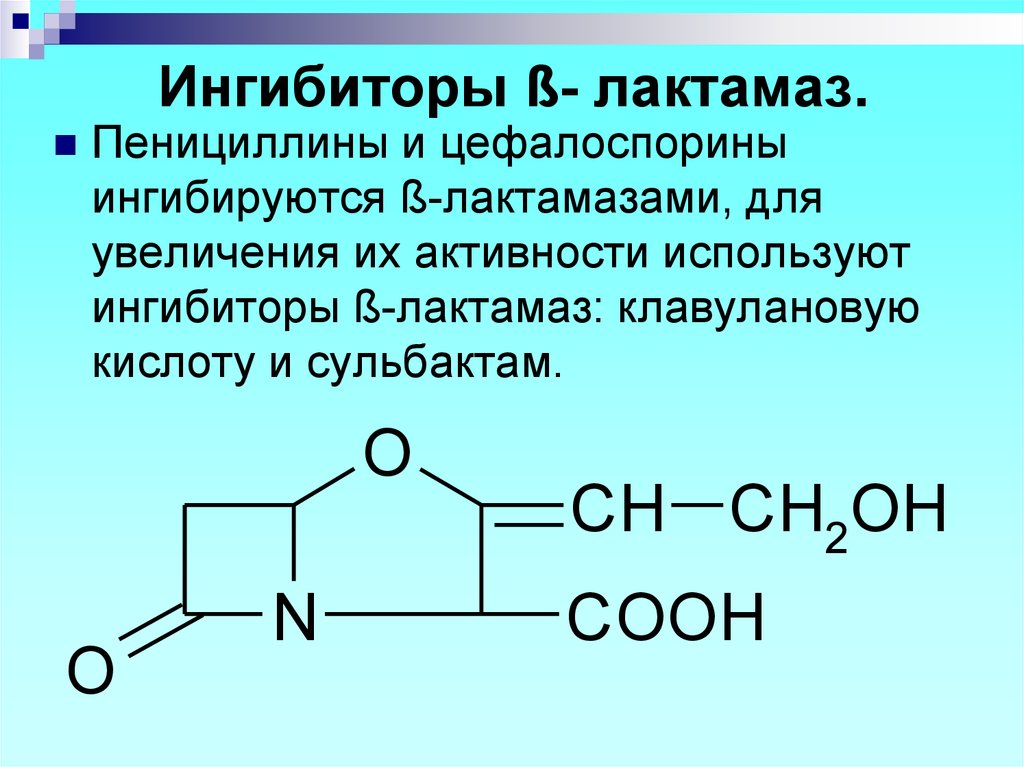
NH
O
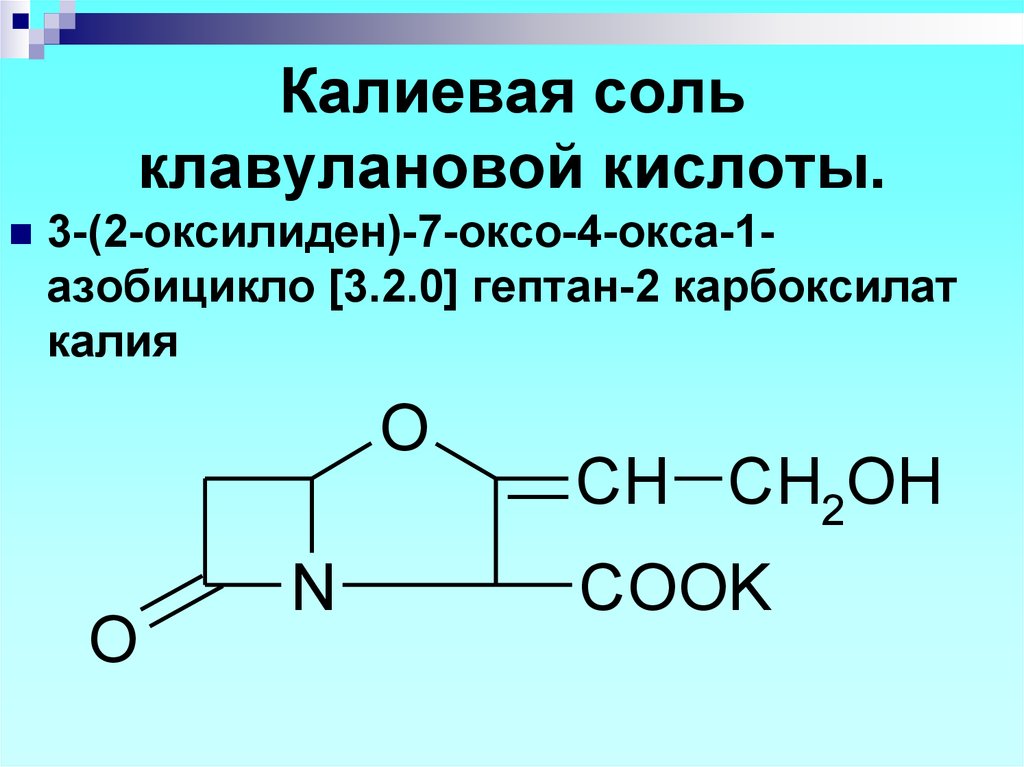
N
CH3
CH3
COO-
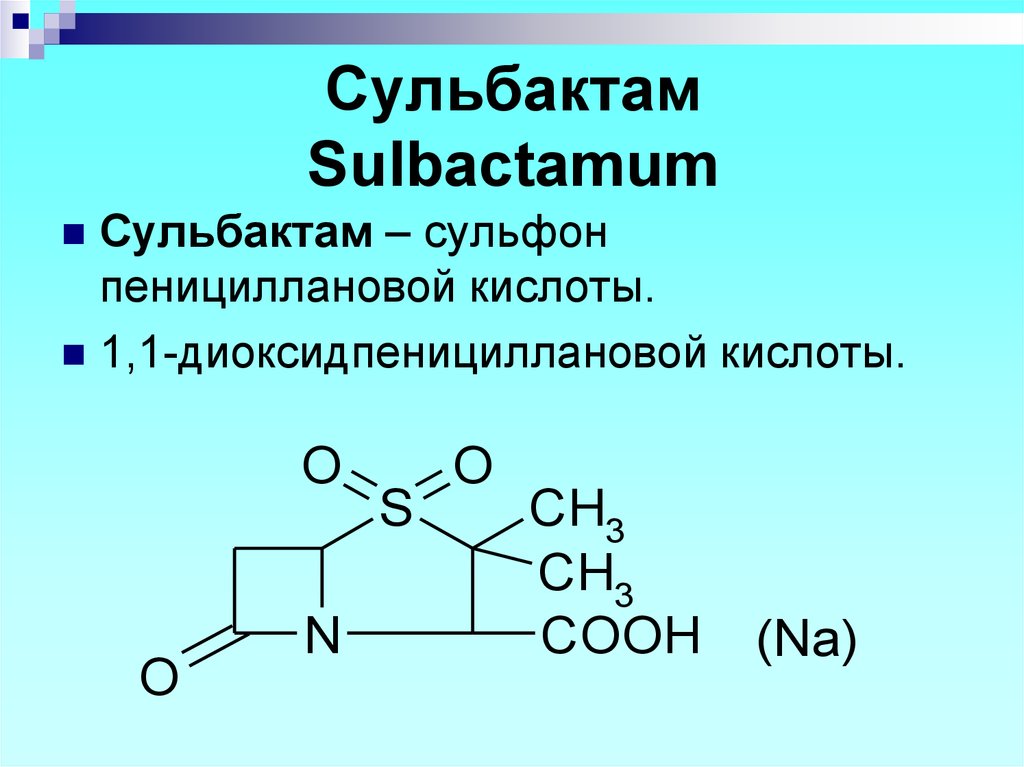
O
* H2O
O
CH2
CH2
+
H5C2
N H
C2H5
9. 3.Бензатин-бензилпенициллин Benzathinum Benzylpenicillinum
CH2O
CH2 C
+
HN H
S
NH
N
O
CH3
CH3
COO
*
CH2
CH2
+
2
HN H
CH2
N,N’ - дибензилэтилендиаминовая
соль бензилпенициллина
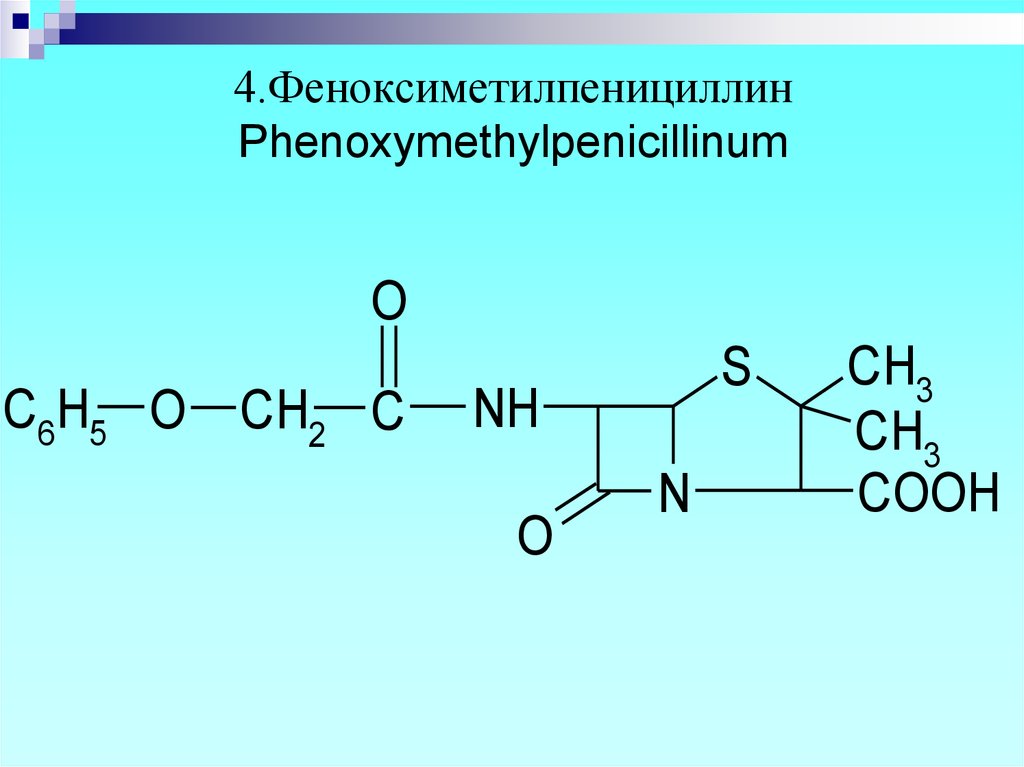
10. 4.Феноксиметилпенициллин Phenoxymethylpenicillinum
OC6H5 O CH2 C
S
NH
O
N
CH3
CH3
COOH
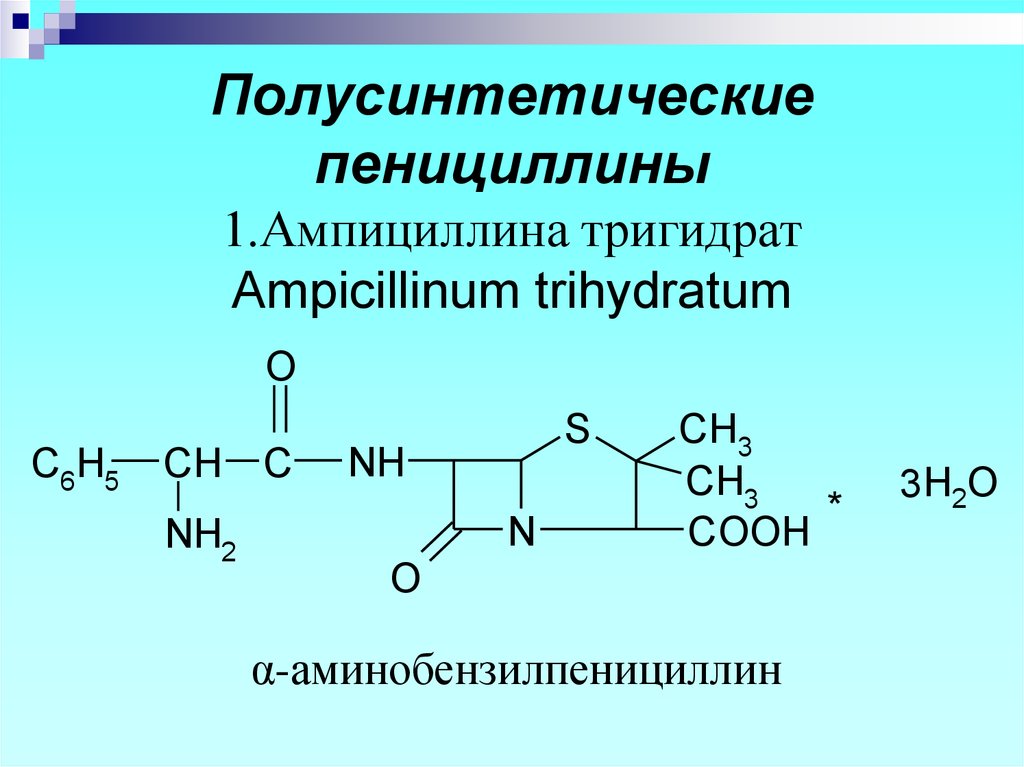
11. Полусинтетические пенициллины 1.Ампициллина тригидрат Ampicillinum trihydratum
OC6H5
CH C
NH2
S
NH
N
CH3
CH3
*
COOH
O
α-аминобензилпенициллин
3 H2O
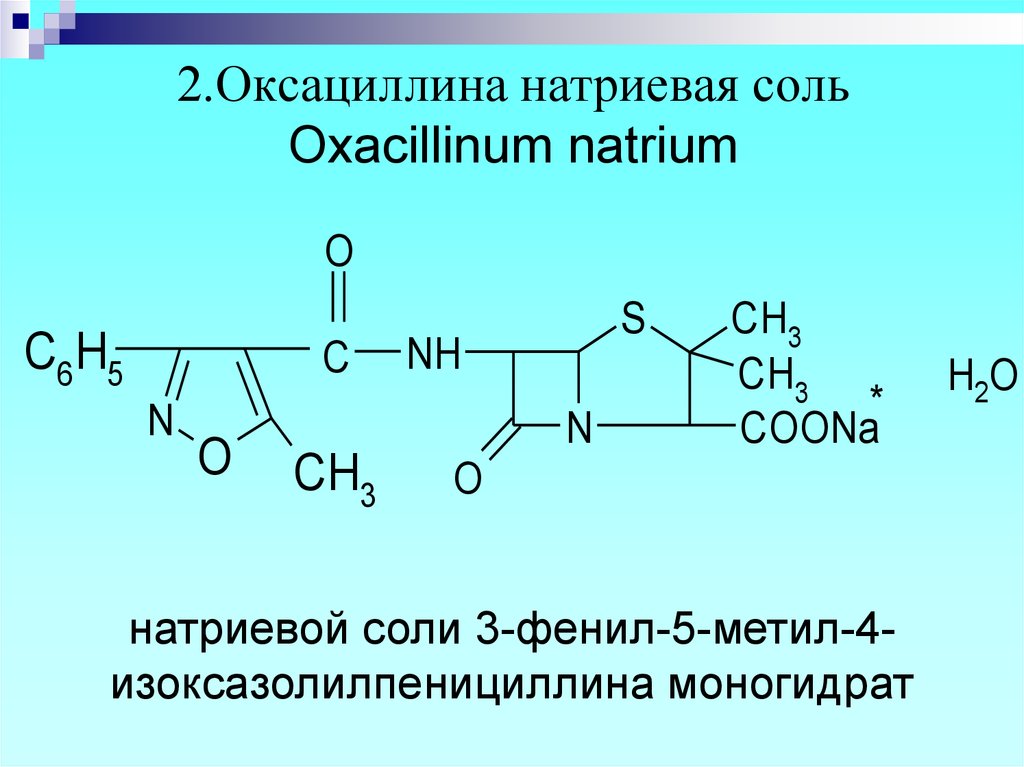
12. 2.Оксациллина натриевая соль Oxacillinum natrium
OC6H5
C
N
O
S
NH
N
CH3
CH3
CH3
*
COONa
O
натриевой соли 3-фенил-5-метил-4изоксазолилпенициллина моногидрат
H2O
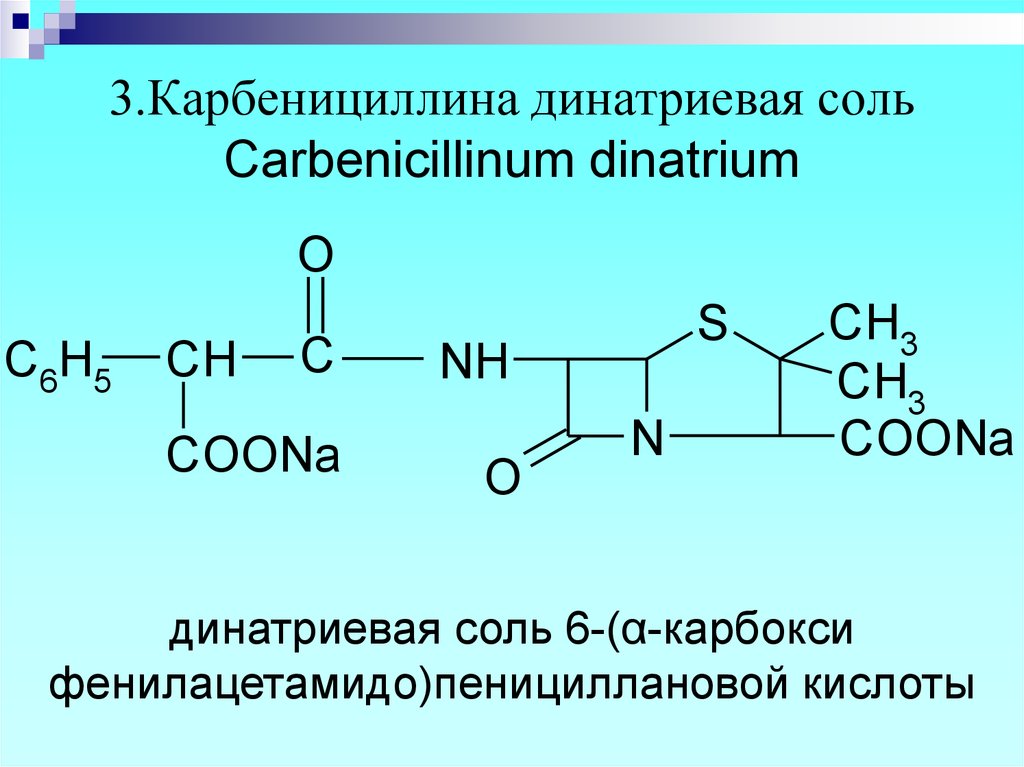
13. 3.Карбенициллина динатриевая соль Carbenicillinum dinatrium
OC6H5
CH
C
COONa
S
NH
O
N
CH3
CH3
COONa
динатриевая соль 6-(α-карбокси
фенилацетамидо)пенициллановой кислоты
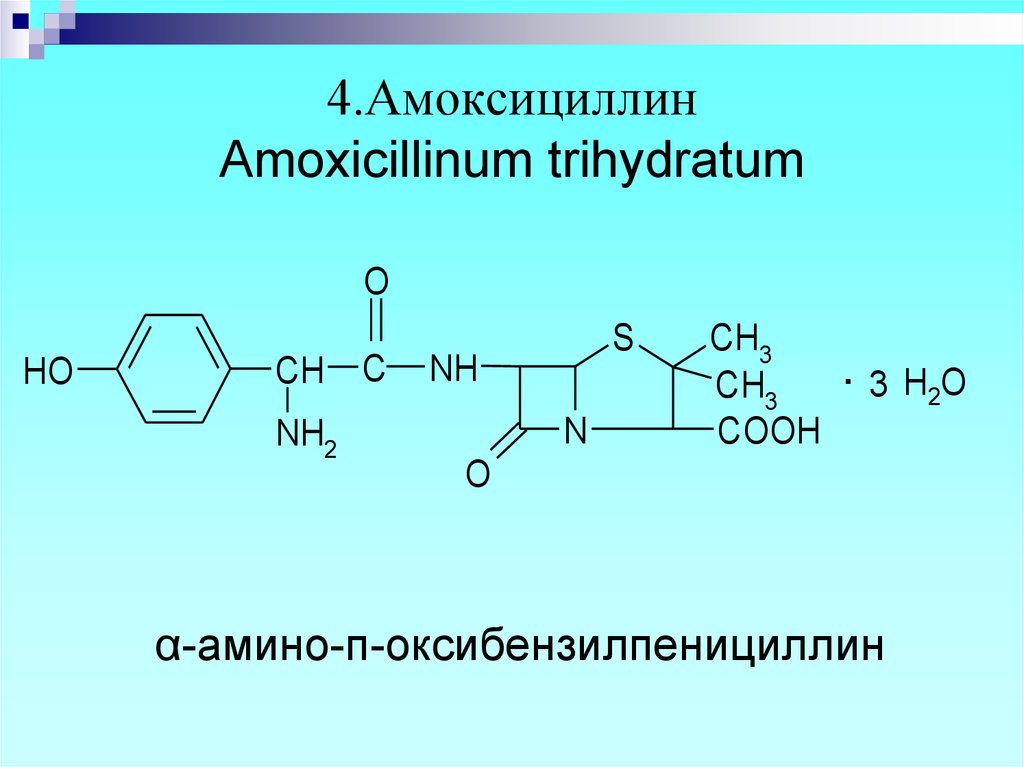
14. 4.Амоксициллин Amoxicillinum trihydratum
OHO
CH C
NH2
S
NH
N
CH3
CH3
COOH
. 3 H2O
O
α-амино-п-оксибензилпенициллин
15. Физические свойства
Препараты – белые кристаллическиепорошки, без запаха. Натриевые и
калиевые соли слегка гигроскопичны,
карбенициллина динатриевая соль –
гигроскопична.
16. Растворимость пенициллинов
препаратвода
спирт
хлороформ
Na,K-соли
бензилпенициллина
легко
растворим
практически
нерастворим
Динатриевая соль
карбенициллина
легко
медленно
растворим
-
Бензилпенициллин
а
новокаиновая соль
мало
мало
умеренно
растворим
Бензатинбензилпенициллин
мало
-
практически
нерастворим
Феноксиметилпенициллин
мало
растворим
растворим
17. Растворимость пенициллинов
препаратвода
спирт
хлороформ
Ампициллин
мало
практически
нерастворим
практически
нерастворим
Оксациллина Naсоль
легко
трудно
растворим
-
Амоксициллин
мало
-
практически
нерастворим
18. Определение подлинности
1. УФ – спектроскопия:соли бензилпенициллина
λ = 280-286 нм.
феноксиметилпенициллин
λmax= 268-274 нм, λmin = 272 нм;
ампициллин
λmax = 256, 261, 267,
λmin = 255, 260, 266 нм
19. Определение подлинности
2. ИК - спектроскопия3. Удельное вращение
4. ВЭЖХ
5. ТСХ
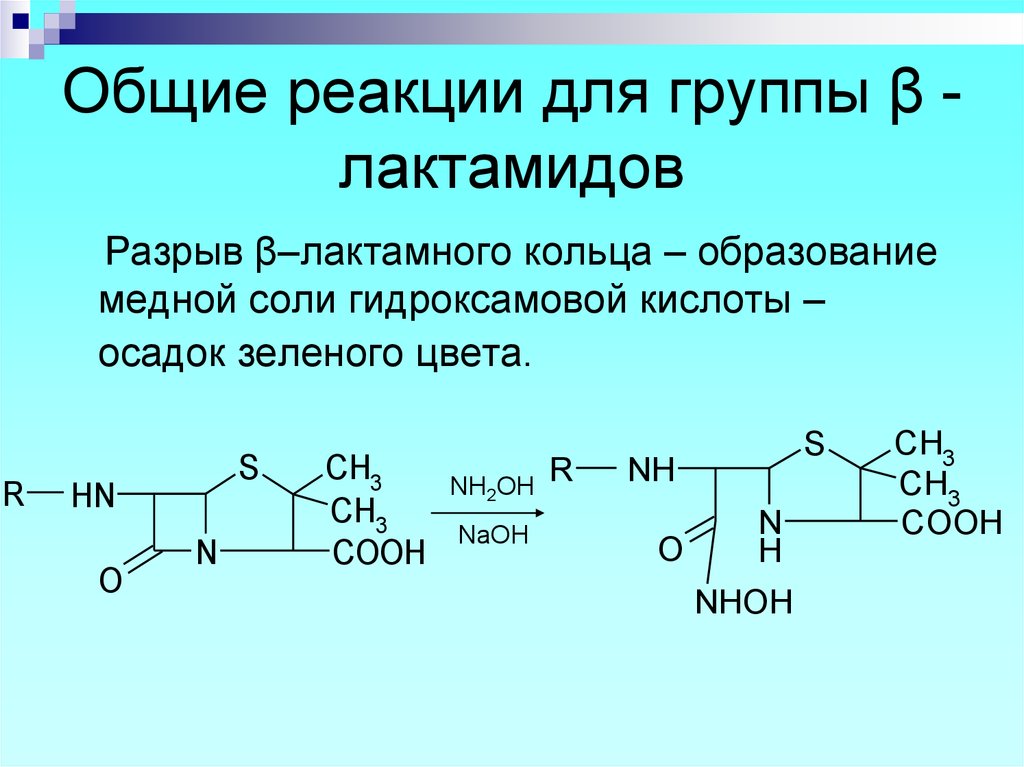
20. Общие реакции для группы β - лактамидов
Общие реакции для группы β лактамидовРазрыв β–лактамного кольца – образование
медной соли гидроксамовой кислоты –
осадок зеленого цвета.
R
S
HN
O
N
CH3
CH3
COOH
NH2OH
NaOH
R
S
NH
O
N
H
NHOH
CH3
CH3
COOH
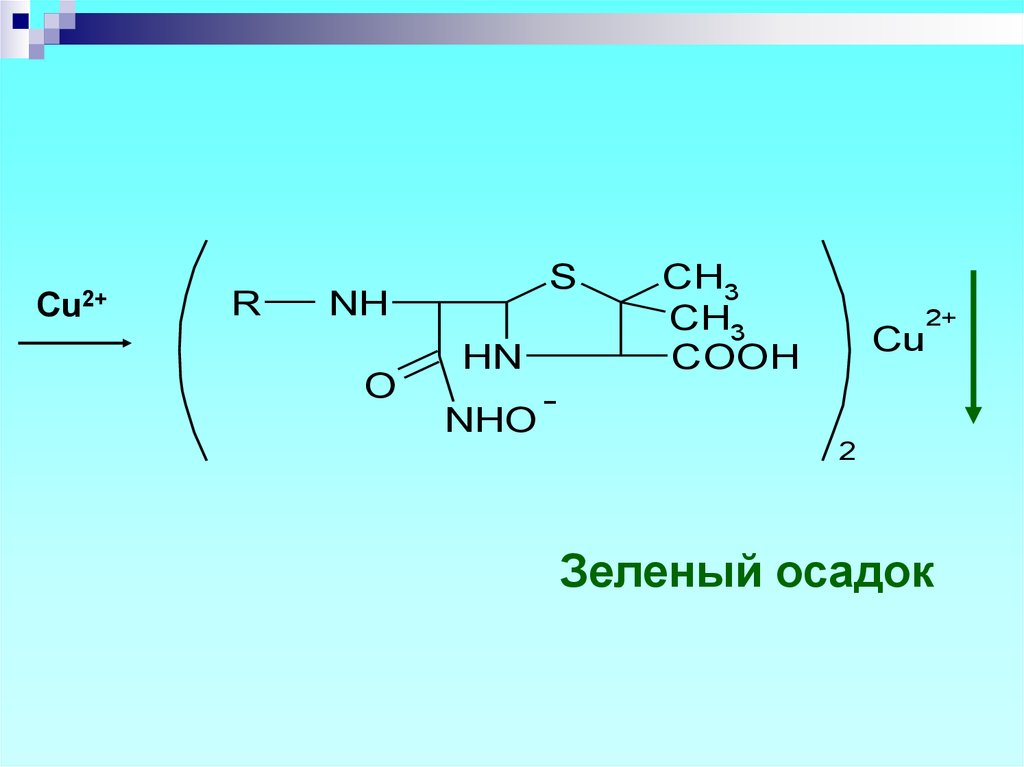
21.
Cu2+R
S
NH
O
HN
NHO
CH3
CH3
COOH
2+
Cu
2
Зеленый осадок
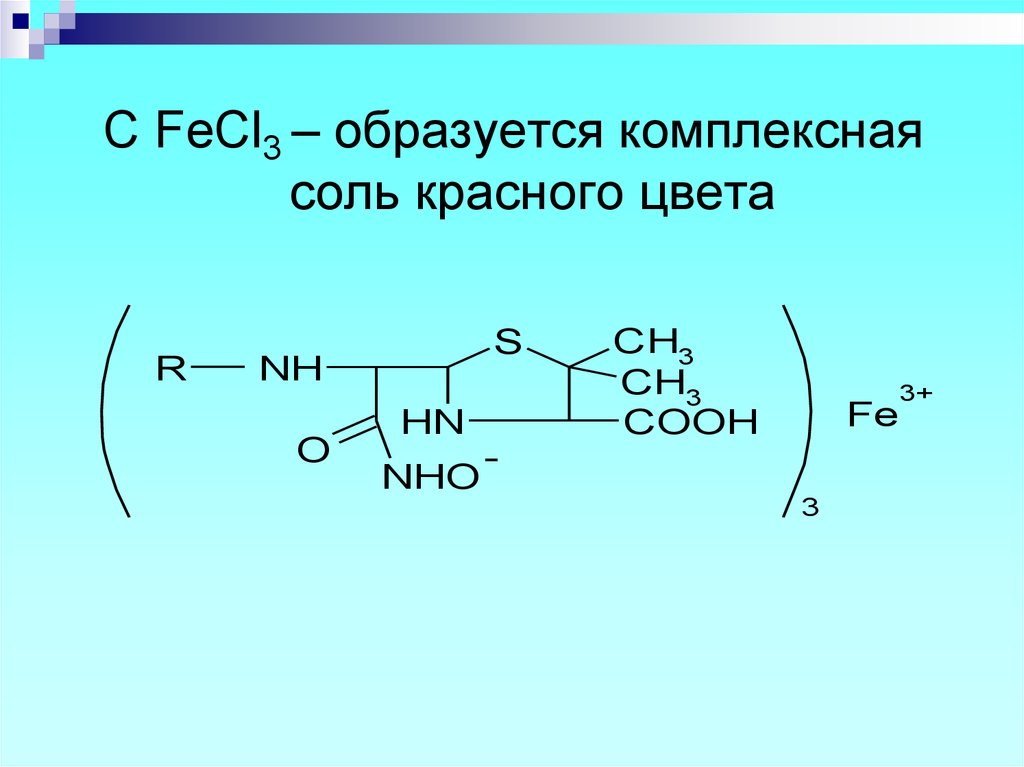
22.
C FeCl3 – образуется комплекснаясоль красного цвета
R
S
NH
O
HN
NHO
CH3
CH3
COOH
Fe
3
3+
23. Обнаружение азотистого основания
а) с насыщенным раствором йода– коричневый осадок;
б) с реактивом Майера – белый
осадок.
24. Проба Лассеня для обнаружения N и S
Препарат прокаливают с солями Na, фильтруют:а) к части фильтрата добавляют FeSO4, затем при
подкислении приливают FeCl3. Образуется синий
осадок – берлинская лазурь.
6NaCN + FeSO4 → Na4[Fe(CN)6] + Na2SO4;
3Na4[Fe(CN)6] + 4FeCl3 → Fe4[Fe(CN)6]3 + 12NaCl
б) часть фильтрата нагревают с соляной кислотой,
образуется H2S, который обнаруживается по
почернению бумаги пропитанной Pb(CH3COO)2.
25. Окислительная минерализация
а) сплавление со щелочью с образованием S2иона:S2- + Pb2+ → PbS
или с нитропруссидом Na – краснофиолетовое окрашивание Na4[Fe(CN)5NOS]
б) минерализация в концентрированной
азотной кислоте (HNO3) до сульфат – иона:
SO42- + Ba2+ → BaSO4 ↓
26. Реакция на СООН – группу:
Rобразование комплексных солей с FeCl3
S
NH
O
N
R
CH3
CH3
COOH
S
NH
O
FeCl3
N
CH3
CH3
COO
Fe
3
3+
27.
ампициллин – желтоеокрашивание;
бензилпенициллин (Na, K) –
желтый осадок;
феноксиметилпенициллин –
желто-зеленый осадок.
28. Взаимодействие с реактивом Марки (формальдегид в концентрированной серной кислоте).
Феноксиметилпенициллин + р-в Марки - краснокоричневое окрашивание (ауриновый краситель).Препарат
гидролиз
O CH2 COOH
H+
гидролиз
H+
феноксиуксусная кислота
OH
+
HO CH2 COOH
Реакция идет без нагревания только для
феноксиметилпенициллина.
29. Взаимодействие с реактивом Марки (формальдегид в концентрированной серной кислоте).
Соли бензилпенициллина + р-в Марки - краснокоричневое окрашиваниеАмпициллин + р-в Марки - темно-желтое
окрашивание
Амоксициллин + р-в Марки - темно-желтое
окрашивание
30. Частные реакции
1. Бензилпенициллина Na и K солиОсаждение свободной кислоты при
добавлении соляной кислоты – белый
осадок, растворимый в избытке
кислоты.
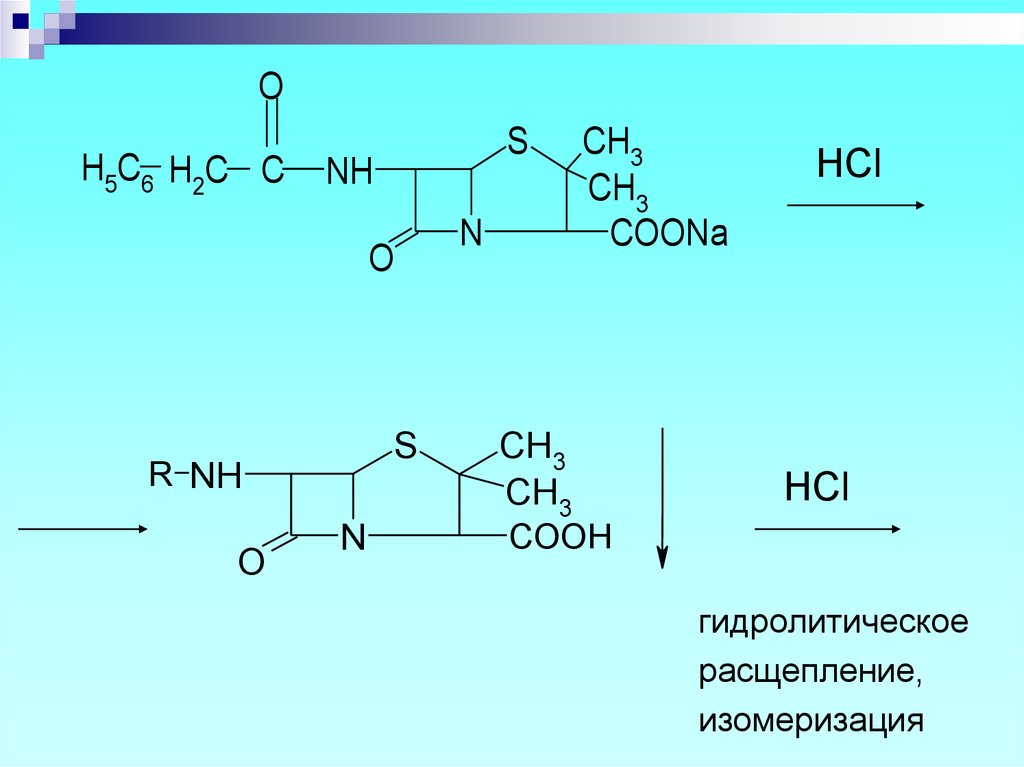
31.
OH5 C6 H2 C C
S
NH
O
S
R NH
O
N
N
CH3
CH3
COONa
CH3
CH3
HCl
HCl
COOH
гидролитическое
расщепление,
изомеризация
32.
SHOOC
N
CH3
CH3
R
HCl
COOH
N
Пенилловая кислота
S
HOOC
N
N
R
CH3
CH3
COOH
. HCl
33. Обнаружение катионов Na и K
1) окраска пламени2) с кобальтинитритом Na на К+ оранжево-желтый осадок.
34. Реакция Витали-Морена:
Препарат выпаривают в смеси сдымящей HNO3, а затем прибавляют
спиртовый раствор KOH и ацетон –
фиолетовое окрашивание.
35.
Выделениефенилуксусной
кислоты после кипячения в 4%
NaOH и последующего добавления
избытка разбавленной H2SO4 (по
запаху)
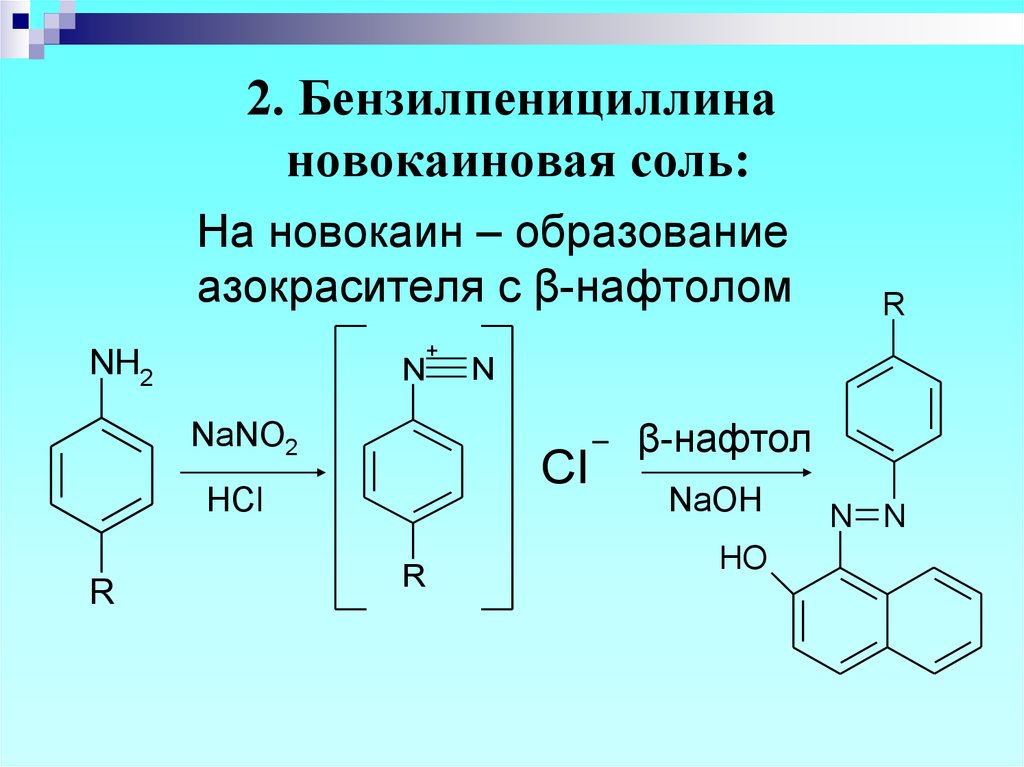
36. 2. Бензилпенициллина новокаиновая соль:
На новокаин – образованиеазокрасителя с β-нафтолом
+
NH2
N
NaNO2
R
N
Cl
HCl
R
R
β-нафтол
NaOH
HO
N N
37. 3. Бициллин-I (бензатин-бензилпенициллин):
3. Бициллин-I (бензатинбензилпенициллин):Обнаружение N,N – дибензилэтилендиамина.
После добавления NaOH и извлечения
эфиром реакция с пикриновой кислотой –
желтые кристаллы.
O
H
+
+
CH2 N CH2 CH2 N CH2
H
O2N
H
NO2
*
H
Определяют tпл
NO2
2
38. Окислительное разложение:
Препарат + NaOH + KMnO4 –зеленое окрашивание
При нагревании появляется запах
бензальдегида.
Действуют K2Cr2O7 и ледяной
CH3COOH – образуется золотистожелтый осадок
39. 4. Ампициллина тригидрат:
с реактивом Фелинга – краснофиолетовое окрашивание(образование медных комплексов).
нагревание с нингидрином –
вишневое окрашивание за счет
фениламиноуксусной кислоты.
40. 5. Карбенициллина натриевая соль:
реакция декарбоксилирования:добавляют Na2CO3 и фенолфталеин –
розовое окрашивание, нагревают окраска фенолфталеина исчезает.
41. 6. Амоксициллин
Амоксициллин имеет свободный фенольныйгидроксил и реагирует с реактивом Миллона:
(р-р HNO3,содержащий NO2,NO3,Hg+2,Hg+)
N O
HNO2
OH
R
N
OH
N O
Hg2+
O
OH
R
O N
O Hg O
R
R
R
42. Чистота:
кислотностьили щелочность (рН = 5,5; 7,5);
потеря в массе при высушивании;
испытания на токсичность, пирогенность,
стерильность;
термостабильность – при нагревании препарата
до 1,5 часов при 1700С допускается снижение
содержания суммы пенициллинов не более 10%;
43. Чистота:
светопоглощающиепримеси;
йодсорбирующие примеси не более 6%
(обратная йодметрия);
остаточные растворители - ГЖХ;
триметиламин, диметиланилин (ампициллин) –
ГЖХ;
феноксиуксусная кислота
(феноксиметилпенициллин) - ВЭЖХ.
44. Устойчивость бензилпенициллина
устойчив на холоду только в сухомсостоянии, при повышенной температуре в
присутствии влаги, следов тяжелых металлов
в кислой и щелочной среде разлагается.
Производные полиэтиленгиколя, ПАВ и
других вспомогательные вещества снижают
устойчивость. Наиболее устойчив при рН 6,07,0.
45. Гидролиз и разложение:
RВ щелочной среде:
S
NH
O
N
R
CH3
CH3
COOH
NH
S
C NH
O
OH
CH3
CH3
COOH
пенициллоиновая кислота
R C NH
-CO2
O
CH2
S
NH
пениллоиновая кислота
CH3
CH3
COOH
46. В кислой среде:
Пенициллоиновая кислота разлагается до:HS
O
R C NH CH C
O
COOH
пенальдиновая кислота
H
+
H2N
C
CH3
CH3
CH COOH
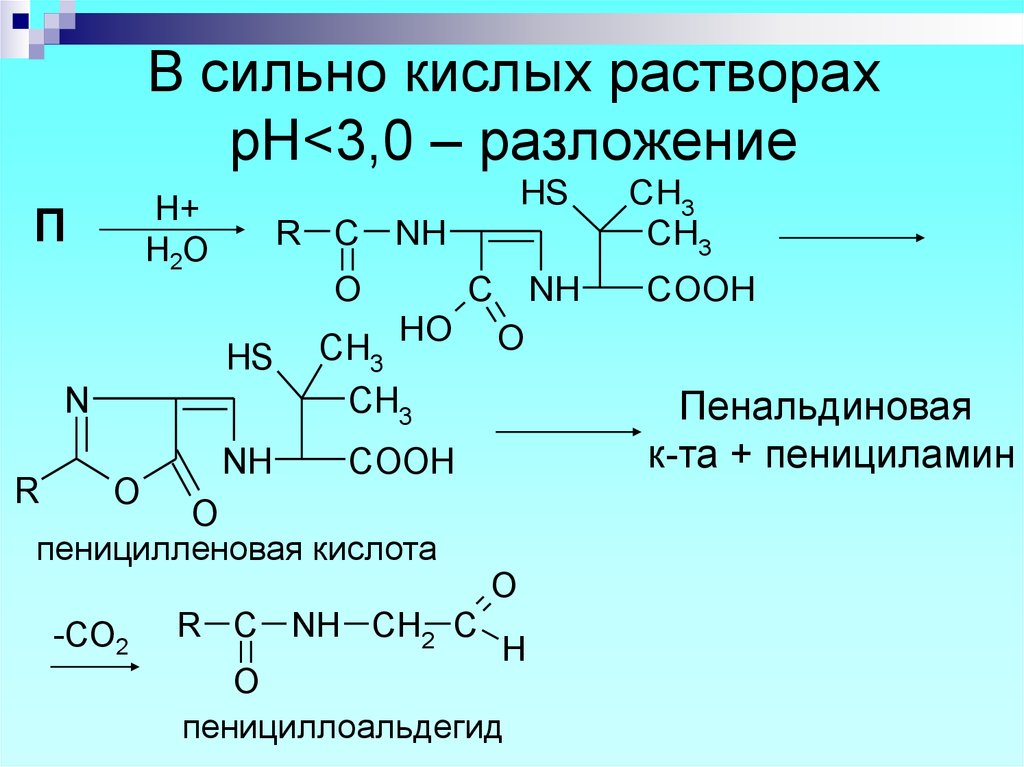
пеницилламин
47. В сильно кислых растворах рН<3,0 – разложение
В сильно кислых растворахрН<3,0 – разложение
HS
H+
H2O
П
R C
NH
O
HS
N
R
O
NH
C
HO
CH3
CH3
NH
Пенальдиновая
к-та + пенициламин
COOH
O
O
R C NH CH2 C
COOH
O
пеницилленовая кислота
-CO2
CH3
CH3
H
O
пенициллоальдегид
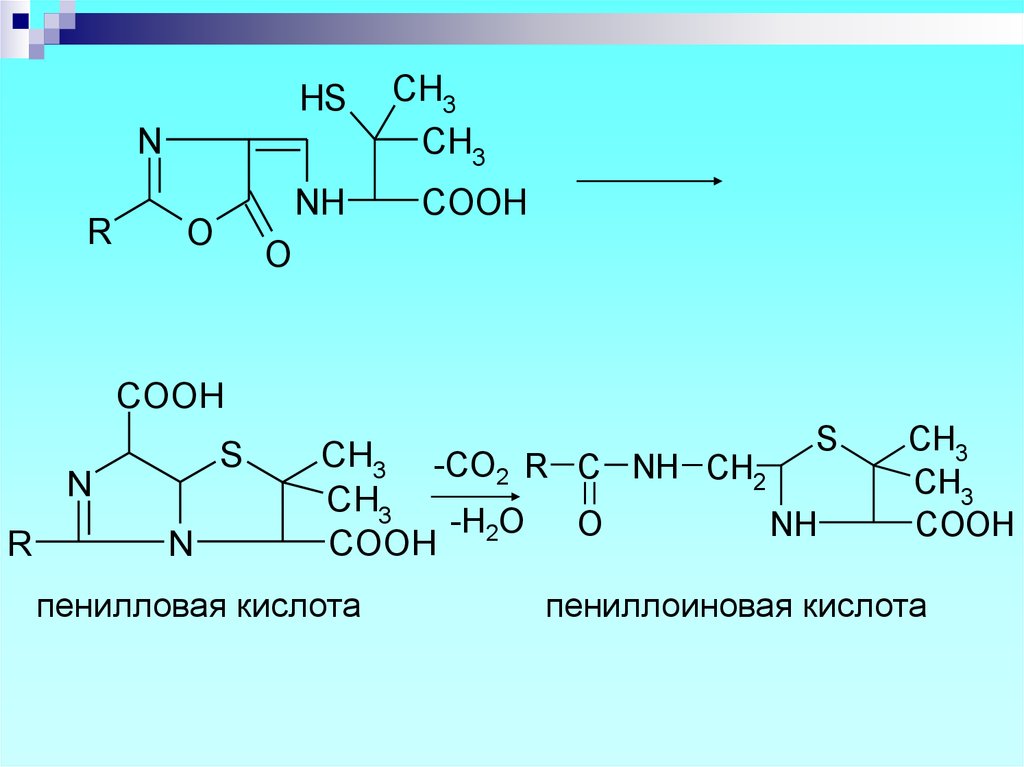
48.
HSN
R
NH
O
CH3
CH3
COOH
O
COOH
S
N
R
N
S
CH3 -CO R C NH CH
2
2
CH3
-H2O
O
NH
COOH
пенилловая кислота
CH3
CH3
COOH
пениллоиновая кислота
49. Количественное определение
Состоит из двух этапов: определение суммыпенициллинов и определение
соответствующего препарата.
1. Обратная йодометрия (ГФХ)
продукты последовательного щелочного, а
затем кислотного гидролиза окисляют
избытком стандартного раствора йода J2 при
рН 4,5
50.
CH2 CS
NH
O
CH3
CH3
COOH
N
NaOH
O
S
CH2 C NH
O
O
C NH
CH3
CH3
COONa
ONa
динатриевая соль пенициллоиновой кислоты
CH2
C NH
O
H+
CH3
C CH
O
3
CH C H +
CH
H2N
COOH
COOH
пенальдиновая кислота
HS
пенициламин
51.
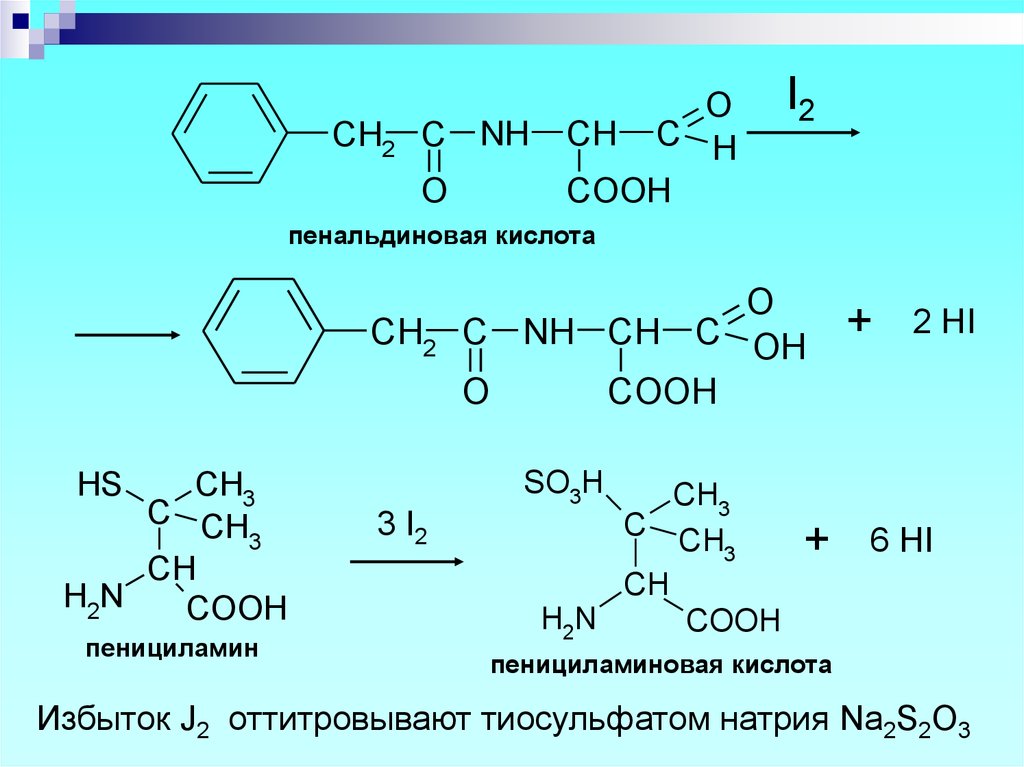
CH2 C NHO
O
CH C H
COOH
I2
пенальдиновая кислота
CH2
CH3
C CH
3
CH
H2N
COOH
+
2 HI
SO3H
HS
пенициламин
O
C NH CH C OH
COOH
O
3 I2
CH3
C CH
3
CH
H2N
COOH
+
6 HI
пенициламиновая кислота
Избыток J2 оттитровывают тиосульфатом натрия Na2S2O3
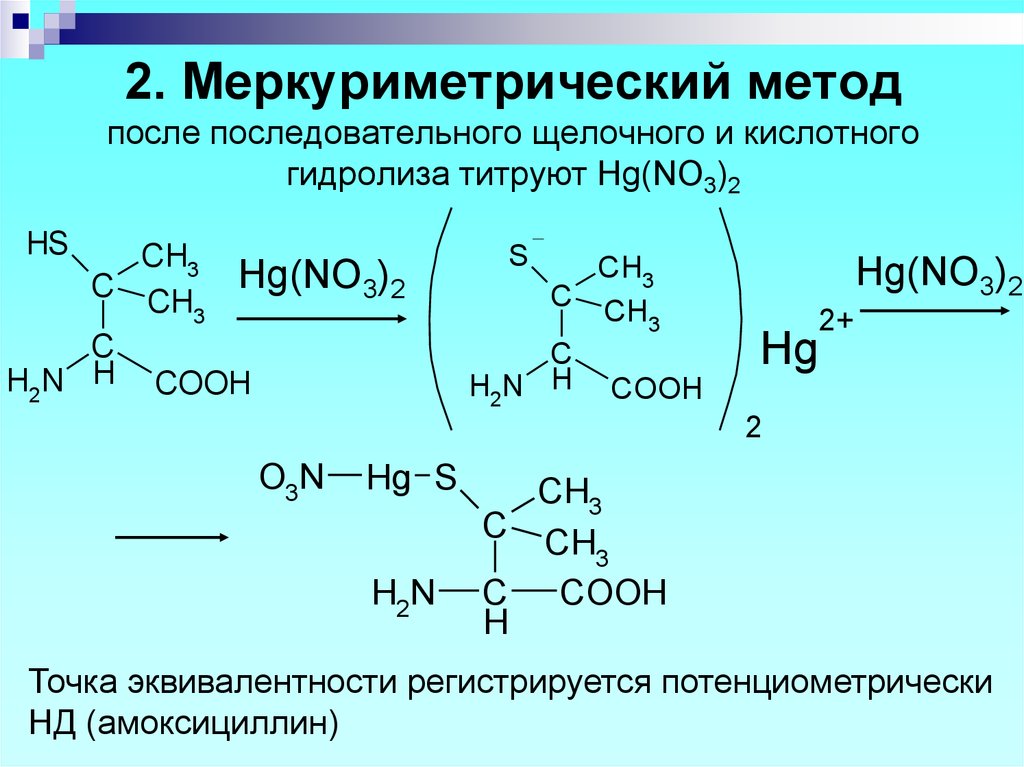
52. 2. Меркуриметрический метод после последовательного щелочного и кислотного гидролиза титруют Hg(NO3)2
HSCH3
C CH Hg(NO3)2
3
C
H2N H COOH
S
CH3
C CH
3
C
H2N H COOH
Hg(NO3)2
Hg
2+
2
O3N
Hg S
H2N
CH3
C CH
3
C COOH
H
Точка эквивалентности регистрируется потенциометрически
НД (амоксициллин)
53. определяют Na, K, новокаиновую соли
3. Гравиметрический методопределяют Na, K, новокаиновую соли
Бензилпенициллин извлекают амилацетатом
и осаждают в виде N-этилпиперидиновой
соли.
O
S
CH2 C NH
O
N
CH3
CH3
COO
+
*
N
H
C2H5
54.
В новокаиновой солибензилпенициллина новокаин
определяют обратной нейтрализацией.
Новокаин извлекают хлороформом и
титруют серной кислотой, избыток
которой оттитровывают NaOH. (МФ)
C2H5
H2N
C
O
O
CH2 CH2 N
C2H5 H SO
2
4
C2H5
-
+
SO4
R N H
C2H5
2
H2SO4 + 2NaOH
Na2SO4 + 2H2O
Или СФ в водно-метанольном растворе
при λ 290 нм
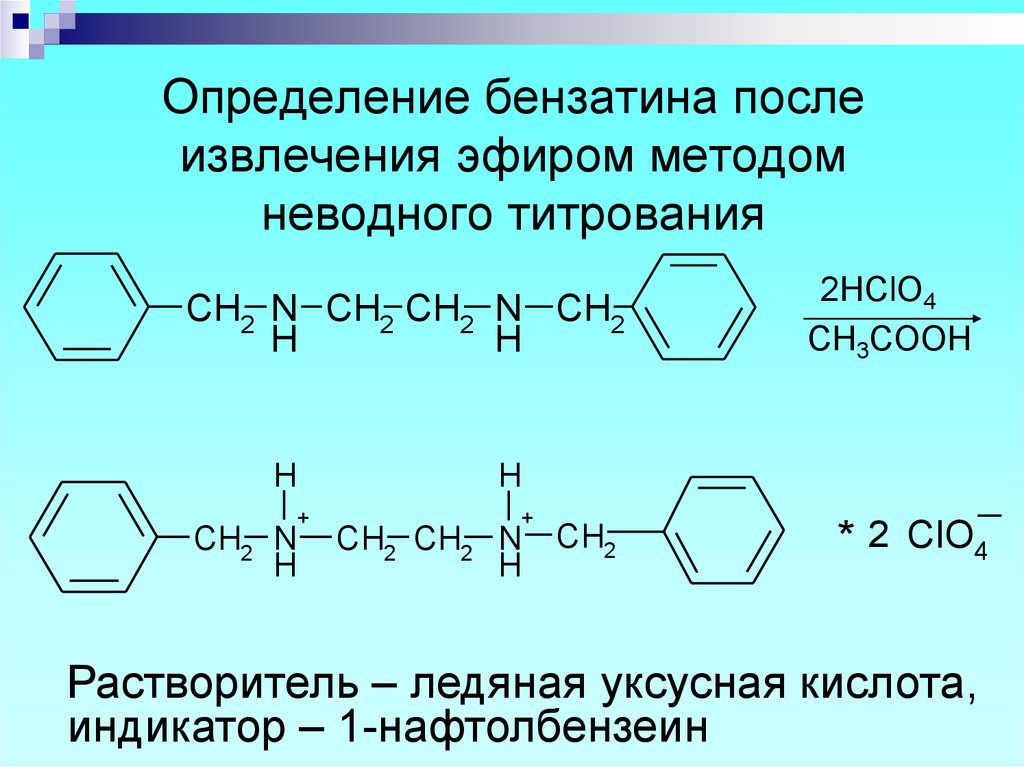
55. Определение бензатина после извлечения эфиром методом неводного титрования
CH2 N CH2 CH2 N CH2H
H
H
+
CH2 N
H
2HClO4
СH3COOH
H
+
CH2 CH2 N
H
CH2
* 2 ClO4
Растворитель – ледяная уксусная кислота,
индикатор – 1-нафтолбензеин
56.
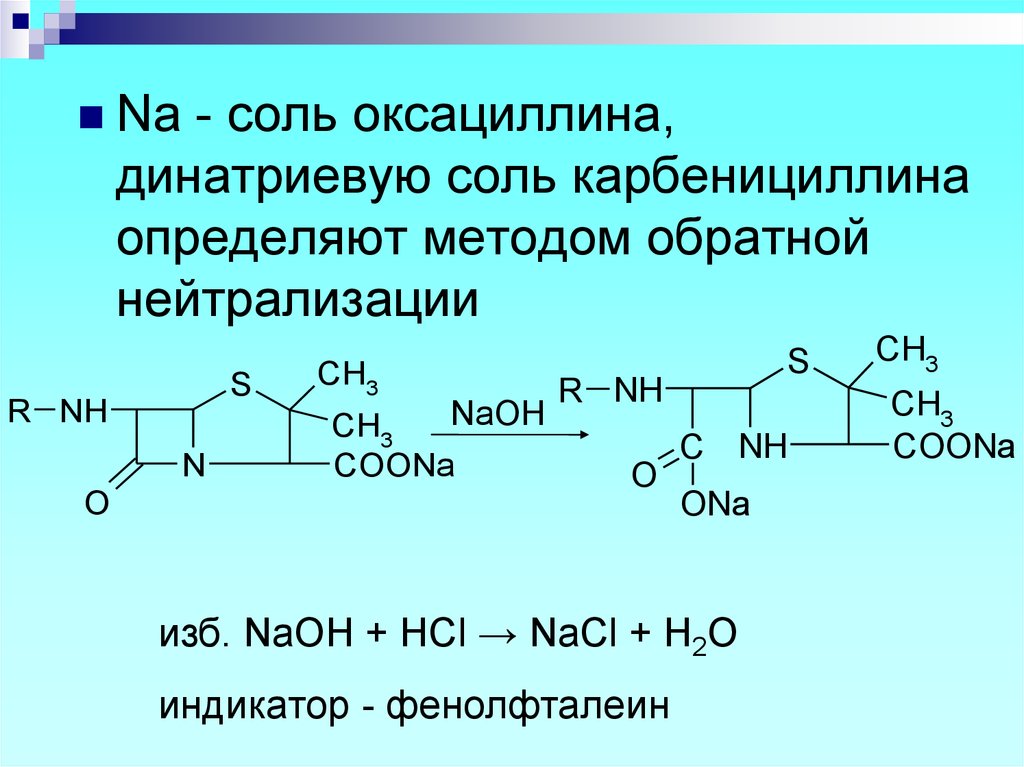
- соль оксациллина,динатриевую соль карбенициллина
определяют методом обратной
нейтрализации
Na
S
R NH
N
O
CH3
NaOH
CH3
COONa
S
R NH
O
C NH
ONa
изб. NaOH + HCl → NaCl + H2O
индикатор - фенолфталеин
CH3
CH3
COONa
57.
Спектрофотометрическийметод
(ФС, МФ)
а) Феноксиметилпенициллин в NaOH
при λ 269 нм
б) МФ – (препарат взаимодействует
с раствором имидазола и HgCl2 –
образуется соль пеницилленовой
кислоты R-S-HgCl) λ=325 нм
ФЭК
58.
Активностьпенициллинов – метод
диффузии в агар
1 ЕД = 0,5988 мкг химически чистой
Na-соли бензилпенициллина
59.
Применение: антибактериальныепрепараты.
Совместимость: пенициллины нельзя
объединять с аминогликозидами в одном
шприце, т.к. образующиеся
пенициллоиновые кислоты дают соли с
основными аминогликозидами
Хранение: в сухом месте при комнатной
температуре, флаконы.
60.
Фармакокинетика: выводятся с мочой90% в неизменном виде, остальное в
виде неактивных продуктов:
пенициллоиновая кислота и
диметилцистеин.
Феноксиметилпенициллин: 30-35%
превращается в
п-оксифеноксиметилпенициллин, в
большей степени связывается с
белками.
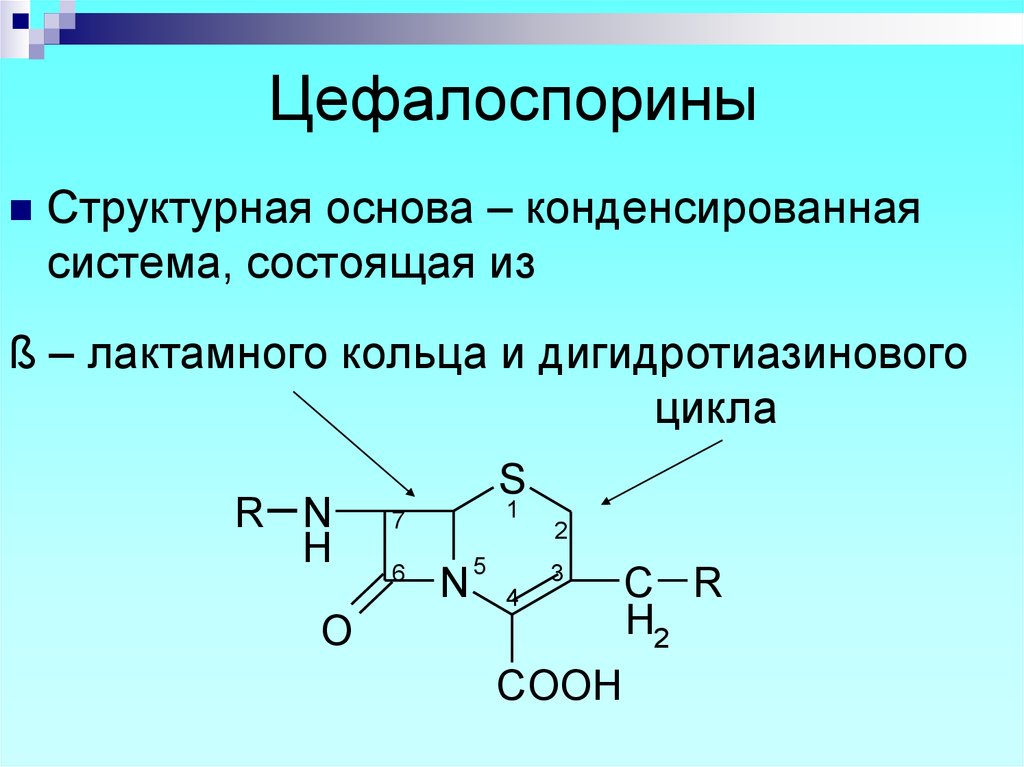
61. Цефалоспорины
Структурная основа – конденсированнаясистема, состоящая из
ß – лактамного кольца и дигидротиазинового
цикла
R N
H
S
1
7
6
N
5
2
3
4
O
COOH
C R
H2
62.
Цефалоспорины являются производными7-аминоцефалоспорановой кислоты и 7аминодезацетоксицефалоспорановой
кислоты.
H2N
O
S
7
6
1
N
5
2
3
4
H2N
CH2 O C CH3
COOH
O
S
7
6
1
N
5
2
3
4
O
COOH
CH3
63. Получение:
природный цефалоспорин С – продуктжизнедеятельности плесневого гриба
Cephalosporium salmosynnematum.
Цефалоспорин С – токсичен и
малоэффективен и является источником
получения полусинтетических
цефалоспоринов, а именно 7аминоцефалоспорановой кислоты.
64.
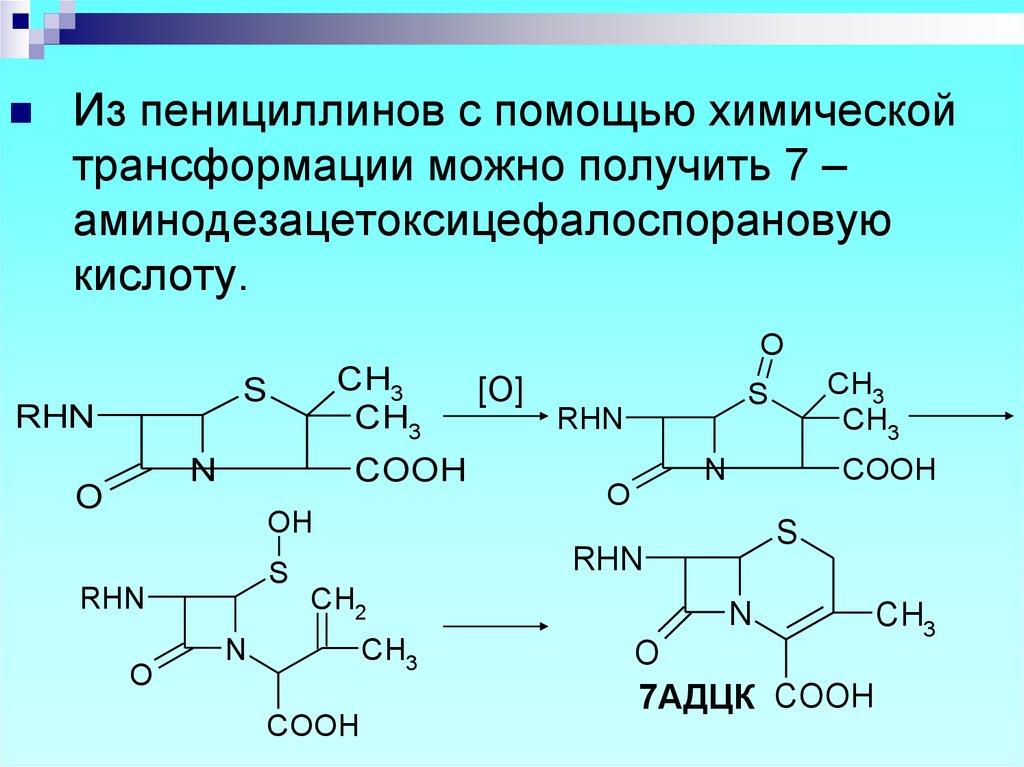
Из пенициллинов с помощью химическойтрансформации можно получить 7 –
аминодезацетоксицефалоспорановую
кислоту.
O
CH3
CH3
S
RHN
N
O
COOH
OH
S
RHN
O
[O]
RHN
N
O
COOH
S
RHN
CH2
N
CH3
COOH
CH3
CH3
S
N
O
7АДЦК COOH
CH3
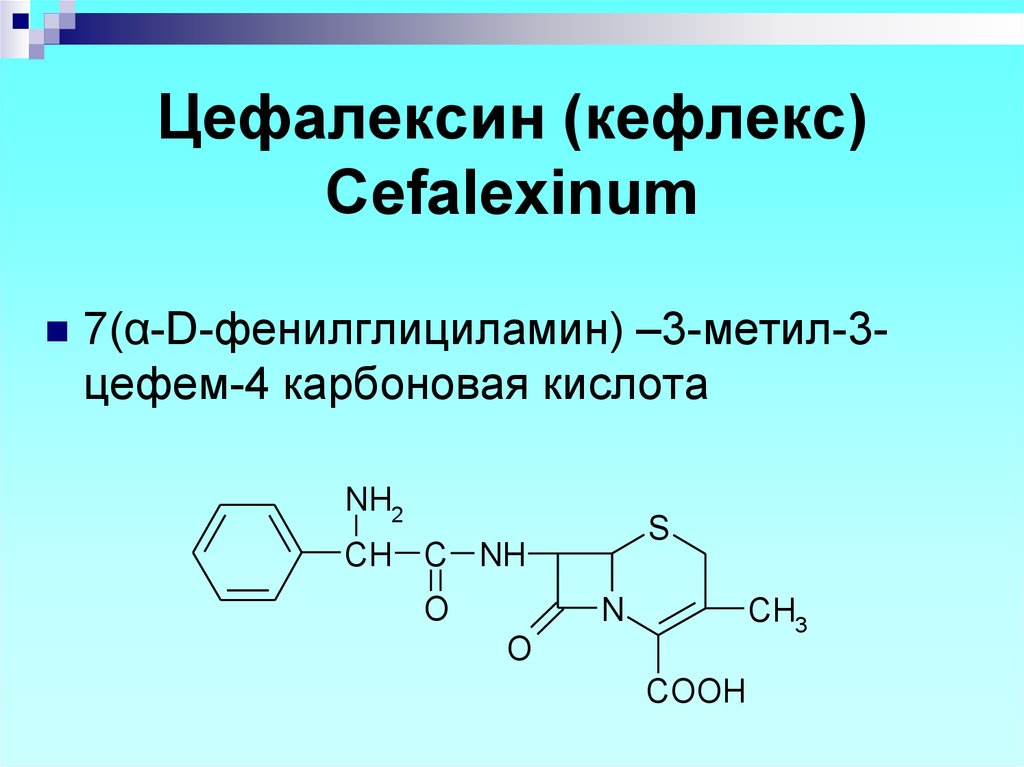
65. Цефалексин (кефлекс) Cefalexinum
7(α-D-фенилглициламин) –3-метил-3цефем-4 карбоновая кислотаNH2
S
CH C NH
O
N
CH3
O
COOH
66. Цефалотина натриевая соль Cefalotinum natrium
Натриевая соль –7-(тиенилацетамидо)цефалоспорановой кислоты
S
CH2 C NH
S
O
N
O
CH2 O C CH3
COONa
O
67.
Описание: белые кристаллическиепорошки, практически не растворимы в
хлороформе и эфире. Цефалотина
натриевая соль – легко растворима в
воде, мало растворим в этаноле.
Цефалотин – трудно растворим в воде,
практически не растворим в этаноле.
Цефалексин – амфотерен (-NH2, СООН).
68. Идентификация
1.Спектрофотометрия в УФ и ИКобластях.
λ = 260 нм, 4000-400 см-1, ЯМР.
2.ТСХ.
3.Удельное вращение.
69. 4. Гидроксамовая проба
SR C NH
O
O
NH2OH
N
R
OH-
R C N
H
O
C HN
O
NHOH
COOH
Cu(NO3)2
O
R
COOH
S
R C NH
O
S
C HN
NHO
R
Cu
COOH
2
2+
70. 5. Реакция с солями тяжелых металлов
SR C NH
O
O
N
R
C O
O
Fe
3
3+
71.
6. Цефалексин - на аминокислоту:нингидриновая проба и реакция
комплексообразования с ионами Cu2+ в
среде уксусной кислоты - после
прибавления гидроксида натрия образуется
оливково-зеленое окрашивание.
7. С реактивом Марки.
8. Со смесью 80% H2SO4 и 1% HNO3:
цефалексин – желтое окрашивание;
цефалотина натриевая соль – оливковозеленое окрашивание.
9. Реакция на Na+.
10. Реакция на органически связанную S.
72. Чистота:
примеси– ВЭЖХ;
наличие специфических
примесей – ГЖХ.
73. Количественное определение:
1. Обратная йодометрия: 1 эквивалентцефалоспорина требует 4 эквивалента J2.
2. Меркуриметрия.
3. Цефалоспорин – неводное титрование:
растворитель – смесь муравьиной и ледяной
уксусной кислот и ацетона;
титрант – диоксановый раствор HClO4;
точка эквивалентности регистрируется
потенциометрически.
4. СФМ.
5. ВЭЖХ.
74.
75.
Хранение:в хорошо
укупоренной таре.
Применение:
антибактериальные
(грамположительные и
грамотрицательные
микроорганизмы).
76. Стабильность:
В сильнокислой среде – гидролиз 3 –ацетоксиметильной группы.
R NH
O
S
7
6
1
N
5
R NH
2
3
4
S
CH2 O C CH3
O
O
COOH
O
CH2
N
O
C
CH2 OH
COOH
S
R NH
N
O
77. В щелочной среде или под действием ß-лактамаз:
SR NH
O
C N
OH-
R NH
CH2R1
O
S
C HN
OH
COOH
COOH
S
R NH
O
CH2R1
C N
OH
CH2
COOH
Ангидродезацетилцефалоспориновая кислота
78. Ингибиторы ß- лактамаз.
Пенициллины и цефалоспориныингибируются ß-лактамазами, для
увеличения их активности используют
ингибиторы ß-лактамаз: клавулановую
кислоту и сульбактам.
O
O
N
CH CH2OH
COOH
79.
Выделяетсяопределенными
штаммами микроорганизмов,
обладает слабой
антибактериальной активностью,
но эффективно угнетает ßлактамазы. В медицине часто
применяется в комбинации с
амоксициллином.
80. Калиевая соль клавулановой кислоты.
3-(2-оксилиден)-7-оксо-4-окса-1азобицикло [3.2.0] гептан-2 карбоксилаткалия
O
O
N
CH CH2OH
COOK
81. Описание:
белыйкристаллический порошок,
гигроскопичен, легко растворим в
воде, мало растворим в этаноле,
очень мало растворим в ацетоне.
82. Идентификация:
ИК-спектроскопия;ВЭЖХ;
реакция на К+.
83.
Испытаниена чистоту и
количественное определение
проводят методом ВЭЖХ.
Стабильность: водные растворы
разлагаются при рН 6,0-6,3.
Метаболизм: до 60% препарата
выводится с мочой в неизменном
виде.
84. Сульбактам Sulbactamum
Сульбактам – сульфонпенициллановой кислоты.
1,1-диоксидпенициллановой кислоты.
O
O
N
S
O
CH3
CH3
COOH
(Na)
85. Описание:
белыйкристаллический
порошок, хорошо растворим в
воде, натриевая соль легко
растворима в воде, кислотах,
мало растворима в ацетоне и
хлороформе.
86. Анализ аналогичен пенициллинам
Идентификация:1. ТСХ
2. Обнаружение Na+
Чистота:
ВЭЖХ, прозрачность, цветность
87.
Количественное определение1. Спектрофотометрия
2. ВЭЖХ
Хранение
в сухом, защищённом от света месте
88. Уназин Unasyn
Уназин состоит из ампициллина натрия исульбактама натрия (2:1).
89. Описание:
белыйкристаллический порошок,
легко растворим в воде. Уназин
необратимо ингибирует ßлактамазу и тем самым повышает
устойчивость ампициллина.



























































 chemistry
chemistry








