Similar presentations:
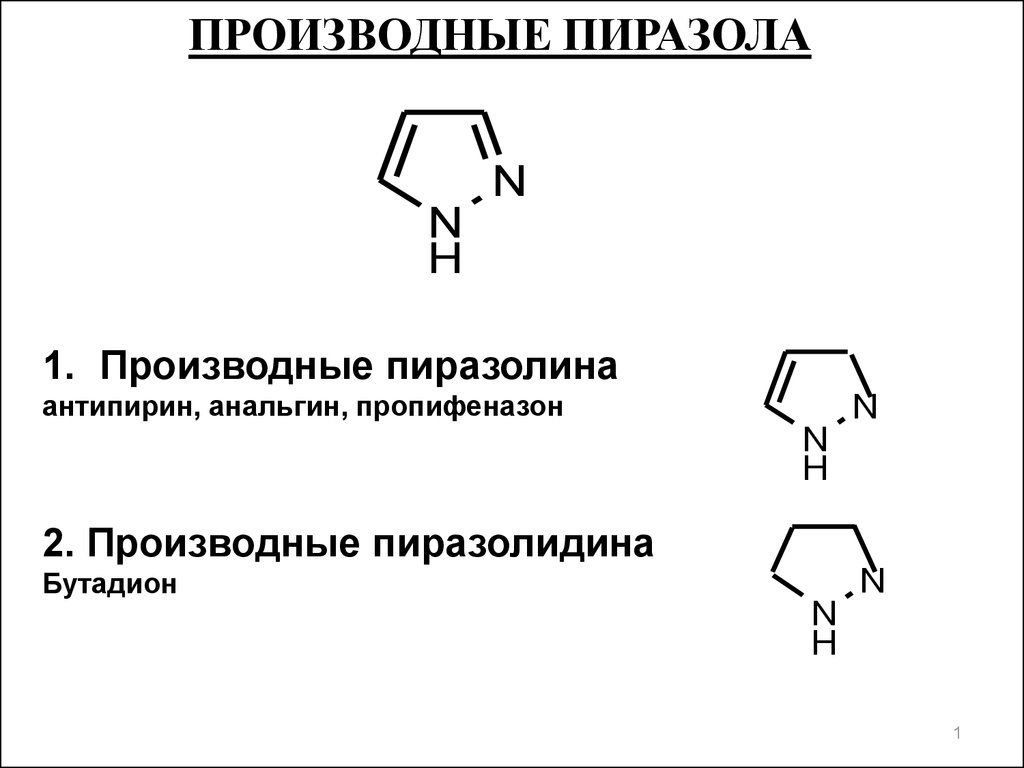
Производные пиразола
1.
ПРОИЗВОДНЫЕ ПИРАЗОЛАN
N
H
1. Производные пиразолина
антипирин, анальгин, пропифеназон
N
N
H
2. Производные пиразолидина
Бутадион
N
N
H
1
2.
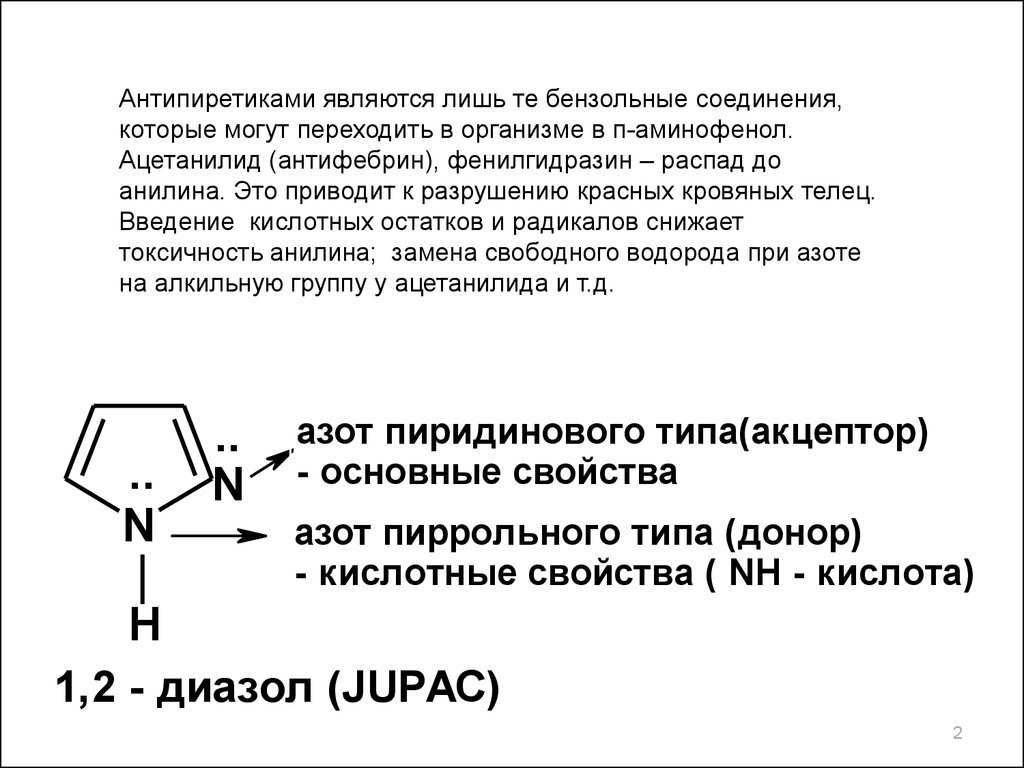
Антипиретиками являются лишь те бензольные соединения,которые могут переходить в организме в п-аминофенол.
Ацетанилид (антифебрин), фенилгидразин – распад до
анилина. Это приводит к разрушению красных кровяных телец.
Введение кислотных остатков и радикалов снижает
токсичность анилина; замена свободного водорода при азоте
на алкильную группу у ацетанилида и т.д.
..
N
..
N
азот пиридинового типа(акцептор)
- основные свойства
азот пиррольного типа (донор)
- кислотные свойства ( NH - кислота)
H
1,2 - диазол (JUPAC)
2
3.
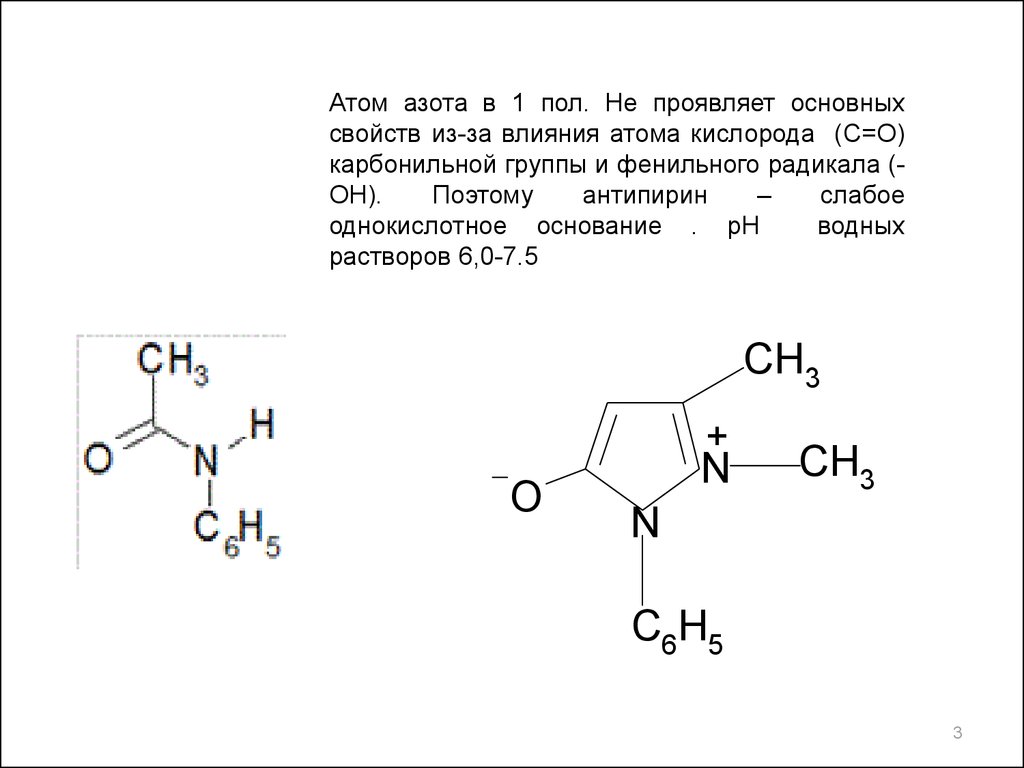
Атом азота в 1 пол. Не проявляет основныхсвойств из-за влияния атома кислорода (C=O)
карбонильной группы и фенильного радикала (OH).
Поэтому
антипирин
–
слабое
однокислотное основание . рН
водных
растворов 6,0-7.5
CH3
+
O
N
CH3
N
C6H5
3
4.
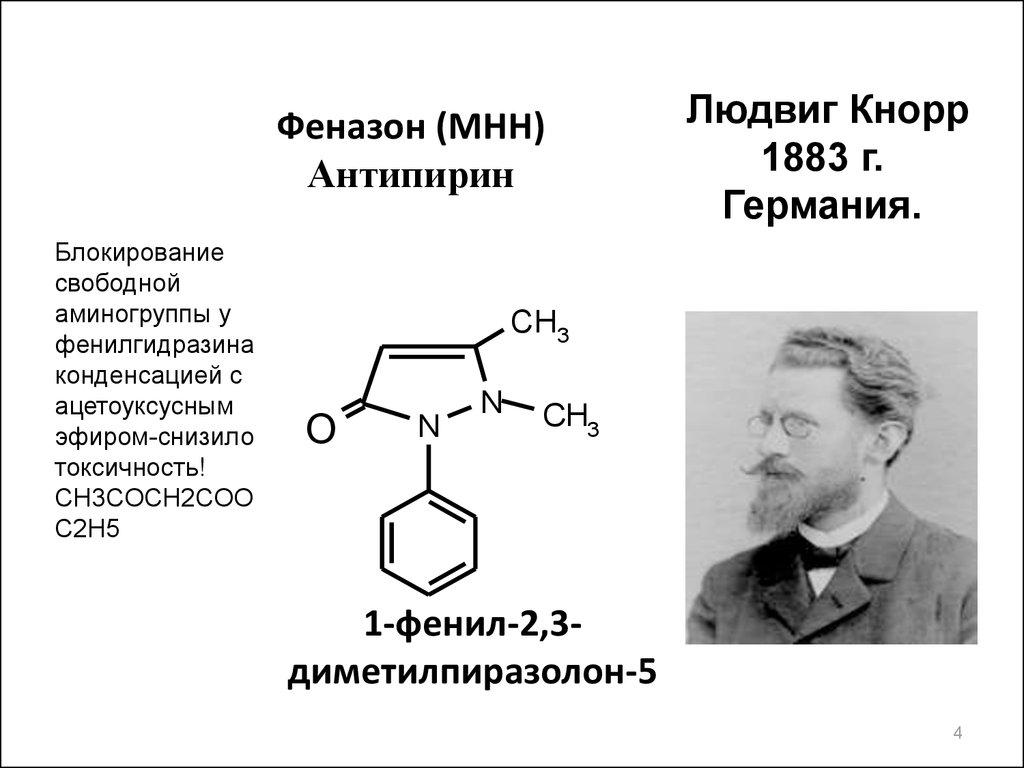
Феназон (МНН)Антипирин
Блокирование
свободной
аминогруппы у
фенилгидразина
конденсацией с
ацетоуксусным
эфиром-снизило
токсичность!
CH3COCH2COO
С2Н5
Людвиг Кнорр
1883 г.
Германия.
CH3
O
N
N
CH3
1-фенил-2,3диметилпиразолон-5
4
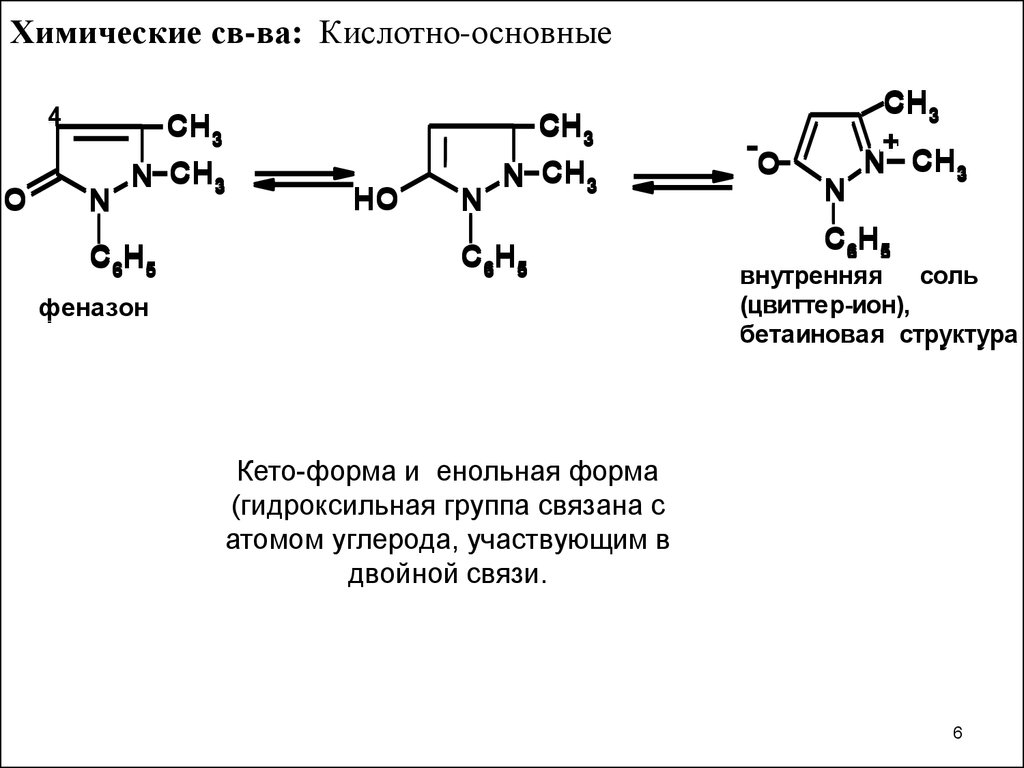
5. Растворимость антипирина обусловлена образованием в воде цвиттер-иона, который хорошо сольватируется водой (высокополярные соединения л
Свойства. Бесцветные кристаллы или белыйкристал. порошок, слабогорького вкуса, очень
легко растворим в воде и спирте, растворим
в хлф. и эфире.
Растворимость антипирина обусловлена
образованием в воде цвиттер-иона, который
хорошо сольватируется водой (высокополярные
соединения легко растворяются в полярных
растворителях)
Цвиттер –(нем.) -гермафродит
5
6.
Химические св-ва: Кислотно-основные4
O
N
CH 3
CH 3
N CH 3
N CH 3
C 6H 5
HO
N
C 6H 5
феназон
O
N
CH 3
+
N CH 3
C 6H 5
внутренняя
соль
(цвиттер-ион),
бетаиновая структура
Кето-форма и енольная форма
(гидроксильная группа связана с
атомом углерода, участвующим в
двойной связи.
6
7.
Физико-химические характеристикиУФ-спектр – мах 230 нм в 0,1М H2SO4
ИК-спектр
Tпл 110-113 ˚С
Химические свойства
1.Слабоосновные свойства
1.1– осадки с общеалкалоидными реактивами,
с танином – белый осадок
7
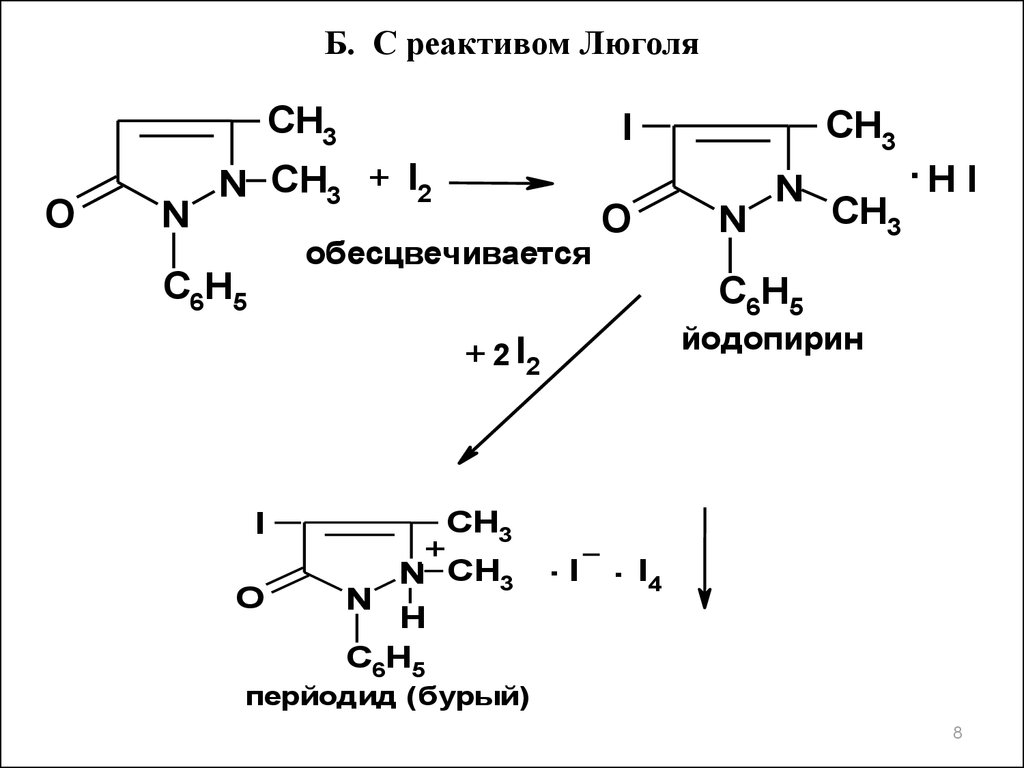
8.
Б. С реактивом ЛюголяCH3
O
N
CH3
I
N CH3 + I2
обесцвечивается
O
C6H5
N
N
CH3
.H I
C6H5
йодопирин
+ 2 I2
I
O
CH3
+
N CH3
N
H
C6H5
.I
. I4
перйодид (бурый)
8
9. Реакции электрофиль- ного замещения
Реакции• Вследствии ароматической
электрофильстуктуры, а. вступает в SE- реакции.
ного замещения
Электрофилы нитрозопроизводные и галогены,
т.е. положительно заряженные
частицы. Электронная плотность
аром. кольца способствует
притяжению положительно
заряженных частиц.
• Поэтому антипирин не окисляется
нитритом натрия в кислой среде и
иодом, а образует продукты
замещения (отличие от анальгина)!
9
10.
CH33
O
N
N
+
CH3
CH3
2 FeCl3
3
O
C6 H5
N
N
* 2 FeCl3
CH3
C6 H5
феррипирин,
буро-красного цвета
2. реакции замещения
А с р-ром NaNO2
CH3
O
N
N
C6H5
CH3
+ NaNO2 + HCl
CH3
O=N
O
N
N
CH3
C6H5
нитрозоантипирин
(изумрудно-зел.)
10
11.
Колич.1.Йодометрия (обратная)
CH3
N
O
N
CH3
C6 H5
HI
I2
+
+
CH3 COONa
2 Na2 S2 O3
I
CH3
I2
O
N
N
+
CH
HI
3
C6 H5
+ CH3COOH
2 NaI + Na2 S4 O6
NaI
•УФ-спектрофотометрия; фотометрия; ВЭЖХ (в ЛФ)
Примен.
Жаропонижающее, менее выражен болеутол. и противовоспалит. эффекты. табл. 0,25 г Не имеет широкого применения
11
12. При действии избытка иода, образуется иодопирин и выделяется кислота иодоводородная, которую связывают натрия ацетатом, чтобы предотврат
При действии избытка иода, образуется иодопирини выделяется кислота иодоводородная, которую
связывают натрия ацетатом, чтобы предотвратить
обратную реакцию. Поскольку иодопирин может
адсорбировать иод, для его извлечения добавляют
хлороформ или спирт. Избыток иода титруют
тиосульфатом натрия до обесцвечивания
хлороформного слоя.
Параллельно проводят контрольный опыт.
12
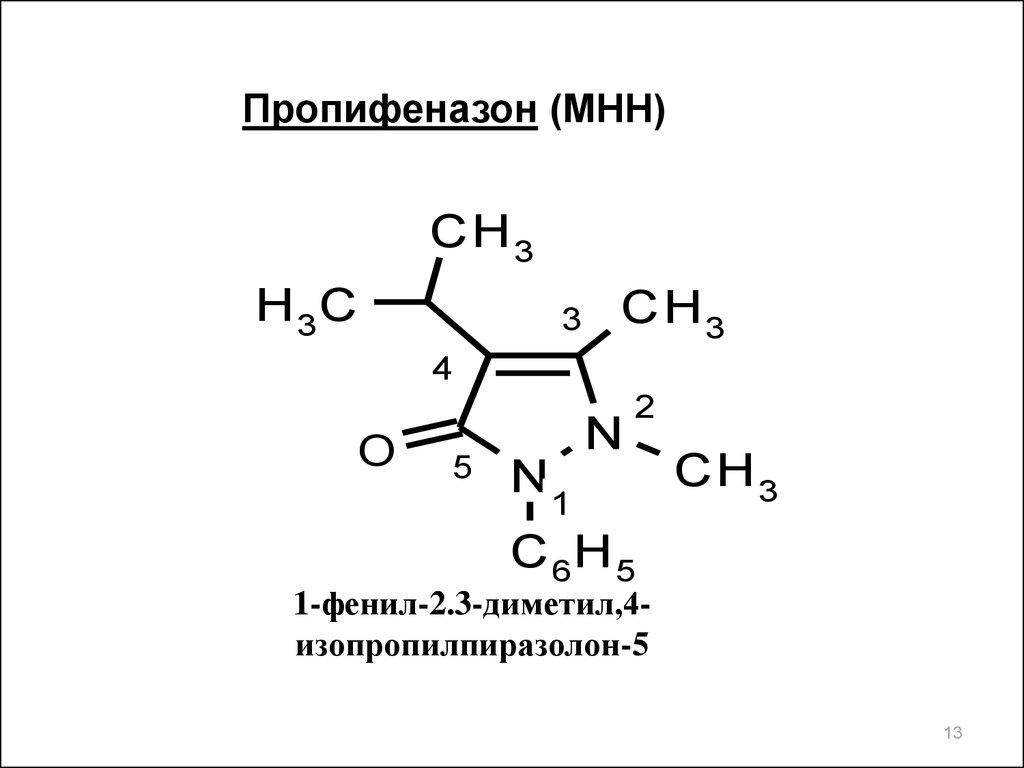
13.
Пропифеназон (МНН)CH 3
H 3C
3
CH 3
4
O
5
N
2
N1
CH 3
C 6H 5
1-фенил-2.3-диметил,4изопропилпиразолон-5
13
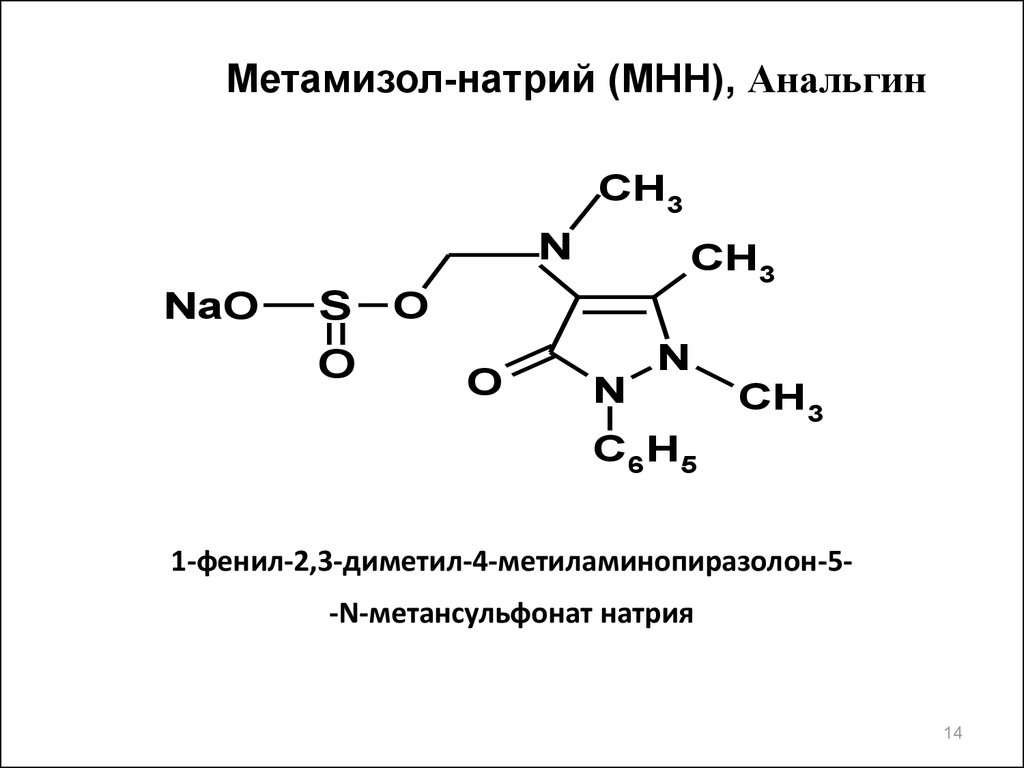
14.
Метамизол-натрий (МНН), АнальгинCH3
N
NaO
S O
O
O
CH3
N
N
CH3
C6 H5
1-фенил-2,3-диметил-4-метиламинопиразолон-5-N-метансульфонат натрия
14
15.
Физико-химические характеристикиПропифеназон, анальгин:
1.tпл
2. ТСХ
3.ИК, УФ-спектры
4.ВЭЖХ (сравнивают время удерж. со станд. образцом)
Химические с-ва
1. Р-и окисления: с хлоридом железа
---анальгин - синее окрашивание,
---пропифеназон – красно-коричневое, переход. в желтое
при добав. HCl развед.
2. основные с-ва:
А. осадки с осадительными реактивами
R N + KBi I4
HCl
R
+
NH .Bi I4 + HCl
15
16. 1. Р-ии окисления. Восстановительные свойства – R при С4. В качестве окислителей можно использовать: хлорная известь,FeCl3, NaNO2, I2, AgNO3 Раствор хл
1. Р-ии окисления. Восстановительные свойства – Rпри С4.
В качестве окислителей можно использовать:
хлорная известь,FeCl3, NaNO2, I2, AgNO3
Раствор хлорной извести используется в последнем
ФСП на анальгин.
Под действие света и кислорода происходит
окисление. Поэтому ФС нормирует прозрачность,
кислотность и щелочность (гидролиз)!
2. Р-ии гидролитического расщепления в
кислой нейтральной и щелочной средах,
особенно при нагревании.
16
17.
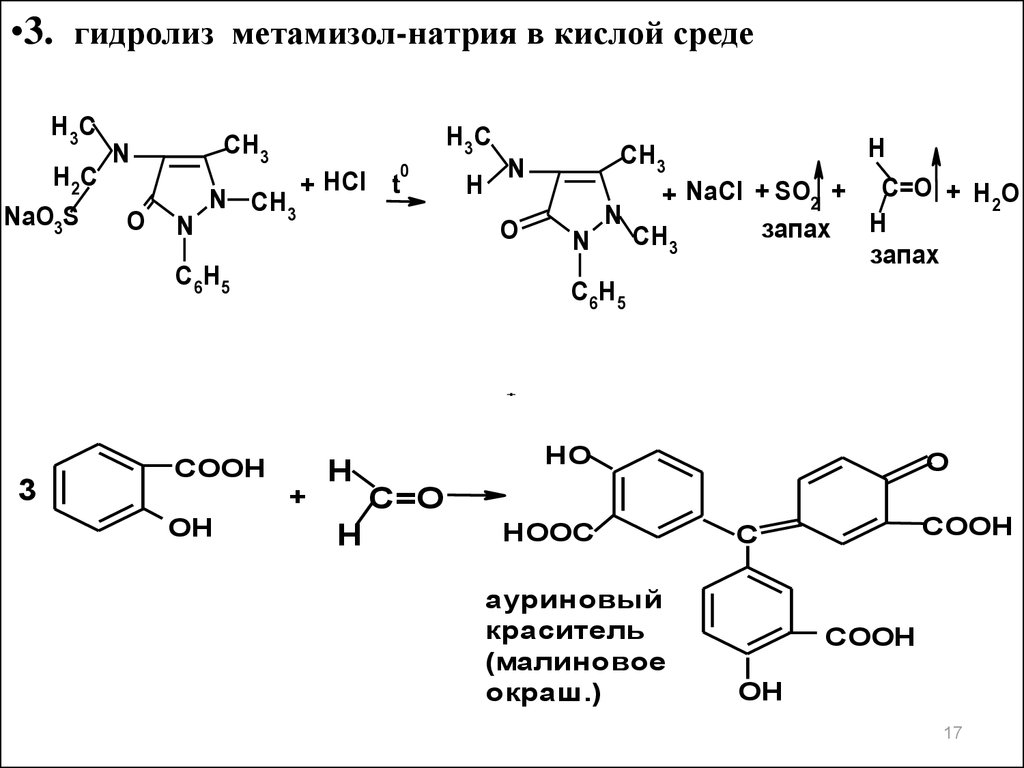
•3. гидролиз метамизол-натрия в кислой средеH 3C
H 2C
NaO3S
O
H 3C
CH 3
N
N
0
N CH 3
+ HCl t
H
N
O
C 6H 5
H
+ NaCl + SO2 + C=O + H 2O
N
запах H
CH 3
N
запах
C 6H 5
CH 3
+
3
COOH
+
OH
H
H
HO
O
C=O
HOOC
ауриновый
краситель
(малиновое
окраш.)
COOH
C
COOH
OH
17
18.
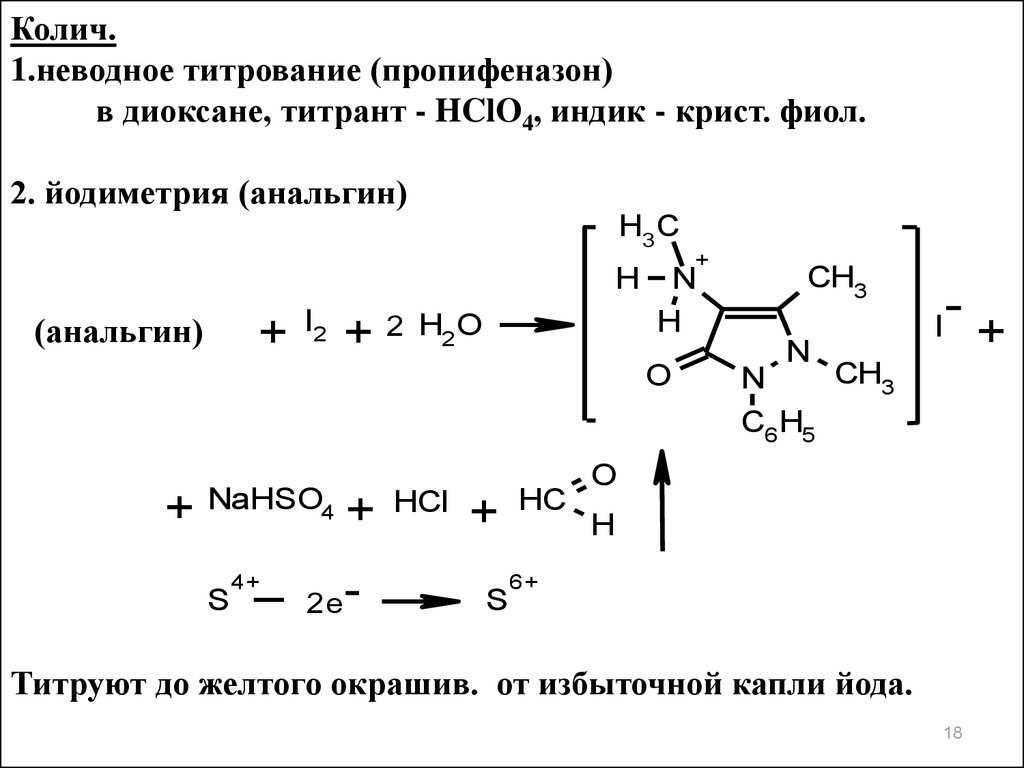
Колич.1.неводное титрование (пропифеназон)
в диоксане, титрант - HClO4, индик - крист. фиол.
2. йодиметрия (анальгин)
H3 C
H
(анальгин)
+
I2
+2
H2 O
+
N
H
O
+ NaHSO4 +
S
4+
2e
HCl
+
S
HC
CH3
N
I
CH3
N
C6 H5
O
H
6+
Титруют до желтого окрашив. от избыточной капли йода.
18
+
19. Окисление сульфитной серы до сульфатной. Навеску растворяют в спирте (колба сухая), прибавляют р-р HCL для разложения анальгина. Кислота нужн
Окисление сульфитной серы до сульфатной.Навеску растворяют в спирте (колба сухая),
прибавляют р-р
HCL для разложения
анальгина. Кислота нужна для гидролиза
остатка
натрия
метиленсульфоната
и
предотвращения окисления формальдегида
(альдегиды окисляются в щелочной среде).
19
20.
3. ВЭЖХ лек. формы пропифеназонаХранение. Т.к. легко окисляются - в хорошо укупорен.
склянках, в прохладном, защищен. от света месте.
Применяют – болеутоляющ., противовоспалит., жаропониж.
пропифеназон (саридон-таблетки, содержащие парацетамол,
пропифеназон и кофеин)
анальгин
табл. 0,5 г; 50% р-р д/ин
входит в состав различных болеутоляющих средств:
баралгин
пентальгин
андипал
темпалгин
20
21.
Ненаркотические анальгетики – синтетическиевещества,
обладающие
обезболивающими
свойствами,
противовоспалительным
и
жаропонижающим действием.
Механизм их действия связан с подавлением синтеза
простагландинов, взаимодействующих с болевыми
рецепторами. Поэтому понижают только повышенную
температуры.
В 1970 году ВОЗ рекомендовала всем странам
отказаться от анальгина.
Сейчас его не купишь в аптеках развитых стран.
Например, в США, Канаде, Британии, Германии,
Норвегии, Дании, Швеции, Австралии, Японии.
«Слишком высокий риск для здоровья» - так еще в
1977 году обосновало свой запрет анальгина
американское Управление по контролю за пищей и
лекарствами.
21
22. У каждого человека в крови есть пять видов лейкоцитов: гранулоциты (нейтрофилы), (70% от белых кровяных телец), эозинофилы, базофилы, моноциты
У каждого человека в крови есть пять видов лейкоцитов: гранулоциты(нейтрофилы), (70% от белых кровяных телец), эозинофилы, базофилы,
моноциты и лимфоциты. Риск развития агранулоцитоза. 7% смертности.
Принимать не более 3 дней. Не более 2 таблеток в день!
22
23.
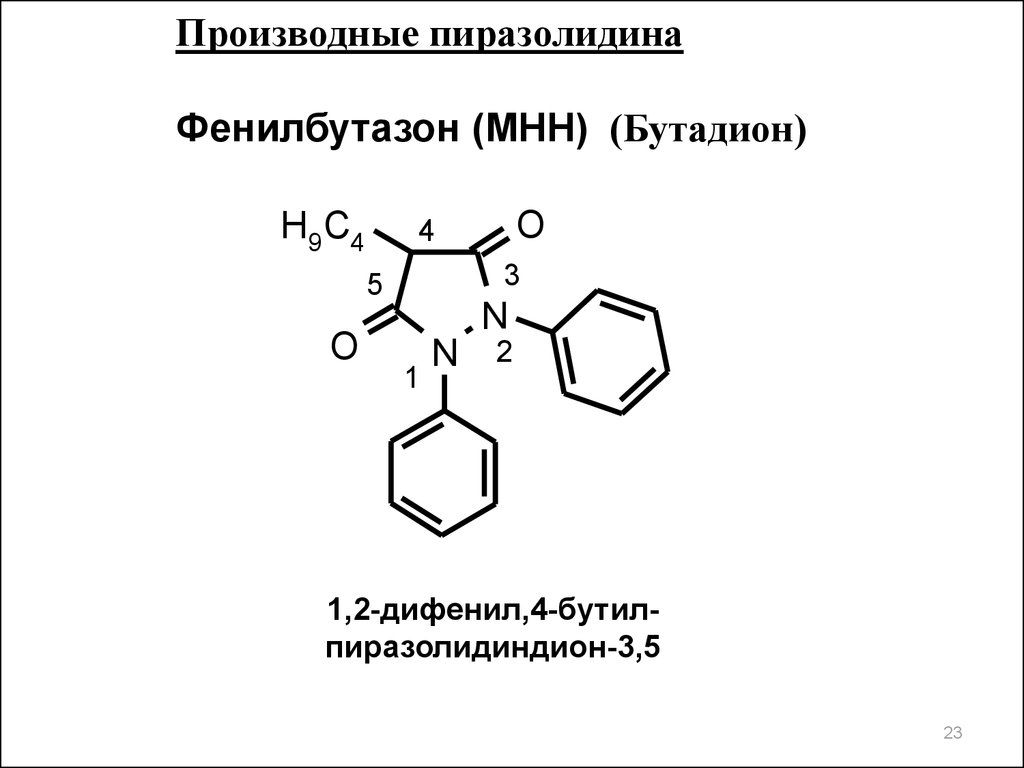
Производные пиразолидинаФенилбутазон (МНН) (Бутадион)
H9 C4
3
5
O
O
4
N
1
N
2
1,2-дифенил,4-бутилпиразолидиндион-3,5
23
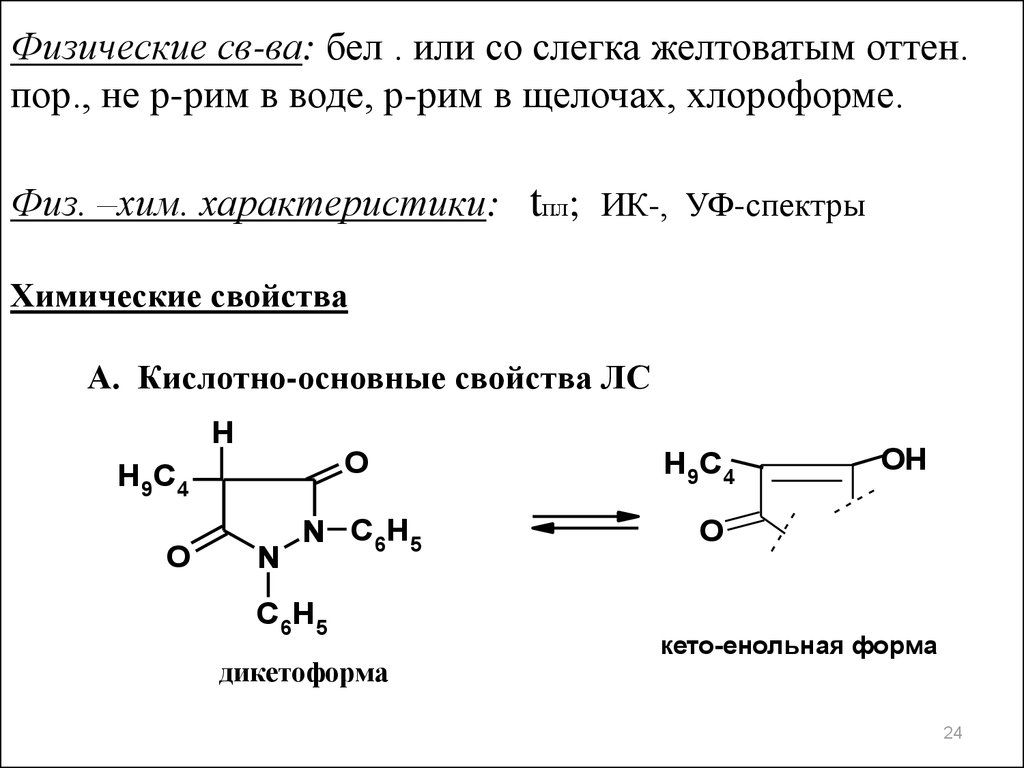
24.
Физические св-ва: бел . или со слегка желтоватым оттен.пор., не р-рим в воде, р-рим в щелочах, хлороформе.
Физ. –хим. характеристики: tпл; ИК-, УФ-спектры
Химические свойства
А. Кислотно-основные свойства ЛС
H
O
H 9C 4
O
N
N C 6H 5
C 6H 5
дикетоформа
H 9C 4
OH
O
кето-енольная форма
24
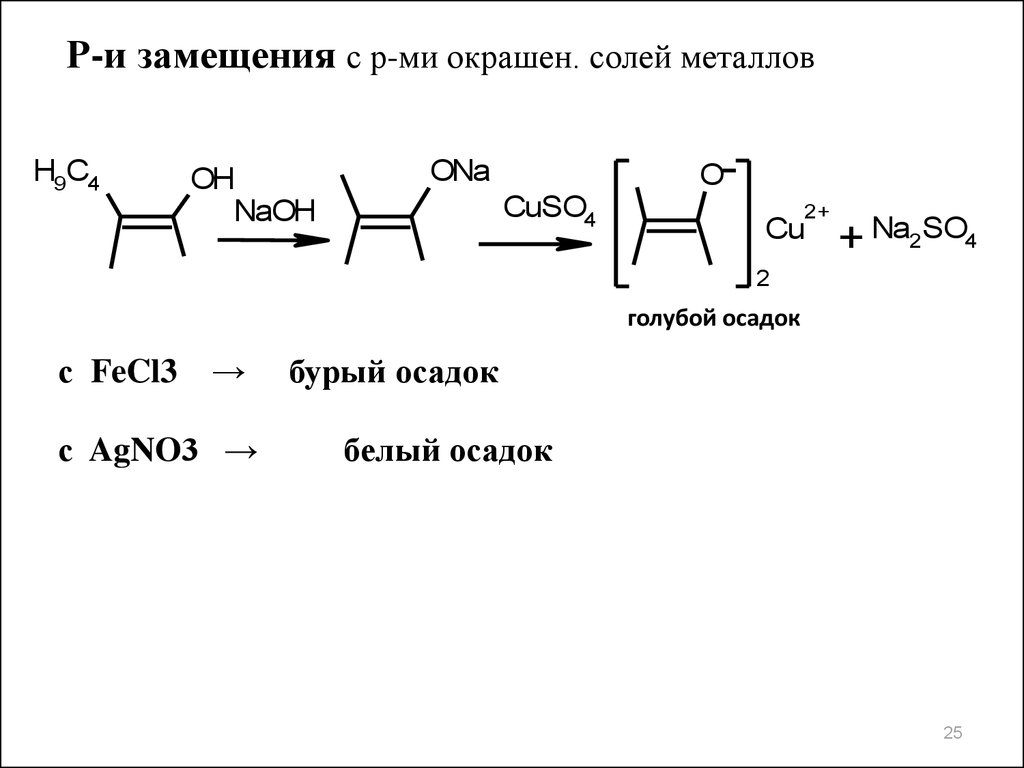
25.
Р-и замещения с р-ми окрашен. солей металловH9C4
OH
NaOH
ONa
O
CuSO4
2+
Cu
+ Na2SO4
2
голубой осадок
с FeCl3 →
с AgNO3 →
бурый осадок
белый осадок
25
26.
•Реакции окисленияO
H5 C4
O
N
N
H2SO4
N N
H H
NaNO2
t
N N
азобензол
26
27.
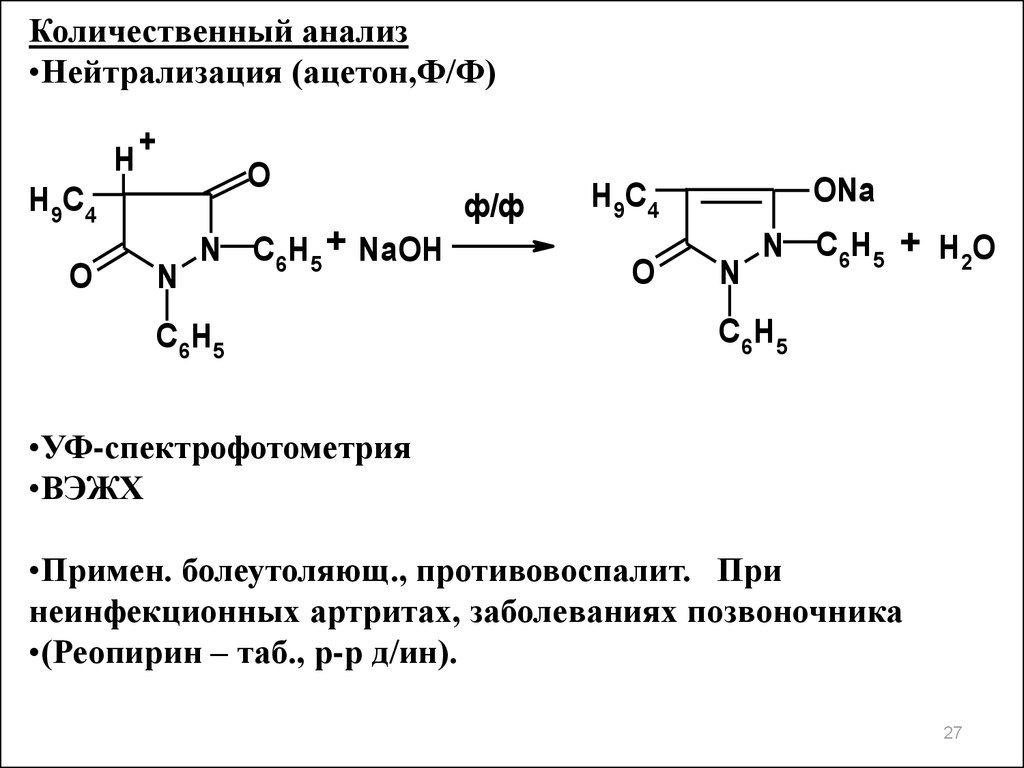
Количественный анализ•Нейтрализация (ацетон,Ф/Ф)
H
+
O
H9C4
O
N
N C6H5 + NaOH
C6H5
ф/ф
ONa
H9C4
O
N
N C6H5 + H2O
C6H5
•УФ-спектрофотометрия
•ВЭЖХ
•Примен. болеутоляющ., противовоспалит. При
неинфекционных артритах, заболеваниях позвоночника
•(Реопирин – таб., р-р д/ин).
27
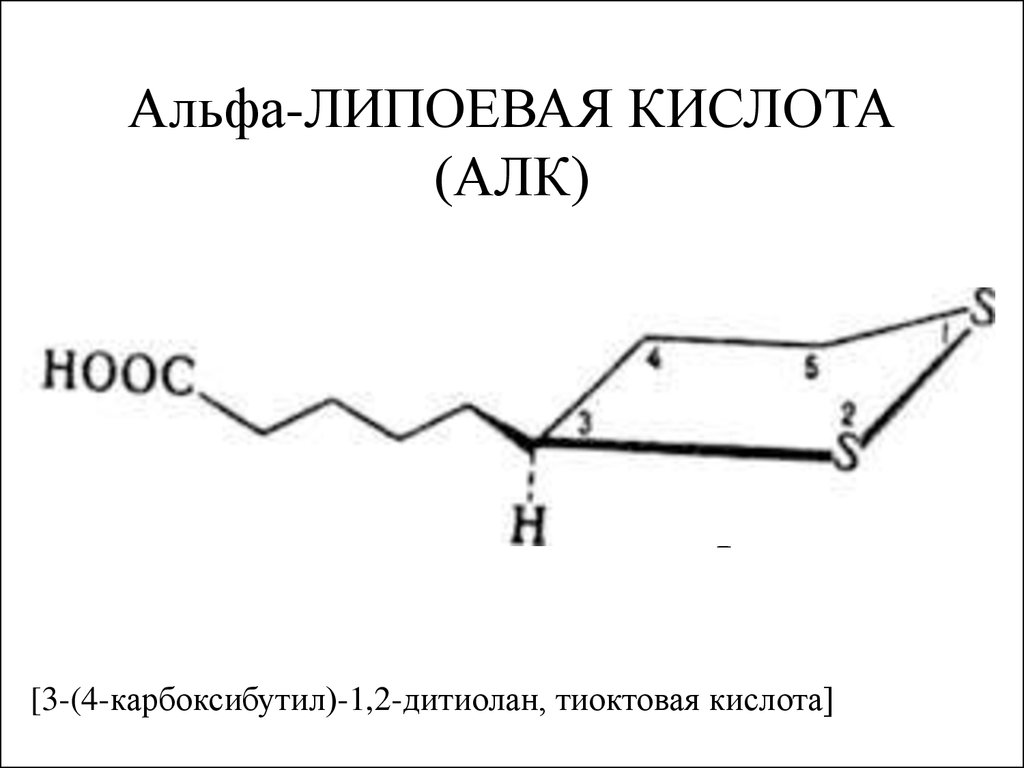
28. Альфа-ЛИПОЕВАЯ КИСЛОТА (АЛК) (Асidum lipoicum, Acidum thiocticum, Biletan, Heparlipon, Protogen, Thioctacid, Thioctan, Tioctacid, Tioctan и дp.) .
[3-(4-карбоксибутил)-1,2-дитиолан, тиоктовая кислота]29.
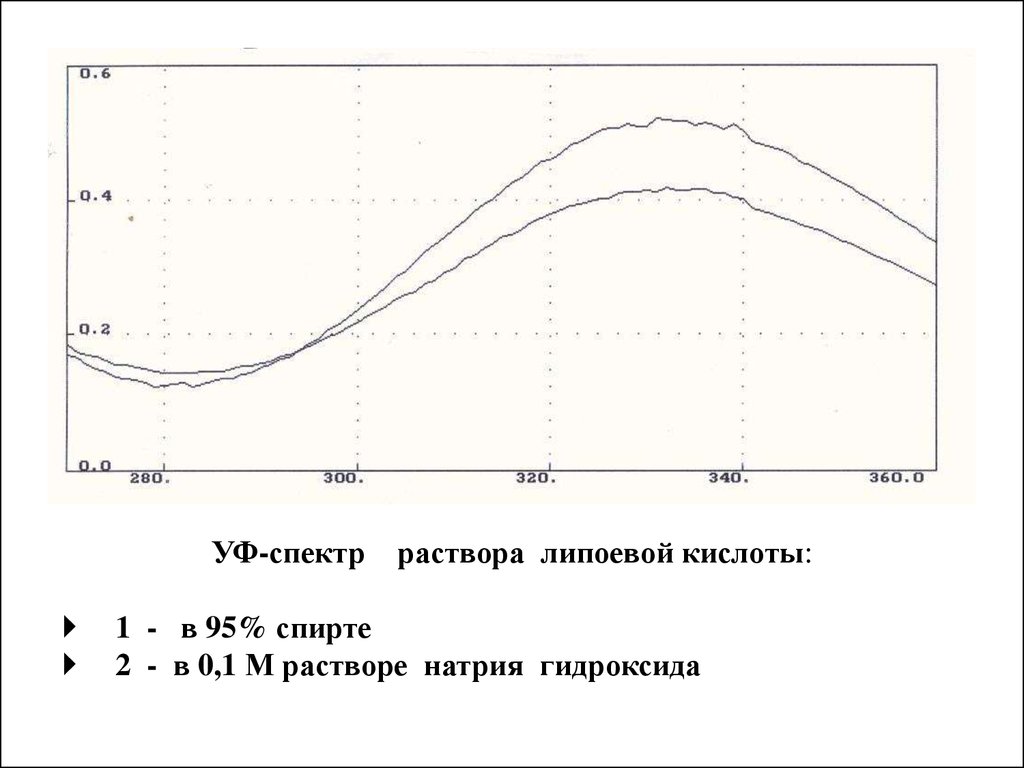
УФ-спектрраствора липоевой кислоты:
1 - в 95% спирте
2 - в 0,1 М растворе натрия гидроксида
30. Химическая идентификация липоевой кислоты
После минерализации с раствором натрия гидроксида, цинковой пылью и добавлении растворов калияферрицианида и хлорида железа (III) - синее
окрашивание (дисульфидная группа)
- после минерализации с раствором натрия гидроксида, цинковой пылью и добавлении раствора раствора
серебра нитрата - выпадение серого осадка
металлического серебра (дисульфидная группа)
- с раствором кобальта нитрата - выпадение осадка
серовато-розового цвета (карбоксильная группа)
31. Применение в медицинской практике
Опыт использования препаратов АЛК в ведущих клиниках позволил сделатьвывод об их высокой эффективности при ряде широко распространенных
заболеваний в эндокринологии, урологии, токсикологии, сексопатологии,
гастроэнтерологии, хирургии и гепатологии. Проведенные многочисленные
клинические исследования доказали их высокую эффективность при лечении
диабетических поражений нервной системы — диабетической дистальной
полинейропатии, энцефалопатии, синдроме диабетической стопы,
диабетической автономной нейропатии сердца и желудочно-кишечного
тракта, а также эректильной дисфункции. Терапевтический успех препаратов
АЛК при диабетических поражениях нервной системы обусловлен прежде
всего патогенетической направленностью их действия и способностью активно
накапливаться в периферической нервной ткани. Помимо метаболической
нейропатии, выраженный эффект АЛК отмечен при различных токсических
(алкогольной, экзогенной, эндогенной) и травматических полинейропатиях,
а также при ряде других заболеваний. В основе нейропротективного действия
лежит тот факт, что АЛК способствует нормализации нарушенного обмена
в нервных клетках и положительно влияет на аксональный транспорт.
В медицинской практике с лечебной целью используется ряд препаратов АЛК,
которые представлены ее тремя основными солями: этилендиаминовой
(препараты Берлитион и Эспа-липон), трометамоловой (препарат Тиоктацид)
и меглюминовой (препараты Диалипон и Тиогамма).
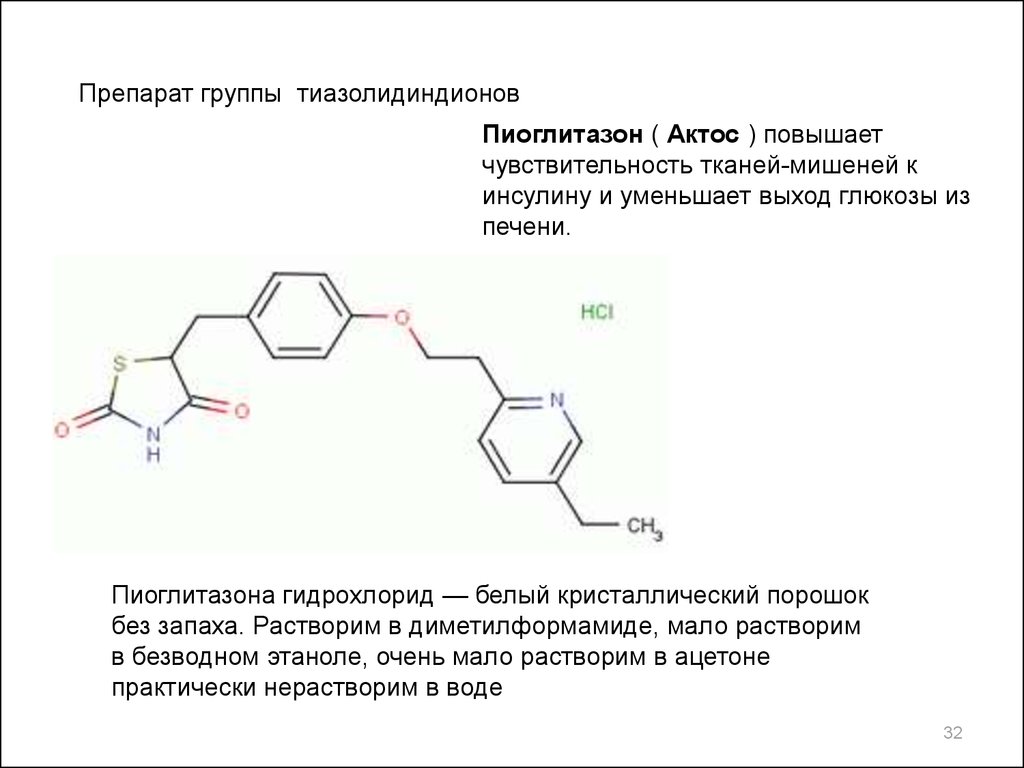
32.
Препарат группы тиазолидиндионовПиоглитазон ( Актос ) повышает
чувствительность тканей-мишеней к
инсулину и уменьшает выход глюкозы из
печени.
Пиоглитазона гидрохлорид — белый кристаллический порошок
без запаха. Растворим в диметилформамиде, мало растворим
в безводном этаноле, очень мало растворим в ацетоне
практически нерастворим в воде
32
33.
Пилокарпина гидрохлоридH
C 2H 5
O
3
2 O
1
H
4
1
N
5
CH 2
5
4
N
3
CH 3
●HCL
2
1N-метил-5-гомопилопилимидазола гидрохлорид
H
H
O
COOH
C2H5
гомопилоповая
кислота, цис-форма
O
33
34.
Pilocarpus Jaborandi.французский химик Харди в 1875 г. в
листьях содержится до 0,9% алкалоидов,
главным из которых является пилокарпин.
34
35.
1933 г. Н.А.Преображенскийi
1 получение пилоповой
кислоты (d-цис-изомер)
4
2 получение гомопилоповой кислоты
3. получение
пилокарпина
Подлинность
1. ИК-спектр
1590 – 1900 см‾¹; 1585 – 1680 см‾¹
C O
C C
1435 – 1470 см
2. tпл
199 – 205 ºС
C
CH3
3. [α] +88,5 -91,5 ºС (основание)
4. ТСХ; проявитель – КВiI4
35
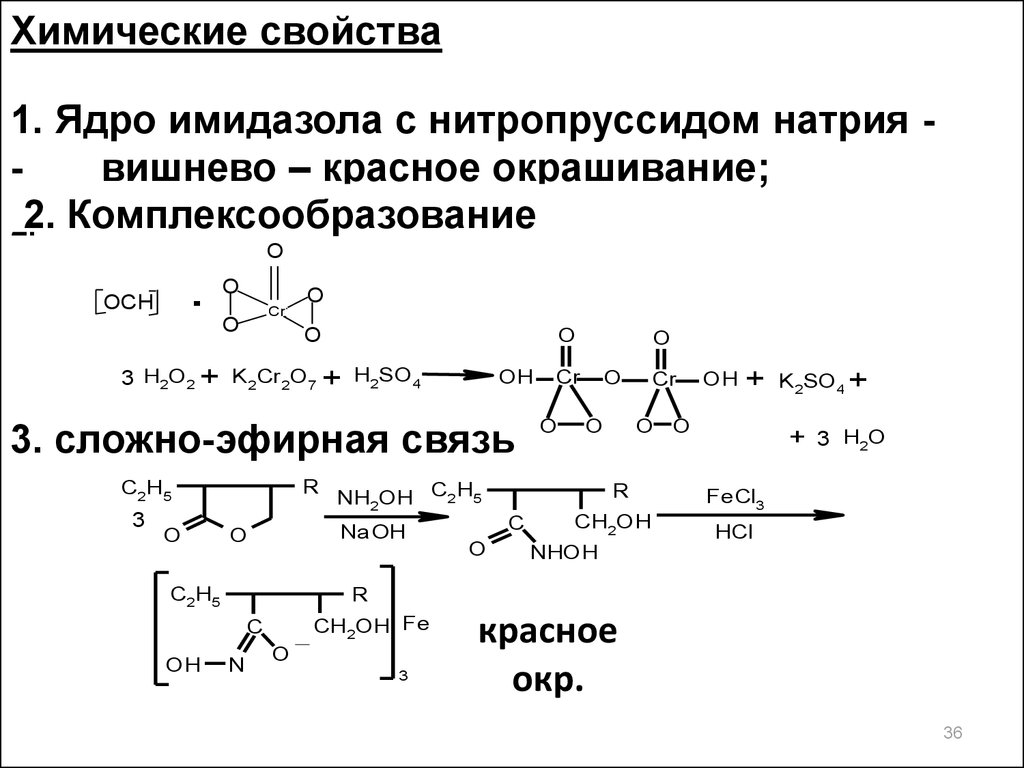
36.
Химические свойства1. Ядро имидазола с нитропруссидом натрия вишнево – красное окрашивание;
22.
. Комплексообразование
O
.
OCH
O
Cr
O
O
O
O
3 H2O2 + K2Cr2O7 + H2SO4
OH
3. сложно-эфирная связь
R
C2H5
3
O
C2H5
O
O
O
OH
+
O O
R
C
O
Cr
CH2OH
K2SO4 +
+3
H2O
FeCl3
HCl
NHOH
R
CH2OH Fe
C
OH
Cr
NH2OH C2H5
NaOH
O
O
N
O
3
красное
окр.
36
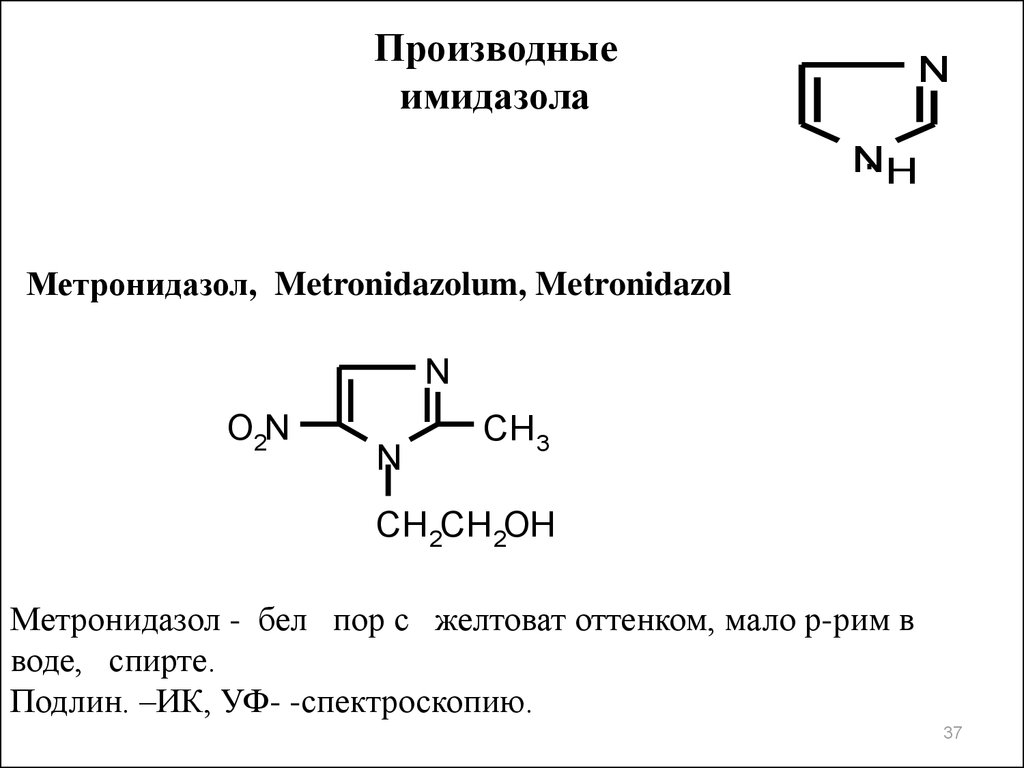
37.
Производныеимидазола
N
NH
Метронидазол, Metronidazolum, Metronidazol
N
O2N
N
CH 3
CH 2CH 2OH
Метронидазол - бел пор с желтоват оттенком, мало р-рим в
воде, спирте.
Подлин. –ИК, УФ- -спектроскопию.
37
38.
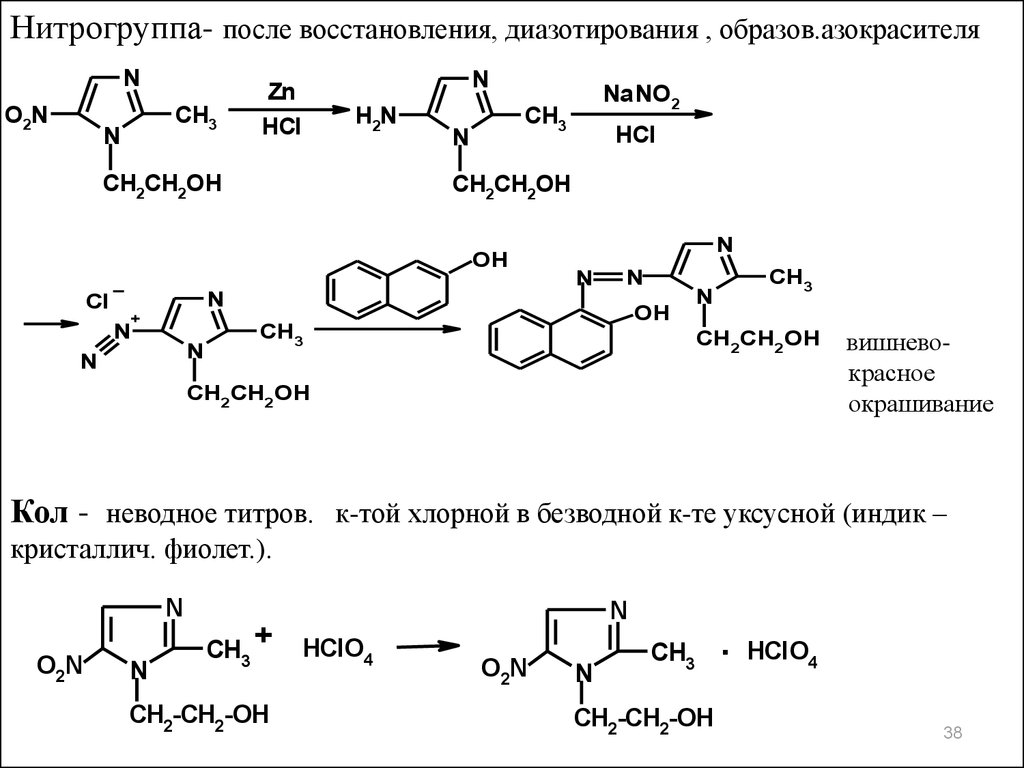
Нитрогруппа- после восстановления, диазотирования , образов.азокрасителяN
O2N
CH3
N
N
Zn
HCl
H2N
CH2CH2OH
NaNO2
CH3
N
HCl
CH2CH2OH
OH
N
N
N
N
Cl
+
N
N
N
OH
CH3
CH3
N
CH2CH2 OH
CH2CH2 OH
вишневокрасное
окрашивание
Кол - неводное титров. к-той хлорной в безводной к-те уксусной (индик –
кристаллич. фиолет.).
N
O2N
N
CH3 +
CH2-CH2-OH
N
HClO4
O2N
N
CH3
CH2-CH2-OH
.
HClO4
38
39.
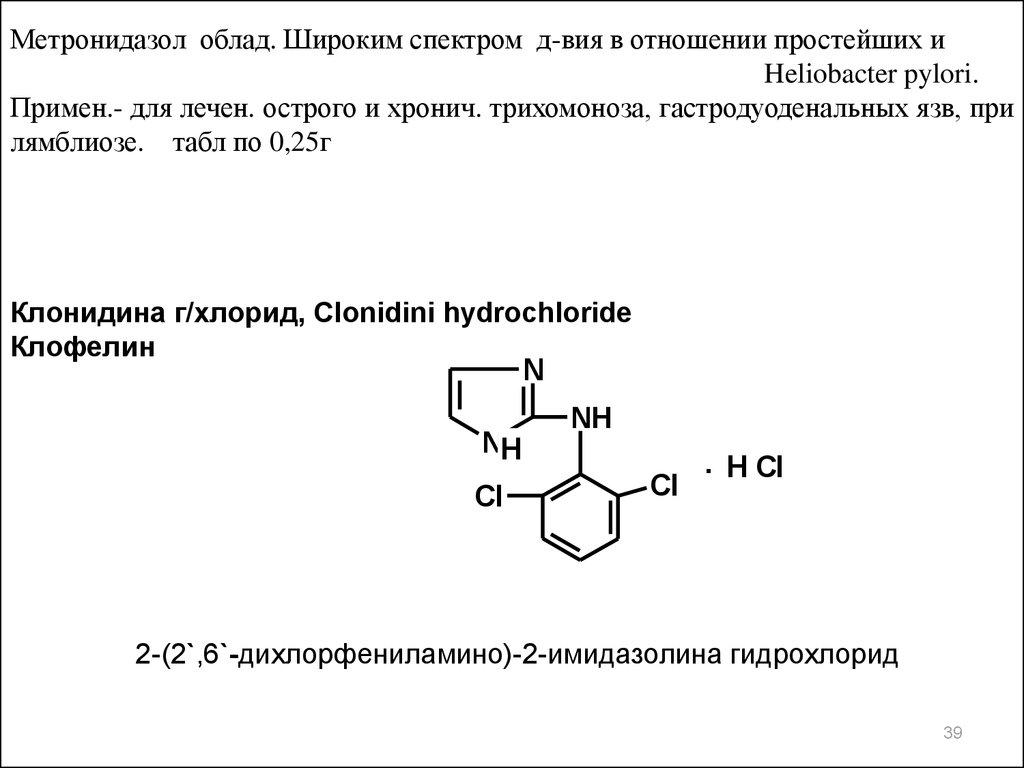
Метронидазол облад. Широким спектром д-вия в отношении простейших иHeliobacter pylori.
Примен.- для лечен. острого и хронич. трихомоноза, гастродуоденальных язв, при
лямблиозе. табл по 0,25г
Клонидина г/хлорид, Clonidini hydrochloride
Клофелин
N
NH
Cl
NH
Cl
. H Cl
2-(2`,6`-дихлорфениламино)-2-имидазолина гидрохлорид
39
40.
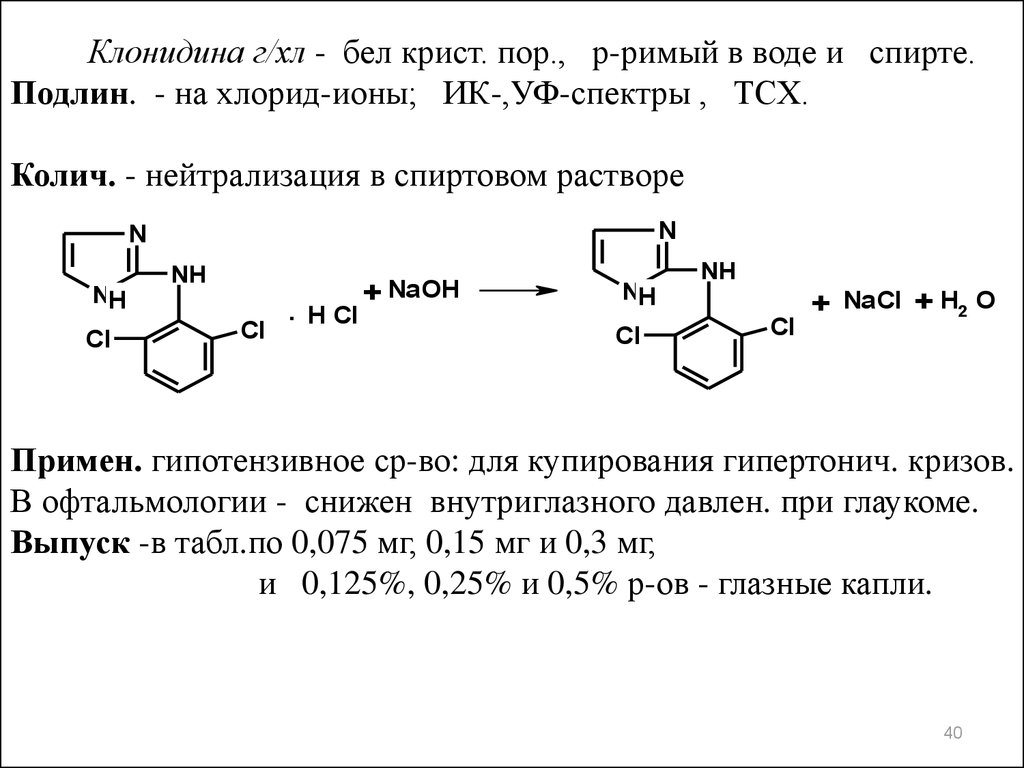
Клонидина г/хл - бел крист. пор., р-римый в воде и спирте.Подлин. - на хлорид-ионы; ИК-,УФ-спектры , ТСХ.
Колич. - нейтрализация в спиртовом растворе
N
N
NH
Cl
NH
Cl
. H Cl
+ NaOH
NH
Cl
NH
Cl
+ NaCl + H2 O
Примен. гипотензивное ср-во: для купирования гипертонич. кризов.
В офтальмологии - снижен внутриглазного давлен. при глаукоме.
Выпуск -в табл.по 0,075 мг, 0,15 мг и 0,3 мг,
и 0,125%, 0,25% и 0,5% р-ов - глазные капли.
40
41.
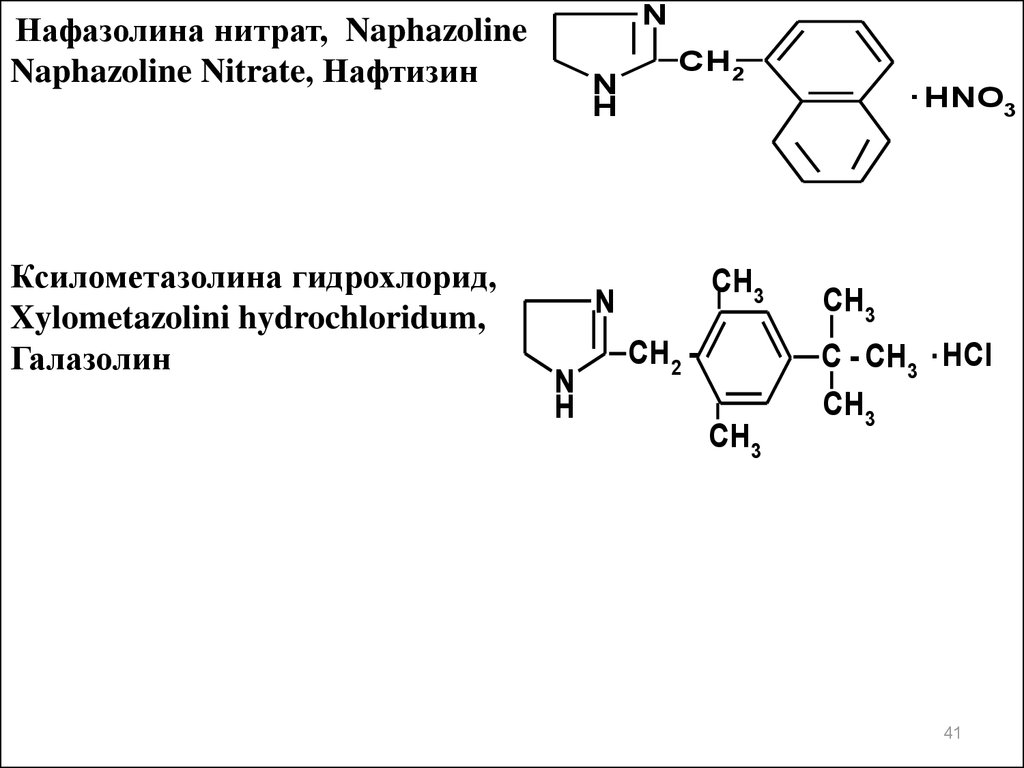
NНафазолина нитрат, Naphazoline
Naphazoline Nitrate, Нафтизин
Ксилометазолина гидрохлорид,
Xylometazolini hydrochloridum,
Галазолин
N
H
CH 2
3
CH 3
N
N
H
. HNO
CH 2 CH 3
CH 3
C - CH 3 . HCl
CH 3
41
42.
Количественное определение1. Неводное титрование:
среда: ЛУК + (CН3СОО)2Нg
титрант: НСLO4
индикатор – кристаллический фиолетовый;
2. По НСl (среда – спирт)
а) с NaOH потенциометрически
б) с NаОН по ф/ф
3. Иодиметрия (обратная): [OCH.] * I2 *H I
42
43.
Получ.- по реакции нитрила нафтилуксусной к-ты с этилендиаминомCH 2- C
N
N
+
NH 2 CH
2
NH 2
CH 2
N
H
CH 2
нафазолин
Ксилометазолин --- аналогично получают
Оба ЛС – бел. крист. пор., легко р- римы в воде и спирте
Идентиф.– нафазолин -нитрат-ионы с дифениламином в конц. Н2SO4
Ксилометазолин - хлорид-ионы с AgNO3.
Оба ЛС с р-ром натрия нитропруссида [Na2Fe (CN)6NO2 ] в щелоч.
среде образ фиолетовое окраш.
-- ИК-, УФ-спектры
Колич. - Кислотно-основное титрование 0,1 М HClO 4 в среде
уксусного ангидрида43
44.
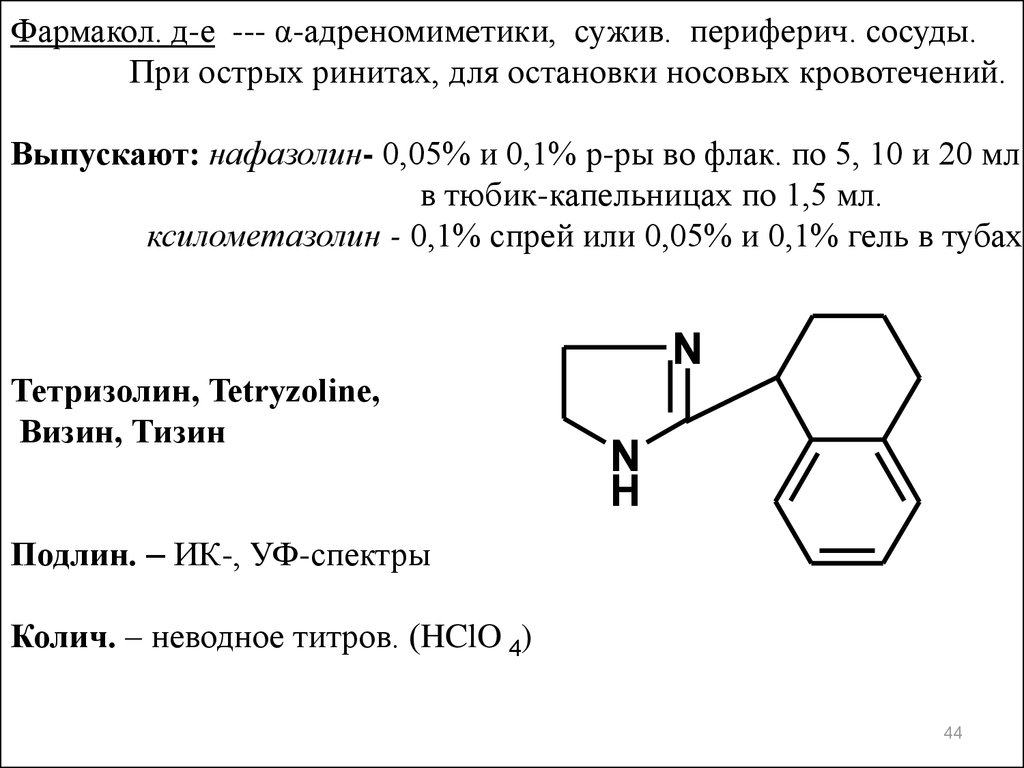
Фармакол. д-е --- α-адреномиметики, сужив. периферич. сосуды.При острых ринитах, для остановки носовых кровотечений.
Выпускают: нафазолин- 0,05% и 0,1% р-ры во флак. по 5, 10 и 20 мл
в тюбик-капельницах по 1,5 мл.
ксилометазолин - 0,1% спрей или 0,05% и 0,1% гель в тубах.
Тетризолин, Tetryzoline,
Визин, Тизин
N
N
H
Подлин. – ИК-, УФ-спектры
Колич. – неводное титров. (HClO 4)
44
45.
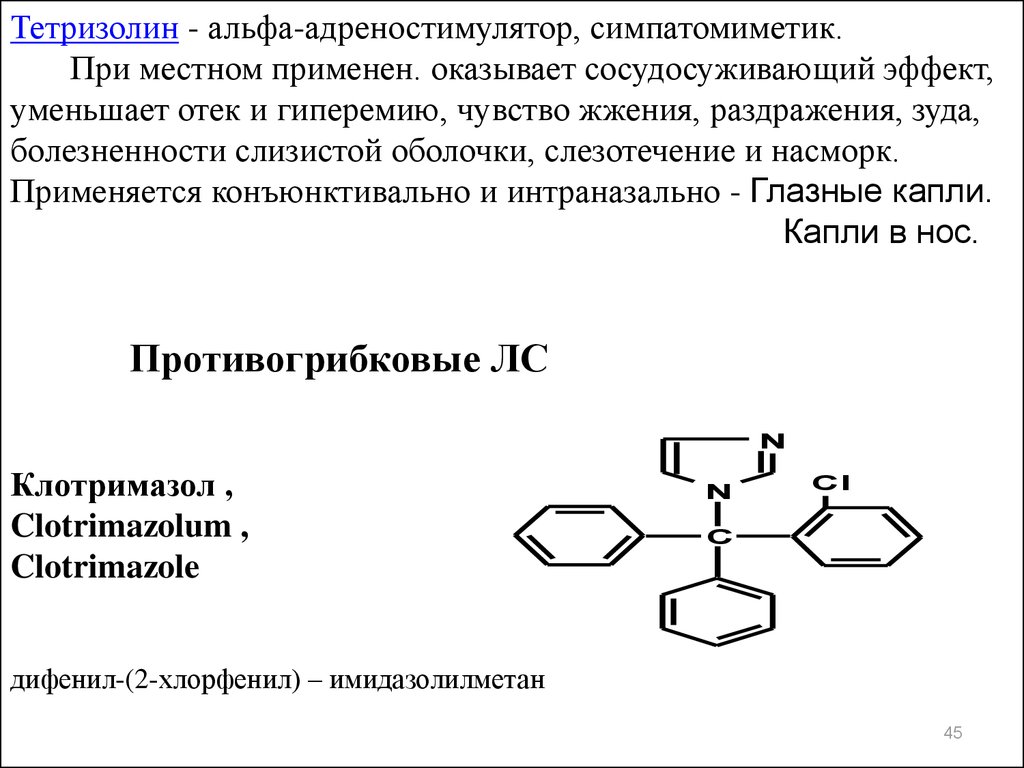
Тетризолин - альфа-адреностимулятор, симпатомиметик.При местном применен. оказывает сосудосуживающий эффект,
уменьшает отек и гиперемию, чувство жжения, раздражения, зуда,
болезненности слизистой оболочки, слезотечение и насморк.
Применяется конъюнктивально и интраназально - Глазные капли.
Капли в нос.
Противогрибковые ЛС
N
Клотримазол ,
Clotrimazolum ,
Clotrimazole
N
Cl
C
дифенил-(2-хлорфенил) – имидазолилметан
45
46.
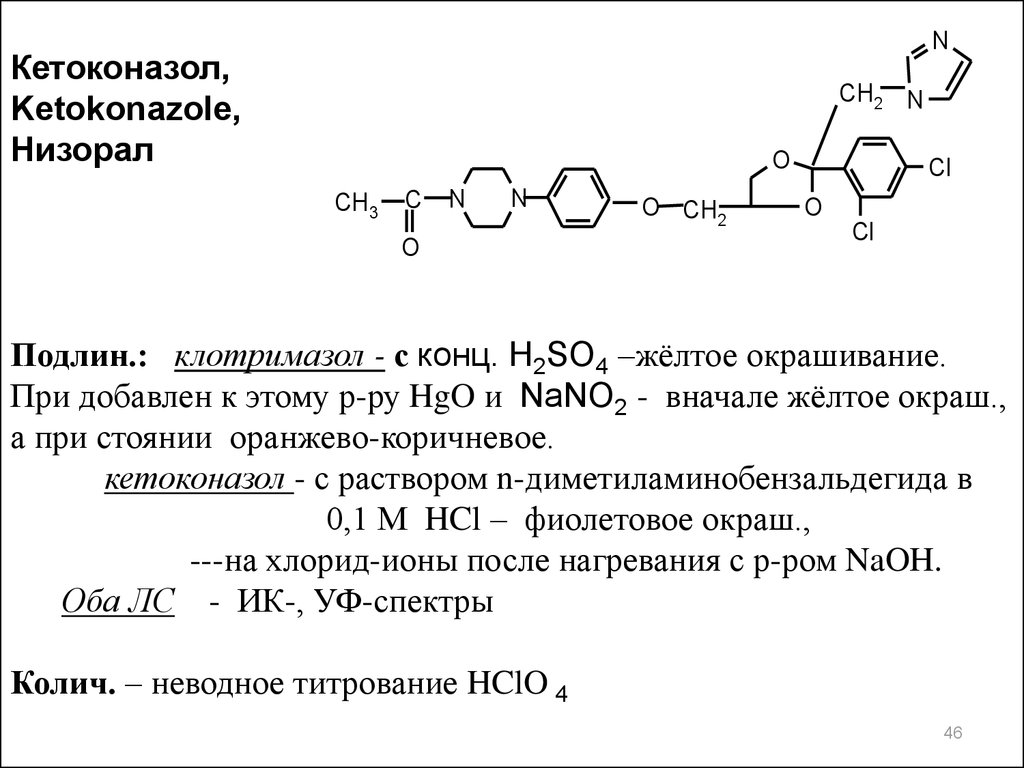
NКетоконазол,
Ketokonazole,
Низорал
CH2 N
O
CH3
C
N
N
O
O CH2
Cl
O
Cl
Подлин.: клотримазол - с конц. H2SO4 –жёлтое окрашивание.
При добавлен к этому р-ру HgO и NaNO2 - вначале жёлтое окраш.,
а при стоянии оранжево-коричневое.
кетоконазол - с раствором n-диметиламинобензальдегида в
0,1 М HCl – фиолетовое окраш.,
---на хлорид-ионы после нагревания с р-ром NaOH.
Оба ЛС - ИК-, УФ-спектры
Колич. – неводное титрование HClO 4
46
47.
Применен. - при поражениях кожи, трихомонозе, вульвовагините.Клотримазол -вагинальные табл. 0,1, 0,2 и 0,5 г,
вагинальный крем 1% и 2% (тубы) по 15,20 и 30г.
Кетоконазол – табл. по 0,2 г, крем, мазь 2% тубы,
суппозитории по 0,4г.
47
48.
1. УФ – спектрофотометрия λ – 215 нм2. Фотометрия λ – 453 нм, по гидроксамату
железа
Глазные капли 0,1% в шприц-тюбиках
Антогонист атропина, при глаукоме
48
49.
4950.
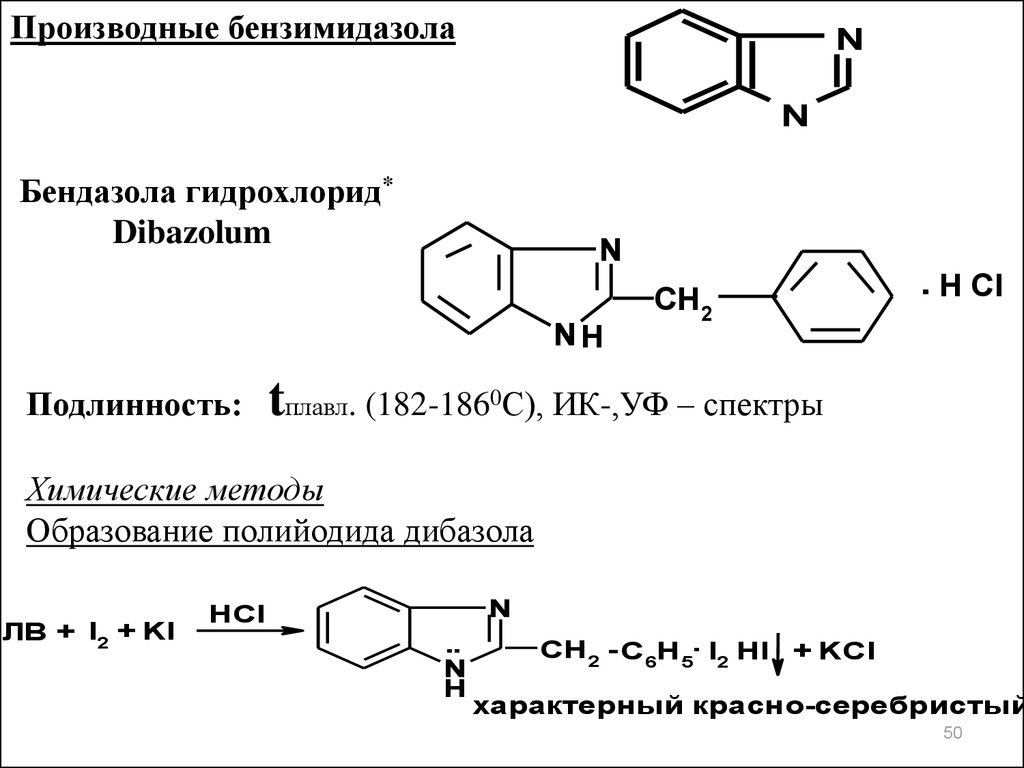
Производные бензимидазолаN
N
Бендазола гидрохлорид*
Dibazolum
N
NH
Подлинность:
CH2
. H Cl
tплавл. (182-1860С), ИК-,УФ – спектры
Химические методы
Образование полийодида дибазола
ЛВ + I2 + KI
N
HCl
..
N
H
CH 2 - C 6H 5. I2 HI + KCl
характерный красно-серебристый
50
51.
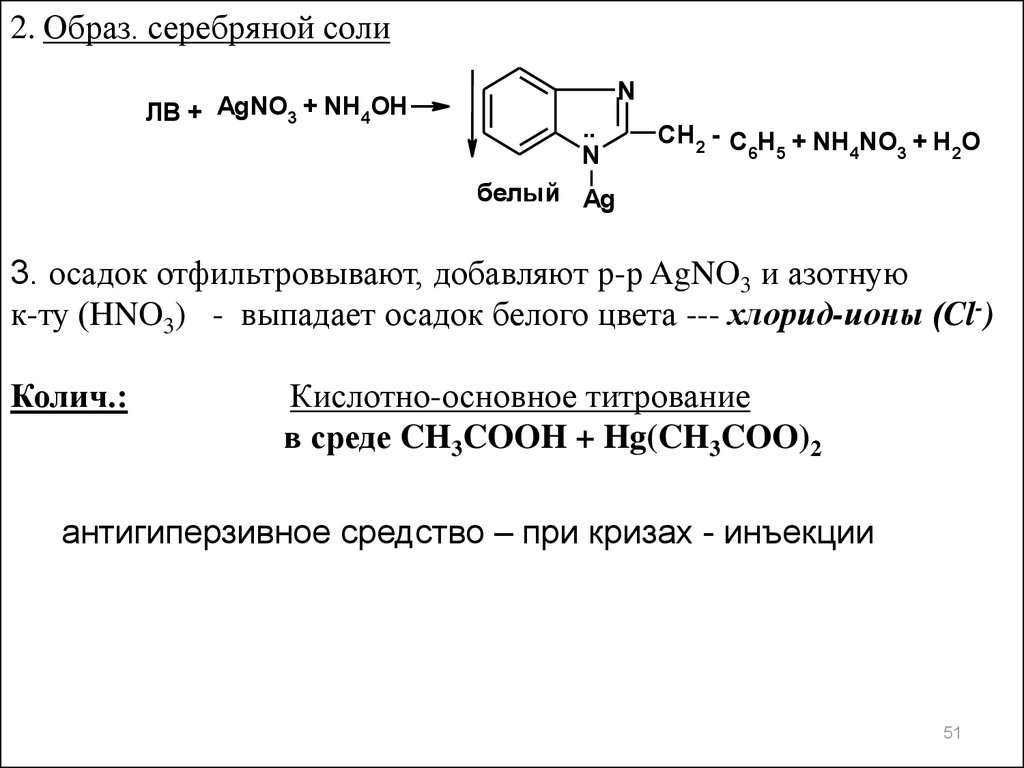
2. Образ. серебряной солиЛВ + AgNO3 + NH 4OH
N
..
N
CH 2 - C H + NH NO + H O
6 5
4
3
2
белый Ag
3. осадок отфильтровывают, добавляют р-р AgNO3 и азотную
к-ту (HNO3) - выпадает осадок белого цвета --- хлорид-ионы (Cl-)
Колич.:
Кислотно-основное титрование
в среде CH3COOH + Hg(CH3COO)2
антигиперзивное средство – при кризах - инъекции
51
52.
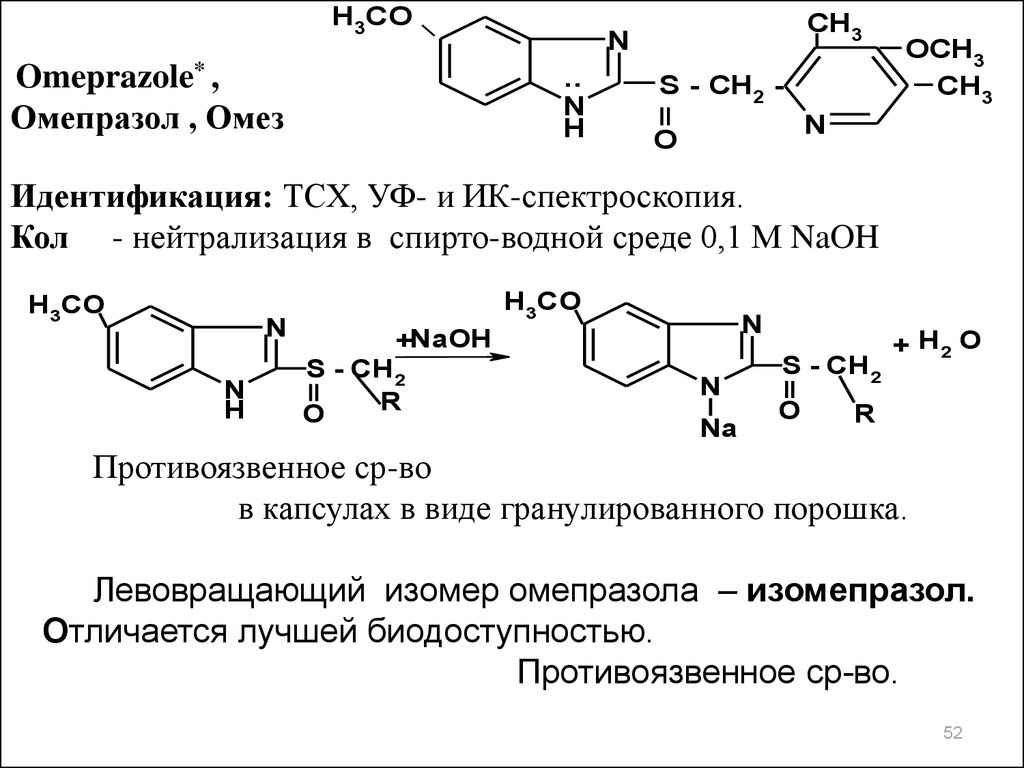
H3COOmeprazole* ,
..
N
H
Омепразол , Омез
CH3
N
S - CH2 -
OCH3
CH3
N
O
Идентификация: ТСХ, УФ- и ИК-спектроскопия.
Кол - нейтрализация в спирто-водной среде 0,1 М NaOH
H 3CO
N
N
H
H 3CO
N
+NaOH
S - CH 2
R
O
N
Na
S - CH 2
O
+ H2 O
R
Противоязвенное ср-во
в капсулах в виде гранулированного порошка.
Левовращающий изомер омепразола – изомепразол.
Отличается лучшей биодоступностью.
Противоязвенное ср-во.
52
53.
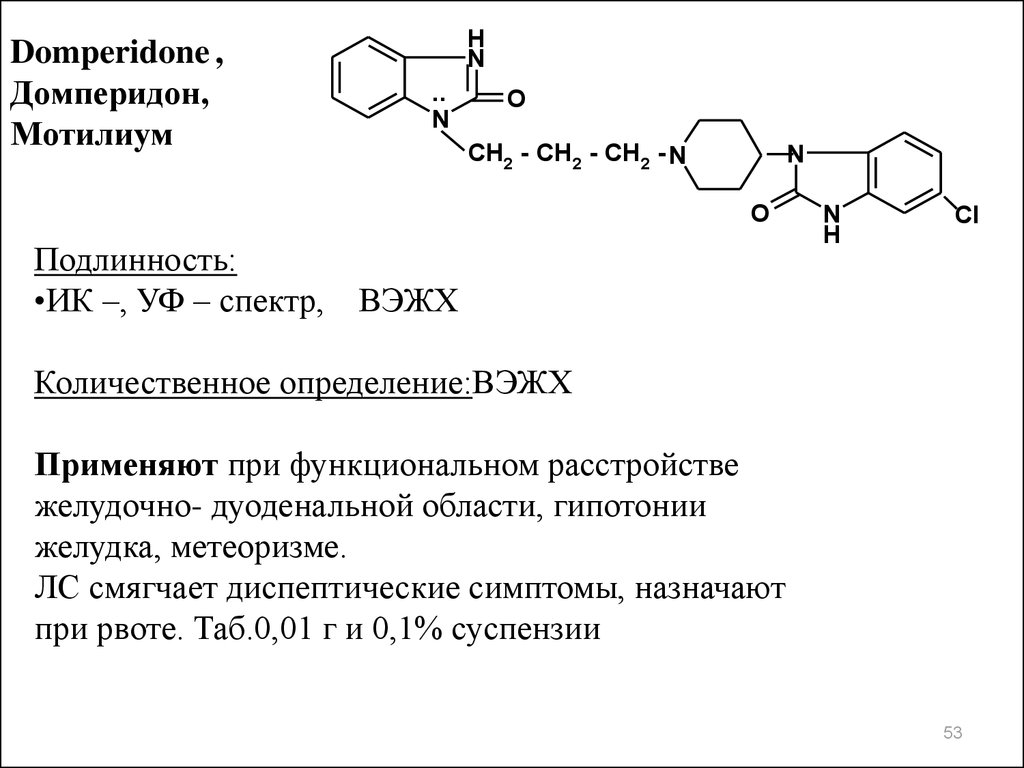
Domperidone ,Домперидон,
Мотилиум
H
N
..
N
O
CH2 - CH2 - CH2 - N
N
O
Подлинность:
•ИК –, УФ – спектр,
N
H
Cl
ВЭЖХ
Количественное определение:ВЭЖХ
Применяют при функциональном расстройстве
желудочно- дуоденальной области, гипотонии
желудка, метеоризме.
ЛС смягчает диспептические симптомы, назначают
при рвоте. Таб.0,01 г и 0,1% суспензии
53
54.
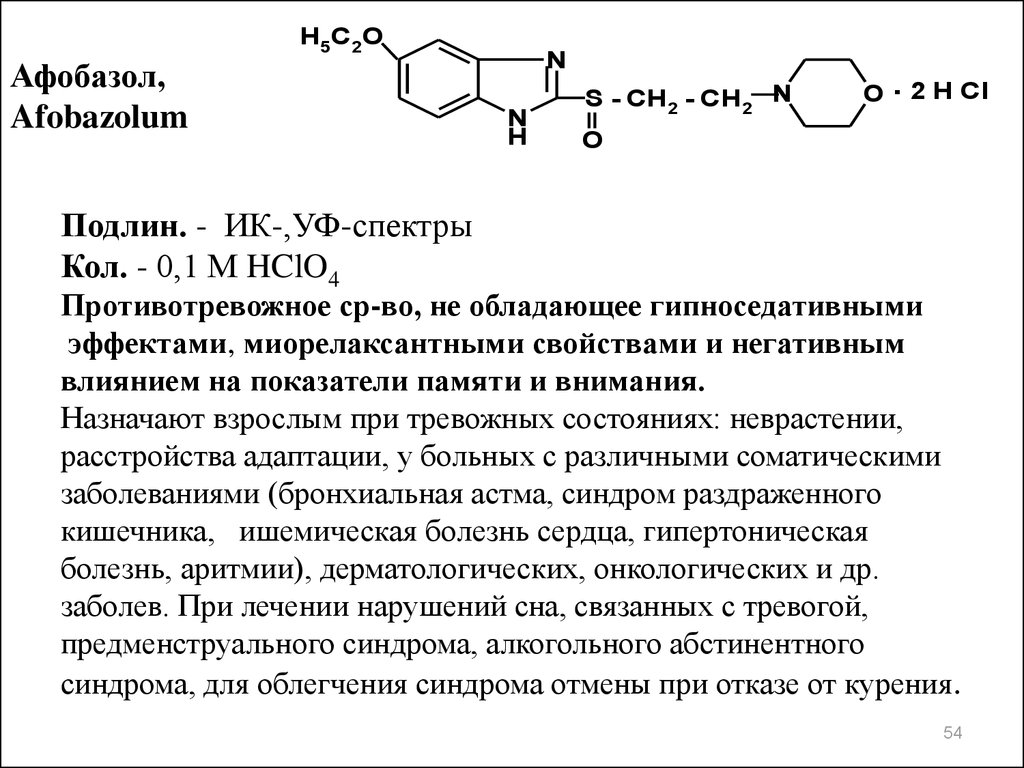
H 5C 2OАфобазол,
Afobazolum
N
N
H
S - CH 2 - CH 2 N
O . 2 H Cl
O
Подлин. - ИК-,УФ-спектры
Кол. - 0,1 М HClO4
Противотревожное ср-во, не обладающее гипноседативными
эффектами, миорелаксантными свойствами и негативным
влиянием на показатели памяти и внимания.
Назначают взрослым при тревожных состояниях: неврастении,
расстройства адаптации, у больных с различными соматическими
заболеваниями (бронхиальная астма, синдром раздраженного
кишечника, ишемическая болезнь сердца, гипертоническая
болезнь, аритмии), дерматологических, онкологических и др.
заболев. При лечении нарушений сна, связанных с тревогой,
предменструального синдрома, алкогольного абстинентного
синдрома, для облегчения синдрома отмены при отказе от курения.
54
55.
Производныепиразола
Производные
имидазола
Феназон
пилокарпин
Метамизол-натрий
гистамин
Фенилбутазон
метронидазол
Пропифеназон
клотримазол
3.Производные
имидазолина
клофелин
нафтизин
галазолин
4.Производные
бензимидазола
дибазол
омепразол
домперидон
нексиум
афабозол
55
56.
5657.
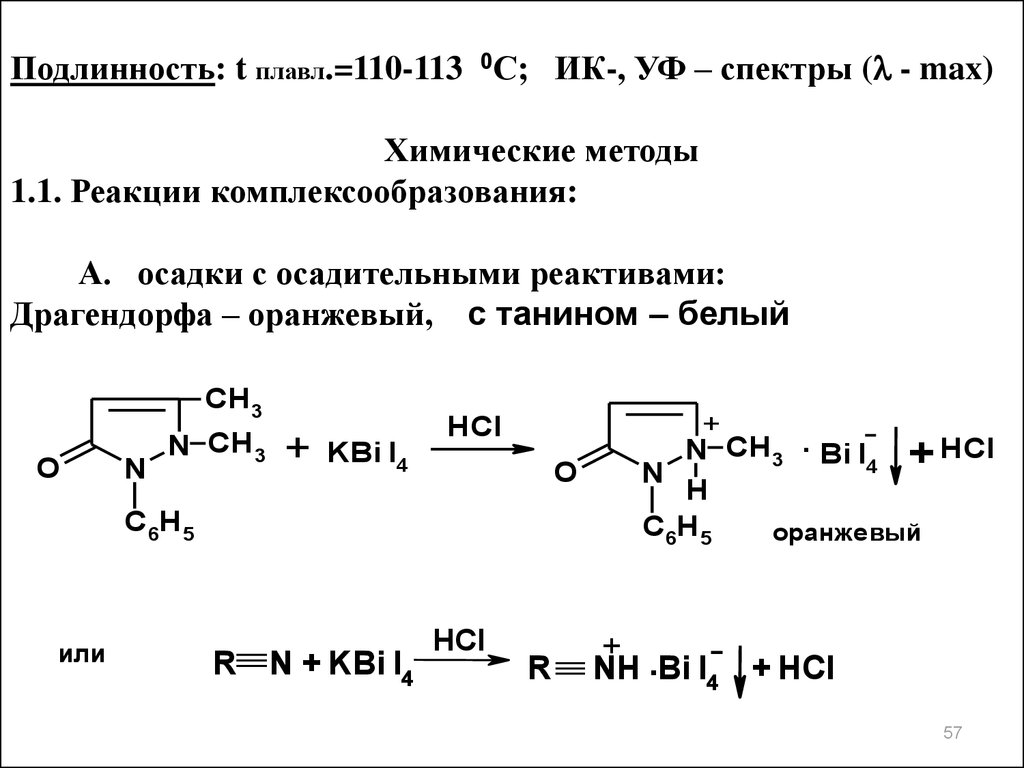
Подлинность: t плавл.=110-113 0С; ИК-, УФ – спектры ( - max)Химические методы
1.1. Реакции комплексообразования:
А. осадки с осадительными реактивами:
Драгендорфа – оранжевый, с танином – белый
CH 3
O
N
N CH 3
+
HCl
KBi I4
O
C 6H 5
или
R N + KBi I4
HCl
R
+
N CH 3 . Bi I4 + HCl
N
H
C 6H 5
оранжевый
+
NH .Bi I4 + HCl
57
























 medicine
medicine chemistry
chemistry








