Similar presentations:
Карбоновые кислоты и их производные
1.
Карбоновые кислоты и их производные.Классификация, номенклатура, изомерия.
Способы получения.
Физические свойства. Образование водородной связи, ее влияние на
физические свойства кислот. Электронное строение карбоксильной
группы, эффект сопряжения.
Общая характеристика реакционной способности карбоновых кислот.
Сравнение кислотных свойств карбоновых кислот со спиртами и
фенолами. Реакции кислот с металлами и основаниями с образованием
солей. Качественная реакция на карбоксильную группу.
Реакции нуклеофильного замещения гидроксильной группы кислот,
приводящие к образованию функциональных производных кислот:
сложных эфиров, галогенангидридов, ангидридов, амидов. Реакции
нитрования, сульфирования, галогенирования ароматических карбоновых
кислот). Основные представители: муравьиная, уксусная, бензойная,
салициловая кислоты и их применение.
2. Функциональные производные карбоновых кислот. Соли карбоновых кислот. Номенклатура, способы получения. Химические свойства:
гидролиз,декарбоксилирование,
пиролиз.
Галогенангидриды
кислот.
Номенклатура,
способы
получения.
Химические свойства: реакции замещения галогена на нуклеофильные реагенты
(кислотный
и
щелочной
гидролиз,
алкоголиз,
аммонолиз).
Ангидриды кислот. Номенклатура. Способы получения: дегидратация
карбоновых кислот, ацилирование солей карбоновых кислот. Химические свойства.
Сложные эфиры. Номенклатура. Способы получения: алкилирование
солей карбоновых кислот, ацилирование спиртов и фенолов галогенангидридами и
ангидридами карбоновых кислот, реакция этерификации. Химические свойства:
гидролиз в кислой и щелочной средах, переэтерификация, аммонолиз,
восстановление
металлическим
натрием.
Амиды кислот. Номенклатура. Способы получения: взаимодействие
карбоновых кислот с аммиаком, ацилирование аммиака или аминов ангидридами,
галогенангидридами и сложными эфирами кислот, гидролиз нитрилов. Химические
свойства.
Двухосновные
карбоновые
кислоты,
номенклатура,
изомерия.
Особенности их химических свойств: изменение кислотности, образование двух
рядов производных, отношение к нагреванию. Основные представители:
щавелевая, молоновая, янтарная, адипиновая и фталевые кислоты. Применение
адипиновой и фталевой кислот в синтезе полиэфиров и полиамидов.
3.
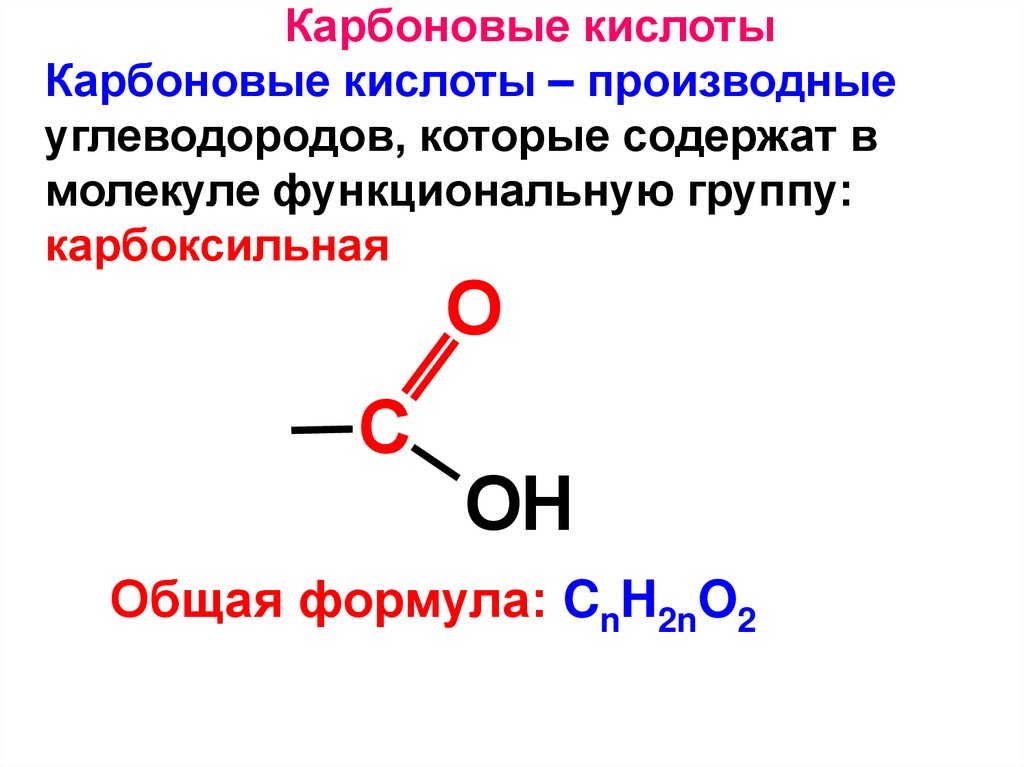
Карбоновые кислотыКарбоновые кислоты – производные
углеводородов, которые содержат в
молекуле функциональную группу:
карбоксильная
O
C
OH
Общая формула: CnH2nO2
4.
5.
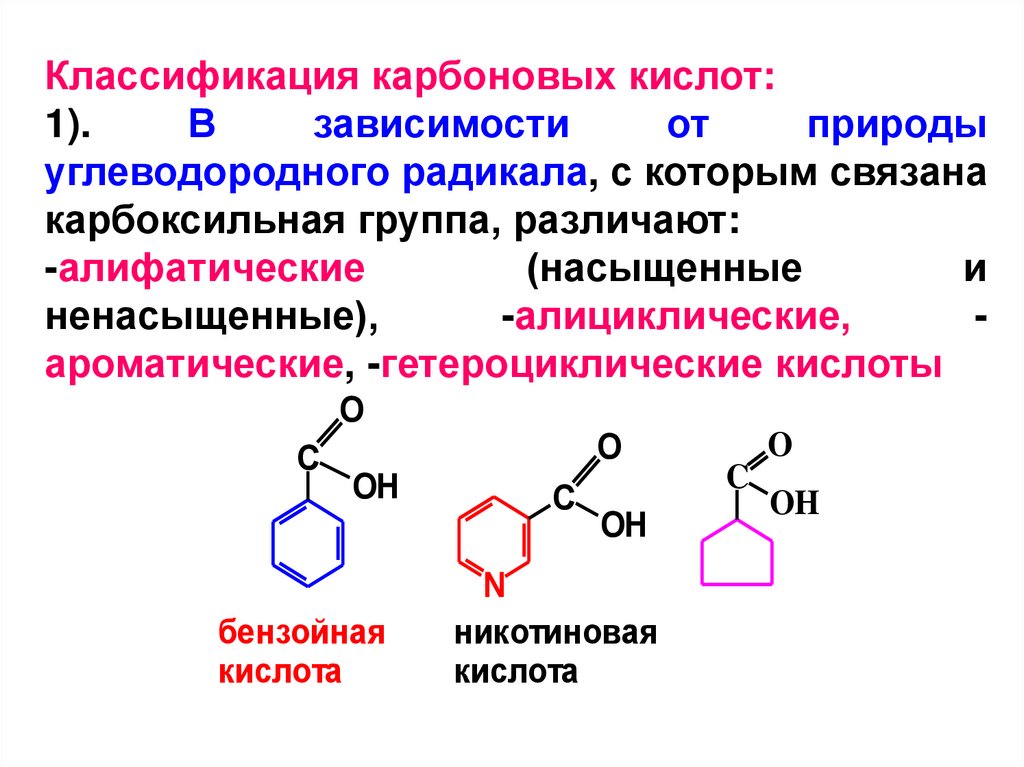
Классификация карбоновых кислот:1).
В
зависимости
от
природы
углеводородного радикала, с которым связана
карбоксильная группа, различают:
-алифатические
(насыщенные
и
ненасыщенные),
-алициклические,
ароматические, -гетероциклические кислоты
O
С
OH
бензойная
кислота
O
C
OH
N
никотиновая
кислота
O
C
OH
6.
2). По числу карбоксильных групп:- монокарбоновые- одноосновные
- дикарбоновые - двухосновные
- трикарбоновые и т.д.
7.
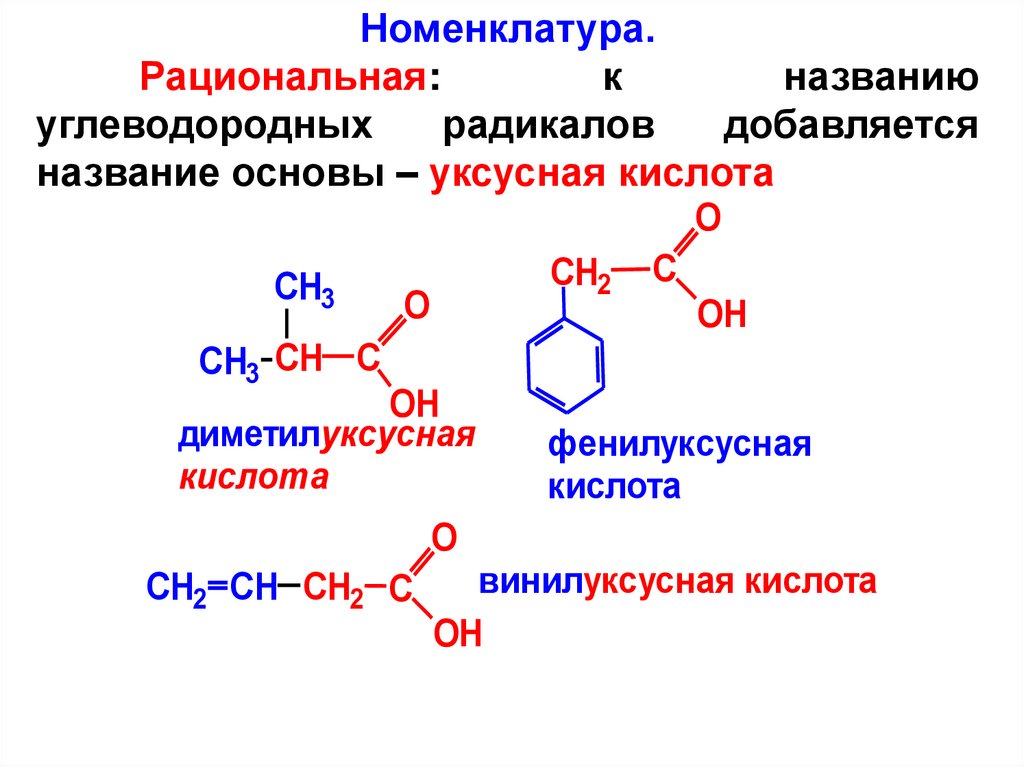
Номенклатура.Рациональная:
к
названию
углеводородных
радикалов
добавляется
название основы – уксусная кислота
O
CH3
CH2
O
С
ОH
СH3 CH C
OH
диметилуксусная
кислота
фенилуксусная
кислота
O
CH2 CH CH2 С
винилуксусная кислота
ОH
8.
Систематическая:название
кислот
производят
от
соответствующего
углеводорода, добавляя суффикс -овая, атом
углерода карбоксильной группы начинает
нумерацию;
1
2
3
4
O
СH2 CH CH2 C
ОH
бутен-3-овая кислота
5
4
3
2
1
СH3 CH CH2 CH C
OH
Cl
O
ОH
9.
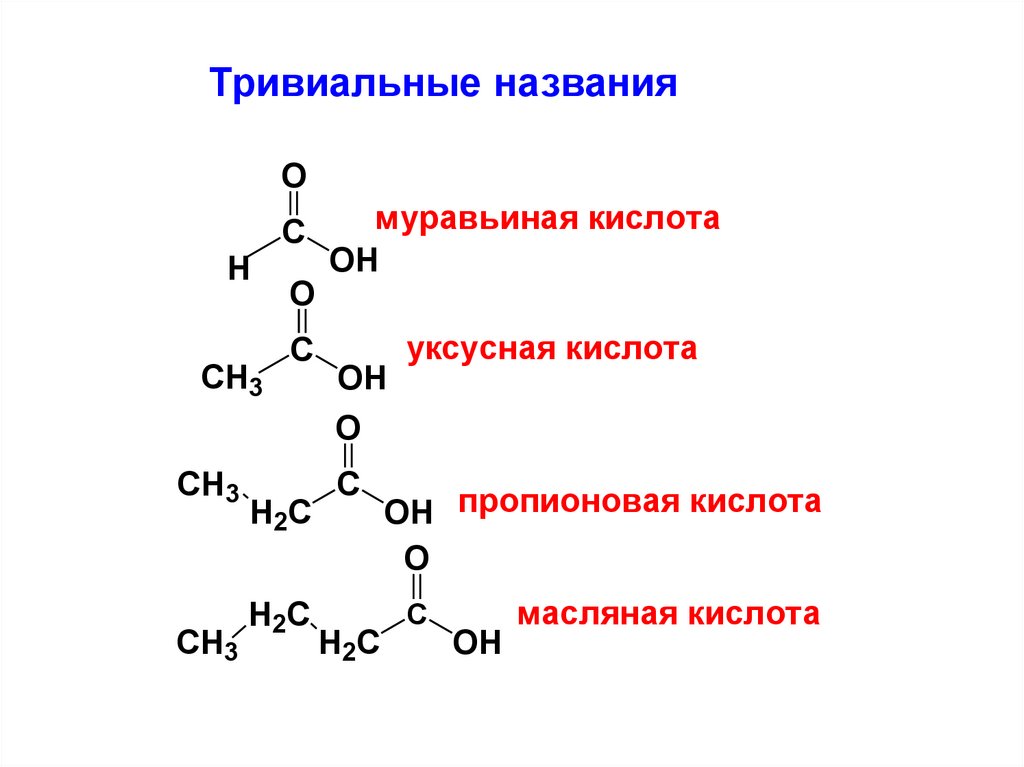
Тривиальные названияO
H
CH3
С
O
С
муравьиная кислота
OH
OH
уксусная кислота
O
CH3
CH3
H2C
H2C
С
H2C
OH пропионовая кислота
O
С
OH
масляная кислота
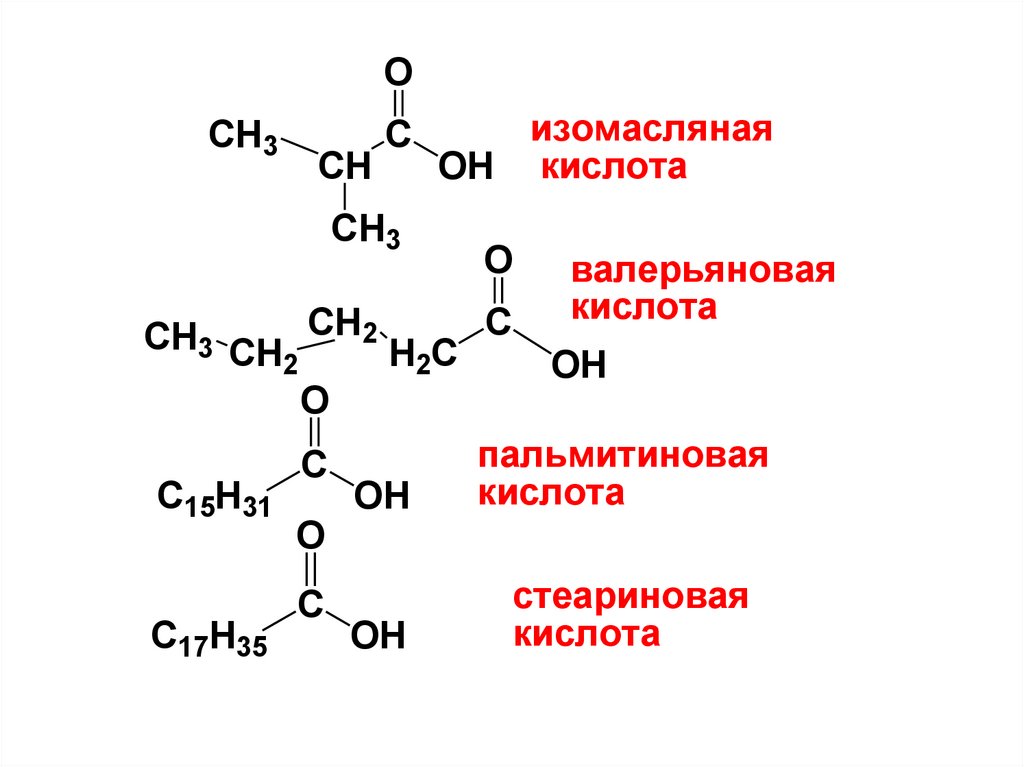
10.
OCH3
CH
изомасляная
OH кислота
С
CH3
O
CH3 CH CH2 H C С
2
C15H31
C17H35
2
O
С
O
С
валерьяновая
кислота
OH
OH
пальмитиновая
кислота
OH
стеариновая
кислота
11.
Способы получения1.ЖЕСТКОЕ ОКИСЛЕНИЕ УВ:
-АЛКАНОВ
-АЛКЕНОВ
-АЛКИНОВ
CH3
CH3-C=CH2-CH3
O
KMnO4
H2SO4
O
CH3-C-CH3 + H3C C
-MnO2
OH
12.
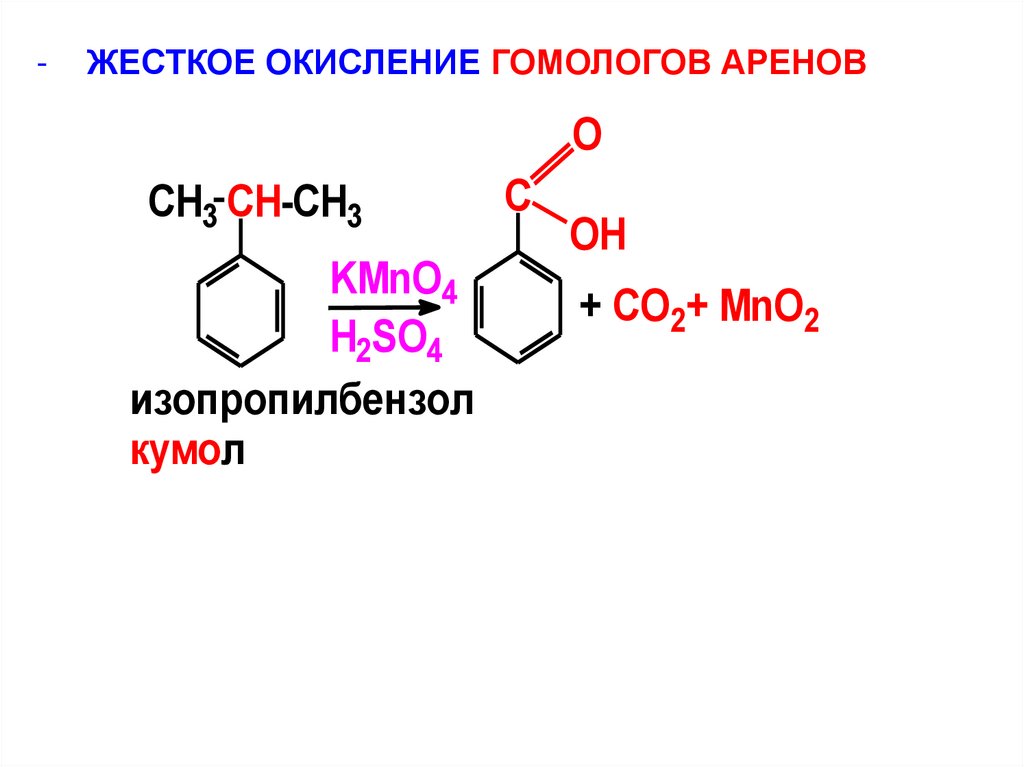
-ЖЕСТКОЕ ОКИСЛЕНИЕ ГОМОЛОГОВ АРЕНОВ
O
CH3 CH-CH3
KMnO4
H2SO4
изопропилбензол
кумол
C
OH
+ CO2+ MnO2
13.
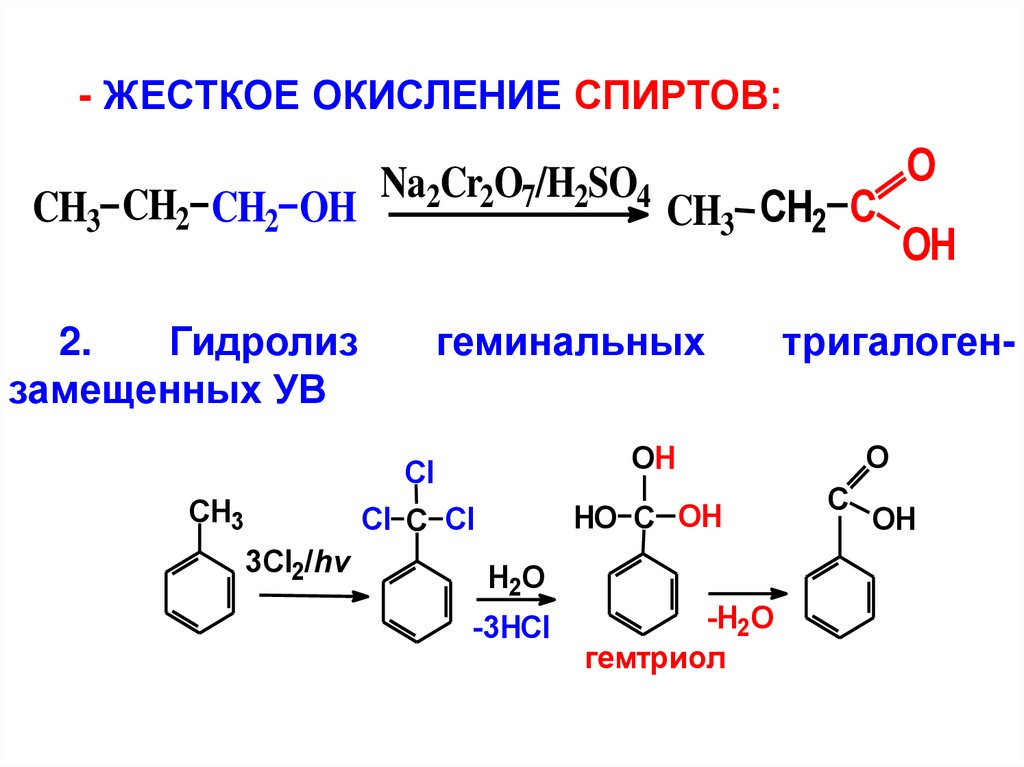
- ЖЕСТКОЕ ОКИСЛЕНИЕ СПИРТОВ:CH3 CH2 CH2 OH
2.
Гидролиз
замещенных УВ
Na2Cr2O7/H2SO4
геминальных
3Cl2/hv
HO C OH
H2O
-3HCl
-H2O
гемтриол
ОH
тригалогенO
OH
Cl
Cl C Cl
CH3
CH3 CH2 C
O
C
OH
14.
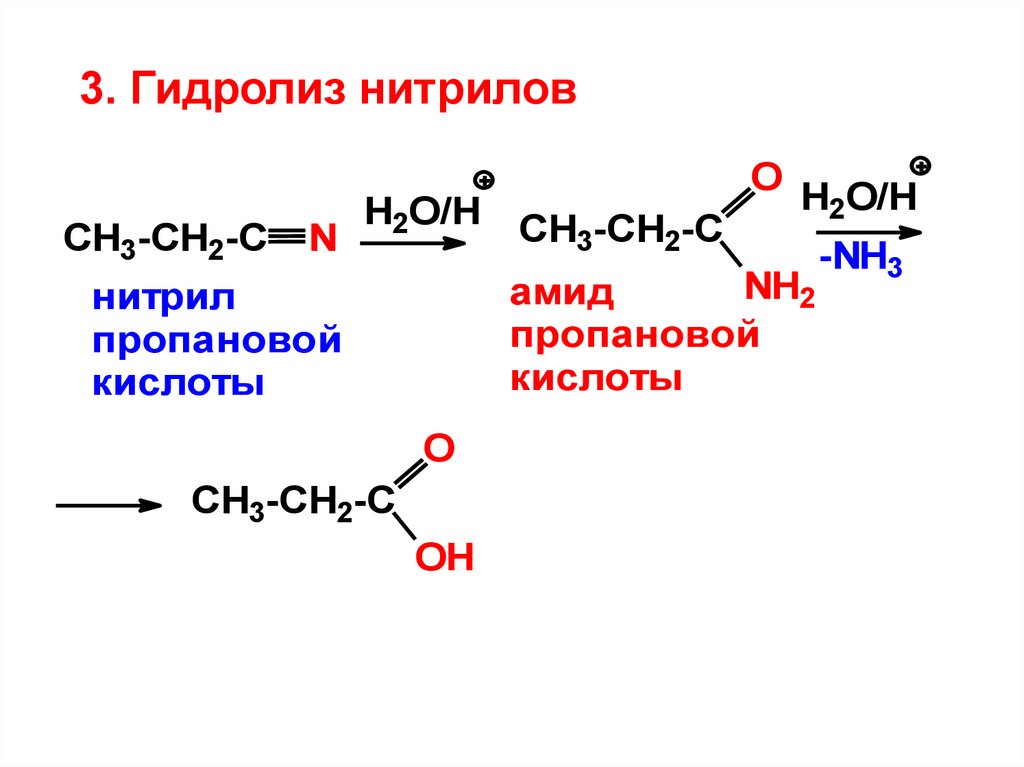
3. Гидролиз нитриловCH3-CH2-C
H2O/H CH -CH -C
N
2
3
O
H2O/H
NH2
амид
пропановой
кислоты
нитрил
пропановой
кислоты
O
CH3-CH2-C
OH
-NH3
15.
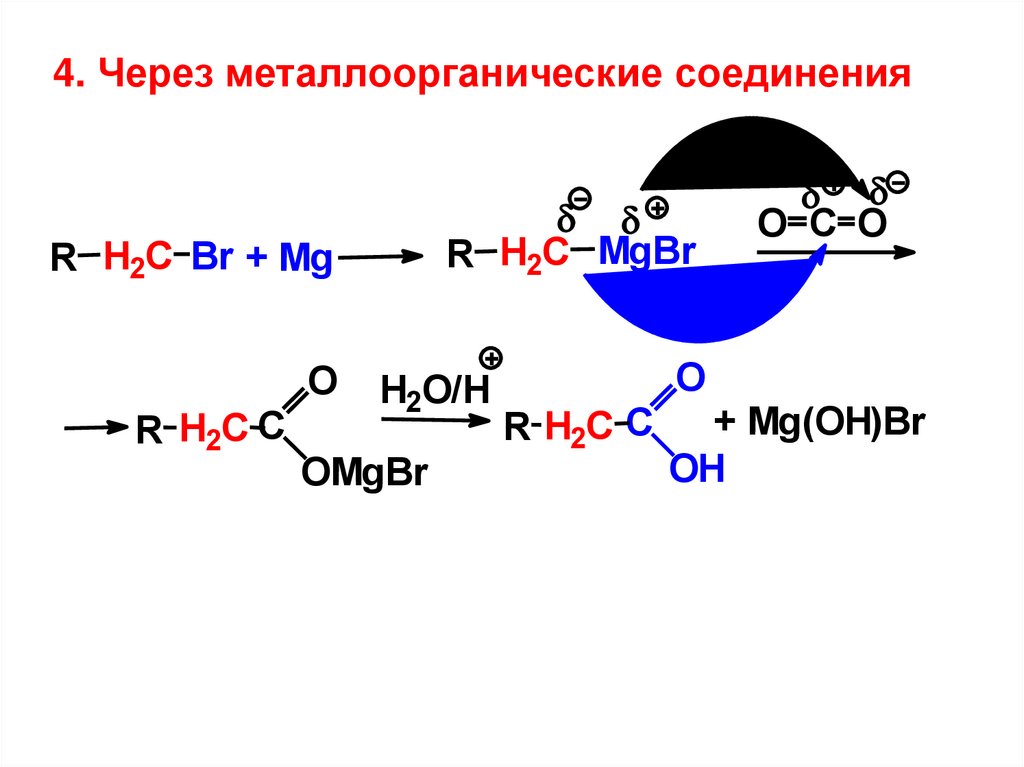
4. Через металлоорганические соединенияR H2C MgBr
R H2C Br + Mg
O
R H2C С
H2O/H
OMgBr
O C O
O
R H2C С
+ Mg(OH)Br
OH
16.
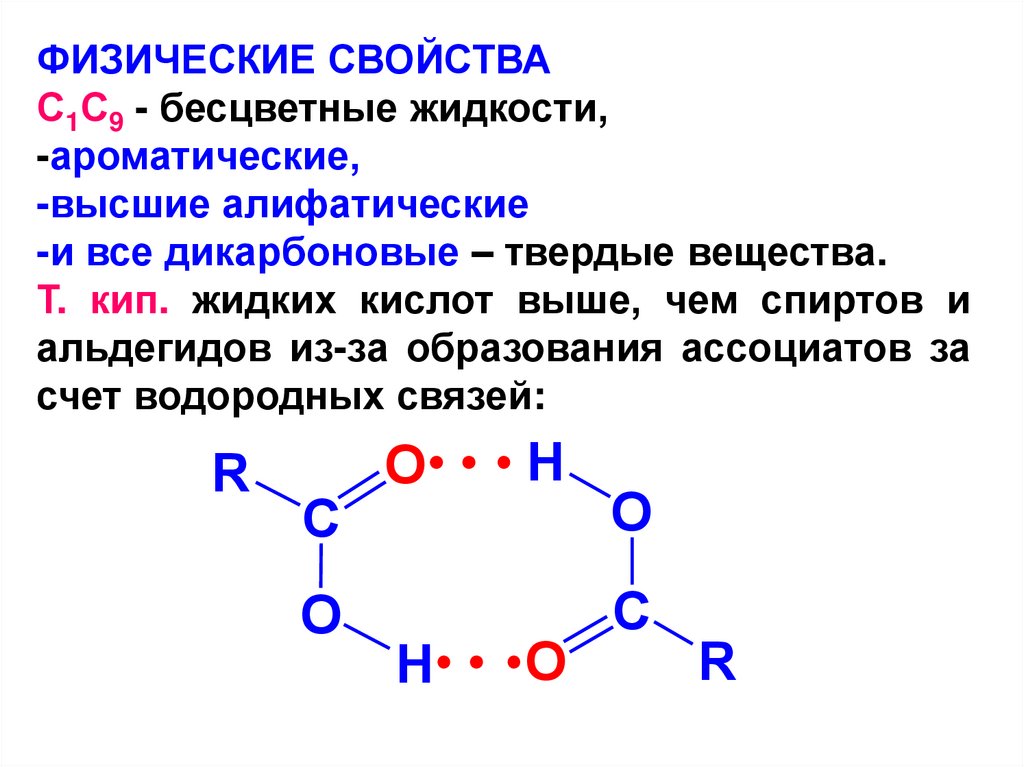
ФИЗИЧЕСКИЕ СВОЙСТВАС1С9 - бесцветные жидкости,
-ароматические,
-высшие алифатические
-и все дикарбоновые – твердые вещества.
Т. кип. жидких кислот выше, чем спиртов и
альдегидов из-за образования ассоциатов за
счет водородных связей:
R
С
O
O
H
H
O
O
С
R
17.
Водородные связи в карбоновых кислотахотносятся к числу самых сильных: 29
кДж/моль
Низшие
члены
гомологического
ряда
алифатических
монокарбоновых
кислот
смешиваются с водой в любых пропорциях.
Ароматические карбоновые кислоты плохо
растворимы в воде, но лучше в этаноле.
18.
Химические свойства1. Реакции с участием карбоксильной группы:
1) кислотные свойства идут с разрывом связи
О-Н ;
2) реакции с разрывом связи
С-О с образованием функцио-нальных
производных;
2. Реакции с участием углеводородного
радикала
19.
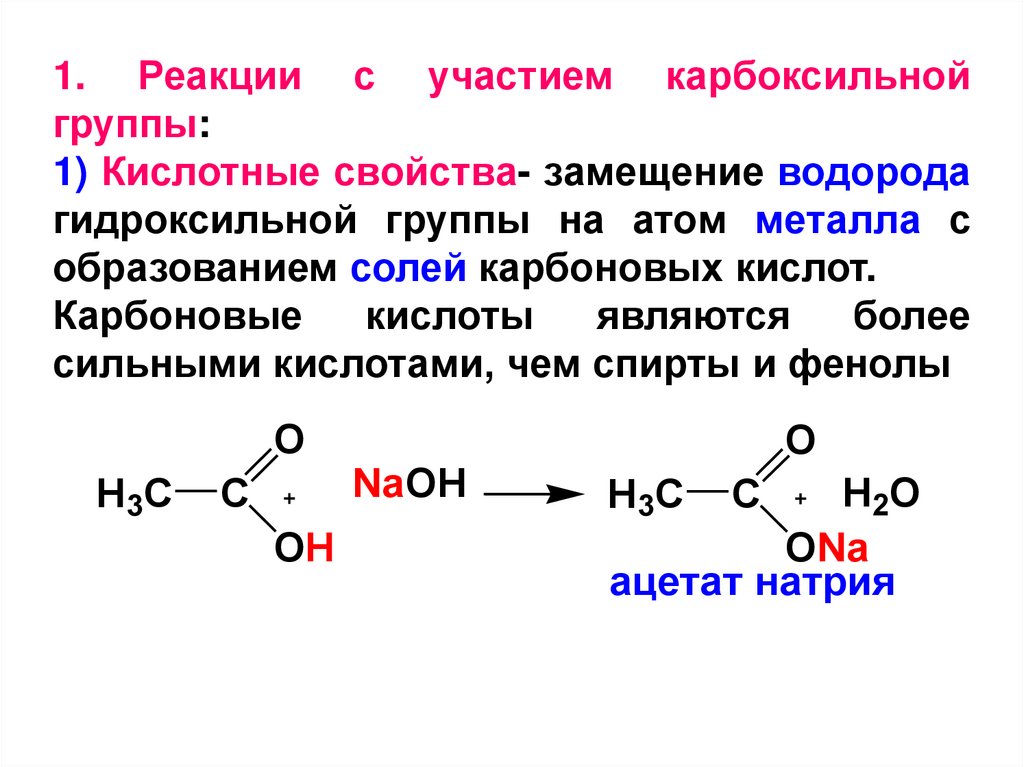
1. Реакции с участием карбоксильнойгруппы:
1) Кислотные свойства- замещение водорода
гидроксильной группы на атом металла с
образованием солей карбоновых кислот.
Карбоновые
кислоты
являются
более
сильными кислотами, чем спирты и фенолы
O
H3C
C
OH
NaOH
O
H2O
ONa
ацетат натрия
H3C
C
20.
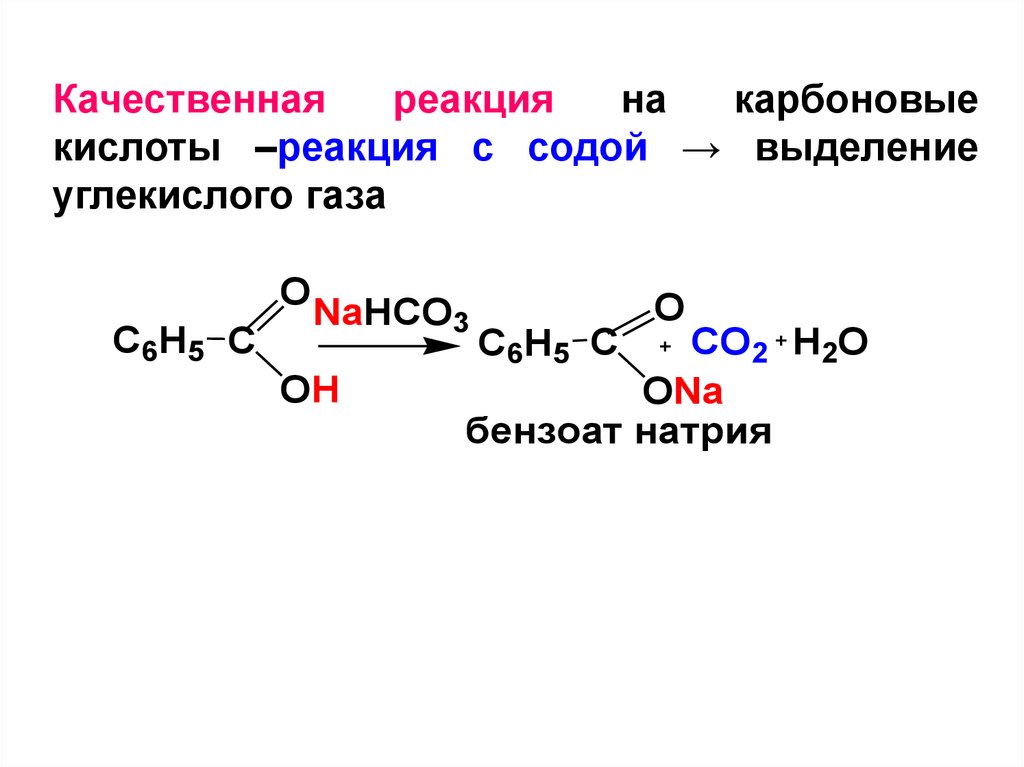
Качественнаяреакция
на
карбоновые
кислоты –реакция с содой → выделение
углекислого газа
O
C6H5 C
NaHCO3
OH
O
CO2 H2O
ONa
бензоат натрия
C6H5 C
21.
22.
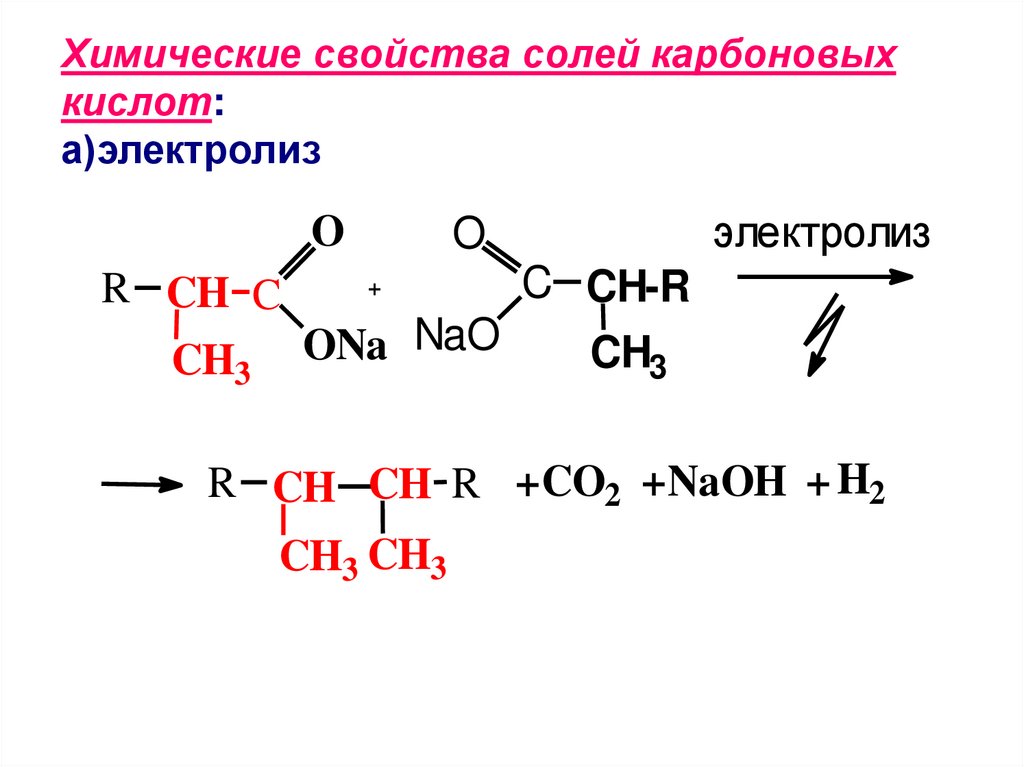
Химические свойства солей карбоновыхкислот:
а)электролиз
O
R CH C
CH3
O
электролиз
C CH-R
ONa NaO
CH3
+
R CH CH R + CO2 +NaOH + H2
CH3 CH3
23.
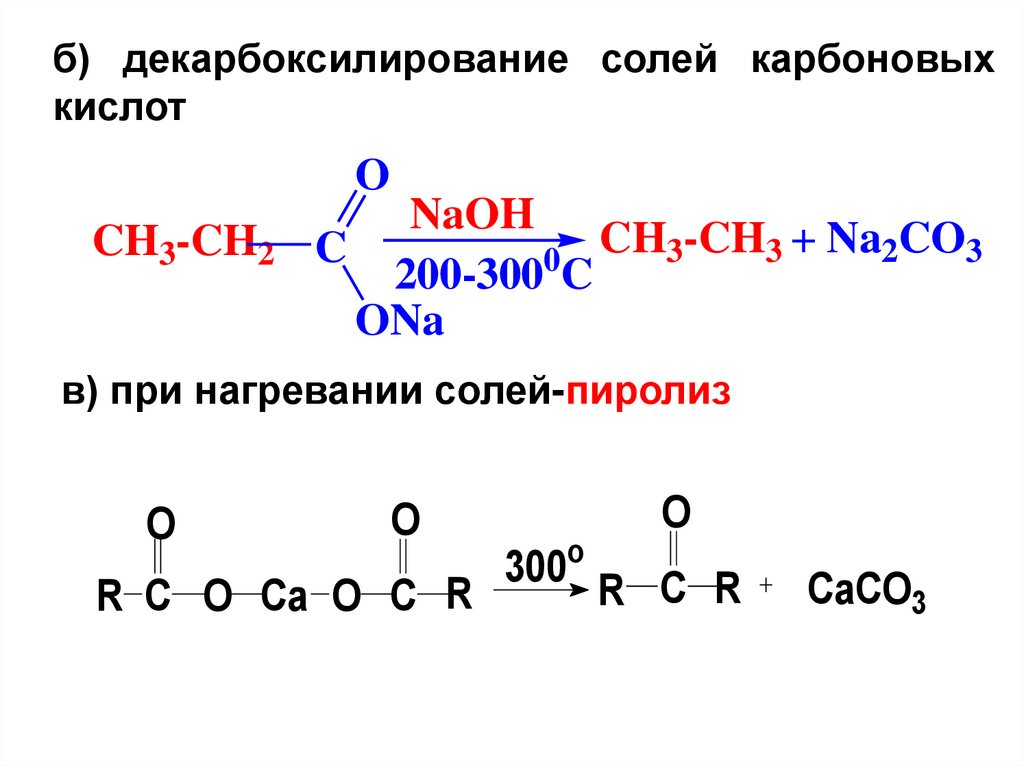
б) декарбоксилирование солей карбоновыхкислот
O
CH3-CH2
NaOH
CH3-CH3 + Na2CO3
C
0
200-300 C
ONa
в) при нагревании солей-пиролиз
O
O
R C O Ca O C R
o
300
O
R C R
CaCO3
24.
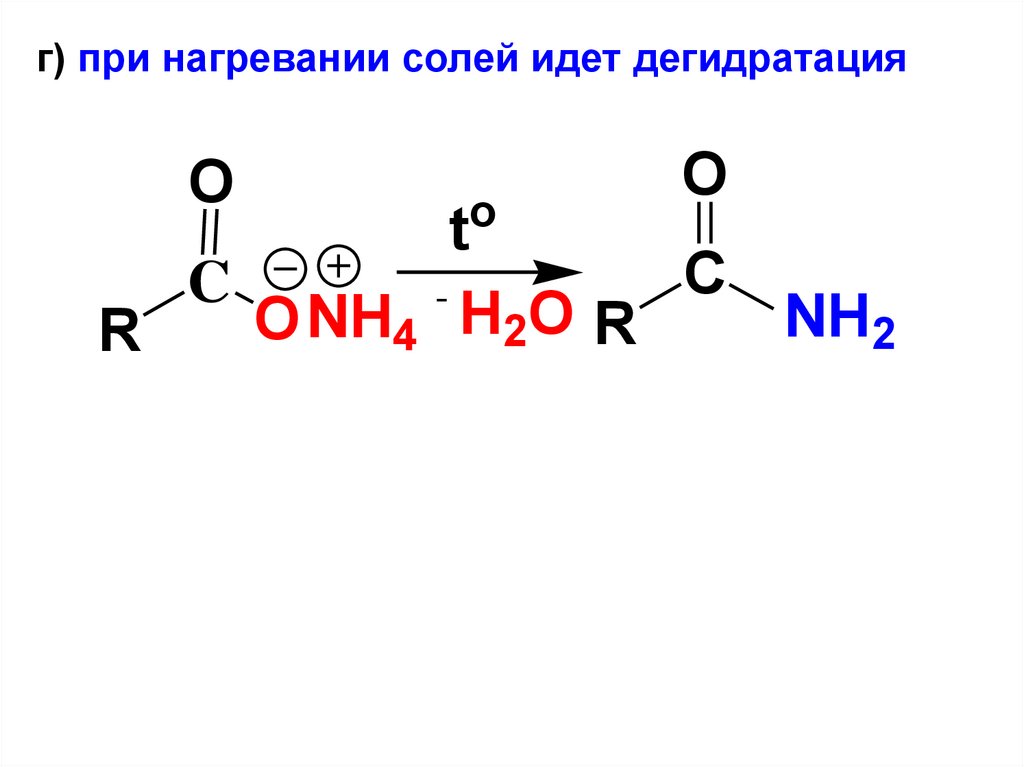
г) при нагревании солей идет дегидратацияO
o
O
t
C
C
NH2
O NH4 H2O R
R
25.
2) Реакции с разрывом связи С - ОН идут собразованием функциональных производных
кислот
- галогенангидриды
- ангидриды
- сложные эфиры
- амиды
По своему результату эти реакции могут
рассматриваться как реакции ацилирования –
замещение в молекуле реагента атома
водорода или металла на ацильную группу
O
R C
26.
1.Образование галогенангидридов кислот.O
R
С
Hal
Название: название ацила + галоген (в форме
прилагательного или с окончанием –ид)бутаноил хлорид, или хлорангидрид бутановой
кислоты.
27.
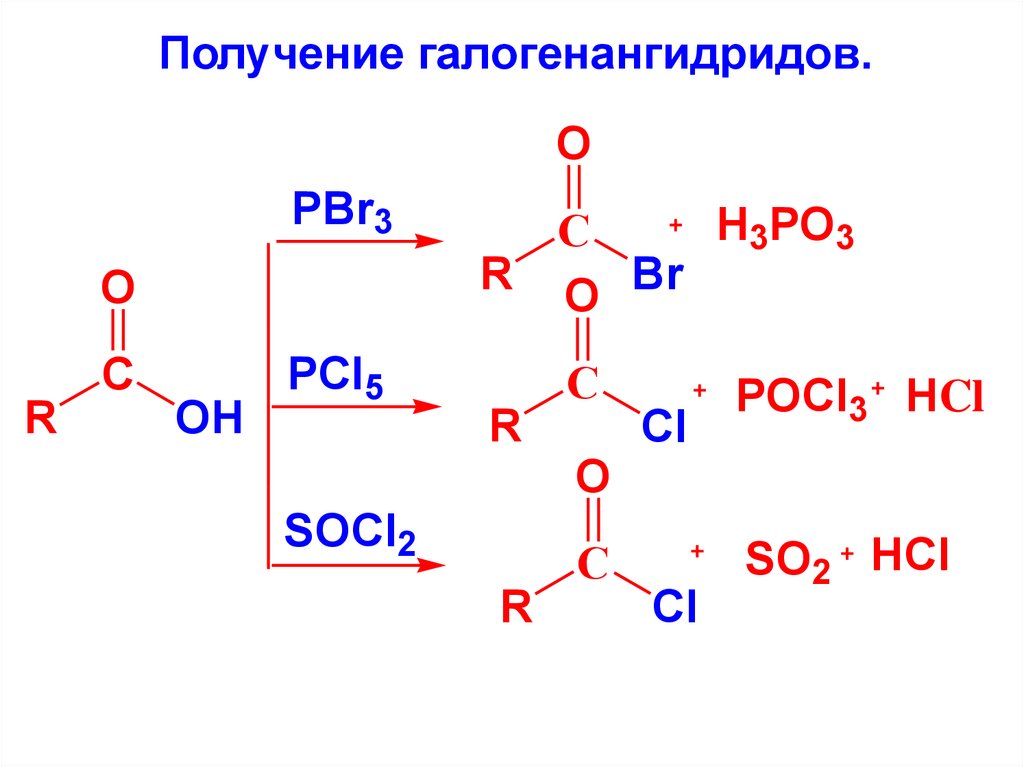
Получение галогенангидридов.O
PBr3
O
R
С
OH
PCl5
H3PO3
С
R O Br
R
SOCl2
R
С
O
С
Cl
Cl
POCl3 HCl
SO2 HCl
28.
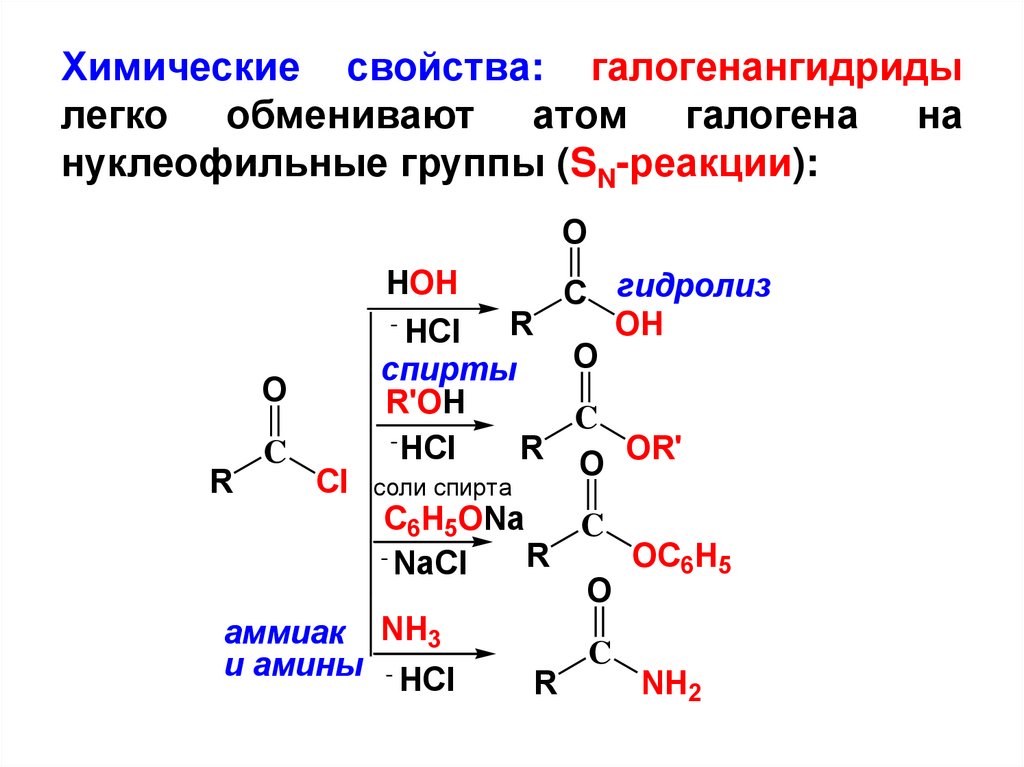
Химические свойства: галогенангидридылегко обменивают атом галогена на
нуклеофильные группы (SN-реакции):
O
HOH
O
R
C
Cl
C гидролиз
- HCl
R
OH
O
спирты
R'OH
C
- HCl
R O OR'
соли спирта
C6H5ONa
C
- NaCl
R
OC6H5
O
аммиак NH3
C
и амины - HCl
R
NH2
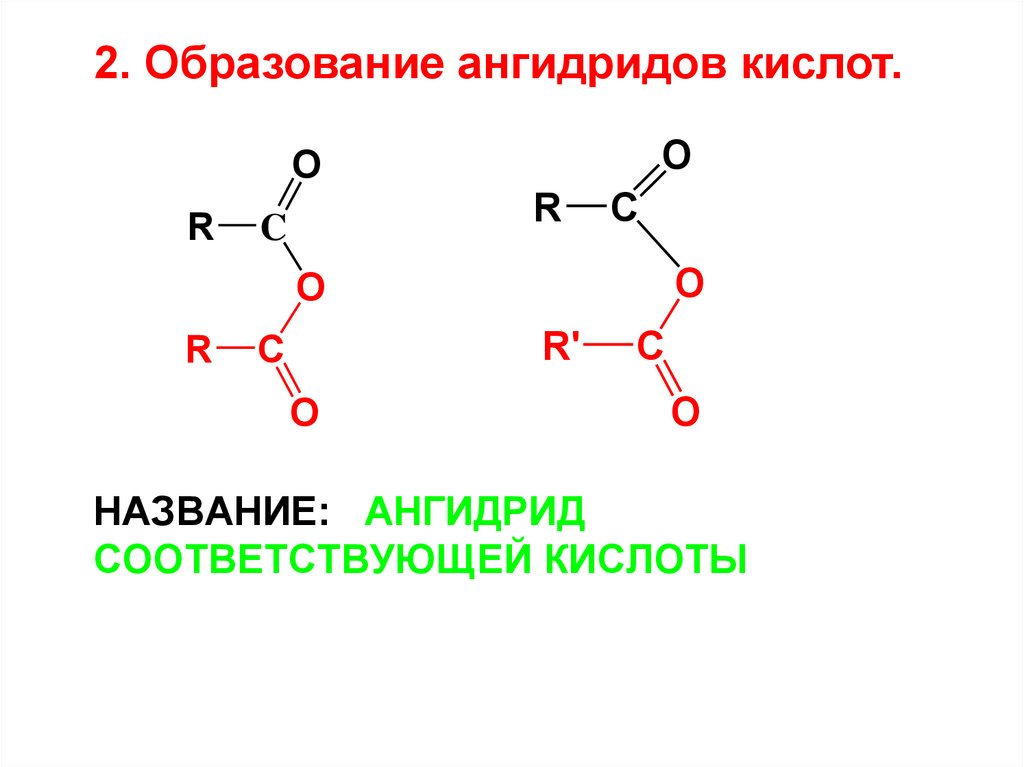
29. Название: ангидрид соответствующей кислоты
2. Образование ангидридов кислот.O
O
R
R
C
C
O
O
R
R'
C
O
C
O
НАЗВАНИЕ: АНГИДРИД
СООТВЕТСТВУЮЩЕЙ КИСЛОТЫ
30.
Получение ангидридов кислот :а) из кислот
O
O
O
P2O5,to
-H2O
C
C
CH3
H3C
OH HO
H3C
C
O
H3C
C
O
б)из соли кислоты и галогенангидрида
кислоты
O
O
R
C
R
O
ONa Cl
C
C
-NaCl
R'
O
R'
C
O
31.
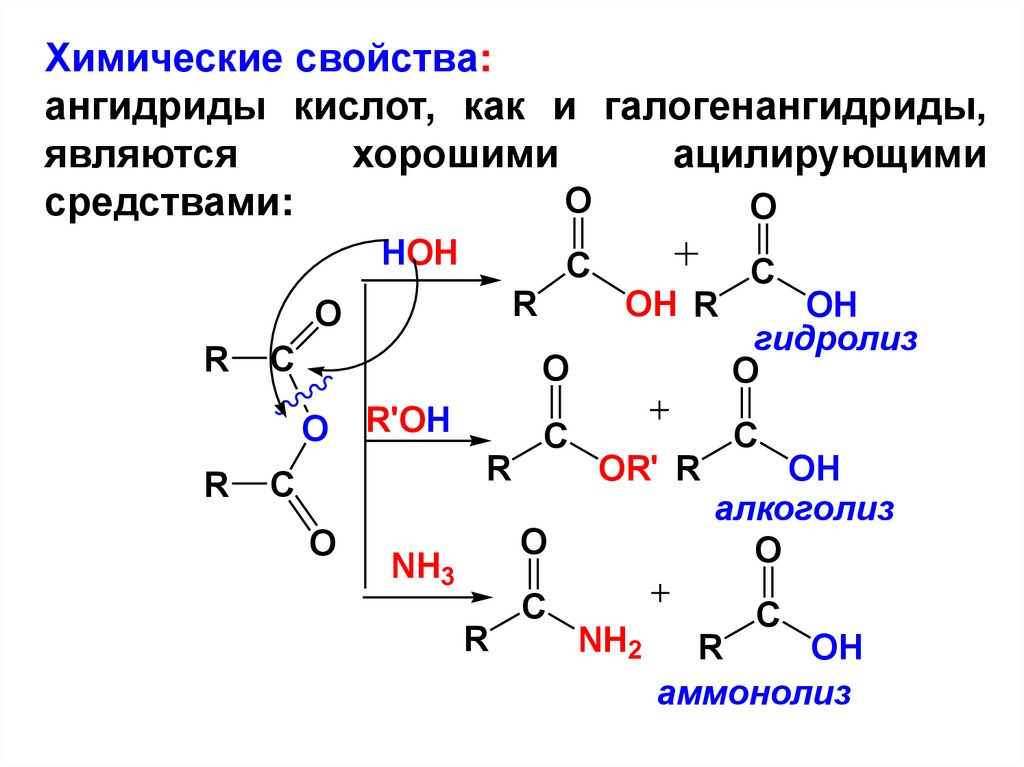
Химические свойства:ангидриды кислот, как и галогенангидриды,
являются
хорошими
ацилирующими
O
средствами:
O
HOH
R
O
R
C
O
R
R'OH
R
C
O
C
OH R
O
OH
гидролиз
O
C
C
OR' R
O
NH3
R
C
C
NH2
OH
алкоголиз
O
C
R
OH
аммонолиз
32.
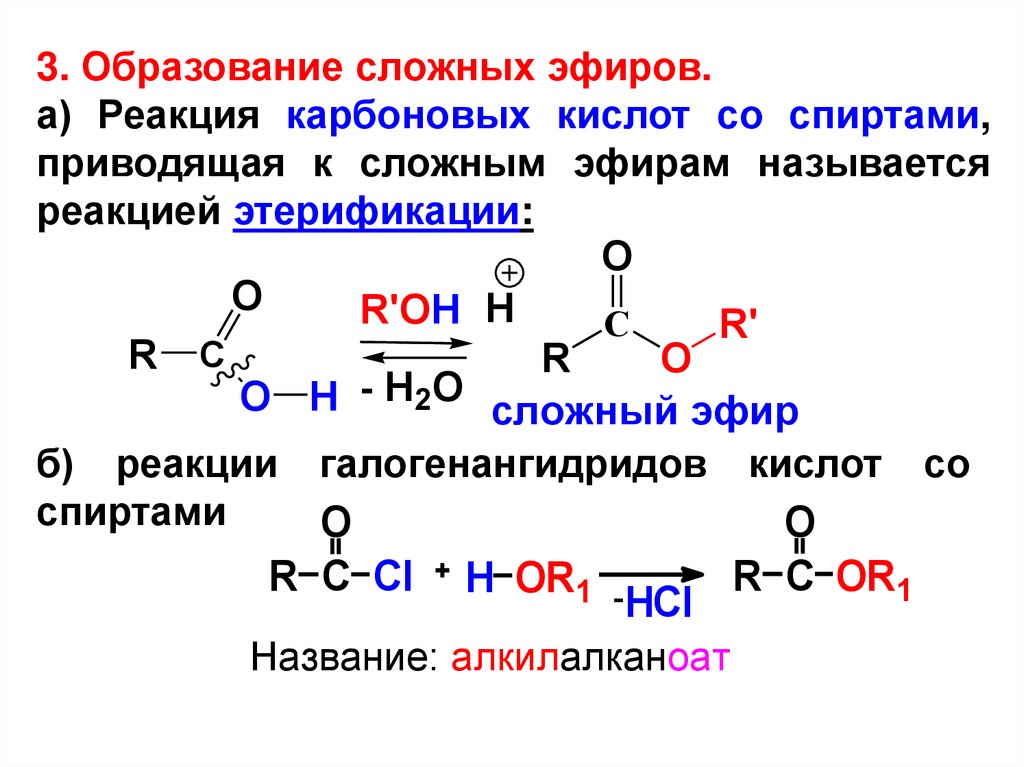
3. Образование сложных эфиров.а) Реакция карбоновых кислот со спиртами,
приводящая к сложным эфирам называется
реакцией этерификации:
O
O
R'OH H
С
R'
R С
R
O
O H - H2O сложный эфир
б) реакции галогенангидридов кислот со
спиртами
O
O
R C Cl
H OR1 -
HCl
Название: алкилалканоат
R C OR1
33.
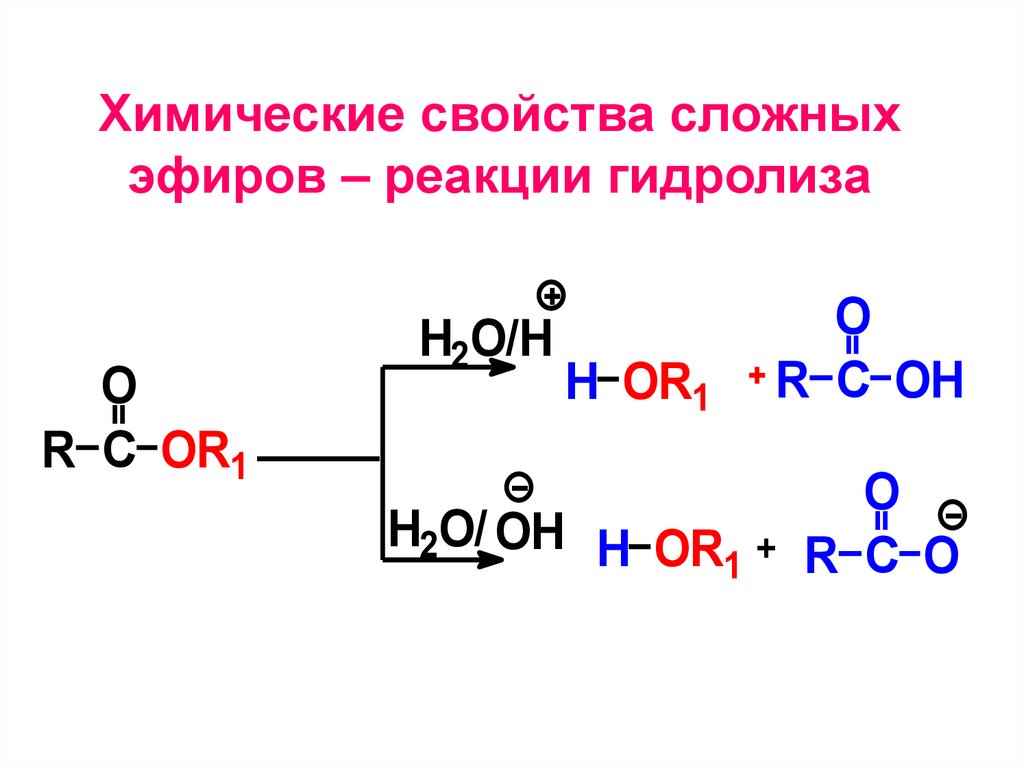
Химические свойства сложныхэфиров – реакции гидролиза
O
R C OR1
H2O/H
H OR1
O
R C OH
O
H2O/ OH H OR +
R C O
1
34. Название: алканамид или амид соответствующей кислоты
4.Образование амидов кислотO
R
C
NH2
Название: алканамид или
соответствующей кислоты
амид
35.
а) Получение из кислот и NH3:O
R C
O
NH3
C
R
ONH4
аммонийная
соль
OH
to
H2O
O
R C
NH2
б) Из ангидридов кислот:
O
R C
Cl
O
2NH3 -NH4Cl R C
NH2
36.
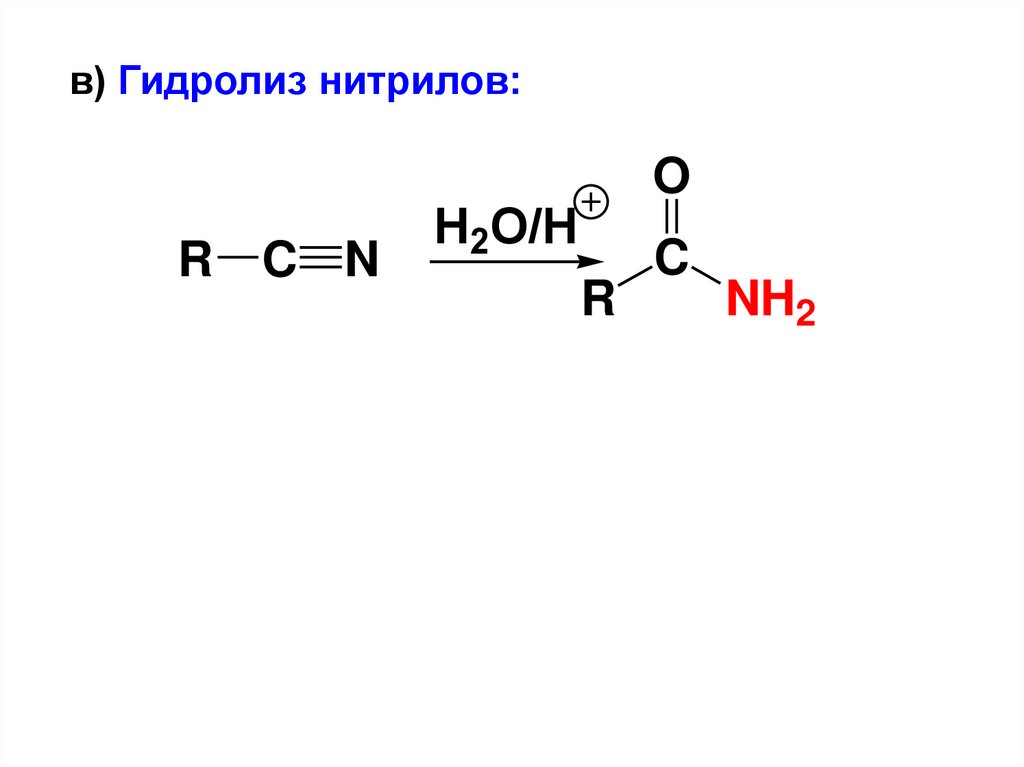
в) Гидролиз нитрилов:R C N
O
H2O/H
R
C
NH2
37.
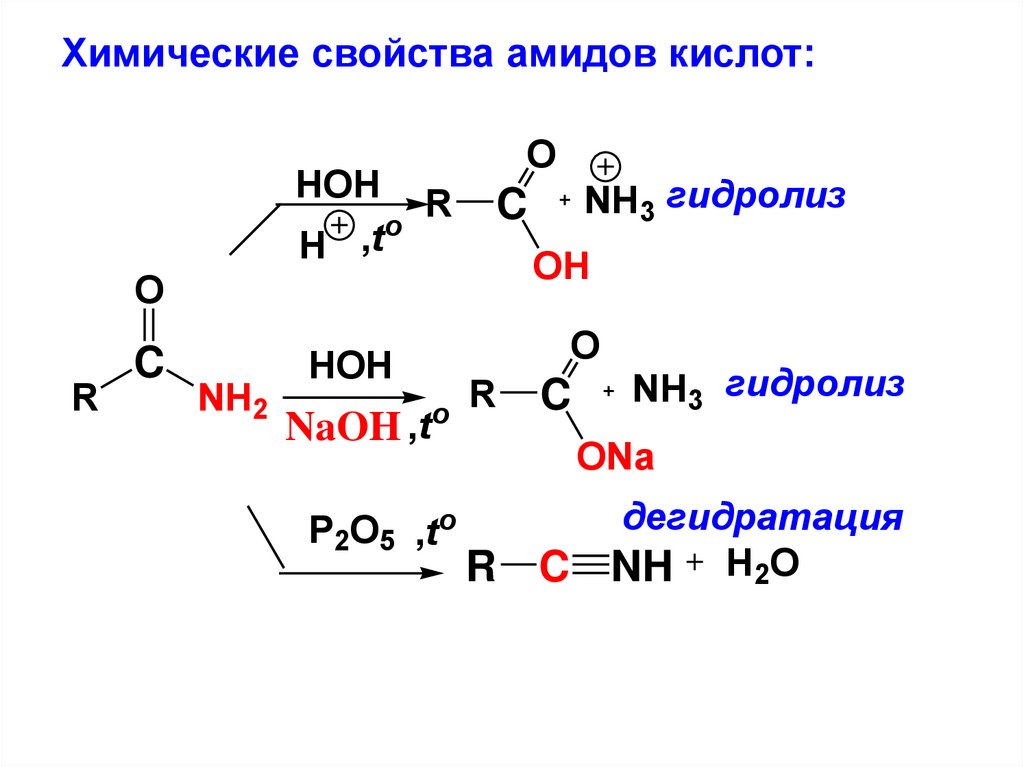
Химические свойства амидов кислот:HOH R
o
,t
H
O
OH
O
R
C
NH2
HOH
NaOH ,t
NH3 гидролиз
C
O
R
o
P2O5 ,to
C
NH3 гидролиз
ONa
R C
дегидратация
NH H2O
38.
2. Реакции по α-углеродному атому-идут собразованием замещенных кислот.
-Галогенирование
O
PCl3
Br2
H3C (CH2)3 H2C C
- HBr
OH
гексановая
кислота
O
H3C (CH2)3 CH C
OH
Br
3-бромгексановая
кислота
39.
- Реакции по ароматическому кольцукарбоксильная группа ориентант II рода.O
C
Br2
AlBr3
C
O
OH
HBr
Br
OH
KNO3
H2SO4
C
O
OH
H2O
NO2
40.
41.
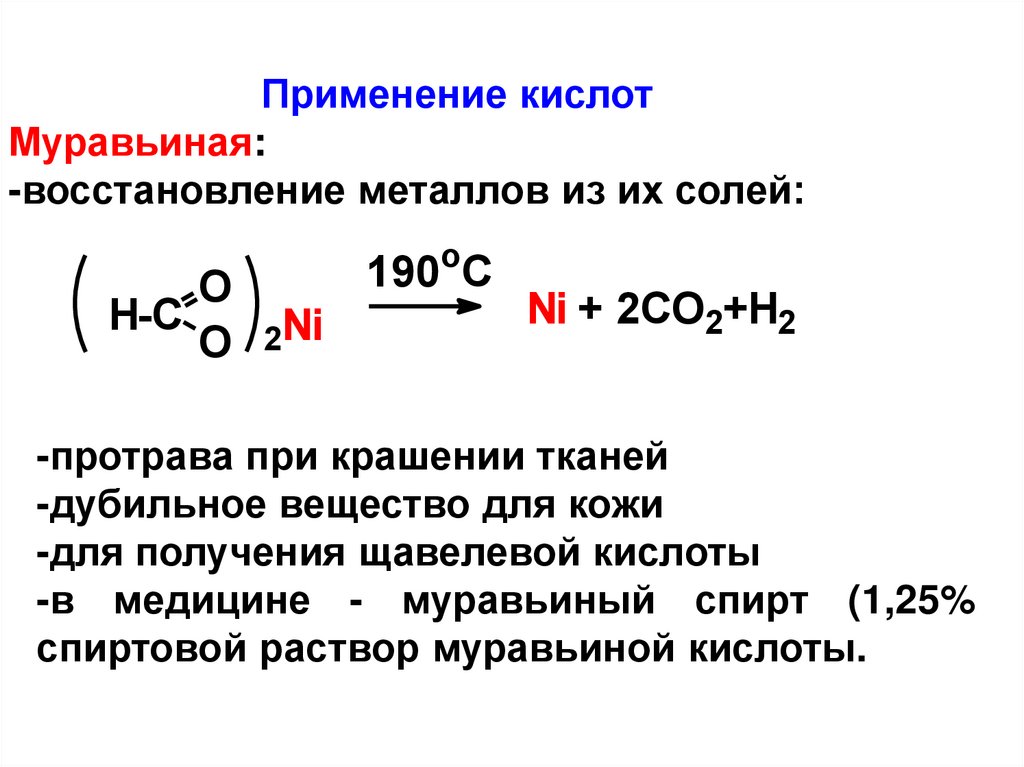
Применение кислотМуравьиная:
-восстановление металлов из их солей:
O
H-C
O 2Ni
190oC
Ni + 2CO2+H2
-протрава при крашении тканей
-дубильное вещество для кожи
-для получения щавелевой кислоты
-в медицине - муравьиный спирт (1,25%
спиртовой раствор муравьиной кислоты.
42.
Уксусная:-образуется при скисании вина
Применяют:
-консервант
-в производстве ацетатного волокна
-в синтезе душистых веществ
-как растворитель
-для синтеза красителей, медицинских
препаратов,
43.
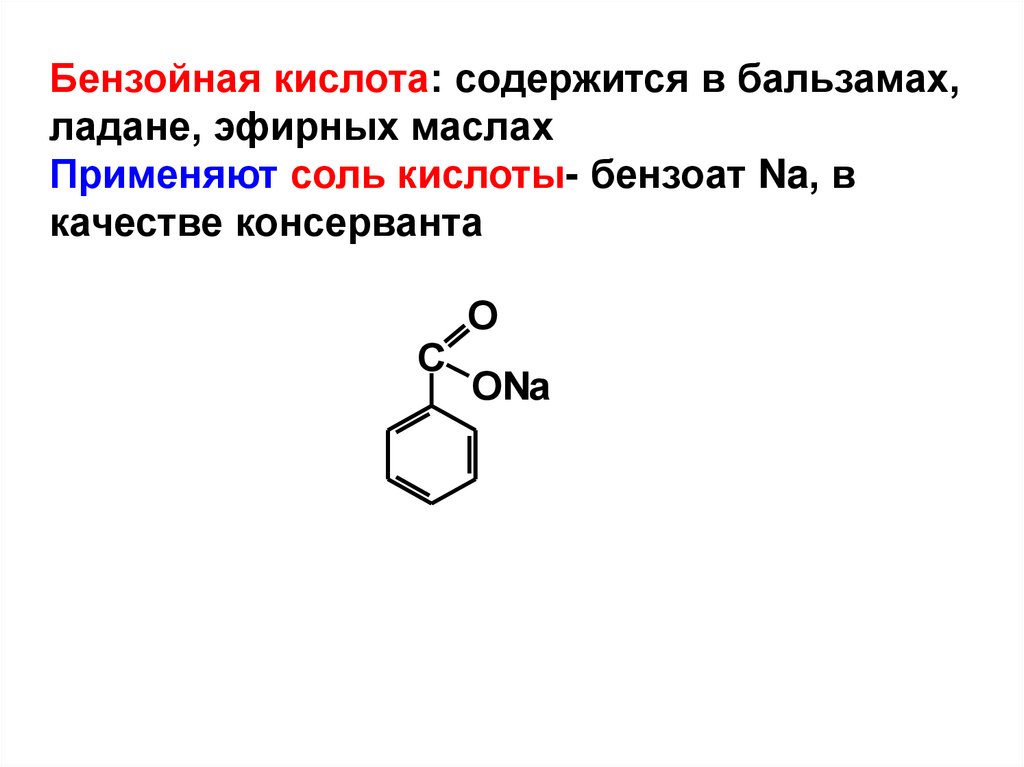
Бензойная кислота: содержится в бальзамах,ладане, эфирных маслах
Применяют соль кислоты- бензоат Na, в
качестве консерванта
С
O
ONa
44.
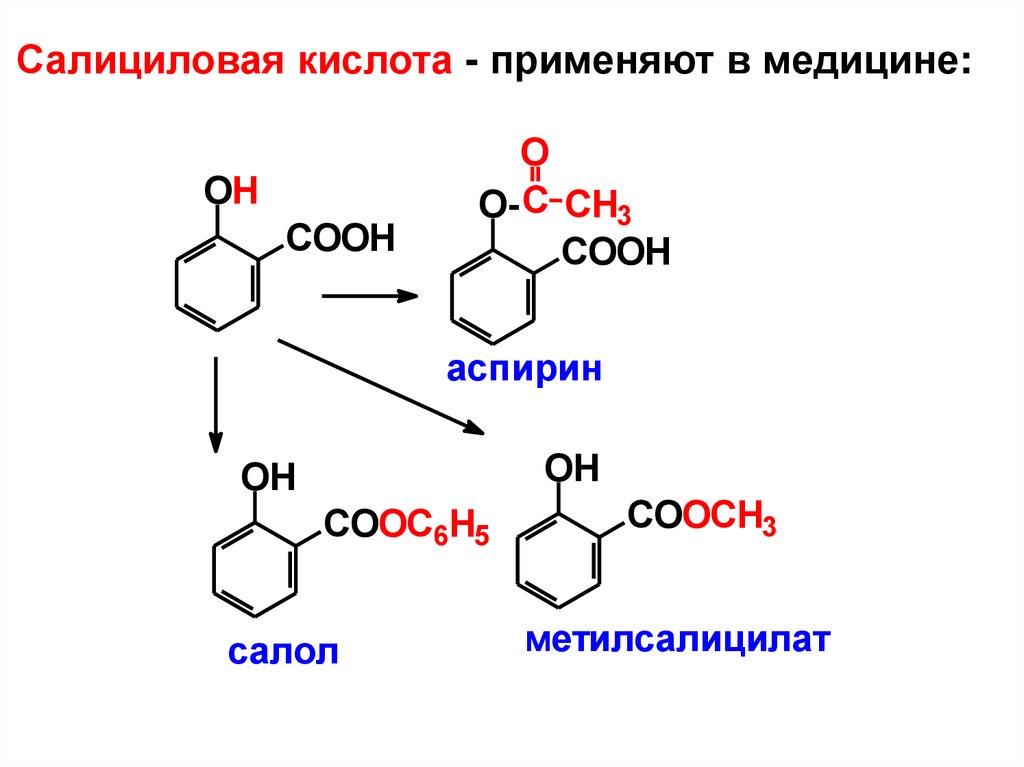
Салициловая кислота - применяют в медицине:OH
COOH
O
O- C CH3
COOH
аспирин
OH
OH
COOC6H5
салол
COOCH3
метилсалицилат
45.
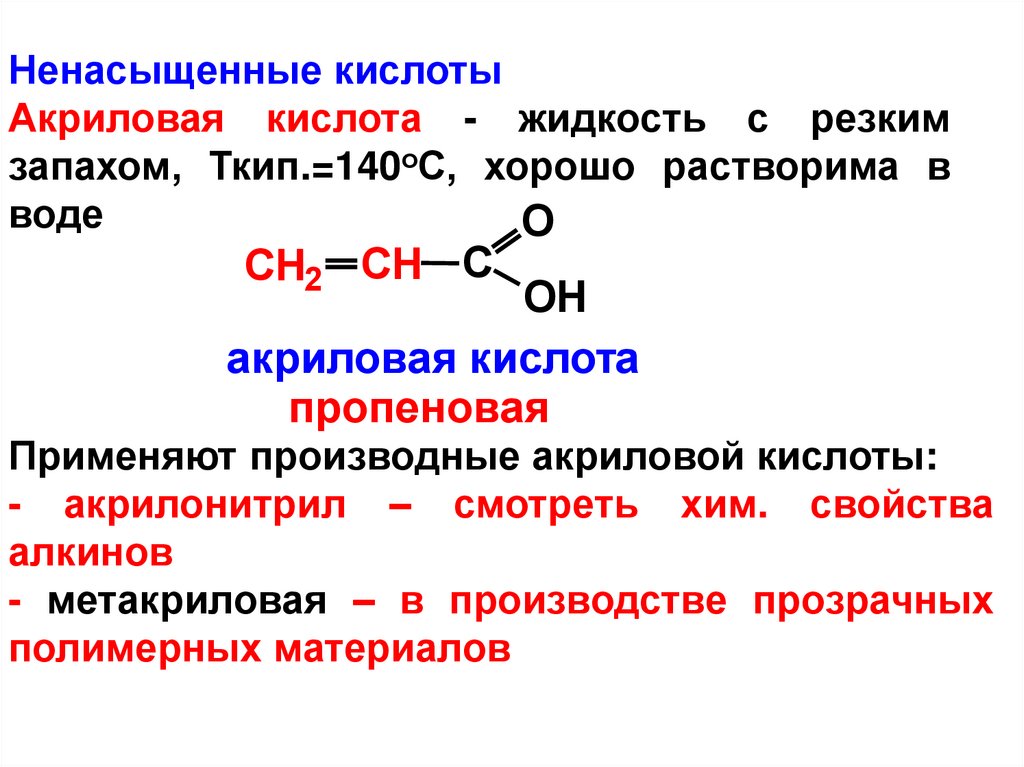
Ненасыщенные кислотыАкриловая кислота - жидкость с резким
запахом, Ткип.=140оС, хорошо растворима в
воде
O
CH2 CH C
OH
акриловая кислота
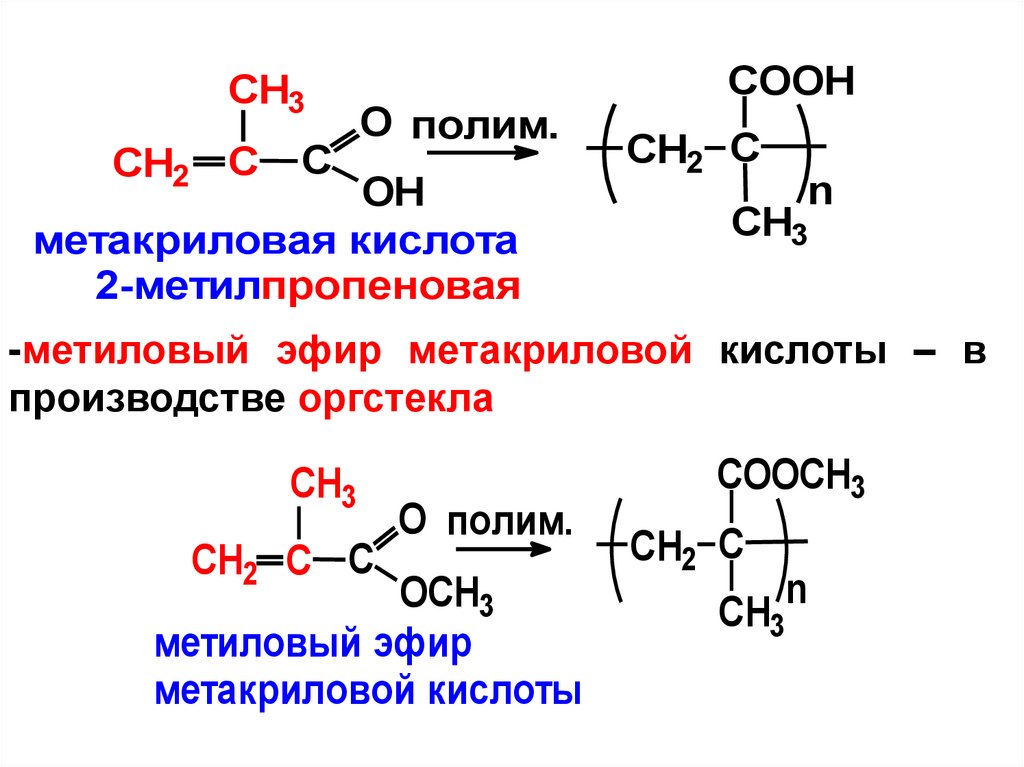
пропеновая
Применяют производные акриловой кислоты:
- акрилонитрил – смотреть хим. свойства
алкинов
- метакриловая – в производстве прозрачных
полимерных материалов
46.
CH3CH2 C
C
O полим.
OH
метакриловая кислота
2-метилпропеновая
COOH
CH2 C
n
CH3
-метиловый эфир метакриловой кислоты – в
производстве оргстекла
CH3
CH2 C C
O полим.
OСH3
метиловый эфир
метакриловой кислоты
COOСH3
CH2 C
CH3
n
47.
Двухосновные кислоты- карбоновые кислоты,содержащие две карбоксильные группы
Гомологический ряд:
HOOC-COOH – щавелевая,
этандиовая
HOOC-CH2-COOH – малоновая,
пропандиовая
HOOC-(CH2)2-COOH – янтарная,
бутандиовая
HOOC-(CH2)3-COOH–глутаровая,
пентандиовая
HOOC-(CH2)4-COOH–адипиновая,
гександиовая
48.
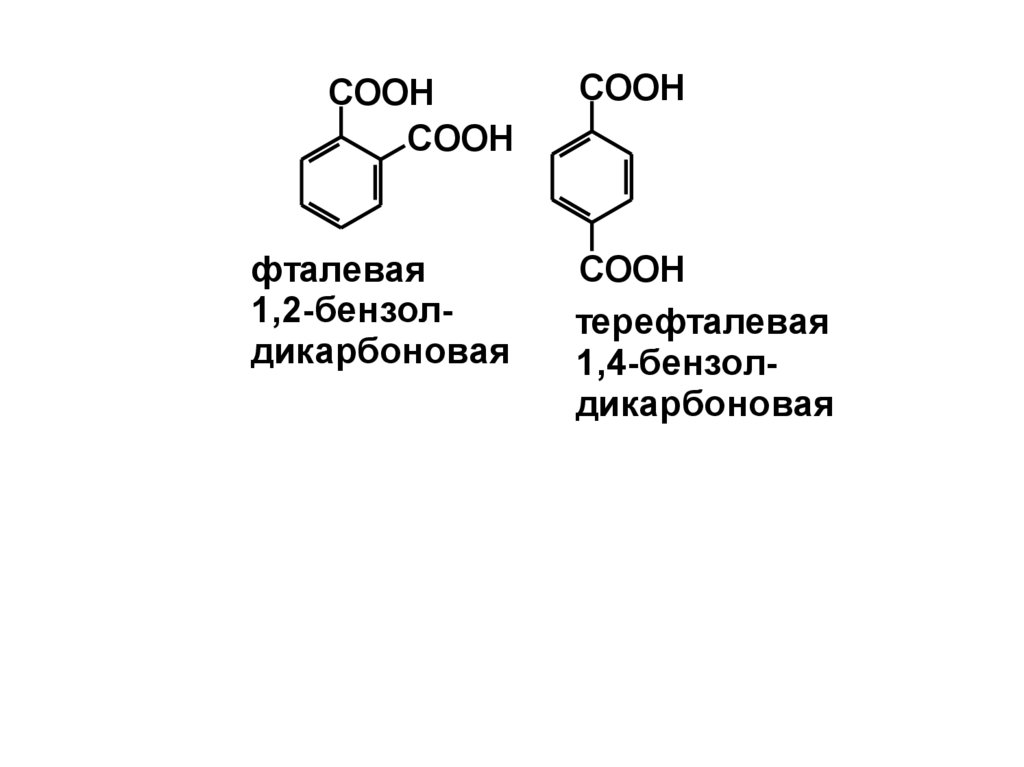
COOHCOOH
фталевая
1,2-бензолдикарбоновая
COOH
COOH
терефталевая
1,4-бензолдикарбоновая
49.
Химические свойства:1. Кислотные – образуют с NaOH, NaHCO3 два
ряда солей: кислые и средние соли.
Кислотные свойства выше одноосновных
кислот, так как содержат две карбоксильные
группы
50.
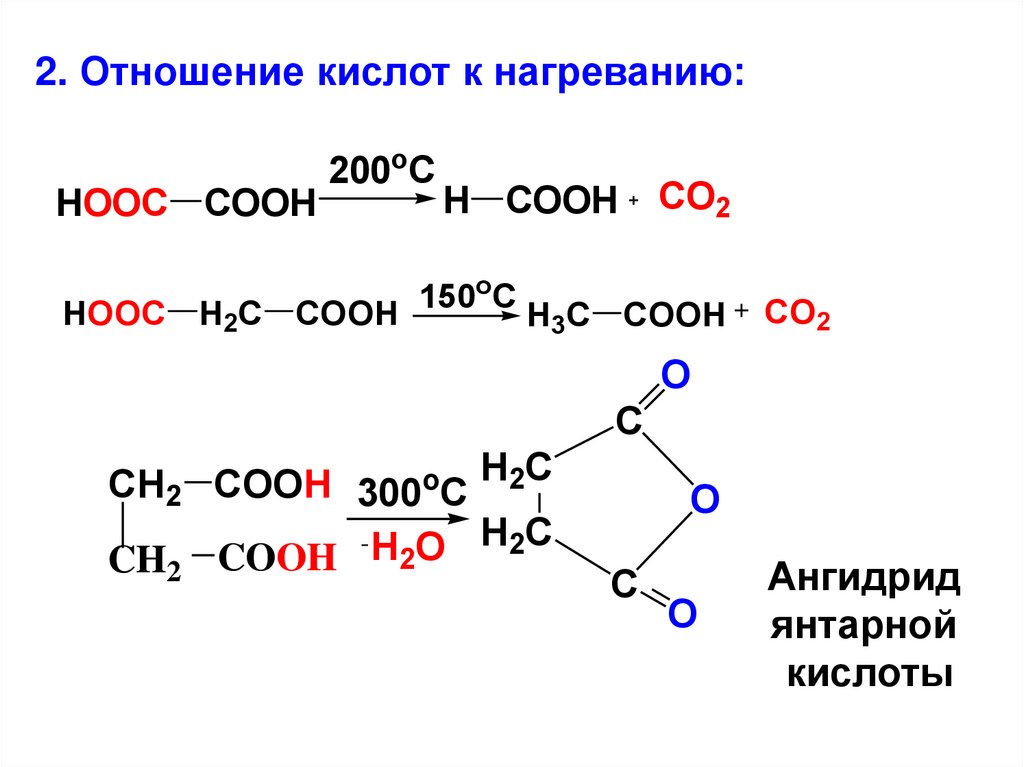
2. Отношение кислот к нагреванию:HOOC COOH
200oC
HOOC H2C COOH
H COOH
150oC
CO2
H3C COOH
CO2
O
C
CH2 COOH 300oC H2C
- H O H2C
2
CH COOH
2
O
C
O
Ангидрид
янтарной
кислоты
51.
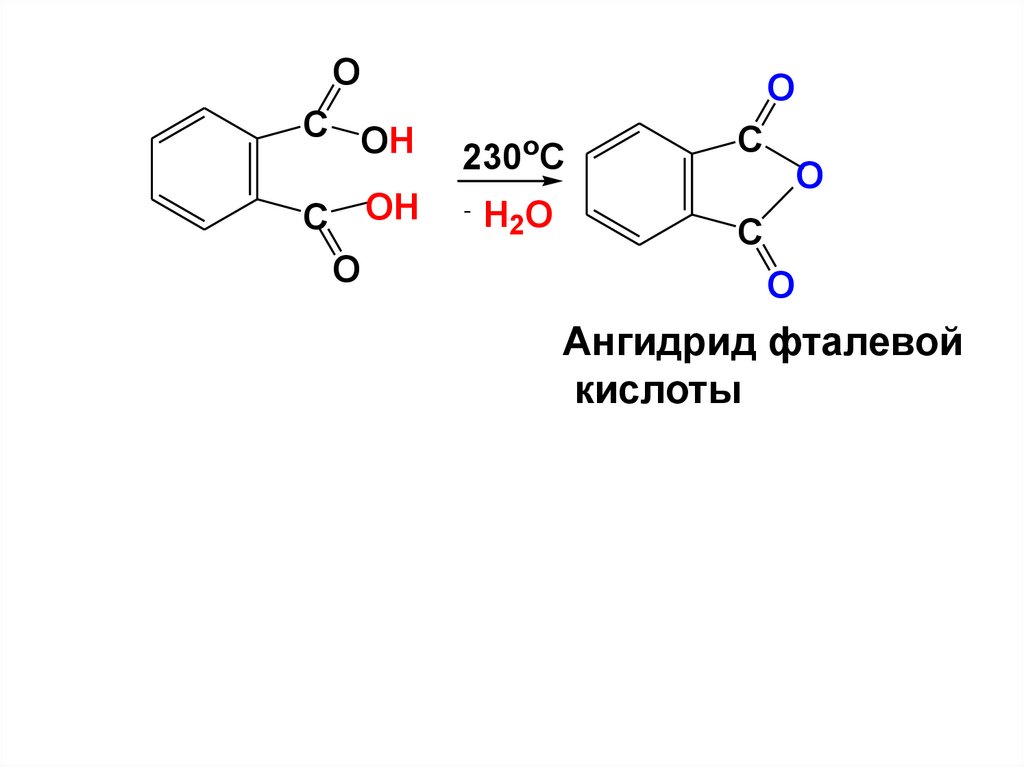
OC OH
C OH
O
O
230oC
- H O
2
C
O
C
O
Ангидрид фталевой
кислоты
52.
ПрименениеЩавелевая:
- для окрашивания тканей,
- как хорошее отбеливающее средство,
- удаляет из тканей ржавчину и чернила
53.
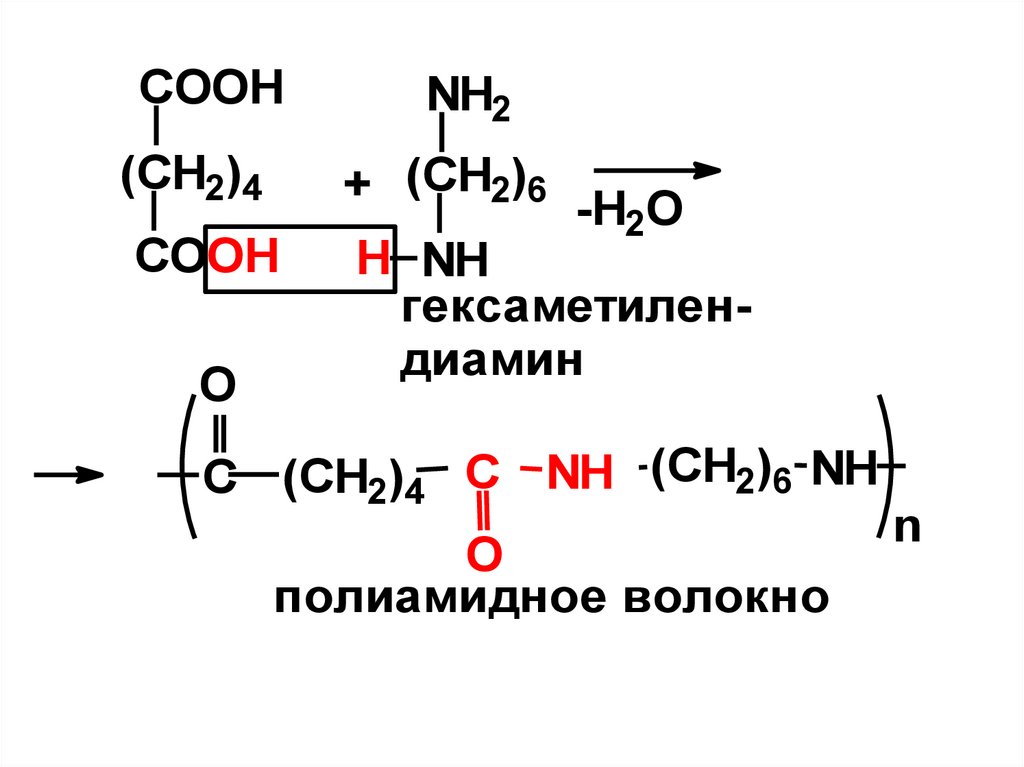
Адипиновая – в производстве полиамидного волокна «Найлон» реакциейконденсации адипиновой кислоты и
гексаметилендиамина.
- Эти волокна обладают высокой
прочностью, упругостью, устойчивостью
к
действию
химических
реагентов,
микроорганизмов, хорошо окрашиваются.
- По своим свойствам ткани из этих
волокон являются заменителями шерсти.
Из них делают бытовые ткани, парашюты,
рыболовные сети, каркасы шин.
54.
COOHNH2
(CH2)4
+ (CH2)6
COOH
H NH
гексаметилендиамин
O
-H2O
C (CH2)4 C NH (CH2)6 NH
O
полиамидное волокно
n
55.
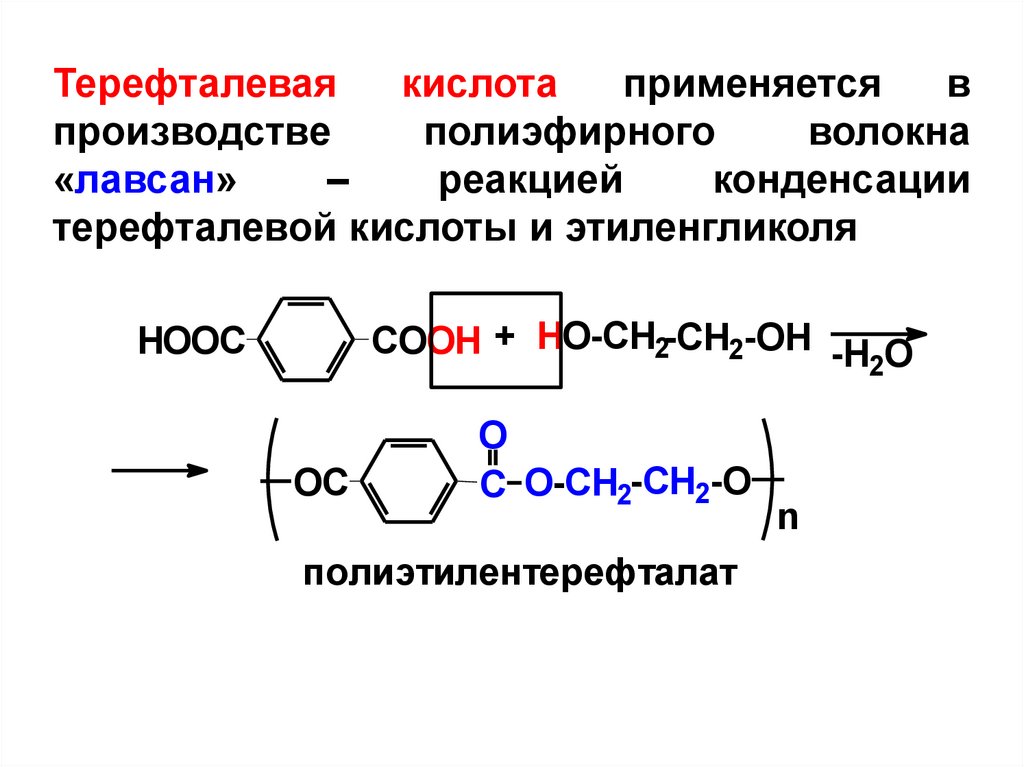
Терефталеваякислота
применяется
в
производстве
полиэфирного
волокна
«лавсан»
–
реакцией
конденсации
терефталевой кислоты и этиленгликоля
COOH + HO-CH2-CH2-OH -H O
HOOC
2
OC
O
C O-CH2-CH2-O
полиэтилентерефталат
n
56.
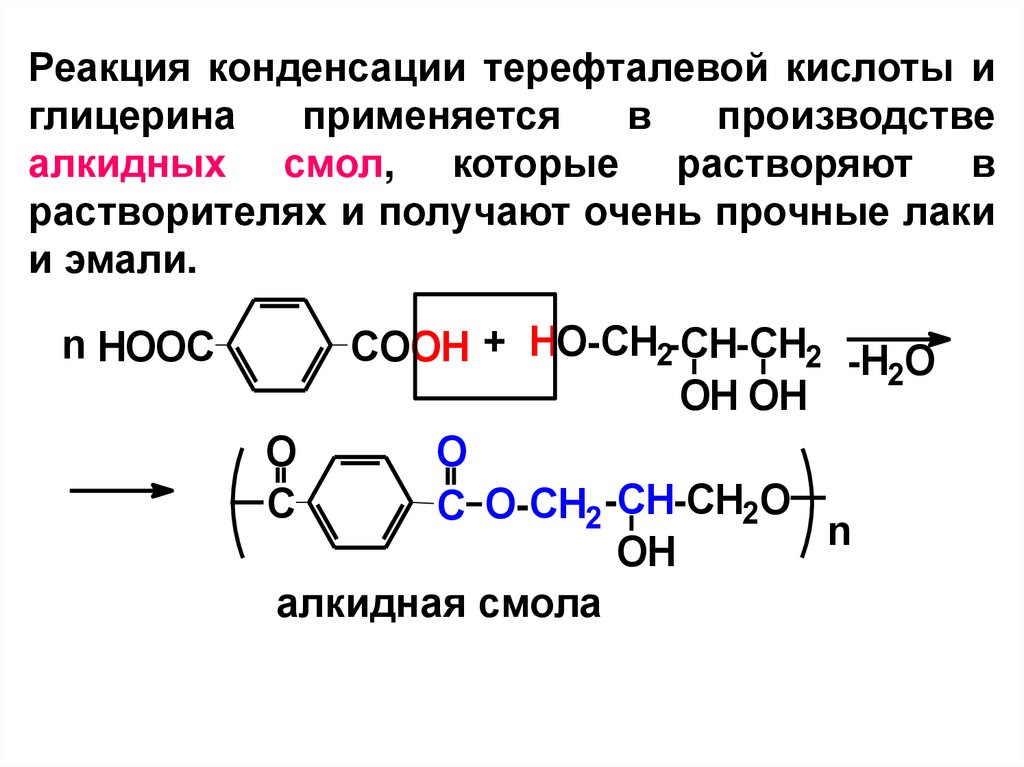
Реакция конденсации терефталевой кислоты иглицерина
применяется
в
производстве
алкидных смол, которые растворяют в
растворителях и получают очень прочные лаки
и эмали.
n HOOC
COOH + HO-CH2-CH-CH2 -H O
2
OH OH
O
O
C
C O-CH2 -CH-CH2O
n
OH
алкидная смола
57.
Высшие жирные кислотыПальмитиновая- С15Н31СООН, Тпл 63оС
Стеариновая - С17Н33СООН, Тпл 69оС
Эти кислоты содержатся: в масле какао,
жире животных.
В промышленности получают из нефтиокислением
высших
алканов
над
катализаторами. Применение:
- в производстве мыла: Na-соли этих кислот
твердое мыло, К-соли - жидкое мыло
- в производстве смазочных материалов для
защиты металла
- в производстве резины, линолеума, лаков,
краски
58.
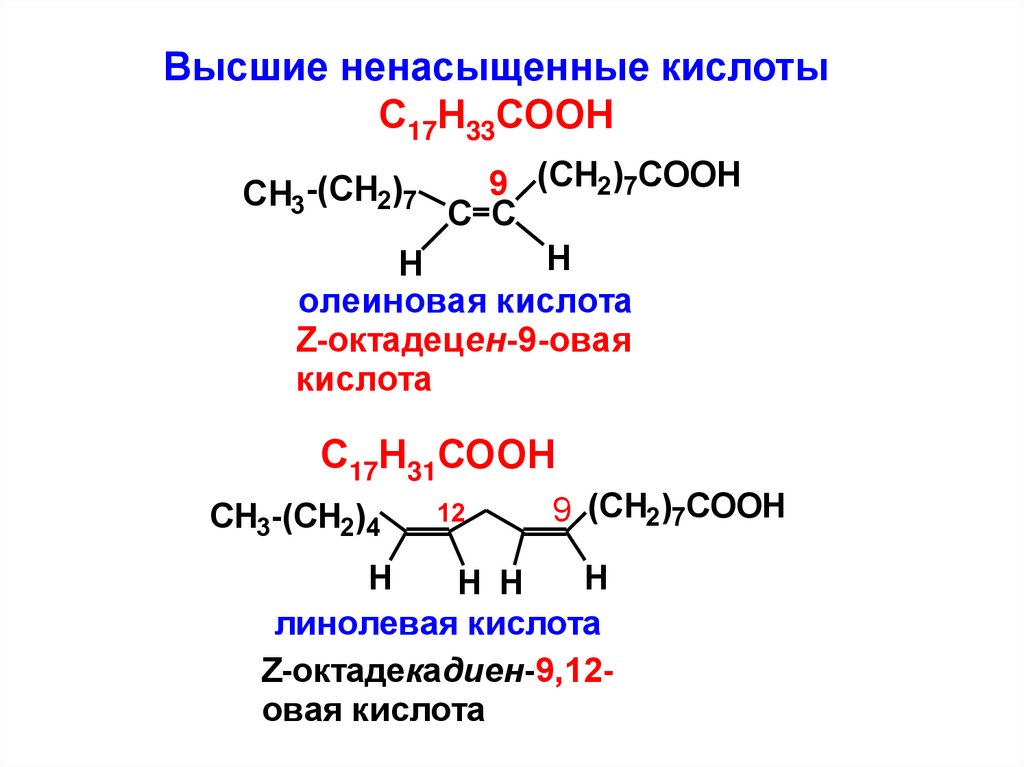
Высшие ненасыщенные кислотыС17Н33СООН
9 (CH2)7COOH
C C
H
H
олеиновая кислота
Z-октадецен-9-овая
кислота
CH3-(CH2)7
С17Н31СООН
CH3-(CH2)4
12
9 (CH2)7COOH
H
H
H H
линолевая кислота
Z-октадекадиен-9,12овая кислота
59.
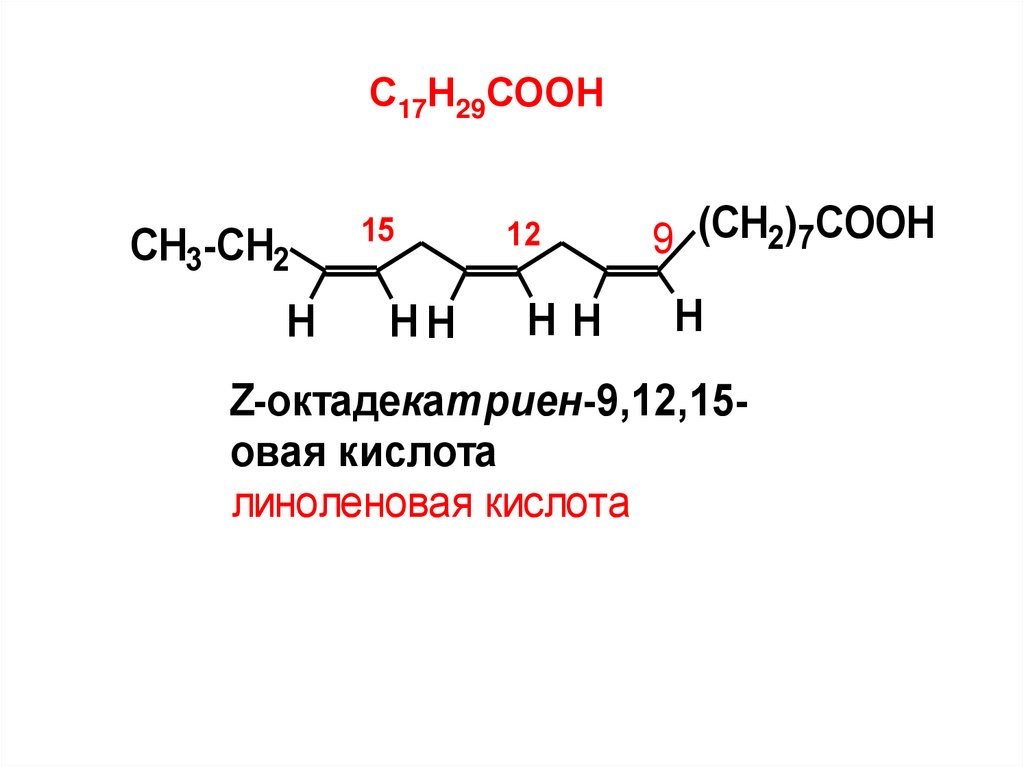
С17Н29СООНCH3-CH2
H
15
HH
12
9 (CH2)7COOH
HH
H
Z-октадекатриен-9,12,15овая кислота
линоленовая кислота
60.
Эти кислоты входят в состав жиров,бесцветные маслянистые жидкости, легче
воды. При Т=14оС образуют игольчатые
кристаллы, легко окисляются на воздухе
(как и алкены) и желтеют. Проявляют
химические свойства алкенов и карбоновых
кислот.
61.
Жиры, липидыЖиры, липиды - сложные эфиры глицерина и
высших насыщенных или ненасыщенных
кислот
Наряду с белками и углеводами входят в
состав растительных и животных организмов
Структурная формула жиров
O
CH2-O-C-R
CH-O-C-R
O
CH2-O-C-R
O
62.
Биологическая роль жиров:- источник энергии (1г при окислении
выделяет 39 кДж энергии)
-растворяют в организме биологически
активные вещества, например,
витамины
-участвуют при осуществлении важных
функций организма
-жировая ткань изолирует внутренние
органы от ударов, толчков и
переохлаждения
63.
Растения синтезируют жиры из крахмала, аживотные и человек – получают с пищей или
синтезируют из углеводов.
Жиры впервые синтезировал Бертло в 1854
году
Физические свойства: не имеют определенной
Тпл, не растворимы в воде, с водой образуют
эмульсию
(молоко),
при
перегонке
разлагаются.
- В состав жидких жиров (масло) входят
ненасыщенные
кислоты,
твердых–
насыщенные
64.
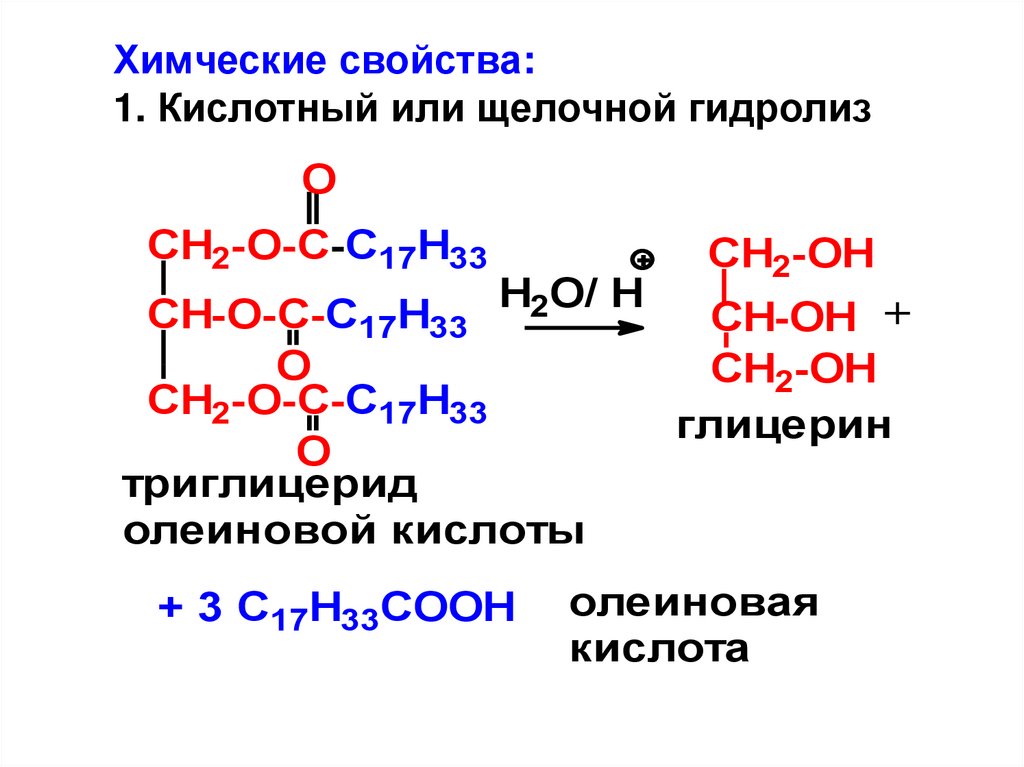
Химческие свойства:1. Кислотный или щелочной гидролиз
O
CH2-O-C-C17H33
CH2-OH
Н O/ H
CH-O-C-C17H33 2
CH-OH +
O
CH2-OH
CH2-O-C-C17H33
глицерин
O
триглицерид
олеиновой кислоты
+ 3 C17H33COOH
олеиновая
кислота
65.
2. Восстановление кратной связи–образуетсятвердый жир
Жиры применяют
-в фармацевтической промышленности.
-парфюмерии (крем, помада)



























 chemistry
chemistry








