Similar presentations:
Карбоновые кислоты
1. Карбоновые кислоты
2.
Карбоновыми кислотаминазываются соединения, в
которых функциональной
группой является
карбоксильная группа:
–COOH
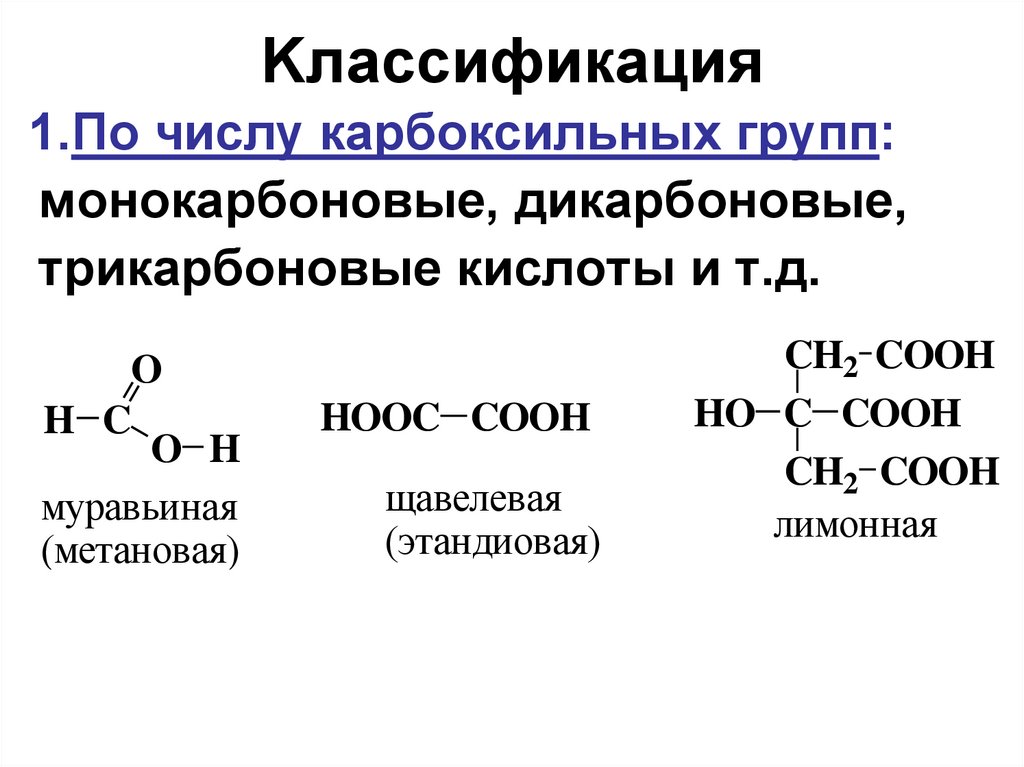
3. Kлассификация
1.По числу карбоксильных групп:монокарбоновые, дикарбоновые,
трикарбоновые кислоты и т.д.
O
H C
O H
муравьиная
(метановая)
HOOC COOH
щавелевая
(этандиовая)
CH2 COOH
HO C COOH
CH2 COOH
лимонная
4. 2. От строения углеводородного радикала, связанного с карбоксильной группой:
на алифатические (насыщенные иненасыщенные), алициклические,
ароматические, гетероциклические.
O
СH2 HC COOH
акриловая
(пропеновая)
OH
O
O H
циклопропанкарбоновая
бензойная
кислота
кислота
5. НОМЕНКЛАТУРА
В систематических названияхкарбоновых кислот карбоксильная
группа обозначается сочетанием:
–овая кислота
Если группа СООН не входит в состав
углеводородной основы, используется
сочетание –карбоновая кислота,
выполняющее роль суффикса в
заместительной номенклатуре.
6.
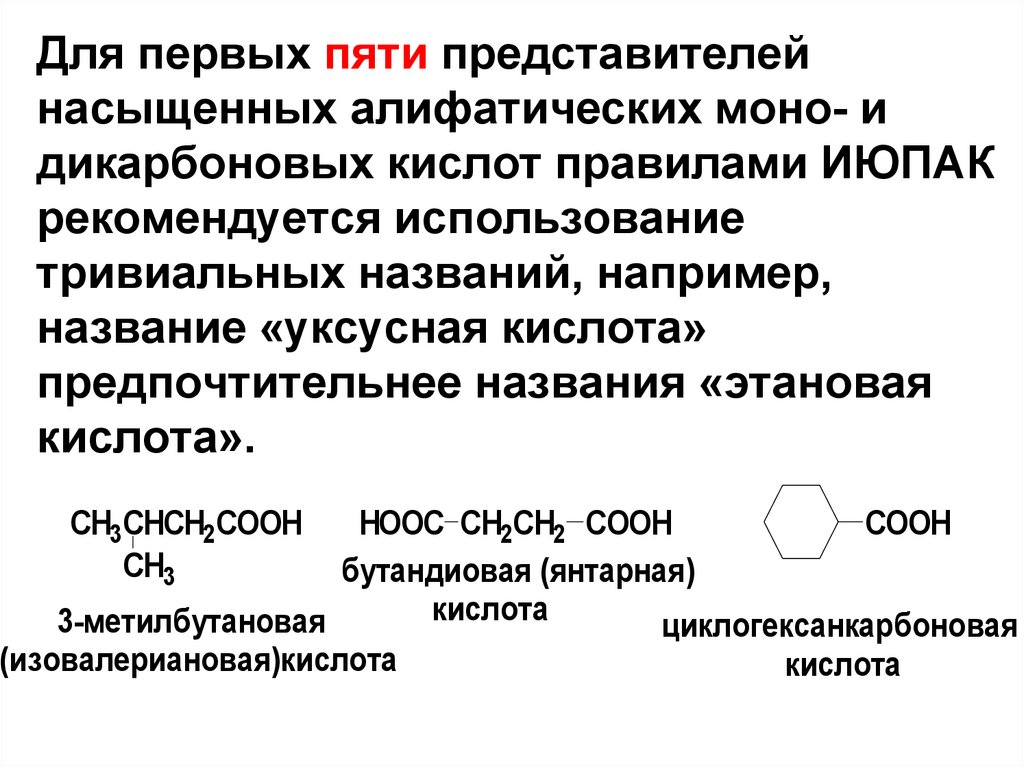
Для первых пяти представителейнасыщенных алифатических моно- и
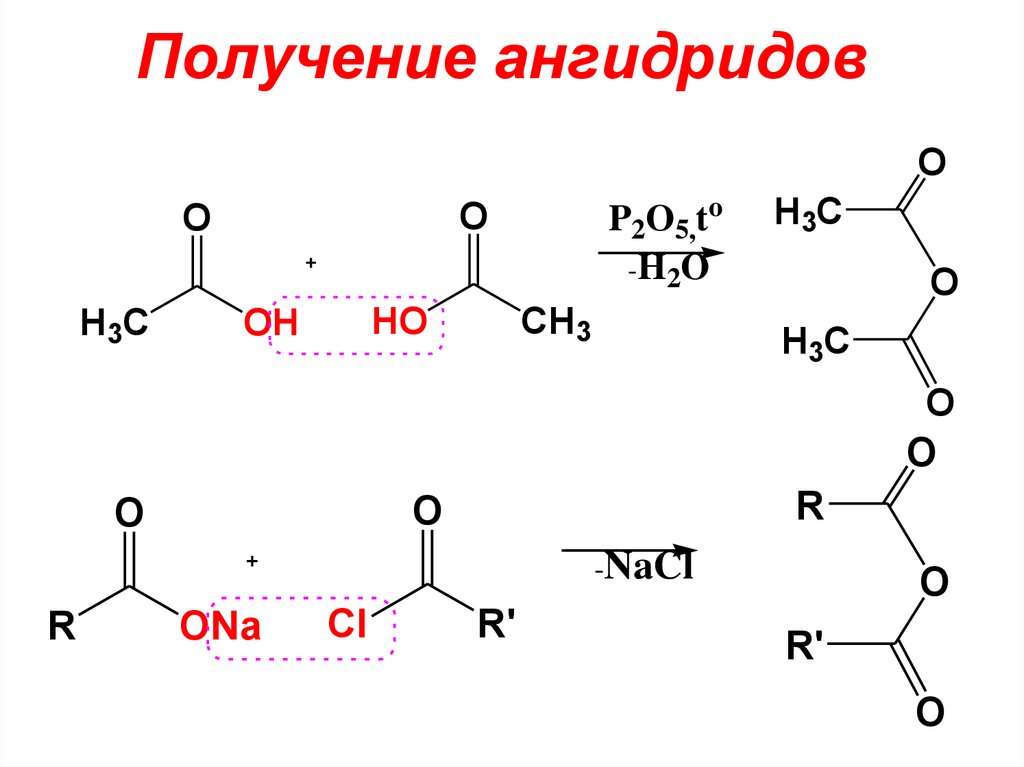
дикарбоновых кислот правилами ИЮПАК
рекомендуется использование
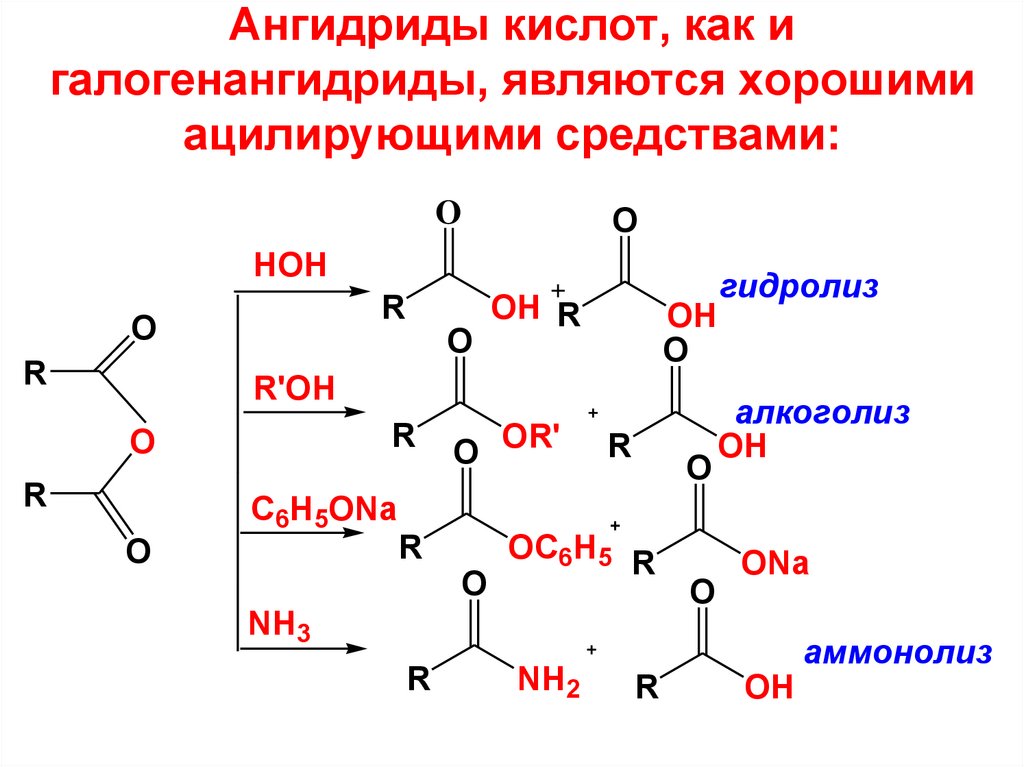
тривиальных названий, например,
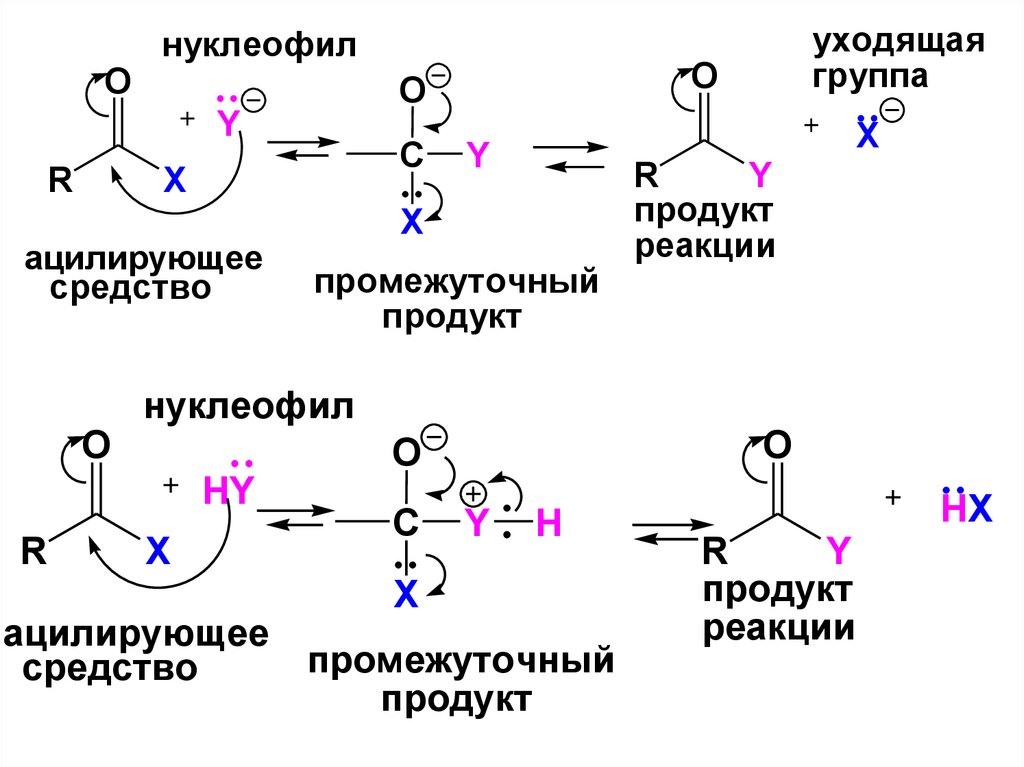
название «уксусная кислота»
предпочтительнее названия «этановая
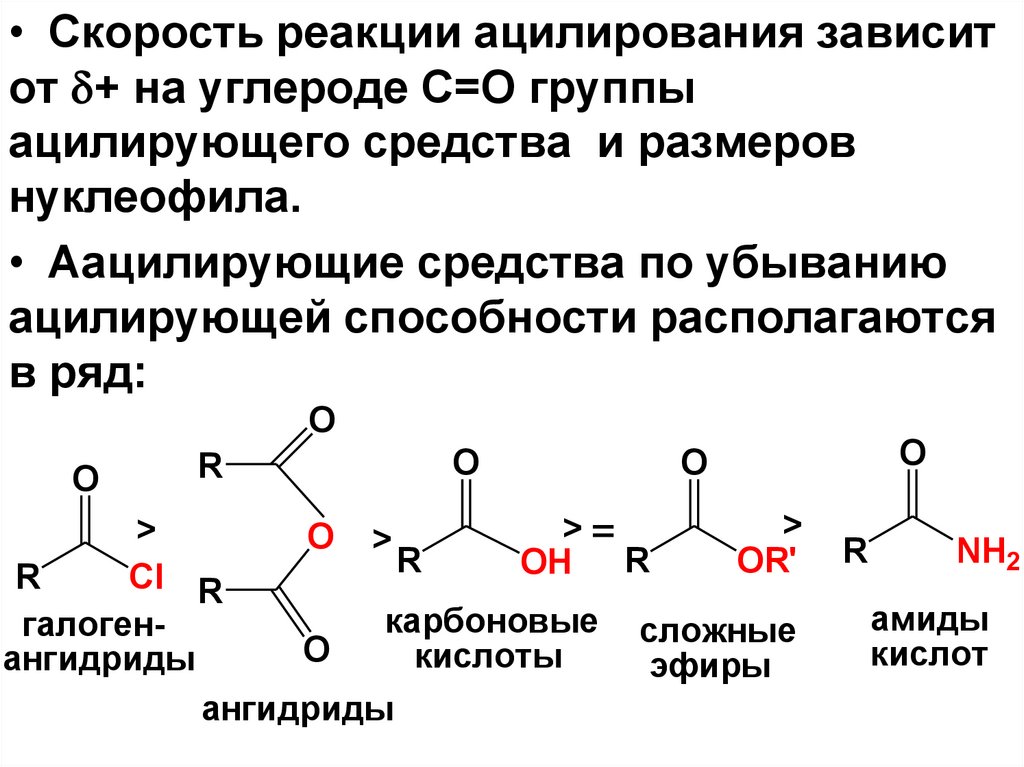
кислота».
CH3CHCH2COOH
CH3
HOOC СH2CH2 COOH
СOOH
бутандиовая (янтарная)
кислота
3-метилбутановая
циклогексанкарбоновая
(изовалериановая)кислота
кислота
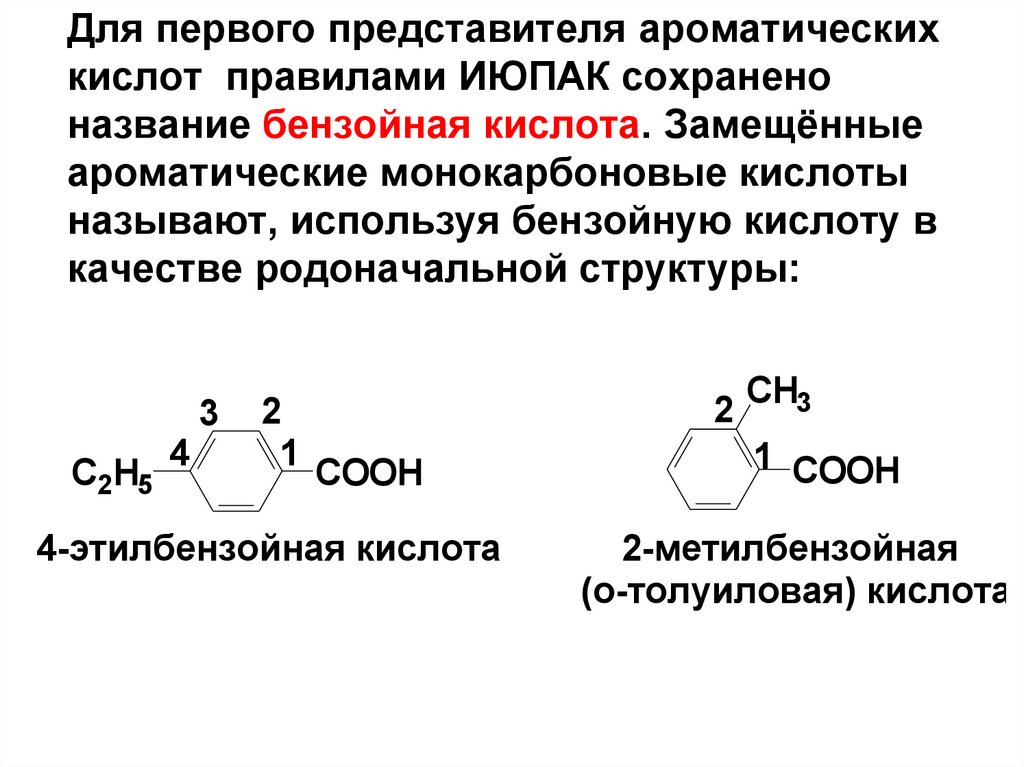
7.
Для первого представителя ароматическихкислот правилами ИЮПАК сохранено
название бензойная кислота. Замещённые
ароматические монокарбоновые кислоты
называют, используя бензойную кислоту в
качестве родоначальной структуры:
C2H5
4
3
2
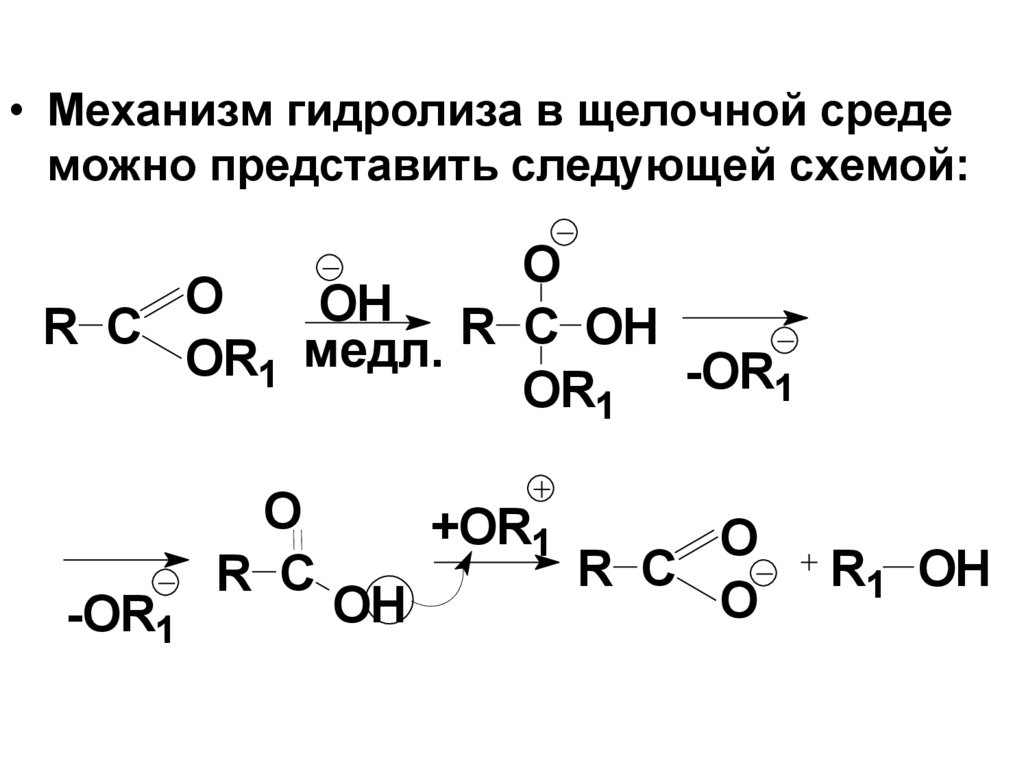
1
2
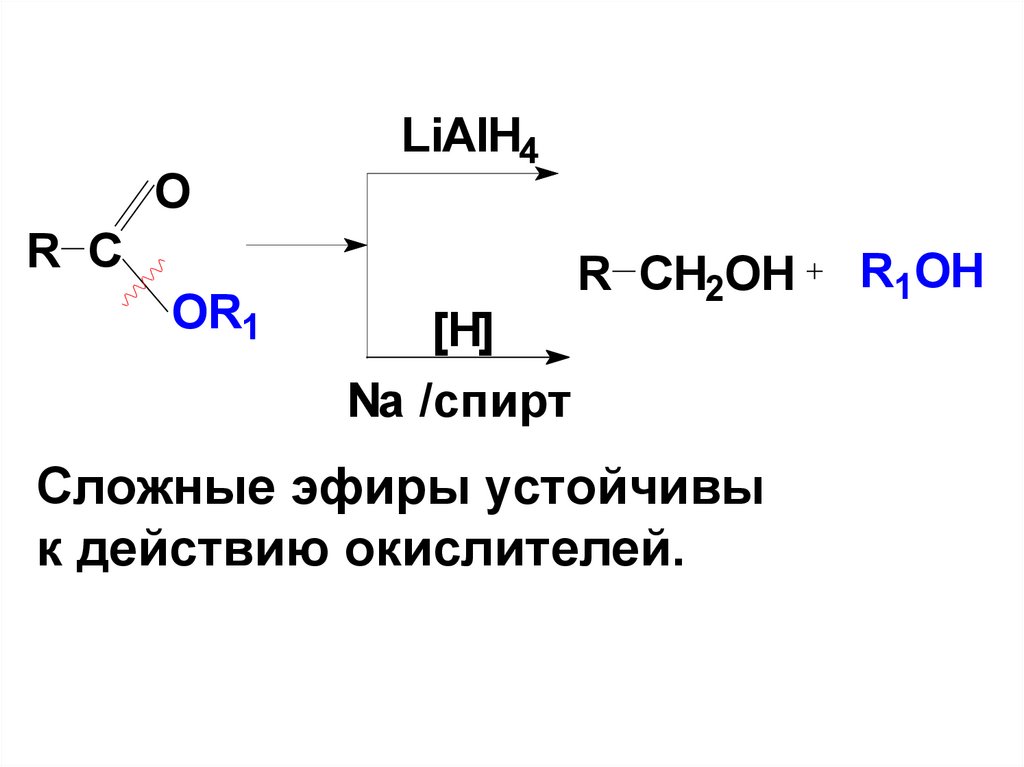
СOOH
4-этилбензойная кислота
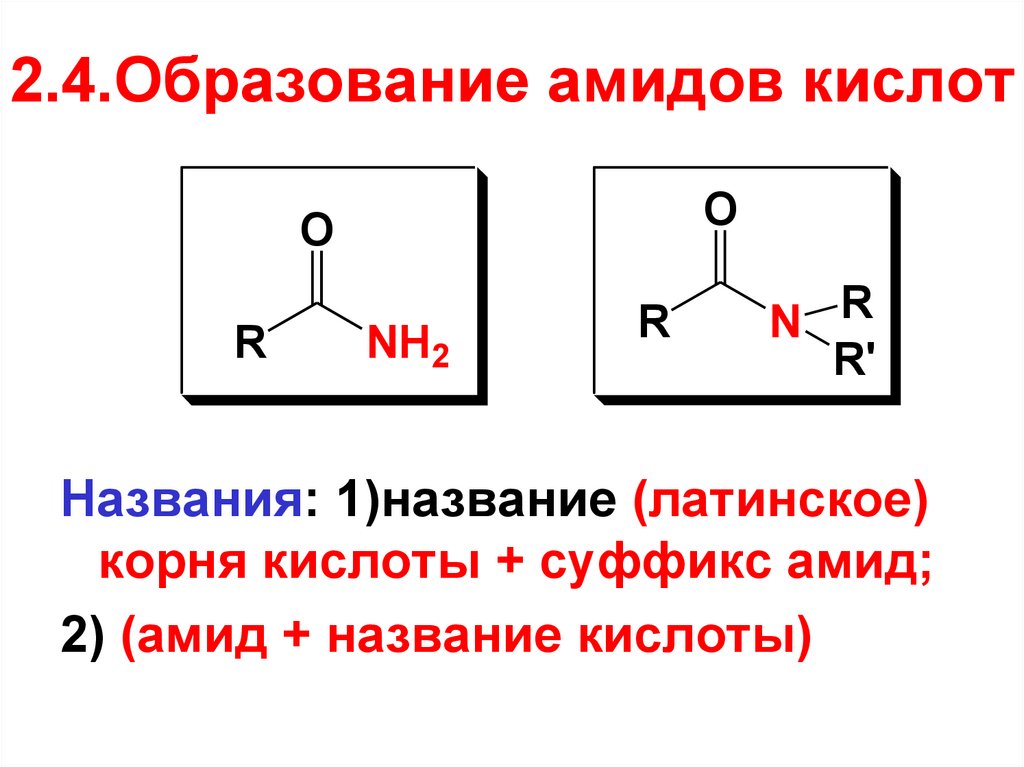
CH3
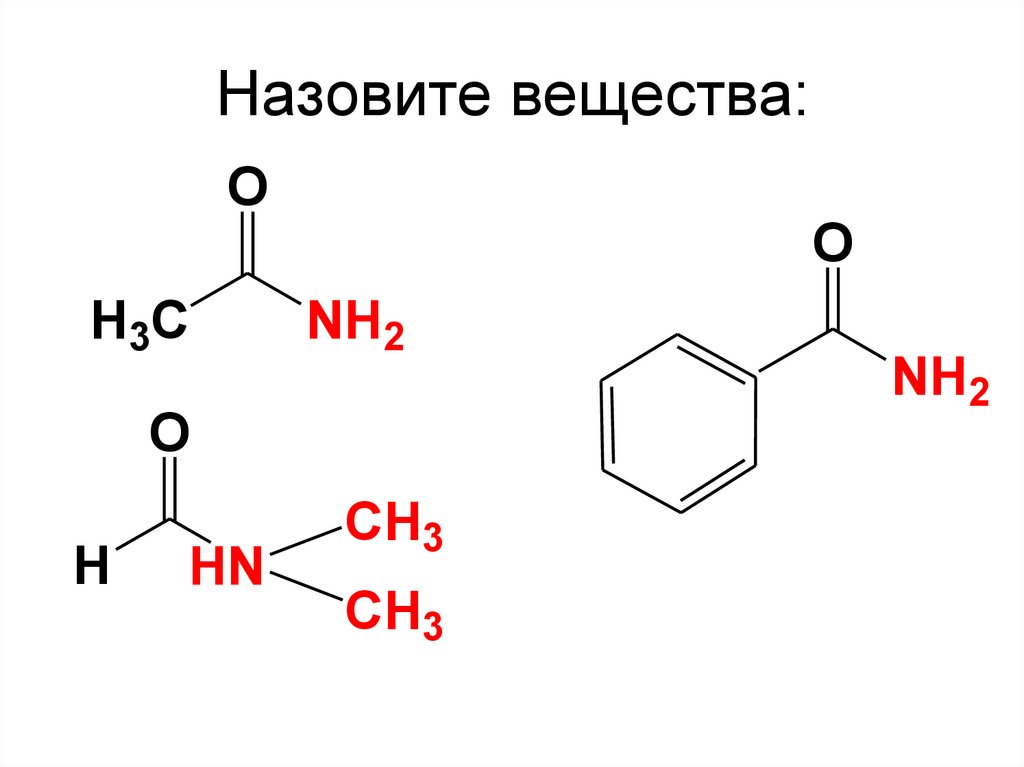
1 СOOH
2-метилбензойная
(о-толуиловая) кислота
8.
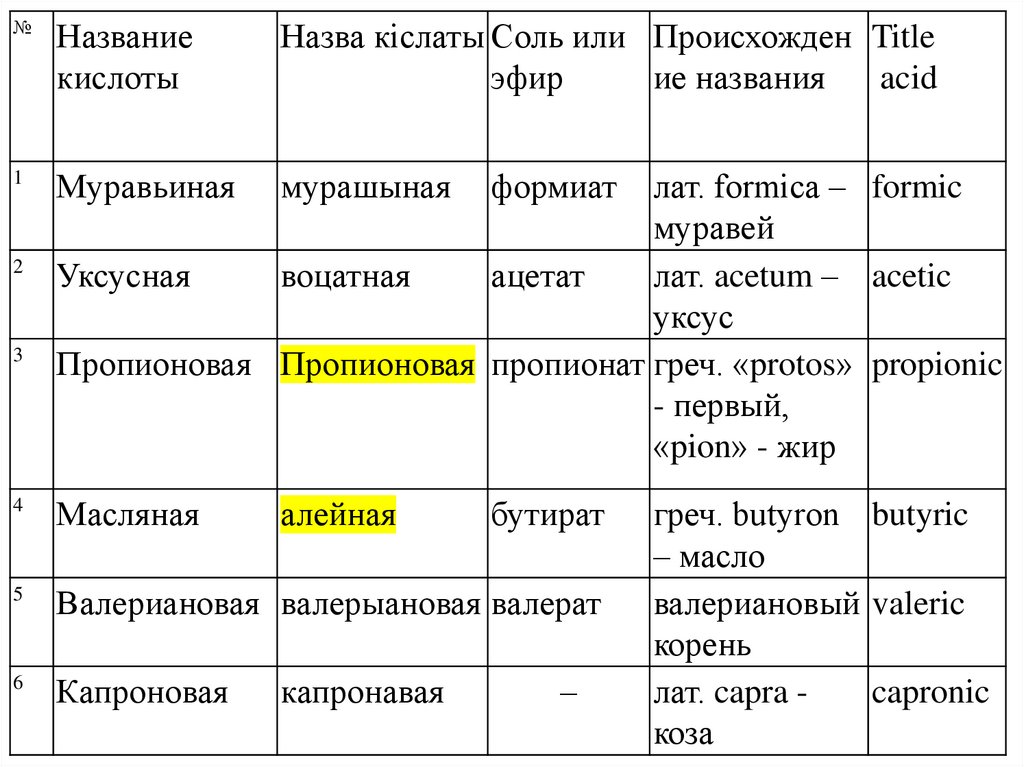
№Название
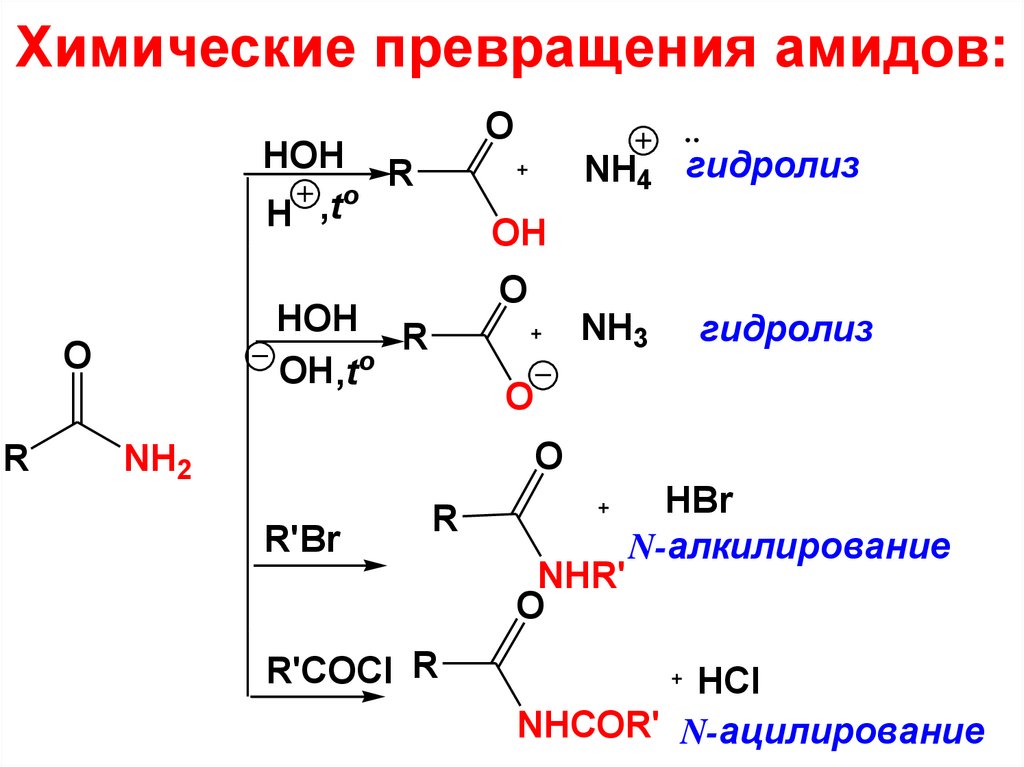
кислоты
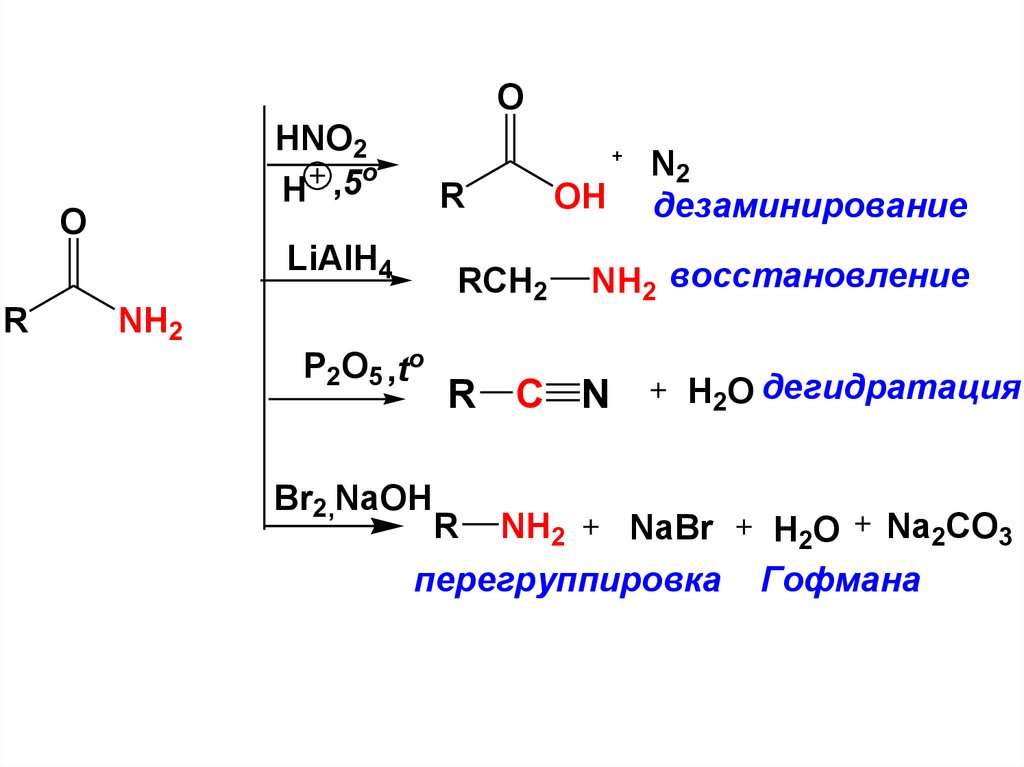
Назва кіслаты Соль или Происхожден Title
эфир
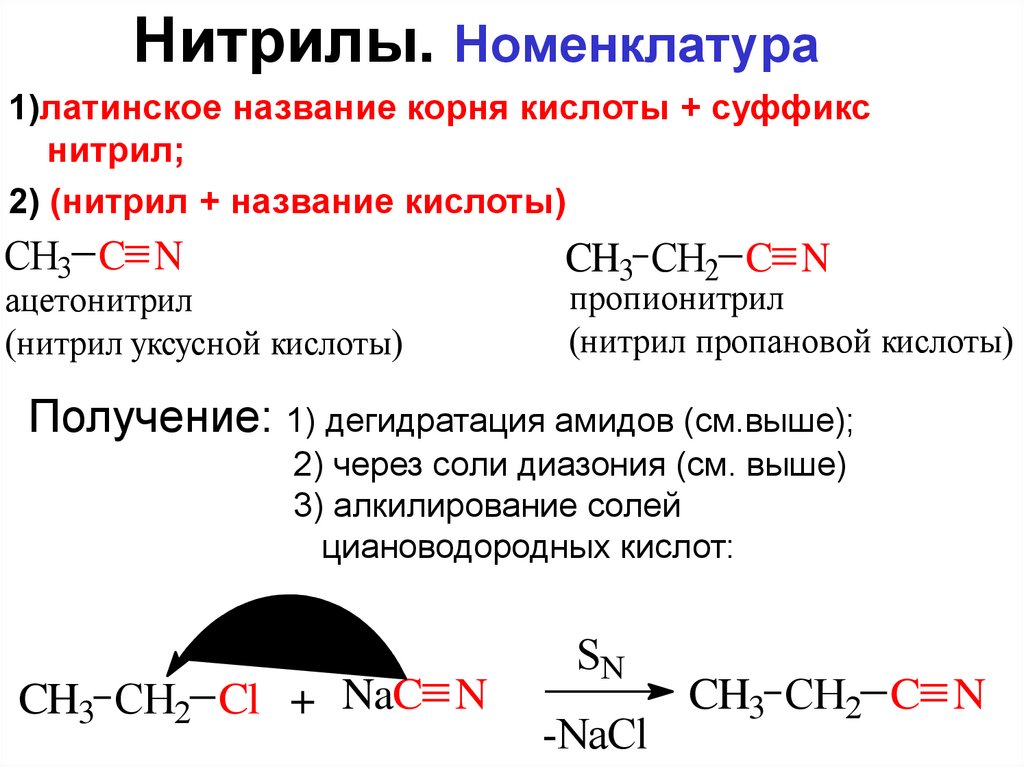
ие названия
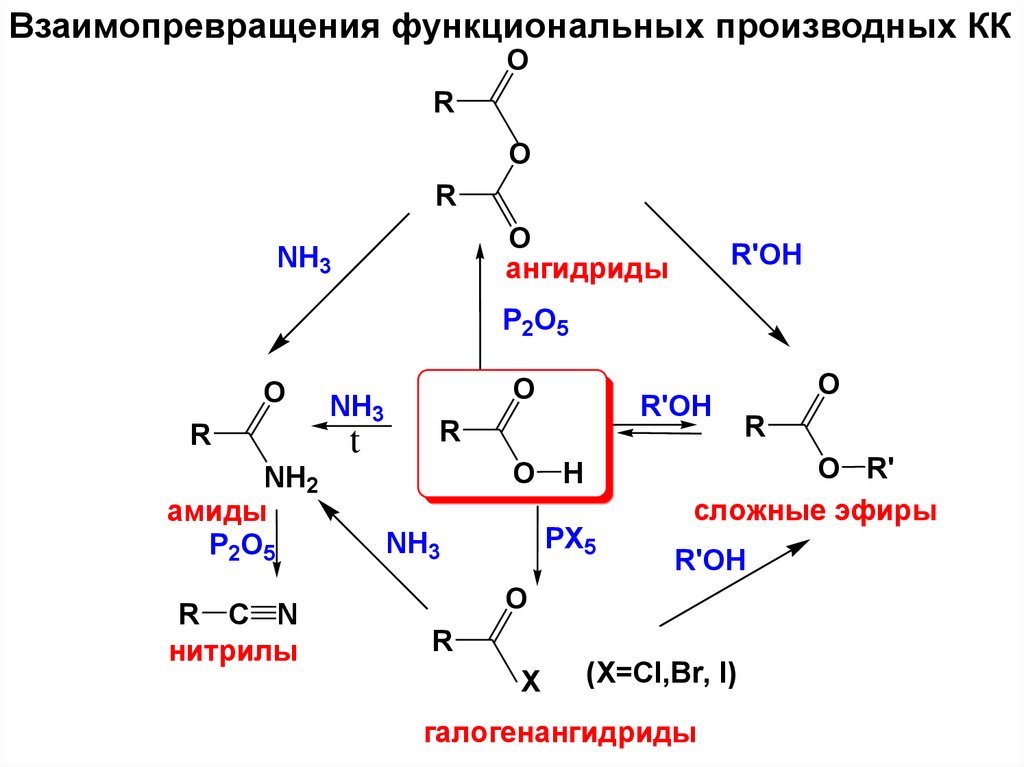
acid
1
Муравьиная
мурашыная
формиат
4
Масляная
алейная
бутират
5
Валериановая валерыановая валерат
6
Капроновая
2
3
лат. formica – formic
муравей
Уксусная
воцатная
ацетат
лат. acetum – acetic
уксус
Пропионовая Пропионовая пропионат греч. «protos» propionic
- первый,
«pion» - жир
капронавая
–
греч. butyron butyric
– масло
валериановый valeric
корень
лат. capra capronic
коза
9.
Все соединения, которые могут бытьпроизведены от кислот в результате
химических превращений по
карбоксильной группе, называют
функциональными производными
кислот.
Эти соединения обычно содержат
ацильную группу.
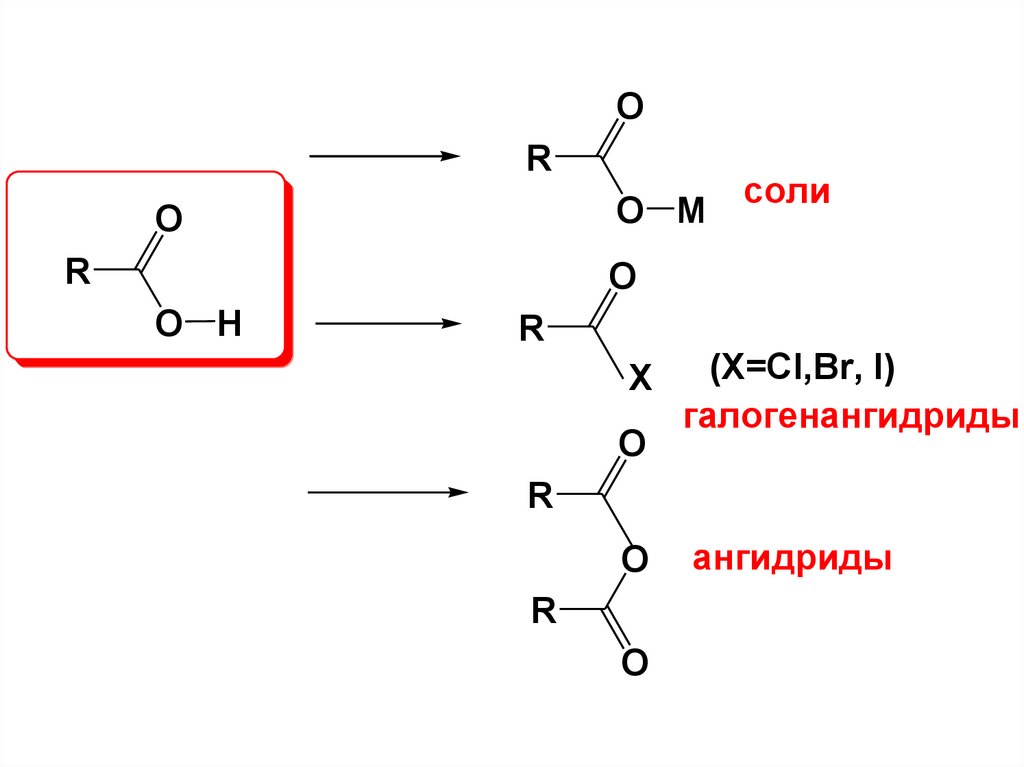
10.
OR
O M
O
R
соли
O
O H
R
X
O
(X=Cl,Br, I)
галогенангидриды
R
O
R
O
ангидриды
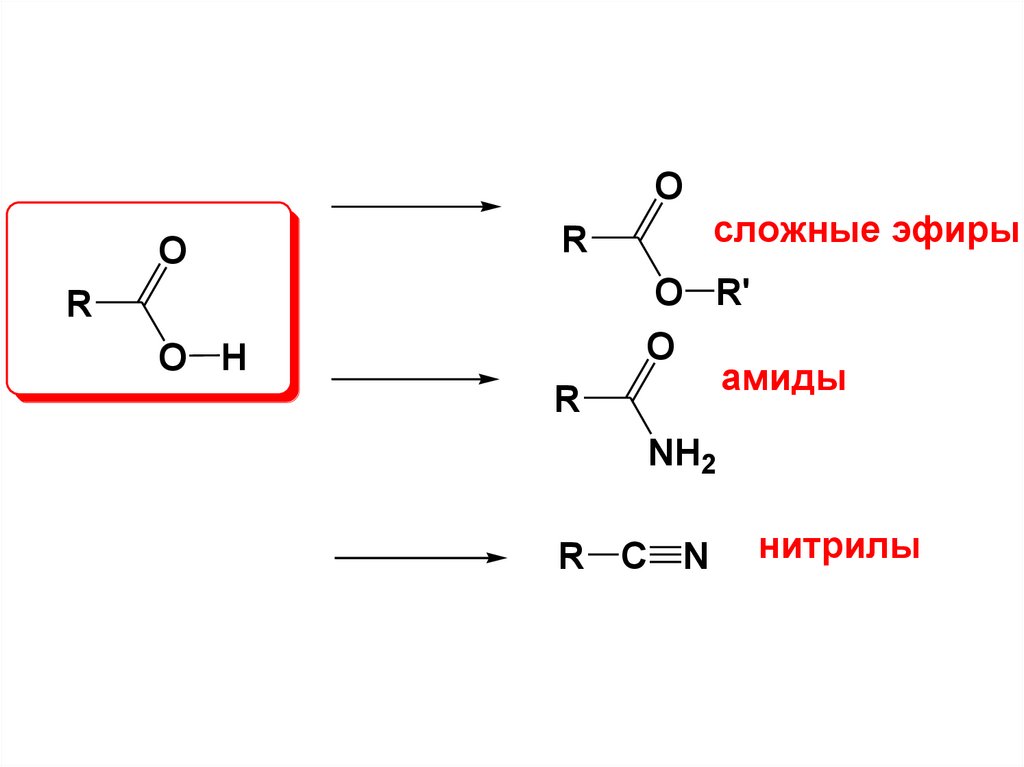
11.
OO
сложные эфиры
R
R
O H
R
O R'
O
амиды
NH2
R C N
нитрилы
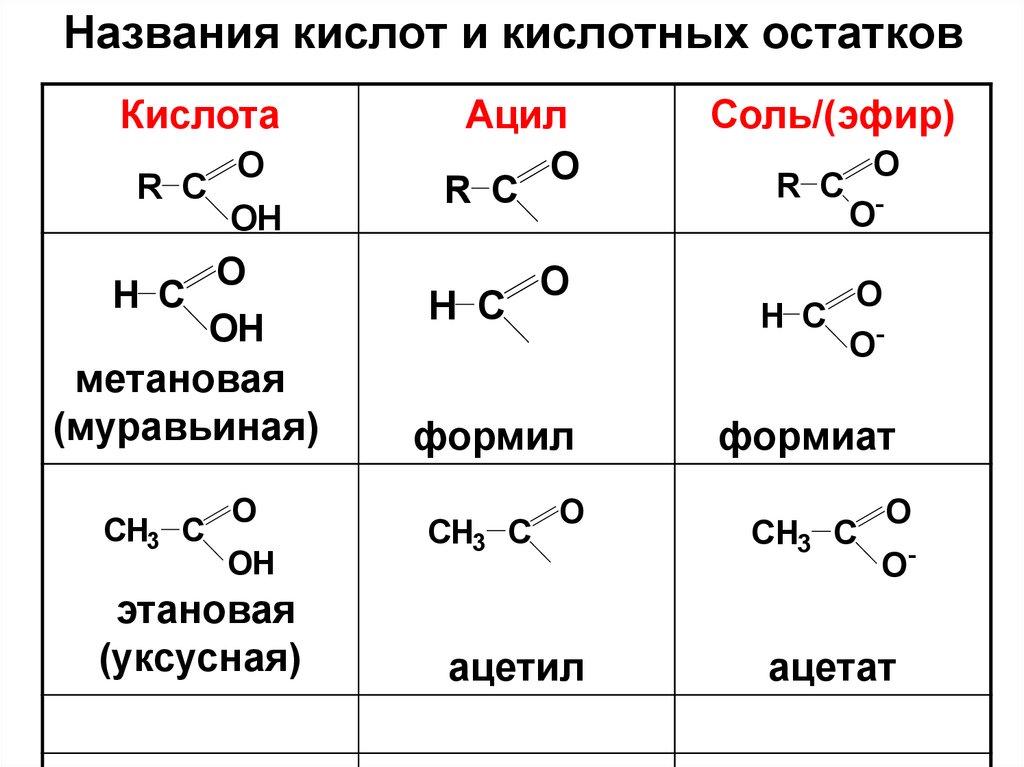
12. Названия кислот и кислотных остатков
КислотаR C
H C
O
OH
O
OH
метановая
(муравьиная)
CH3 C
O
OH
этановая
(уксусная)
Ацил
R C
H C
O
O
формил
CH3 C
O
ацетил
Соль/(эфир)
R C
O
O-
O
H C O
формиат
CH3 C
O
O-
ацетат
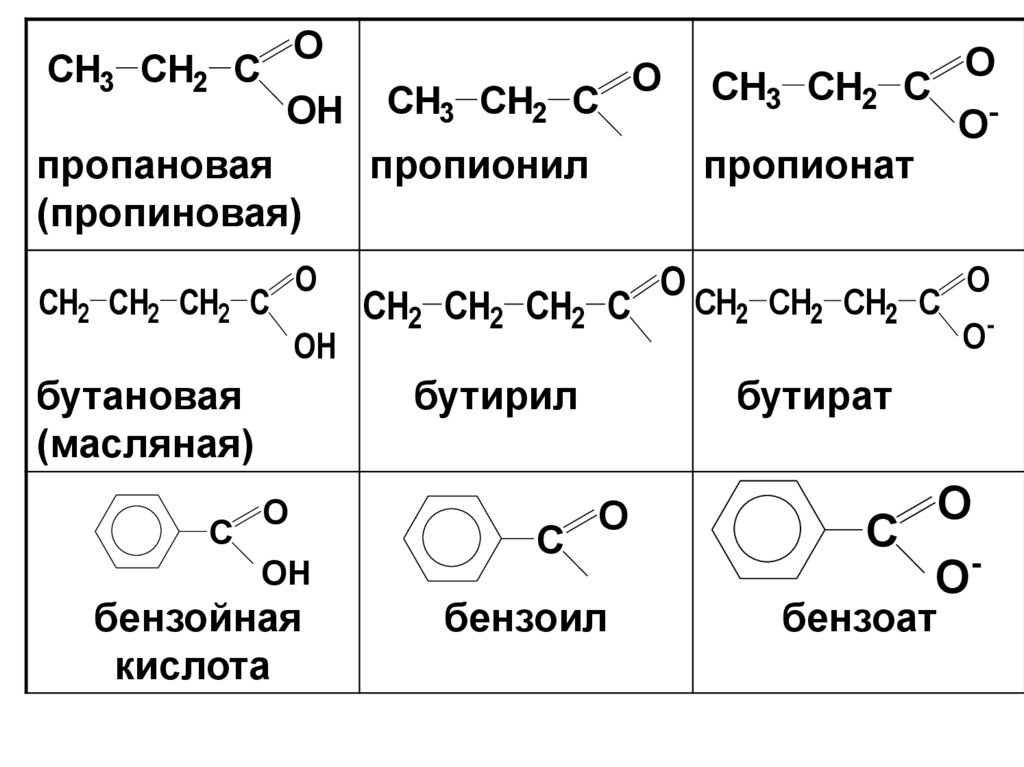
13.
OCH3 CH2 C
OH
пропановая
(пропиновая)
CH2 CH2 CH2 C
O
OH
бутановая
(масляная)
C
CH3 CH2 C
пропионил
CH2 CH2 CH2 C
OH
бензойная
кислота
C
O
CH3 CH2 C
O-
пропионат
бутирил
O
O
O
CH2 CH2 CH2 C
O
O-
бутират
O
бензоил
C
O
-
O
бензоат
14.
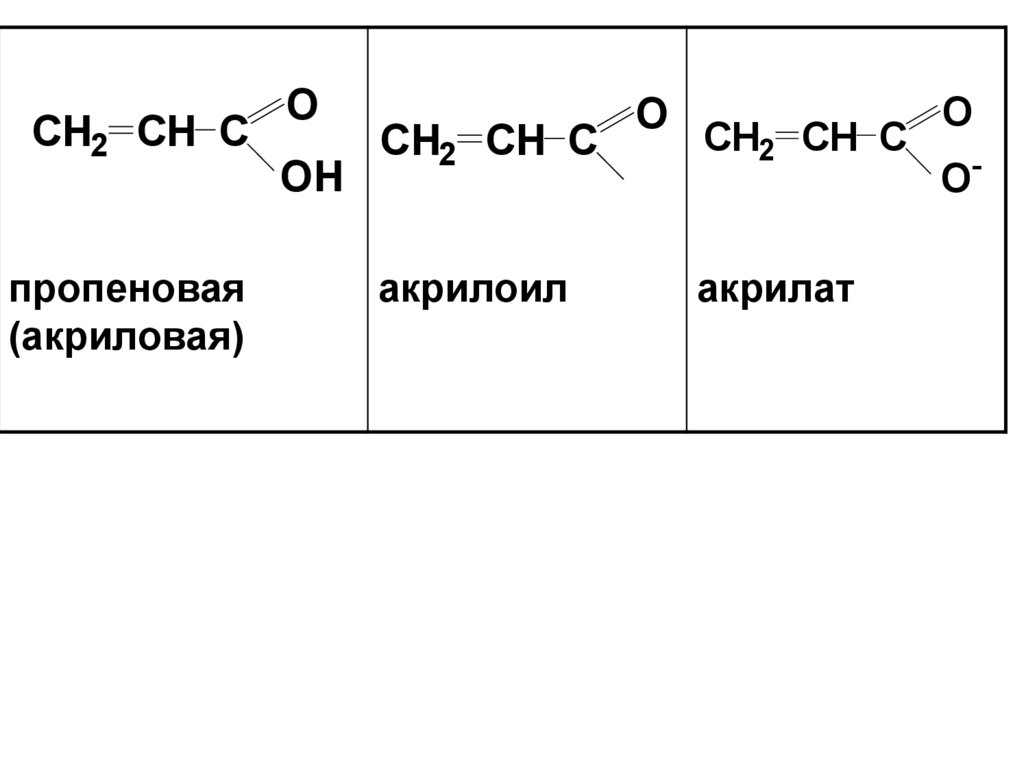
CH2 CH Cпропеновая
(акриловая)
O
OH
CH2 CH C
акрилоил
O
CH2 CH C
акрилат
O
O-
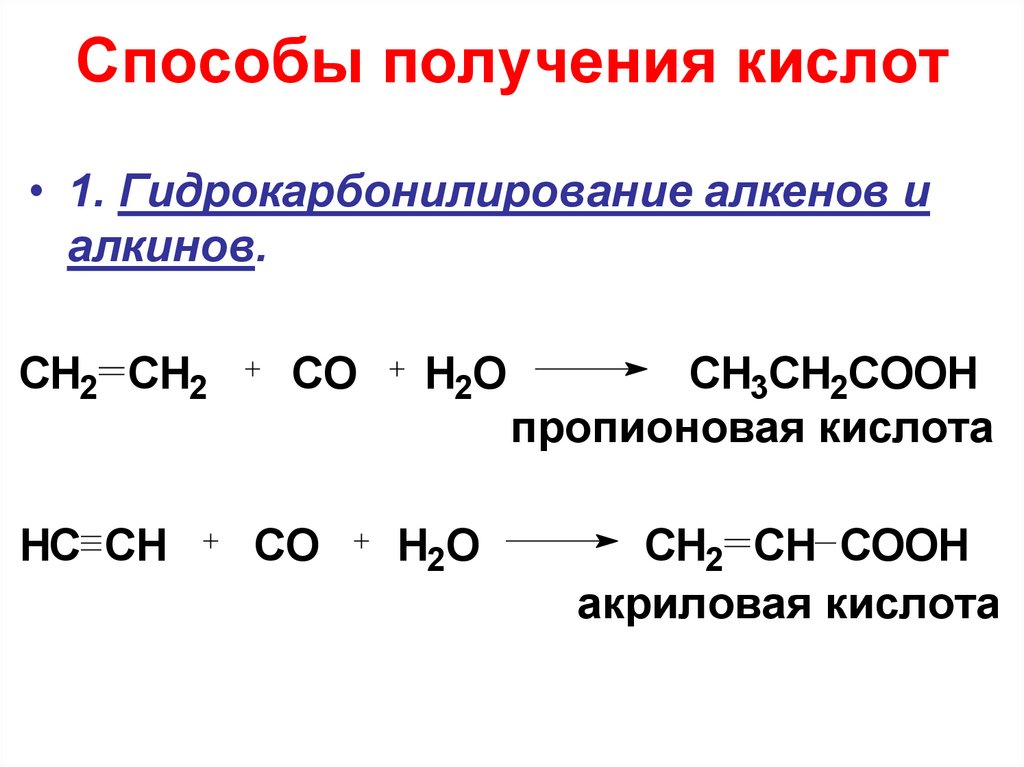
15. Способы получения кислот
• 1. Гидрокарбонилирование алкенов иалкинов.
CH2 CH2
HC CH
CO
CO
H2O
H2O
CH3CH2COOH
пропионовая кислота
CH2 CH COOH
акриловая кислота
16. 2. Окисление гомологов аренов.
XСH3
[O]
СOOH
X
Х- неокисляемая группа
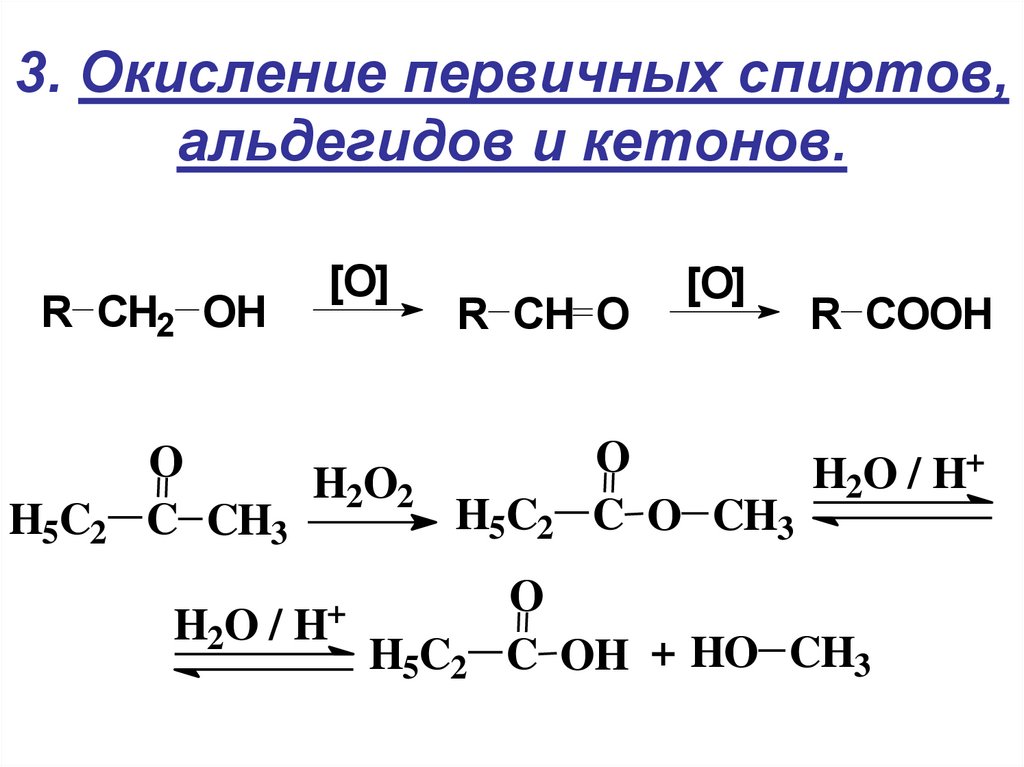
17. 3. Окисление первичных спиртов, альдегидов и кетонов.
R СH2 OHH5C2
[O]
R CH O
[O]
R COOH
O
+
O
H
O
/
H
2
H2O2
H5C2 C O CH3
C CH3
H2O /
H+
H5C2
O
C OH + HO CH3
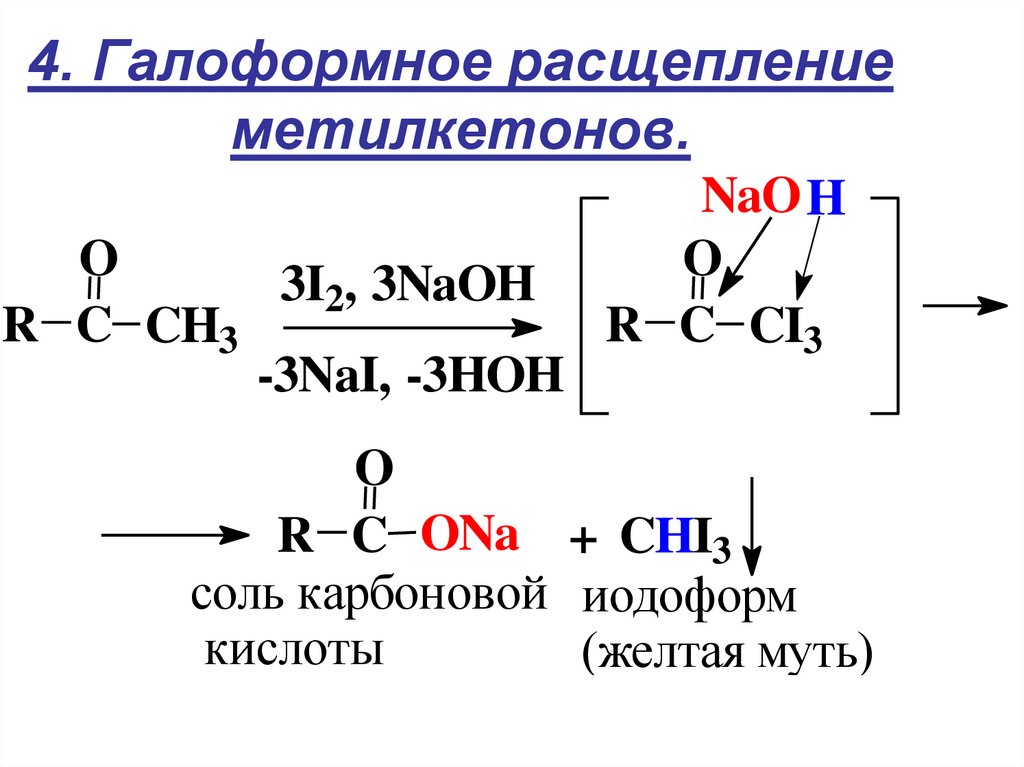
18. 4. Галоформное расщепление метилкетонов.
O3I2, 3NaOH
R C CH3
-3NaI, -3HOH
NaO H
O
R C CI3
O
R C ONa + CHI3
соль карбоновой иодоформ
кислоты
(желтая муть)
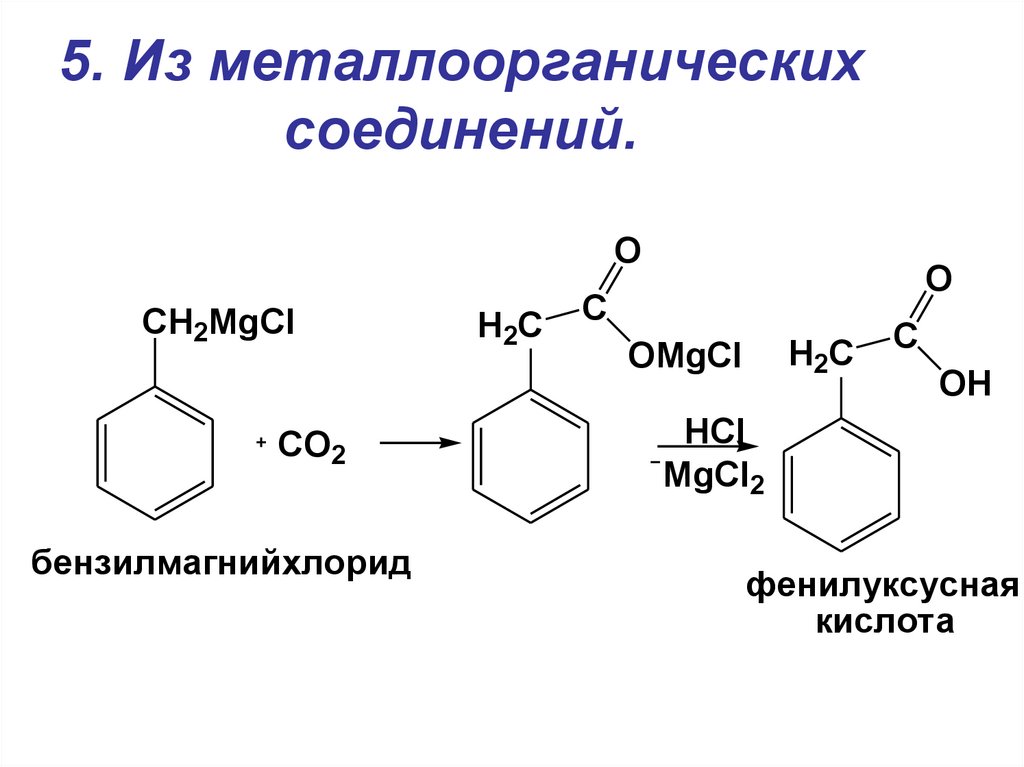
19. 5. Из металлоорганических соединений.
OCH2MgCl
CO2
бензилмагнийхлорид
H2C
O
C
H2C
OMgCl
C
OH
HCl
MgCl2
фенилуксусная
кислота
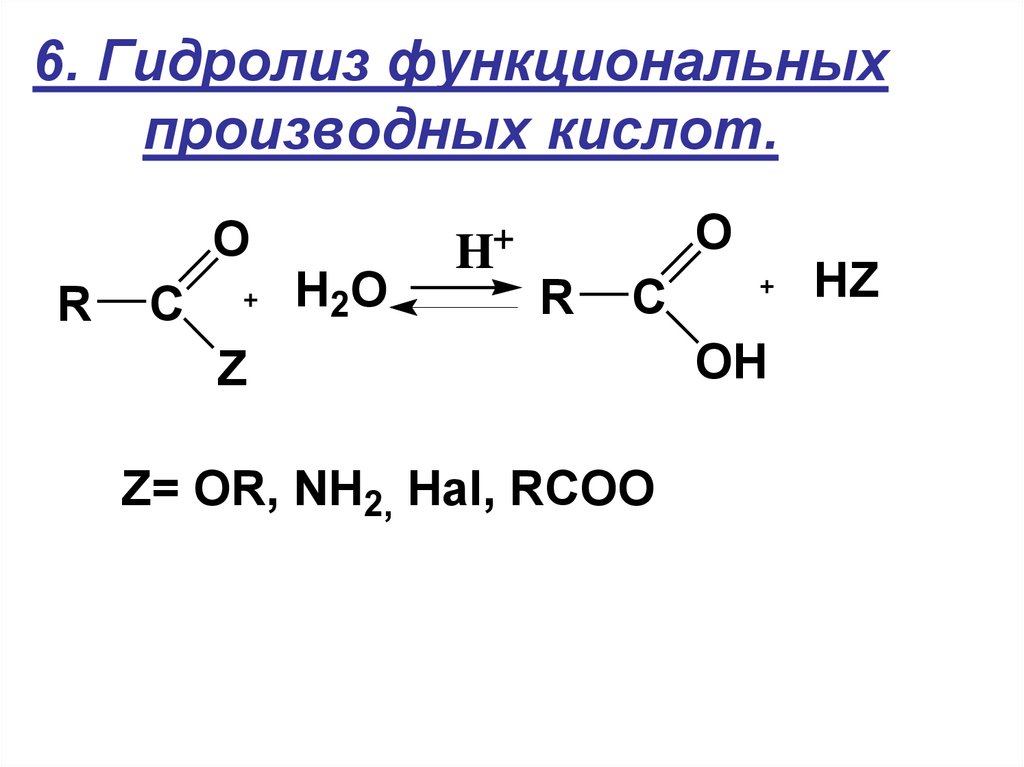
20. 6. Гидролиз функциональных производных кислот.
OR
C
O
+
H2O
H
R
C
Z
Z= OR, NH2, Hal, RCOO
OH
HZ
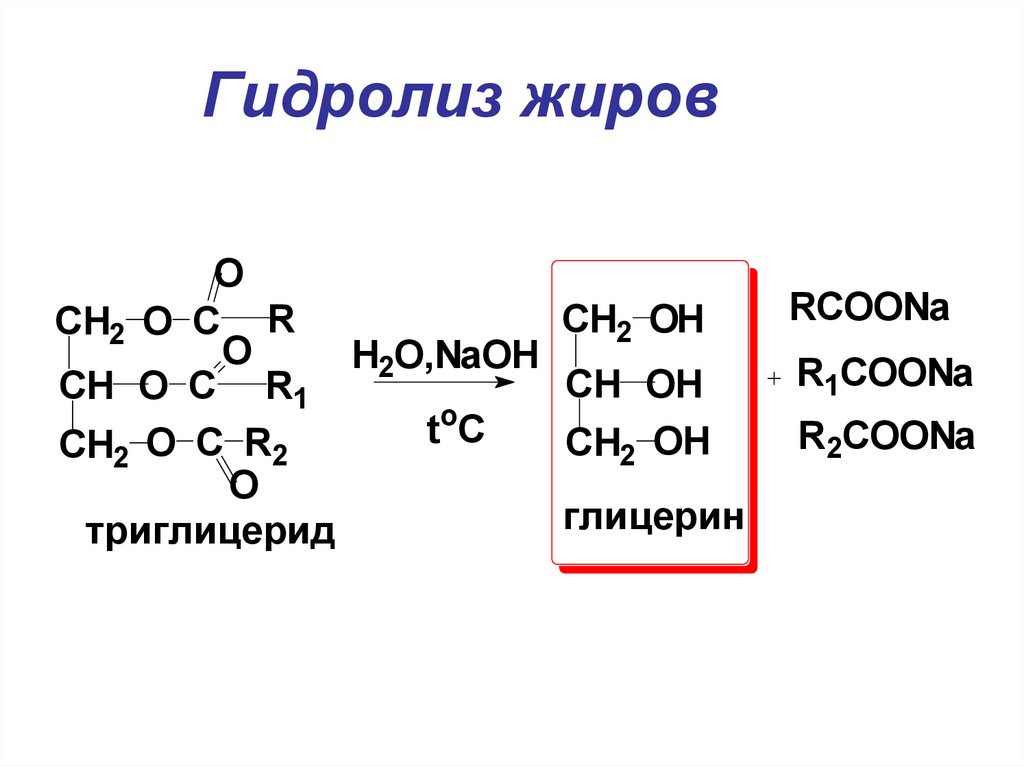
21. Гидролиз жиров
OCH2 O C R
O
H2O,NaOH
CH O C R1
o
t
C
CH2 O C R2
O
триглицерид
CH2 OH
RCOONa
CH OH
CH2 OH
R1COONa
глицерин
R2COONa
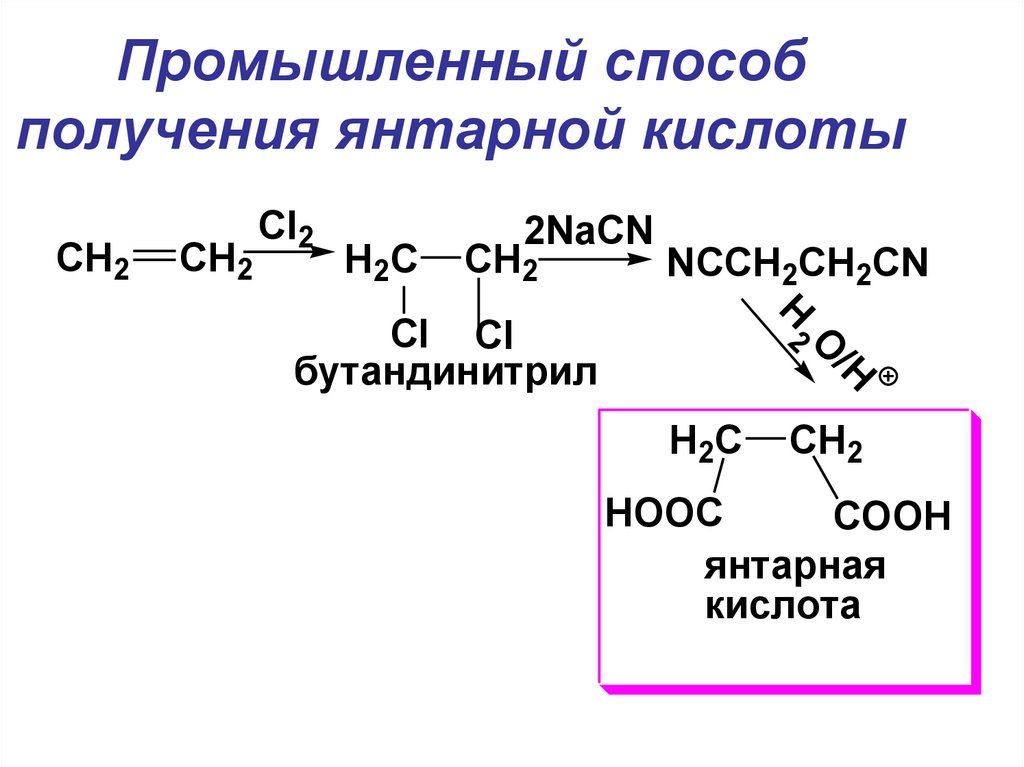
22. Промышленный способ получения янтарной кислоты
CH2CH2
Cl2
H2C
2NaCN
CH2
Cl Cl
бутандинитрил
NCCH2CH2CN
H
2O
/H
H2C
CH2
HOOC
COOH
янтарная
кислота
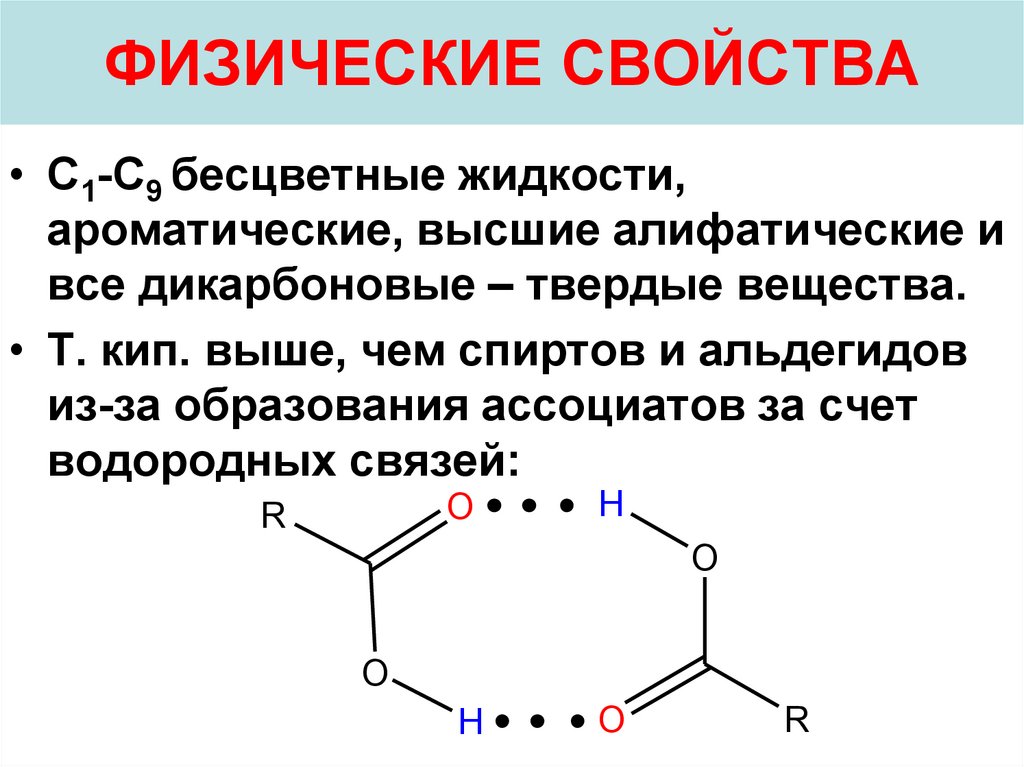
23. ФИЗИЧЕСКИЕ СВОЙСТВА
• С1-С9 бесцветные жидкости,ароматические, высшие алифатические и
все дикарбоновые – твердые вещества.
• Т. кип. выше, чем спиртов и альдегидов
из-за образования ассоциатов за счет
водородных связей:
O
R
H
O
O
H
O
R
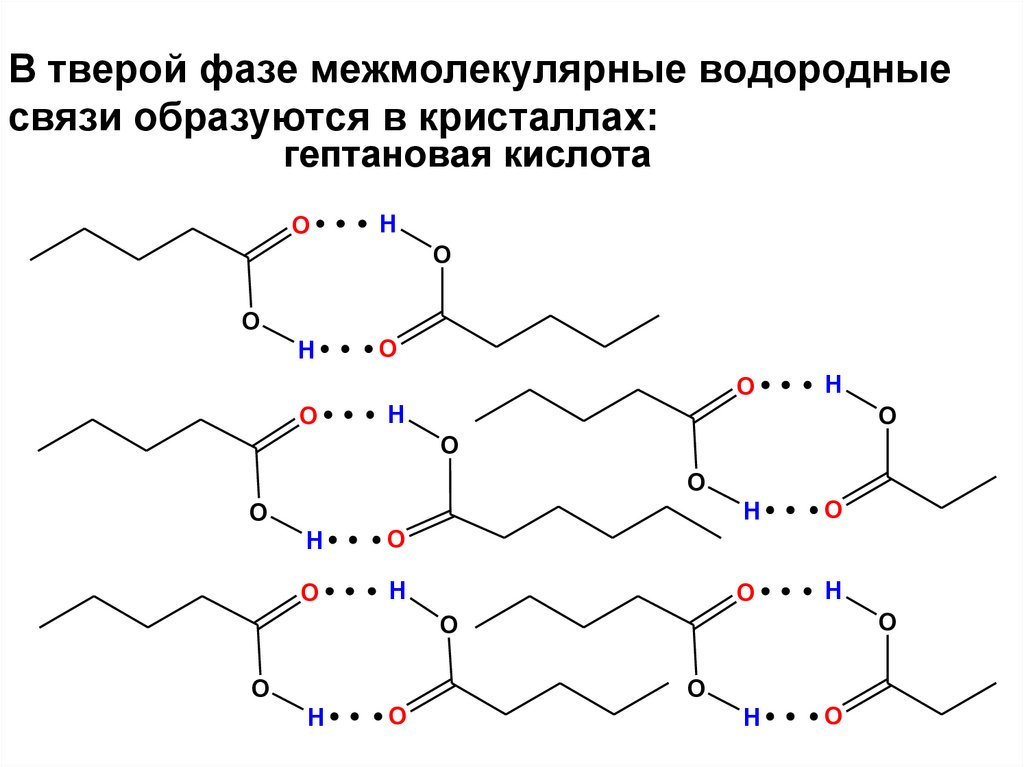
24. В тверой фазе межмолекулярные водородные связи образуются в кристаллах:
гептановая кислотаO
H
O
O
H
O
O
O
H
H
O
O
O
O
H
O
O
H
H
O
O
H
O
O
O
O
H
O
H
O
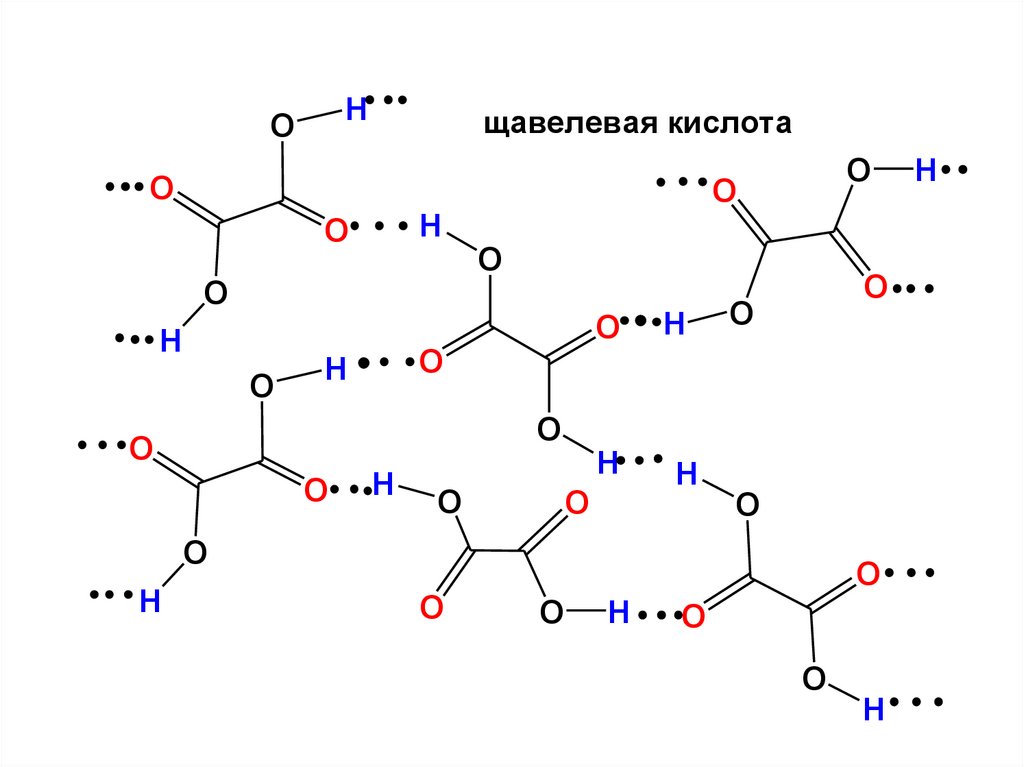
25.
HO
щавелевая кислота
O
O
O
H
O
O
O
O
H
O
H
O
O
O
H
O
O
O
H
H
O
O
H
O
O
H
O
O
O
H
O
O
H
H
26.
• Водородные связи в карбоновыхкислотах относятся к числу самых
сильных: 29 кДж/моль.
• Низшие члены гомологического ряда
алифатических монокарбоновых кислот
смешиваются с водой в любых
пропорциях.
• Ароматические карбоновые кислоты
плохо растворимы в воде, но лучше в
этаноле.
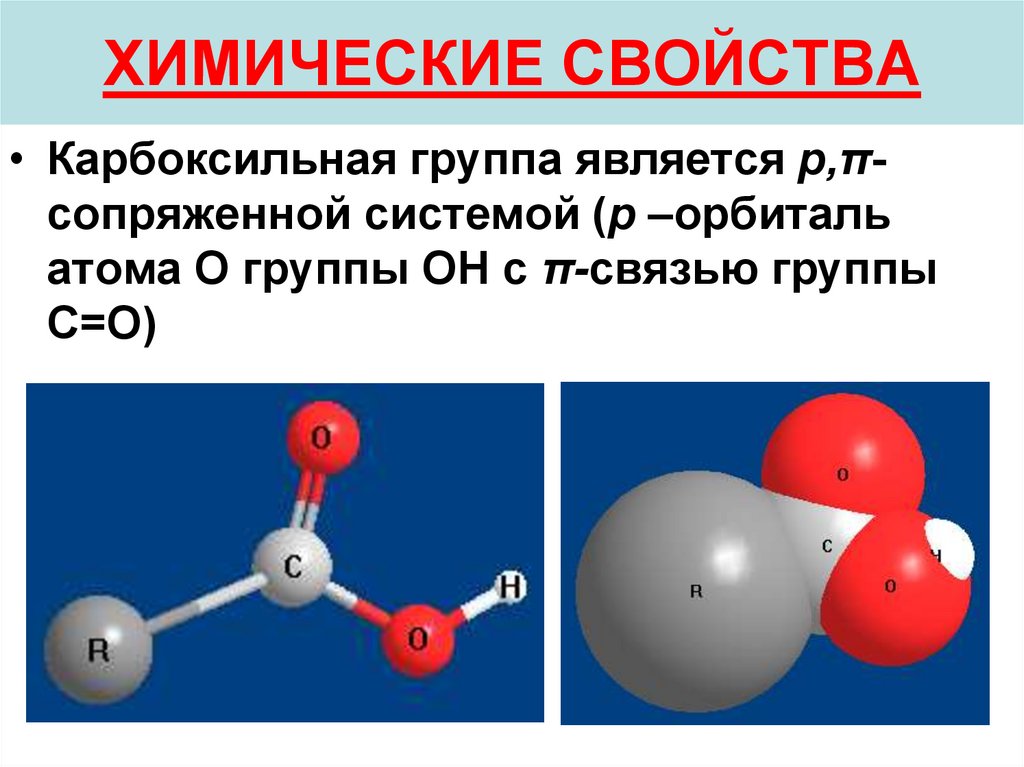
27. ХИМИЧЕСКИЕ СВОЙСТВА
• Карбоксильная группа является p,πсопряженной системой (p –орбитальатома О группы ОН с π-связью группы
С=О)
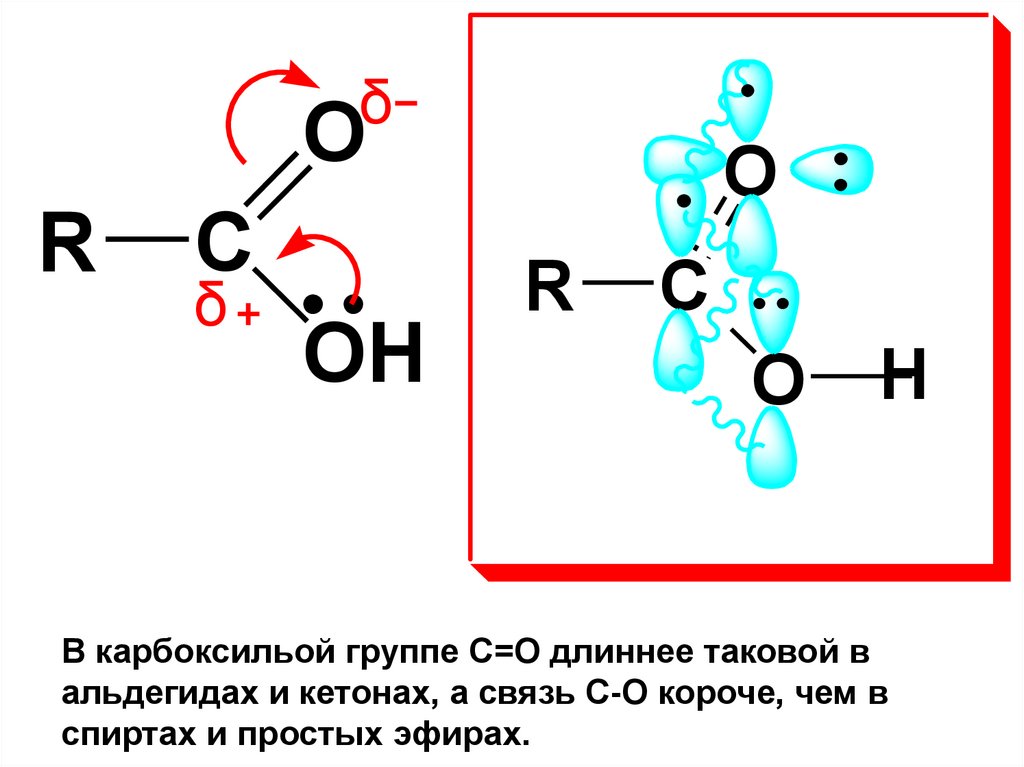
28.
δO
R
C
δ
OH
O
R
C
O
H
В карбоксильой группе С=О длиннее таковой в
альдегидах и кетонах, а связь С-О короче, чем в
спиртах и простых эфирах.
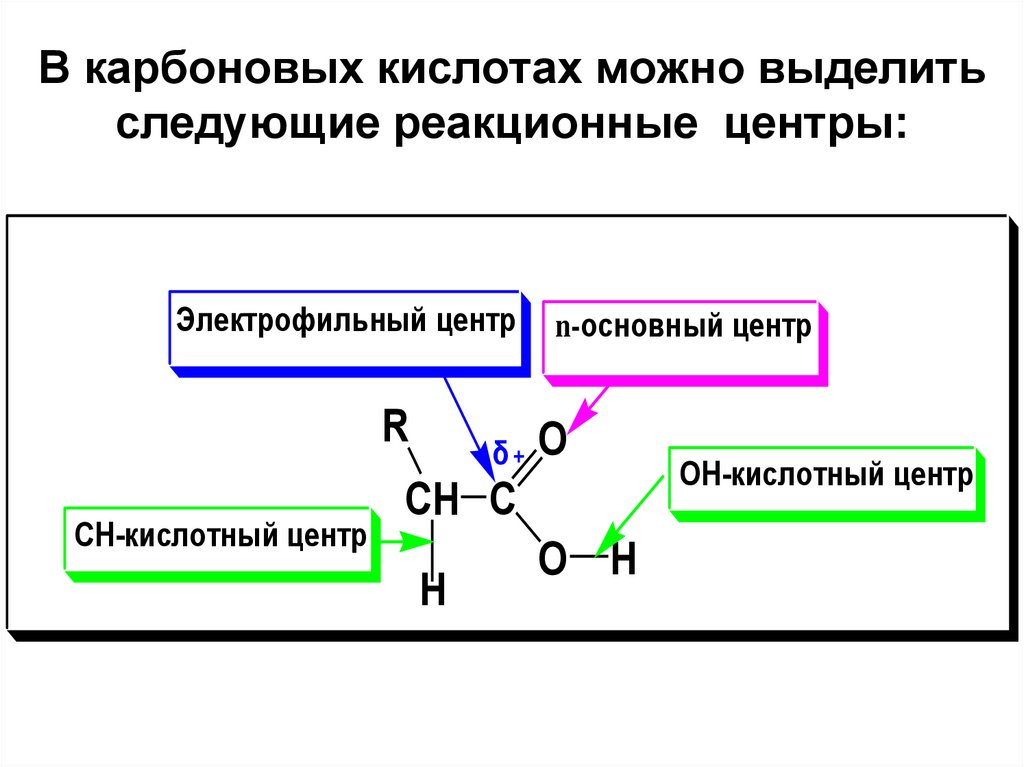
29. В карбоновых кислотах можно выделить следующие реакционные центры:
Электрофильный центрR
СН-кислотный центр
δ
n-основный центр
O
CH C
H
O H
ОН-кислотный центр
30.
• ОН-кислотный центр, за счет которогокарбоновые кислоты проявляют кислотные
свойства в реакция с основаниями;
• Электрофильный центр – атом С
карбоксильной группы, при участии которого
карбоновые кислоты и их функциональные
производные вступают в реакции
нуклеофильного замещения;
• Основный центр – оксогруппа со своей
неподеленной электронной парой, которая
протонируется в реакциях нуклеофильного
замещения.
• С-Н –кислотный центр, возникающий у αатома углерода за счет –I-эффекта группы
СООН.
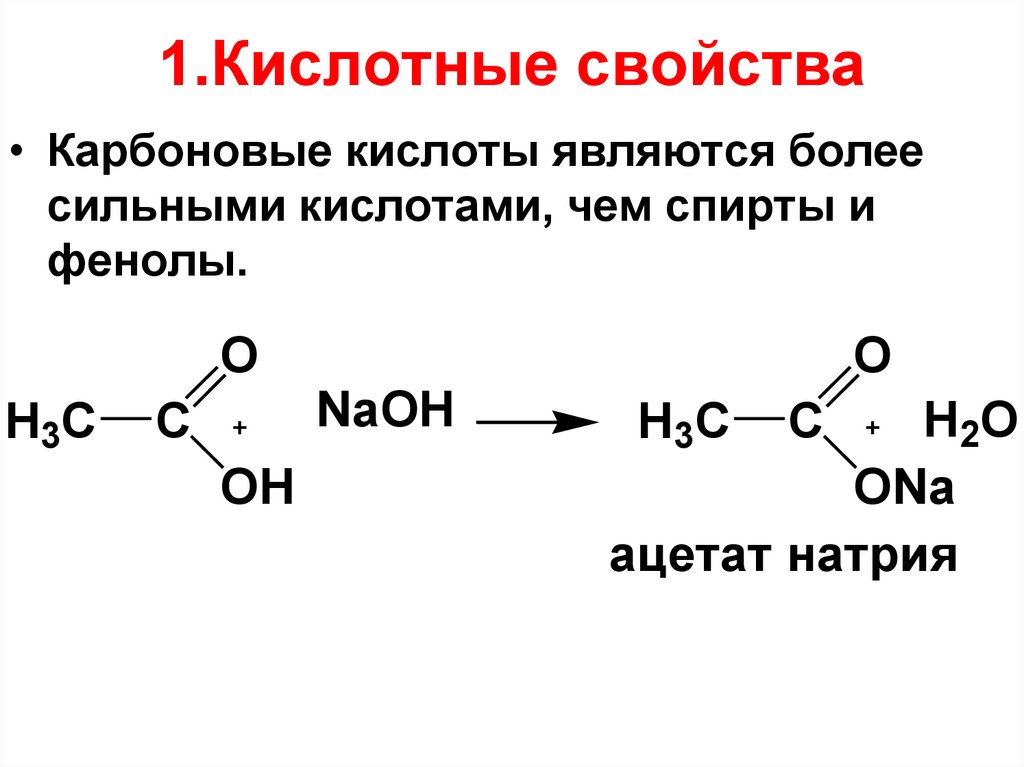
31. 1.Кислотные свойства
• Карбоновые кислоты являются болеесильными кислотами, чем спирты и
фенолы.
O
H3C
C
OH
NaOH
O
H2O
ONa
ацетат натрия
H3 C
C
32.
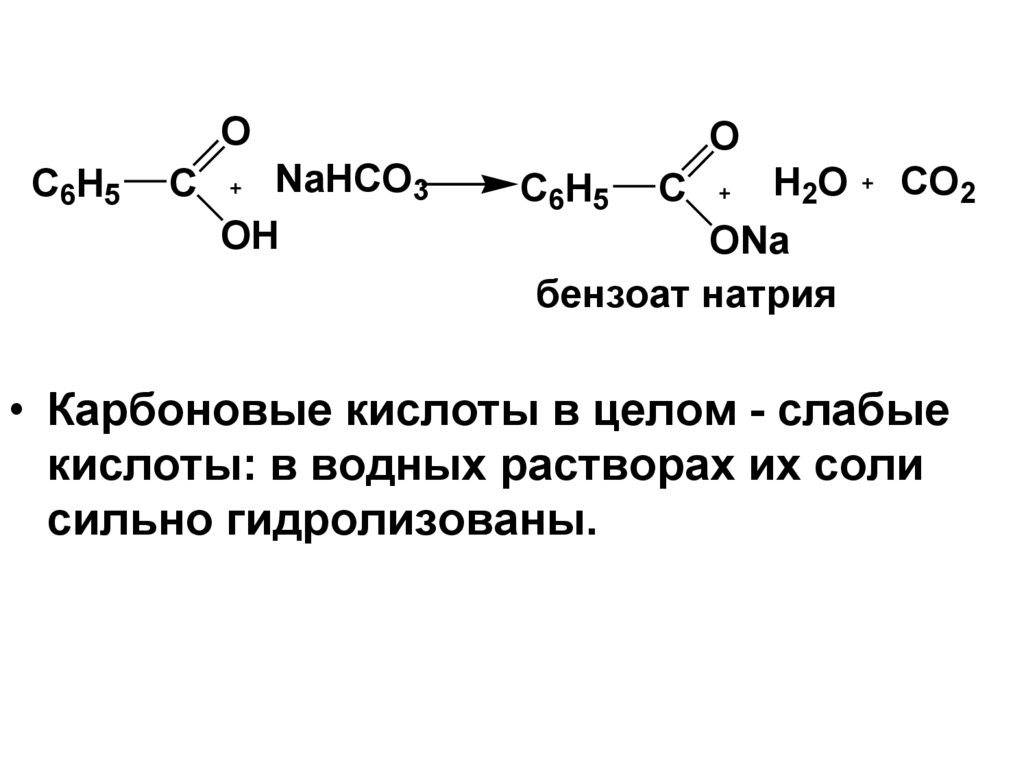
OC6H5
C
NaHCO3
OH
O
H2O
ONa
бензоат натрия
C6H5
C
CO2
• Карбоновые кислоты в целом - слабые
кислоты: в водных растворах их соли
сильно гидролизованы.
33.
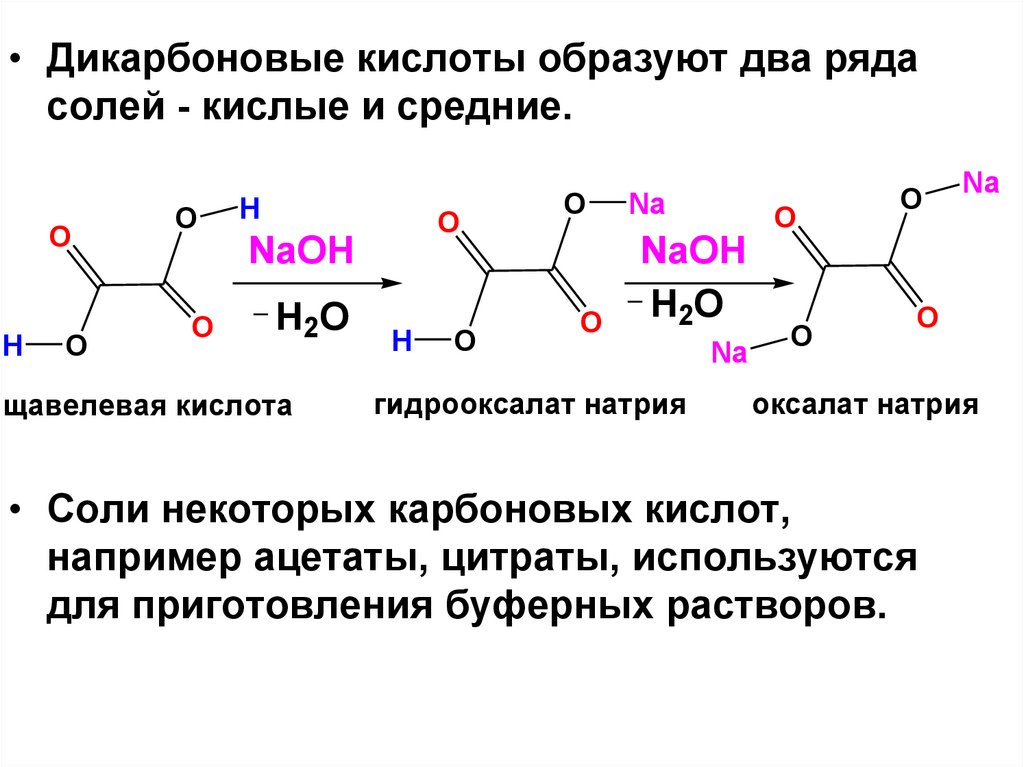
• Дикарбоновые кислоты образуют два рядасолей - кислые и средние.
O
H
O
O
O
H
O
NaOH
H2O
щавелевая кислота
H
O
O
O
Na
NaOH
H2O
гидрооксалат натрия
Na
O
O
O
Na
O
оксалат натрия
• Соли некоторых карбоновых кислот,
например ацетаты, цитраты, используются
для приготовления буферных растворов.
34.
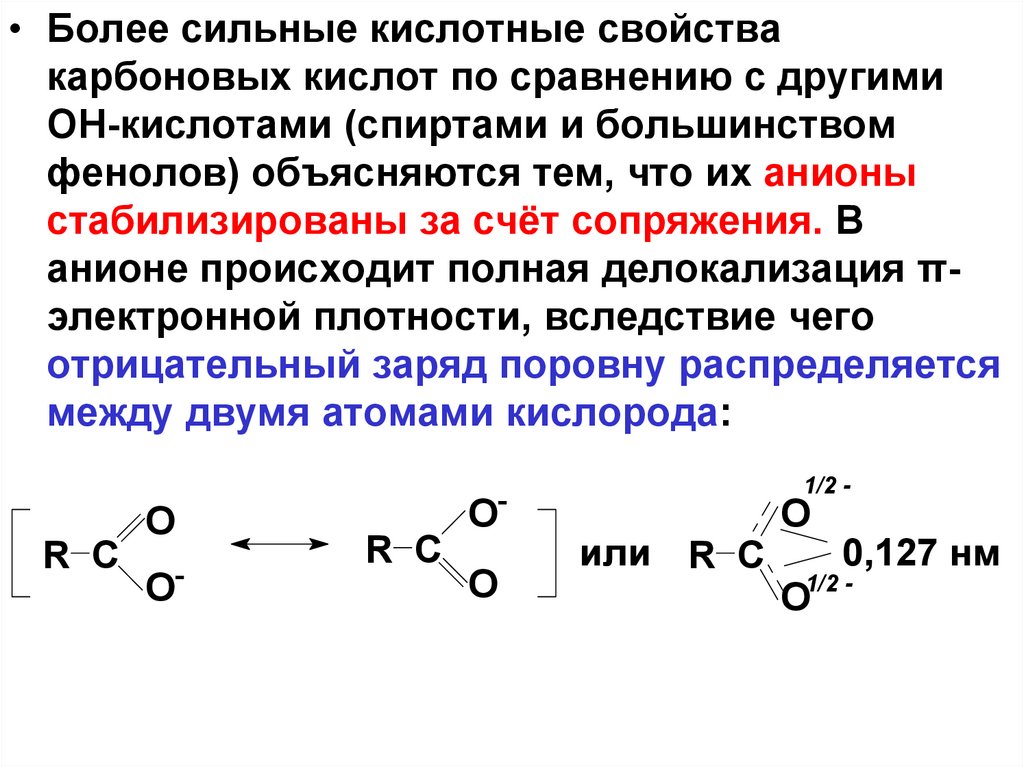
• Более сильные кислотные свойствакарбоновых кислот по сравнению с другими
ОН-кислотами (спиртами и большинством
фенолов) объясняются тем, что их анионы
стабилизированы за счёт сопряжения. В
анионе происходит полная делокализация πэлектронной плотности, вследствие чего
отрицательный заряд поровну распределяется
между двумя атомами кислорода:
R C
O
-
O
1/2 -
-
R C
O
O
или R C
O
0,127 нм
1/2 -
O
35.
• Ароматические кислоты с заместителем в ортоположении более сильные кислоты, чем мета- и параизомеры, независимо от типа заместителя.• Значение замещённых бензойных кислот
pK a
Х
Орто-
Мета-
Пара-
CH 3
3,92
4,27
4,36
OH
2,98
4,06
4,48
OCH 3
4,09
4,09
4,47
NO2
2,17
3,45
3,44
COOH
3,00
3,54
3,54
3,27
3,86
4,14
F
36.
• Влияние электроноакцепторныхзаместителей на кислотные свойства
карбоновых кислот в алифатическом
ряду подчиняется закономерностям как
по числу этих заместителей, так и по
взаимному расположению
электроноакцепторной и карбоксильной
групп.
37. Значение замещённых алифатических карбоновых кислот
ФормулаpK a
Формула
pK a
FCH 2 COOH
2,66
NCCH2COOH
2,47
F2CHCOOH
1,24
O2 NCH 2 COOH
1,68
F3CCOOH
0,23
(CH 3 ) 3 N CH 2 COOH
1,80
ClCH 2COOH
2,86
CH 3CH (Cl )COOH
2,80
Cl2CHCOOH
1,25
ClCH 2CH 2COOH
4,08
Cl3CCOOH
0,66
CH 3CH 2 CH (Cl )COOH
2,84
BrCH 2 COOH
2,90
CH 3CH (Cl )CH 2 COOH
4,06
ICH 2COOH
3,12
ClCH 2CH 2CH 2COOH
4,52
38.
• Ненасыщенные и ароматические кислотыобладают несколько большей
кислотностью, чем насыщенные
алифатические кислоты. В ряде случаев,
например, у салициловой кислоты,
повышенная кислотность орто-изомеров
объясняется стабилизацией аниона за
счёт образования внутримолекулярных
водородных связей:
O
C OO H
салицилат-ион
Внутримолекулярная
водородная связь
39.
• Вследствие затухания индуктивногоэффекта второй карбоксильной
группы кислотные свойства
дикарбоновых кислот (по первой
ступени диссоциации) уменьшаются
по мере удаления карбоксильных
групп друг от друга.
• Пример:
• этандиовая > пропандиовая >
> бутандиовая
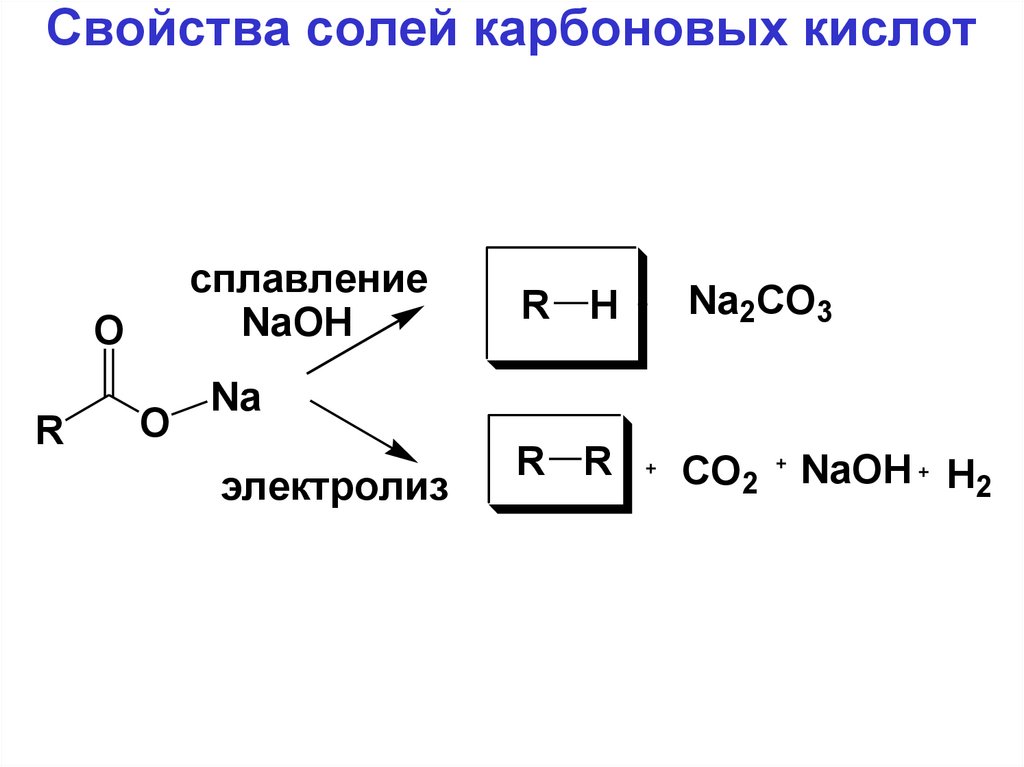
40. Свойства солей карбоновых кислот
сплавлениеNaOH
O
R
O
R H
Na2CO3
R R
CO2
Na
электролиз
NaOH H2
41.
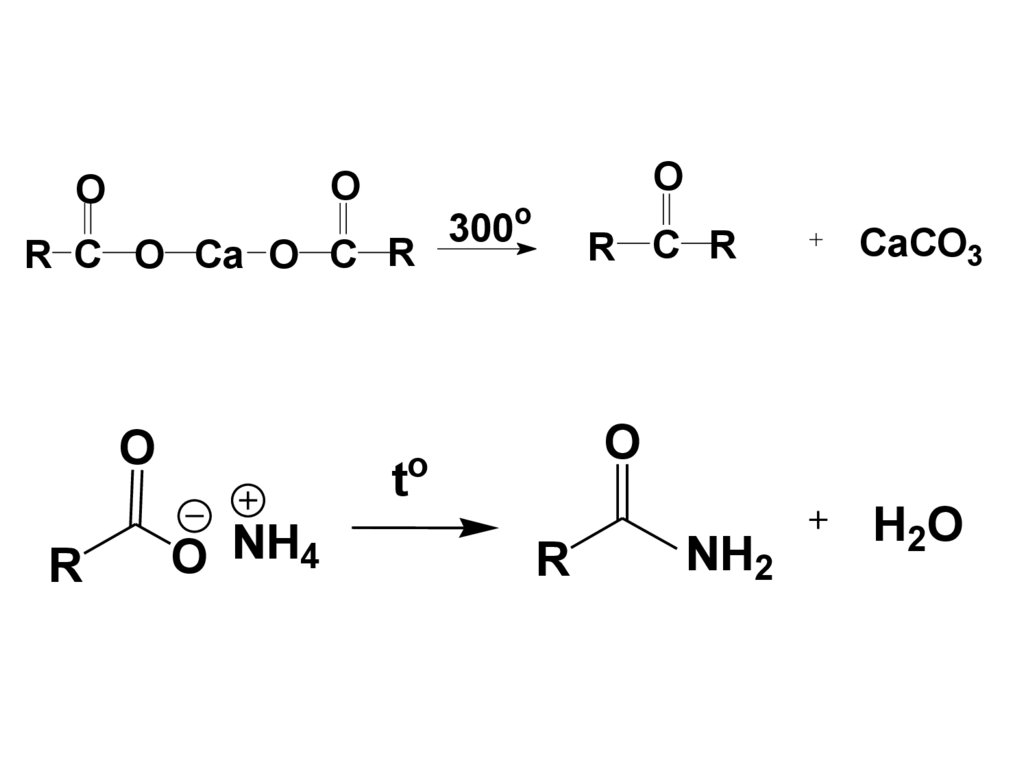
OO
R C O Ca O C R
O
R
t
O NH4
O
300o
R C R
CaCO3
O
o
R
NH2
H2O
42. 2. Реакции SN
• Это реакции нуклеофильного замещенияу sp2-гибридизованного атома С
карбоксильной группы, в результате
которых НО-группа замещается на другой
нуклеофил.
• За счет +М эффекта НО-группы
электрофильность С=О в карбоксильной
группе ниже, чем у карбонильных
соединений и реакции веду в присутствии
кислотого катализа.
• В результате этих реакций получают
функциональные производные
карбоновых кислот – сложные эфиры,
амиды, ангидриды, галогенангидриды.
43.
• По своему результату относительноучаствующего во взаимодействии
нуклеофильного реагента эти реакции
могут рассматриваться как реакции –
ацилирования
- введение в молекулу нуклеофильного
реагента ацильной группы
R-CO-.
Важнейшие ацильные группы:
ацетил-СН3СО-, формил НСО-,
бензоил С6Н5СО-, пропаноил, бутаноил
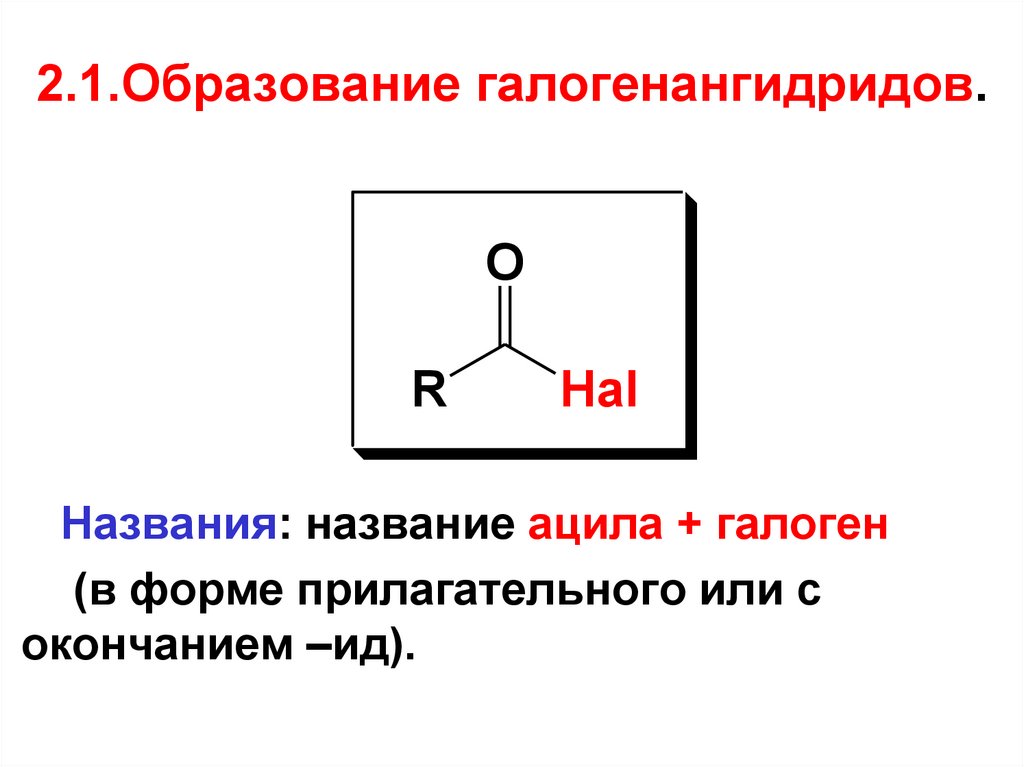
44. 2.1.Образование галогенангидридов.
OR
Hal
Названия: название ацила + галоген
(в форме прилагательного или с
окончанием –ид).
45. Получение галогенангидридов
HClне идет
O
O
PBr3
R
OH
R
PCl5
R
O Br
O
Cl
SOCl2
R
Cl
H3PO4
POCl3 HCl
SO2
HCl
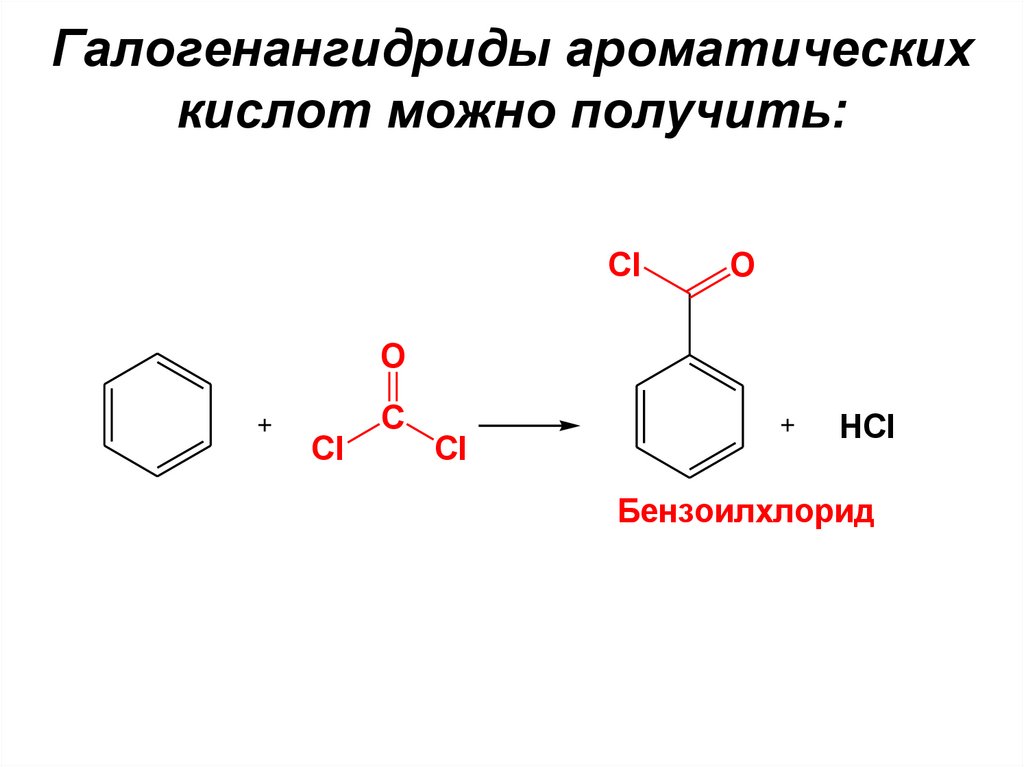
46. Галогенангидриды ароматических кислот можно получить:
ClO
O
Cl
C
Cl
HCl
Бензоилхлорид
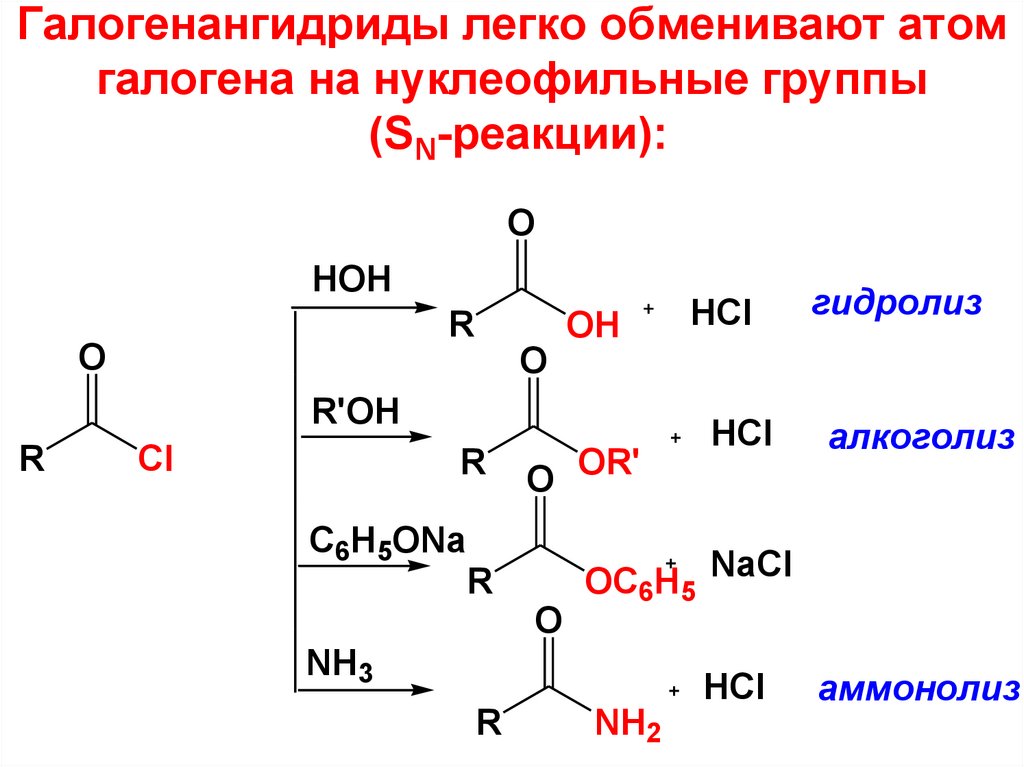
47. Галогенангидриды легко обменивают атом галогена на нуклеофильные группы (SN-реакции):
OHOH
R
O
O
OH
R'OH
R
Cl
R
C6H5ONa
R
O OR'
O
HCl
гидролиз
алкоголиз
OC6H5 NaCl
NH3
R
HCl
NH2
HCl
аммонолиз
48.
• В этих реакциях происходит заменаатома водорода или металла на
ацильный остаток, поэтому эти реакции
называют реакциями ацилирования.
• Субстраты (галогенангидриды) называют
ацилирующими агентами.
• Галогенангидриды выступают также как
ацилирующие агенты в реакции
ацилирования по Фриделю-Крафтсу.
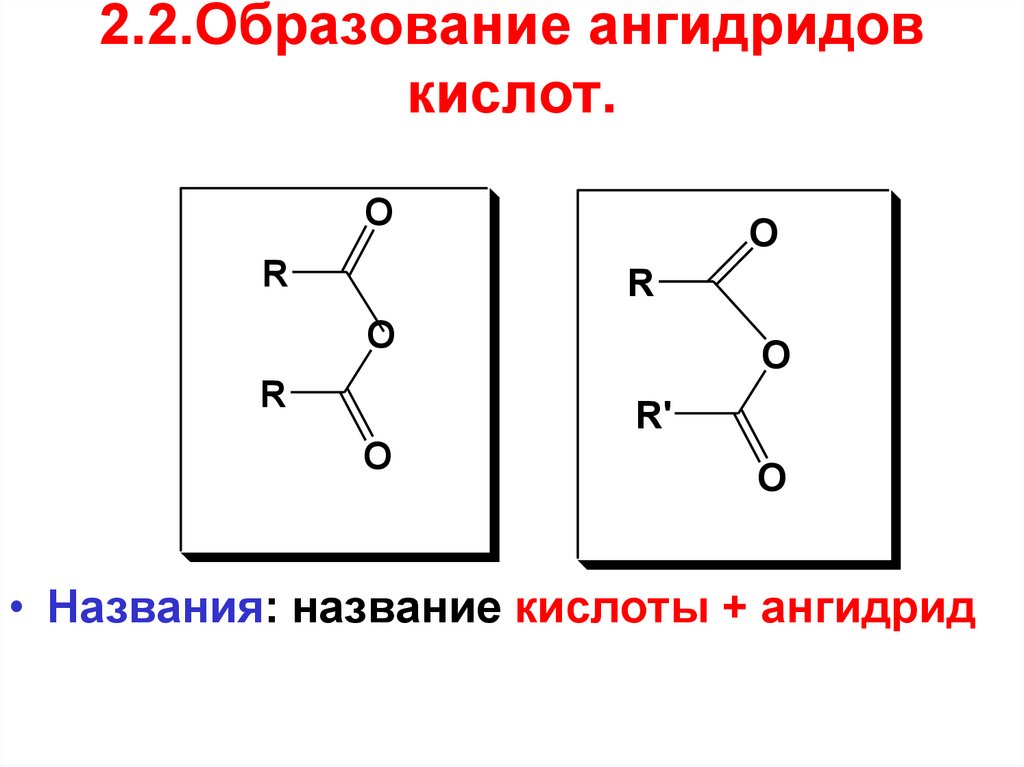
49. 2.2.Образование ангидридов кислот.
OR
O
R
O
R
O
O
R'
O
• Названия: название кислоты + ангидрид
50. Получение ангидридов
OO
O
H3 C
CH3
HO
OH
P2O5,to
-H2O
H3C
O
H3C
O
O
R
O
O
-NaCl
R
ONa
Cl
R'
O
R'
O
51. Ангидриды кислот, как и галогенангидриды, являются хорошими ацилирующими средствами:
OO
HOH
R
O
R
O
OH R
OH
O
R'OH
R
O
R
O
C6H5ONa
R
O OR'
O
R
O
OC6H5 R
NH3
R
NH2
R
O
гидролиз
алкоголиз
OH
ONa
OH
аммонолиз
52. МЕХАНИЗМ РЕАКЦИЙ АЦИЛИРОВАНИЯ
• Реакция протекает в 2 стадии:• 1. AN присоединение нуклеофила
по С=О группе ацилирующего
средства – лимитирующая стадия;
• 2. Отщепление уходящей группы
(быстро).
• По результату это SN реакции.
53.
Oнуклеофил
R
O
X
Y
X
промежуточный
продукт
нуклеофил
НY
R
C
X
ацилирующее
средство
O
O
Y
X
X
R
Y
продукт
реакции
O
O
C
уходящая
группа
Y
H
ацилирующее
промежуточный
средство
продукт
HX
R
Y
продукт
реакции
54.
• Скорость реакции ацилирования зависитот + на углероде С=О группы
ацилирующего средства и размеров
нуклеофила.
• Аацилирующие средства по убыванию
ацилирующей способности располагаются
в ряд:
O
O
R
O
O
O
>
>=
>
O >
R
OR'
OH R
R
Cl R
карбоновые сложные
галогенO
кислоты
ангидриды
эфиры
ангидриды
R
NH2
амиды
кислот
55. Соли карбоновых кислот не обладают ацилирующей способностью :
OR
O
56.
В ряде случаев ацилирование проводят вусловиях кислотного или основного
катализа. Кислотный катализ используют
для активации ацилирующего средства:
OH
O
Н
R
X
ацилирующее
средство
R
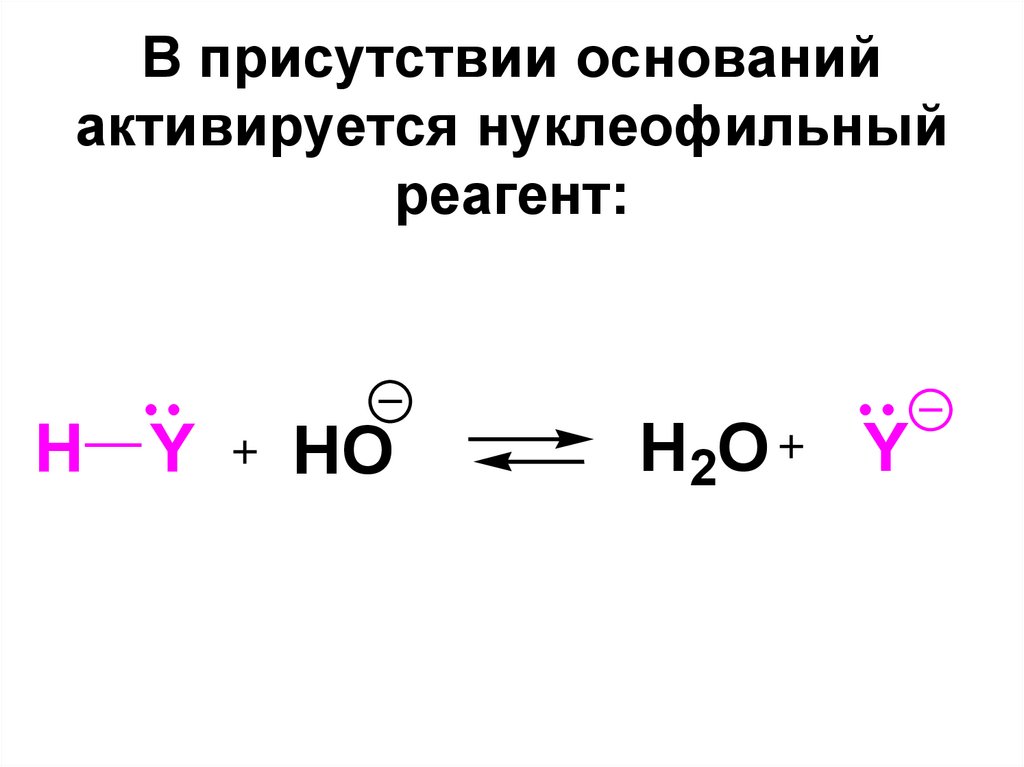
C
X
57. В присутствии оснований активируется нуклеофильный реагент:
H YHO
H2O
Y
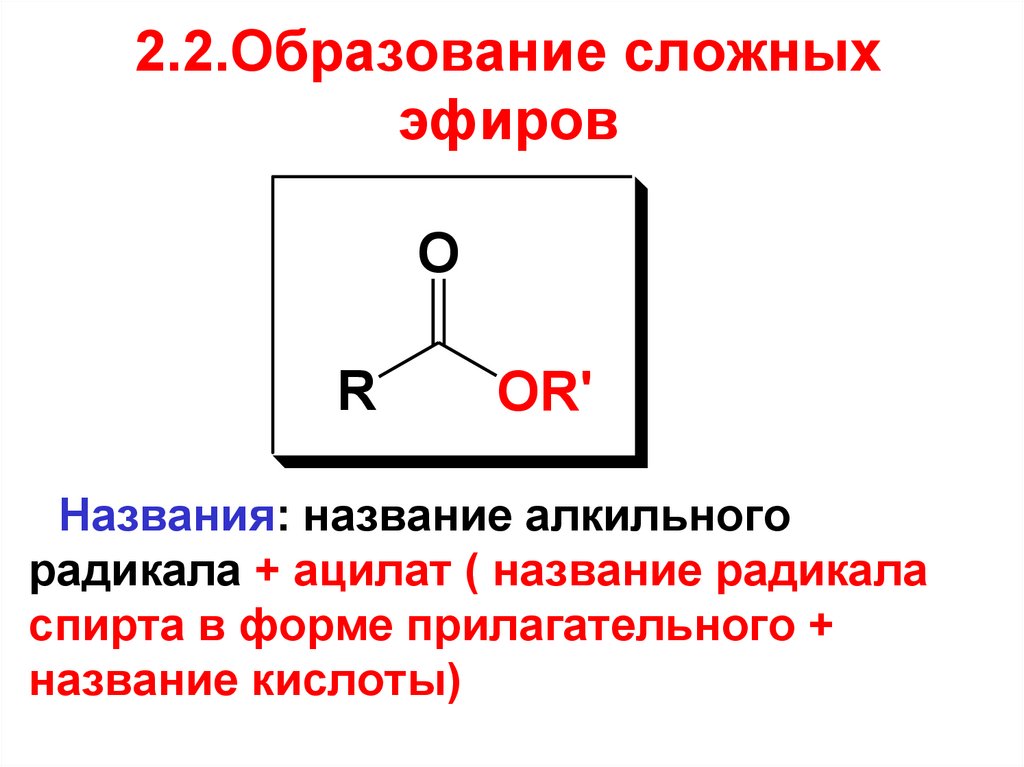
58. 2.2.Образование сложных эфиров
OR
OR'
Названия: название алкильного
радикала + ацилат ( название радикала
спирта в форме прилагательного +
название кислоты)
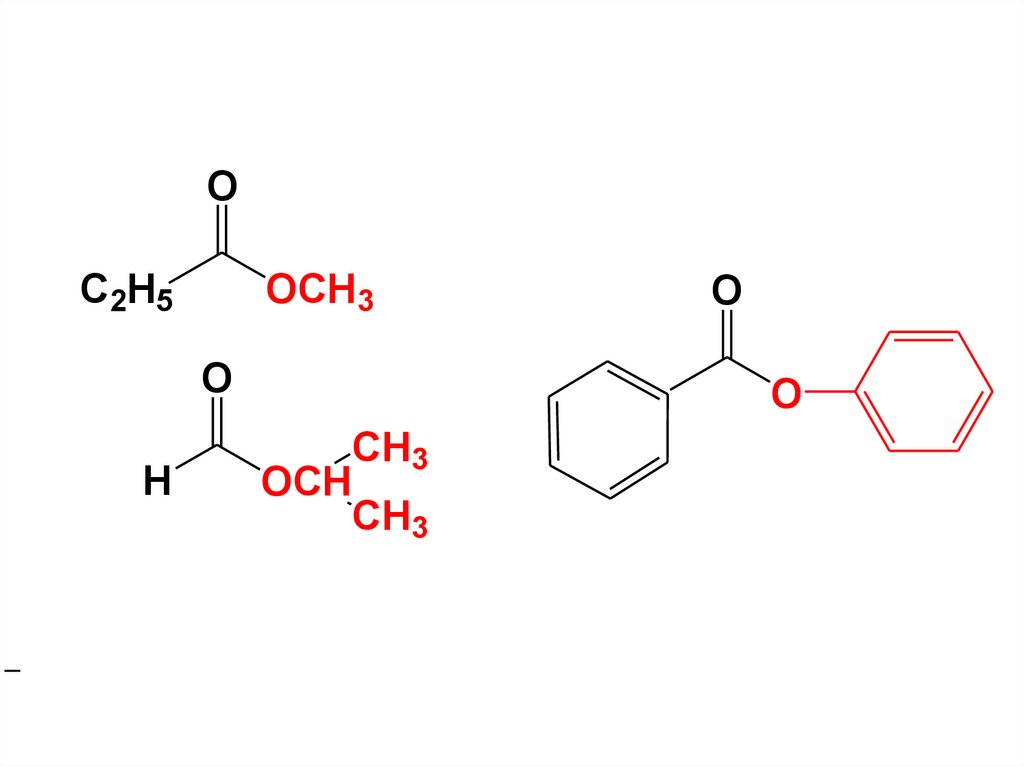
59.
OC2H5
OCH3
O
H
O
O
CH3
OCH
CH3
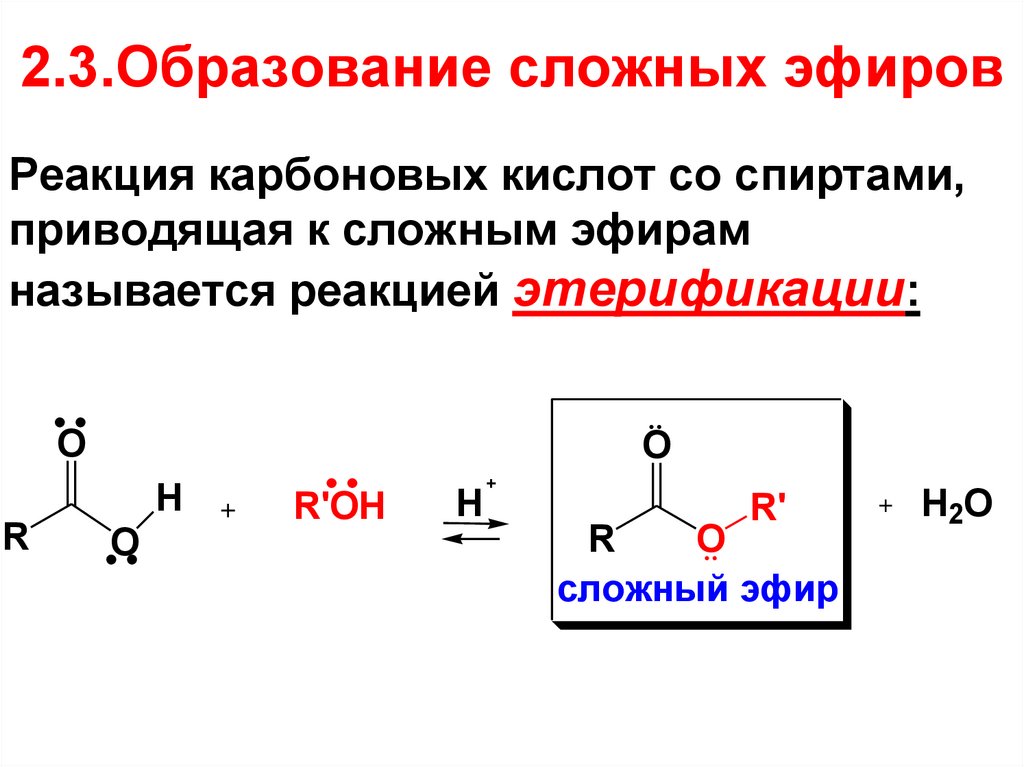
60. 2.3.Образование сложных эфиров
Реакция карбоновых кислот со спиртами,приводящая к сложным эфирам
называется реакцией этерификации:
O
R
O
H
O
R'OH
H
R'
R
O
сложный эфир
+
H2O
61.
Реакция этерификации – частный случайр-ции ацилирования. Р-ция обратима,
поскольку КК и сложный эфир близки по
ацилирующей способности.
Равновесие можно сместить двумя
путями:
1) взять одно в-во в избытке (обычно
более дешевое),
2) выводить из сферы р-ции один из
продуктов: либо сложный эфир, либо
воду
62.
КК – слабое ацилирующее средство, аспирт –слабый нуклеофил, поэтому
реакция этерификации идет медленно и
для ускорения требуется катализатор.
Кислотный катализатор активирует
ацилирующее средство – сложный
эфир, что и приводит к ускорению реакции.
Килотные кат-ры не смещают
положение равновесия, а только ускоряют
процесс его достижения.
Основной катализ невозможен, т.к. КК
превращается в соль, которая
ацилирующей способностью не обладает.
63.
В случае сильных карбоновых кислот(щавелевая, муравьиная,
трифторуксусная) катализаторы не
нужны.
Избыток минеральной к-ты в реакции
этерификации нежелателен, поскольку
в этом случае происходит потеря
нуклеофильных свойств спирта
вследствие его протонирования с
образованием оксониевой соли.
64. Реакция этерификации проекает по механизму, обозначаемому ААС2 (кислотнокатализируемая ацильная бимолекулярная реакция).
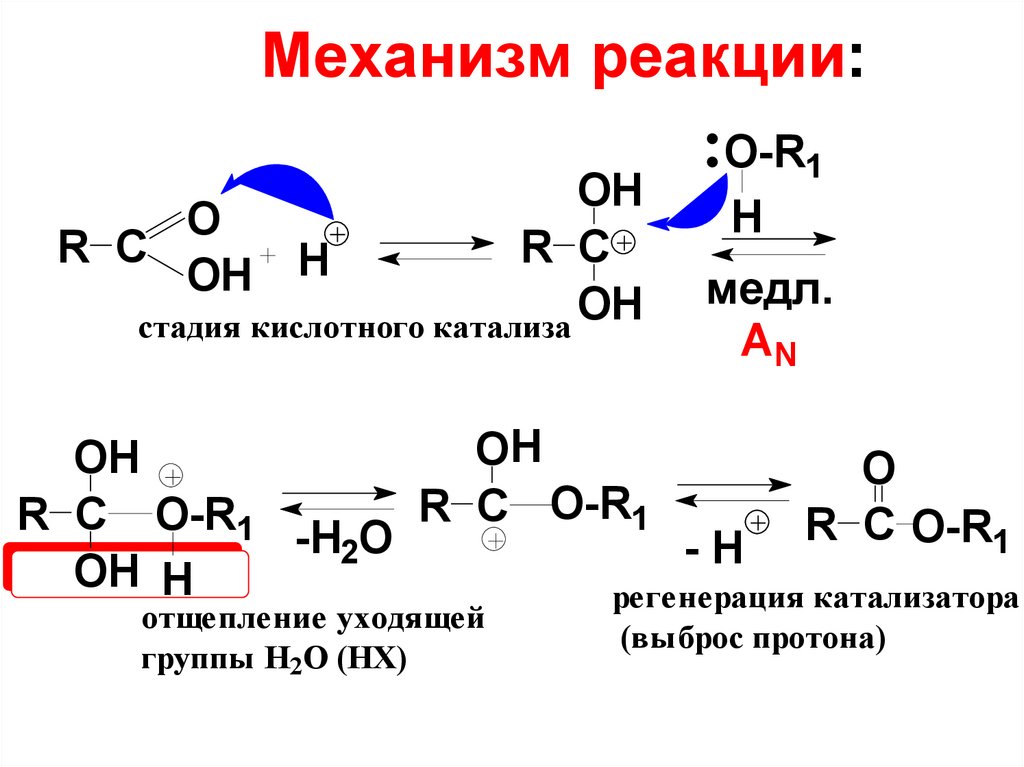
65. Механизм реакции:
OНO
R C
R С
H
OН
OН
стадия кислотного катализа
O-R1
Н
медл.
AN
OH
OН
O
R С O-R1
R С O-R1
R С O-R1
-H2О
-H
OН Н
регенерация катализатора
отщепление уходящей
группы Н2О (НХ)
(выброс протона)
66.
• Все стадии этерификацииобратимы.
• Обратная реакция представляет
катализируемый кислотой
гидролиз сложных эфиров
(реакция омыления).
67.
Пространственные факторыУвеличение объема радикалов и в КК и в
спирте снижают скорость р-ции.
В ряду первичный, вторичный,
третичный спирт скорость снижается. (У
третичных спиртов скорость
этерификации очень мала). Кроме того,
третичные спирты склонны к
элиминированию
(трет.спирт → алкен).
Поэтому сложные эфиры третичных
спиртов не получают р-цией
этерификации.
68.
Реакции этерификацииароматических к-т, имеющих
заместители в о-положении,
протекают медленно и с низким
выходом (из-за пространственных
затруднений).
Фенолы не вступают в р-цию
этерификации, т. к. фенол - слабый
нуклеофил.
69.
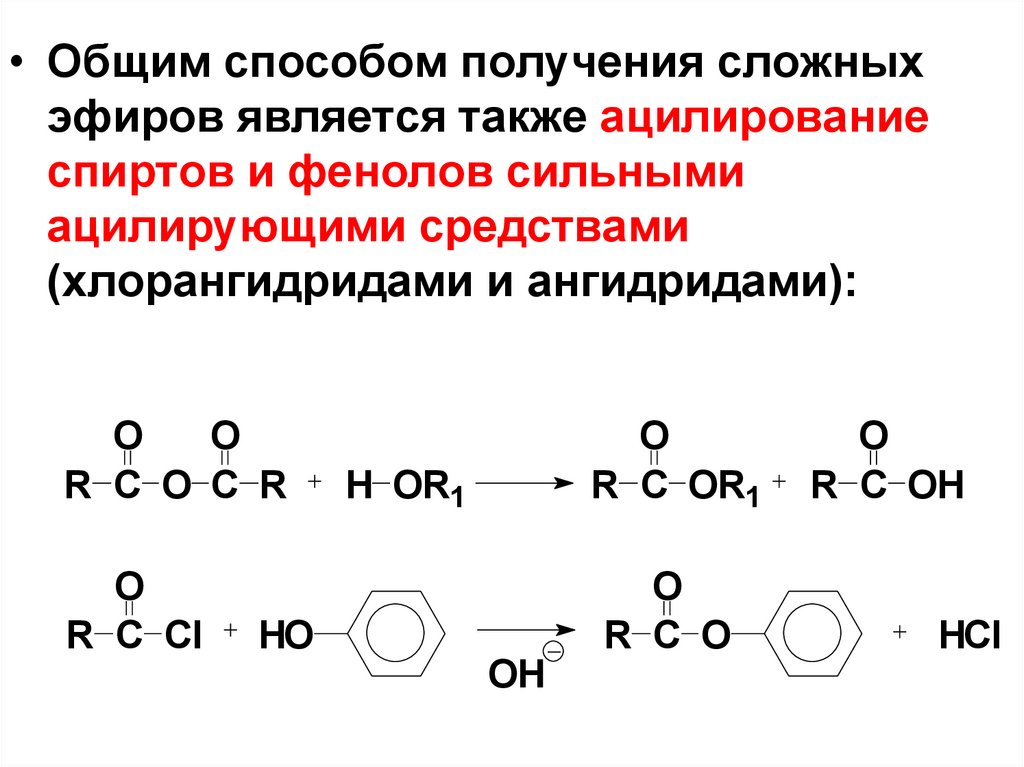
• Oбщим способом получения сложныхэфиров является также ацилирование
спиртов и фенолов сильными
ацилирующими средствами
(хлорангидридами и ангидридами):
O
O
R C O C R
O
R C Cl
HO
O
R C OR1
H OR1
OH
O
R C O
O
R C OH
HCl
70.
• В случае спиртов реакцияпротекает легче и не требует
обязательного присутствия
катализатора.
• Ацилирование фенолов как
слабых нуклеофилов
осуществляют по методу ШоттенБаумана (1884): к воднощелочному раствору фенола
добавляют при встряхивании
хлорангидрид кислоты.
71.
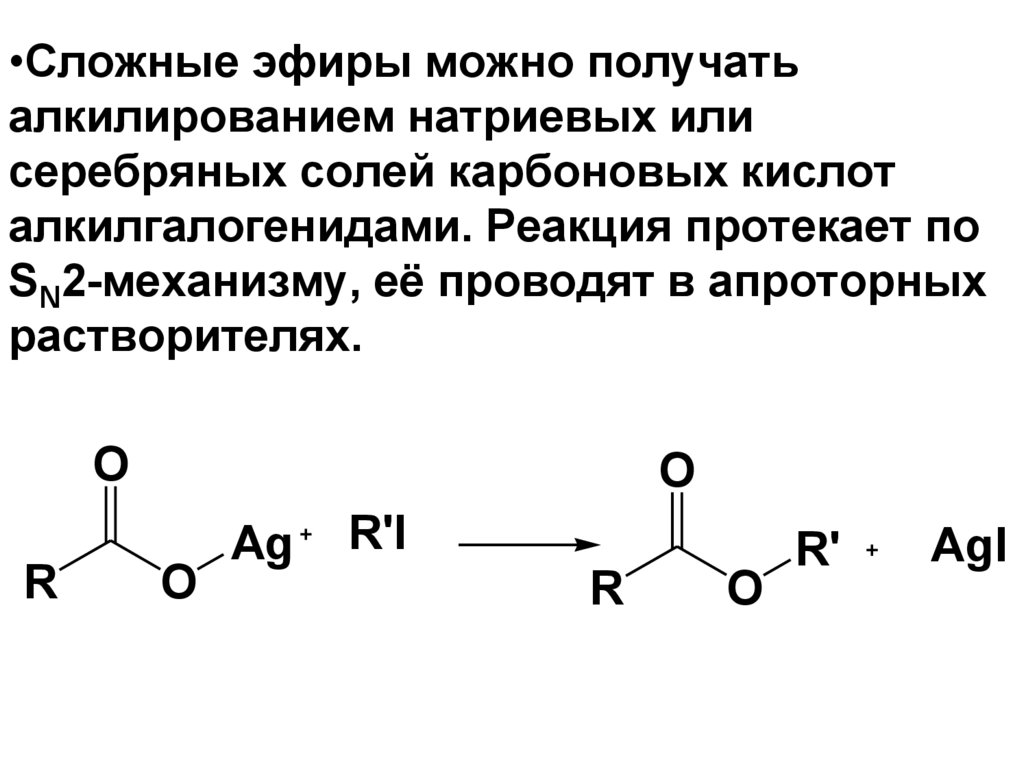
•Сложные эфиры можно получатьалкилированием натриевых или
серебряных солей карбоновых кислот
алкилгалогенидами. Реакция протекает по
SN2-механизму, её проводят в апроторных
растворителях.
O
R
O
O
Ag
R'I
R
O
R'
AgI
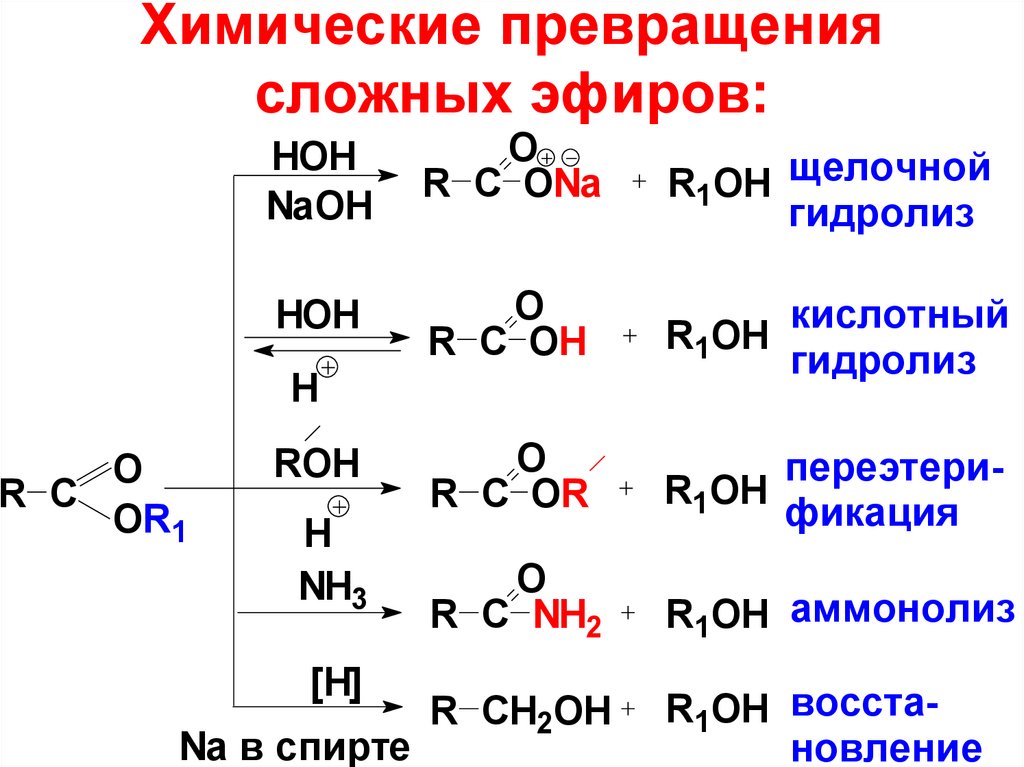
72. Химические превращения сложных эфиров:
HOHNaOH
O
R С ONa
R1OH щелочной
гидролиз
HOH
O
R С OH
кислотный
R1OH
гидролиз
O
R С OR
переэтериR1OH
фикация
O
R С NH2
R1OH аммонолиз
R СH2OH
R1OH восстановление
H
O
R C
OR1
ROH
H
NH3
[H]
Na в спирте
73.
Поскольку сложный эфир – слабоеацилирующее средство, то его можно
подвергнуть гидролизу в присутствии
катализаторов – кислот или оснований.
Гидролиз в кислой среде – реакция
обратная реакции этерификации
(обратим).
Гидролиз в щелочной среде (омыление)
– реакция необратимая. Имеет важное
значение в промышленности для
получения мыла гидролизом природных
жиров и масел.
74.
Щелочной гидролиз преимущественперед кислотным:
1) протекает с большей скоростью
(гидроксид-анион является более сильным
и меньшим по объёму нуклеофилом по
сравнению с молекулой воды).
2) в щелочной среде реакция
гидролиза необратима (соль кислоты,
не обладает ацилирующей способностью).
Выводы: на практике используют гидролиз
сложных эфиров в щелочной среде.
75.
• Механизм гидролиза в щелочной средеможно представить следующей схемой:
O
O
OH
R C
R
С
OH
OR1 медл.
OR1 -OR1
-OR1
О
R C
+OR1
OH
O
R C
O
R1 OH
76.
1я стадия – Нуклеофильноеприсоединение гидроксид-иона по
С=О группе с образованием
промежуточного тетраэдрического
продукта (медленная );
2я стадия - Отщепление от
промежуточного продукта уходящей
группы алкоксид-аниона;
3я стадия - Кислотно-основное
взаимодействие продуктов гидролиза
77.
Переэтерификация (используется дляполучения метиловых эфиров
жирных кислот МЭЖК - биодизеля).
Переэтерификация также как и
гидролиз может протекать как в
кислой, так и щелочной средах.
Сложные эфиры легко
восстанавливаются с разрывом связи
между карбонильным С-атомом и Оатомом алкокси-группы.
78.
OLiAlH4
R C
OR1
[H]
Na /спирт
R СH2OH
Сложные эфиры устойчивы
к действию окислителей.
R1OH
79. 2.4.Образование амидов кислот
OO
R
NH2
R
N R
R'
Названия: 1)название (латинское)
корня кислоты + суффикс амид;
2) (амид + название кислоты)
80. Назовите вещества:
OO
H3C
NH2
O
H
HN
CH3
CH3
NH2
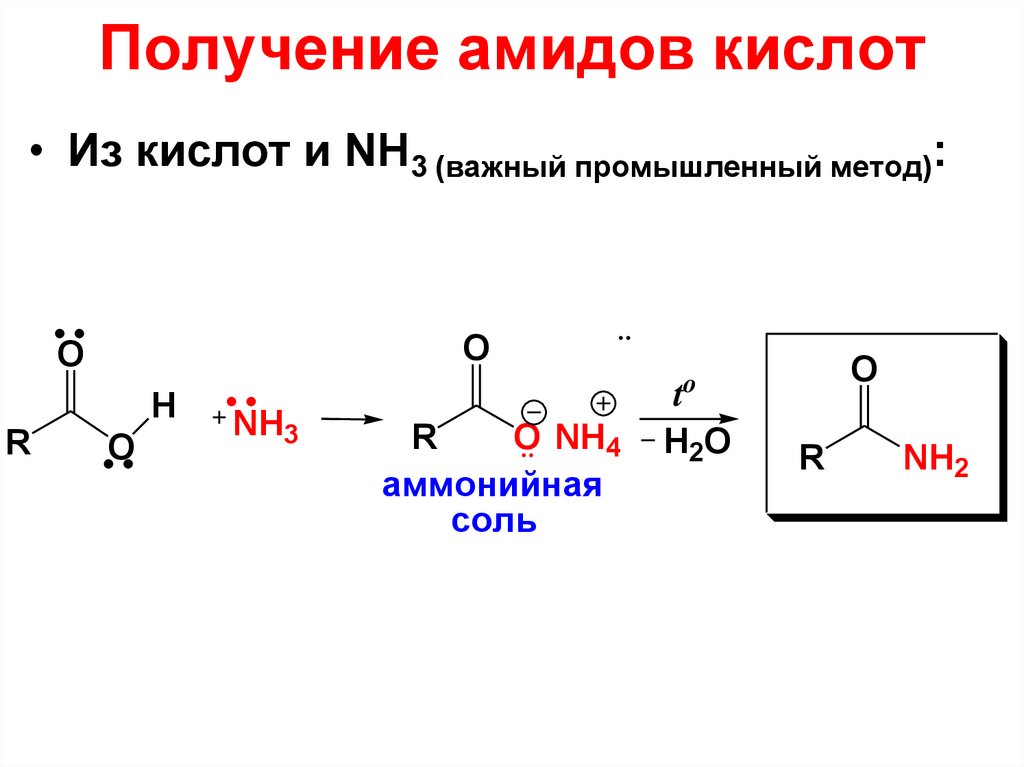
81. Получение амидов кислот
• Из кислот и NH3 (важный промышленный метод):O
O
R
H
O
O
o
NH3
R
O NH4
аммонийная
соль
t
H2O
R
NH2
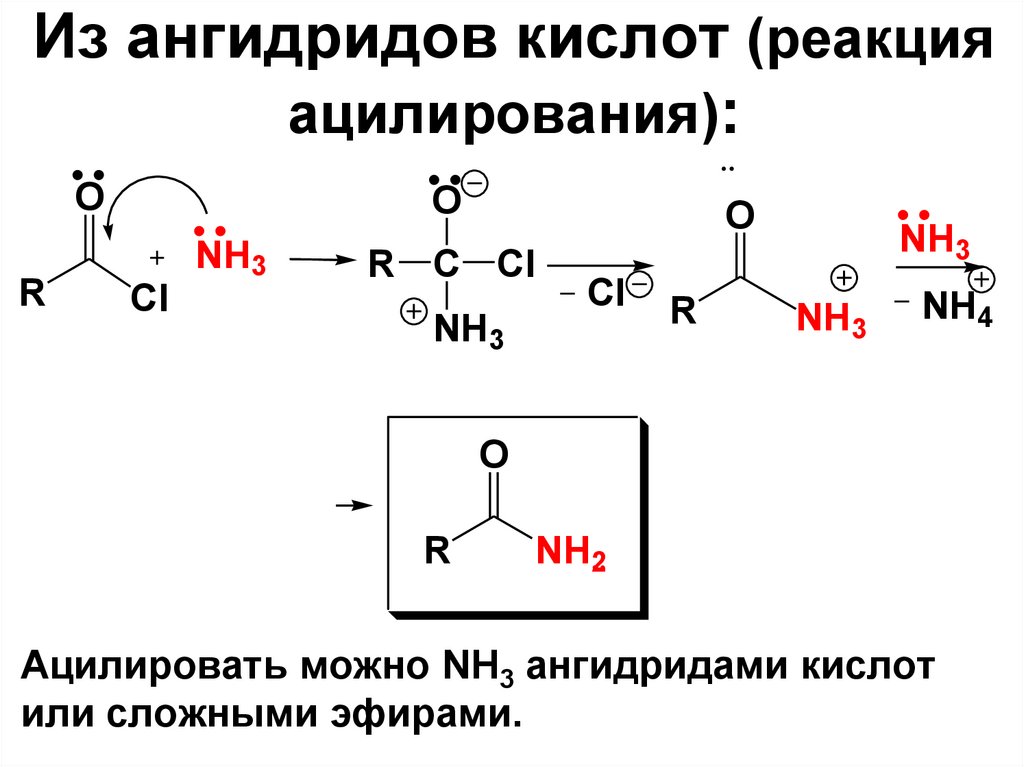
82. Из ангидридов кислот (реакция ацилирования):
OR
O
Cl
NH3
O
R C Cl
NH3
Cl
R
NH3
NH3
NH4
O
R
NH2
Ацилировать можно NH3 ангидридами кислот
или сложными эфирами.
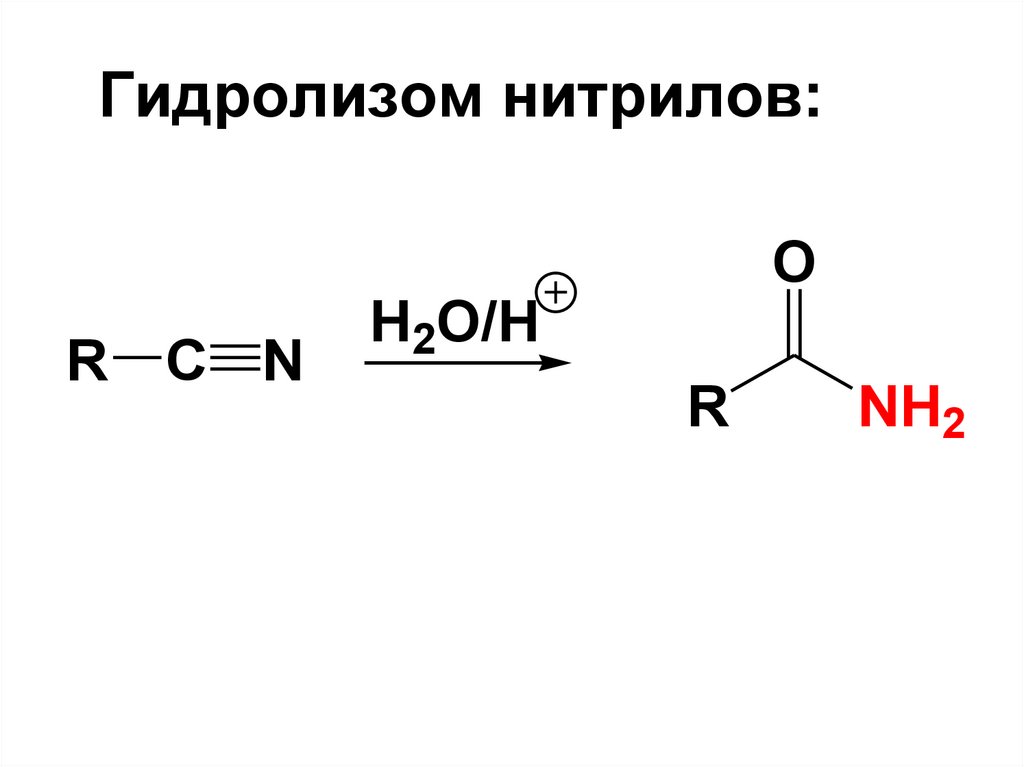
83. Гидролизом нитрилов:
R C NO
H2O/H
R
NH2
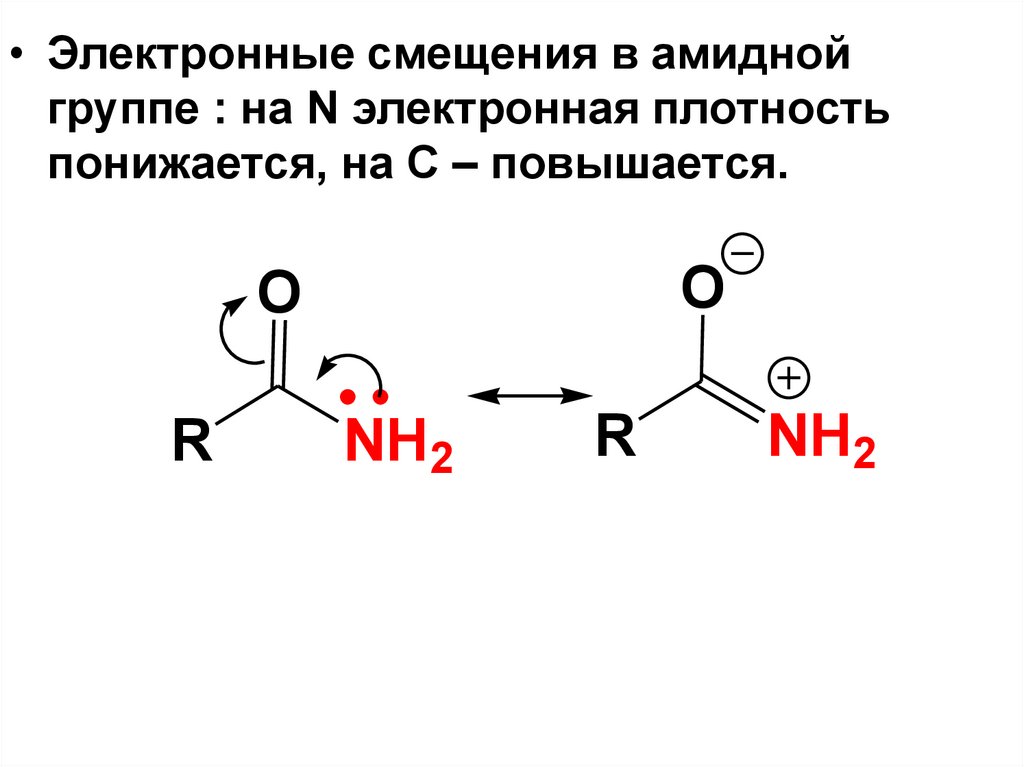
84.
• Электронные смещения в амиднойгруппе : на N электронная плотность
понижается, на С – повышается.
O
O
R
NH2
R
NH2
85.
Химические превращения амидов:O
HOH R
o
H ,t
R
OH
O
HOH R
OH,to
O
NH4 гидролиз
NH3
гидролиз
O
O
NH2
R'Br
R
R'COCl R
NHR'
O
HBr
N-алкилирование
HCl
NHCOR' N-ацилирование
86.
OHNO2
o
,5
H
O
R
R
LiAlH4
NH2
OH
RCH2
P2O5 ,to
Br2,NaOH
NH2 восстановление
R C N
R
NH2
N2
дезаминирование
H2O дегидратация
NaBr
перегруппировка
H2O Na2CO3
Гофмана
87.
Низшие амиды - жидкости, хорошорастворимые в воде, некоторые из
них используют как растворители
(ДМФА).
В водных р-рах амиды являются
нейтральными соединениями.
Основность амидов значительно
ниже, чем основность алифатических
аминов (на N-атоме понижена
электронная плотность, и протон
присоединяется к О-атому).
88. Нитрилы. Номенклатура
1)латинское название корня кислоты + суффикснитрил;
2) (нитрил + название кислоты)
CH3 C N
ацетонитрил
(нитрил уксусной кислоты)
CH3 CH2 C N
пропионитрил
(нитрил пропановой кислоты)
Получение: 1) дегидратация амидов (см.выше);
2) через соли диазония (см. выше)
3) алкилирование солей
циановодородных кислот:
CH3 CH2 Cl + NaC N
SN
-NaCl
CH3 CH2 C N
89.
Взаимопревращения функциональных производных ККO
R
O
R
O
ангидриды
NH3
R'OH
P2O5
O
R
NH2
амиды
P2O5
R C N
нитрилы
NH3
t
O
R'OH
R
O H
PX5
NH3
X
R
O R'
сложные эфиры
R'OH
O
R
O
(X=Cl,Br, I)
галогенангидриды
90.
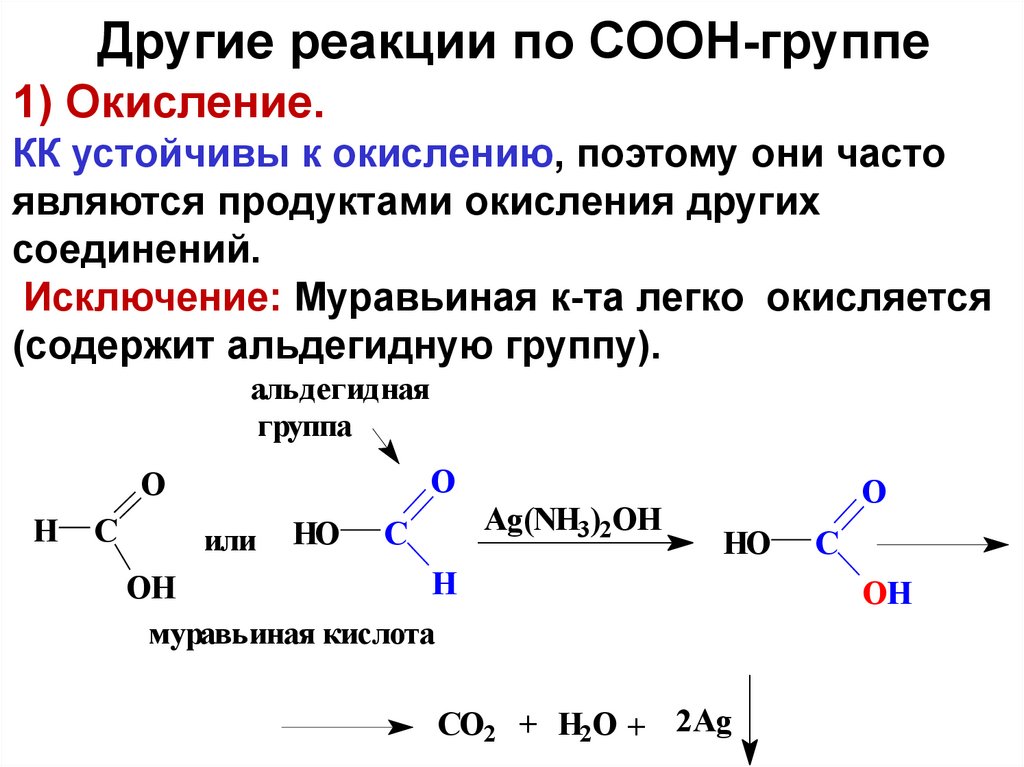
Другие реакции по СООН-группе1) Окисление.
КК устойчивы к окислению, поэтому они часто
являются продуктами окисления других
соединений.
Исключение: Муравьиная к-та легко окисляется
(содержит альдегидную группу).
альдегидная
группа
O
O
H
C
или
HO
Ag(NH3)2OH
C
O
HO
H
OH
муравьиная кислота
CO2 + H2O + 2Ag
C
ОH
91.
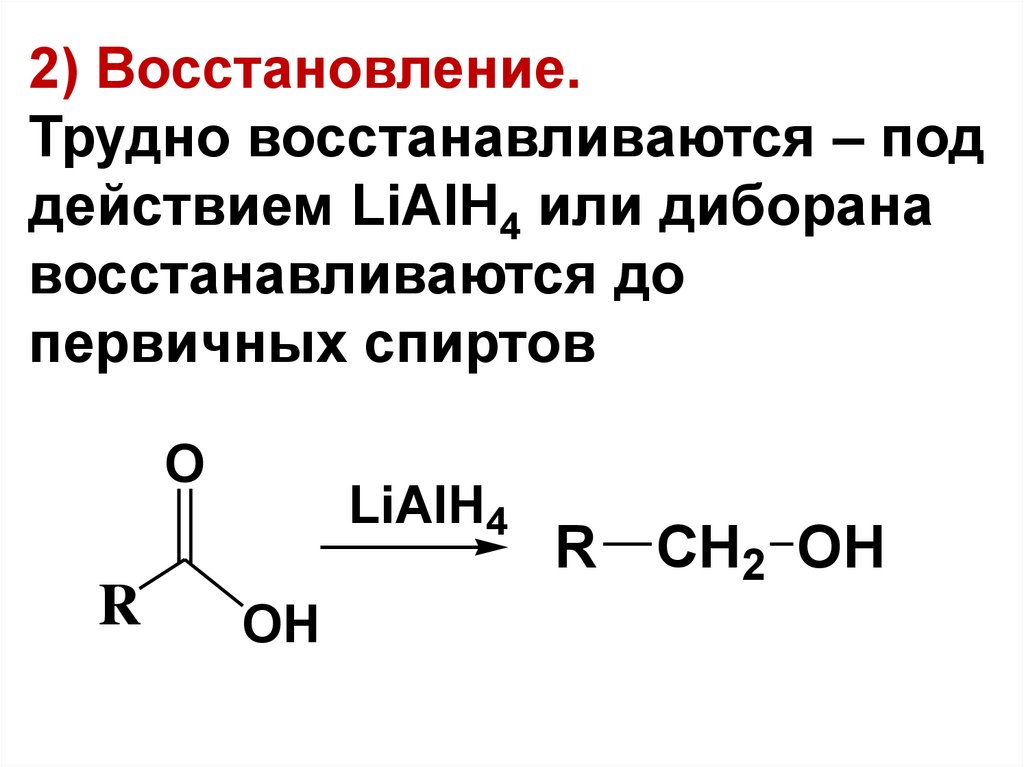
2) Восстановление.Трудно восстанавливаются – под
действием LiAlH4 или диборана
восстанавливаются до
первичных спиртов
O
R
LiAlH4
OH
R CH2 OH
92.
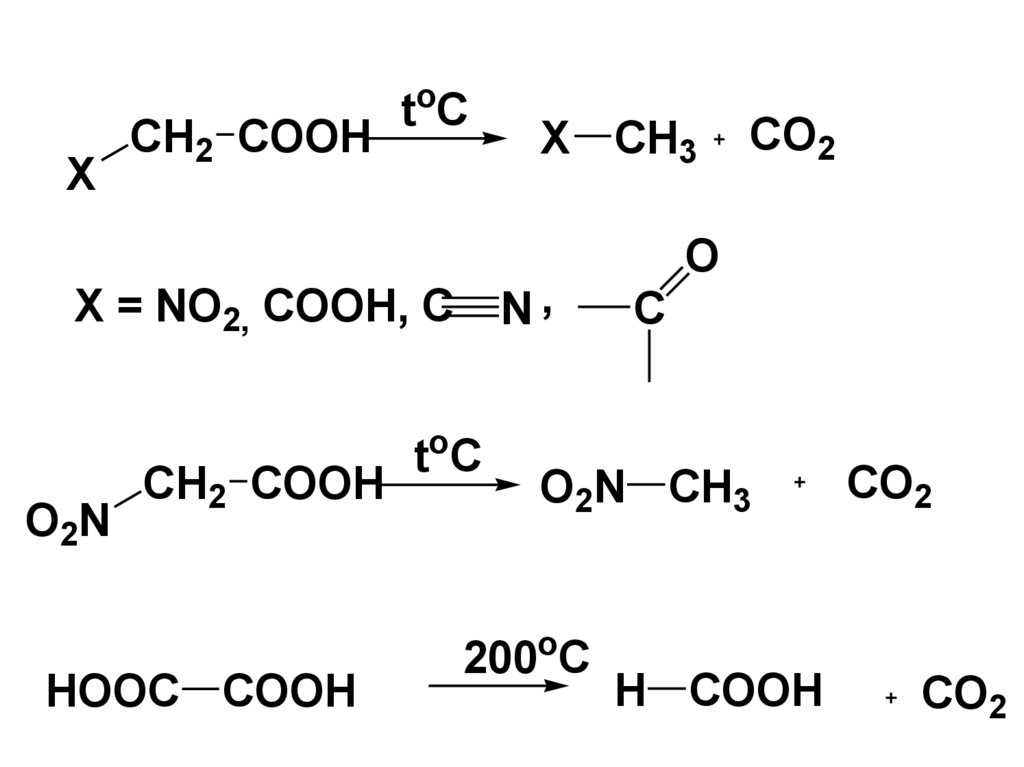
3) Декарбоксилирование.КК довольно устойчивы к нагреванию.
При высоких температурах >300 °С в
присутствии катализаторов
подвергаются декарбоксилированию.
При наличии сильных ЭАзаместителей в радикале
декарбоксилирование идет в более
мягких условиях.
93.
XCH2 COOH
toC
N,
X = NO2, COOH, C
O2N
CH2 COOH
HOOC COOH
X CH3
toC
CO2
O
C
O2N CH3
200oC
H COOH
CO2
CO2
94.
Реакции КК с по углеводородномурадикалу
1. В алифатическом ряду
1.1) Образование замещенных КК.
В алифатическом ряду у КК Н-атом у
α-С-атома подвижен, однако
вследствие меньшего δ+заряда на
карбонильном С-атоме, подвижность
меньше, чем у Альдегидов и Кетонов
(вспомните реакции конденсации в
щелочной среде!).
95.
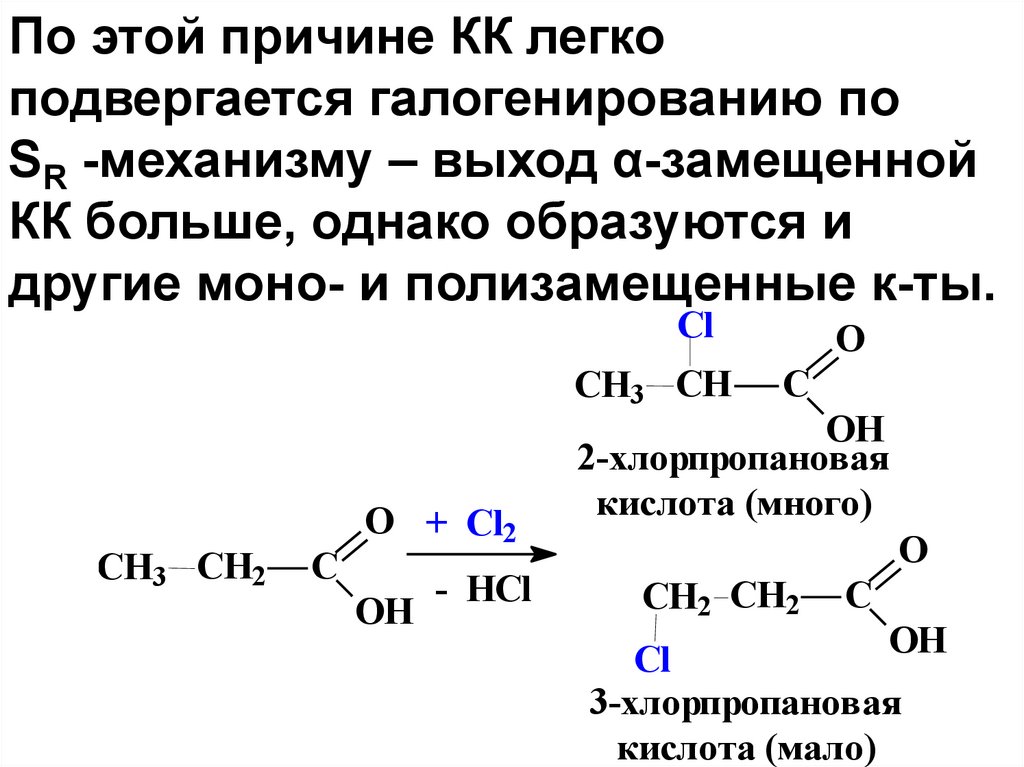
По этой причине КК легкоподвергается галогенированию по
SR -механизму – выход α-замещенной
КК больше, однако образуются и
другие моно- и полизамещенные к-ты.
Cl
СН3 CH
СН3 CH2
C
O + Cl2
OH
- HCl
O
C
OH
2-хлорпропановая
кислота (много)
O
СН2 CH2
C
OH
Сl
3-хлорпропановая
кислота (мало)
96.
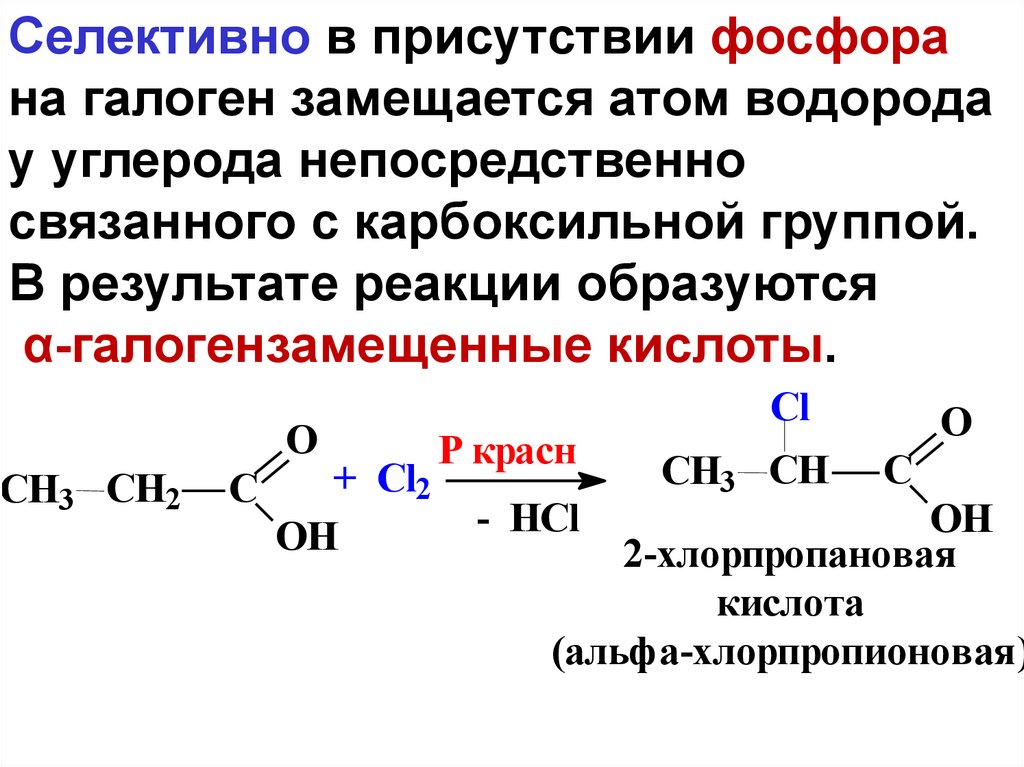
Селективно в присутствии фосфорана галоген замещается атом водорода
у углерода непосредственно
связанного с карбоксильной группой.
В результате реакции образуются
α-галогензамещенные кислоты.
O
СН3 CH2
+ Cl2
C
OH
Р красн
- HCl
Cl
СН3 CH
O
C
OH
2-хлорпропановая
кислота
(альфа-хлорпропионовая)
97. 1.2. Сложноэфирная конденсация Кляйзена:
Сложные эфиры КК проявляют СНкислотность, что обусловленоповышенной подвижностью Н-атомов
у α-С-атома вследствие повышенной
полярности связи под действием –Iэффекта сложноэфирной группы и
стабилизации аниона за счет
делокализации «-» - заряда.
98.
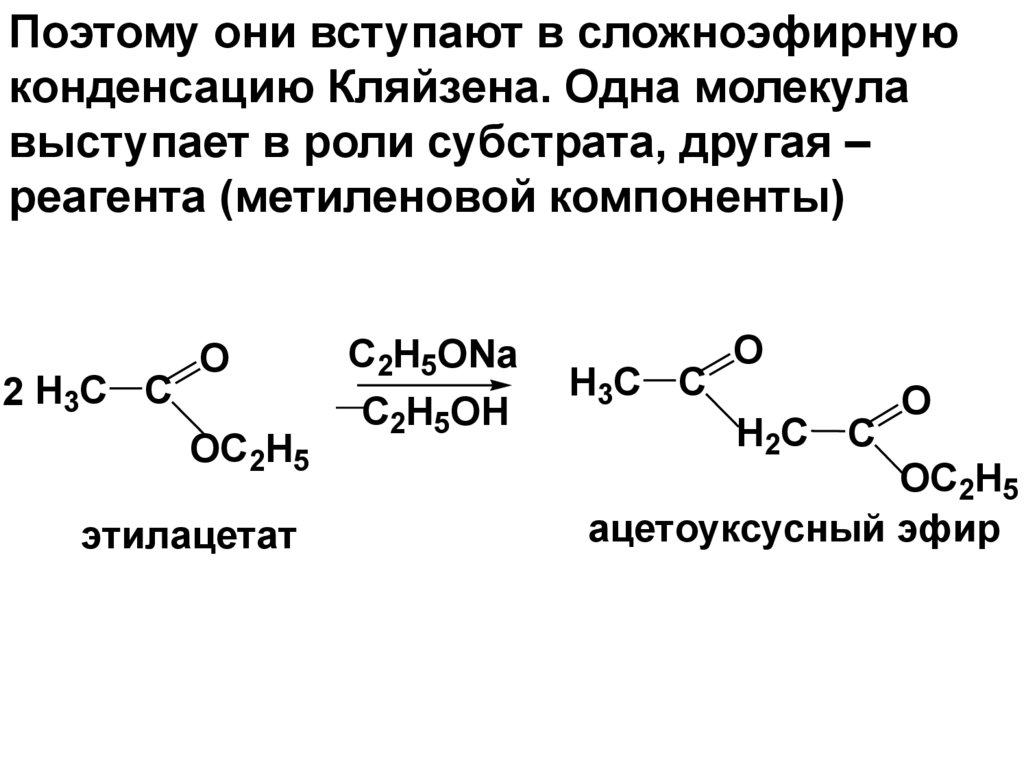
Поэтому они вступают в сложноэфирнуюконденсацию Кляйзена. Одна молекула
выступает в роли субстрата, другая –
реагента (метиленовой компоненты)
2 H3C C
O
OC2H5
этилацетат
C2H5ONa
C2H5OН
H3C C
O
H2C C
O
OC2H5
ацетоуксусный эфир
99.
2. В ароматическом рядуНапоминание: В ароматическом ряду
СООН-группа является заместителем
II рода (ЭА-заместителем) (-I и –Mэффекты) дезактивирует кольцо в SЕ реакциях, м-ориентант.
Реакции алкилирования и
ацилирования не идут.
100.
Применение КК• Муравьиная к-та. Используется в
текстильной, бумажной, кожевенной промсти, для получения лекарственных
средств, консервантов, средств защиты
растений.
• Уксусная кислота. Применяют в качестве
растворителя при производстве
искусственных волокон, консервант в
пищевой пром-сти, в хим. пром-сти в
производстве красителей, инсектицидов,
лекарственных средств
101.
Высшие жирные кислоты (ВЖК).ВЖК с четным числом С-атомов (С12-С18) – они
входят в состав жиров и масел:
С11Н23СOOH – лауриновая
С13Н27СOOH – миристиновая
С15H31СOOH – пальмитиновая
С17H35СOOH – стеариновая
Бензойная кислота. Распространена в природе
– как в свободном виде, так и виде
производных (клюква, брусника). Применяют в
пищевой пром-сти как консервант (бензоат
натрия). Используют в парфюмерной,
фармацевтической пром-сти, в производстве
красителей.
102. Общие сведения о ненасыщенных и дикарбоновых кислотах
В молекуле ненасыщенных кислот врадикале содержатся кратные связи.
Общая формула ненасыщенных кислот
с 1 двойной связью
СnH2n-1COOH
Простейшая – акриловая (пропеновая)
СH2=СН-СООН
103.
Химическое поведение непредельных к-тсвязано с наличием двух активных
групп СООН и двойной связи. Они
вступают во все р-ции, характерные для
КК и непредельных соединений и
оказывают взаимное влияние.
Введение в молекулу двойной связи
увеличивают силу к-ты, т.к.
образующийся в результате диссоциации
карбоксилат-ион более устойчив
вследствие сопряжения.
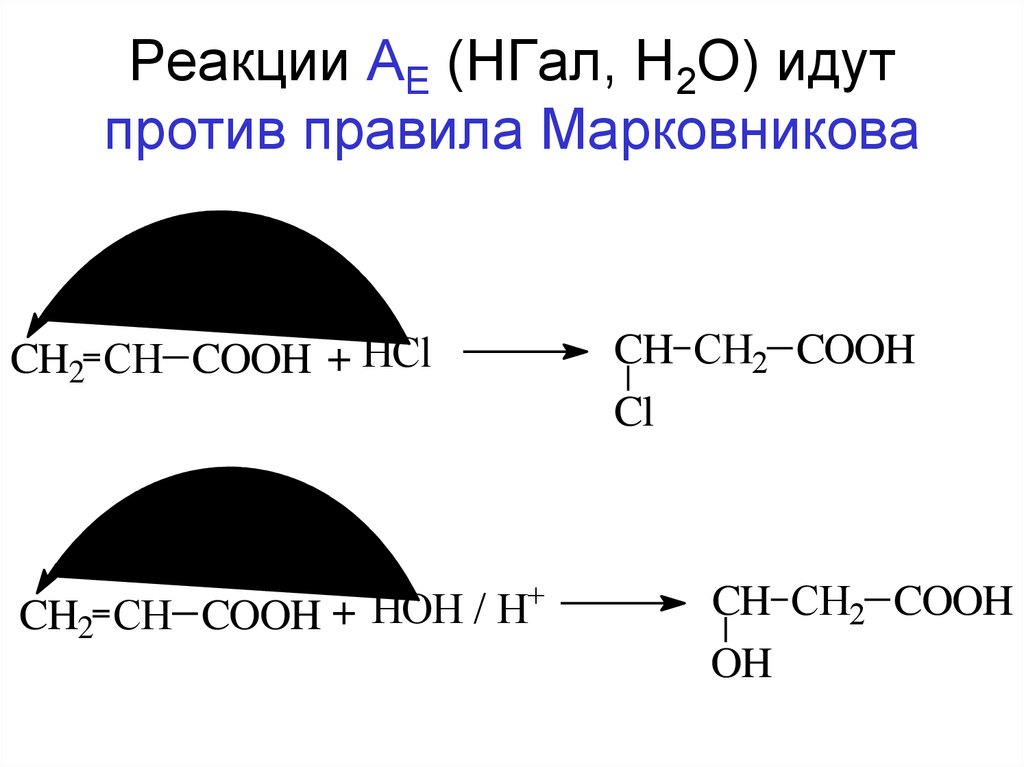
104. Реакции АЕ (НГал, Н2О) идут против правила Марковникова
CH2 CH COOH + HCl+
H
/
HOH
+
CH2 CH COOH
CH CH2 COOH
Cl
CH CH2 COOH
OH
105.
Акриловая кислота.Получают гидролизом акрилонитрила
HCN
HC CH
CuCl
H2O, t
H2C CH C N
H2C CH COOH
H
Оксосинтезом
HC CH + СО + H2O
кат
H2C CH COOH
Широкое применение получили эфиры и
нитрилы акриловой к-ты, полимеризацией
которых получают ценные полимерные
материалы (оргстекло, синтетические
волокна ).
106.
Метакриловая кислота. Большое техническоезначение имеет метиловый эфир метакриловой
к-ты, полимеризацией которого получают
плексиглас (оргстекло).
H2C C COOH
H2C C COOСH3
СН3
метакриловая
кислота
СН3
метилметакрилат
(метиловый эфир
2-метилпропеновой
кислоты)
СООСН3
ROOR
n H2C C
полимеризация
СН3
СООСН3
H2C C
СН3
n
полиметилметакрилат
(оргстекло)
107.
Непредельные высшие жирные кислоты –входят в состав жидких жиров (масел):
С17Н33 СOOH – олеиновая (1 двойная связь)
С17Н31СOOH – линолевая (2 двойные связи)
С17Н29СOOH – линоленовая (3 двойные
связи).
108.
Дикарбоновые кислотыСодержат 2 СООН – гр.
Могут давать два ряда производных – по
одной и по обеим СООН гр.
Свойства, отличные от свойств
монокарбоновых к-т:
1) Диссоциируют в 2 ступени:
2)
Двухосновные
к-ты
сильнее
одноосновных, т.к вторая СООН-гр. за
счет –I-эффекта способствует ионизации
первой СООН. Наибольшее влияние у
этандиовой (щавелевой) к-ты , т.к. группы
находятся рядом.
109.
Второй протон отщепляется труднее, т.к.карбоксилат-ион уменьшает способность к
диссоциации второй СООН –гр. за счет
водородных связей. По мере удаления
СООН-гр. друг от друга эти эффекты
ослабевают.
3. Отношение к нагреванию.
Щавелевая и малоновая к-ты при
нагревании (150°С) легко отщепляют СО2
(декарбокислируются)
HOOC H2C COOH
150oC
H3C COOH
CO2
110.
Янтарная (бутандиовая) и фталевая принагревании отщепляют воду с
образованием циклических ангидридов.
O
C
(CH2)2
HOOC
COOH
300oC
H2C
H2C
C
O
O
C OH
C OH
O
H2O
O
O
230oC
C
O
C
O
H2O
111.
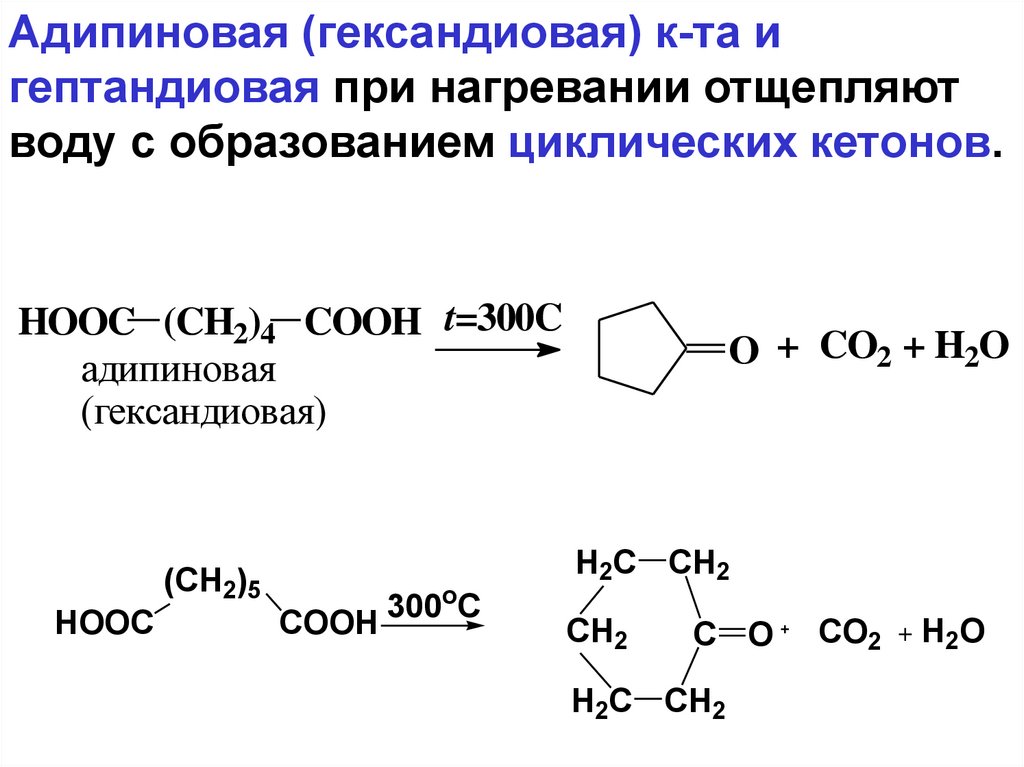
Адипиновая (гександиовая) к-та игептандиовая при нагревании отщепляют
воду с образованием циклических кетонов.
HOOC (CH2)4 COOH t=300C
адипиновая
(гександиовая)
(CH2)5
HOOC
COOH
300oC
O + CO2 + H2O
H2C CH2
CH2
C O
H2C CH2
CO2
H2O
112.
Отдельные представителиЩавелевая к-та. Обладает
восстанавливающими cв-вами (легко
окисляется), на чем основано ее
использование в аналитической
химии и как отбеливающее средство,
для удаления ржавчины.
Малоновая к-та. Применяют в
синтетической химии для получения
КК, аминокислот, лекарственных в-в.
113.
Янтарная к-та. Интерес представляетангидрид и имид (сукцинимид) – мягкий
бромирующий агент. Применяют в орг.
синтезе, в производстве красителей,
полимерных материалов.
Адипиновая к-та. Вступает в реакцию
поликонденсации с
гексаметилендиамином, образуя полиамид
(полимер), идущую на изготовление
синтетических волокон.
114.
HOOC-(CH2)4-COOH + n H-HN-(CH2)6-NH-HOC-(CH2)4-CO HN-(CH2)6-NH
амидная группа
n
+ n Н2O
115.
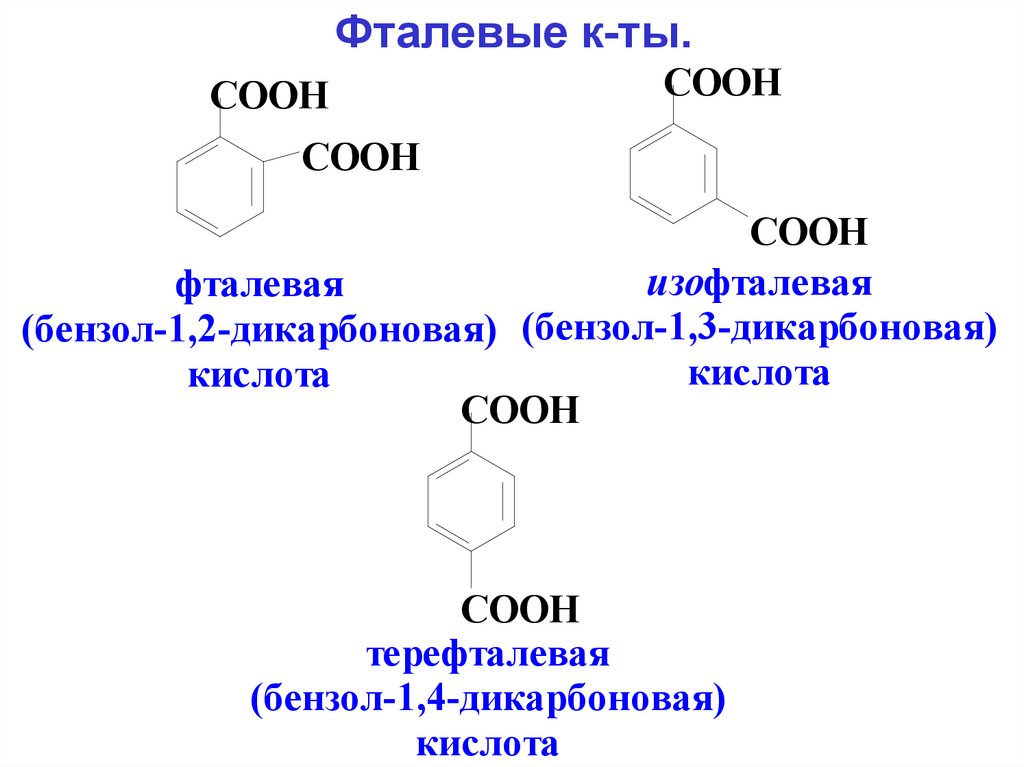
Фталевые к-ты.COOH
COOH
COOH
COOH
изофталевая
фталевая
(бензол-1,2-дикарбоновая) (бензол-1,3-дикарбоновая)
кислота
кислота
COOH
COOH
терефталевая
(бензол-1,4-дикарбоновая)
кислота
116.
Наиболее ценные фталевая итерефталевая к-ты. Фталевая к-та склонна
к образованию ангидрида, который имеет
большое практическое значение.
Фталимид калия используют в оргсинтезе
для получения первичных аминов, для
синтеза аминокислот. Применяют в пр-ве
алкидных смол, пластификаторов,
лекарственных в-в.
Терефталевая к-та в больших количествах
используется для производства
полиэфиров (poliester) (лакокрасочные
материалы, волокна, напр. лавсан).
117.
HOOC-C6H4-COOH + n H-О-СН2-CH2-О-Hтерефталевая к-та
этиленгликоль
OC-C6H4-CO О-СН2-CH2-О
сложноэфирная связь
n
полиэтилентерефталат (ПЭТФ)
+ n Н2O




















































 chemistry
chemistry








