Similar presentations:
Кислоты: состав, строение, классификация
1.
Что объединяеткартинках?
изображения,
на
этих
2.
НАЗОВИТЕ ТЕМУ УРОКА?3.
КИСЛОТЫ:СОСТАВ, СТРОЕНИЕ, КЛАССИФИКАЦИЯ.
4.
В ПРИРОДЕ ВСТРЕЧАЕТСЯ МНОГО КИСЛОТ:молочная
яблочная
муравьиная
лимонная
щавелевая
5.
В природе кислоты находятся в:• растениях;
• организмах
животных;
• организме
человека.
6.
Рассмотрите формулы кислоти найдите сходство между ними.
Как бы вы назвали оставшуюся часть,
если убрать общие атомы водорода?
7.
КИСЛОТЫ – этосложные вещества,
в составе которых атомы водорода связаны
с кислотным остатком.
Составьте общую формулу по определению
НК
8.
Как можно классифицировать кислоты?КИСЛОТЫ
1. ПО СОСТАВУ
БЕСКИСЛОРОДНЫЕ
КИСЛОРОДСОДЕРЖАЩИЕ
2. ПО КОЛИЧЕСТВУ АТОМОВ ВОДОРОДА
КИСЛОТЫ
ОДНООСНОВНЫЕ
ДВУХОСНОВНЫЕ
ТРЕХОСНОВНЫЕ
3. ПО РАСТВОРИМОСТИ
КИСЛОТЫ
РАСТВОРИМЫЕ
НЕРАСТВОРИМЫЕ
9.
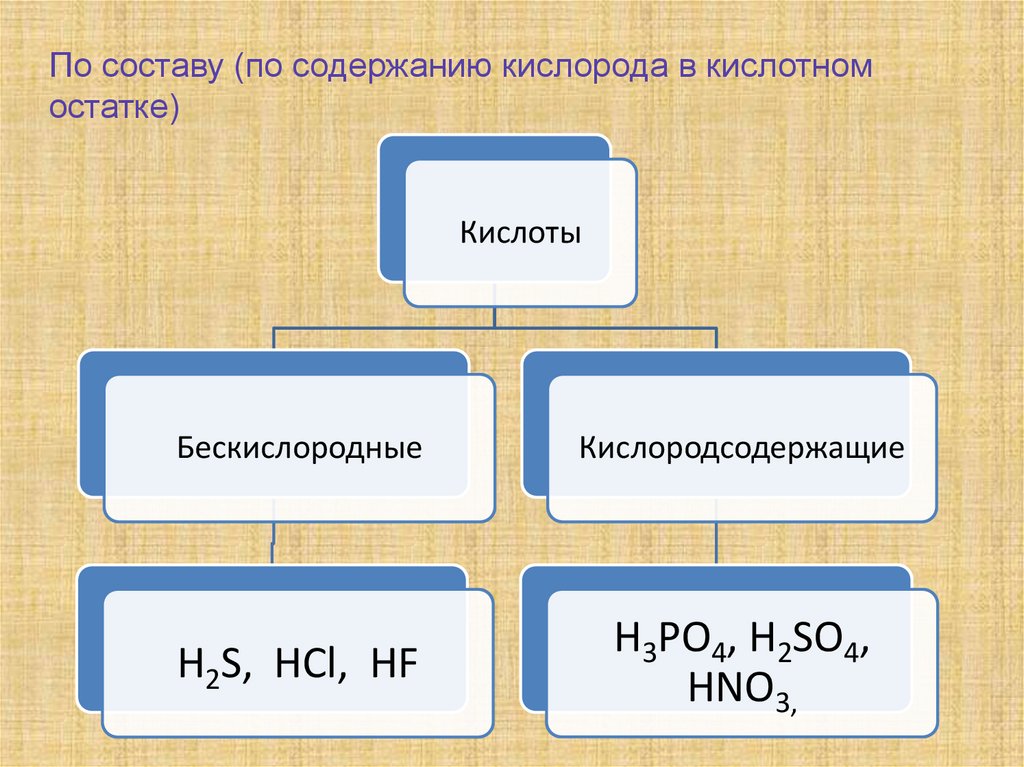
По составу (по содержанию кислорода в кислотномостатке)
Кислоты
Бескислородные
Кислородсодержащие
H2S, HCl, HF
H3PO4, H2SO4,
HNO3,
10.
По количеству атомов водородаодноосновные
• HCl
• HNO3
двухосновные
• H2S
• H2SO4
трехосновные
• H3PO4
11.
По растворимостиКислоты
Растворимые
H2SO4
HCl
Нерастворимые
H2SiO3
12.
Кремниевая кислота• H2SiO3
• Единственная
нерастворимая
кислота
13.
Жили-были четыре подружкикислоты:Серная была очень хитрая:
ни запаха, ни цвета не имела,
старалась не выделяться среди
подружек, а сама потихоньку
поглощала влагу из Воздуха и
других газов.
Характер у неё был жгучий.
Кожу, Ткани и Древесину она
при встрече тут же обугливала, а
при встрече с Водой начинала
кипеть и брызгаться.
Опасная была кислота.
Опишите физические свойства
кислот по сказке.
Сказка
Вторая подружка - кислота
Соляная - имела такой же резкий
характер, как и запах.
С водой общаться любила, но
при этом выделяла молекулы
газа,
которые
притягивали
водяные пары, поэтому Соляная
кислота начинала «дымиться» во
время общения.
Угольная и Сернистая кислоты были лучшими подружками, они
разлагались на воду и оксид - это их сближало.
Скучно было жить кислотам. И решили они найти себе ещё друзей и
для этого кинули клич, чтобы все, кому нужны друзья-кислоты,
присоединялись к ним. Всех, кто откликнулся, они вносили в список, и
вскоре их стало так много, что основали они целое государство,
которое образовало Таблицу кислот.
(текст Ильина Янина)
14.
Серная кислотабесцветная , вязкая
жидкость, без запаха,
вдвое тяжелее воды,
поглощает влагу из
воздуха и других
газов, обугливает
древесину, кожу,
ткани, бумагу.
15.
Обугливание лучинки сернойкислотой
16.
Соляная кислотаСоляная кислота (хлороводородная)
одноосновная кислота, «дымящая» на
воздухе, бесцветная едкая жидкость с
острым запахом хлористого водорода.
Соляная кислота содержится
желудочном соке (около 0,3%)
способствует пищеварению и
убивает болезнетворные бактерии.
Соляная кислота — едкое вещество, при попадании на
кожу вызывает сильные ожоги. Особенно опасно
попадание в глаза. При открывании сосудов с соляной
кислотой в обычных условиях образуется туман и пары
хлороводорода, которые раздражают слизистые оболочки
и дыхательные пути.
17.
Правило разбавлениякислот
Запомните правило:
сначала вода, потом
кислота, иначе случится
большая беда!!!
При растворении кислоты
нужно вливать ее тонкой
струей в воду и перемешивать.
18.
19.
ПРАВИЛА БЕЗОПАСНОСТИЕдкое вещество—кислота!
Разрушает и раздражает
кожу, слизистые оболочки.
Попавшие на кожу капли раствора
кислоты немедленно смойте
сильной струей холодной воды, а
затем обработайте поврежденную
поверхность 2%-м раствором
питьевой соды.
20.
Каждой кислородсодержащей кислоте соответствует свой оксид.Как узнать какие оксиды соответствуют данным кислотам?
Рассмотрим серную кислоту H2SO4 .
Помните, что суммарная степень
окисления атомов всех элементов в
соединении равна нулю, а степени
окисления водорода + 1 и кислорода – 2.
Рассчитаем СО серы:
О: -2*4=-8
Н: +1*2=+2
О и Н: -8+2=-6, значит
S: +6:1=+6
Серной кислоте H2SO4, в которой у серы
степень окисления равна + 6,
соответствует оксид серы (VI) –SO3
21.
Среду водных растворов экспериментально можноопределить различными способами.
Одним из способов является применение индикаторов,
изменяющих свою окраску при изменении среды
раствора.
Индикаторы — вещества, обратимо изменяющие
цвет в зависимости от среды раствора.
В качестве индикаторов чаще всего на практике
используют:
метилоранж,
лакмус,
фенолфталеин,
1) Метилоранж в водном растворе (в нейтральной
среде) имеет оранжевый цвет, лакмус — фиолетовый.
В кислой среде и метилоранж, и лакмус
приобретают красный цвет. Бесцветный фенолфталеин
в кислотной среде окраски не изменяет.
22.
МОЖНО ЛИ ОТЛИЧИТЬ КИСЛОТЫОТ ДРУГИХ ВЕЩЕСТВ С ПОМОЩЬЮ ИНДИКАТОРОВ?
ЛАКМУС
МЕТИЛОРАНЖ
Сделайте вывод из проделанной работы.
23.
Изменение цвета индикаторов в кислойсреде
Индикатор
Лакмус
Фенолфталеин
Метиловый
оранжевый
Нейтральная
среда
Кислая
среда
Фиолетовый
Красный
Бесцветный
Бесцветный
Оранжевый
Краснорозовый
Помни! Нерастворимые кислоты не меняют окраску
индикаторов.
24.
ПРИМЕНЕНИЕ КИСЛОТ В ЖИЗНИ ЧЕЛОВЕКА:25.
Проверь себяВыберите группу веществ, в состав которой
входят только кислоты
HCl, SO3, NaOH,CuCl2
HNO3, H2S, HCl, H3PO4
K2O, H2SO4, H2S, KOH
AgNO3, CO2, CuSO4, HCl
26.
Проверь себяВыберите группу веществ, в состав которой
входят только двухосновные кислоты
HNO3, H2S, HCl, H3PO4
H3PO4, H2SO4, H2S, HCl
H2S, H2SO4, H2SiO3, H2CO3
HNO3, H2CO3, H2SO4, HF
27.
Проверь себяВыберите группу веществ, в состав которой
входят только кислородсодержащие кислоты
HNO3, H2S, HCl, H2CO3
HCl, H2SO4, H2SiO3, H2SO3
H2S, HNO3, H2SO3, H3PO4
HNO3, H2SO4, H3PO4, HNO2
28.
Проверь себяВ кислой среде синий лакмус становится:
фиолетовым
красным
малиновым
не изменяет окраску
29.
Вспомните правилоразбавления кислот
30.
Сделайте вывод о вашей работе на уроке,используя одно из выражений.
Сегодня на уроке :
я научился…..
мне показалось, что
наиболее важным было….
я почувствовал, что…….
Или оцените свою работу на уроке:
НЕ ДОВОЛЕН
НЕ СОВСЕМ
ДОВОЛЕН
ДОВОЛЕН
31.
БУДЬ ПРИЛЕЖЕН,И У ТЕБЯ ВСЕ ПОЛУЧИТСЯ!
32.
ДОМАШНЕЕ ЗАДАНИЕ.1.
2.
3.
4.
21 (пересказ); названия и формулы кислот – выучить;
в параграфе обратить внимание на заряды ионов
кислотных остатков (заряды можно посмотреть в
таблице растворимости) и на существование угольной и
сернистой кислот.
Конспект презентации записать в тетради.
Задание «проверь себя» из презентации выполнить
письменно как домашнее задание.
Все это должно быть в тетради к следующему уроку.
Мне не отправлять!
33.
Используемые интернет – ресурсы (картинки) :http://lechenie-simptomy.ru/wp-content/uploads/2015/05/limon.jpg
http://www.opt-union.ru/l1579405/images/photocat/1000x1000/1001618467.jpg
http://fotohomka.ru/images/Nov/14/ac7011f92405c35f0cae5376d7d8f2cf/1.jpg
http://открытыйурок.рф/статьи/503041/
https://riaami.ru/wp-content/uploads/2017/05/sugary-drinks-soda-obesity.jpg
http://heaclub.ru/tim/69f50579607932ee3f6ff28d5996e6ed/chem-ubit-muravev-vdome.jpg
http://seana-stroy.ru/wp-content/uploads/2016/12/Промышленный-объект.jpg
https://www.treatmentonline.com.ua/images/13_Skin_and_subcutaneous_tissue/13_4_Skin_and_subc
utaneous_tissue/13_4_39.jpg
https://selitra.in.ua/sites/default/files/imagecache/thumbimages/images/product/_1%20(1)_6.jpg
http://lechenie-simptomy.ru/wp-content/uploads/2017/04/57546905d3e79.jpg
http://sadsha.ru/content/posts/2016-10/biznes-1_deshevye-lekarstva-mogutrezko-podorozhat_1.jpeg
































 chemistry
chemistry








