Similar presentations:
Кислоты. Физические свойства кислот
1.
УРОК №2. Определение
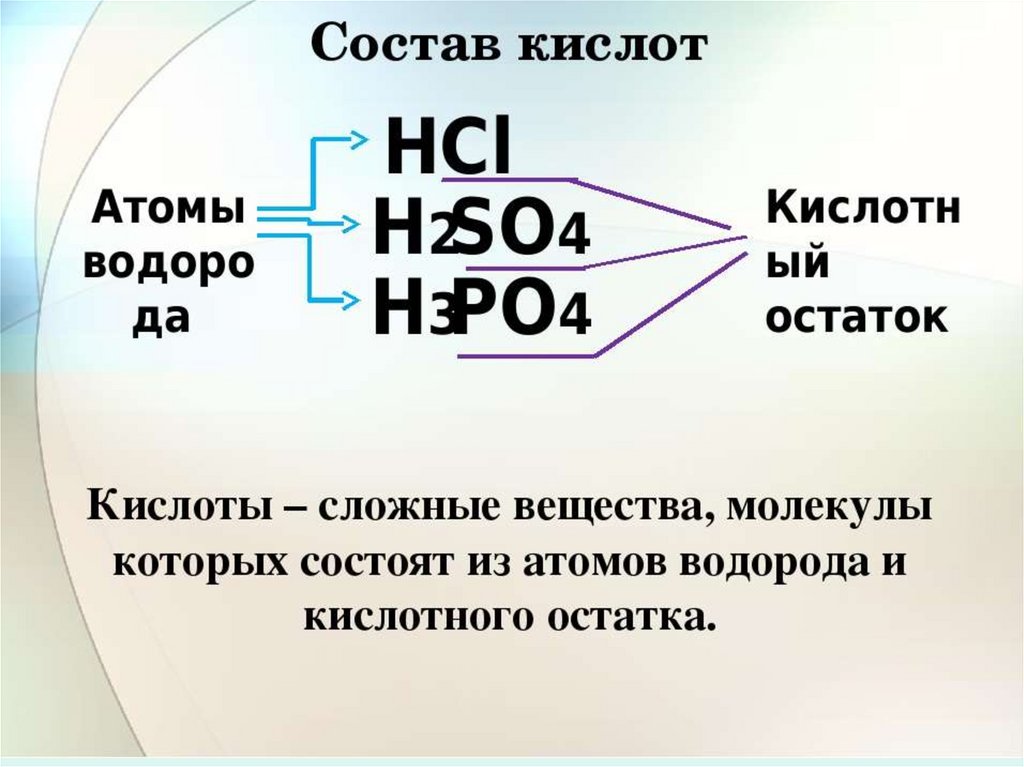
• Кислоты- сложные вещества,состоящие из одного или нескольких
атомов водорода, способных
заместиться на атом металла, и
кислотного остатка.
Число атомов водорода определяет
основность кислот и валентность
кислотного остатка.
3.
4.
5. Определение
• С точки зрения теорииэлектролитической диссоциации:
Кислоты - электролиты, которые при
диссоциации в качестве катионов
образуют только H+.
6.
Физические свойства кислотЖидкости
Твердые
H2SO4
H3PO4
HClO4 и др. H2SiO3
Газообразные
HCl
H2S и др.
и др.
*Кремниевая не растворима в воде.
*Некоторые кислоты «дымят» на воздухе,
например соляная.
*Многие кислоты имеют специфический
запах.
7.
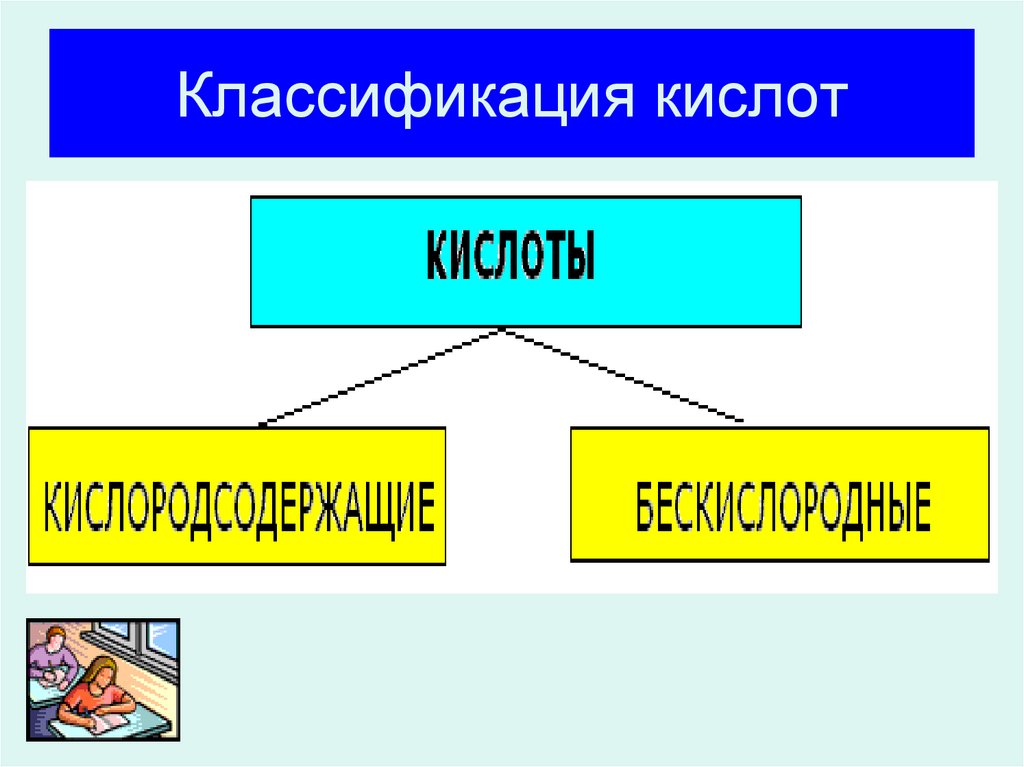
8. Классификация кислот
9. Классификация кислот
БескислородныеHCl, HBr, HI, H2S
анион "-ид"
HCl- хлороводородная
(соляная кислота),
Cl-хлорид
H2S-сероводородная,
S2- - сульфид
Кислородсодержащие
H2SO4
HNO3
H2CO3
H3PO4
и другие.
10. Классификация кислот
• По числу атомов водорода,способных замещаться на металл:
одно-, двух-, трёхосновные...
11.
Бескислородные:HCl - хлороводородная (соляная)одноосновная - хлорид
HBr -бромоводородная одноосновная бромид
HI - йодоводородная одноосновнаяйодид
HF - фтороводородная(плавиковая)одноосновная- фторид
H2S - сероводородная двухосновная сульфид
Кислородсодержащие:
HNO3 – азотная одноосновная нитрат
H2SO3 - сернистая двухосновная сульфит
H2SO4 – серная двухосновная сульфат
H2CO3 - угольная двухосновная карбонат
H2SiO3 - кремниевая двухосновная силикат
H3PO4 - фосфорная трёхосновная фосфат
12.
13. Определение растворимых кислот с помощью индикаторов
Индикаторы и ихцвет в нейтральной
среде
Универсальный
бумажный (желтый)
Цвет индикаторов в
кислотах
Лакмус (фиолетовый)
Красный
Метилоранж
(оранжевый)
Розовый
Красный
14.
15. Важнейшие представители
H2SO4 – серная кислота.Бесцветная жидкость, вязкая, как масло, не
имеющая запаха, тяжелее воды. Может
поглощать воду из воздуха и других газов,
поэтому ее используют для осушения
некоторых газов. При растворении в воде
выделяется большое количество тепла.
Серная кислота обугливает древесину, кожу,
ткани.
При попадании на кожу кислоту следует
нейтрализовать раствором соды и промыть
водой.
16. Модель молекулы
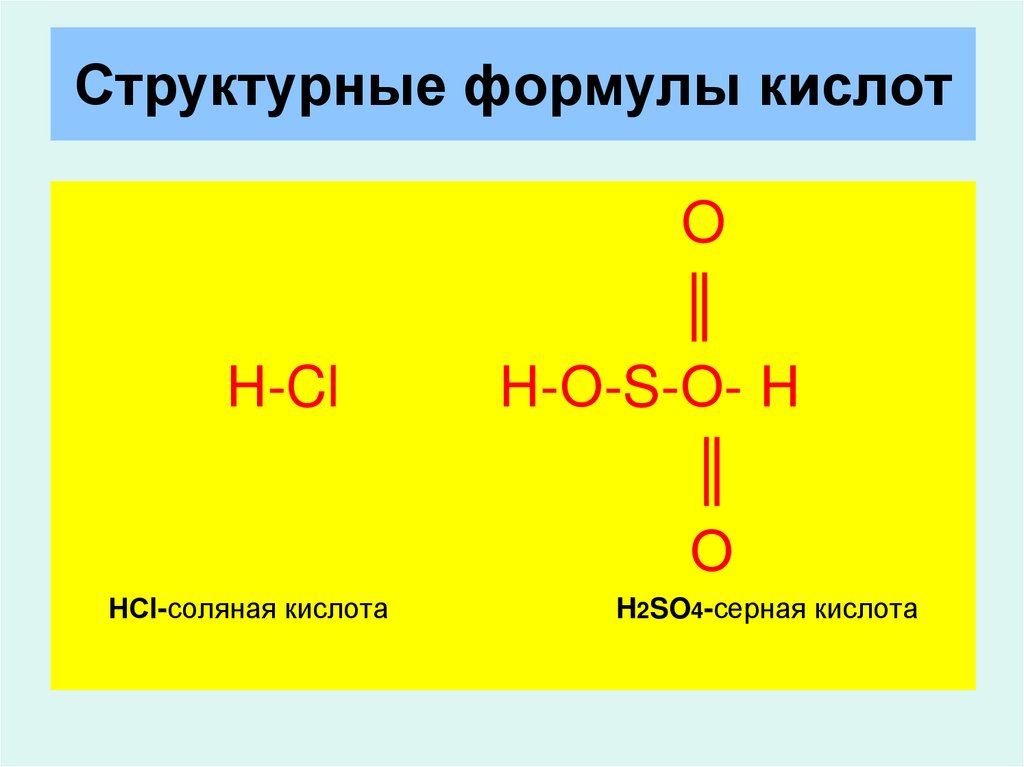
17. Структурные формулы кислот
Н-ClНСl-соляная кислота
O
║
Н-О-S-О- Н
║
О
H2SO4-серная кислота
18.
19. ПОЛУЧЕНИЕ КИСЛОТ
Кислородсодержащие:1.Кислотный оксид+вода:
SO3+H2O=H2SO4
P2O5+3H2O=2H3PO4
2.Металл+сильный окислитель:
P+5HNO3+2H2O=3H3PO4+5NO
3.Cоль + менее летучая кислота:
NaNO3+H2SO4=HNO3↑+NaHSO4
Бескислородные:
1.Водород+неметалл:
H2+Cl2=2HCl
2.Cоль + менее летучая кислота:
NaCl+H2SO4=2HCl↑+NaHSO4
20.
21. ХИМИЧЕСКИЕ СВОЙСТВА
1.Изменяют окраску индикаторов:-лакмус - красный
-метилоранж – розовый( только для
растворимых кислот)
22. ХИМИЧЕСКИЕ СВОЙСТВА
2.Взаимодействие с металлами,стоящими до водорода:
H2SO4 + Ca = CaSO4 + H2
2HCl + Ca = CaCl2 + H2
23. ХИМИЧЕСКИЕ СВОЙСТВА
3.Взаимодействие с основнымиоксидами:
H2SO4 + CaO = CaSO4 + H2O
2HCl + CaO = CaCl2 + H2O
24. ХИМИЧЕСКИЕ СВОЙСТВА
4.Взаимодействие с амфотернымиоксидами:
H2SO4 + ZnO = ZnSO4 + H2O
2HCl + ZnO = ZnCl2 + H2O
25. ХИМИЧЕСКИЕ СВОЙСТВА
5.Взаимодействие с основаниями(реакция нейтрализации):
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
2HCl + Ca(OH)2 = CaCl2 + 2H2O
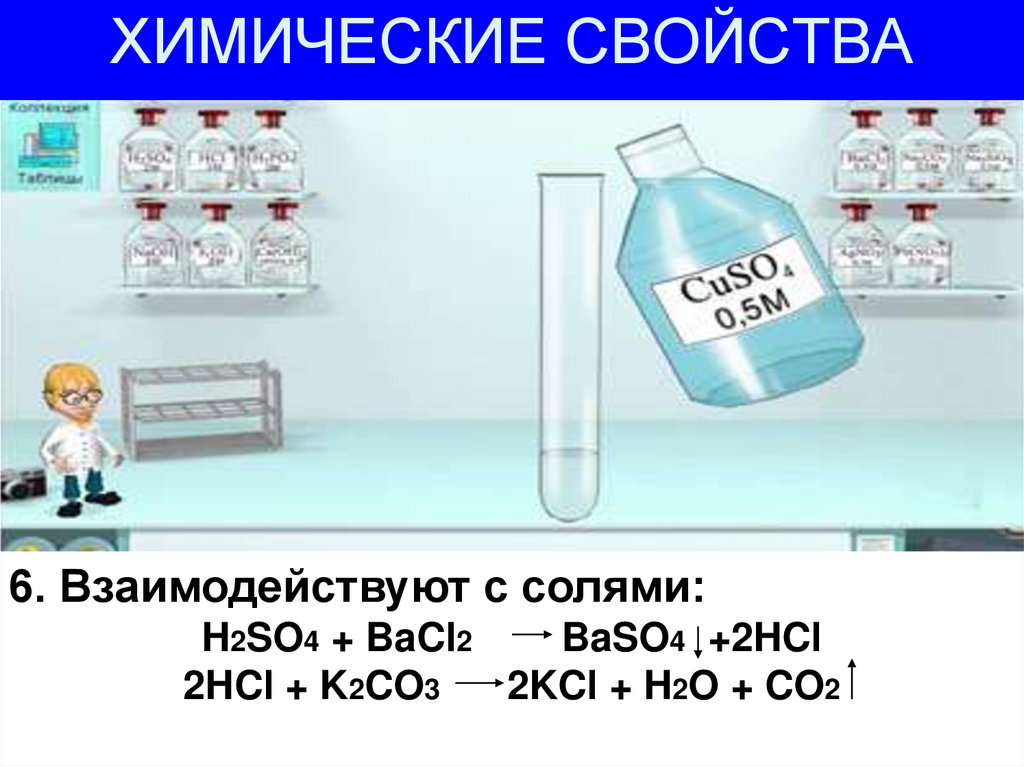
26. ХИМИЧЕСКИЕ СВОЙСТВА
6. Взаимодействуют с солями:H2SO4 + BaCl2
BaSO4 +2HCl
2HCl + K2CO3
2KCl + H2O + CO2
27.
28. Закрепление
• 1-й уровень. Запишите формулыгидроксидов, соответствующих оксидам,
формулы которых: N2O5 , CO2.
• 2-й уровень. Запишите формулы
гидроксидов, соответствующих оксидам,
формулы которых: Mn2O7, SiO2, B2O3.
• 3-й уровень. Запишите формулы
гидроксидов, соответствующих оксидам,
формулы которых: P2O5, N2O3, CO.
29. Закрепление
• Из перечня формул:KOH, НВr, CO2, НI, NaOH, H2SO4, MgO,
Н2SO3, HNO3, NaCl, Н2CO3, FeO,
Н3РO4, FeCl3, НCl
выпишите и назовите вещества,
относящиеся к классу кислот.
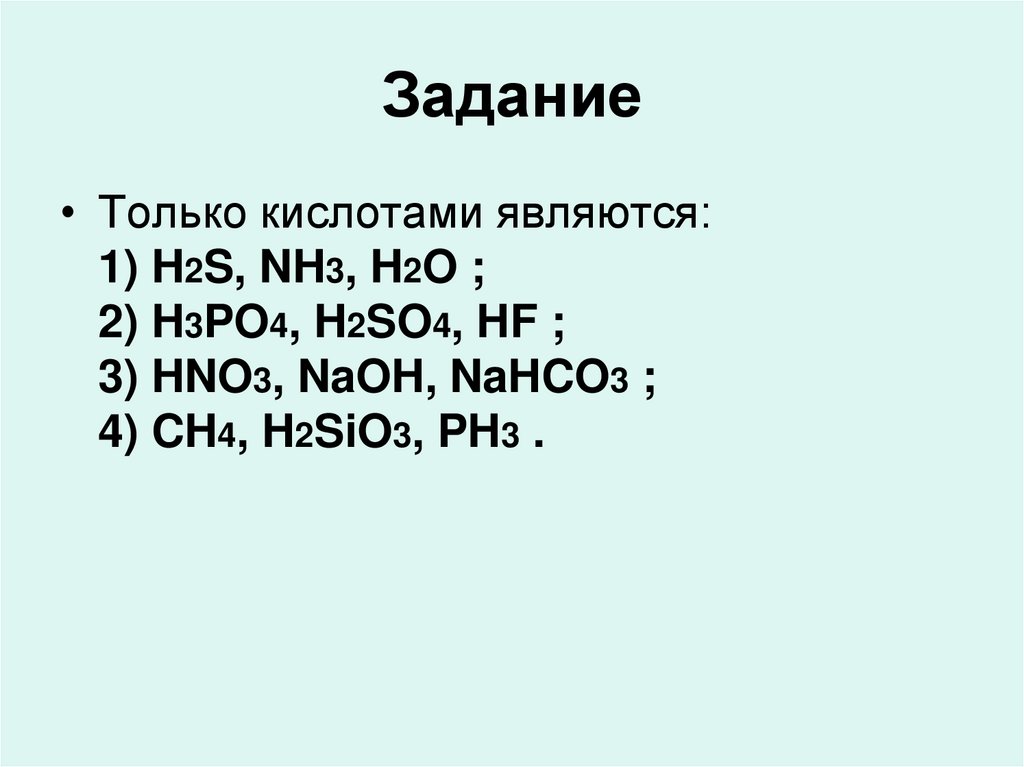
30. Задание
• Только кислотами являются:1) H2S, NH3, H2O ;
2) H3PO4, H2SO4, HF ;
3) HNO3, NaOH, NaHCO3 ;
4) CH4, H2SiO3, PH3 .
31. Задание
• Какое утверждение изклассификационной характеристики
фосфорной кислоты H3PO4 не верно:
1)кислородсодержащая;
2)сильная;
3)трёхосновная;
4)растворимая.
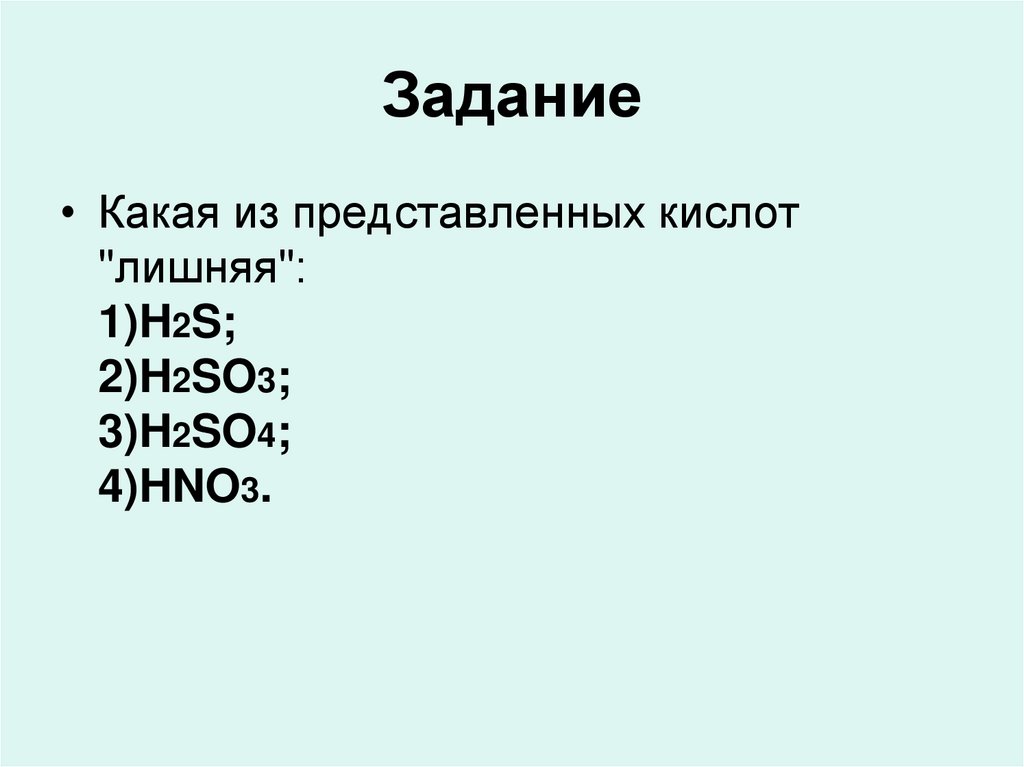
32. Задание
• Какая из представленных кислот"лишняя":
1)H2S;
2)H2SO3;
3)H2SO4;
4)HNO3.
33. Задание
• Основные свойства кислот:1.
Действие на индикаторы.
лакмус метилоранж –
2. Кислота+ металл
HCI + Mg=
H₂SO₄ + Fe =
H₂SO₄ + AI=
34.
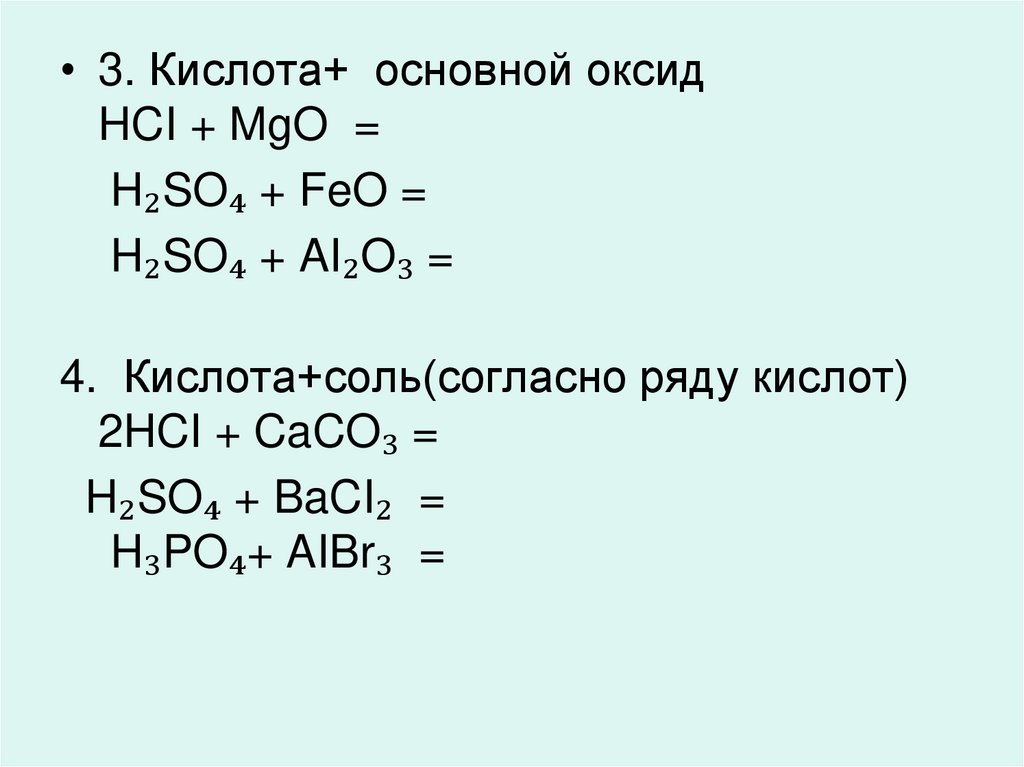
• 3. Кислота+ основной оксидHCI + MgO =
H₂SO₄ + FeO =
H₂SO₄ + AI₂O₃ =
4. Кислота+соль(согласно ряду кислот)
2HCI + CaCO₃ =
H₂SO₄ + BaCI₂ =
H₃PO₄+ AIBr₃ =
35.
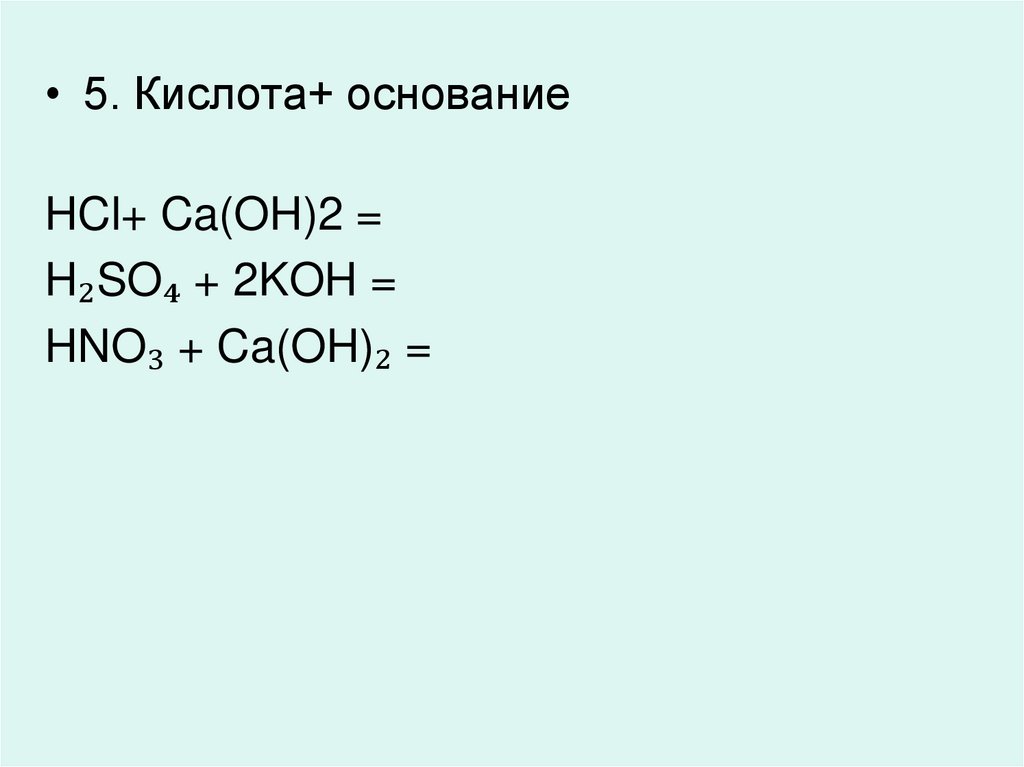
• 5. Кислота+ основаниеHCl+ Ca(OH)2 =
H₂SO₄ + 2KOH =
HNO₃ + Ca(OH)₂ =





























 chemistry
chemistry








