Similar presentations:
Кислоты, классификация, свойства кислот
1.
2. Тема урока
«Кислоты, классификация, свойства кислот»3.
КислотыНеорганические кислоты- это сложные
вещества, молекулы которых содержат
один или несколько
атомов водорода,
способных замещаться на атомы
металлов,
и кислотного остатка.
Hn R-n,
где R- кислотный
остаток ;
n- число атомов
водорода, равное
степени окисления
кислотного остатка.
4.
Выбери формулы кислотСхем
а
NaCl
Ba(ОH)2
H3BО3
BaSO4
СaО
Cl2О7
Mg3(PO4
)2
CО2
Основани
я
H2SО4
HCl
Fe(ОH)3
HNO3
Сa(ОH)2
K2SiO3
SО3
CuО
Кислоты
P2О5
Сu(ОH)2
CuBr2
CaCO3
Na2SO4
Ag2О
HNO2
LiОH
NaОH
H3PО4
Fe2О3
H2SО3
NaNO2
Mg(NO3)
KОH
Fe(ОH)2
H2S
Li2О
K2CO3
H2SiО3
Оксиды
Соли
2
5.
ФормулыHCl
H2CO3
H2SO4
H2SO3
H2S
HNO2
HNO3
H3PO4
H2SiO3
Названия
хлороводородая
угольная
серная
сернистая
сероводородная
азотистая
азотная
фосфорная
кремниевая
6. Определить степень окисления кислотного остатка
HClH2SO4
HNO3
H2CO3
H3PO4
7. Классификация кислот
По количеству атомов водорода(по основности)
По наличию атома кислорода
.
1. одноосновные HCl
2. двухосновные H2SO4
3. трехосновные H3PO4
1. Кислородсодержащи
е H2SO4
2. Бескислородные HCl
Классифицируйте
кислоты :
HF
H
SO
2
H3AsO3 4
8.
Какие из этих кислот слабые?HCl
H2CO3
H2SO4
H2SO3
H2S
HNO2
HNO3
H3PO4
H2SiO3
хлороводородая
угольная
серная
сернистая
сероводородная
азотистая
азотная
фосфорная
кремниевая
9. Слабые кислоты
ЗАПОМНИ !SO2
CO2
H2CO3
H2SO3
H 2O
Угольная кислота
H 2O
Сернистая кислота
HNO2
Азотистая кислота
H2SiO3
Кремниевая кислота
H2S
Сероводородная
кислота
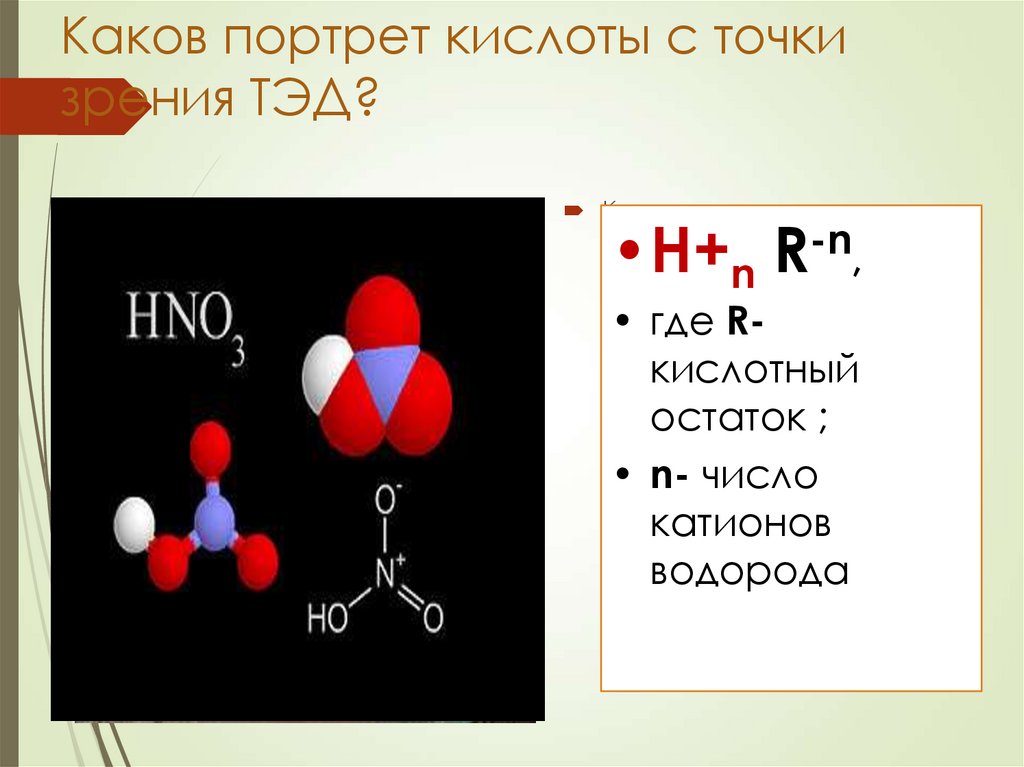
10. Каков портрет кислоты с точки зрения ТЭД?
Кислота, когда здорова,Угостить друзей готова
,
Тем, что ей дала природа:
Катионом водорода!
•H+n
-n
R
• где Rкислотный
остаток ;
• n- число
катионов
водорода
11. Каков портрет кислоты с точки зрения АМУ и ТЭД?
-n•Hn R ,
• где R- кислотный
остаток ;
• n- число атомов
водорода, равное
степени окисления
кислотного остатка.
Кислота, когда здорова,
Угостить друзей готова
Тем, что ей дала,природа:
Катионом водорода!
•H+n
-n
R
• где R- кислотный
остаток ;
• n- число
катионов
водорода
12.
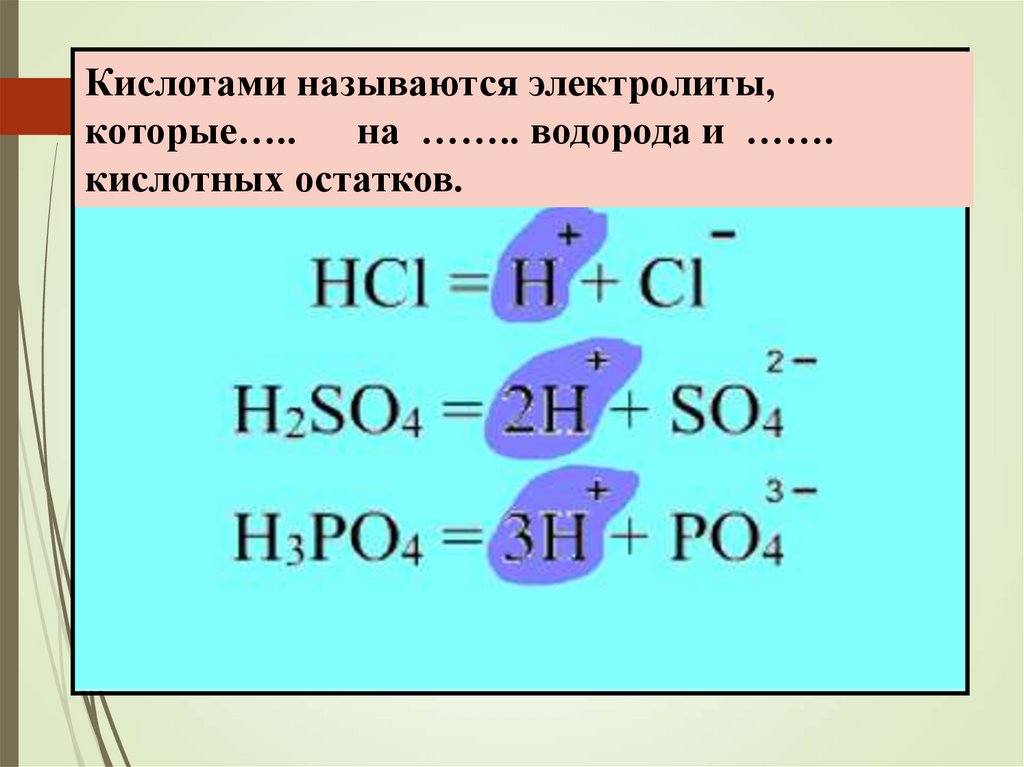
Кислотами называются электролиты,которые…..
на …….. водорода и …….
кислотных остатков.
13.
Кислотами называются электролиты, которыедиссоциируют на катионы водорода и анионы
кислотных остатков.
14.
Физические свойства…………в воде
H2SiO3
К
И
С
Л
О
Т
Ы
………..в воде
H2SO4
H3PO4
Растворы кислот имеют …….. вкус. Например, многим
плодам придают этот вкус содержащиеся в них…….
Отсюда названия …….
яблочная
муравьиная
лимонная
щавелевая
15.
Физические свойстваНерастворимые
в воде
H2SiO3
К
И
С
Л
О
Т
Ы
растворимые
H2SO4
H3PO4
Растворы кислот имеют кислый вкус. Например, многим
плодам придают кислый вкус содержащиеся в них кислоты.
Отсюда названия кислот:
яблочная
муравьиная
лимонная
щавелевая
16.
Изменение окраски индикатора вкислотах
название
индикатора
лакмус
окраска индикатора
в нейтральной
среде
окраска
индикатора в
кислой среде
фиолетовая
красная
оранжевая
краснорозовая
бесцветная
бесцветная
метилоранж
фенолфталеин
Подсказка: Фенолфталеин,
метилоранж, лакмус
17.
Неорганические кислоты- это сложные вещества, молекулы которыхсодержат…….
один или несколько атомов водорода,
способных замещаться на атомы….
и ……. кислотного остатка.
металлов
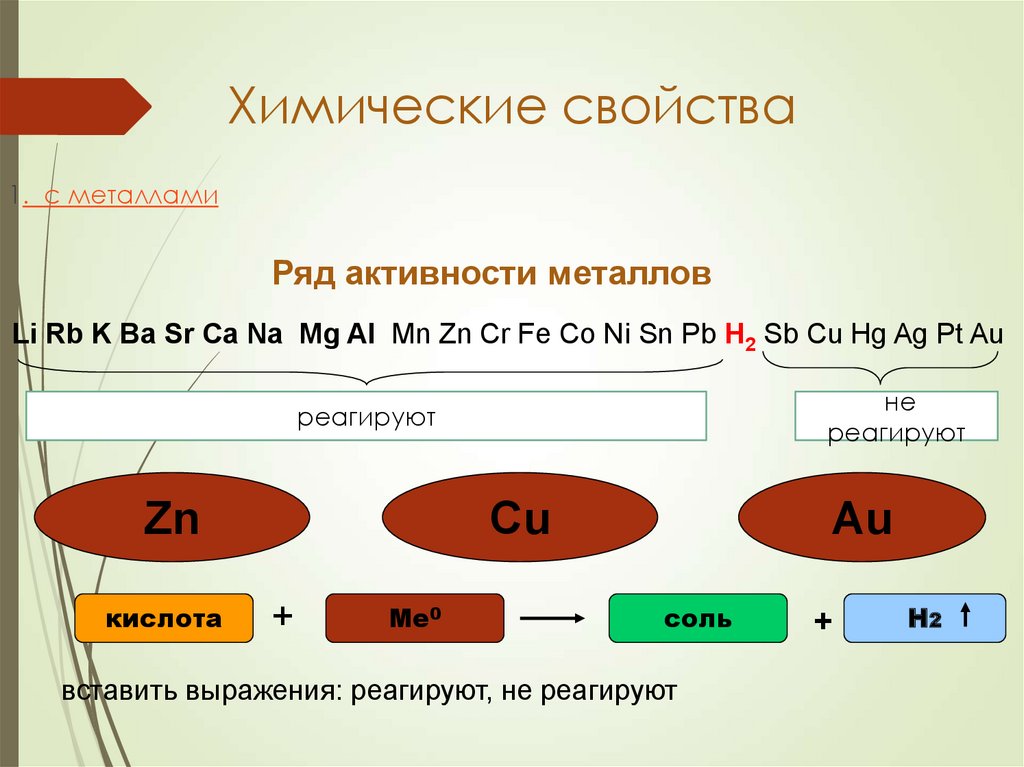
18. Химические свойства
1. с металламиРяд активности металлов
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H2 Sb Cu Hg Ag Pt Au
не
реагируют
реагируют
Сu
Zn
кислота
+
Ме0
Au
соль
вставить выражения: реагируют, не реагируют
+
H2
19. Бекетов Николай Николаевич
Русский химик, академикПетербургской Академии
наук. Основоположник
физической химии. В 1863 г.
составил вытеснительный
ряд металлов, который
называется по имени
ученого.
20. Химические свойства
2.Взаимодействиесоксидами Ме (МеО)CuO
CuSO4
+
H2SO4
H2O
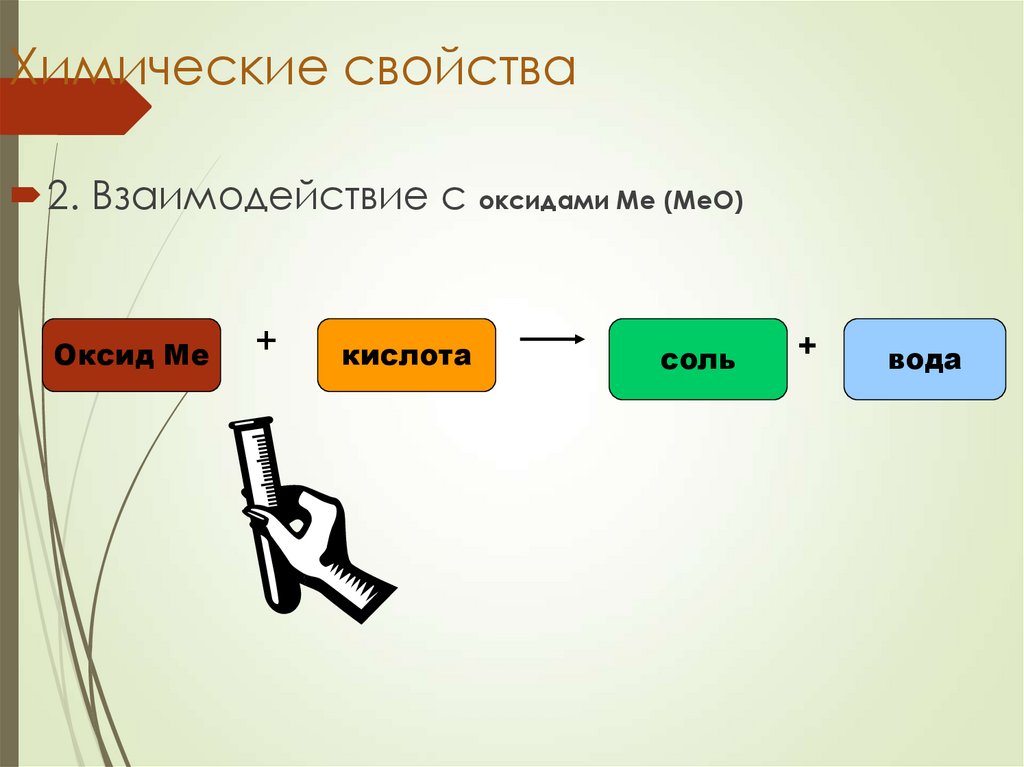
21. Химические свойства
2. Взаимодействие с оксидами Ме (МеО)Оксид Ме
CuO
+
кислота
соль
+
H2SO4
вода
22. Химические свойства
2. Взаимодействие с оксидами Ме (МеО)Оксид Ме
+
кислота
соль
+
вода
23. Химические свойства
3. Взаимодействие с основаниями Ме(ОН)nнейтрализации)
основание
+
кислота
(р.
соль
+
вода
24. Химические свойства
4. Взаимодействие с солямисоль
+
Раствор соли
кислота
+
осадок
Слабая кислота
Сухая соль
HNO3
H2SO4, HCl, H2SO3, H2CO3, H2S, H2SiO3
H3PO4
(каждая предыдущая кислота может вытеснить из соли последующую)
25. Химические свойства
4. Взаимодействие с солямисоль
+
кислота
соль
+
кислота
осадок
Слабая кислота
HNO3
H2SO4, HCl, H2SO3, H2CO3, H2S, H2SiO3
H3PO4
(каждая предыдущая кислота может вытеснить из соли последующую)
26.
Химические свойства кислотЗдесь начало уравнений.
Дописать вы их должны,
и еще хочу сказать:
«Нужно также уравнять!»
1.H2SO4 +Cu
→
2.H2SO4 + Zn
→
3.H2SO4+ Au
→
4.H2SO4
+ CuO
→
5.H2SO4
+ (CuOH)2
→
6.H2SO4
+ CaCO3
→
27.
лакмус – красныйК
И
С
Л
О
Т
А
+
Индикатор метилоранж – красный
+
Основание
фенолфталеин - бесцветный
+
МехОу
+
Ме
(доН2)
соль + Н2О
соль + Н2О
соль + Н2
28. Практическая часть
Определите, содержит ли выданный вам напитоки минеральная вода кислоту.
Можно ли очистить пробирку раствором кислоты,
если если на стенках пробирки налет Cu2O
.Почему?
29. Правила обращения с кислотами
!Разрушают кожу, ткани,
древесину.
ОСТОРОЖНО!
Нейтрализовать раствором соды,
смыть водой.
30. Химические свойства кислот
Химические свойстваКислоты взаимодействуют:
кислот
1.с……, стоящими в ряду напряжений до……,с образованием соли и
водорода;
2.со всеми …….с образованием соли и воды (реакция
нейтрализации);
3. с всеми ……металлов с образованием соли и воды;
4. с солями, если выпадает…… или выделяется ……..
31. Химические свойства кислот
Химические свойстваКислоты взаимодействуют:
кислот
1.с металлами, стоящими в ряду напряжений до водорода, с
образованием соли и водорода
2.со всеми основаниями с образованием соли и воды (реакция
нейтрализации):
3. с оксидами металлов с образованием соли и воды,
4.солями, если выпадает осадок или выделяется газ.
32. Выводы
1.Кислота – это ……вещество, в молекуле которого имеется один или
несколько атомов ….. и ……..остаток.
2.
Кислота – это электролит, который …… на …….. водорода и …..
кислотного остатка.
3.
Кислоты классифицируются:
по числу атомов водорода (основности) – ….., ……и…..;
по наличию кислорода в кислотном остатке –…….и ……….;
по растворимости – …… и .
по силе -……и…………
4. Кислоты взаимодействуют с……., стоящими в ряду напряжений до ……..,
со всеми …….. и ……металлов, ………, если при этом образуются газ
или осадок.
33. Выводы
1.Кислота – это сложное вещество, в молекуле которого имеется один
или несколько атомов водорода и кислотный остаток.
2.
Кислота – это электролит, который диссоциируют на катионы водорода
и анионы и кислотного остатка.
3.
Кислоты классифицируются по числу атомов водорода (основности) –
одноосновные, двухосновные и трехосновные; по наличию кислорода в
кислотном остатке – бескислородные и кислородсодержащие; по
растворимости – нерастворимые и растворимые.
4.
Кислоты взаимодействуют с металлами, стоящими в ряду напряжений
до водорода, со всеми оксидами и гидроксидами металлов, солями,
если при этом образуются газ или осадок.
34. Рефлексия
Сегодня на уроке я:Научился…
Мне показалось важным…
Я понял, что…
Я почувствовал, что…
Своей работой на уроке я:
♦ Доволен…
♦ Не совсем доволен…
♦ Я не доволен, потому что





























 chemistry
chemistry








