Similar presentations:
Свойства кислот
1.
Тема презентацииКИСЛОТЫ
2.
Назначение презентацииПрезентация предназначена для использования в
качестве наглядного материала при изучении темы
«Кислоты» на уроках химии в 8 классе.
Цель презентации
Познакомить учащихся с классификацией
и химическими свойствами кислот.
3.
Преимущества презентации• Содержит опорные схемы, способствующие
быстрому запоминанию учащимися учебного
материала;
• Содержит анимацию «Изменение окраски
индикаторов», что позволяет наблюдать
учащимся за изменениями окраски индикаторов в
растворах кислот;
• В презентации использованы видеофрагменты с
диска «Уроки химии Кирилла и Мефодия. 8-9
классы.»;
• Презентация интерактивна, дает возможность
фронтальной работы с классом.
4.
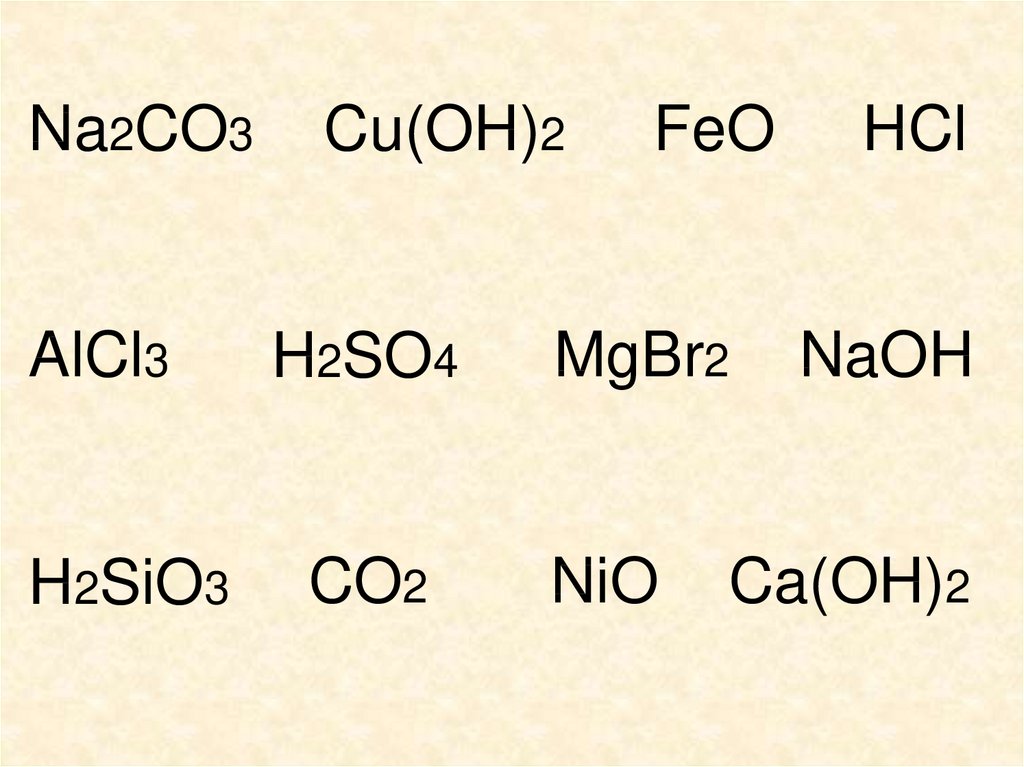
Na2CO3AlCl3
H2SiO3
Cu(OH)2
H2SO4
CO2
FeO
MgBr2
NiO
HCl
NaOH
Ca(OH)2
5.
Тема урокаКИСЛОТЫ
6.
Цель урока: познакомиться склассификациями и общими
химическими свойствами кислот.
7. План урока
1. Классификации кислот2. Физические свойства кислот
3. Химические свойства кислот
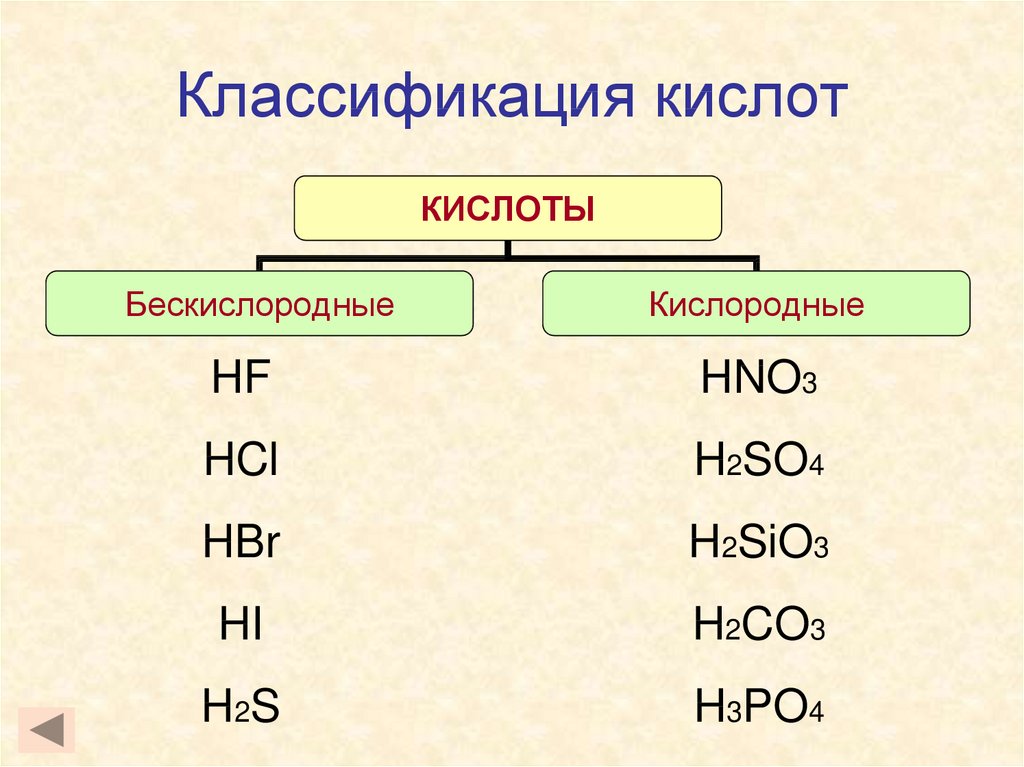
8. Классификация кислот
КИСЛОТЫБескислородные
Кислородные
HF
HNO3
HCl
H2SO4
HBr
H2SiO3
HI
H2CO3
H 2S
H3PO4
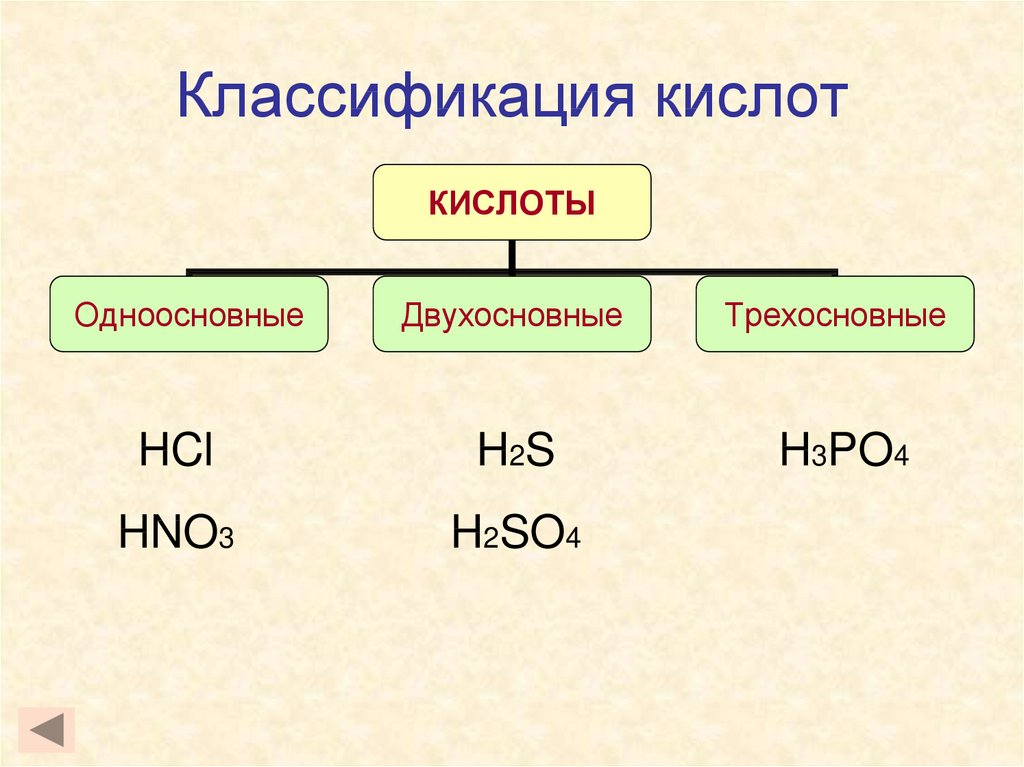
9. Классификация кислот
КИСЛОТЫОдноосновные
Двухосновные
Трехосновные
HCl
H 2S
H3PO4
HNO3
H2SO4
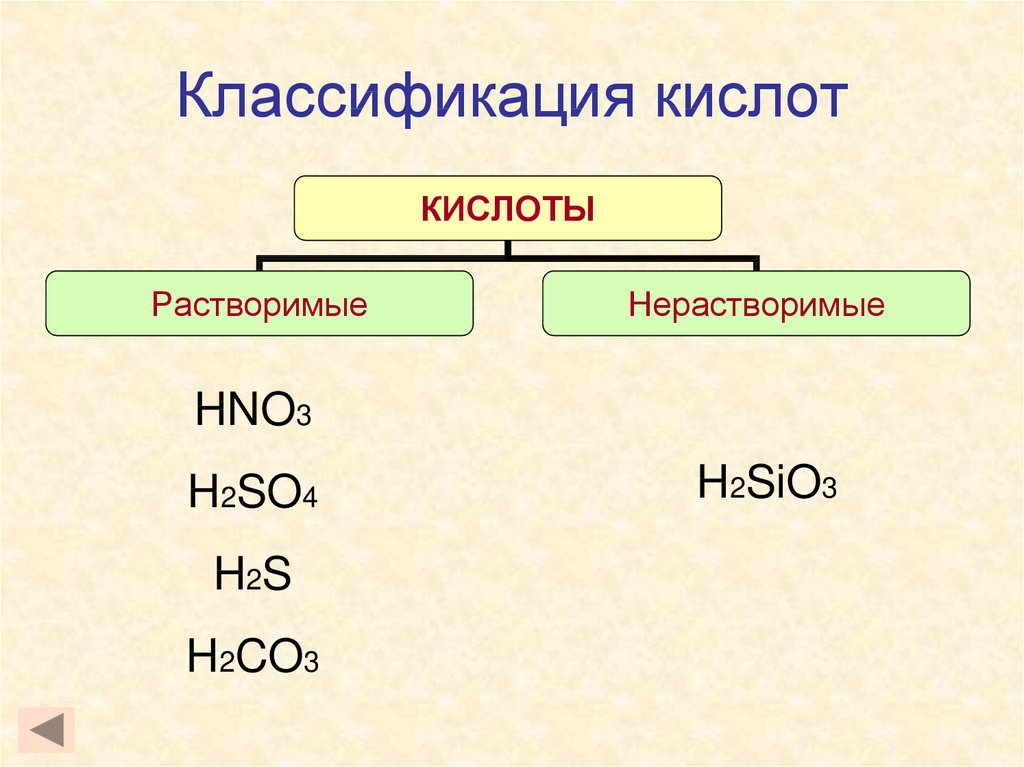
10. Классификация кислот
КИСЛОТЫРастворимые
Нерастворимые
HNO3
H2SO4
H 2S
H2CO3
H2SiO3
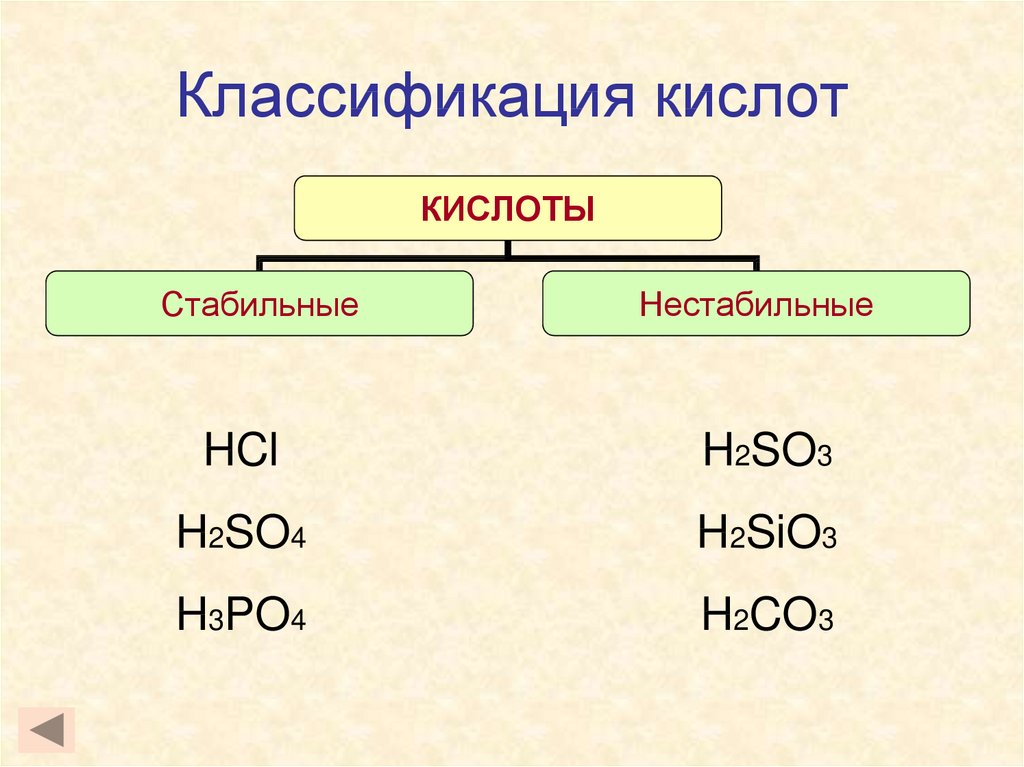
11. Классификация кислот
КИСЛОТЫСтабильные
Нестабильные
HCl
H2SO3
H2SO4
H2SiO3
H3PO4
H2CO3
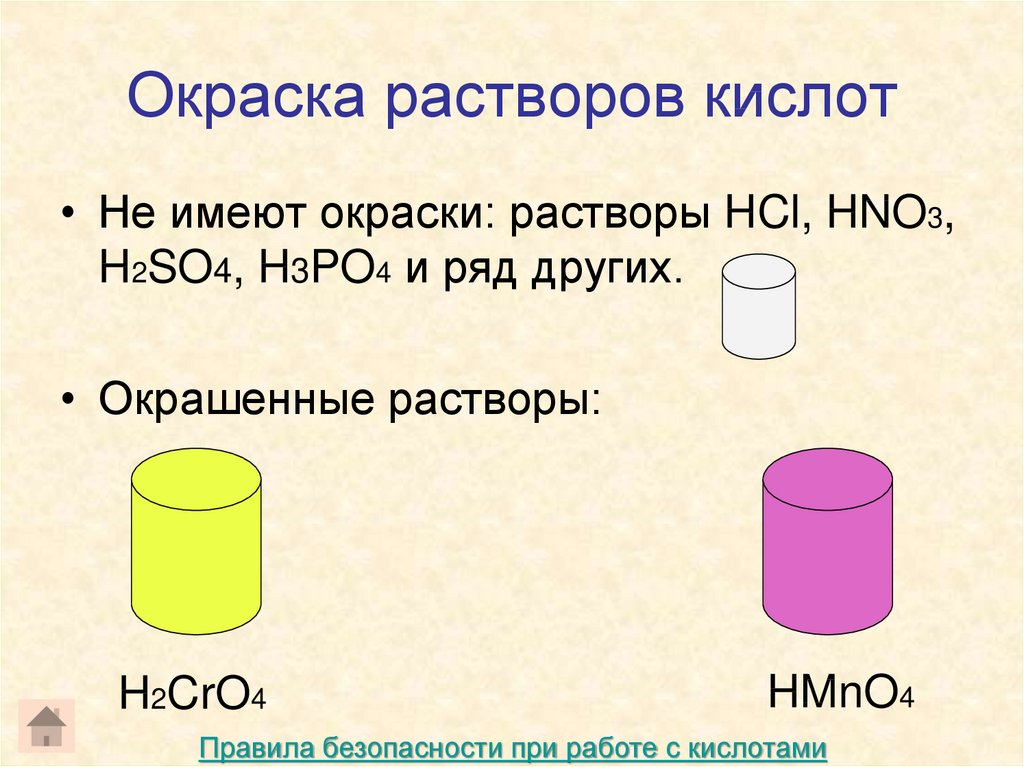
12. Окраска растворов кислот
• Не имеют окраски: растворы HCl, HNO3,H2SO4, H3PO4 и ряд других.
• Окрашенные растворы:
H2CrO4
HMnO4
Правила безопасности при работе с кислотами
13. Химические свойства кислот
• Действие кислот на индикаторылакмус
метилоранж
Опыт
фенолфталеин
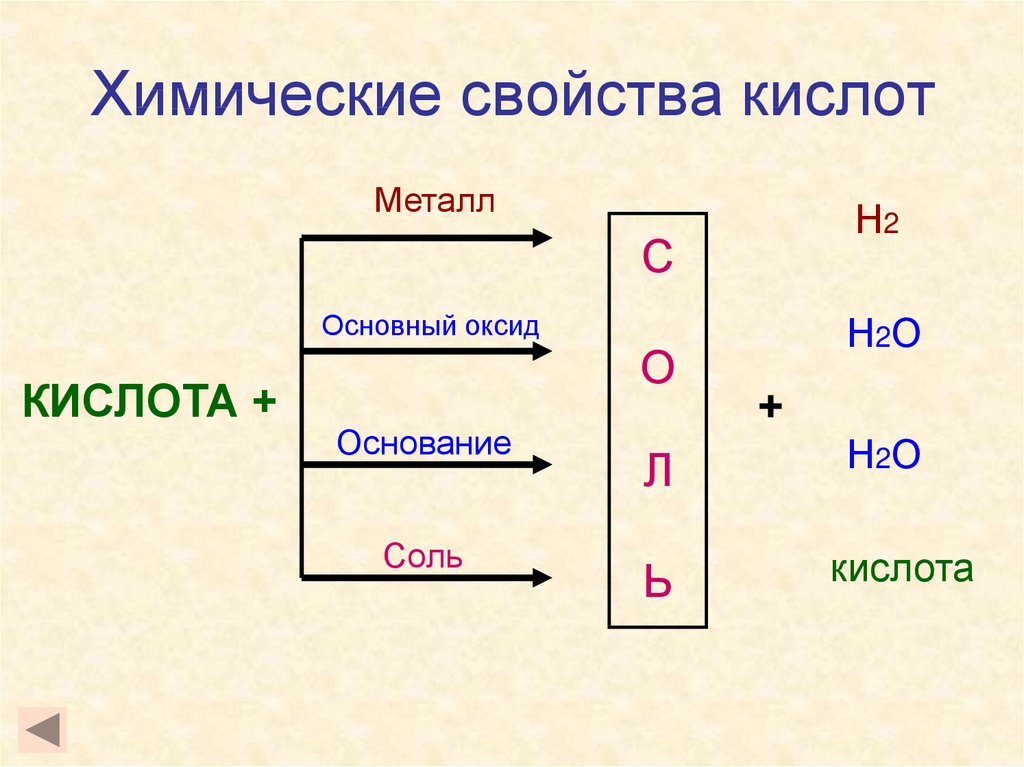
14. Химические свойства кислот
МеталлН2
С
Основный оксид
КИСЛОТА +
О
Основание
Соль
Л
Ь
Н2О
+
Н2О
кислота
15. Химические свойства кислот
• Кислота + металл = соль + водородРяд активности металлов:
Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Активность металлов уменьшается
Опыт 1. Взаимодействие цинка с соляной кислотой
Опыт 2. Взаимодействие металлов с кислотами
16.
Химические свойства кислот• Кислота + основный оксид = соль + вода
Опыт. Взаимодействие оксида меди (II) с
серной кислотой
СuO + H2SO4 = CuSO4 + H2O
17.
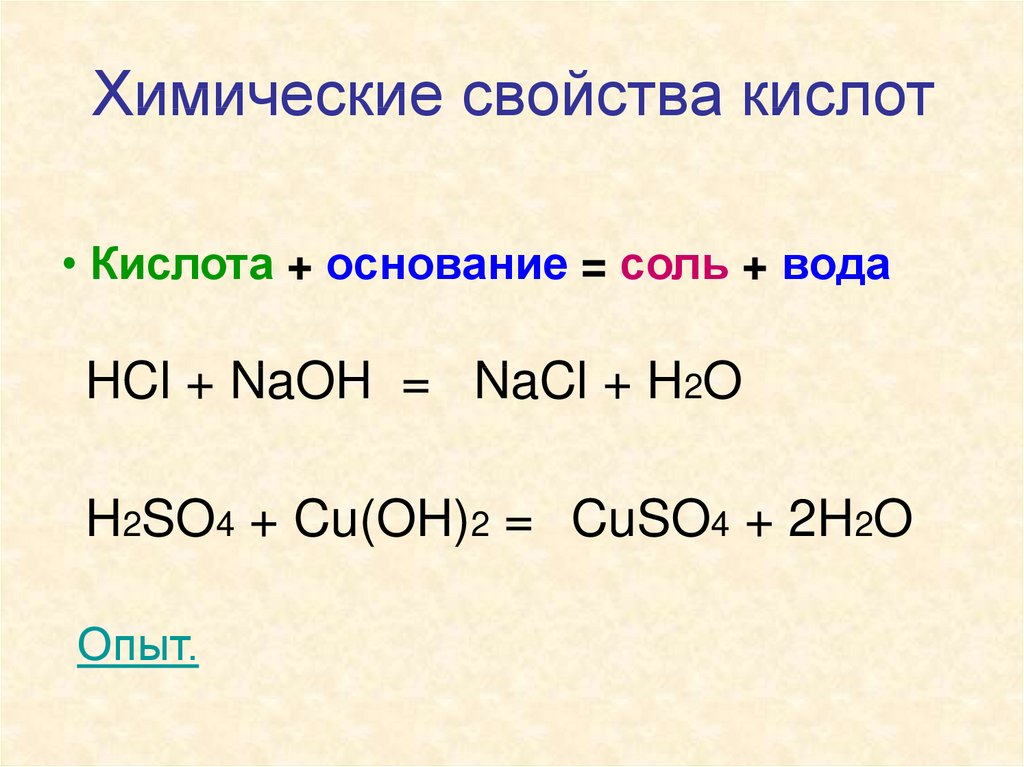
Химические свойства кислот• Кислота + основание = соль + вода
HCl + NaOH = NaCl + H2O
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
Опыт.
18.
Химические свойства кислот• Кислота 1 + соль 1 = соль 2 + Кислота 2
Условия реакции:
1. Если образуется осадок ↓:
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
2. Если выделяется газ:
2 HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2
19. Составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты.
1) SiО22) LiОН
3) Ва (NО3)2
4) НСI
5) К2О
6) К2 SiО3
7) Н NО3
8) Fе(ОН)3
А
К
А
С
Л
И
О
Й












 chemistry
chemistry








