Similar presentations:
Кислоты
1.
Тема урокаКИСЛОТЫ
2.
Цель урока: познакомиться склассификациями и общими
химическими свойствами кислот.
3.
Что нас объединяет?4.
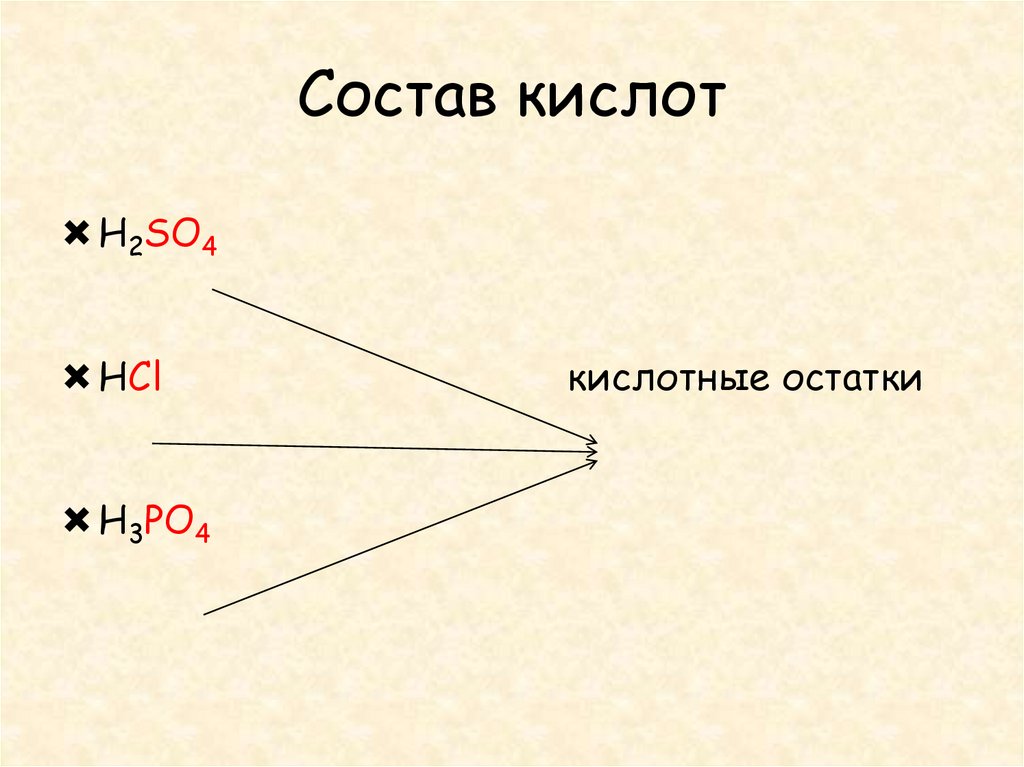
Кислоты – это сложныевещества, молекулы,
которых состоят из атомов
водорода и кислотных
остатков
5. Состав кислот
H2SO4HCl
H3PO4
кислотные остатки
6. Названия распространенных кислот
HCl - хлороводородная (соляная)
HF - фтороводородная (плавиковая)
HBr - бромоводородная
HI - иодоводородная
H2S - сероводородная
H2CO3 - угольная
H2SO4 - серная
• HNO3 - азотная
• H3PO4 - ортофосфорная
7.
Na2CO3Cu(OH)2
FeO
AlCl3
H2SO4
MgBr2
H2SiO3
CO2
NiO
HCl
NaOH
Ca(OH)2
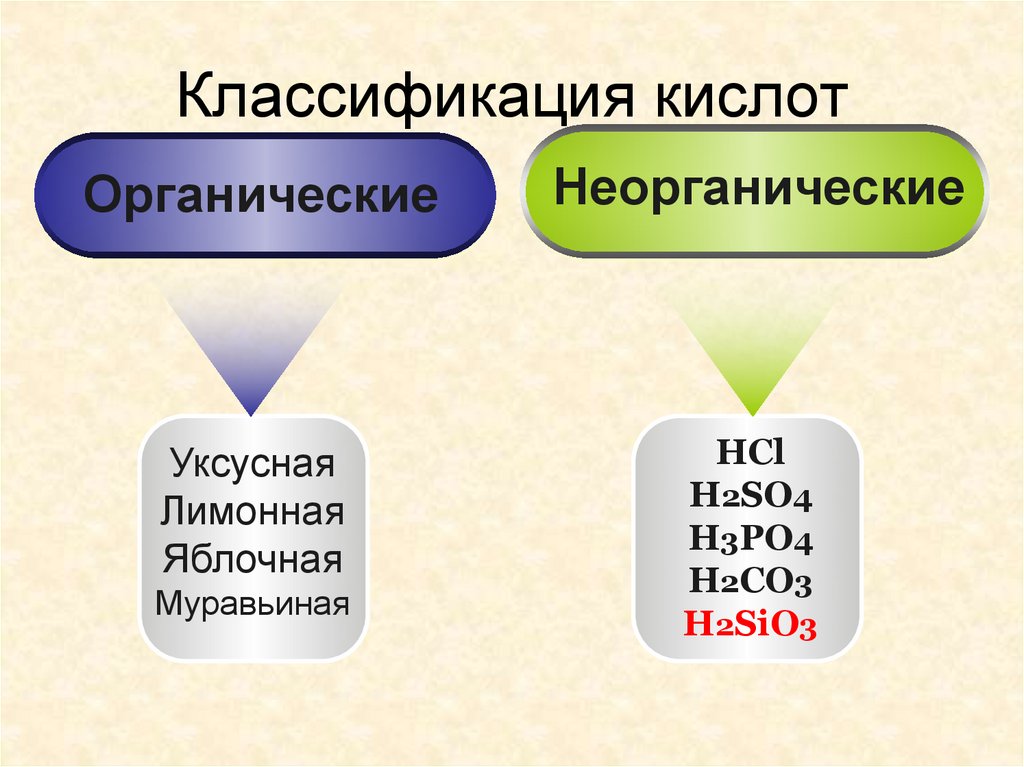
8. Классификация кислот
ОрганическиеНеорганические
Уксусная
Лимонная
Яблочная
HCl
H2SO4
H3PO4
H2CO3
H2SiO3
Муравьиная
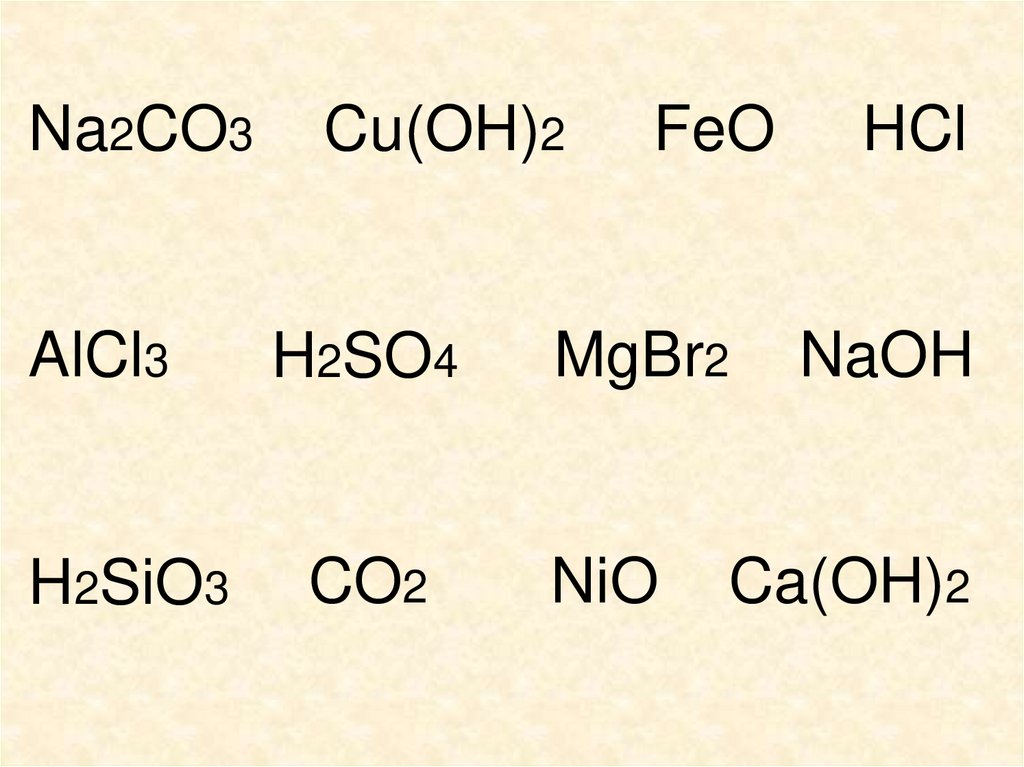
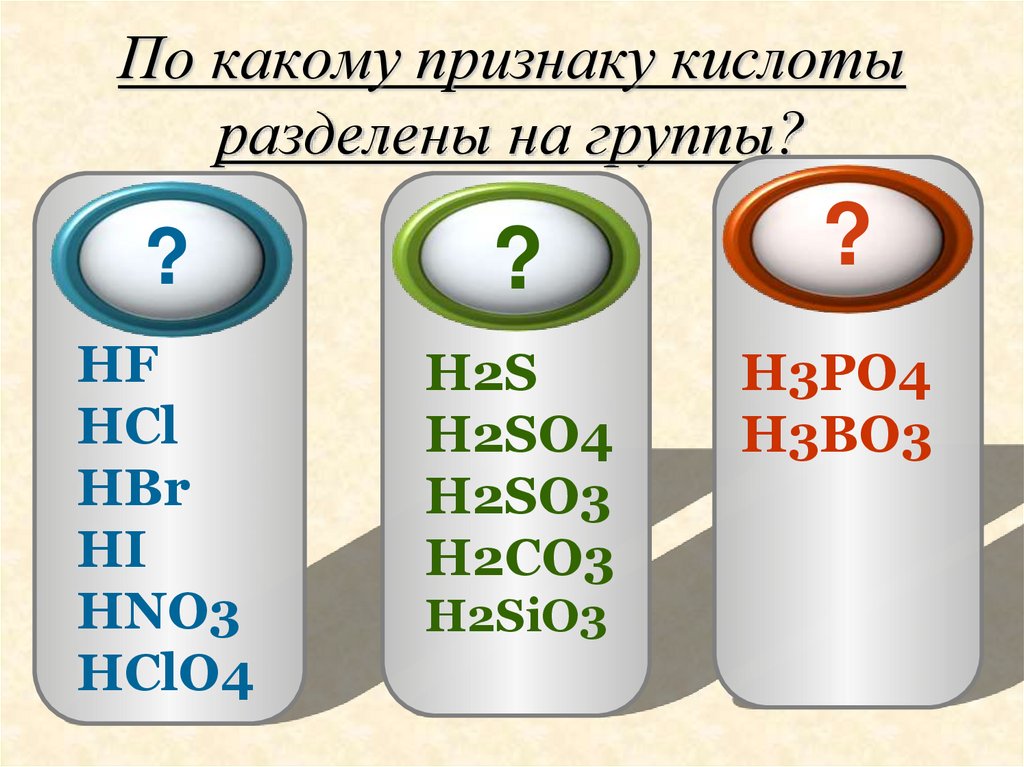
9. По какому признаку кислоты разделены на группы?
ents 1По какому признаку
кислоты разделены на группы?
HCl
HNO3
HF
H2SO4
HBr
H2CO3
H2S
H2SiO3
HI
H3PO4
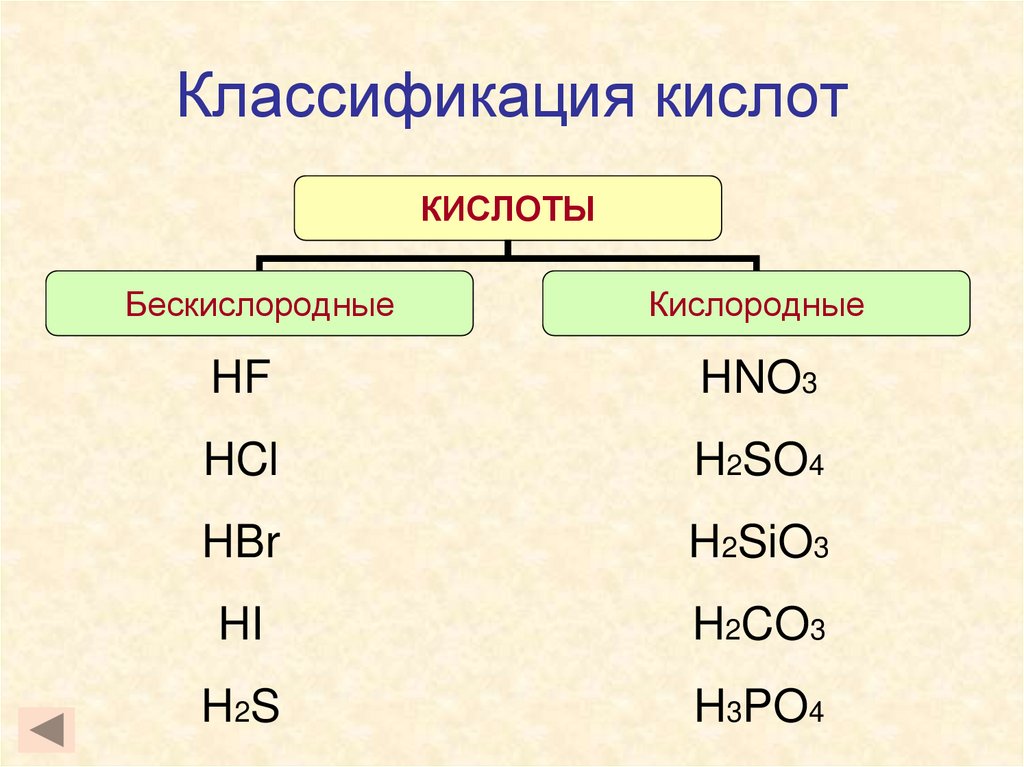
10. Классификация кислот
КИСЛОТЫБескислородные
Кислородные
HF
HNO3
HCl
H2SO4
HBr
H2SiO3
HI
H2CO3
H 2S
H3PO4
11. По какому признаку кислоты разделены на группы?
??
?
HF
HCl
HBr
HI
HNO3
HClO4
H2S
H2SO4
H2SO3
H2CO3
H3PO4
H3BO3
H2SiO3
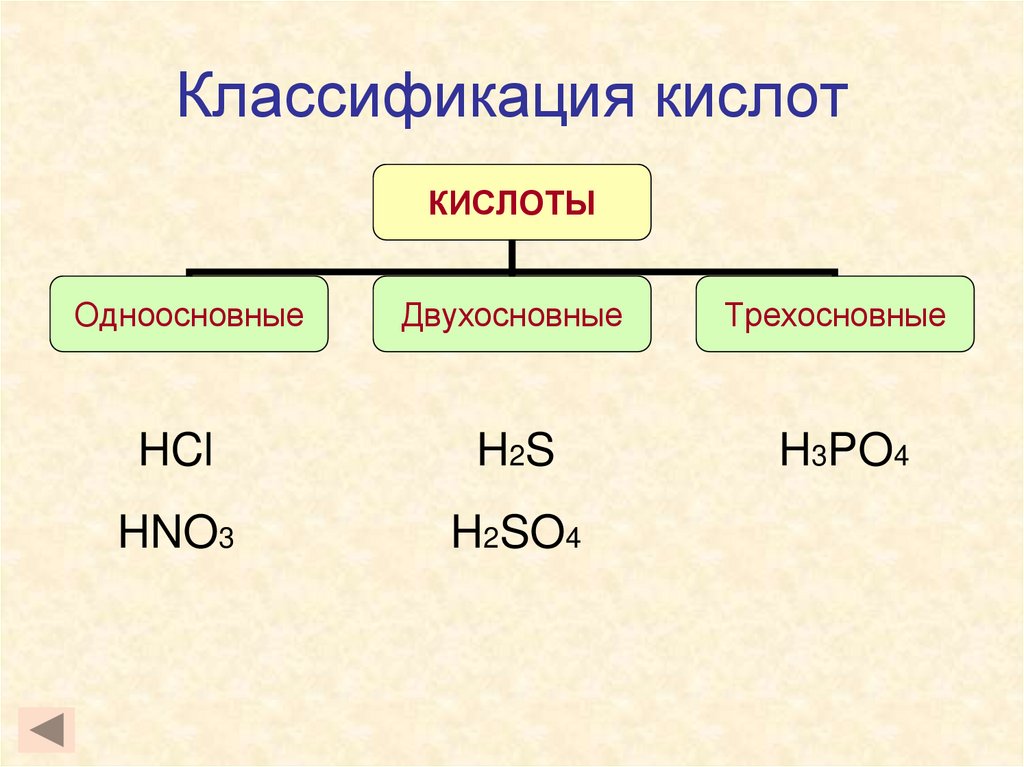
12. Классификация кислот
КИСЛОТЫОдноосновные
Двухосновные
Трехосновные
HCl
H 2S
H3PO4
HNO3
H2SO4
13. Классификация кислот
КИСЛОТЫРастворимые
Нерастворимые
HNO3
H2SO4
H 2S
H2CO3
H2SiO3
14.
15. Выбери:
формулыкислот и назови
их
NaОH
CaCO3
H3PO4
HCl
SO2
H2SO4
формулы двухосновных
кислородосодержащих
кислот
H2SiO3
HCl
NaHCO3
H2S
H2SO4
H2СО3
формулы
одноосновных
бескислородных кислот
HBr
H2S
HF
HClO
HCl
NaH
формулы растворимых и
нерастворимых кислот
H2SO3
H3PO4
HNO3
H2SiO3
H2S
HСl
16. Физические свойства кислот
• По агрегатномусостоянию:
- Газообразные (HCl, H2S)
- Жидкие (HNO3, H2SO4)
- Твердые (H3PO4, H2SiO3)
• Цвет кислот – ?
• Запах – ?
• Вкус – ?
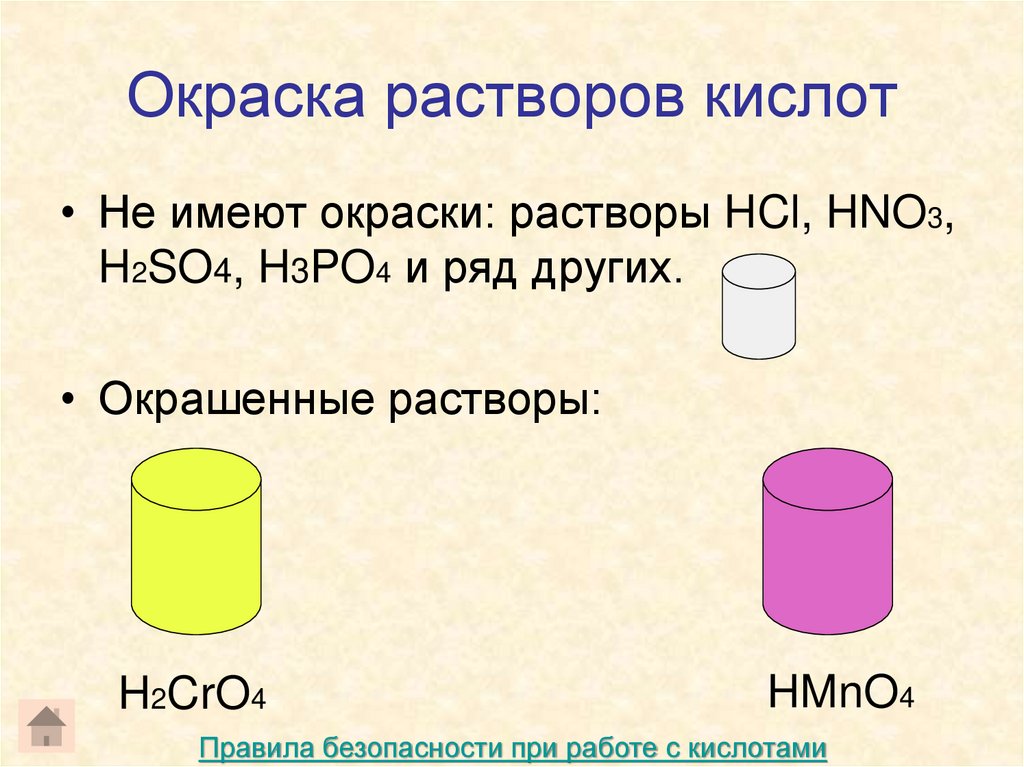
17. Окраска растворов кислот
• Не имеют окраски: растворы HCl, HNO3,H2SO4, H3PO4 и ряд других.
• Окрашенные растворы:
H2CrO4
HMnO4
Правила безопасности при работе с кислотами
18. Серная кислота бесцветная , вязкая жидкость, без запаха, вдвое тяжелее воды, поглощает влагу из воздуха и других газов,
обугливаетдревесину, кожу,
ткани, бумагу.
19.
20. Соляная кислота
Соляная кислота (хлороводородная)одноосновная кислота, «дымящая» на
воздухе, бесцветная едкая жидкость с
острым запахом хлористого водорода.
Соляная кислота содержится
желудочном соке (около 0,3%)
способствует пищеварению и
убивает болезнетворные бактерии.
Соляная кислота — едкое вещество, при попадании на
кожу вызывает сильные ожоги. Особенно опасно
попадание в глаза. При открывании сосудов с соляной
кислотой в обычных условиях образуется туман и пары
хлороводорода, которые раздражают слизистые оболочки
и дыхательные пути.
21.
Угольная кислотаH2CO3
УГОЛЬНАЯ КИСЛОТА - очень слабая
и непрочная кислота.
Образуется при растворении диоксида
углерода в воде, например, в минеральной
воде.
В начало
22. Кремниевая кислота
• H2SiO3• Единственная
нерастворимая
кислота
• Она соответствует кислотному оксиду SiO2
23.
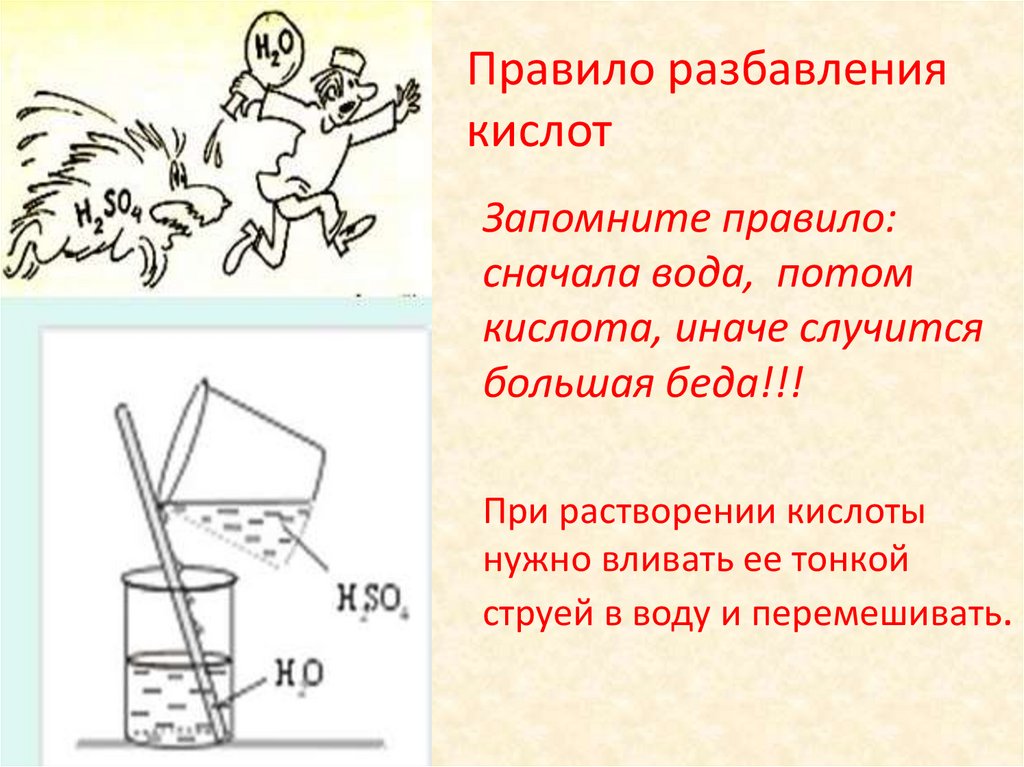
Правило разбавлениякислот
Запомните правило:
сначала вода, потом
кислота, иначе случится
большая беда!!!
При растворении кислоты
нужно вливать ее тонкой
струей в воду и перемешивать.
24.
25.
ЕСЛИ КИСЛОТА ПОПАЛА НАКОЖУ.
Пораженный участок кожи
промывают сильно скользящей
струей холодной воды в течение
10 – 15 мин. После промывки на
обожженное место накладывают
пропитанную водным 2%-м
раствором питьевой соды
марлевую повязку или ватный
тампон. Через 10 мин. повязку
снимают, кожу обмывают,
осторожно удаляют влагу
фильтровальной бумагой или
мягкой тканью и смазывают
глицерином для уменьшения
болевых ощущений
26.
Закрепление!1. Найдите группу формул кислот:
а) NH3
HCl
H2 SO4
б) H2S
HNO3
HBr
в) HCl
KCl
H3PO4
2. Выберите формулу «третьего лишнего» вещества в
каждом ряду:
а) K2O
HCl
H2 SO4
б) HNO3
H2O
H2CO3
в) H2 S
H2 SO4
NaOH
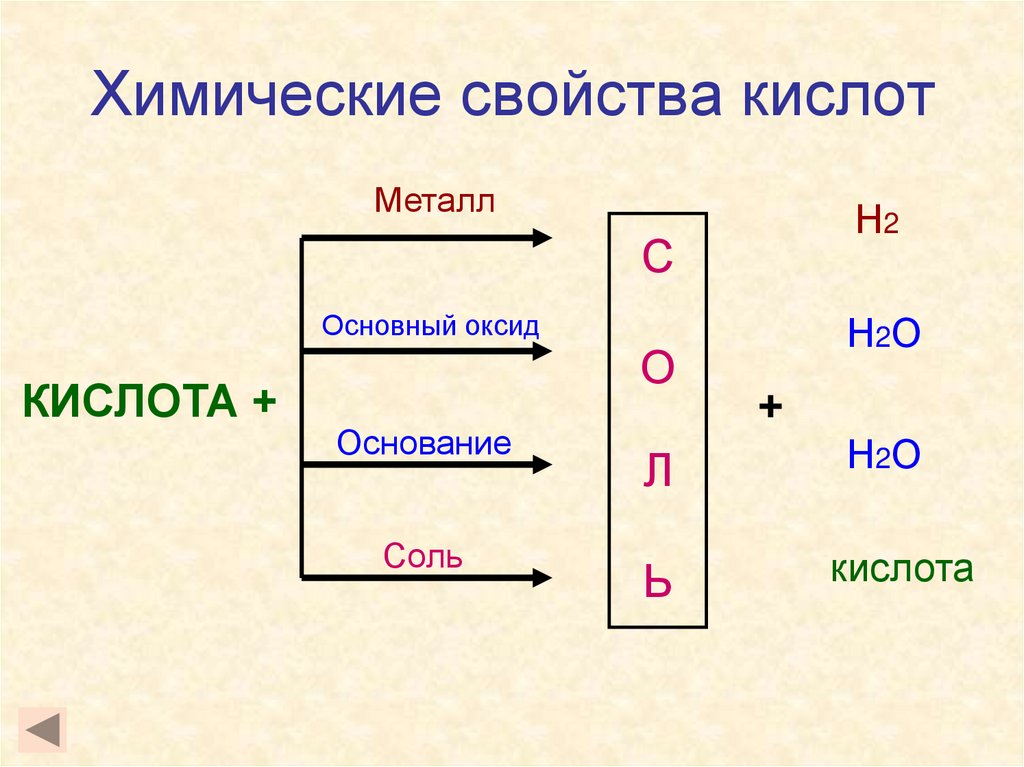
27. Химические свойства кислот
• Действие кислот на индикаторылакмус
метилоранж
Опыт
фенолфталеин
28. Химические свойства кислот
МеталлН2
С
Основный оксид
КИСЛОТА +
О
Основание
Соль
Н2О
+
Л
Н2О
Ь
кислота
29. Химические свойства кислот
• Кислота + металл = соль + водородРяд активности металлов:
Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Активность металлов уменьшается
Опыт 1. Взаимодействие цинка с соляной кислотой
Опыт 2. Взаимодействие металлов с кислотами
30.
Химические свойства кислот• Кислота + основный оксид = соль + вода
Опыт. Взаимодействие оксида меди (II) с
серной кислотой
СuO + H2SO4 = CuSO4 + H2O
31.
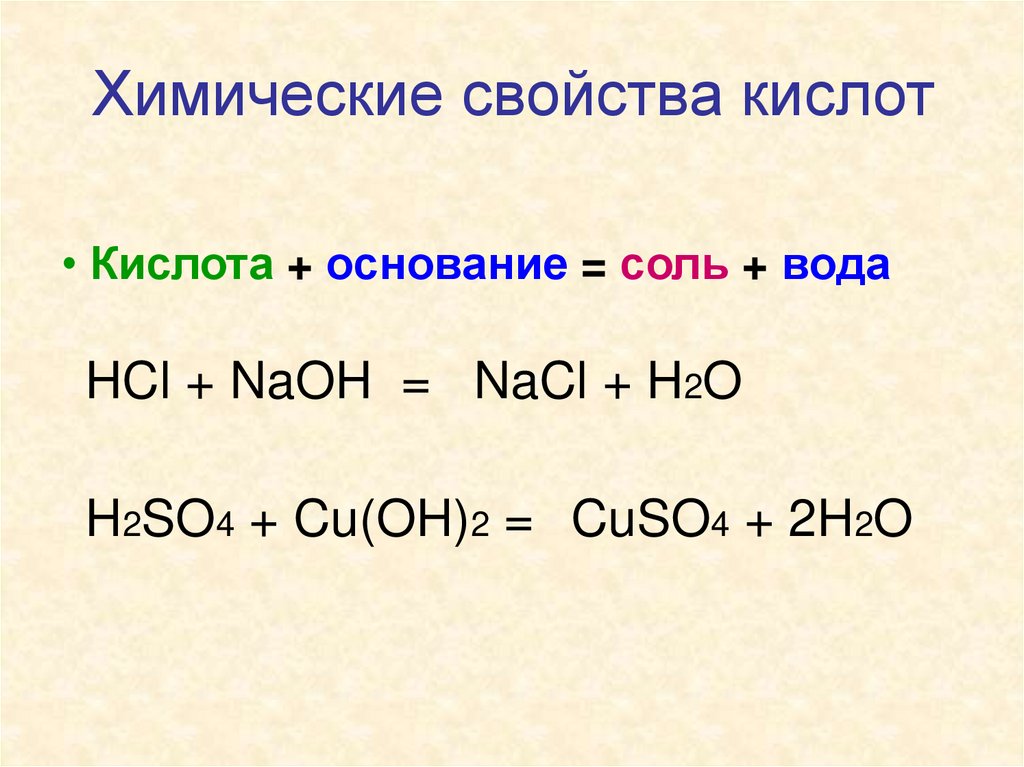
Химические свойства кислот• Кислота + основание = соль + вода
HCl + NaOH = NaCl + H2O
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
32.
Химические свойства кислот• Кислота 1 + соль 1 = соль 2 + Кислота 2
Условия реакции:
1. Если образуется осадок ↓:
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
2. Если выделяется газ:
2 HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2
33. С какими из перечисленных соединений будет взаимодействовать раствор серной кислоты?
NaОHCaO
HCl
SO3
Ba(NO3)2
Составьте уравнения возможных химических
реакций, укажите их типы.
H2SO4 + NaOH = Na2SO4 + H2O (реакция обмена,
нейтрализации)
H2SO4 + CaO = CaSO4 + H2O (реакция обмена)
H2SO4 + Ba(NO3)2 = BaSO4↓ + HNO3 (реакция обмена)
34. Составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты.
1) SiО22) LiОН
3) Ва (NО3)2
4) НСI
5) К2О
6) К2 SiО3
7) Н NО3
8) Fе(ОН)3
А
К
А
С
Л
И
О
Й
35. Продолжите фразу: «Сегодня на уроке мы…»
1. повторили классификацию и физическиесвойства кислот.
2. познакомились с химическими свойствами
кислот.
3. познакомились с использованием электрохимического ряда напряжения металлов и
таблицы растворимости.
4. усовершенствовали умения и навыки
работы с лабораторным оборудованием и
реактивами.
36. Информационные источники:
1.3CD-ROM «Химия.8 класс» (Электронный ресурс) – М.
«Просвещение»,2004.
2.
Габриелян О.С. Настольная книга учителя. Химия. 8 класс. М.: Дрофа,
2003
3.
Маркина И.В. Современный урок химии. Ярославль. Академия развития.
2008
4.
Правила техники безопасности при работе с кислотами. Анимация.
http://files.school-collection.edu.ru/dlrstore/0ab6f5aa-4185-11db-b0de0800200c9a66/ch08_20_05.swf
5. http://www.logosib.ru/him/HCl.jpg
6. http://forexaw.com/TERMs/Metal121313/img73211_41_Himicheskie_svoystva_zolota-rastvoryi.jpg
7. http://festival.1september.ru/

























 chemistry
chemistry








