Similar presentations:
Кислоты. Состав кислот
1. КИСЛОТЫ
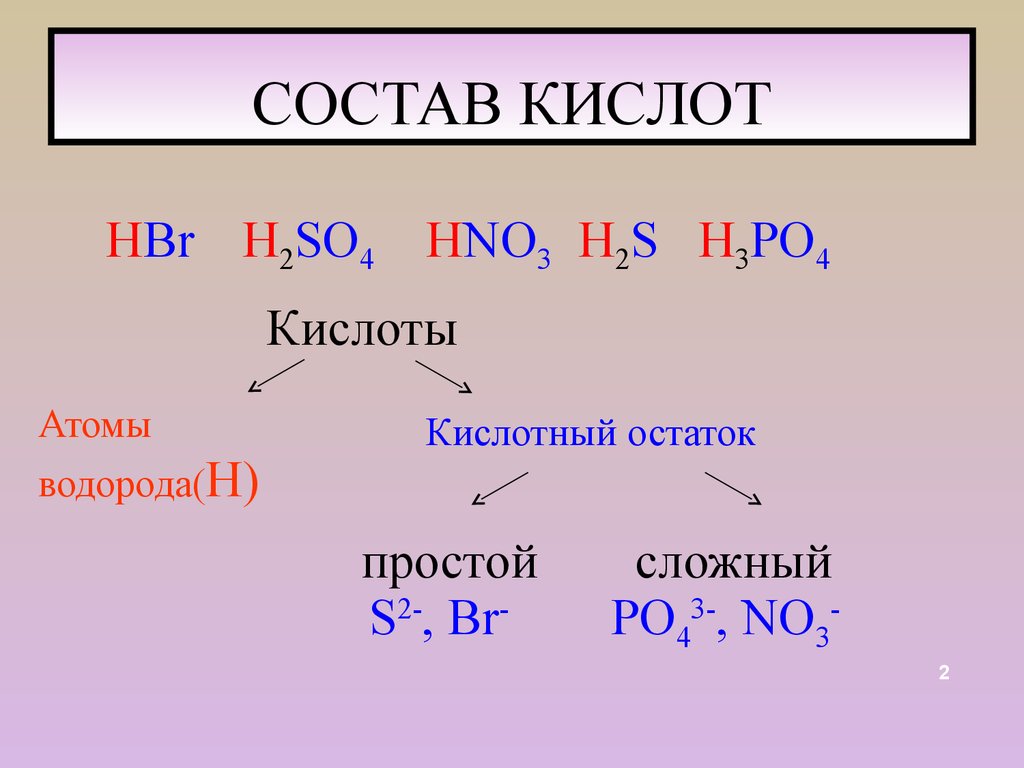
2. СОСТАВ КИСЛОТ
HВr H2SO4HNO3 H2S H3PO4
Кислоты
Атомы
водорода(Н)
Кислотный остаток
простой
S2-, Br-
сложный
PO43-, NO32
3.
Кислоты это сложные вещества,молекулы которых состоят
из атомов водорода и
кислотного остатка.
4. Какие из приведенных формул веществ относятся к кислотам:
NO2H2SO4
H3PO4
Na2SO4
H2SO4
H3PO4
5. Классификация кислот
По содержанию атомов кислорода в кислоте:• Беcкислородные - HCI, НВr, HI
• Кислородсодержащие - НNО3, H2SO4, Н3РO4
По числу атомов водорода:
• Одноосновные – НВr , НNО3
• Двухосновные - H2S, H2SO4
• Многоосновные – Н3PO4
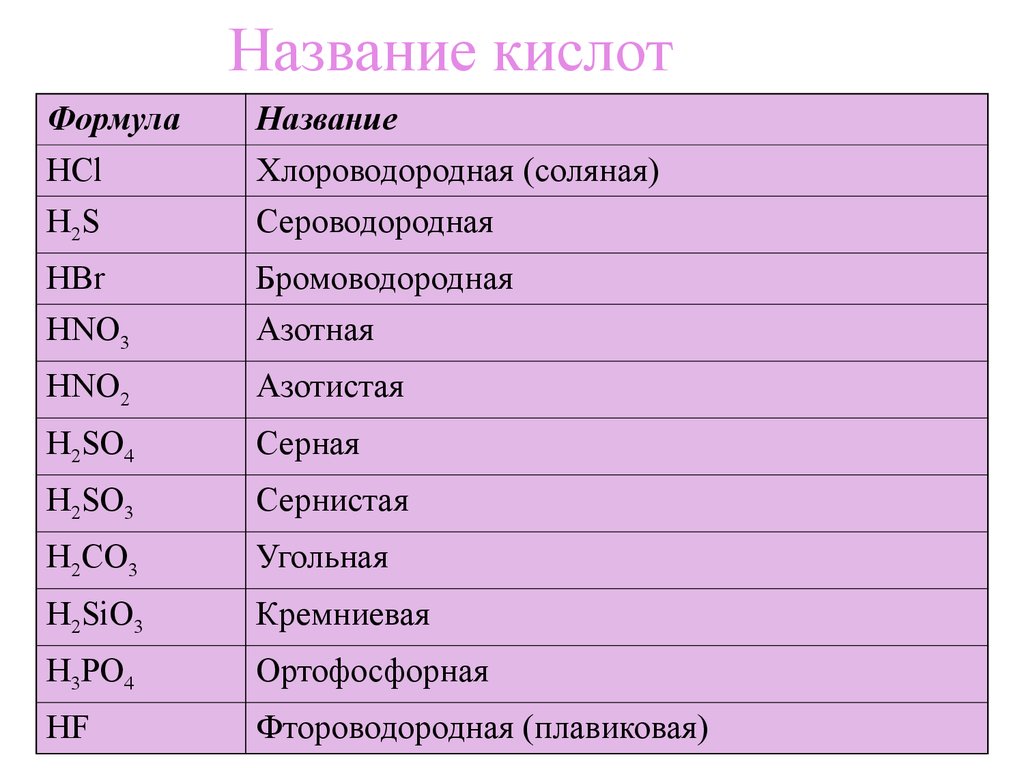
6. Название кислот
ФормулаHCl
H2S
Название
Хлороводородная (соляная)
Сероводородная
HBr
HNO3
Бромоводородная
Азотная
HNO2
Азотистая
H2SO4
Серная
H2SO3
Сернистая
H2CO3
Угольная
H2SiO3
Кремниевая
H3PO4
Ортофосфорная
HF
Фтороводородная (плавиковая)
7. Действие кислот на индикаторы
+ лакмус - красный+ метилоранж - розовый
+ фенолфталеин - цвет не меняется
Вывод: лакмус и метилоранж можно
использовать для определения кислоты
8. Химические свойства кислот-неокислителей
1. Взаимодействие кислот с металлами2HCl + Mg = MgCl2+H2↑
HCl + Hg =
Металлы, которые вытесняют водород
из растворов кислот
Металлы, которые не
вытесняют водород из
растворов кислот
9. С какими из перечисленных металлов реагирует соляная кислота
CaCu
Ag
Zn
Ca + 2HCl = CaCl2 + H2↑
Cu + HCl =
Ag + HCl =
Zn + 2HCl = ZnCl2 + H2↑
10. Химические свойства кислот
2. Взаимодействие кислот с основнымиоксидами
H2SO4+ MgO = MgSO4+H2O
3. Взаимодействие кислот с основаниями –
реакция нейтрализации
H2SO4 + 2NaOH = Na2SO4 + 2H2O
H3PO4 + Fe(OH)3(тв.)= FePO4+3H2O
4. Взаимодействие кислот с солями
H2SO4 + ВаСl2 = ВаSO4↓ + 2HCl
11.
5. Неустойчивые кислотыугольная и сернистая
разлагаются на газ и воду:
•H2CO3 ↔ H2O + CO2↑
•H2SO3 ↔ H2O + SO2↑
12. С какими из перечисленных веществ будет взаимодействовать раствор серной кислоты
CO2ZnO
Fe(OH)2
NaCl
BaCl2
CO2 + H2SO4 =
ZnO + H2SO4 = ZnSO4 + H2O
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
NaCl + H2SO4 =
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
13. Способы получения кислот
бескислородныекислородсодержащие
HCl, HBr, HI, HF, H2S
HNO3, H2SO4 и другие
Прямое взаимодействие
неметаллов с водородом с
растворением в воде
H2 + Cl2 = 2HCl
Кислотный оксид + вода
= кислота
SO3 + H2O = H2SO4
Реакции обмена между солью
и менее летучей кислотой
2NaCl (тв.) + H2SO4 (конц.) = Na2SO4 + 2HCl↑











 chemistry
chemistry








