Similar presentations:
Классы неорганических веществ. Кислоты. Свойства кислот
1.
Классы неорганических веществ.Кислоты.
Свойства кислот.
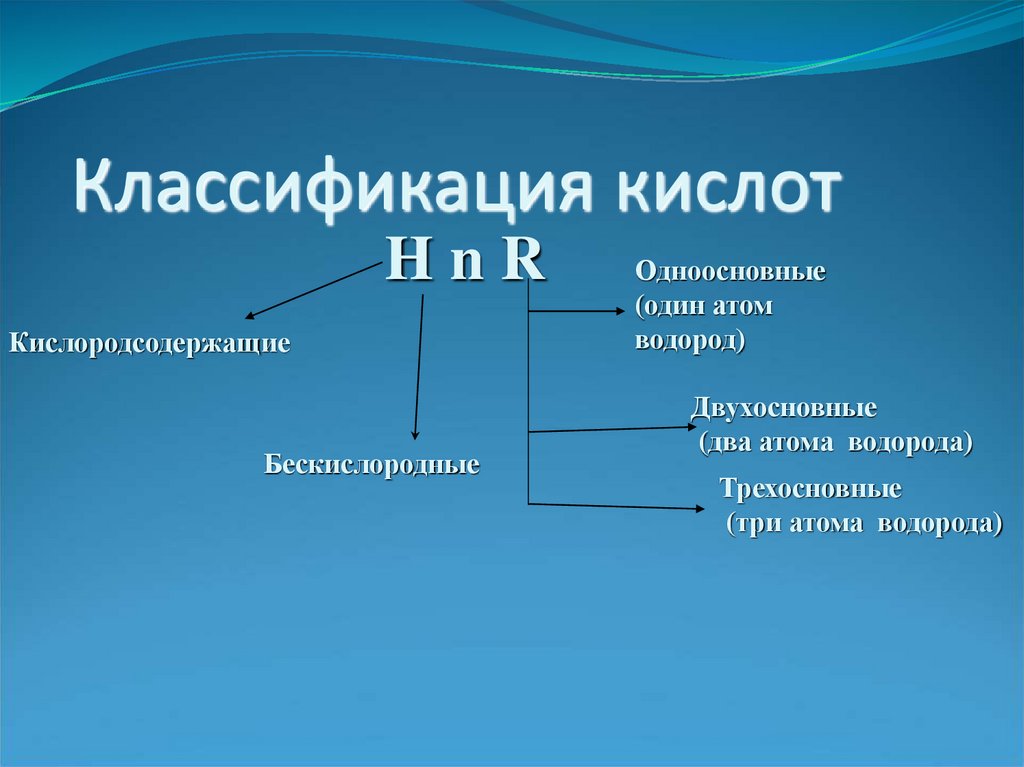
2. Классификация кислот
HnRКислородсодержащие
Бескислородные
Одноосновные
(один атом
водород)
Двухосновные
(два атома водорода)
Трехосновные
(три атома водорода)
3. Сильные кислоты
HCl – соляная кислотаHI – иодоводородная кислота
HBr – бромоводородная кислота
HNO3 – азотная кислота
H2SO4 – серная кислота
4. Слабые кислоты
Сероводородная кислота-H2S
Азотистая кислота
-HNO2
Сернистая кислота
-H2SO 3
Угольная кислота
Кремниевая кислота
-H2CO3
-H2SiO3
SO2
H2O
CO2
H2O
5.
H2S H2SiO3 H3PO4 H2CO3 HCl HNO26.
H2 SH2SiO3 H2CO3 HCl H3PO4 HNO2
7. Кислотные оксиды -> Кислоты
Кислотные оксиды -> Кислоты+5
+5
N 2O 5 -> HNO3
Оксид азота (V)-> Азотная кислота
+6
+6
SO 3 -> H2SO4
+4
+4
SO2 -> H2SO 3
+4
+4
CO2 ->
H2 CO3
+5
+5
P 2O5-> H3PO4
8. Индикаторы – вещества, которые в растворах кислот изменяют свой цвет.
ЛАКМУС в р-ре кислоты – красныйМЕТИЛОРАНЖЕВЫЙ – розовый
ФЕНОЛФТАЛЕИНОВЫЙ –
не изменяется /белый/
9. Химические свойства кислот
1. Взаимодействие с металлами ( стоящими до Н )HR + Me -> MeR + H2
2. Взаимодействие с основными оксидами
HR + MeO -> MeR + H2O
3. Взаимодействие с основаниями
HR + Me(OH)n -> MeR + H2O
4. Взаимодействие с солями ( слабых кислот)
HR + MeR1 -> MeR + HR 1
( если в результате образуется осадок или газ )
10. Na +
2 Na + 2 HCl - > 2 NaCl + H2CaO + H2SO4 -> CaSO4 + H2O
Cu(OH) 2+ H2SO4 -> CuSO4 + 2 H2O
CaCO3 + H2SO4 -> CaSO4+ H 2CO
+ 3
CO2
H2O
11. Закончите уравнения реакций.
Са +2 HNO2 -> Са (NO2) 2+ H2FeO +2 HNO2 -> Fe (NO2 )2+ H 2O
Cu (OH )2+ H 2 SO 4 -> Cu SO 4 +2 H 2 O
SO 2
CaSO3 + H 2 SO 4 -> CaSO4 + H 2 SO 3
H2O
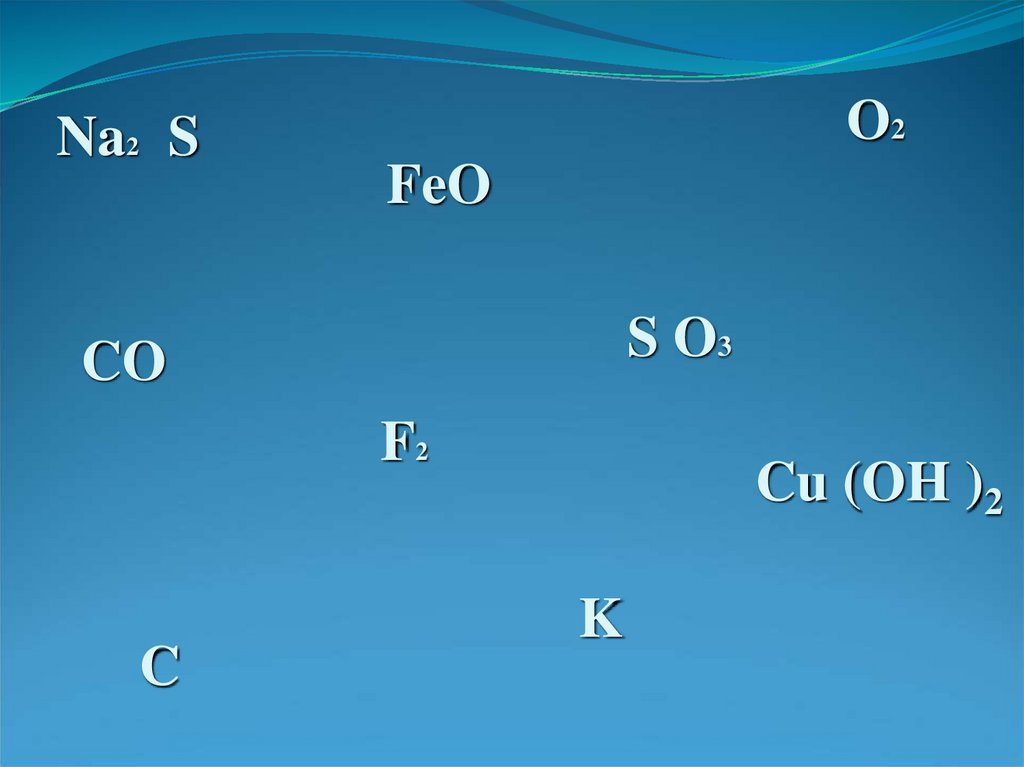
12.
Na2 SO2
FeO
S O3
CO
F2
C
Cu (OH )2
K










 chemistry
chemistry








