Similar presentations:
Кислоты, их классификация и свойства
1.
Кислоты, их классификация и свойства.2.
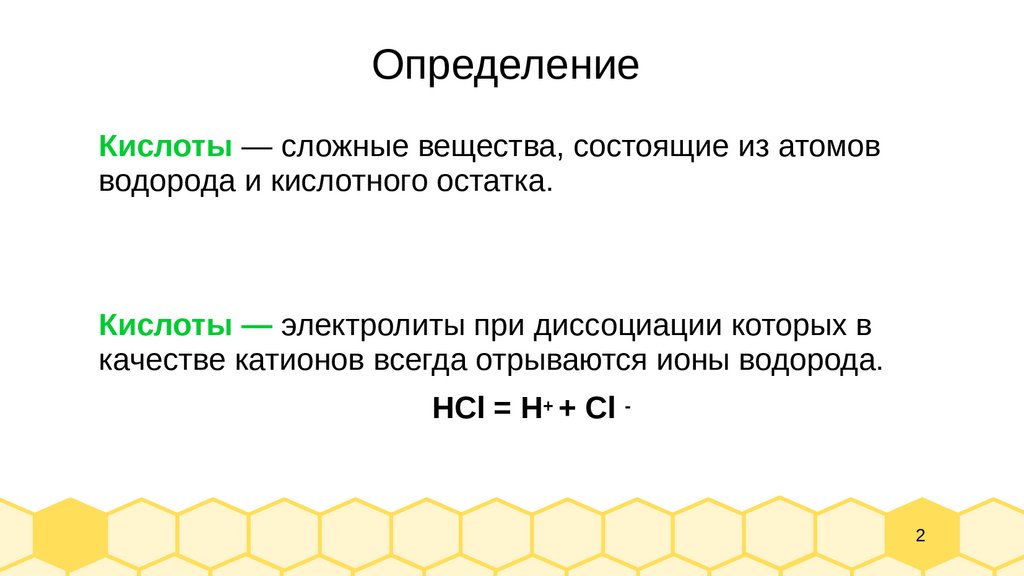
ОпределениеКислоты — сложные вещества, состоящие из атомов
водорода и кислотного остатка.
Кислоты — электролиты при диссоциации которых в
качестве катионов всегда отрываются ионы водорода.
HCl = H+ + Cl -
2
3.
34.
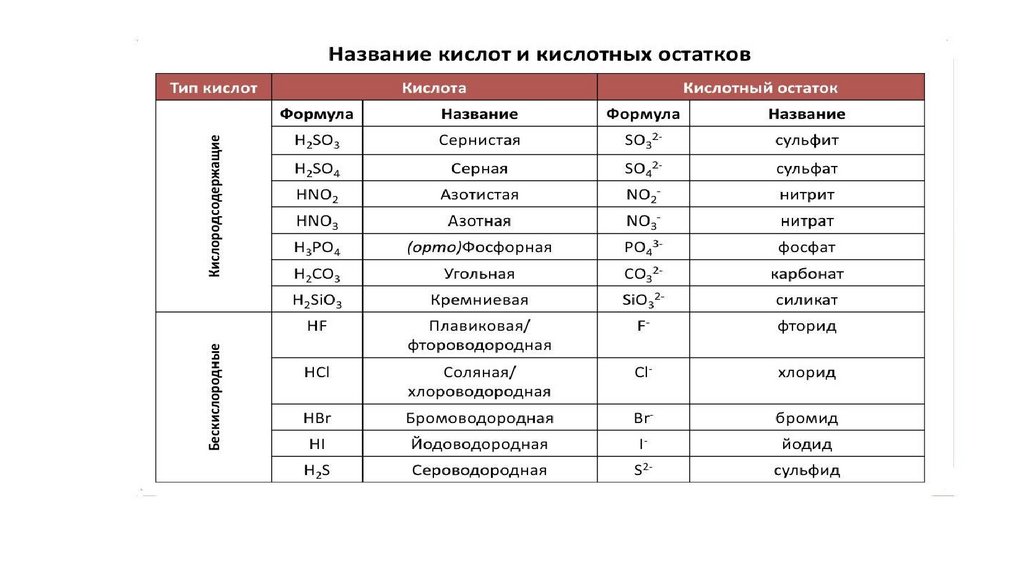
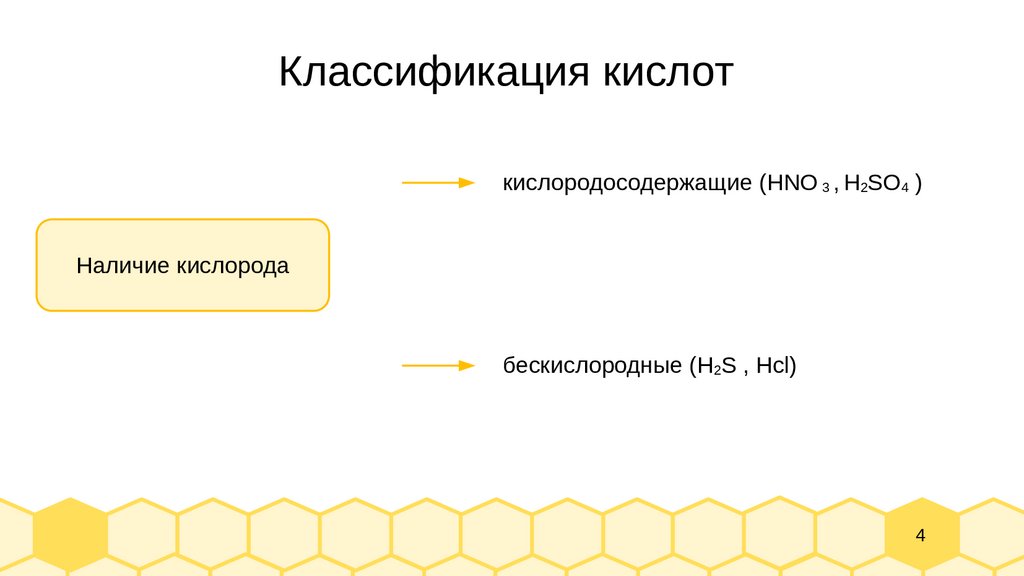
Классификация кислоткислородосодержащие (HNO 3 , H2SO4 )
Наличие кислорода
бескислородные (H2S , Hcl)
4
5.
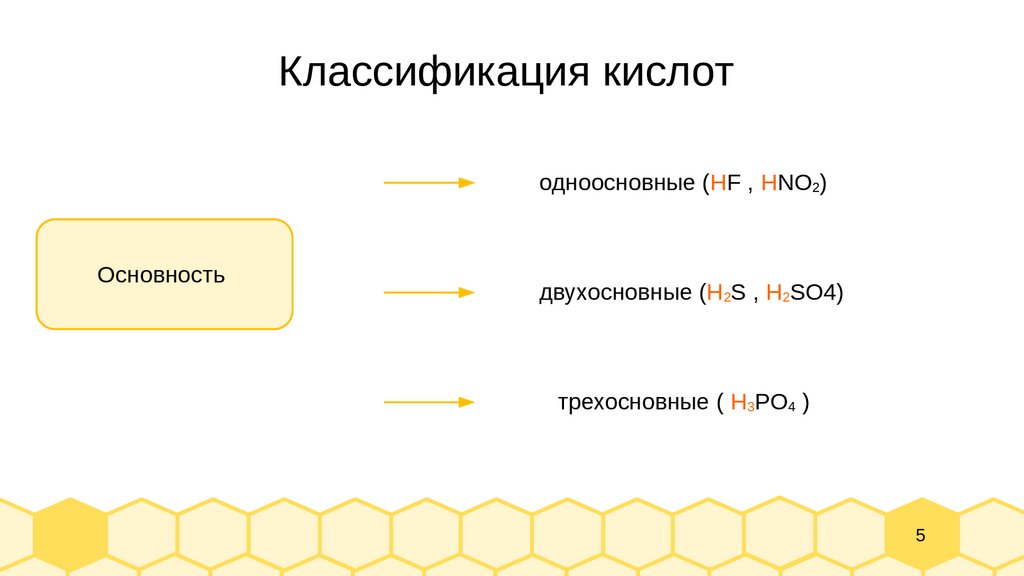
Классификация кислотодноосновные (HF , HNO2)
Основность
двухосновные (H2S , H2SO4)
трехосновные ( H3PO4 )
5
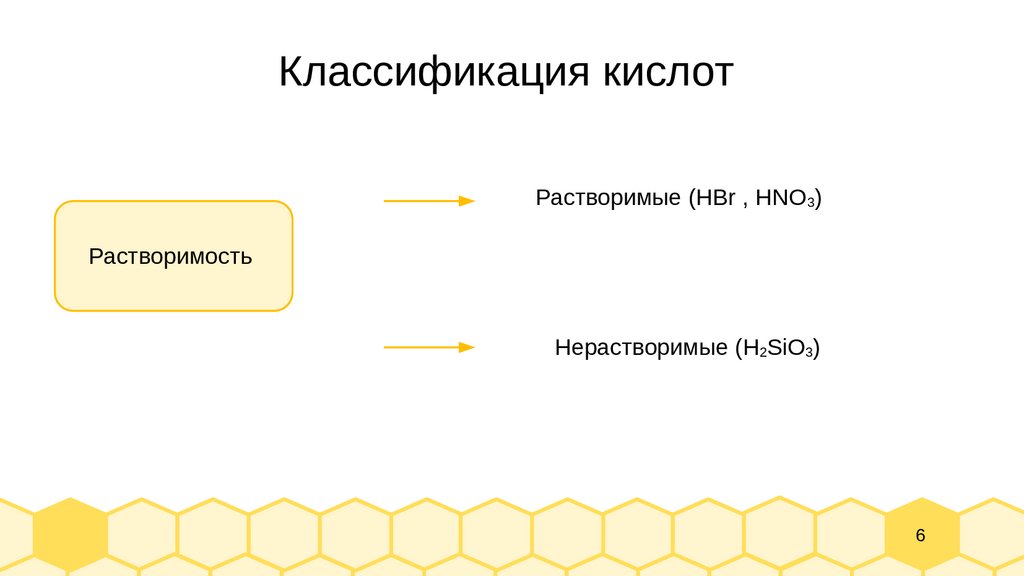
6.
Классификация кислотРастворимые (HBr , HNO3)
Растворимость
Нерастворимые (H2SiO3)
6
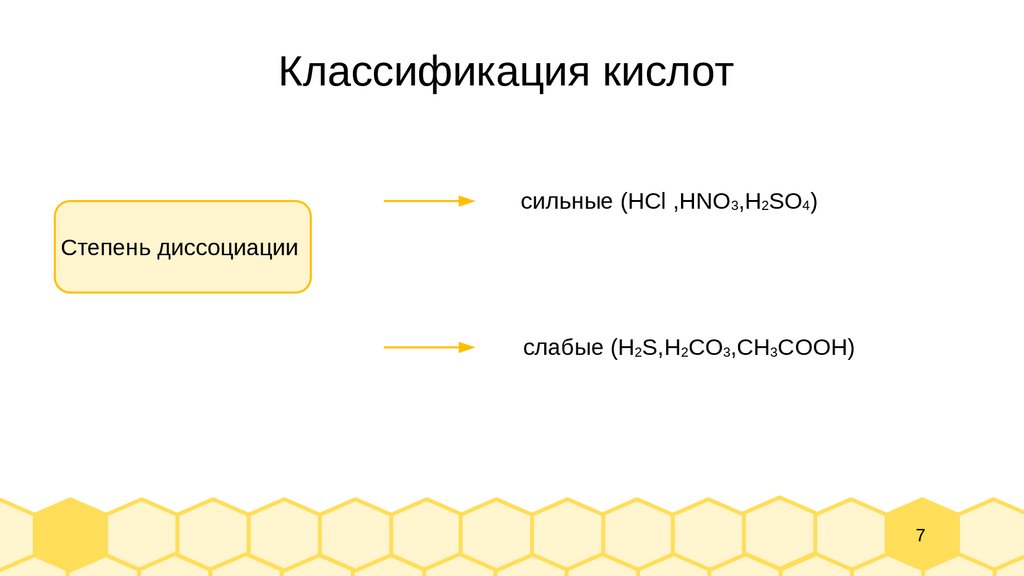
7.
Классификация кислотсильные (HСl ,HNO3,H2SO4)
Степень диссоциации
слабые (H2S,H2CO3,CH3COOH)
7
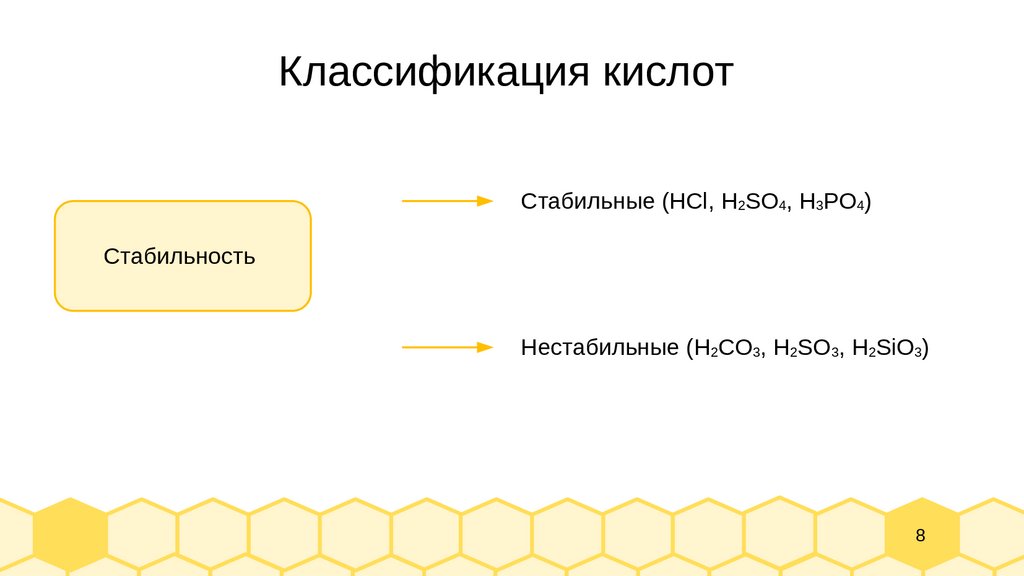
8.
Классификация кислотСтабильные (HСl, H2SO4, H3PO4)
Стабильность
Нестабильные (H2CO3, H2SO3, H2SiO3)
8
9.
Задание1. Выпишите только формулы кислоты и дайте им характеристику по плану.
KHSO4 , CO2 , H2SO4 , Cu(OH)2 , Hcl , HNO2 , Na2SO3 , CH3COONa , Al2O3 , KMnO4
2. Каждой кислородосодержащей кислоте соответствует свой оксид. Для данных
кислот составьте формулы соответствующих оксидов.
H2SO3 , H2CO3, HNO3, H3PO4, HNO2
9
10.
1011.
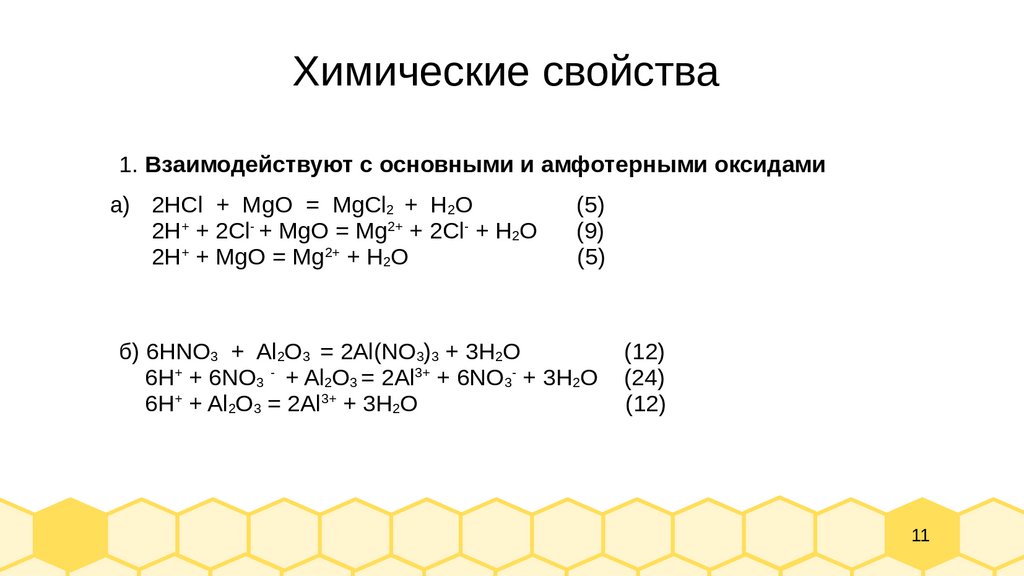
Химические свойства1. Взаимодействуют с основными и амфотерными оксидами
а) 2HCl + MgO = MgCl2 + H2O
2H+ + 2Cl- + MgO = Mg2+ + 2Cl- + H2O
2H+ + MgO = Mg2+ + H2O
(5)
(9)
(5)
б) 6HNO3 + Al2O3 = 2Al(NO3)3 + 3H2O
6H+ + 6NO3 - + Al2O3 = 2Al3+ + 6NO3- + 3H2O
6H+ + Al2O3 = 2Al3+ + 3H2O
(12)
(24)
(12)
11
12.
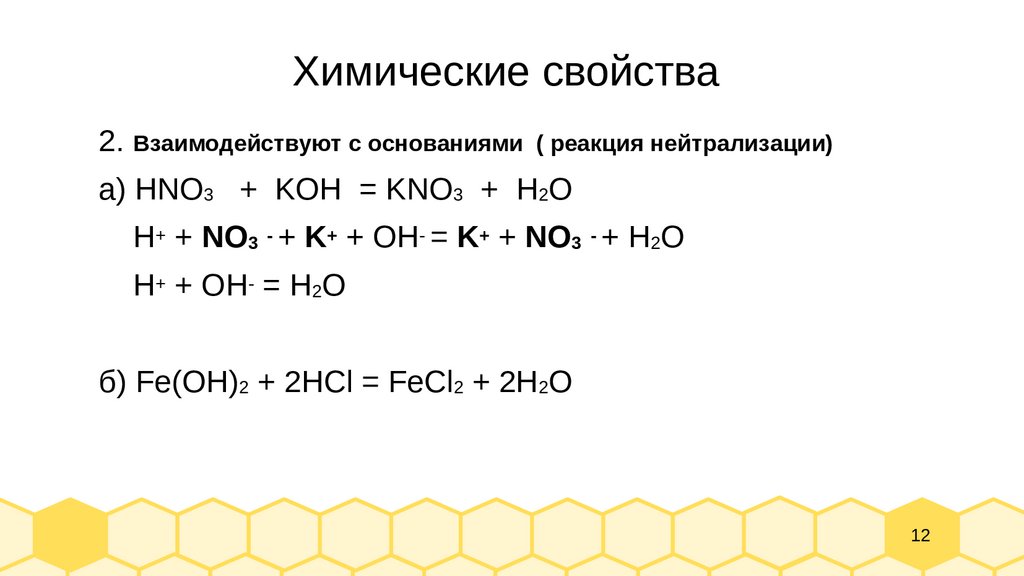
Химические свойства2. Взаимодействуют с основаниями
( реакция нейтрализации)
а) HNO3 + KOH = KNO3 + H2O
H+ + NO3 - + K+ + OH- = K+ + NO3 - + H2O
H+ + OH- = H2O
б) Fe(OH)2 + 2HCl = FeCl2 + 2H2O
12
13.
Химические свойства3. Взаимодействуют с солями с образованием осадка или газа
а) K2SiO3 + 2HNO3 = 2KNO3 + H2SiO3
2K+ + SiO3 2- + 2H + + 2NO3 - = 2K+ + 2NO3 - + H2SiO3
SiO32- + 2H+ = H2SiO3
б) 2HBr + Na2CO3 = 2NaBr + CO2 + H2O
2H+ + 2Br- + 2Na+ + CO3 2- = 2Na+ + 2Br- + CO2 + H2O
2H+ + CO32- = CO2 + H2O
13
14.
Химические свойства4. а) Взаимодействие с металлами, расположенными в ряду напряжений
до
водорода
2HCl + Zn = 2ZnCl2 + H2
б) Разбавленная серная кислота взаимодействует ТОЛЬКО с металлами,
стоящими в ряду напряжений до водорода.
H2SO4 (разб.) + Fe = FeSO4 + H2
14
15.
Химические свойства15
16.
Получение1. Взаимодействие кислотных оксидов с водой
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
2. Взаимодействие простых веществ
H2 + Cl2 = 2HCl
H2 + S = H2S
3. слабые кислородосодержащие кислоты выделяются из их солей при действии более
сильных кислот
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl
Ca3(PO4)2 + 3H2SO4 = 2 H3PO4 + 3 CaSO4
16






 chemistry
chemistry








