Similar presentations:
Кислоты: классификация и свойства в свете ТЭД
1.
«Кислоты: классификация исвойства в свете ТЭД»
8 класс
Учитель химии
Стреха Дарья Сергеевна
МКОУ
«Комсомольская ООШ»,
п. Комсомольский, 2017г.
2.
3.
Лист учета знаний учащегося по теме:«Кислоты, их классификация и свойства в свете ТЭД»
№п/п
Знания, умения
I
Я буду знать:
Определение
понятий
кислоты
Признаки
классификации кислот
Химические
свойства
кислот с точки зрения
ТЭД
II
1
Я буду уметь
Давать
характеристику
кислоте,
используя
различные
признаки
классификации
Пользоваться
таблицей
растворимости
Составлять
уравнения
реакций ионного обмена
Проводить реакции ионного
обмена, соблюдая правила
безопасного обращения с
реактивами
2
3
4
Самооценка
Знаю хорошо
Частично
Не знаю
Оценка
4.
Классификация кислот5.
Ключ для проверкиПризнак
классификации
Название и формула кислоты
серная кислота
соляная кислота
Фосфорная кислота
Наличие кислорода в кислородсодержащая
кислотном остатке
бескислородная
кислородсодержащая
Растворимость в воде растворимая
растворимая
растворимая
Основность
двухосновная
одноосновная
трехосновная
Летучесть
нелетучая
нелетучая
нелетучая
Степень
электролитической
диссоциации
сильная
сильная
средней силы
6.
Состав кислот7.
А) Вставьте пропущенное слово:Кислота, когда здорова,
Угостить друзей готова
Тем, что ей дала природа,
Катионом ……...
8.
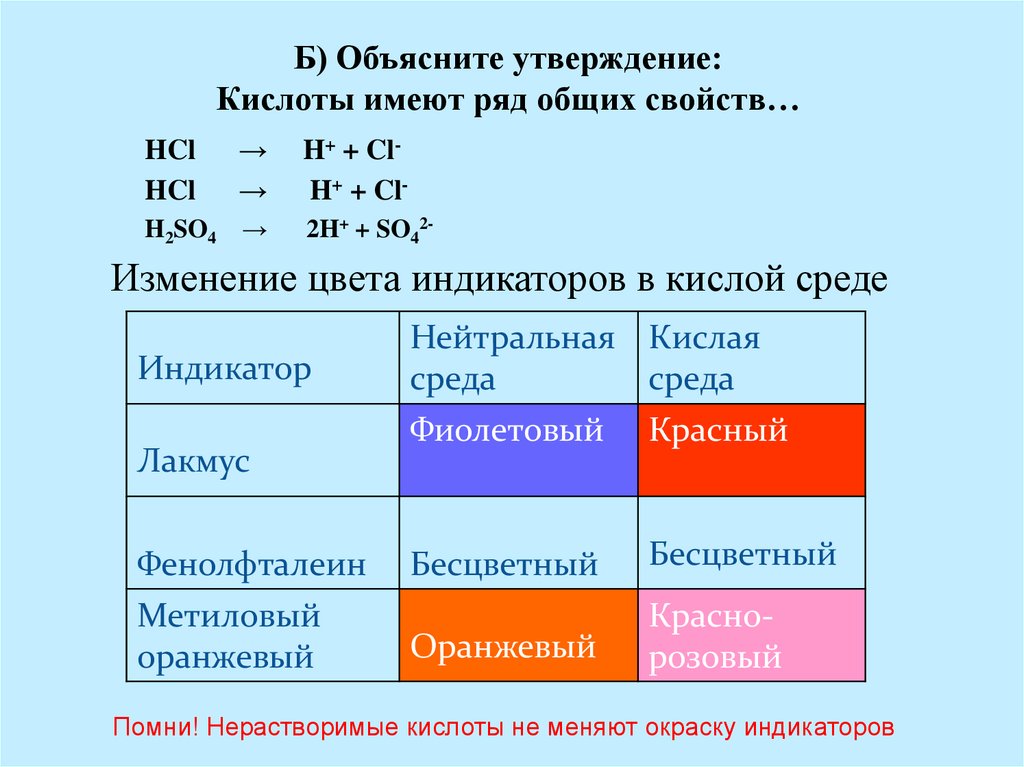
Б) Объясните утверждение:Кислоты имеют ряд общих свойств…
HCl
HCl
→
→
H+ + ClH+ + Cl-
H2SO4
→
2H+ + SO42-
Изменение цвета индикаторов в кислой среде
Индикатор
Лакмус
Фенолфталеин
Метиловый
оранжевый
Нейтральная Кислая
среда
среда
Фиолетовый
Красный
Бесцветный
Бесцветный
Оранжевый
Краснорозовый
Помни! Нерастворимые кислоты не меняют окраску индикаторов
9.
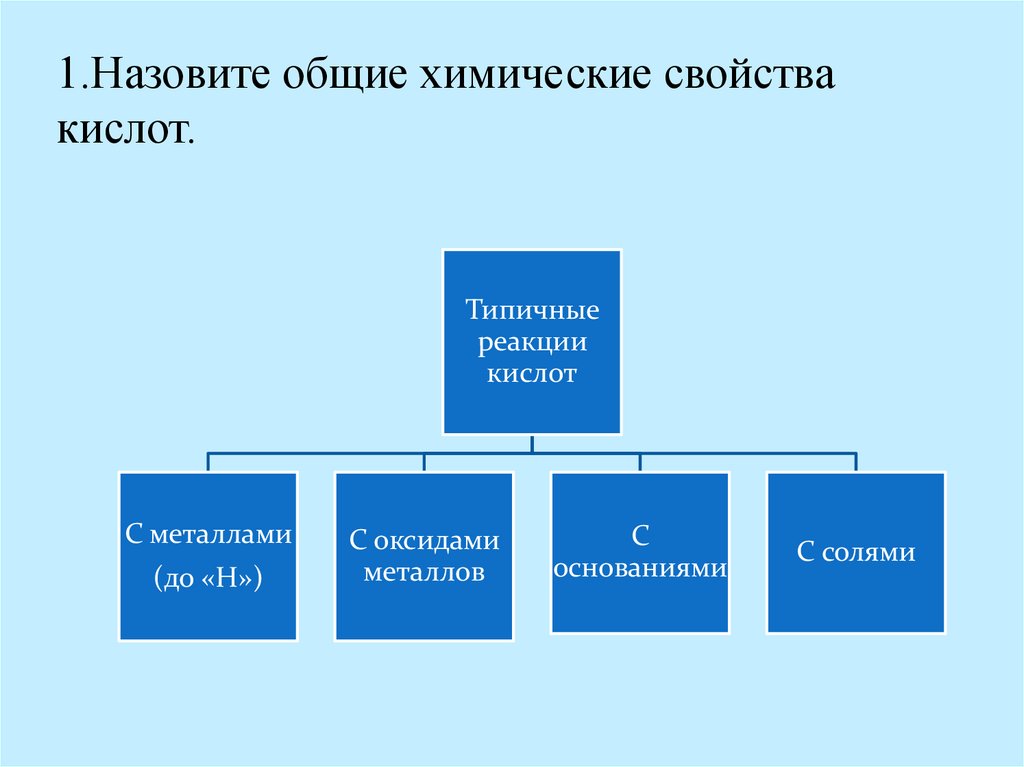
Общие химические свойства кислот10.
1.Назовите общие химические свойствакислот.
Типичные
реакции
кислот
С металлами
(до «Н»)
С оксидами
металлов
С
основаниями
С солями
11.
2.Назовите условия, при которыхвозможны реакции представленные в
схеме
12.
Условия протекания химических реакций длякислот
1. М находиться в ряду напряжений металлов до
водорода;
2. В результате реакции должна получиться
растворимая соль;
3. В реакцию вступает растворимая кислота;
4. Концентрированный раствор серной и раствор
азотной кислоты любой конценцентрации
взаимодействует с М иначе.
13. Проверь себя Выберите группу веществ, в состав которой входят только кислоты HCl, SO3, NaOH,CuCl2 HNO3, H2S, HCl, H3PO4 K2O,
H2SO4, H2S, KOHAgNO3, CO2, CuSO4, HCl
14. Проверь себя Выберите группу веществ, в состав которой входят только двухосновные кислоты HNO3, H2S, HCl, H3PO4 H3PO4, H2SO4,
H2S, HClH2S, H2SO4, H2SiO3, H2CO3
HNO3, H2CO3, H2SO4, HF
15.
Проверь себяВыберите группу веществ, в состав которой
входят только кислородсодержащие кислоты
HNO3, H2S, HCl, H2CO3
HCl, H2SO4, H2SiO3, H2SO3
H2S, HNO3, H2SO3, H3PO4
HNO3, H2SO4, H3PO4, HNO2
16. Проверь себя В кислой среде синий лакмус становится: фиолетовым красным малиновым не изменяет окраску
17.
Инструкционная картаЛабораторная работа
По теме: «Химические свойства кислот»
Цель: проделать реакции, характерные для кислот на примере серной кислоты, сделать
вывод о химических свойствах кислот, закрепить навыки безопасного обращения с
реактивами.
Ход работы
Опыт 1. Качественная реакция на катион водорода в кислоте
1.Раствор соляной кислоты налейте в чистую пробирку.
2.Прилейте к кислоте несколько капель индикатора метилоранжа.
Признак реакции…..
Вывод:
Растворимые кислоты действуют на индикатор ( индикатор изменяет окраску).
Опыт 2. Взаимодействие кислот с металлами
1.В пробирке № 1 находятся гранулы цинка, в пробирке №2 находятся кусочки медной
проволоки
2.Налейте в пробирки №1 и №2 два миллилитра раствора соляной кислоты.
Признак реакции…….
Напишите молекулярное уравнение реакции
Zn + НСl =
Вывод: Кислоты взаимодействуют с металлами, стоящими в электрохимическом
ряду напряжений металлов до __________ (Реакция замещения)
18.
Опыт 3. Взаимодействие кислоты с оксидом металлаЗапишите уравнение реакции между веществами в молекулярном виде
Вывод:
Кислоты взаимодействуют с оксидами металлов с образованием соли и воды.
(Реакция обмена)
Опыт 4. Взаимодействие кислот с основаниями
1.В пробирке № 3 находиться гидроксид калия, добавьте к нему несколько капель
фенолфталеина, а затем соляную кислоту.
Признак реакции…….
Запишите уравнение реакции в молекулярном и ионном видах.
Вывод:
Кислоты взаимодействуют с основаниями с образованием соли и воды. (Реакция
обмена, нейтрализации).
Опыт 5. Взаимодействие кислот с солями
1.В пустую пробирку налейте 1 мл раствора соляной кислоты.
2.Добавьте 2-3 капли раствора нитрата серебра
Признак реакции …….
Запишите уравнение реакции в молекулярном виде и ионном видах
Вывод: Кислоты взаимодействуют с солями с образованием новой кислоты и новой
соли, при условии, что образуется газ или осадок. (Реакция обмена)
19.
Запишите в тетрадь формулы веществ, скоторыми взаимодействует серная кислота
Ключ ответа: Al, CaO, NaOH, BaCl2, лакмус.
Критерии оценки: «5»-5правильных ответа;
«4»-4правильных ответа; «3»-3 правильных
ответа; «2»-1-2 правильных ответа
20.
Домашнее задание§ 39, рабочая тетрадь стр.142
таблицы)
№1 (закончить заполнение
Напишите уравнения реакций серной кислоты с веществами,
которые остались (игра «Гадание на химическом цветке») в
молекулярном и ионном виде.
Дополнительно:
Используя
различные
источники
информации подготовить сообщение или презентацию по
теме «Применение кислот».
21.
22. Используемая литература:
1. О.С. Габриелян. Химия 8 класс: учеб. для общеобразоват. Учреждений /О.С. Габриелян. – 2-е изд., стереотип. – М. : Дрофа, 2013. – 286, с. : ил.
2. О.С. Габриелян. Химия. 8 класс. Настольная книга учителя.
Методическое пособие / О.С. Габриелян, Т.В. Смирнова, С.А. Сладков – М. :
Дрофа, 2015. – 400 с. : ил.
3. О.С. Габриелян. Химия в тестах, задачах, упражнениях. 8 класс / О.С.
Габриелян, Т.В. Смирнова, С.А. Сладков – 2-е изд. стереотип – М. : Дрофа,
2016. – 221 с. : ил.
4. Интернет-ресурсы
Свободная энциклопедия Википедия, статья "Кислоты"
https://ru.wikipedia.org/wiki/Кислоты
http://experiment.edu.ru/
http://www.korkitv.tv/img/foto_profile/Mystique1986.jpg
http://900igr.net/datas/khimija/Kislota-1/0004-004-Razbavlenie-sernoj-kisloty.jpg
http://en.academic.ru/pictures/enwiki/72/Hydrogen-chloride-3D-vdW-labelled.png
http://chimia24.ucoz.ru/skrinshot/H2SO4sbumagoy.jpg




















 chemistry
chemistry








