Similar presentations:
Кислоты. 8 класс
1.
кислоты8 класс
Учитель химии
Широкова Ирина Геннадьевна
ГБОУ СОШ № 644
Санкт - Петербург
2.
Растворы всех кислот навкус кислые.
Но ни один химик не будет
распознавать кислоты на
вкус.
Как же химики судят о том, является ли данное
вещество кислотой?
3. 1)Что такое индикаторы? 2)Какие индикаторы вы знаете?
3) Как индикаторы меняют цвет вщелочной среде?
4. Изменение цвета индикаторов в щелочной среде
ИндикаторЛакмус
Нейтральная Щелочная
среда
среда
Фиолетовый Синий
Фенолфталеин Бесцветный
Метиловый
Оранжевый
оранжевый
Малиновый
Желтый
5. Изменение цвета индикаторов в кислой среде
ИндикаторЛакмус
Нейтральная Кислая
среда
среда
Фиолетовый Красный
Фенолфталеин Бесцветный
Бесцветный
Метиловый
оранжевый
Краснорозовый
Оранжевый
Помни! Нерастворимые кислоты не меняют окраску
индикаторов.
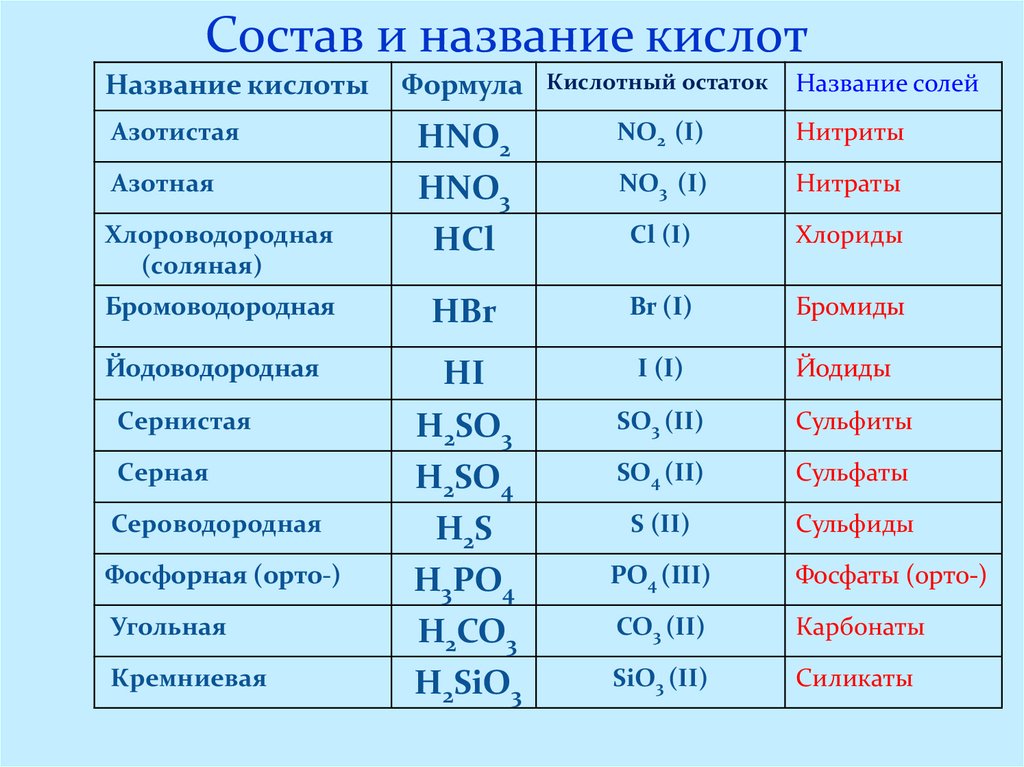
6. Состав и название кислот
Название кислотыФормула
Кислотный остаток
Азотистая
HNO2
NO2 (I)
Нитриты
Азотная
HNO3
HCl
NO3 (I)
Нитраты
Cl (I)
Хлориды
Бромоводородная
НBr
Br (I)
Бромиды
Йодоводородная
НI
I (I)
Йодиды
Сернистая
H2SO3
SO3 (II)
Сульфиты
Серная
H2SO4
H2S
H3PO4
SO4 (II)
Сульфаты
S (II)
Сульфиды
Хлороводородная
(соляная)
Сероводородная
Фосфорная (орто-)
Угольная
Кремниевая
H2CO3
H2SiO3
Название солей
PO4 (III)
Фосфаты (орто-)
CO3 (II)
Карбонаты
SiO3 (II)
Силикаты
7.
Кислоты – это сложные вещества,молекулы которых состоят из одного
или нескольких атомов водорода,
способных заместиться на металл,
и кислотного остатка.
8.
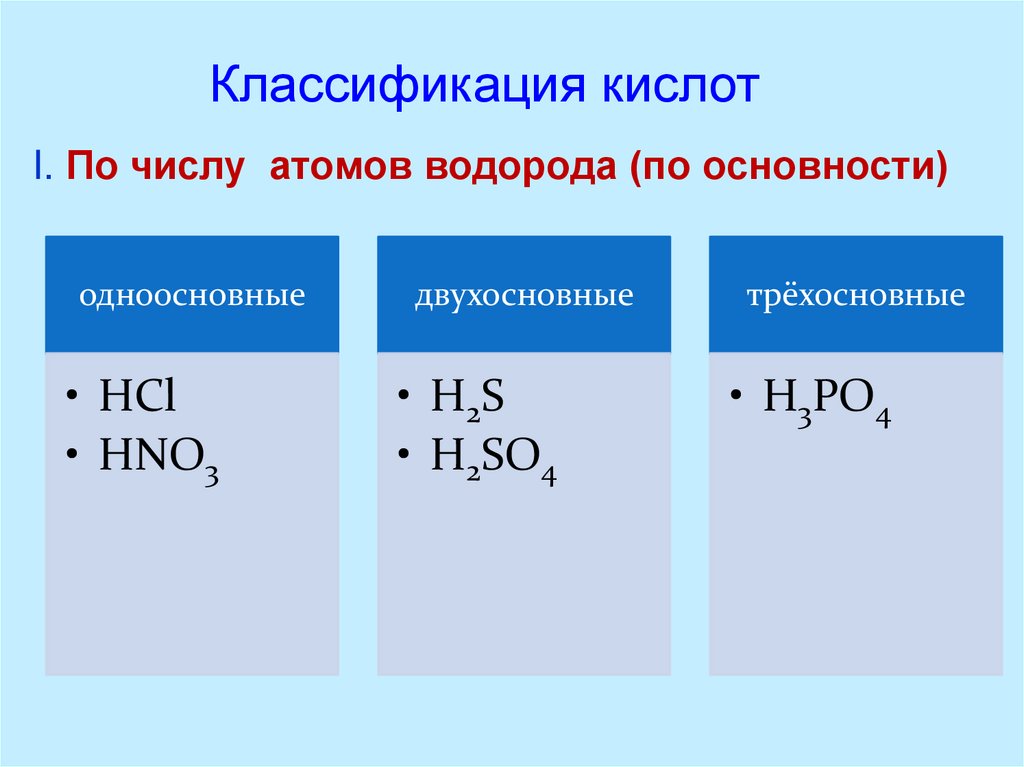
Классификация кислотI. По числу атомов водорода (по основности)
одноосновные
двухосновные
трёхосновные
• HCl
• HNO3
• H2S
• H2SO4
• H3PO4
9.
II. По содержанию кислорода в кислотномостатке
Кислоты
Бескислородные
Кислородсодержащие
H2S, HCl, HF
H3PO4, H2SO4,
HNO3,
10.
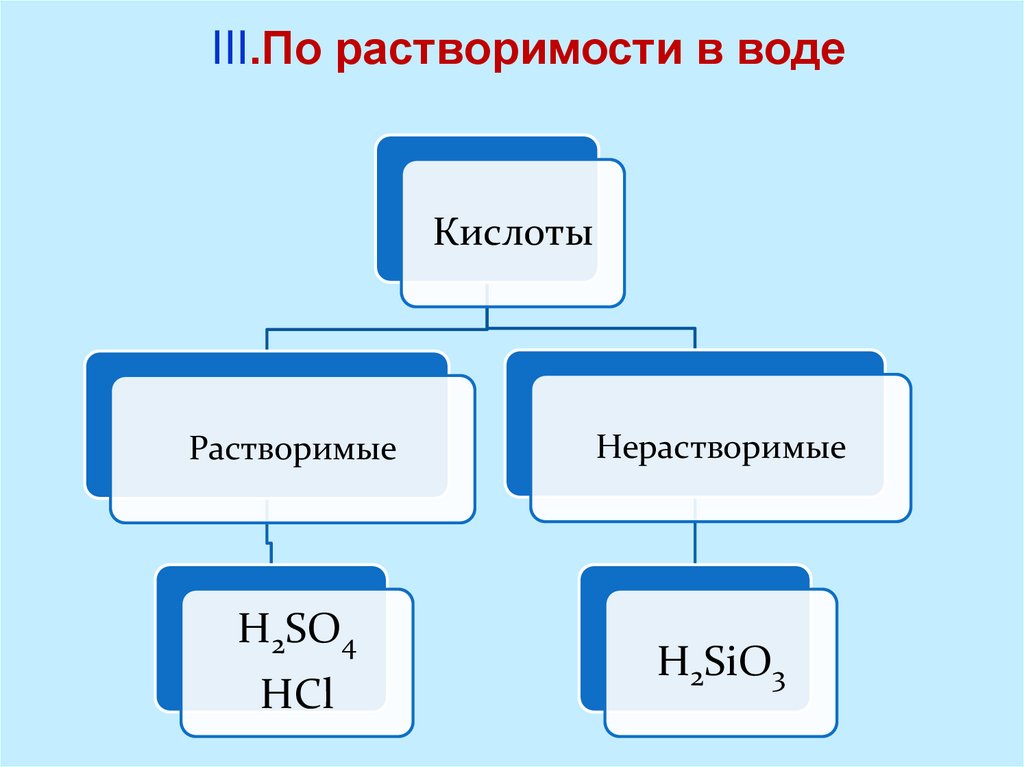
III.По растворимости в водеКислоты
Растворимые
H2SO4
HCl
Нерастворимые
H2SiO3
11.
12.
13. Серная кислота - двухосновная, кислородсодержащая кислота. Физические свойства: бесцветная, вязкая жидкость, без запаха, вдвое
Серная кислота двухосновная,кислородсодержащая кислота.
Физические свойства:
бесцветная, вязкая
жидкость, без запаха, вдвое
тяжелее воды, поглощает
влагу из воздуха и других
газов (обладает
гигроскопичностью),
обугливает древесину, кожу,
ткани, бумагу.
14. Обугливание лучинки серной кислотой (конц.)
15. Обугливание сахара конц. серной кислотой
16. Соляная кислота
Соляная кислота (хлороводородная) одноосновная кислота, бескислородная,«дымящая» на воздухе, бесцветная
едкая жидкость с острым запахом
хлористого водорода.
Соляная кислота содержится в
желудочном соке, способствует
пищеварению и убивает
болезнетворные бактерии.
Соляная кислота - едкое вещество, при попадании на
кожу вызывает сильные ожоги. Особенно опасно
попадание в глаза. При открывании сосудов с соляной
кислотой в обычных условиях образуется туман и пары
хлороводорода, которые раздражают слизистые оболочки
и дыхательные пути.
17.
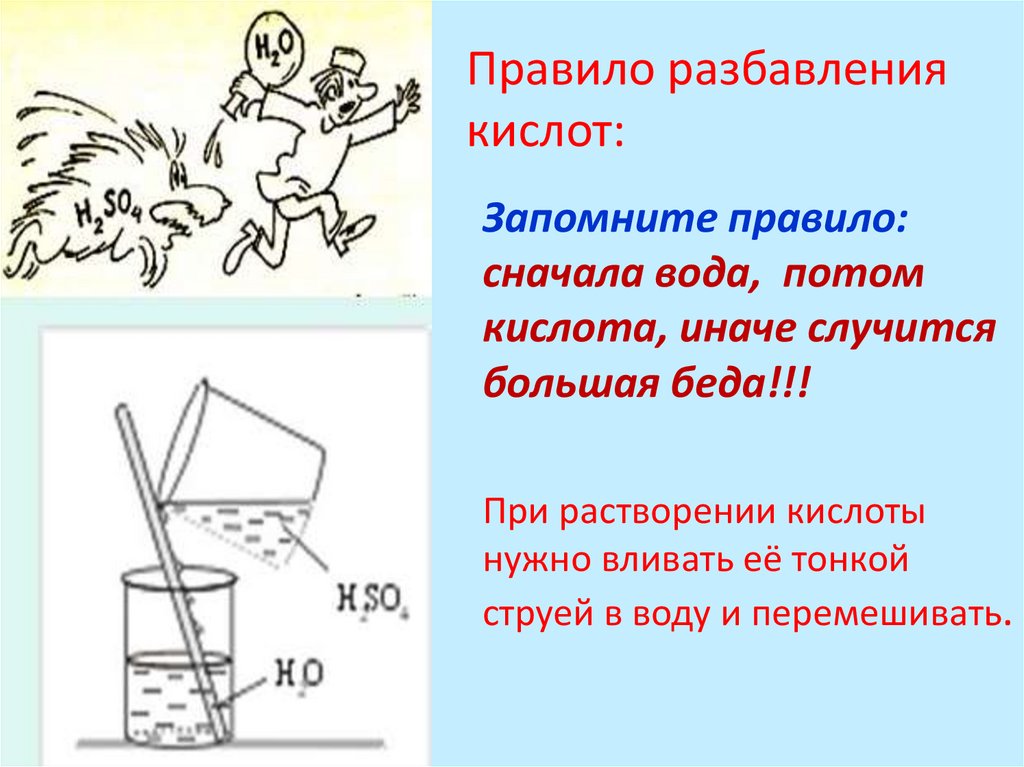
Правило разбавлениякислот:
Запомните правило:
сначала вода, потом
кислота, иначе случится
большая беда!!!
При растворении кислоты
нужно вливать её тонкой
струей в воду и перемешивать.
18.
19.
ЕСЛИ КИСЛОТА ПОПАЛА НАКОЖУ:
Поражённый участок кожи
промывают сильно скользящей
струей холодной воды в течение
10 – 15 мин. После промывки на
обожжённое место накладывают
пропитанную водным 2%-м
раствором питьевой соды
марлевую повязку или ватный
тампон. Через 10 мин. повязку
снимают, кожу обмывают,
осторожно удаляют влагу
фильтровальной бумагой или
мягкой тканью и смазывают
глицерином для уменьшения
болевых ощущений.
20. H2CO3 CO2↑ + H2O H2SO3 SO2↑ + H2O В свободном виде угольная и сернистая кислоты не существуют, т.к.распадаются на воду и
H2CO3H2SO3
CO2↑ + H2O
SO2↑ + H2O
В свободном виде угольная и сернистая
кислоты не существуют, т.к.распадаются на
воду и соответствующие оксиды.
21. Как узнать, какие оксиды соответствуют данным кислотам?
Помните, что суммарная степень окисленияатомов всех элементов в соединении равна
нулю, а степени окисления водорода + 1 и
кислорода – 2.
Тогда по формуле кислоты можно составить
уравнение.
Например, в формуле H2SO4 степень
окисления серы обозначим за Х, тогда:
(+1) ∙ 2 + Х + (- 2) ∙ 4 = 0, откуда Х = + 6
Серной кислоте H2SO4, в которой у серы
степень окисления равна + 6, соответствует
оксид серы (VI) SO3.
22. Проверь себя Выберите группу веществ, в состав которой входят только кислоты: 1) HCl, SO3, NaOH,CuCl2 2)HNO3, H2S, HCl, H3PO4
3)K2O, H2SO4, H2S, KOH4)AgNO3, CO2, CuSO4, HCl
23. Проверь себя Выберите группу веществ, в состав которой входят только двухосновные кислоты: 1) HNO3, H2S, HCl, H3PO4 2)H3PO4,
H2SO4, H2S, HCl3)H2S, H2SO4, H2SiO3, H2CO3
4)HNO3, H2CO3, H2SO4, HF
24.
Проверь себяВыберите группу веществ, в состав которой
входят только кислородсодержащие кислоты
1) HNO3, H2S, HCl, H2CO3
2)HCl, H2SO4, H2SiO3, H2SO3
3)H2S, HNO3, H2SO3, H3PO4
4)HNO3, H2SO4, H3PO4, HNO2
25. Проверь себя В кислой среде синий лакмус становится: 1) фиолетовым 2) красным 3) малиновым 4) не изменяет окраску
26.
Проверь себяУстановите соответствие:
оксид – гидроксид (цифру соотнесите с буквой):
1) Серная кислота H2SO4 2) Азотная кислота HNO3 –
3) Угольная кислота H2CO3 –
4) Фосфорная кислота H3PO4 а) SO3
б) N2O5
в) СО2
г) P2O5
27.
Вспомните правилоразбавления кислот
28.
Домашнее задание:§21, упр. 1-4
























 chemistry
chemistry








