Similar presentations:
Кислоты в животном и растительном мире
1.
Распределите эти формулыпо классам в таблицу
оксиды
основания
SO3 , HCl,CuO,H2SO4, NaOH, K2O,
N2O5,
Na2 o, KOH, Cu (OH) 2 .
ответ
2.
ОксидыОснования
SO3
CuO
K2 O
Na2O
N2O5
NaOH
KOH
Cu(OH)2
3.
Лакмус будет в нихкраснеть,
Растворяться – цинк и медь.
А мелок в них, посмотри,
В миг пускает пузыри!
И опасны для работы
Эти жгучие ……
кислоты.
4.
Тема урока:5. Кислоты в животном мире
Есть в муравьях и крапиве невинная,С пользой для нас – кислота муравьиная.
Жжет она кожу, но есть в ней и прок –
Ваш ревматизм она вылечит в срок.
Голожаберные моллюски в
порядке самообороны
выстреливают парами
серной кислоты
Тропический паук педипальпида
стреляет во врагов струйкой жидкости,
содержащей 84% уксусной кислоты.
6. Кислоты в растительном мире
Лишайники выделяют кислоты,которые разрушают
горные породы
Мухоморы в качестве ядовитых токсинов
«используют» иботеновую кислоту. Это
вещество так ядовито, что мухомору
незачем прятаться.
Очень популярен в народе щавель,
который содержит щавелевую кислоту
7.
Томаты содержат яблочную,лимонную, щавелевую кислоты
8.
Аскорбиновая кислотавитамин С
9. Кислоты в организме человека
Если ты проглотил аскорбинку,Твой организм получил витаминку.
Она закрывает болезням врата –
Аскорбиновая кислота.
Аминокислот в организме целые полки,
Соединяясь, они образуют белки.
А без белков нет ни мышц и ни кожи,
Скажите, на что мы будем похожи?
10.
Молочная кислотаобразуется в мышцах при
физической нагрузке.
Соляная кислота, находящаяся
в желудке, помогает
переваривать пищу.
11.
Кислоты применяютсяв медицине.
Аскорбиновая,
фолиевая,
липоевая,
ацетилсалициловая
и другие
12.
Кислоты применяются в кулинарии.Уксусная и лимонная
кислоты.
13.
Кислоты – это сложные вещества,состоящие из атомов
связанных с
НnK
водорода
кислотным остатком
,
где К-кислотный остаток
Кислота, когда здорова,
Угостить друзей готова
Тем, что ей дала природа, Катионом водорода.
Общая
формула
кислот
14.
КЛАССИФИКАЦИЯ КИСЛОТ1. По происхождению
ОРГАНИЧЕСКИЕ –
ЛИМОННАЯ, ЯБЛОЧНАЯ, УКСУСНАЯ, ЩАВЕЛЕВАЯ,
МУРАВЬИНАЯ.
НЕОРГАНИЧЕСКИЕСЕРНАЯ, СОЛЯНАЯ,
ПЛАВИКОВАЯ,
ФОСФОРНАЯ,
АЗОТНАЯ.
15.
2. По содержанию кислорода.бескислородные
HF
HBr
HCl
HI
H2 S
кислородсодержащие
HNO3 H2SO4
H2CO3 H3PO4
16.
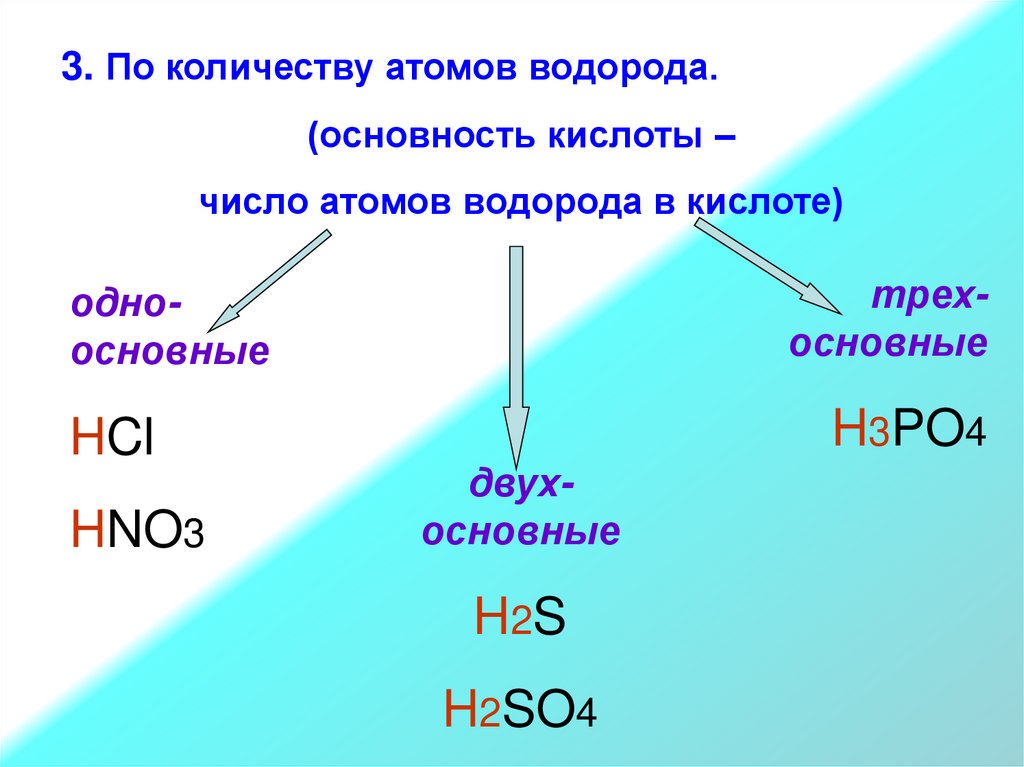
3. По количеству атомов водорода.(основность кислоты –
число атомов водорода в кислоте)
трехосновные
одноосновные
HCl
HNO3
H3PO4
двухосновные
H2 S
H2SO4
17.
4. По растворимости .растворимые
Нерастворимые
HCl H2CO3
H2SiO3
HBr H3PO4 H2S
18. Агрегатное состояние кислот
кислотыЖидкие
HCI, H2SO4, HNO3
Растворимые
в воде
Твердые
H3PO4, H2SiO3
Нерастворимые
в воде
H2SiO3
H2CO3 , H2SO3 в свободном виде не существуют
19.
Физические свойства:Большинство кислот – жидкие вещества.
Разъедают (разрушают):
• кожу,
• ткани,
• бумагу,
• древесину.
Техника безопасности
При попадании кислоты на кожу необходимо это
место промыть большим количеством воды
и обработать раствором соды.
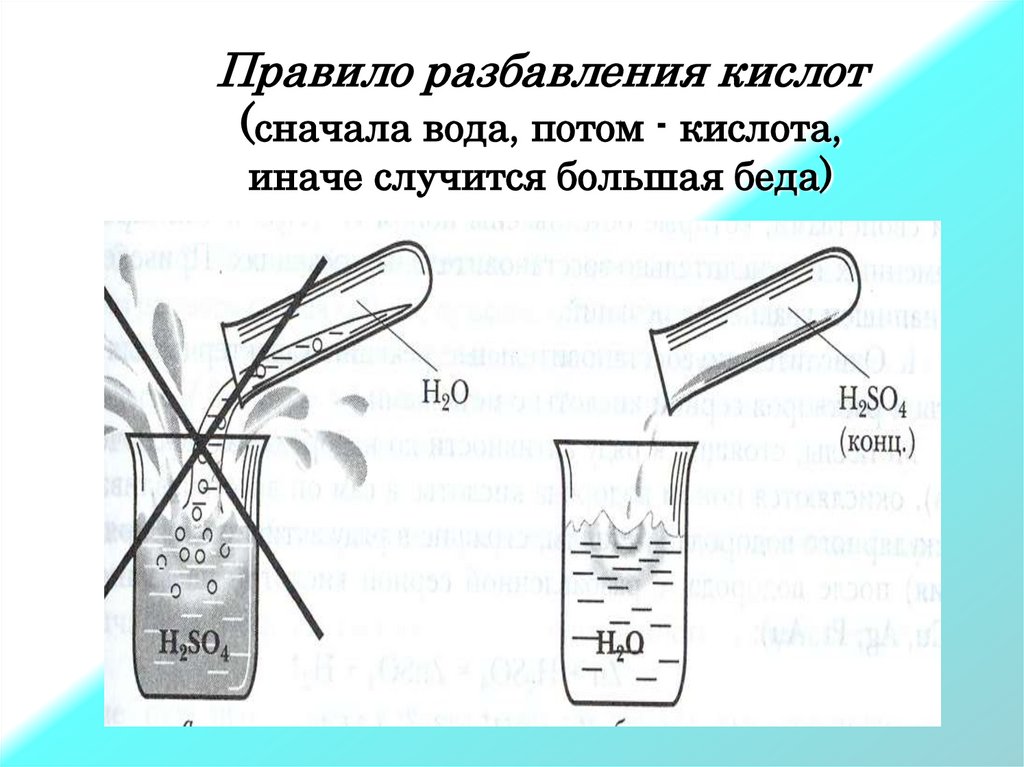
При разбавлении серной кислоты
приливают кислоту к воде, а не наоборот.
Нельзя приливать воду к кислоте, потому что происходит
сильное разогревание раствора и его разбрызгивание.
Это очень опасно!
20.
Правило разбавления кислот(сначала вода, потом - кислота,
иначе случится большая беда)
21.
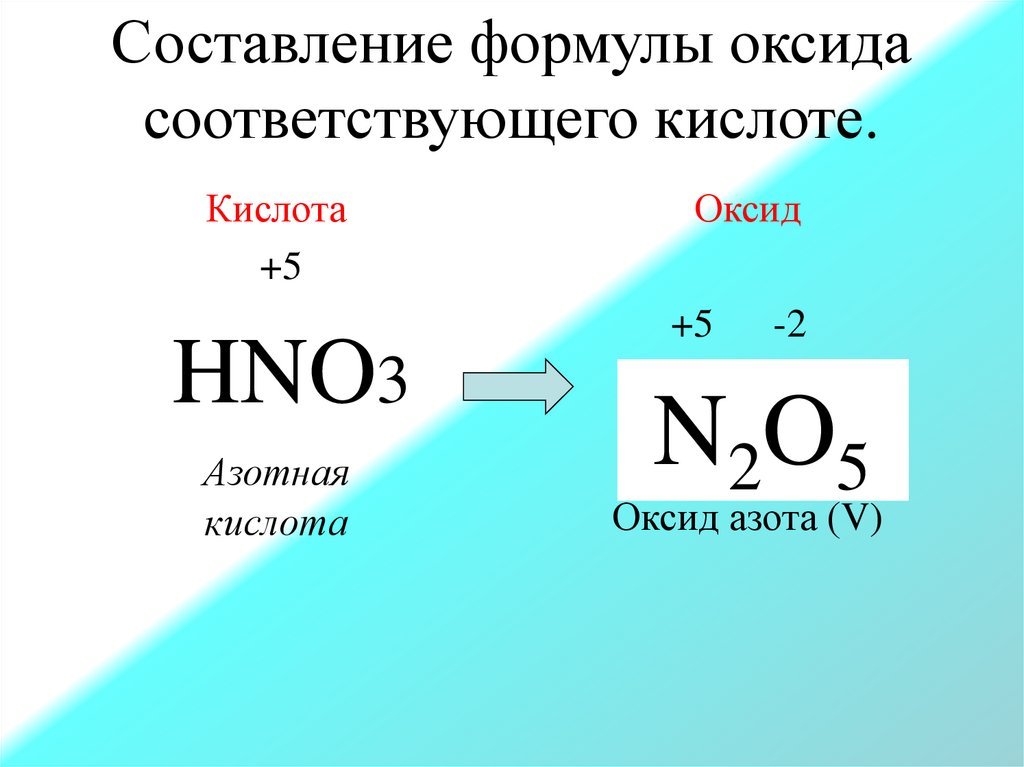
Составление формулы оксидасоответствующего кислоте.
Кислота
+5
HNO3
Азотная
кислота
Оксид
+5
-2
N2O 5
Оксид азота (V)
22.
Составление формулы кислоты посоответствующему оксиду.
+6
SO3
+ H2O
N2O5
+6
H2SO4
HNO3
23.
Уксусная кислота(древесная кислота)H2SO4 ( купоросное масло)
HCl (соляной спирт)
HNO3 (селитряная водка)
H2CO3 (содовая вода)
24. Тест по теме «КИСЛОТЫ»
25. 1. Выберите группу веществ, в которой указаны только формулы кислот.
а) НСL, H2 O, H2 CO3б) НСL, HNO3, H2 CO3
в) NaСL, H3PO4, H2 SO3
26. 2. Выберите группу, в которой указаны формулы только кислородсодержащих кислот
а)НСL, Н2 SО4 , НNO3б)Н2 SО4, НNO3, Н3 PO4б
в)НСL, Н2 S , НNO3
27. 3. Выберите группу, в которой указаны формулы только одноосновных кислот
а) НСL, НNO3, НFаб) Н2 SО4, Н3 PO4, Н2 S
в) Н3 PO4, НСL, НNO3
28. 4. Под действием растворов кислот лакмус синий становится:
а) малиновымб) не изменяет окраску
в) красным
г) фиолетовым
29. 5. «Купоросным маслом» называют:
а)Соляную кислоту HСLб)Азотную кислоту HNO3
в)Фосфорную кислоту H3PO4
г)Серную кислоту H2SO4
30. 6. При разбавлении кислоты:
а)Воду приливают к кислотеб)Кислоту приливают к воде
в)Воду и кислоту смешивают
одновременно
31.
7.Формула оксида, соответствующегоH2SO4?
1) SO2
2) SO3
3)SiO2
4)CO2
8.Формула кислоты, соответствующей
N2O3?
1) HNO3
2) HNO2
3) H2SO4 4) H3PO4
32.
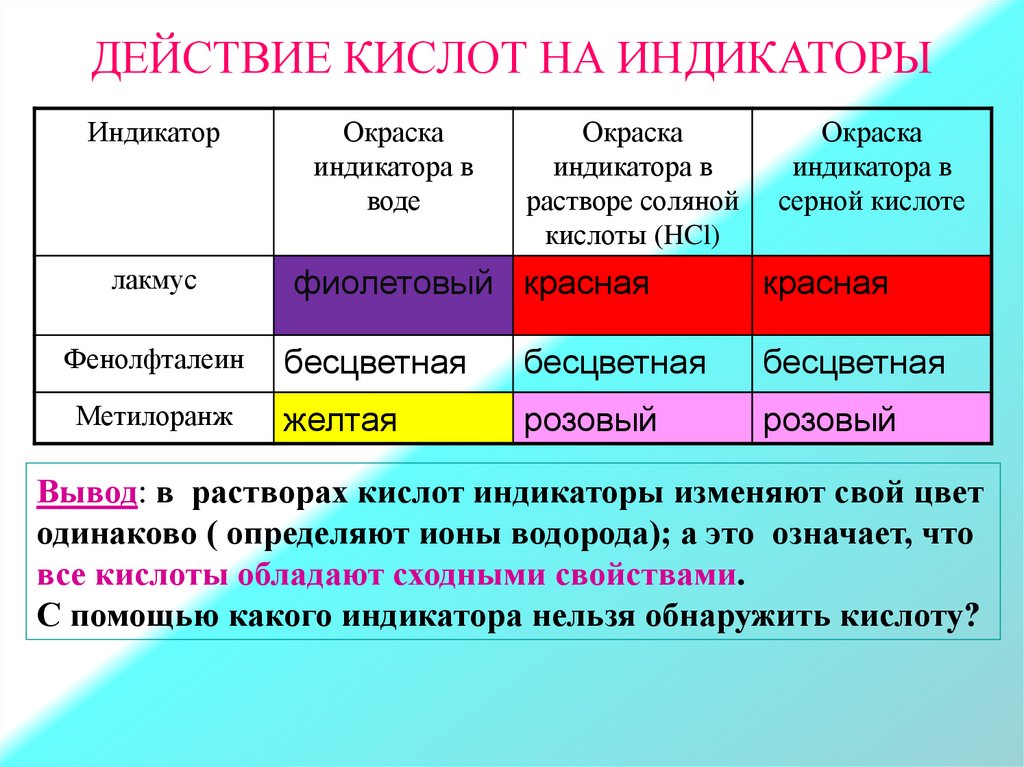
ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫИндикатор
лакмус
Окраска
индикатора в
воде
Окраска
индикатора в
растворе соляной
кислоты (HCl)
Окраска
индикатора в
серной кислоте
фиолетовый красная
красная
Фенолфталеин
бесцветная
бесцветная
бесцветная
Метилоранж
желтая
розовый
розовый
Вывод: в растворах кислот индикаторы изменяют свой цвет
одинаково ( определяют ионы водорода); а это означает, что
все кислоты обладают сходными свойствами.
С помощью какого индикатора нельзя обнаружить кислоту?
33. Химические свойства кислот
МеталлН2
С
Основный оксид
КИСЛОТА +
Основание
Соль
О
Н2О
+
Л
Н2О
Ь
кислота
34. Химические свойства кислот
Кислота + металл = соль + водородРяд активности металлов:
Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Активность металлов уменьшается
Опыт 1. Взаимодействие цинка с соляной
кислотой
Опыт 2. Взаимодействие металлов с
кислотами
35.
Химические свойства кислотКислота + основный оксид = соль + вода
H2SO4+СuO = CuSO4 +H2O
Опыт. Взаимодействие оксида меди
(II) с серной кислотой
36.
Химические свойства кислотКислота + основание = соль + вода
HCl + NaOH = NaCl +H2O
H2SO4 + Cu(OH)2= CuSO4 + 2H2O
37.
Химические свойства кислотКислота 1 + соль 1 = соль 2 + Кислота 2
Условия реакции:
1. Если образуется осадок ↓:
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
2. Если выделяется газ :
2 HNO3+CaCO3= Ca(NO3)2+H2O + CO2
38.
Минеральные кислотыНазвание кислоты
Формула кислоты
Азотная
Серная
Угольная
Кремниевая
Метафосфорная
Ортофосфорная
Соляная
С
Р
HNO3
H2SO4
H2CO3
H2SiO3
HPO3
H3PO4
HCl

































 chemistry
chemistry








