Similar presentations:
Кислоты в свете ТЭД
1. КИСЛОТЫ В СВЕТЕ ТЭД.
План работы на уроке.1. Повторить классификацию и формулы
кислот. Номенклатуру.
2. Дать определение кислотам с точки зрения
ТЭД.
3. Изучить физические свойства кислот.
4. Научиться определять кислотную среду
раствора.
5. Изучить взаимодействие кислот с
основаниями.
2. КИСЛОТЫ: НАЗВАНИЯ, ОБЩАЯ ФОРМУЛА, ОПРЕДЕЛЕНИЕ.
СПРАВКА: параграф 20 стр. 71.ЗАДАНИЕ: выберите формулы кислот, запишите в
тетрадь и назовите.
NaOH, HCL, KCL, H2SO4, Na2O, H3PO4,
AL(OH)3, HNO3, Cu2O, K2SO4, H2SiO3, Na2S,
H2CO3, H2S.
3. Формулы и названия кислот.
HCLH2SO4
H3PO4
HNO3
H2SiO3
H2CO3
H2S
соляная кислота
серная кислота
фосфорная кислота
азотная кислота
кремниевая кислота
угольная кислота
сероводородная кислота
4. Кислоты: общая формула и определение.
Кислоты – сложные вещества, молекулыкоторых состоят из атомов водорода и
кислотных остатков.
Общая формула:
+
Н Ас
-
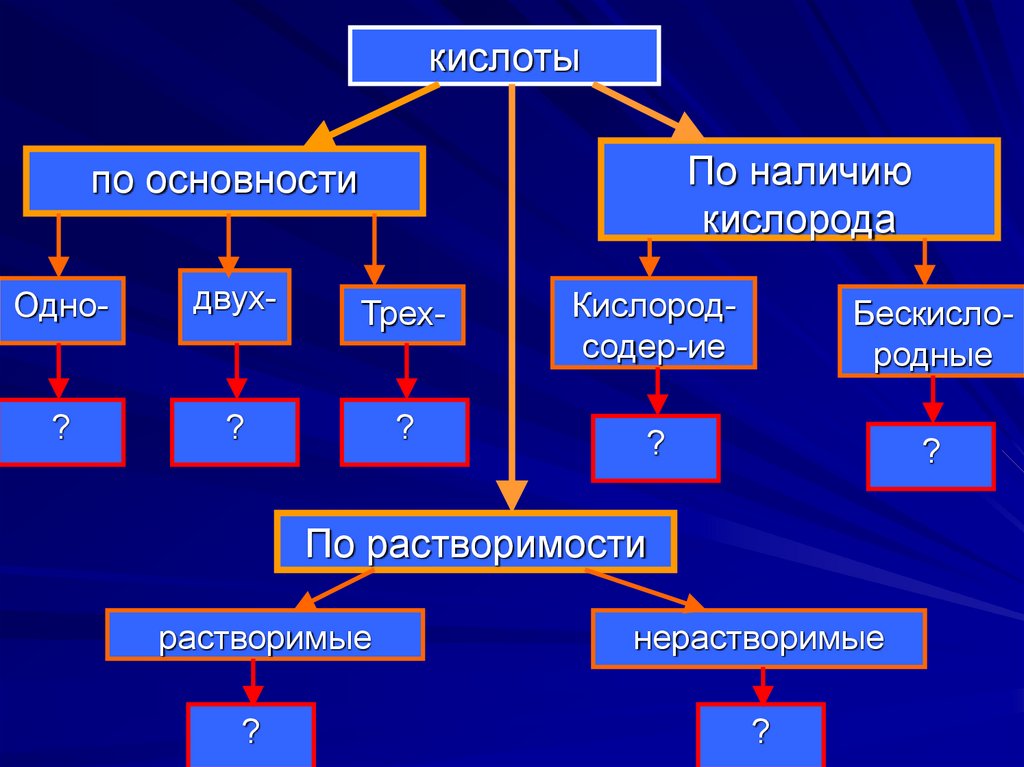
5. кислоты
По наличиюкислорода
по основности
Одно-
двух-
Трех-
Кислородсодер-ие
Бескислородные
?
?
?
?
?
По растворимости
растворимые
?
нерастворимые
?
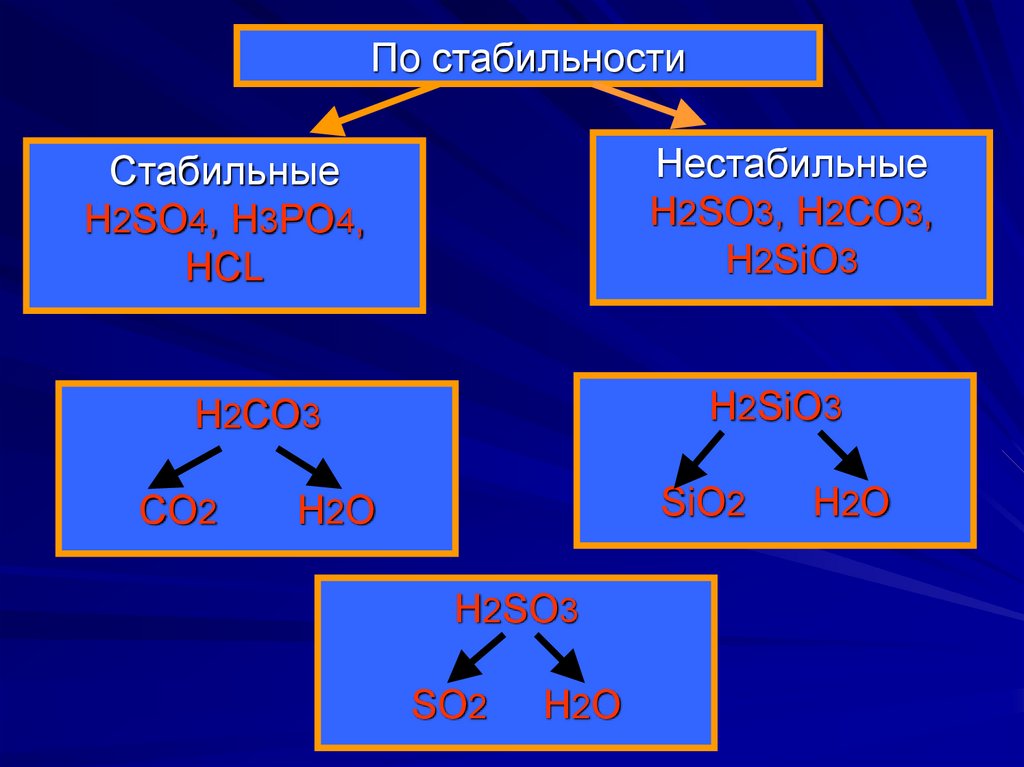
6. По стабильности
НестабильныеH2SO3, H2CO3,
H2SiO3
Стабильные
H2SO4, H3PO4,
HCL
H2SiO3
H2CO3
CO2
SiO2
H2O
H2SO3
SO2
H2O
H2O
7. Разложение угольной кислоты
H2CO3CO2
H2O
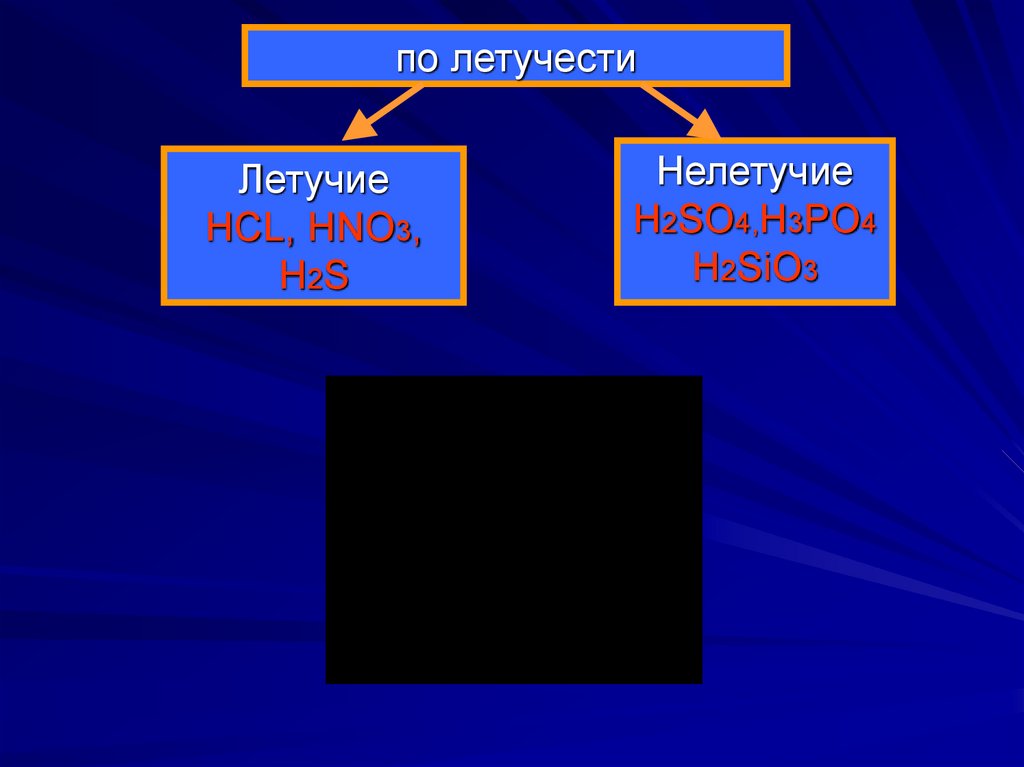
8.
по летучестиЛетучие
HCL, HNO3,
H2S
Нелетучие
H2SO4,H3PO4
H2SiO3
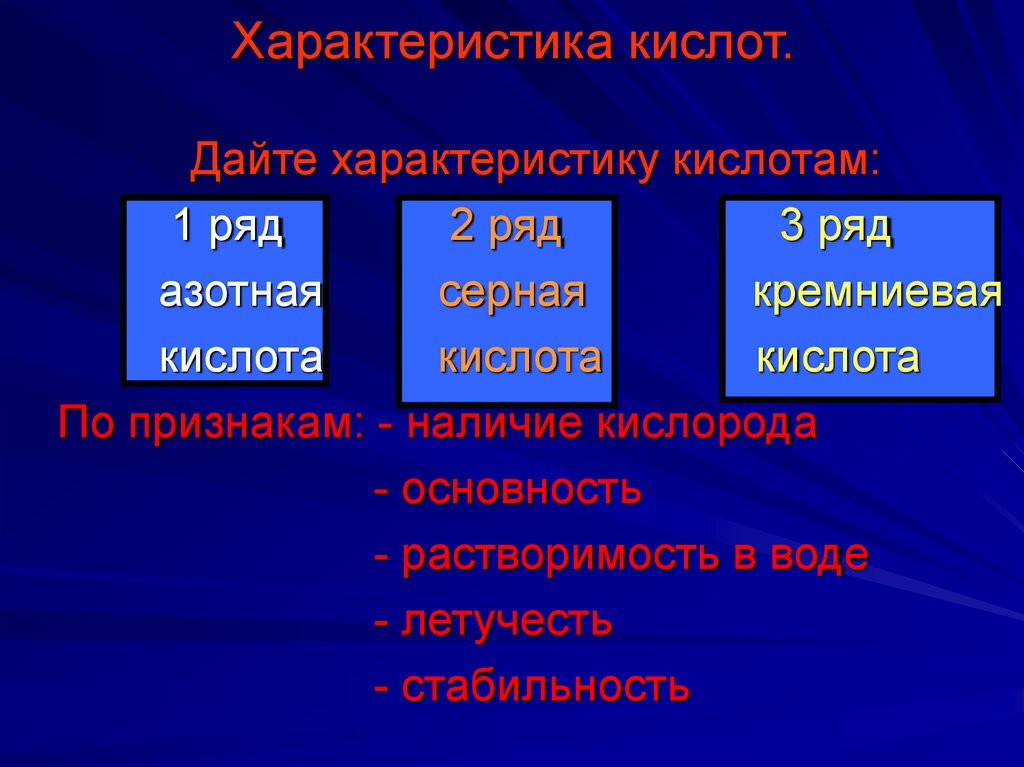
9. Характеристика кислот.
Дайте характеристику кислотам:1 ряд
2 ряд
3 ряд
азотная
серная
кремниевая
кислота
кислота
кислота
По признакам: - наличие кислорода
- основность
- растворимость в воде
- летучесть
- стабильность
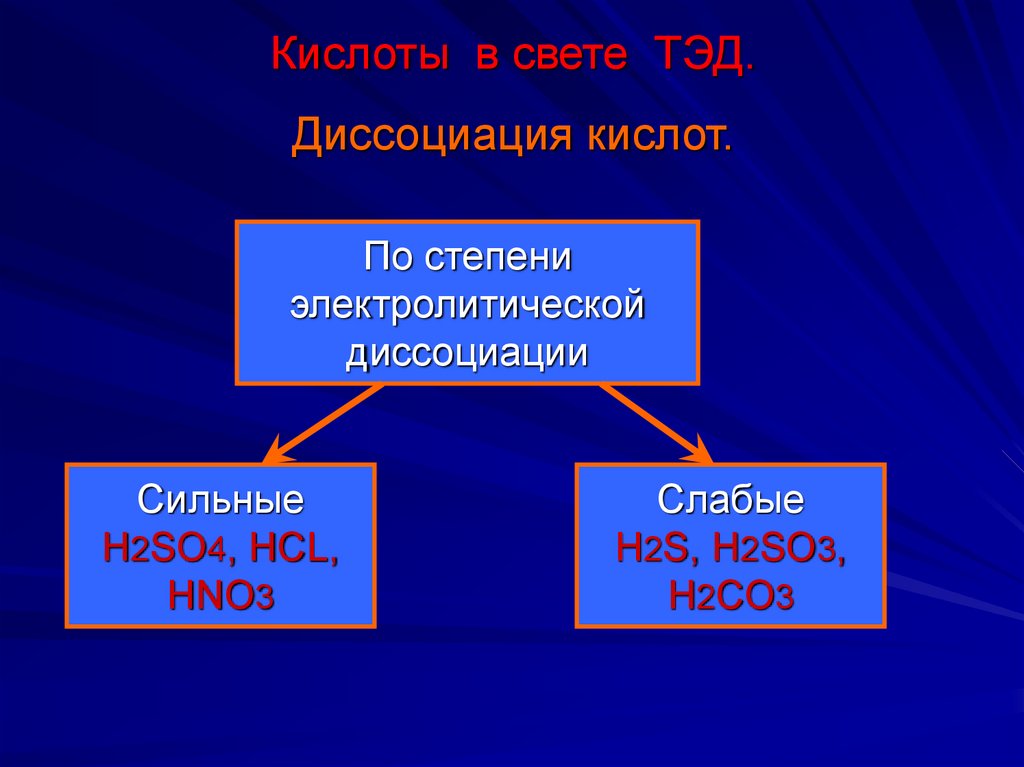
10. Кислоты в свете ТЭД.
Диссоциация кислот.По степени
электролитической
диссоциации
Сильные
H2SO4, HCL,
HNO3
Слабые
H2S, H2SO3,
H2CO3
11. Кислота как сильный или слабый электролит.
Сильные электролиты – которые прирастворении в воде практические полностью
диссоциируют на ионы.
Для сильных электролитов процесс диссоциации практически необратим.
+
HNO3 = H + NO3
Слабые электролиты – которые при растворении в воде почти не диссоциируют на ионы.
Для слабых электролитов процесс диссоциации
обратим.
+
HNO2
H + NO2
12. Сильные и слабые электролиты.
13. Разрушительное действие серной кислоты на различные материалы.
14. Диссоциация кислот.
Вариант 1.1.Выберите сильные электролиты:
а)H3PO4, б)H2SO4, в)HCL, г)HNO3, д)HNO2.
2.Запишите уравнение диссоциации этих в-в.
3.Укажите в растворах каких веществ универс.
индикатор окрасится в красный цвет.
а)HCL, б)NaOH, в)K2O, г)HNO3, д)KNO3.
Вариант 2.
1.Выберите слабые электролиты:
а)H3PO4, б)H2SiO3, в)HCL, г)HNO3, д)H2СO3.
2.Запишите уравнение диссоциации этих в-в.
3.Укажите в растворах каких веществ м.о.
индикатор окрасится в красно-розовый цвет.
а)HCL, б)Na2O, в)KOН, г)H2SO4, д)К2SO4.
15. Диссоциация кислот. ОТВЕТЫ.
Вариант 1.1. б), в), г).
2+
2. H2SO4 = 2H + SO4
+
HCL = H + CL
+
HNO3 = H + NO3
3. а), г).
Вариант 2.
1. а), б), д).
3+
2. H3PO4
3H + PO4
H2SiO3 =
2+
H2CO3
2H + CO3
3. а), г).
16. Общие химические свойства кислот.
+-
HCL = H + CL
+
HNO3 = H + NO3 2H2SO4 = 2H + + SO4
Общие химические свойства кислот.
1. Изменяют окраску индикатора.
2. Взаимодействуют с основаниями.
3. Реагируют с металлами.
4. Взаимодействуют с основными
оксидами.
5. Реагируют с солями.
Общие свойства водных растворов кислот
Обусловлены присутствием ионов
водорода!
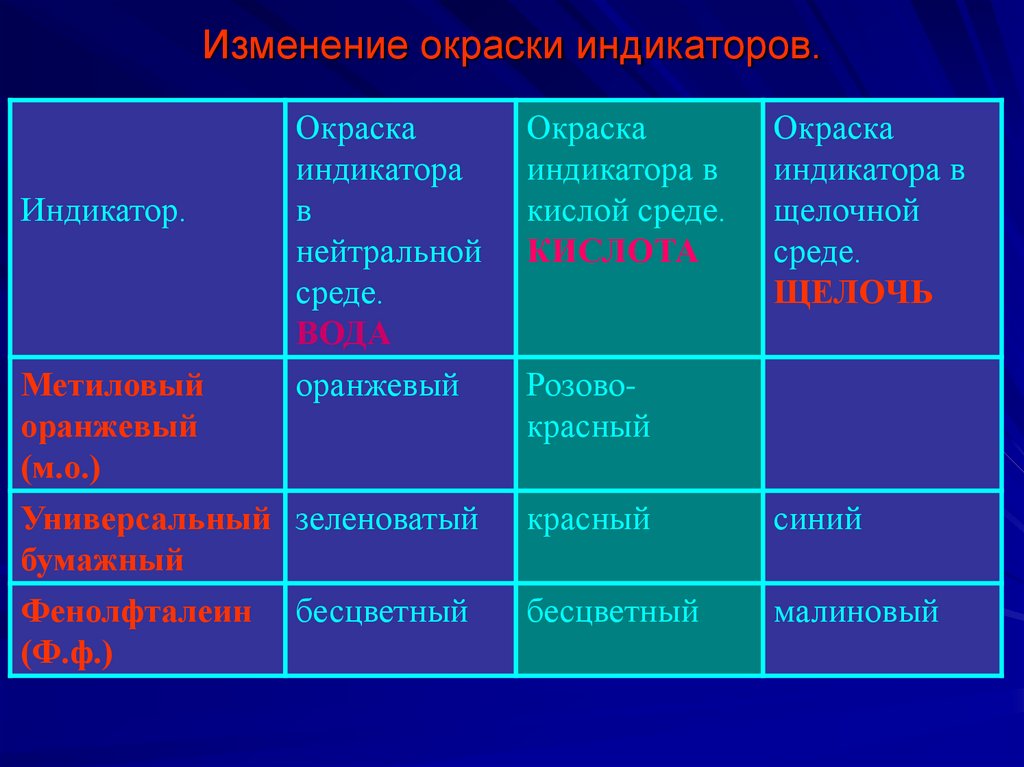
17. Изменение окраски индикаторов.
Индикатор.Метиловый
оранжевый
(м.о.)
Окраска
индикатора
в
нейтральной
среде.
ВОДА
Окраска
индикатора в
кислой среде.
КИСЛОТА
оранжевый
Розовокрасный
Универсальный зеленоватый
бумажный
Фенолфталеин бесцветный
(Ф.ф.)
Окраска
индикатора в
щелочной
среде.
ЩЕЛОЧЬ
красный
синий
бесцветный
малиновый
18. Взаимодействие кислот с основаниями.
Гидроксид натрия и соляная кислотаГидроксид натрия и серная кислота
Гидроксид алюминия и азотная кислота












 chemistry
chemistry








