Similar presentations:
Кислоты. Состав и классификация кислот
1.
Муниципальное бюджетное общеобразовательное учреждение«Средняя многопрофильная школа №65 „Спектр‟» г.Липецка
Учитель химии
Светлана Николаевна Малык
2018 год
2.
«Ум заключается не только взнании, но и в умении прилагать
знание на деле»
Аристотель
3.
День прожит не зря,если ты узнал что-то новое
4.
Н.Н.Семёнов –советский
физико-химик
5.
6.
7.
СаО, Ba(ОН)2, СuО, НСl,Н2О, Сl2О7, Fе(ОН)2, НNО3,
NаОН, Н2SО4, H3PO4, Н2S
Оксиды
Основания
?
8.
9.
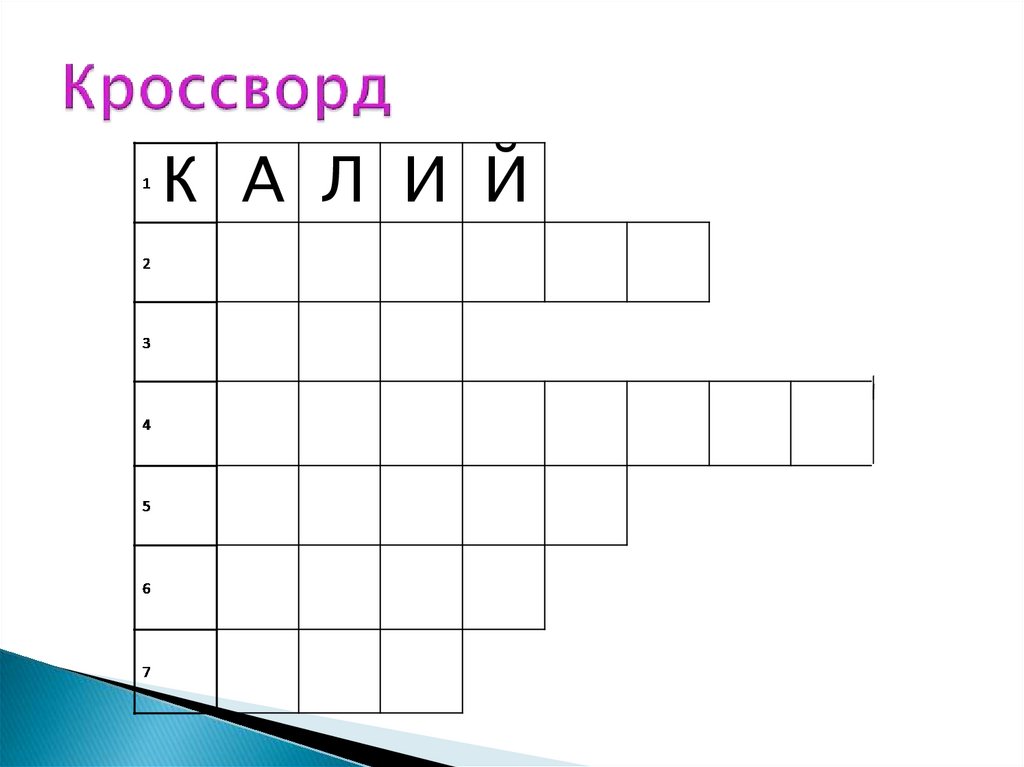
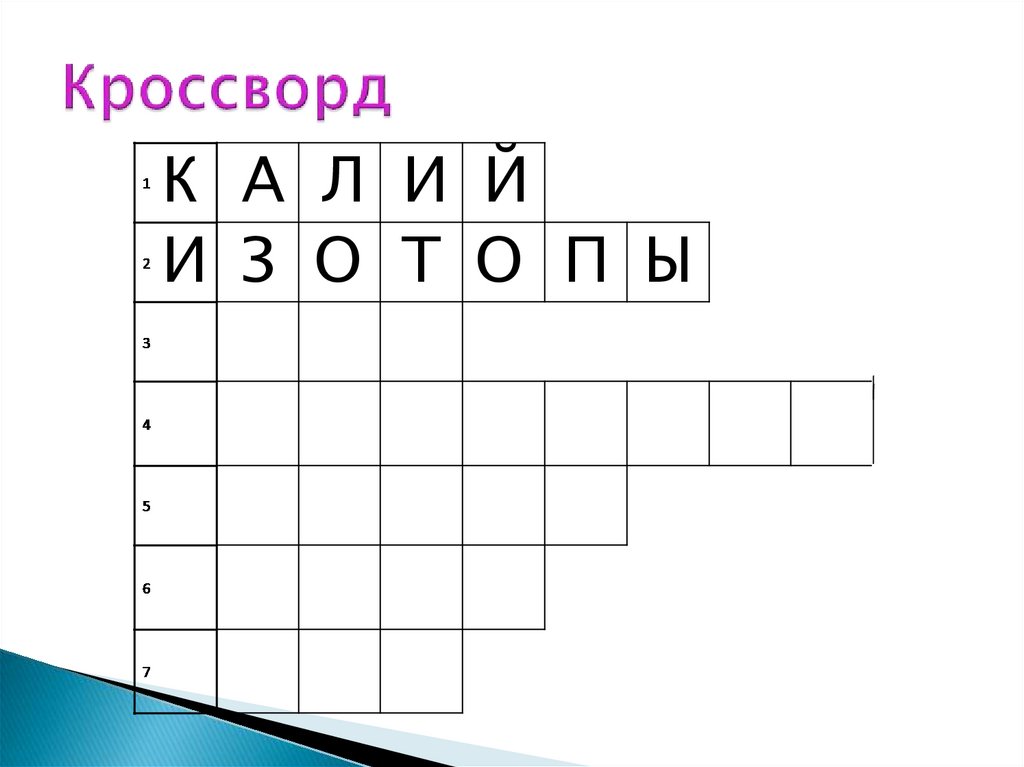
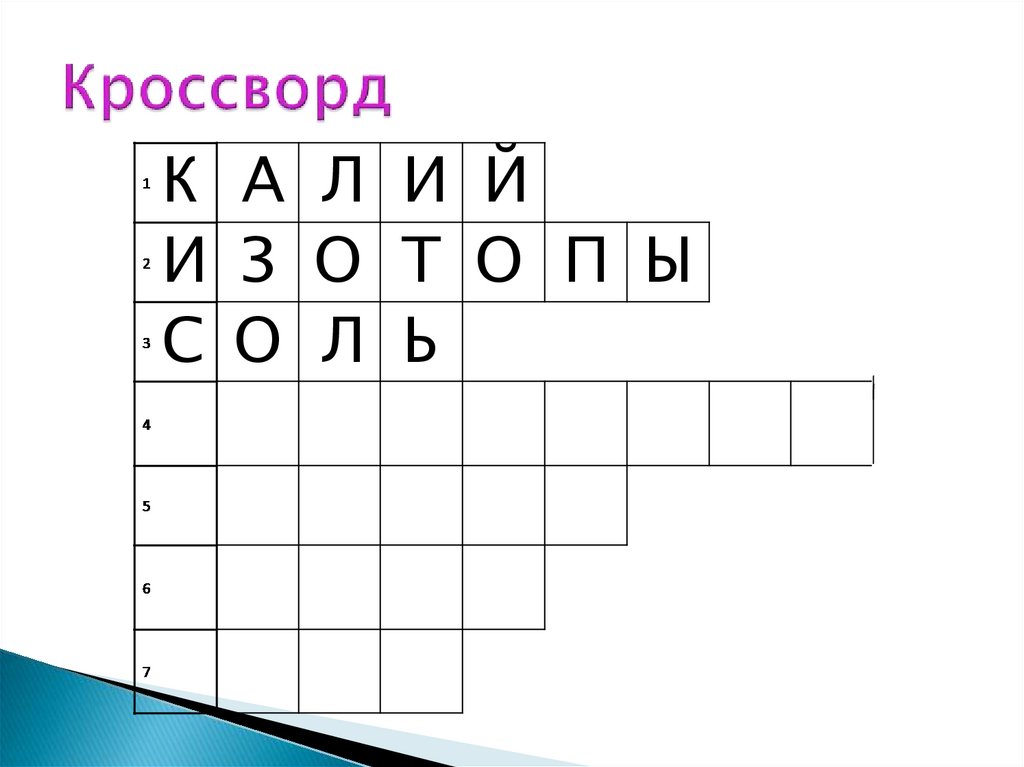
К А Л И Й10.
К А Л И ЙИ З О Т О П Ы
11.
К А Л И ЙИ З О Т О П Ы
С О Л Ь
12.
КИ
С
Л
А
З
О
О
Л
О
Л
М
И Й
Т О П Ы
Ь
О Н О С О В
13.
КИ
С
Л
О
А
З
О
О
К
Л
О
Л
М
С
И
Т
Ь
О
И
Й
О П Ы
Н О С О В
Д Ы
14.
КИ
С
Л
О
Т
А
З
О
О
К
И
Л
О
Л
М
С
Т
И
Т
Ь
О
И
А
Й
О П Ы
Н О С О В
Д Ы
Н
15.
КИ
С
Л
О
Т
А
А
З
О
О
К
И
Т
Л
О
Л
М
С
Т
О
И
Т
Ь
О
И
А
М
Й
О П Ы
Н О С О В
Д Ы
Н
16.
17.
Что такое кислоты?Какие виды кислот бывают?
Как распознать кислоты среди других
веществ?
Определите степени окисления элементов в
кислотах (смотри приложение №2).
18.
Знать определение класса кислот;Уметь составлять формулы кислот;
Знать номенклатуру кислот;
Знать классификацию кислот;
Уметь распознавать кислоты;
Знать правила техники безопасности при
работе с кислотами.
19.
Что нам нужно узнать?▶
▶
▶
что такое кислоты, какие они бывают, как их
классифицируют;
формулы некоторых неорганических кислот;
правила техники безопасности при работе с кислотами;
Чему мы должны научиться?
▶ распознавать кислоты среди других соединений;
▶ определять заряды ионов кислотных остатков;
▶ определять степени окисления атомов
химических элементов , образующих кислоты.
20.
1.2.
3.
4.
5.
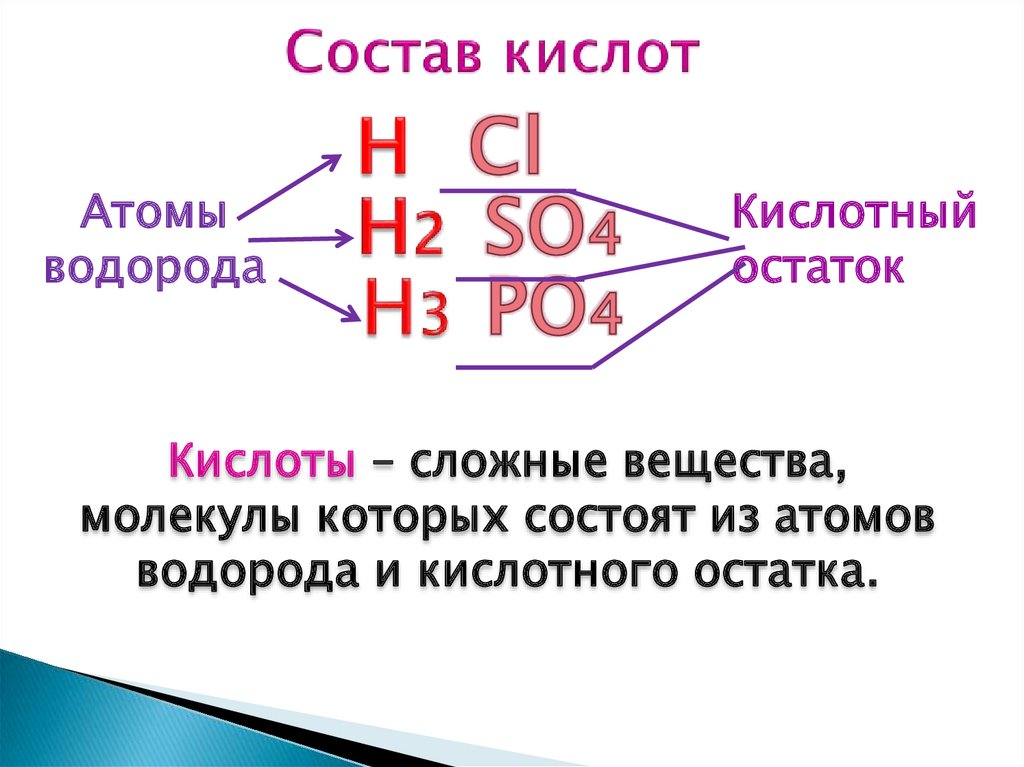
Состав
Номенклатура
Классификация
Распознавание кислот
Правила техники
безопасности при работе с
кислотами
21.
Атомыводорода
Кислотный
остаток
Кислоты – сложные вещества,
молекулы которых состоят из атомов
водорода и кислотного остатка.
22.
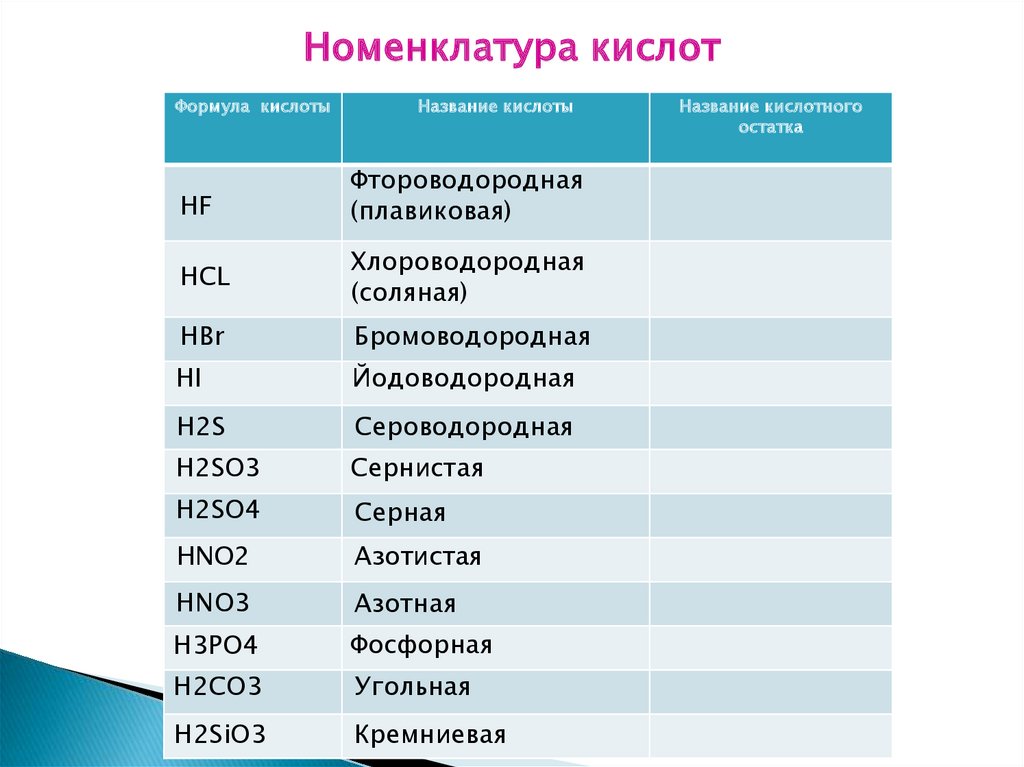
Номенклатура кислотФормула кислоты
Название кислоты
HF
Фтороводородная
(плавиковая)
HCL
Хлороводородная
(соляная)
HBr
Бромоводородная
HI
Йодоводородная
H2S
Сероводородная
H2SO3
Сернистая
H2SO4
Серная
HNO2
Азотистая
HNO3
Азотная
H3PO4
Фосфорная
H2CO3
Угольная
H2SiO3
Кремниевая
Название кислотного
остатка
23.
По какому признакукислоты разделены на группы?
HCl
HNO3
HF
H2SO4
HBr
H2CO3
H2S
H2SiO3
HI
H3PO4
24.
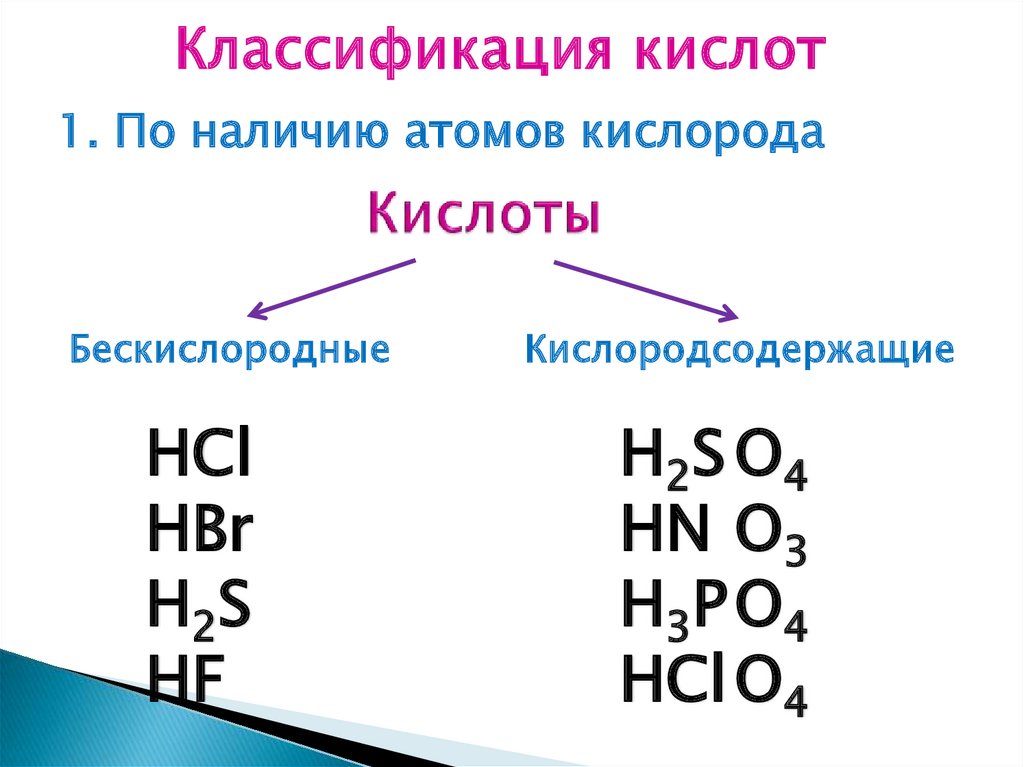
Классификация кислот1. По наличию атомов кислорода
Бескислородные
НСl
НВr
Н 2S
НF
Кислородсодержащие
Н 2S О 4
НN О3
Н 3Р О 4
НСl О4
25.
??
HF
HCl
HBr
HI
HNO3
HClO4
H2S
H2SO4
H2SO3
H2CO3
H2SiO3
?
H3PO4
H3BO3
26.
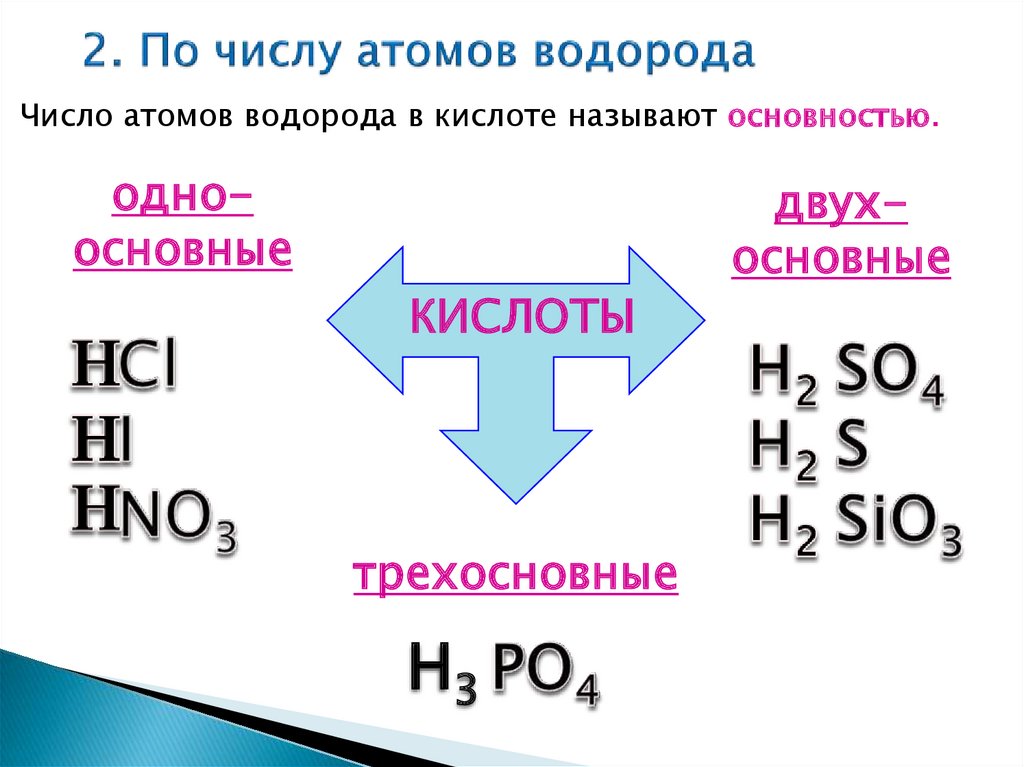
Число атомов водорода в кислоте называют основностью.одноосновные
двухосновные
КИСЛОТЫ
трехосновные
Н3
27.
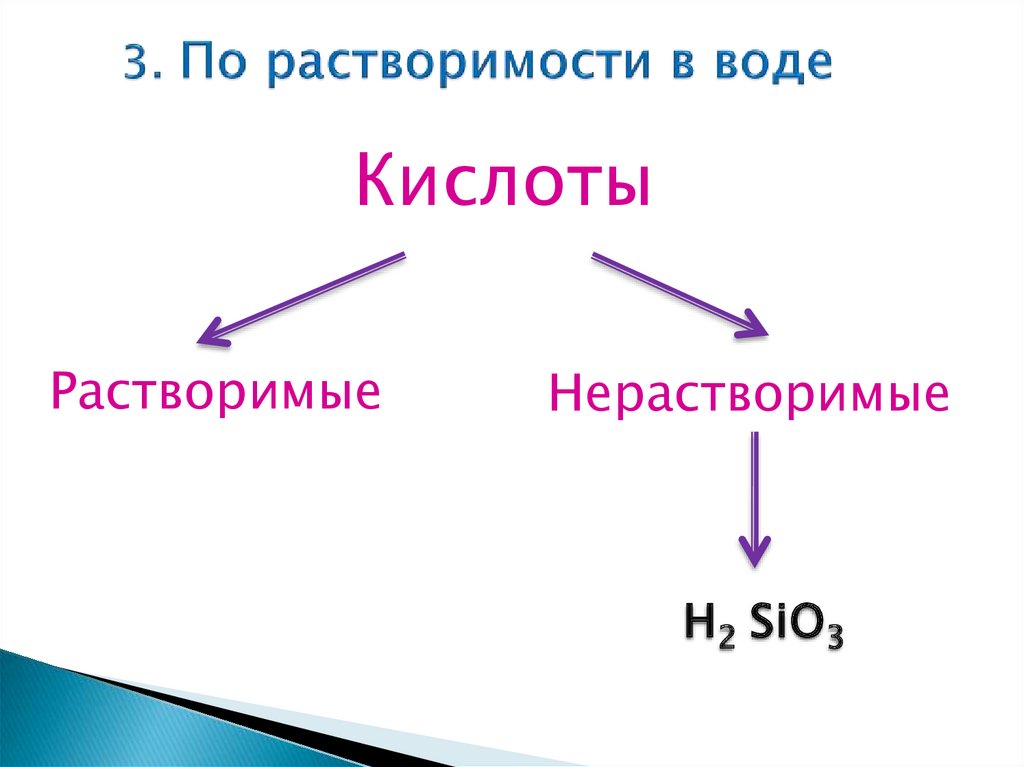
КислотыРастворимые
Нерастворимые
Н2 SiО3
28.
ПРАВИЛА БЕЗОПАСНОСТИЕдкое
вещество—
кислота! Разрушает и
раздражает
кожу,
слизистые оболочки.
Попавшие
на
кожу
капли
раствора кислоты немедленно
смойте
сильной
струей
холодной
воды, а затем
обработайте
поврежденную
поверхность 2%-м раствором
питьевой соды.
29.
30.
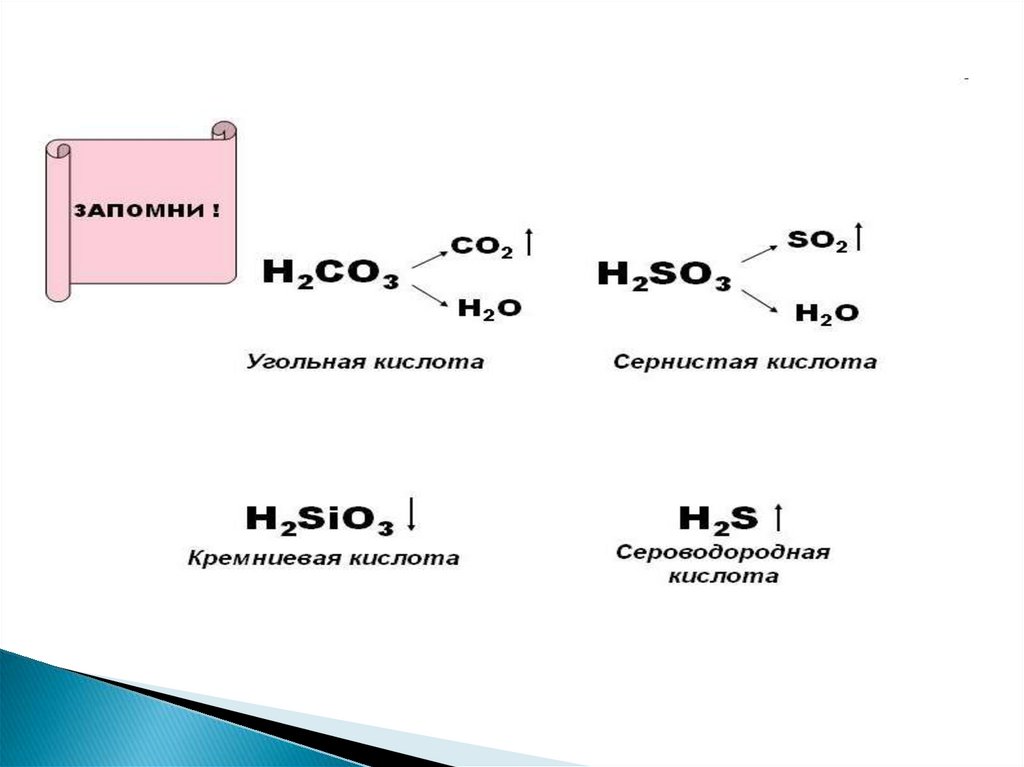
→SO2
→
N2O3
H2SO3
Сернистая кислота
HNO2
Азотистая кислота
31.
Кислоты – это сложные вещества, молекулыкоторых состоят из атомов водорода и
кислотного остатка.
Классификация кислот – бескислородные и
кислородсодержащие; одноосновные,
двухосновные и многоосновные;
растворимые и нерастворимые.
Кислоты изменяют окраску индикаторов:
лакмуса из фиолетового в красный,
метилового оранжевого из оранжевого в
красный.
Индикаторы – вещества, изменяющие свой
цвет в растворах кислот.
32.
а) H3PO4б) кислородсодержащая
в) трёхосновная
г) растворимая в воде
д) +1 +5 -2
H3PO4
е)
H3+PO43-
ж) P +5O -2
2
5
33.
1. л а к м у с2. а) HCl, так как бескислородная кислота
б) H3PO4 , так как трехосновная кислота
34.
35.
День прожит не зря,если ты узнал что-то новое
36.
«Знание только тогда знание, когдаоно приобретено усилиями своей
мысли, а не памятью»
Лев Николаевич Толстой
37.
Параграф 21Упражнения 2-4
Презентации «Кислоты в домашней
аптечке»,»Кислоты в продуктах
питания»-по желанию.




























 chemistry
chemistry








