Similar presentations:
Производные карбоновых кислот
1.
ЛЕКЦИЯ«Производные карбоновых кислот»
Лектор: старший преподаватель
Оренбургского государственного университета,
канд. хим. наук
Строганова Елена Алексеевна
2.
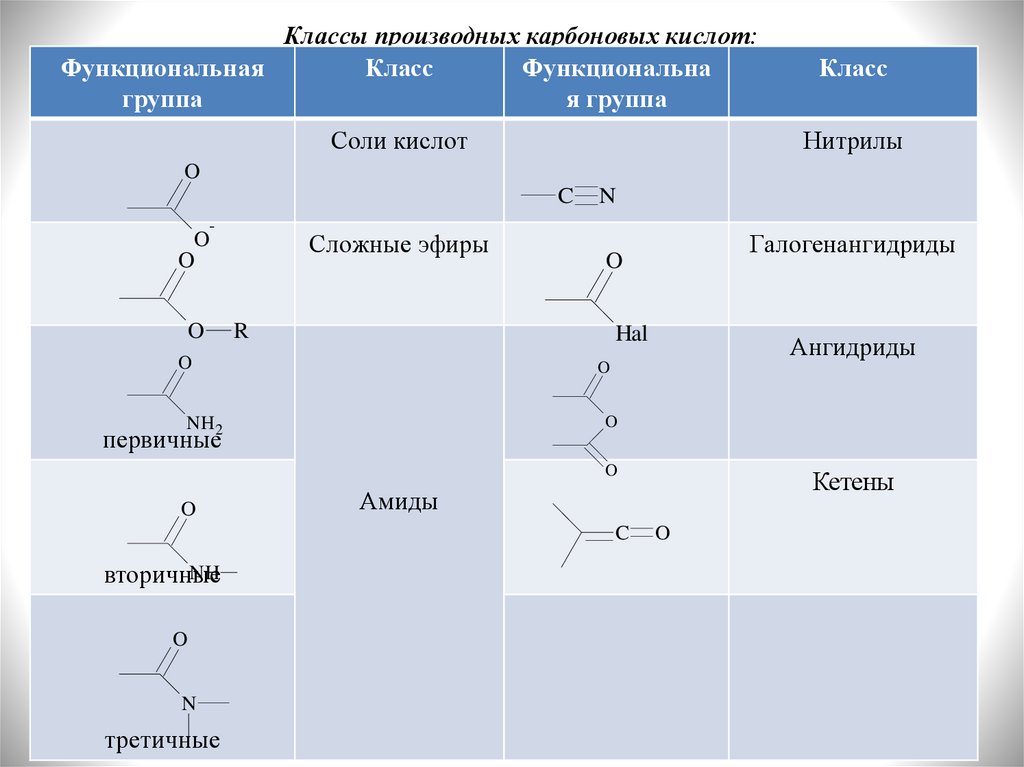
Классы производных карбоновых кислот:Функциональная
Класс
Функциональна
группа
я группа
Соли кислот
Класс
Нитрилы
O
C
O
O
-
O
Сложные эфиры
N
Галогенангидриды
O
R
Hal
O
Ангидриды
O
O
NH2
первичные
O
O
C
NH
вторичные
O
N
третичные
Кетены
Амиды
O
3.
! Гидролиз любого производного карбоновой кислоты всегда ведет кобразованию исходной карбоновой кислоты
Основная роль производных карбоновых кислот – ацилирование нуклеофилов.
Ацилирование = перенос катионов ацилия на нуклеофильную частицу
В целом, чем больше δ+ на ацильном атоме углерода, тем легче процесс
ацилирования.
По способности к реакциям ацилирования производные кислот распределяются в
следующий ряд:
O
R
O
O
O
<
-
O
R
<
NH2
R
<
O R
O
<
R
OH
O
R
O <
R
R
<
Hal
R
O
R
C
N
sp
C
<
R
O
4.
I Соли карбоновых кислот-
O
O
R
R
-
O
O
O
-
R
O
Распределение отрицательного заряда с атома кислорода за счет эффекта
сопряжения гасит δ+ ацильного атома углерода, что обусловливает слабую
ацилирующую способность
Химические свойства
1) Реакция Гриньяра (превращение солей в третичные спирты)
O
O
+
R
O
Na
R-MgHal
R
MgHal
O Na
R
H2O
-NaOH
R
-MgOHHal
O
O
R-MgHal
R
R
R
MgHal
R
OH
H2O
R
R
-MgOHHal
R
5.
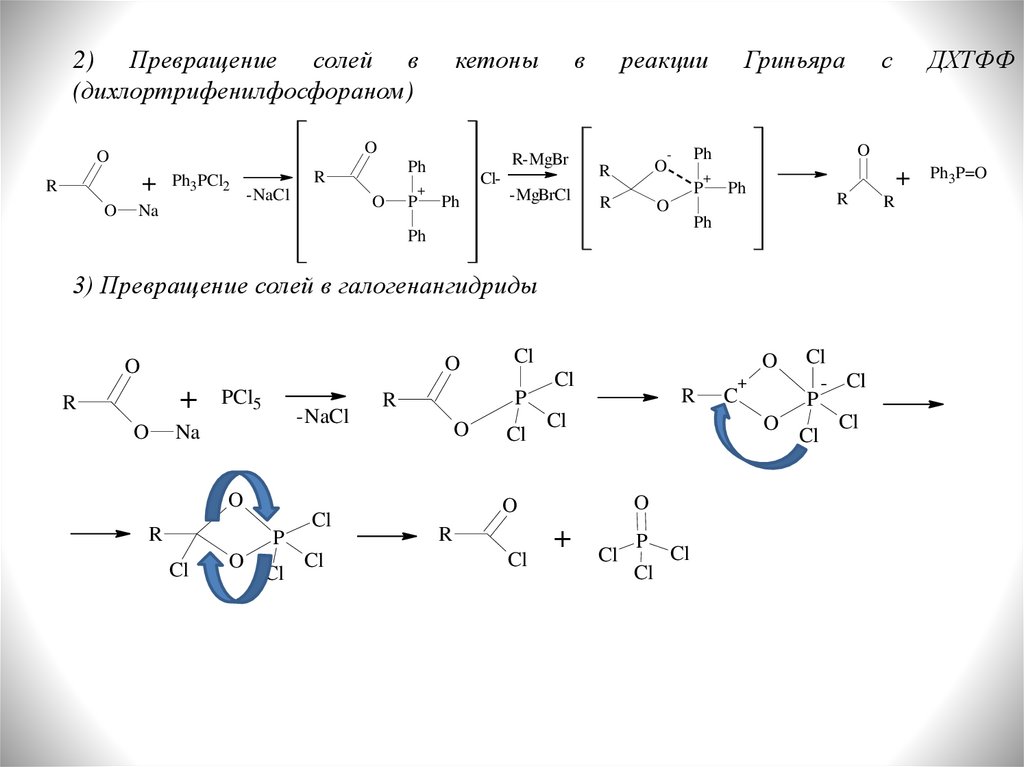
2) Превращение солей в(дихлортрифенилфосфораном)
O
O
+
R
O
кетоны
Ph3PCl2
Na
-NaCl
R-MgBr
Ph
R
O
P
+
в
ClPh
-MgBrCl
реакции
P
R
+
с
+
Ph
R
O
Ph
Ph
3) Превращение солей в галогенангидриды
O
O
+
R
O
PCl5
-NaCl
Na
P
R
O
O
R
P
Cl
O
Cl
Cl
Cl
Cl
Cl
R
Cl
O
O
R
Cl
Cl
- Cl
P
Cl
O
Cl
O
Cl
+
Cl
P
Cl
Cl
ДХТФФ
O
Ph
-
O
R
Гриньяра
+
C
R
Ph3P=O
6.
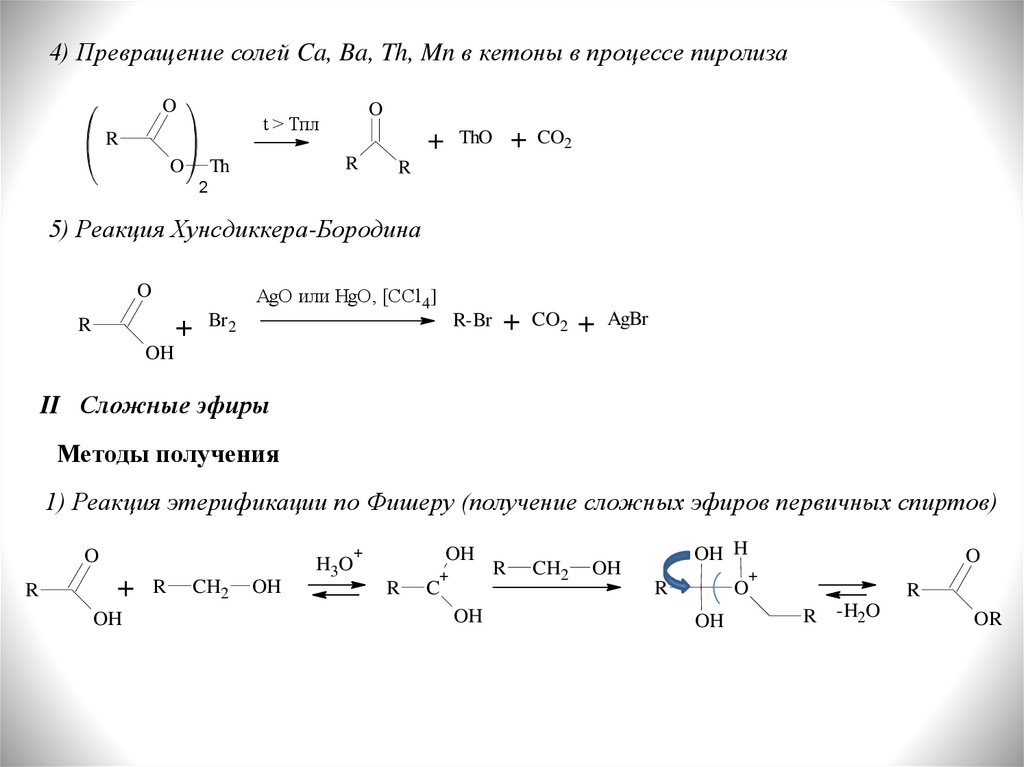
4) Превращение солей Ca, Ba, Th, Mn в кетоны в процессе пиролизаO
O
t > Tпл
R
O
+
R
Th
+
ThO
CO2
R
2
5) Реакция Хунсдиккера-Бородина
O
AgO или HgO, [CCl 4]
+
R
Br 2
R-Br
+
CO2
+
AgBr
OH
II Сложные эфиры
Методы получения
1) Реакция этерификации по Фишеру (получение сложных эфиров первичных спиртов)
O
R
+
OH
R
CH2
OH
H3 O
+
OH
R
+
C
OH
R
CH2
OH H
OH
O
+
R
O
OH
R
R -H2O
OR
7.
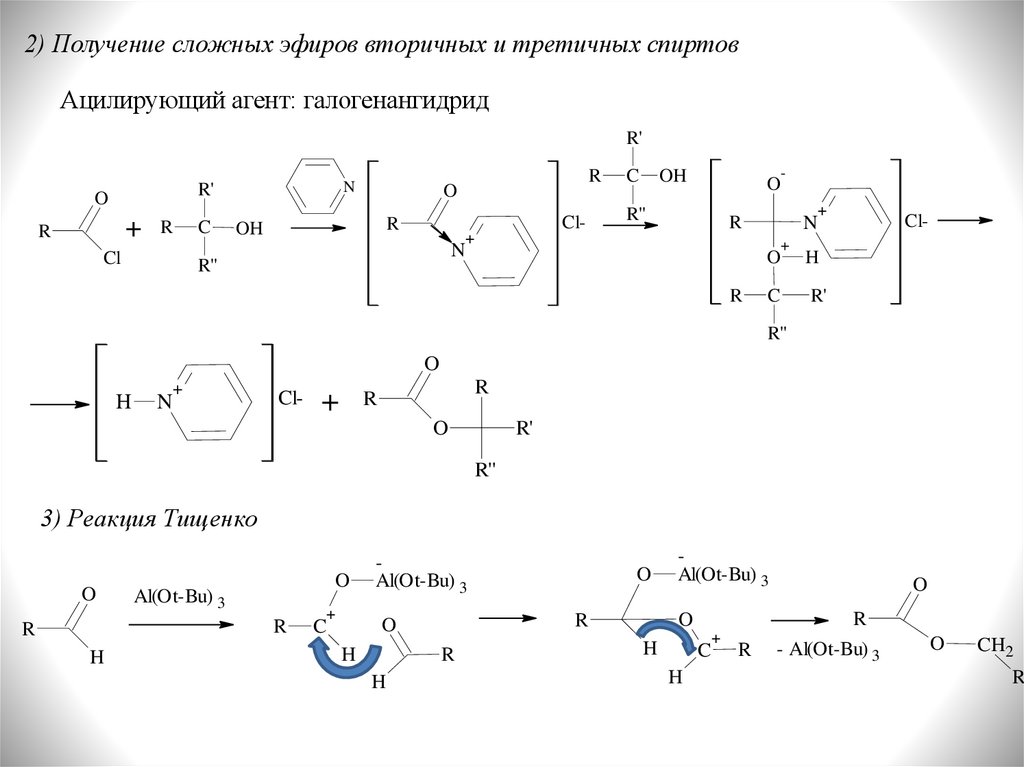
2) Получение сложных эфиров вторичных и третичных спиртовАцилирующий агент: галогенангидрид
R'
N
R'
O
+
R
R
C
Cl
R
O
R
OH
N
R''
Cl-
+
C
-
OH
O
R''
R
N
+
O
R
C
+
Cl-
H
R'
R''
O
H
+
N
Cl-
+
R
R
O
R'
R''
3) Реакция Тищенко
O
O
Al(Ot-Bu) 3
R
R
H
+
Al(Ot-Bu) 3
H
R
H
+
H
C
H
O
R
O
R
O
C
O
Al(Ot-Bu) 3
R
- Al(Ot-Bu) 3
O
CH2
R
8.
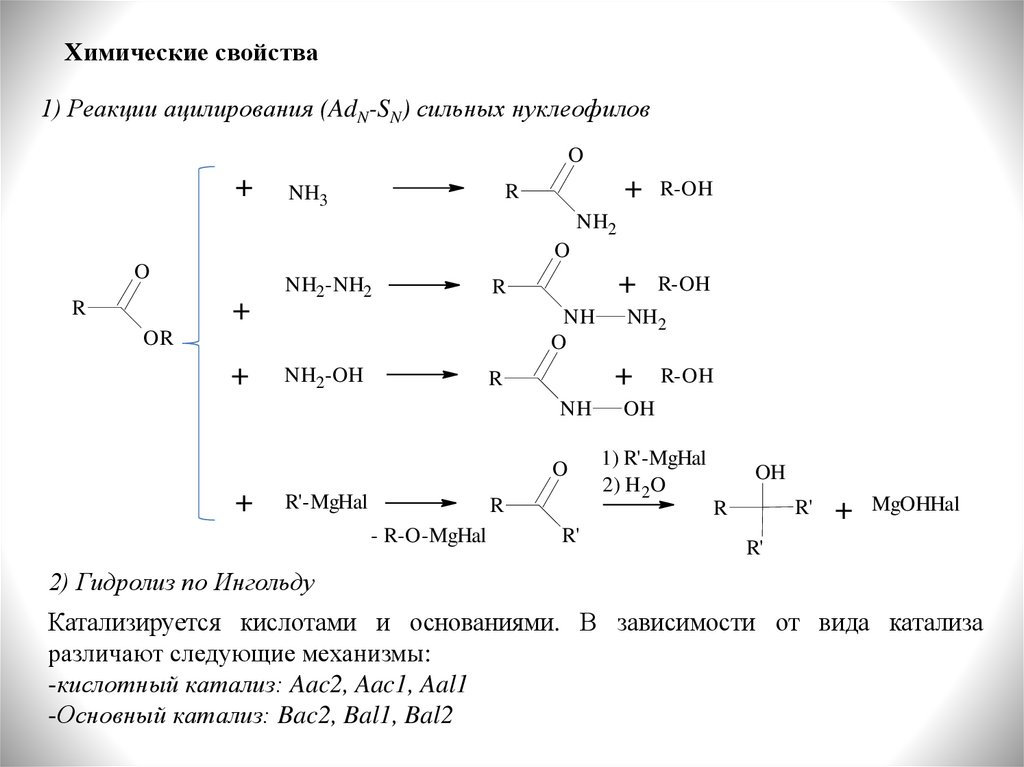
Химические свойства1) Реакции ацилирования (AdN-SN) сильных нуклеофилов
O
+
+
R
NH3
R-OH
NH2
O
O
+
R
NH2-NH2
NH
O
OR
+
+
R
NH2-OH
NH
O
+
R'-MgHal
R
- R-O-MgHal
NH2
+
R
R'
R-OH
R-OH
OH
1) R'-MgHal
2) H 2O
OH
R'
R
+
MgOHHal
R'
2) Гидролиз по Ингольду
Катализируется кислотами и основаниями. В зависимости от вида катализа
различают следующие механизмы:
-кислотный катализ: Aac2, Aac1, Aal1
-Основный катализ: Bac2, Bal1, Bal2
9.
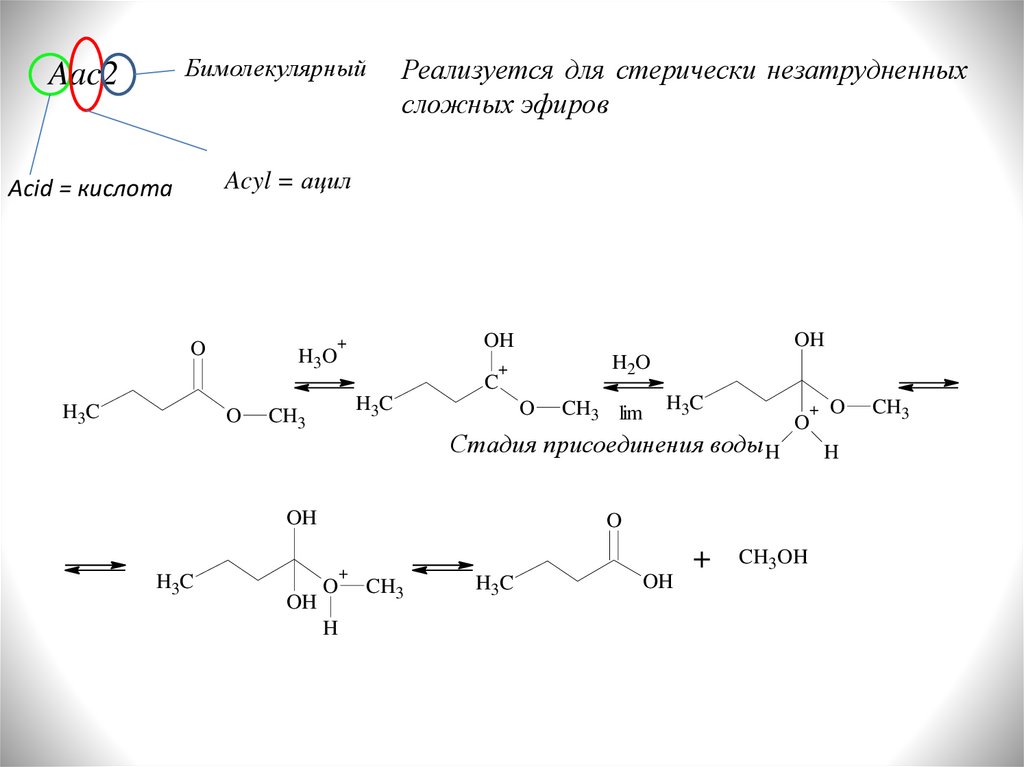
БимолекулярныйAac2
Реализуется для стерически незатрудненных
сложных эфиров
Acyl = ацил
Acid = кислота
O
H3O
OH
OH
+
H2O
+
C
H3C
O
H3C
CH3
O
+
O
O
+
OH
H3C
Стадия присоединения воды H
OH
H3C
CH3 lim
O
H
CH3
H3C
OH
+
CH3OH
O
H
CH3
10.
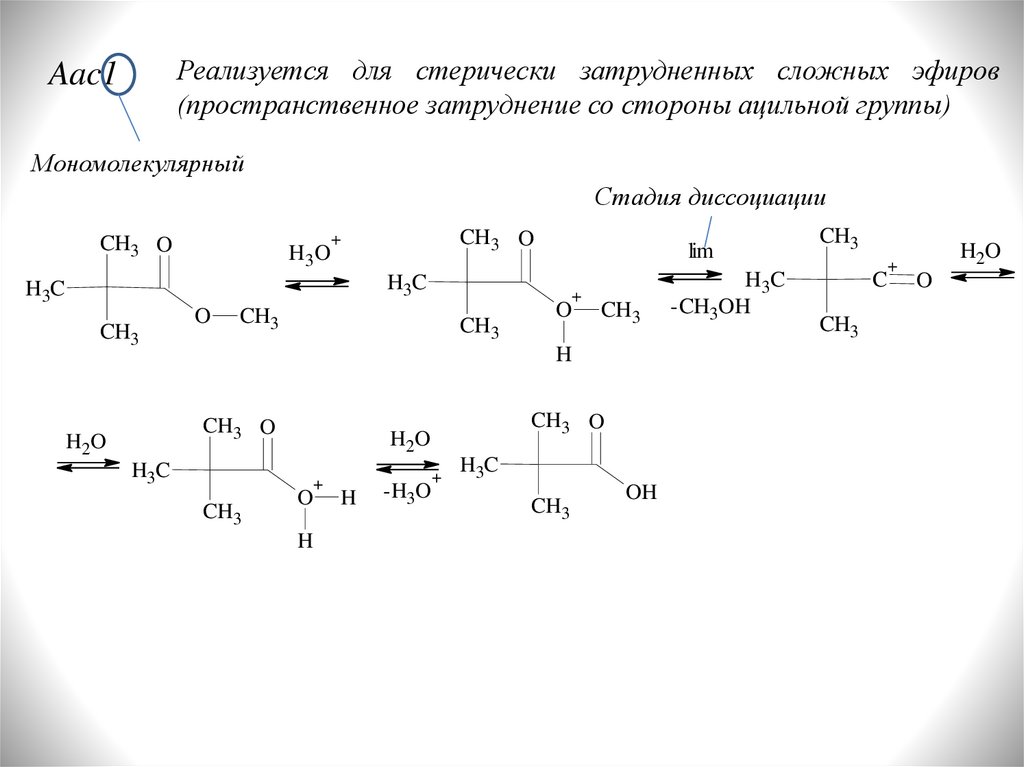
Реализуется для стерически затрудненных сложных эфиров(пространственное затруднение со стороны ацильной группы)
Aac1
Мономолекулярный
Стадия диссоциации
CH3 O
H3O
CH3 O
+
lim
H3C
H3C
CH3
O
CH3
CH3
O
CH3
H
CH3 O
H2O
+
H3C
+
CH3
CH3 O
H2O
O
H
H
-H3O
+
H3C
CH3
OH
H3C
-CH3OH
CH3
+
C
CH3
H2O
O
11.
Реализуется для стерически затрудненных сложных эфиров(пространственное затруднение со стороны алкокси-группы)
Aal 1
Расщепление по алкокси-группе
Стадия диссоциации
O
H3 O
CH3
H3C
O
+
O
CH3
H3C
O
CH3
CH3
O
H3C
+
CH3
H3 C
+
OH
+
C
CH3
H3O
O
CH3
H
CH3
CH3
H3 C
-H2O
CH3
O
+
lim
CH3
CH3
CH3
lim
H
O
+
+
OH
HO
CH3
CH3
12.
Реализуется для стерически незатрудненных сложныхэфиров
Bac2
Basic = основный
Стадия присоединения гидроксила
O
O
OHH3C
O
Метилбутират
CH3
O
lim H3C
OH
O
H3C
-
O
+
CH3OH
CH3
O
H3C
OH
+
CH3O-
13.
Реализуется для стерически затрудненных сложных эфиров(пространственное затруднение со стороны алкокси-группы)
Bal 1
Расщепление по алкокси-группе
O
CH3
H3C
O
CH3
CH3
O
lim
+
+
H3C
C
OH
O
OHCH3
H3C
CH3
+
-
HO
O
CH3
CH3
CH3
CH3
Трет-бутилпропионат
Bal2
Реализуется для стерически затрудненных сложных эфиров
(пространственное затруднение со стороны ацильной группы)
CH3 O
CH3 O
OH-
H3C
H3C
H3C
CH3
O
CH3
Метил-нео-валерат
O
lim
CH3
O
CH3
OH-
-
O
+
CH3OH
14.
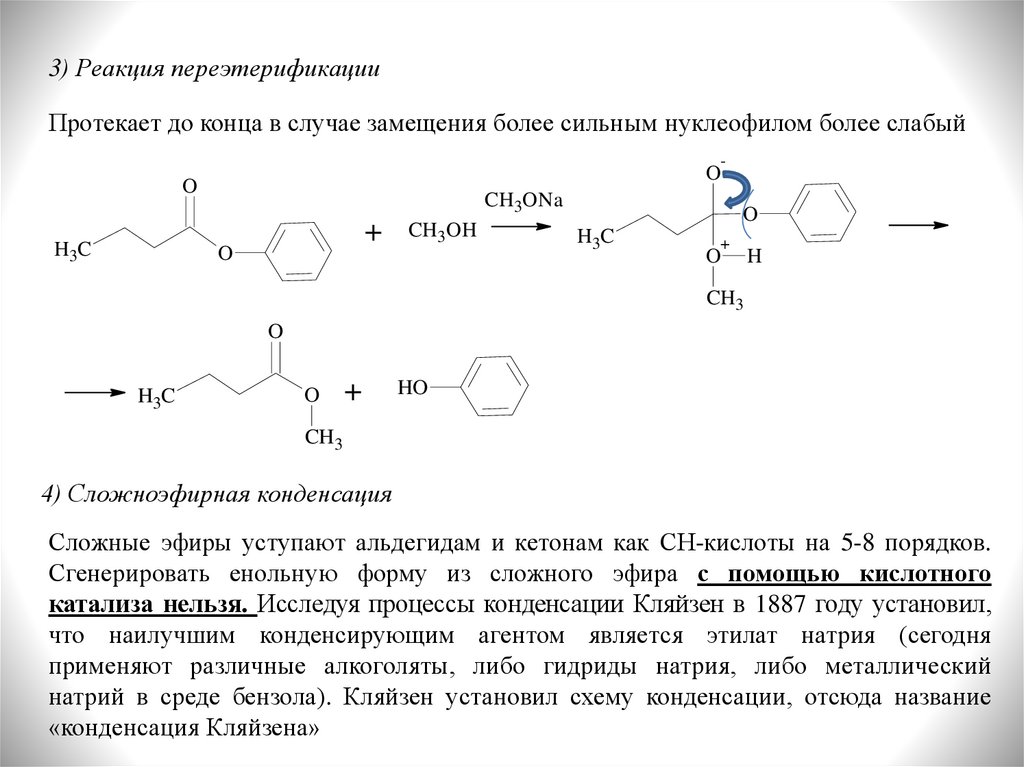
3) Реакция переэтерификацииПротекает до конца в случае замещения более сильным нуклеофилом более слабый
-
O
O
H3C
CH3ONa
+
O
CH3OH
O
H3C
+
O
H
CH3
O
H3C
O
+
HO
CH3
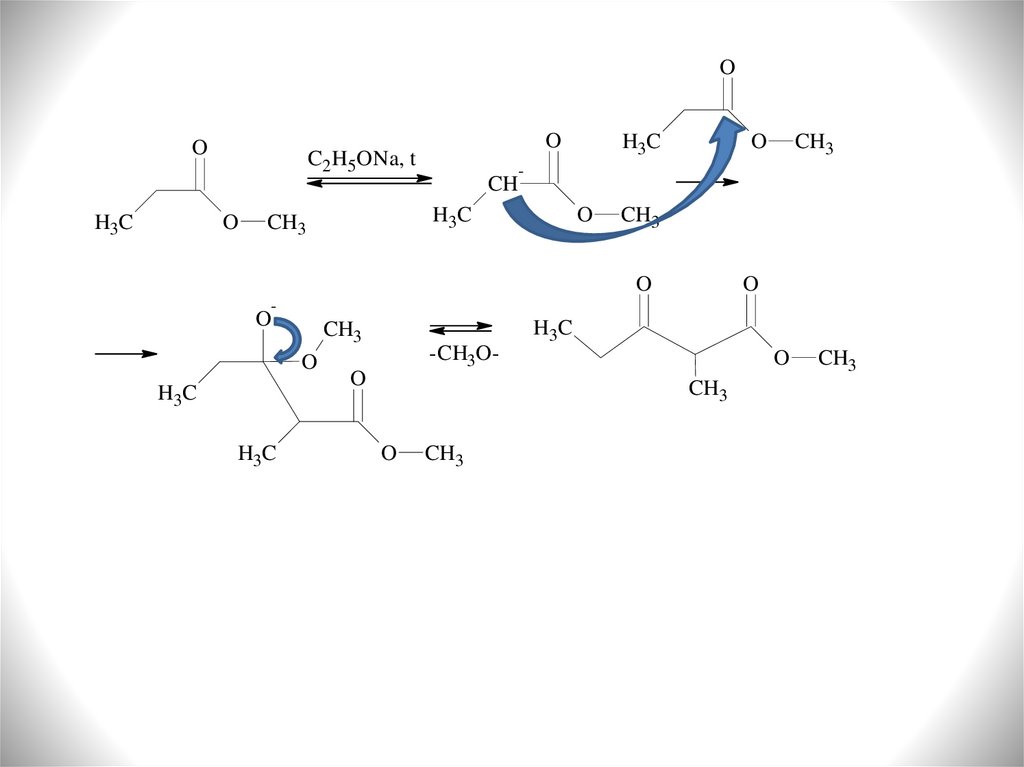
4) Сложноэфирная конденсация
Сложные эфиры уступают альдегидам и кетонам как СН-кислоты на 5-8 порядков.
Сгенерировать енольную форму из сложного эфира с помощью кислотного
катализа нельзя. Исследуя процессы конденсации Кляйзен в 1887 году установил,
что наилучшим конденсирующим агентом является этилат натрия (сегодня
применяют различные алкоголяты, либо гидриды натрия, либо металлический
натрий в среде бензола). Кляйзен установил схему конденсации, отсюда название
«конденсация Кляйзена»
15.
OO
O
C2H5ONa, t
H3C
O
CH3
-
CH
H3C
O
H3C
CH3
O
CH3
O
O
-
O
O
H3C
H3C
H3C
CH3
-CH3O-
O
O
CH3
O
CH3
CH3
16.
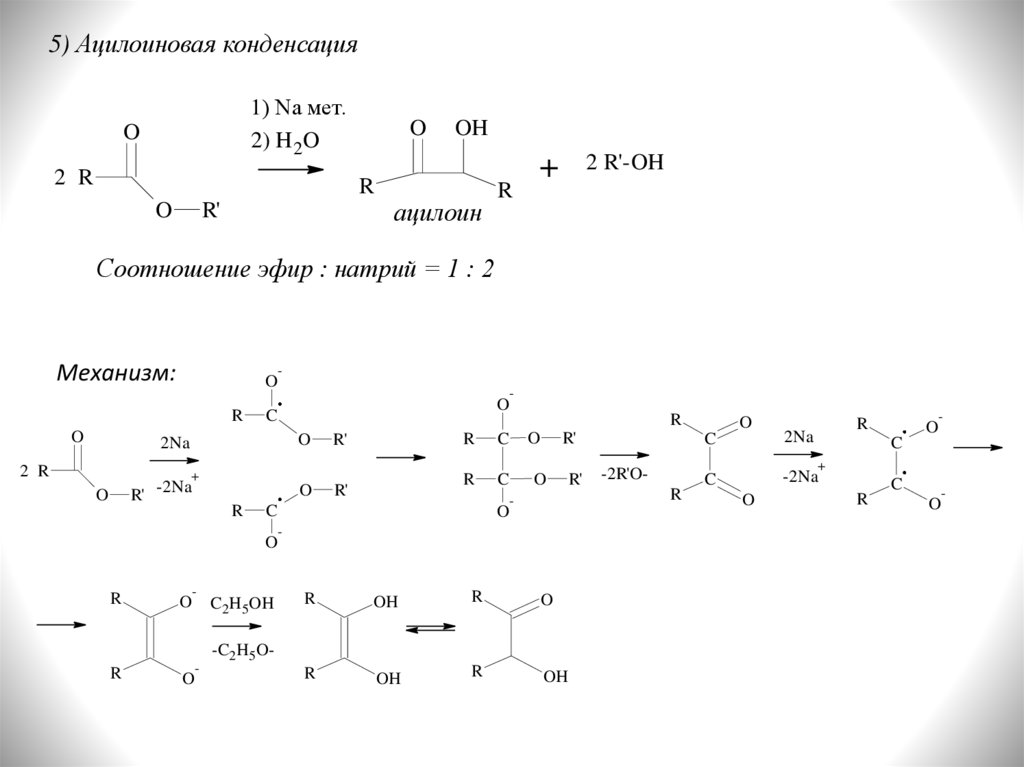
5) Ацилоиновая конденсация1) Na мет.
2) H 2O
O
2 R
O
R
O
R'
OH
ацилоин
R
+
2 R'-OH
Соотношение эфир : натрий = 1 : 2
Механизм:
-
O
R
O
O
2Na
2 R
-
O
C
R'
+
O
R'
-2Na
O
R
R'
R
C
R
C
R
O
R'
O
O
-
O
R
-
O
C2H5OH
R
OH
R
O
R
OH
R
OH
-C2H5OR
-
O
-
R
C
2Na
C
-2Na
O
C
+
-2R'OR
-
C
R'
O
O
R
C
-
O
17.
6) Восстановление сложных эфирова) Восстановление по Буво-Блану
Условия проведения реакции похожи на ацилоиновую конденсацию, но для
восстановление требуется избыток натрия и среда – этиловый спирт
-
1) Na мет. (изб)
O
R
+
R
-2Na
O
O
-
R
+
-2Na
-
O
O
R HC
C
R'
3) Na мет. (изб)
-
-
2) С 2Н5ОН
O
R'
-C2H5O-
O
R'
4) 2 С2Н5ОН
O
C
R
-2 C2H5O-
H
CH2
OH
R'-OH
+
б) Восстановление с Li[AlH4]
1) Li[AlH 4]
2) H 2O
O
R
O
R'
R
CH2
OH
+
LiOH
+
Al(OH) 3
- R'O-
R
C
3) Na мет. (изб)
+
H
-2Na
18.
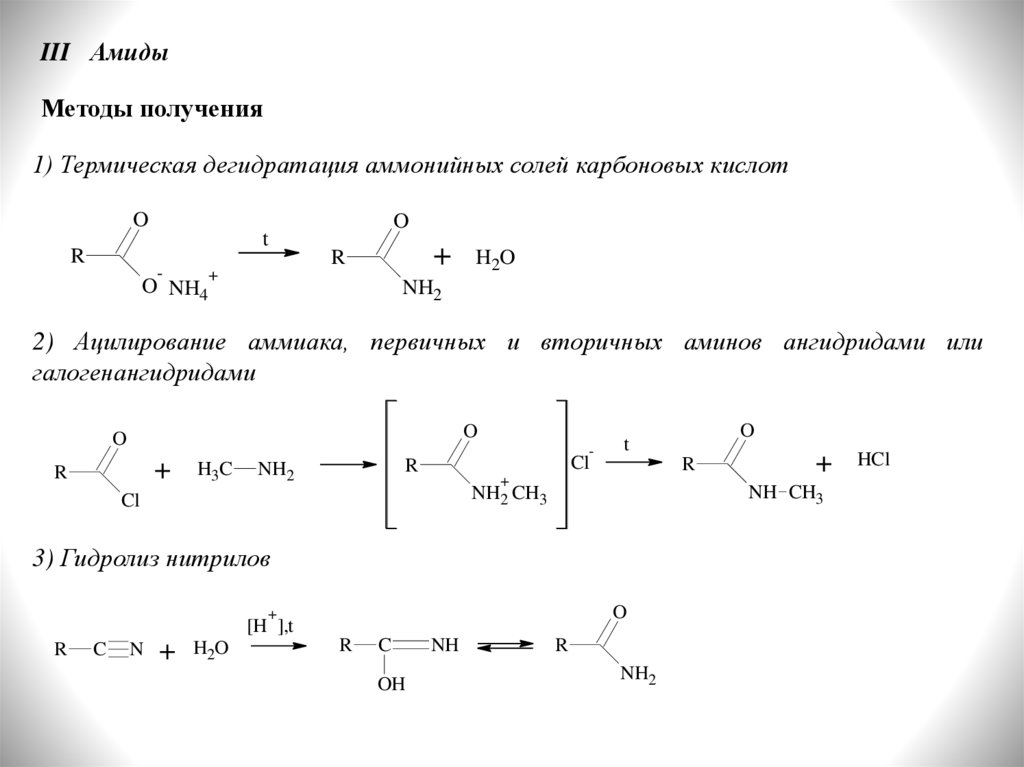
III АмидыМетоды получения
1) Термическая дегидратация аммонийных солей карбоновых кислот
O
t
R
-
O NH4
+
O
+
R
H2O
NH2
2) Ацилирование аммиака, первичных и вторичных аминов ангидридами или
галогенангидридами
O
O
+
R
H3C
-
Cl
R
NH2
R
+
3) Гидролиз нитрилов
O
+
[H ],t
R
C
N
+
H2O
R
C
OH
NH
+
NH CH3
NH2 CH3
Cl
O
t
R
NH2
HCl
19.
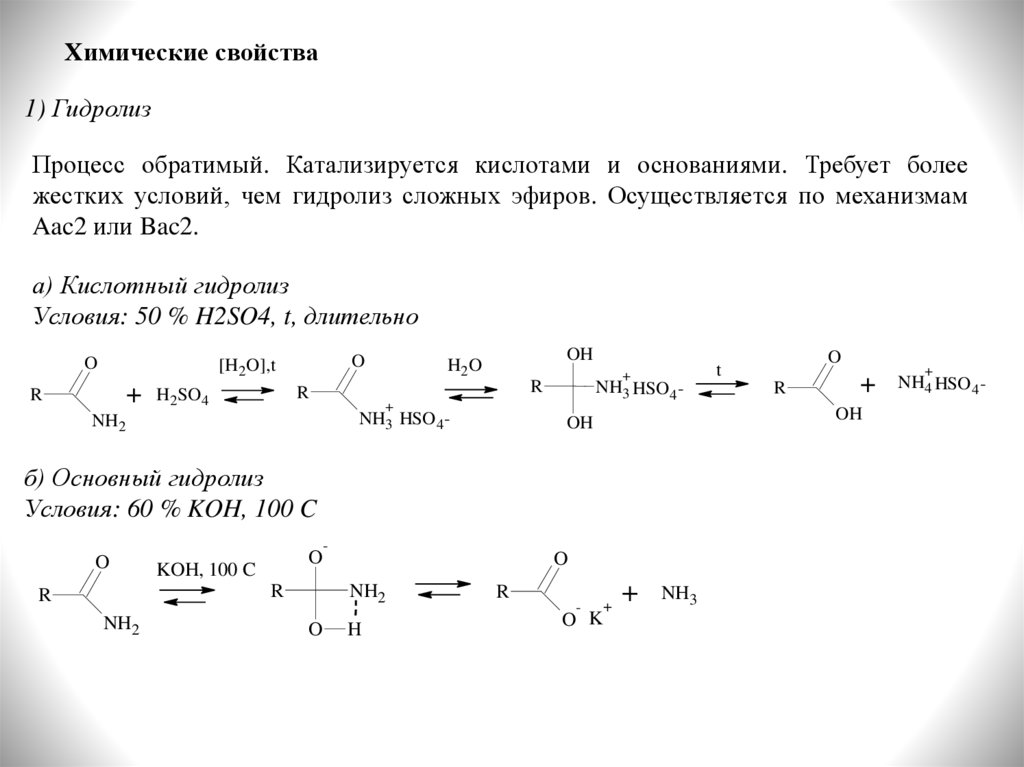
Химические свойства1) Гидролиз
Процесс обратимый. Катализируется кислотами и основаниями. Требует более
жестких условий, чем гидролиз сложных эфиров. Осуществляется по механизмам
Aac2 или Bac2.
а) Кислотный гидролиз
Условия: 50 % H2SO4, t, длительно
O
O
[H 2O],t
+
R
+
NH3 HSO 4-
R
R
H2SO4
OH
H2O
+
NH3 HSO 4-
NH2
-
O
KOH, 100 C
R
R
NH2
O
NH2
O
H
R
-
R
+
OH
OH
б) Основный гидролиз
Условия: 60 % KOH, 100 C
O
O
t
+
O K
+
NH3
+
NH4 HSO 4-
20.
2) Реакция ГриньяраO
O
+
R
R'
Mg Br
R
- R'H
NH Mg Br
OH
R
- 2 MgOHBr
O
Mg Br
R
NH2
H2O
R'
Mg Br
NH Mg Br
H2O
- 2 MgOHBr
R'
O
t
+
NH2
R
R'
NH3
R'
3) Дегидратация под действием POCl3 или SOCl2
-
Cl
O
O
+
R
NH2
SOCl2
R
O
S
+
C ..
N
O
O
Cl
H
R
- HCl
S
Cl
..
N
R
C ..N
+
SO2
H
H
Вторичные амиды образуют устойчивые имидоилхлориды, распадающиеся на
нитрил и алкилгалогенид при температурах более 150 С:
+
HCl
21.
-Cl
O
O
+
R
SOCl2
R
NH
O
S
+
C ..
N
O
O
Cl
H
150 C
Cl
R
..
N
- HCl
R
R
..
N
- SO2
C ..N
+
R'-Cl
R'
R'
R'
R'
Cl
S
имидоилхлорид
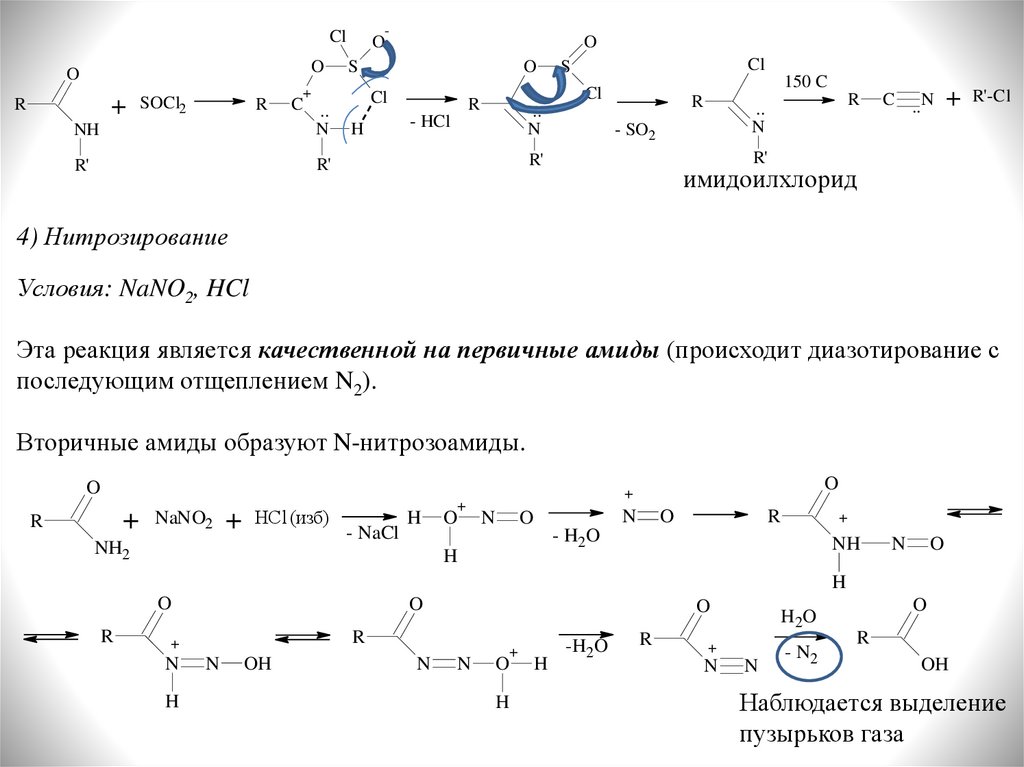
4) Нитрозирование
Условия: NaNO2, HCl
Эта реакция является качественной на первичные амиды (происходит диазотирование с
последующим отщеплением N2).
Вторичные амиды образуют N-нитрозоамиды.
O
+
R
NaNO2
+
HCl (изб)
NH2
- NaCl
H
+
O
O
+
N
N
O
O
R
+
- H2O
H
NH
N
O
H
O
R
O
R
+
N
H
O
N
OH
N
N
+
O
H
H
-H2O
R
H2 O
+
N
N
- N2
O
R
OH
Наблюдается выделение
пузырьков газа
22.
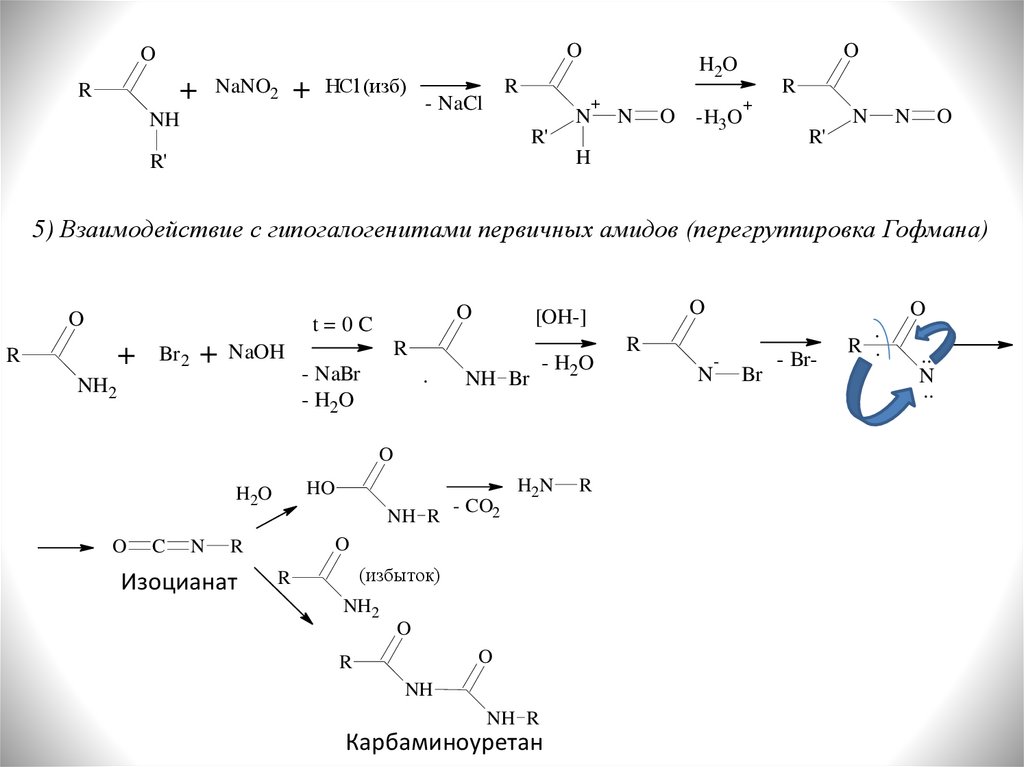
OO
+
R
NaNO2
+
HCl (изб)
NH
R
- NaCl
N
O
H2O
+
N
R'
O
R
-H3O
+
N
N
O
R'
H
R'
5) Взаимодействие с гипогалогенитами первичных амидов (перегруппировка Гофмана)
O
O
t= 0C
+
R
Br 2
+
R
NaOH
- NaBr
- H2O
NH2
.
NH Br
- H2O
O
HO
H2O
NH R
O
C
N
Изоцианат
- CO2
H2N
O
R
(избыток)
R
NH2
O
O
R
O
[OH-]
NH
NH R
Карбаминоуретан
R
R
O
-
N
Br
- Br-
.
R .
..
N
..
23.
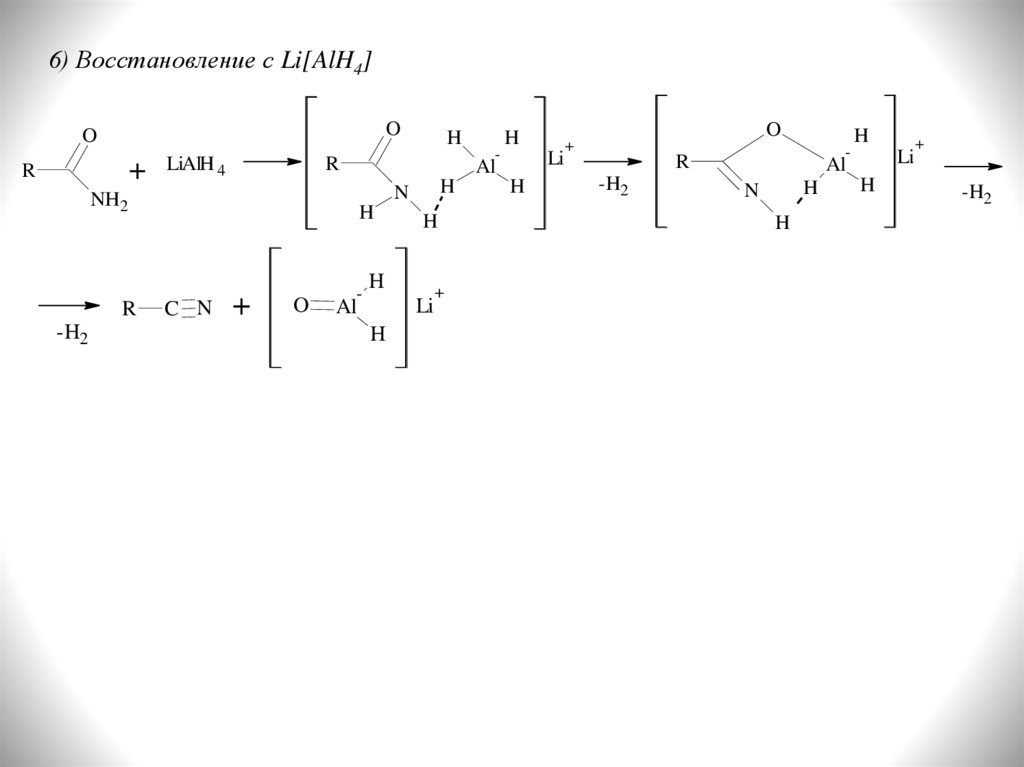
6) Восстановление с Li[AlH4]O
O
+
R
LiAlH 4
R
-H2
H
N
H
C N
+
O
-
H
Li
Al
NH2
R
H
-
H
H
Li
Al
H
+
H
O
+
-
R
-H2
H
Li
Al
H
N
H
H
+
-H2
24.
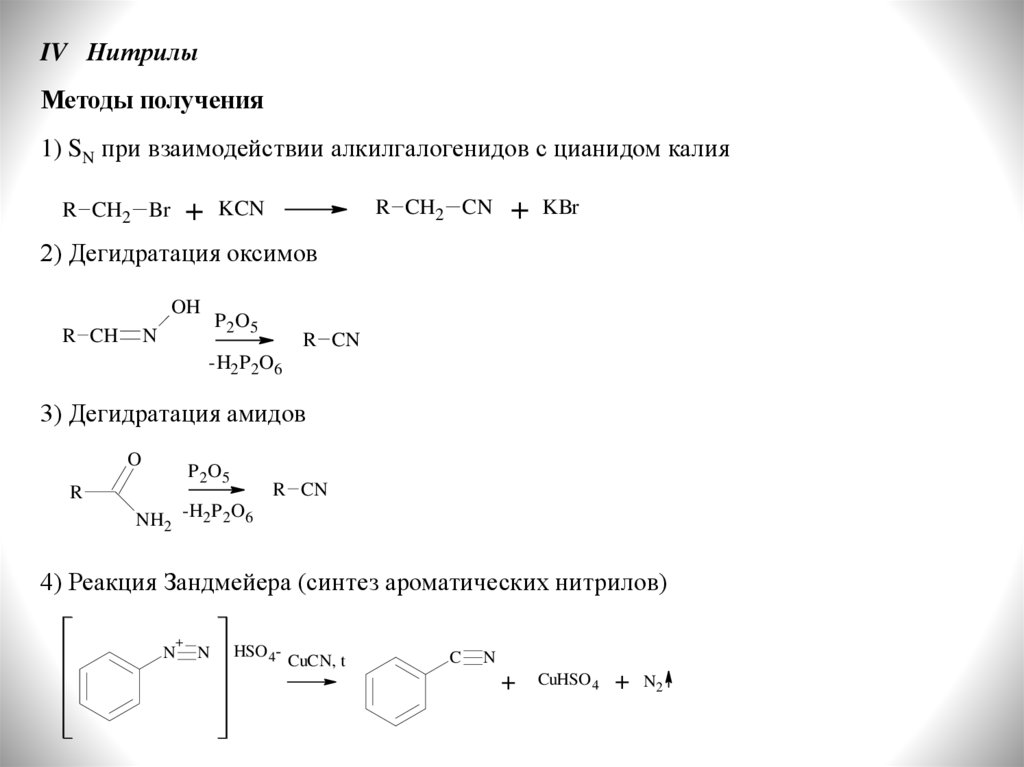
IV НитрилыМетоды получения
1) SN при взаимодействии алкилгалогенидов с цианидом калия
+
R CH2 Br
R CH2 CN
KCN
+
KBr
2) Дегидратация оксимов
OH
R CH
P2O5
N
R CN
-H2P2O6
3) Дегидратация амидов
O
P2O5
R
R CN
NH2 -H2P2O6
4) Реакция Зандмейера (синтез ароматических нитрилов)
+
N
N
HSO 4-
CuCN, t
C
N
+
CuHSO 4
+
N2
25.
Химические свойства1) Гидролиз
Процесс обратимый. Катализируется кислотами и основаниями. Требует еще более
жестких условий, чем гидролиз амидов и многочасового прогревания.
а) Кислотный гидролиз
Условия: 75 % H2SO4, t, длительно
[H2O],t
R
C
N
+
H2SO4
R
H2O
+
C
N
R
H
C
N
H
+
+
O
H3O
+
O
NH4
+
H
+
H
OH
NH2
б) Основный гидролиз
Условия: 60 % KOH, 100 C
R
C
N
KOH, 100 C [этиленгликоль]
R C
-
N
OH
O
R
O
[OH-]
R
NH2
O
-
+
NH3
C
OH
O
R
R
R
-H
HO-CH2-CH2-OH
R
- HO-CH2-CH2-O-
C
OH
NH
N
H
26.
2) Реакция Гриньяра[эфир]
R
C
N
+
R'
Mg Br
R
AdE
C
N
Mg Br
O
OH
R
C
R
-MgOHBr
R'
H2O
H2O
NH2
R
R'
+
C
NH
H2O
R'
NH3
R'
3) Восстановление с Li[AlH4]
2 R
H2O
C
N
2R
+
LiAlH 4
CH2
NH2
R
+
LiOH
+
CH2
N
Al(OH) 3
-
Al
N
CH2 R
Li
+
H2O
27.
V АнгидридыМетоды получения
1) Ацилирование карбоновых кислот и их солей галогенангидридами
O
N
O
O
+
H3C
t
H3C
R
Cl
OH
-
+
N H
O
-
R
Cl
O
2) Ацилирование карбоновых кислот кетенами
R
O
C
+
H3C
OH
R
R
O
R'
C
R'
R
C
O
R'
O
H
C
R'
O
O
O
H3C
OH
O
O
H3C
H3C
C
O
Химические свойства
1) Ацилирование нуклеофилов
Для взаимодействия со слабыми нуклеофилами
минеральными кислотами (создается слабо кислая среда)
требуется
активация
28.
OHO
H
C
H
O
H3C
+
H3C
H
+
+
C
OH
HO
CH3
H
C
C
H3C
O
H3C
C
O
2) Гидролиз
O
C
H3 C
H3O
O
H3 C
C
O
Ацетилбутаноат =
бутаноилацетат
+
O
O
+
C
H3 C
OH
H3 C
O
C
O
C
O
Ацетилформиат =
формилацетат
O
CH3
H
O
O
OH
O
C
OH
+
CH3
H3C
C
OH
29.
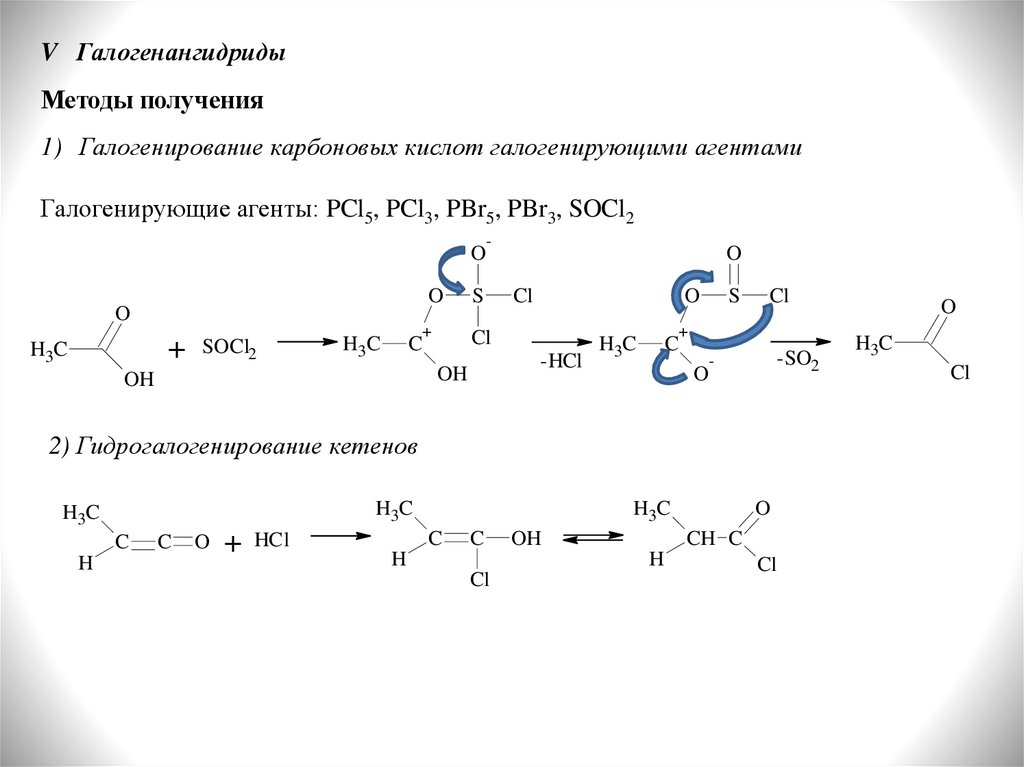
V ГалогенангидридыМетоды получения
1) Галогенирование карбоновых кислот галогенирующими агентами
Галогенирующие агенты: PCl5, PCl3, PBr5, PBr3, SOCl2
-
O
O
O
+
H3C
SOCl2
+
H3C
S
Cl
O
Cl
C
-HCl
OH
OH
O
S
Cl
+
H3C
C
-SO2
-
O
2) Гидрогалогенирование кетенов
H3C
H3C
C
H
C
O
+
C
HCl
O
H 3C
C
H
OH
CH C
H
Cl
Cl
O
H3C
Cl
30.
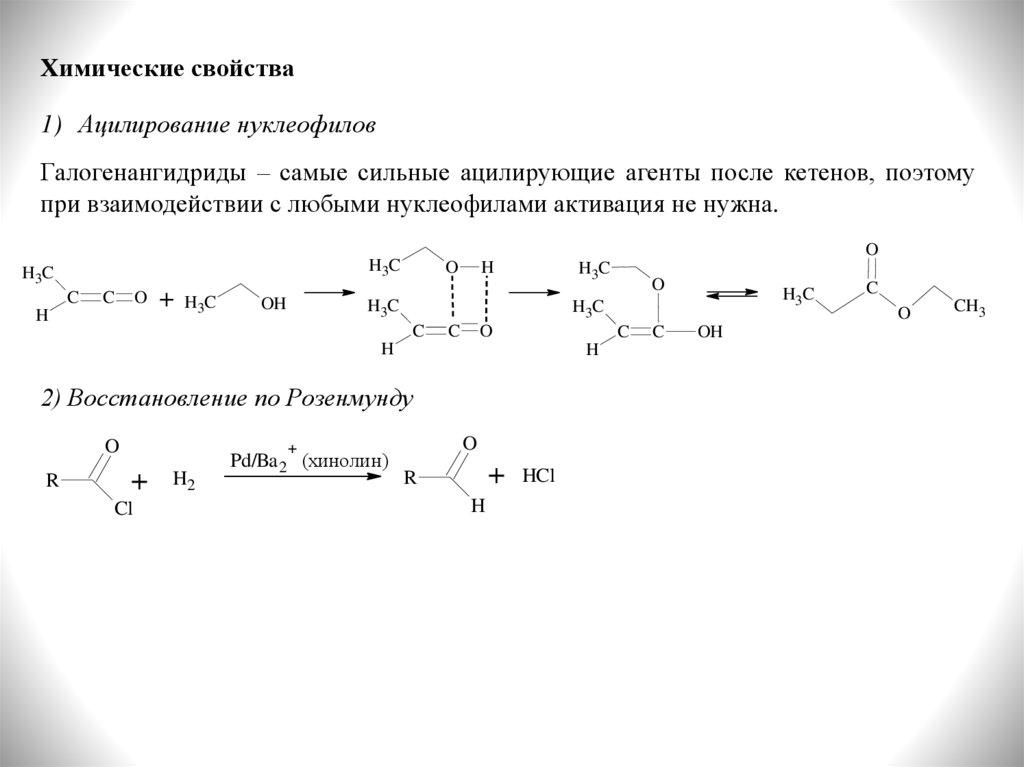
Химические свойства1) Ацилирование нуклеофилов
Галогенангидриды – самые сильные ацилирующие агенты после кетенов, поэтому
при взаимодействии с любыми нуклеофилами активация не нужна.
O
H3C
H3C
C
C
O
H
+
H3C
OH
O
H
H3C
H3C
C
C
O
C
H
2) Восстановление по Розенмунду
R
O
+
+
Cl
H2
Pd/Ba 2 (хинолин)
H3C
H3C
H
O
O
+
R
H
HCl
C
OH
C
O
CH3












 chemistry
chemistry








