Similar presentations:
Карбоновые кислоты
1.
ЛЕКЦИЯ«Карбоновые кислоты»
Лектор: старший преподаватель
Оренбургского государственного университета,
канд. хим. наук
Строганова Елена Алексеевна
2.
Карбоновые кислоты – органические соединения, имеющие вкачестве старшей функциональной группы группу -СOOH
Ацильный атом кислорода
O
R
Ацильная группа
Ацильный атом углерода
C
O
H
Ацилоксигруппа
Классификация :
По природе остова (ранжирование по ряду): - алифатические
- ароматические
- алициклические
По насыщенности углеродного скелета: - предельные алифатические
- непредельные алифатические
По количеству функциональных групп: - дикарбоновые
- трикарбоновые и т.д.
По наличию гетерофункциональных групп: - оксикислоты (гидроксокислоты)
- оксокислоты (кето-, альдокислоты)
- аминокислоты
- галогенкислоты
3.
Номенклатура:1. Систематическая
Заместители с указанием местоположения (по возрастанию позиции) + корень
названия углеводорода основной цепи + суффикс «ов» + окончание «ая» + кислота
(нумерация начинается всегда с карбоксильной группы);
Примечание:
1) В случаях, когда карбоксильна группа связана с алициклом, после названия цикла
в конце добавляют «карбоновая кислота».
2) В случаях, когда в веществе 3 и более карбоксильных групп, к общему названию
одну или две из них называют в префиксе «карбокси»
6
H3C
ex:
5
2'
H3C
4
1'
CH3
O
HO
2
3
1
4-(1’-метилэтил)гексен-4-овая кислота
OH
5
6
4
O
1
3
2
Метилен-
O
O
OH
2-карбоксиметилен-1,4-бензолдикарбоновая кислота
OH
Карбокси-
4.
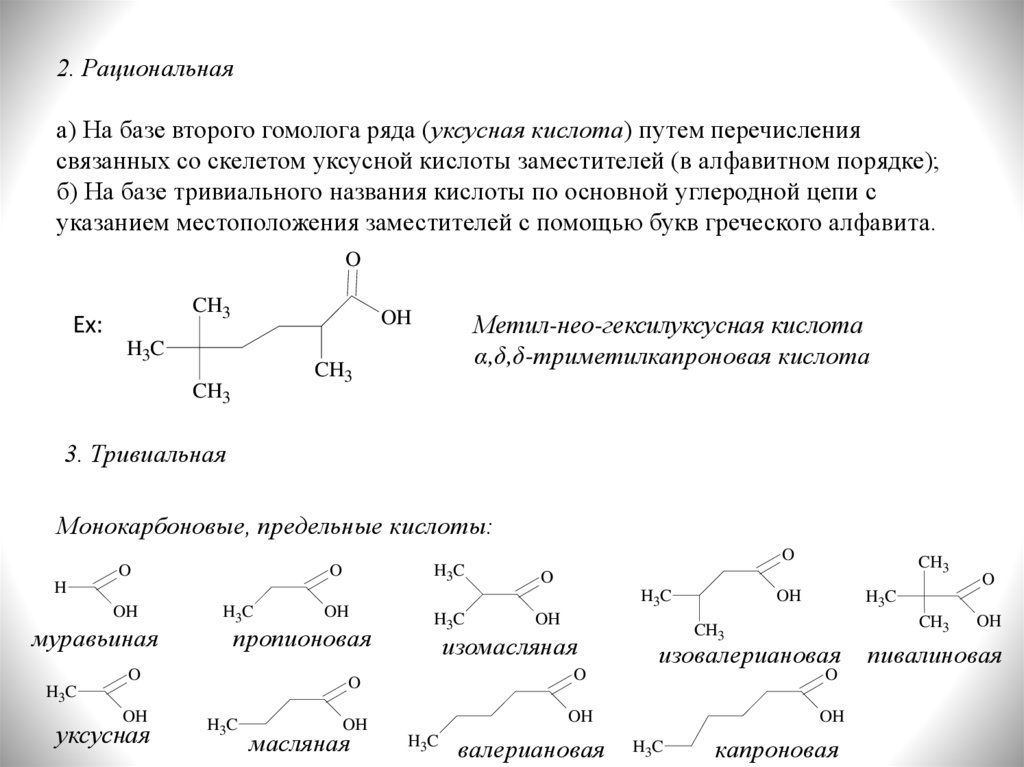
2. Рациональнаяа) На базе второго гомолога ряда (уксусная кислота) путем перечисления
связанных со скелетом уксусной кислоты заместителей (в алфавитном порядке);
б) На базе тривиального названия кислоты по основной углеродной цепи с
указанием местоположения заместителей с помощью букв греческого алфавита.
O
CH3
Ex:
OH
H3C
Метил-нео-гексилуксусная кислота
α,δ,δ-триметилкапроновая кислота
CH3
CH3
3. Тривиальная
Монокарбоновые, предельные кислоты:
O
O
H3C
O
H
OH
муравьиная
H3C
пропионовая
O
H3C
OH
уксусная
OH
H3C
H3C
H3C
CH3
O
OH
изомасляная
OH
CH3
CH3
изовалериановая
O
O
O
OH
OH
OH
масляная
H3C
валериановая
H3C
O
H3C
капроновая
OH
пивалиновая
5.
Монокарбоновые, непредельные:O
H2C
OH
акриловая
H3C
O
O
H3C
O
OH
H2C
OH
кротоновая
метакриловая
OH
коричная
Карбоновые кислоты жирного ряда (жирные кислоты = неразветвленные,
алифатические, с четным количеством атомов углерода): CH3-(CH2)n-COOH
n
Название
Формула
2
Масляная
С3Н7-СООН
4
Капроновая
С5Н11-СООН
6
Каприловая
С7Н15-СООН
8
Каприновая
С9Н19-СООН
10
Лауриновая
С11Н23-СООН
12
Миристиновая
С13Н27-СООН
14
Пальмитиновая
С15Н31-СООН
16
Стеариновая
С17Н35-СООН
18
Арахинговая
С19Н39-СООН
6.
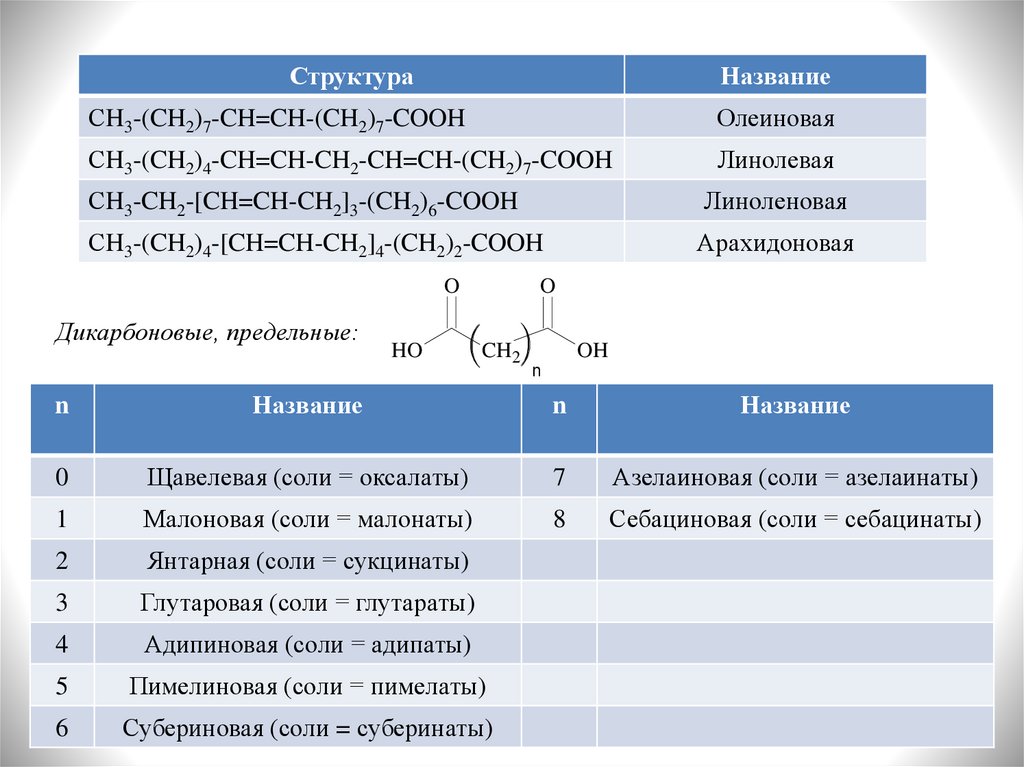
СтруктураНазвание
СH3-(CH2)7-CH=CH-(CH2)7-COOH
Олеиновая
СH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH
Линолевая
СH3-CH2-[CH=CH-CH2]3-(CH2)6-COOH
Линоленовая
СH3-(CH2)4-[CH=CH-CH2]4-(CH2)2-COOH
Арахидоновая
O
Дикарбоновые, предельные:
HO
O
CH2
OH
n
n
Название
n
Название
0
Щавелевая (соли = оксалаты)
7
Азелаиновая (соли = азелаинаты)
1
Малоновая (соли = малонаты)
8
Себациновая (соли = себацинаты)
2
Янтарная (соли = сукцинаты)
3
Глутаровая (соли = глутараты)
4
Адипиновая (соли = адипаты)
5
Пимелиновая (соли = пимелаты)
6
Субериновая (соли = суберинаты)
7.
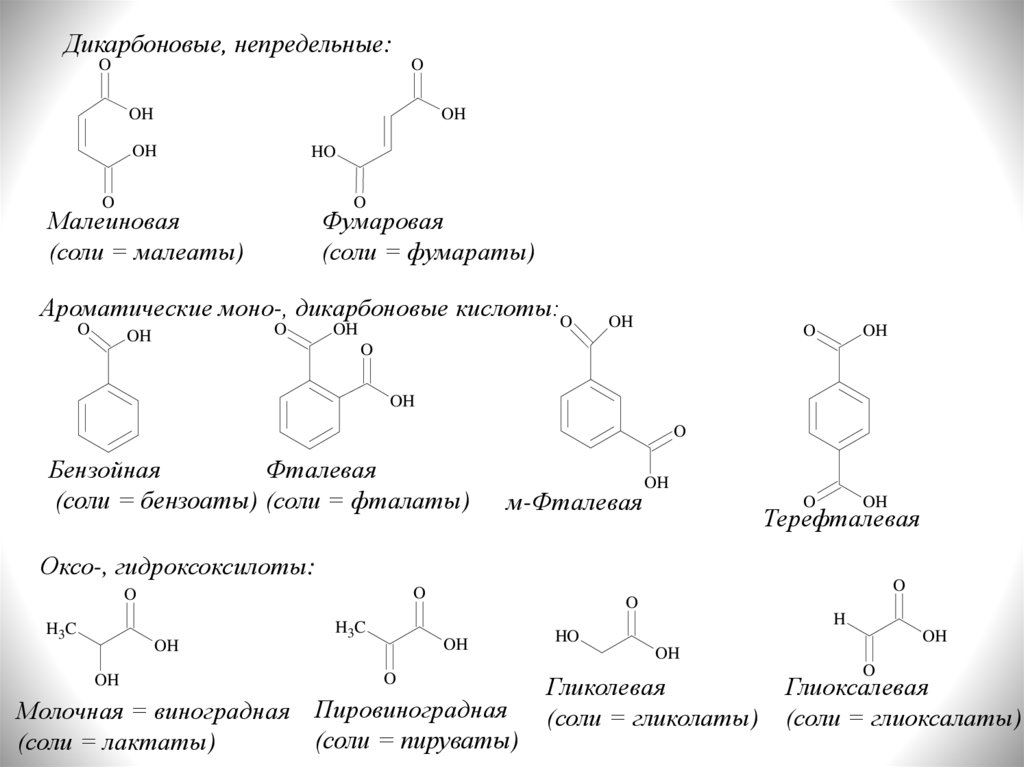
Дикарбоновые, непредельные:O
O
OH
OH
OH
HO
O
O
Малеиновая
(соли = малеаты)
Фумаровая
(соли = фумараты)
Ароматические моно-, дикарбоновые кислоты:O
O
O
OH
OH
OH
O
OH
O
OH
O
OH
O
Фталевая
Бензойная
(соли = бензоаты) (соли = фталаты)
м-Фталевая
OH
Терефталевая
Оксо-, гидроксоксилоты:
H3 C
OH
OH
O
O
O
O
H
H3 C
OH
O
Молочная = виноградная Пировиноградная
(соли = пируваты)
(соли = лактаты)
HO
OH
OH
Гликолевая
(соли = гликолаты)
O
Глиоксалевая
(соли = глиоксалаты)
8.
OO
O
OH
HO
O
O
OH
HO
OH
OH
OH
OH
O
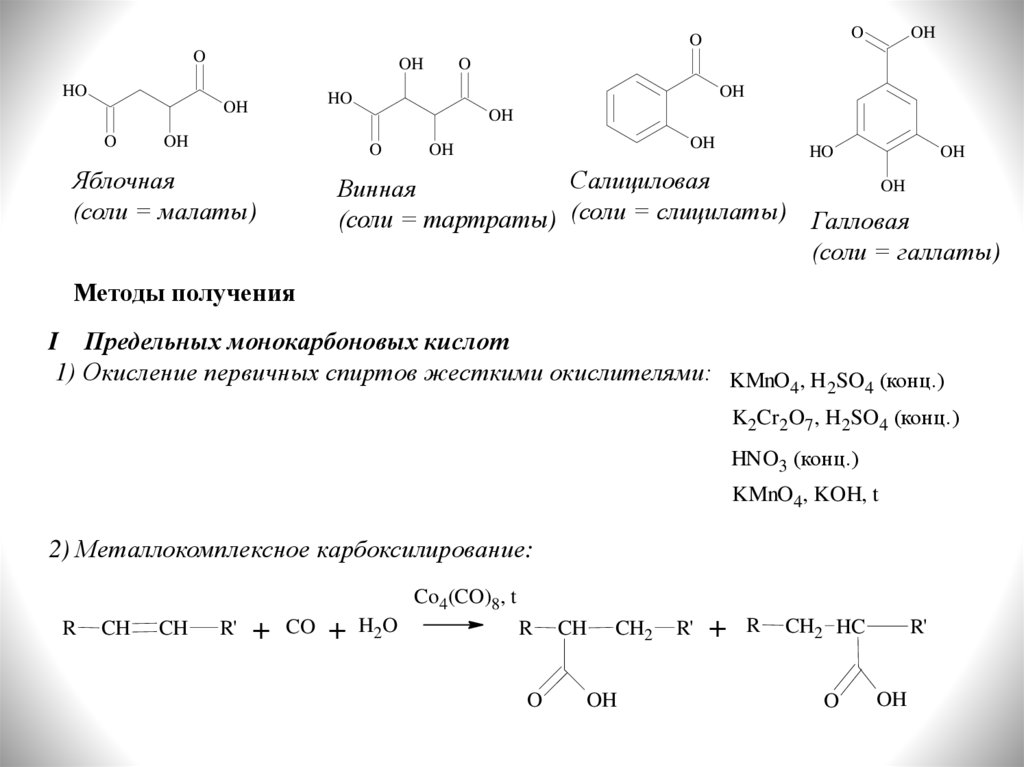
Яблочная
(соли = малаты)
OH
OH
HO
OH
Салициловая
OH
Винная
(соли = тартраты) (соли = слицилаты) Галловая
(соли = галлаты)
Методы получения
I Предельных монокарбоновых кислот
1) Окисление первичных спиртов жесткими окислителями: KMnO , H SO (конц.)
4
2
4
K2Cr2O7, H 2SO4 (конц.)
HNO3 (конц.)
KMnO4, KOH, t
2) Металлокомплексное карбоксилирование:
Co4(CO)8, t
R
CH
CH
R'
+
CO
+
H2 O
R
O
CH
CH2
OH
R'
+
R
CH2 HC
O
R'
OH
9.
3) Карбонилирование спиртов1. Na(мет.)
2. CO, CoI2
+
3. H 3O
R
+
OH
R
OH
-Na
O
4) Окисление альдегидов мягкими окислителями: CrO3, H2SO4, H2O [ацетон]
Ag 2O, H2O
NaOOC
H
O
COOK
O
= [Cu(tart Na, K) 2](OH) 2 (р-в Фелинга)
Cu
O
KOOC
O
H
[Ag(NH 3)2]OH (р-в Толленса)
COONa
5) Окислительный озонолиз непредельных углеводородов
6) Окисление кетонов жесткими окислителями
7) Синтез Гриньяра
Mg, эфир
R
Hal
O
CO2
R
MgHal
H2O
R
O
MgHal
R
-MgOHHal
O
OH
10.
8) Гидролиз производных карбоновых кислот:O
O
R
R
O
O
Met
+
R-OH
OH
O
Met
R
R
O
+
+
OH
R
O
O
R
+
R
Hal
O
HHal
OH
H3O+, t
O
O
R
O
+
R
R
OH
OH
R
O
O
R
C
N
R
+
NH4
O
R
NH2
NH4
+
OH
O
R
+
OH
+
11.
9) Гидролиз геминальных тригалогенпроизводныхCl
R
C
Cl
+
OH
H2O
3NaOH
R
C
+
OH
NaCl
OH
Cl
10) Промышленное получение муравьиной кислоты
NaOH +
+
O
100-150 C
H
CO
O
H3 O , t
O
Na
+
H
-Na
OH
11) Промышленное получение уксусной кислоты
HC
2+
H2O, Hg
H3C
CH
O
[O]
O
H3C
H
OH
12.
Непредельных монокарбоновых кислотII
1) Реакция Реформатского
R
R'
Zn(порошок), C 6H6
COOH
R
R''
COOH
O
ZnHal
Hal
R
COOH
R'
R''
H2O
-ZnOHHal
O
ZnHal
H 2O
-ZnOHHal
R
COOH H O+, t
3
R'
R''
R
COOH
R'
R''
OH
2) Циангидринный синтез
O
HCN, KCN
R
H
R'
+
+
OH
H3 O , t
H3O , t
R
R
CN
R'
CN
-H2O
R'
-NH4
+
R
O
R'
OH
13.
III Дикарбоновых кислот1) Промышленный синтез щавелевой кислоты
O
O
t > Tпл
+
O
O
H3O , t
O
+
2 H
O
Na
Na O
O
-2Na
Na
HO
OH
2) Препаративный синтез малоновой кислоты
O
а)
OH
Cl
O
NaHCO3, H 2O
O
Cl
O
KCN
Na
б)
O
H3 O , t
O
пропиолактон
O
NC
O
+
O
[O]
HO
OH
HO
+
OH
O
H3O , t
O
Na
-NH4
+
-Na
+
HO
O
OH
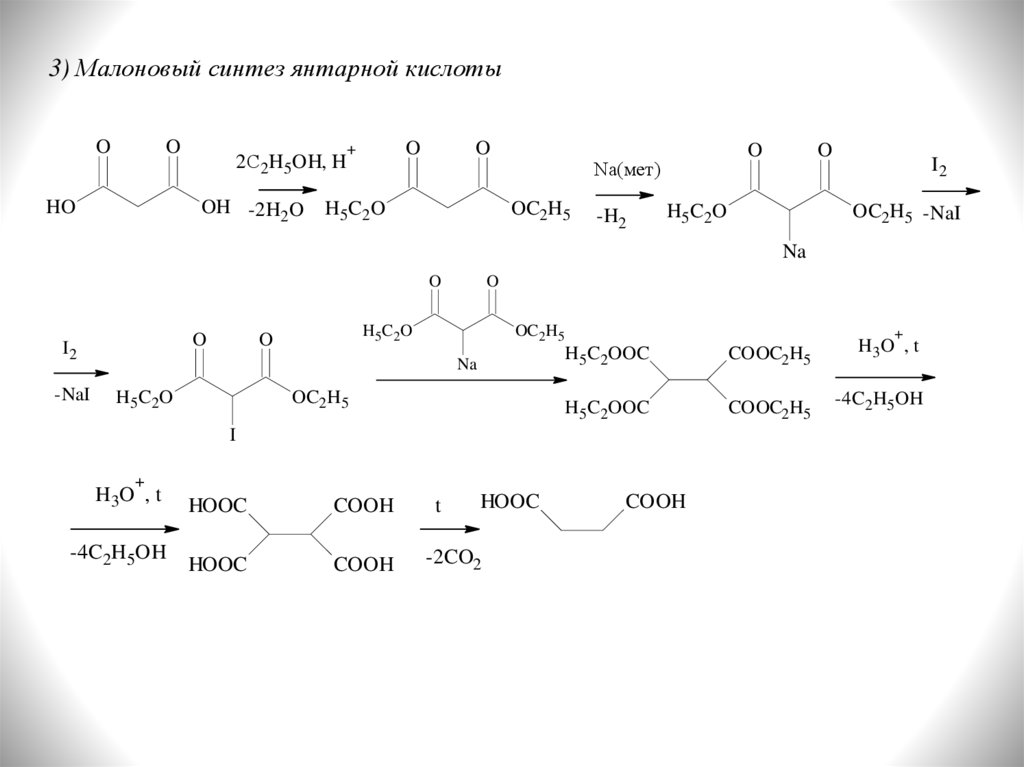
14.
3) Малоновый синтез янтарной кислотыO
O
HO
2С2H5OH, H
OH -2H2O
O
+
O
H 5 C2 O
O
Na(мет)
OC2H5
-H2
O
H 5 C2 O
I2
OC2H5 -NaI
Na
O
O
I2
-NaI
O
H5 C 2 O
O
OC2H5
Na
H 5 C2 O
OC2H5
+
H5C2OOC
COOC2H5
H3 O , t
H5C2OOC
COOC2H5
-4C2H5OH
I
+
H3 O , t
HOOC
COOH
-4C2H5OH
HOOC
COOH
t
HOOC
-2CO2
COOH
15.
3) Малоновый синтез других дикарбоновых кислотO
O
HO
2С2H5OH, H
OH -2H2O
O
+
H5 C2 O
O
O
Na(мет)
OC2H5
-H2
O
Cl-(CH2)n-Cl
H 5 C2 O
OC2H5
Na
+
Cl-(CH2)n-Cl
H5C2OOC
COOC2H5
H3O , t
COOC2H5
-4C2H5OH
CH2
n
H5C2OOC
HOOC
COOH
CH2
n
HOOC
t
HOOC
CH2
-2CO2
COOH
n+2
IV Оксикарбоновых кислот
1) Гидролиз галогенпроизводных кислот
O
Hal
+
CH2
R
H2 O
n
OH
O
HO
KOH
CH2
-KHal
R
t
n
OH
COOH
-2CO2
16.
2) Гидролиз циангидриновO
R
OH
HCN, KCN
R
R'
H3 O
R'
+
OH
-NH4
R
R'
O
OH
CN
V Оксокарбоновых кислот
1) Окисление оксикислот
R
CH
R
C
OH
O
K2Cr2O7, H2SO4
O
C
C
OH
O
OH
2) Пиролиз винной кислоты – получение пировиноградной кислоты (ПВК)
H
OH
+
H
O
O
KHSO4, t
HO
HO
HO
OH
O
OH
O
O
OH
OH
O
OH
O
OH
17.
OO
O
O
HO
OH
OH
O
O
O
t
H2C
OH
O
H
+
CO2
O
H
Оксалилуксусная килота
O
H3C
OH
Физические свойства карбоновых кислот
O
В молекулах карбоновых кислот присутствуют подвижные атомы водорода в
составе –СООН групп, способные к образованию водородных связей. Поэтому их
температуры кипения гораздо выше, чем у соответствующих альдегидов и спиртов.
Алифатические кислоты С1–C3 — жидкости, высшие — твердые вещества. Низшие
гомологи очень хорошо растворимы в воде, высшие гомологи – плохо и только при
нагревании. В целом КК растворимы в полярных органических растворителях.
Все ароматические КК – кристаллические вещества, очень плохо растворимые
в воде. Температура кипения ароматических кислот выше температуры кипения
алифатических.
В ИК спектре карбоксильная группа проявляет 2 характерных полосы
поглощения: ν(С=O)R = 1740-1700 см-1(с), ν(С=O)R = 1800-1740 см-1(с)Ar, ν(O-H) =
3300-2500 см-1 (с). Поглощение -ОН группы проявляется в виде уширенной полосы в
результате образования водородной связи.
18.
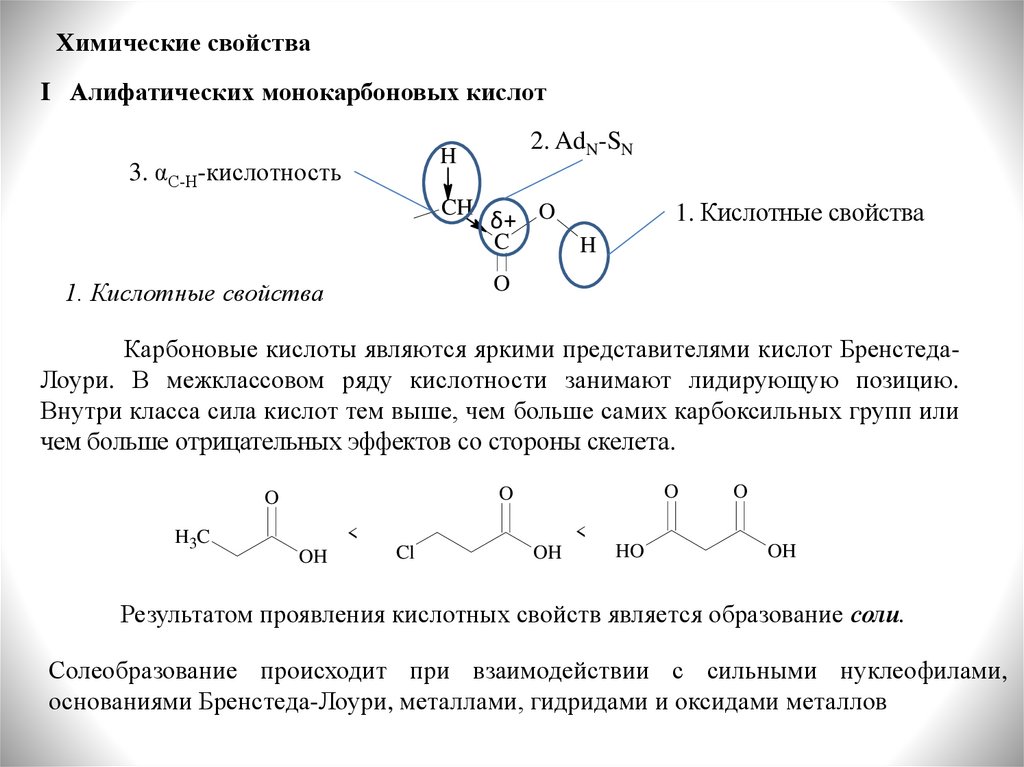
Химические свойстваI Алифатических монокарбоновых кислот
2. AdN-SN
H
3. αС-Н-кислотность
CH
1. Кислотные свойства
δ+ O
C
H
O
1. Кислотные свойства
Карбоновые кислоты являются яркими представителями кислот БренстедаЛоури. В межклассовом ряду кислотности занимают лидирующую позицию.
Внутри класса сила кислот тем выше, чем больше самих карбоксильных групп или
чем больше отрицательных эффектов со стороны скелета.
H3C
O
O
O
<
<
OH
O
Cl
OH
HO
OH
Результатом проявления кислотных свойств является образование соли.
Солеобразование происходит при взаимодействии с сильными нуклеофилами,
основаниями Бренстеда-Лоури, металлами, гидридами и оксидами металлов
19.
O+
+
MetH
R
O
Met
O
Met
-
+
H2
+
O
O
R
Met
OH
+
+
Met 2O
MetOH
R
+
H2O
O
+
NH3
R
O NH4
O
+
R'-MgHal
R
O
MgHal
+
RH
2. Реакции AdN-SN
AdN-SN
- нуклеофильное присоединение с последующим замещением.
Осуществляется при взаимодействии со слабыми нуклеофилами в присутствии
кислот Льюиса (обычно в среде минеральных кислот)
20.
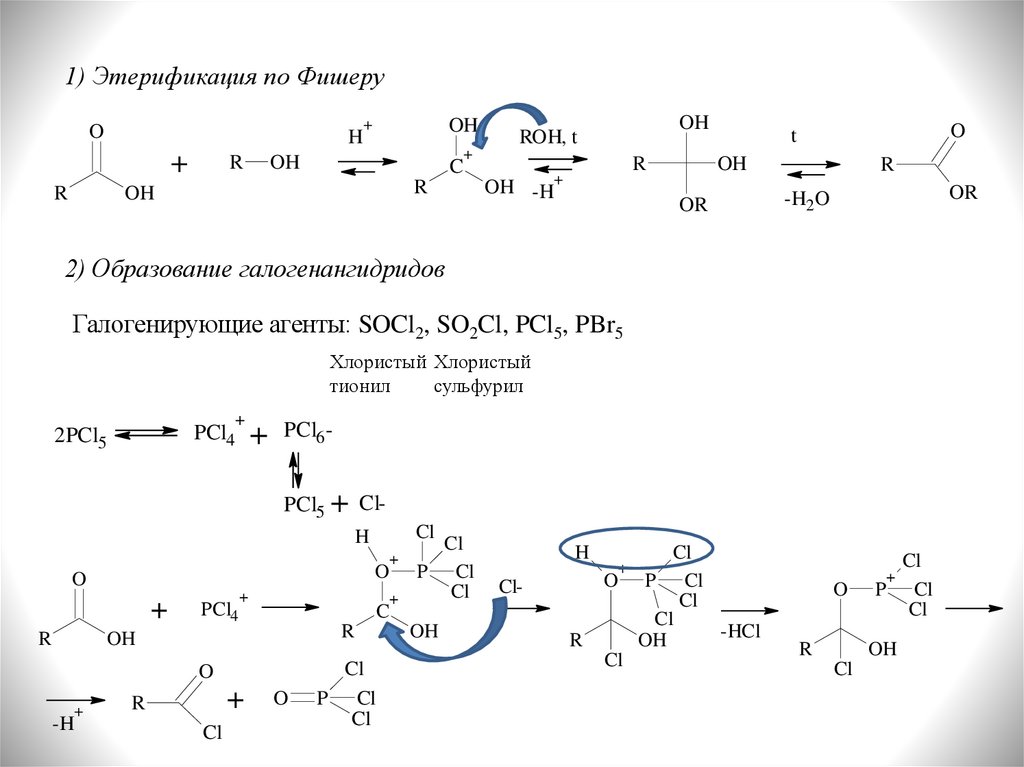
1) Этерификация по ФишеруO
H
+
R
R
OH
+
+
OH
C
R
OH
OH
ROH, t
R
+
OH -H
O
t
OH
OR
R
OR
-H2O
2) Образование галогенангидридов
Галогенирующие агенты: SOCl2, SO2Cl, PCl5, PBr5
Хлористый Хлористый
тионил
сульфурил
PCl4
2PCl5
+
+
PCl6PCl5 + ClH
Cl
Cl
O P Cl
Cl
+
C
OH
H
+
O
+
R
PCl4
+
R
OH
O
+
-H
+
R
Cl
O
Cl
P Cl
Cl
+
O
ClR
Cl
Cl
P Cl
Cl
Cl
-HCl
OH
O
R
Cl
P Cl
Cl
+
OH
Cl
21.
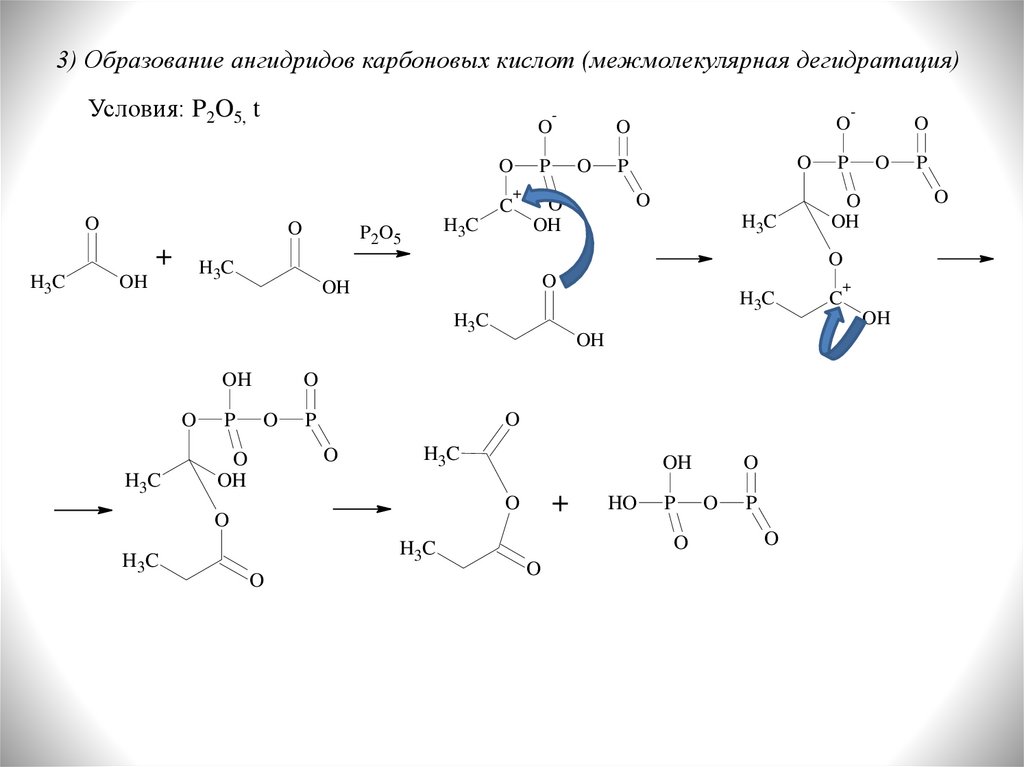
3) Образование ангидридов карбоновых кислот (межмолекулярная дегидратация)Условия: P2O5, t
O
+
C
O
O
+
H3C
H3C
P 2O5
P
O
H3C
H3C
OH
O
O
O
P
O
O
OH
H3C
OH
+
O
O
H3C
H3C
O
OH
OH
P
O
P
O
O
OH
H3C
O
O
O
P
O
O
H3C
O
HO
P
O
O
O
O
P
O
P
O
O
OH
O
H3C
OH
-
-
O
+
C
OH
22.
3. СН-кислотность проявляется в реакции Гелля-Фольгарда-ЗелинскогоРеакция α-галогенирования протекает при условиях: Br2, PBr3
H
Br
O P Br
Br
+
C
-HBr
OH
+
O
+
R
PBr 3
R
OH
Br
Br
+
O
Br
+
R
O
P
P
Br
R
C
OH
OH
H
Br
O
Br 2
P
O
Br
R
R
OH
-O=PBr
-HBr
Br
Br
O
PBr 3
+
R
C
Br
O
R
-HBr
-PBr3
OH
Br
4. Восстановление карбоновых кислот (до спиртов)
Восстановители: LiAlH4, NaBH4
H2 O
O
R
Br
P Br
Br
+
Br
Br
Br
Br
Br
P Br
Br
+
OH
Br
-HBr
-PBr3
Br 2
23.
II Алифатических дикарбоновых кислот1. Щавелевая кислота
H
O
HO
O
O
O
OH
O
O
H
Прямая связь карбоксильных групп приводит к эффекту взаимного стягивания
электронной плотности, что способствует легкому протеканию процессов
декарбоксилирования и реакций AdN-SN (без активации).
1) Декарбоксилирование
а) Термическое
O
O
O
t > Tпл
+
H
HO
OH
СO2
OH
б) Кислотное
O
HO
O
OH
+
H3O , t
O
HO
O
+
O
H
H2 O
H
+
CO
+
CO2
24.
в) ОкислительноеO
O
[O], t
H2 O
HO
+
2 CO2
OH
2) Образование оксалилхлорида
O
O
2PCl5
OH -2OPCl3
HO
O
O
Cl
Cl
Оксалилхлорид склонен к гомолитическому типу расщепления С-С связи, что
используется в реакциях радикального образования хлорангидридов карбоновых
кислот из алканов
O
H3 C
O
hv
+
CH3
H3C
Cl
Cl
+
CO
Cl
O
O
O
hv
O
O
C
Cl
Cl
Cl
+
O
O
C
C
Cl
Cl
+
C
+
Cl
+
HCl
25.
3) Образование диэтилоксалатаO
O
HO
OH
O
2C2H5OH, t
-H2O
O
H5C2O
- Без активации; азеотропная отгонка воды
OC2H5
Диэтилоксалат – сильнейший ацилирующий агент, применяемый в т.ч. в реакциях
сложноэфирной конденсации Кляйзена
O
O
O
R
R
O
R
+
H 5 C2 O
O
H 5 C2 O
O
+
H3O , t
R
O
O
O
O
R
R
-
O
O
R
O
-C2H5OO
OC2H5
OC2H5
R
-
CH
OC2H5
O
H 5 C2 O
O
Na, C2H5OH, t
O
-ROH
-C2H5OH
OC2H5
O
R
OH
O
O
OH
OH
t
R
-CO2
OH
O
26.
2. Малоновая кислотаO
O
HO
OH
H
Повышенная α-СН-кислотность
Карбоксильные группы по-прежнему оказывают взаимный отрицательный
индуктивный эффект, что приводит к реакциям декарбоксилирования. А кроме того,
повышенная подвижность протона в α-положении приводит к возможности
проводить синтезы с малоновым эфиром.
1) Термическое декарбоксилирование
O
O
O
t
HO
OH
OH
O
H
H2C
O
OH
OH
O
H3C
OH
+
CO2
27.
2) Проявление α-СН-кислотностиO
O
HO
O
BOH
-BH
O
O
-
O
OH
H
H
-
O
-
O
C
H
H
O
OH
O
O
OH
H
H
OH
H
O
-
HO
O
OH
Реакция Кневенагеля:
O
O
H
O
-
O
H
H
O
O
O
H
+
HO
OH
O
-HNEt 3
O
O
NEt 3
-
+
O
O
O
-
HO
OH
H
O
O
O
C
H
OH
H
O
O
O
O
H
HO
OH
-
O
HNEt 3
-NEt 3
+
HO
OH
OH
HO
NEt 3, t
-HNEt 3
-OH-
OH
t
+
-CO2
HO
28.
Синтезы с малоновым эфиромO
O
O
t
+
HO
2C2H5OH
OH
O
-2H2O H C O
5 2
O
Na(мет.)
OC2H5
-Н2
O
H5 C2 O
OC2H5
Na
Натриймалоновый эфир
а) Синтез одноосновных кислот с натриймалоновым эфиром
O
O
H 5 C2 O
O
OC2H5
+
R
+
O
-NaCl H C O
5 2
Cl
O
H3 O , t
O
O
OC2H5 -2C2H5OH HO
t
OH
-CO2
HO
Na
R
R
R
б) Синтез двухосновных кислот с натриймалоновым эфиром
O
OC2H5
O
O
2
H 5 C2 O
OC2H5
Na
H 5 C2 O
+
Cl
CH2
Cl
n
-2NaCl
O
CH2
n
O
OC2H5
H 5C2O
O
Na(мет.)
-Н2
29.
OC2H5Na(мет.)
O
O
CH2
Na
-Н2
OC2H5
H 5 C2O
n
O
OC2H5
+
OC2H5
CH2
t
R
n
OH
O
-4C2H5OH
H5 C2 O
OH
HO
O
+
H3O , t
R
n
H 5 C2 O
O
R
CH2
O
O
-4C2H5OH
O
R
-2NaCl
O
OH
H3O , t
O
2R-Cl
Na
H 5 C2 O
R
O
CH2
-2CO2
O
n
R
O
HO
HO
в) Синтезы Михаэля (сопряженное присоединение натриймалонового эфира к
винил-функциональным производным)
O
OC2H5
O
+
O
H5 C2 O
OC2H5
+
H3C
CH3
H
Na
-2C2H5OH
O
O
OC2H5 O
H3C
H
+
CH
-
O
H3O , t
H
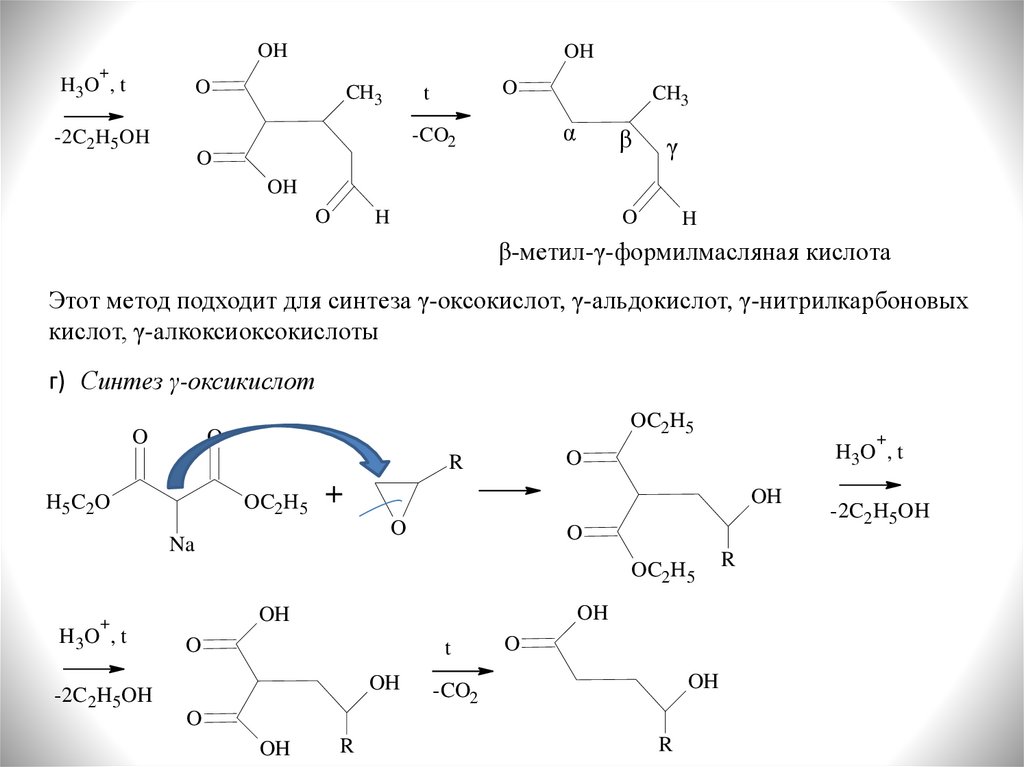
30.
OH+
H3O , t
OH
O
CH3
O
t
α
-CO2
-2C2H5OH
CH3
β
O
γ
OH
O
O
H
H
β-метил-γ-формилмасляная кислота
Этот метод подходит для синтеза γ-оксокислот, γ-альдокислот, γ-нитрилкарбоновых
кислот, γ-алкоксиоксокислоты
г) Синтез γ-оксикислот
O
OC2H5
O
R
H 5 C2 O
OC2H5
+
OH
O
Na
O
OC2H5
H3O , t
-2C2H5OH
OH
OH
+
O
t
OH
O
OH
-CO2
O
OH
+
H3O , t
O
R
R
R
-2C2H5OH
31.
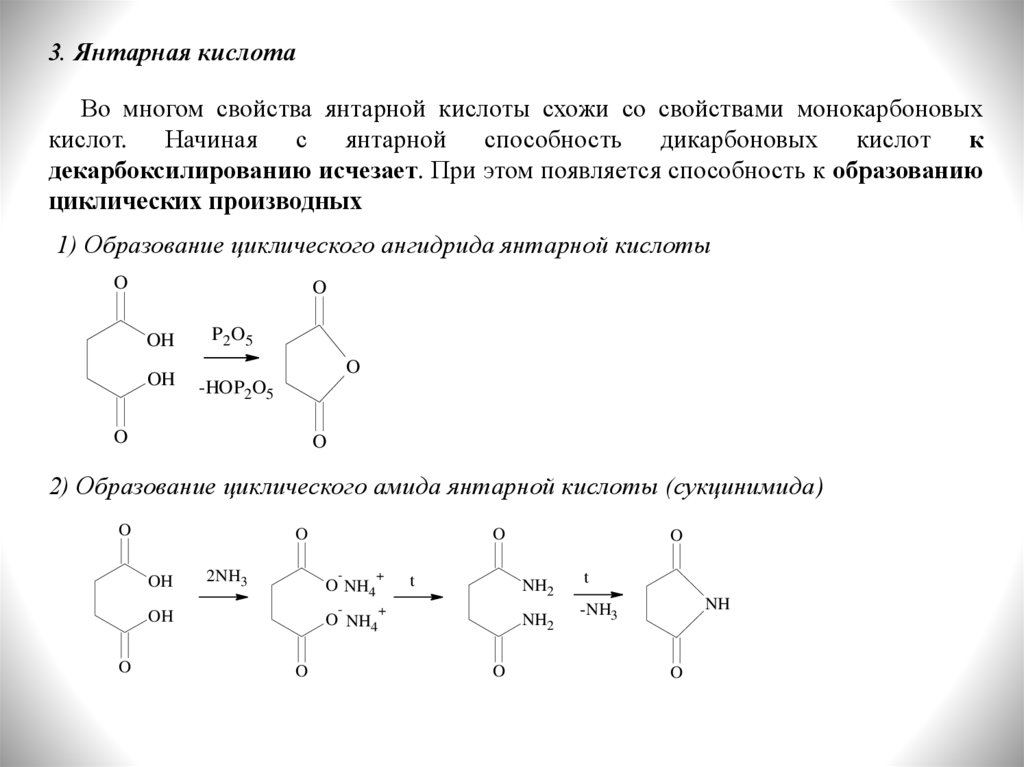
3. Янтарная кислотаВо многом свойства янтарной кислоты схожи со свойствами монокарбоновых
кислот. Начиная с янтарной способность дикарбоновых кислот к
декарбоксилированию исчезает. При этом появляется способность к образованию
циклических производных
1) Образование циклического ангидрида янтарной кислоты
O
O
OH
OH
P 2O5
O
-HOP2O5
O
O
2) Образование циклического амида янтарной кислоты (сукцинимида)
O
O
OH
2NH3
-
+
-
+
O NH4
OH
O
O
O NH4
O
t
O
NH2
NH2
O
t
NH
-NH3
O
32.
3) Конденсация диэтилсукцината с альдегидами/кетонами (реакция Штоббе)R
R
C2H5ONa, t
OC2H5
R
R
+
-
HC
OC2H5
OC2H5
OC2H5
-
-C2H5OH
O
OC2H5
-
-C2H5O-
O
OC2H5
H 5 C2 O
O
O
O
O
O
R
R
R
R
O
OC2H5
O
O
O
O
-
O
C2H5ONa, t
R
R
R
R
C
O
OC2H5
-
O
H3 O
+
-C2H5OH
O
O
O
R
R
O
O
O
R
R
OH
HO
O
OC2H5
OC2H5
O
-C2H5OH
O
R
R
-
OC2H5
-C2H5O-
O
O
33.
4. Адипиновая кислота1) Образование циклопентанона
O
O
O
400 C
Ba
O
-CO2
-BaO
O
2) Реакция Дикмана (внутримолекулярная сложноэфирная конденсация)
O
OC2H5
OC2H5
O
Na, толуол, t
O
CH
O
OC2H5
-Н2
OC2H5
O
O
H3 O
+
ОС2Н5
O
O
OH
-C2H5OH
34.
III Оксикислот1) Особенности химических свойств α-оксикислот
а) Образование лактидов
H3C
O
O
O
O
CH3
O
2
t
H3C
-2H2O
OH
OH
б) Кислотное расщепление
HCl, t
H3C
OH
H3C
H3C
.
H3C
O
H
O
H
+
.
+
OH
H
O
O
O
+
+
O
H
CH
+
+
C
H
H
+
O
O
H
H
H
H
O
C
H
C
H
+
O
H
O
O
-2H
H
+
+
H3C
H
C
H
OH
35.
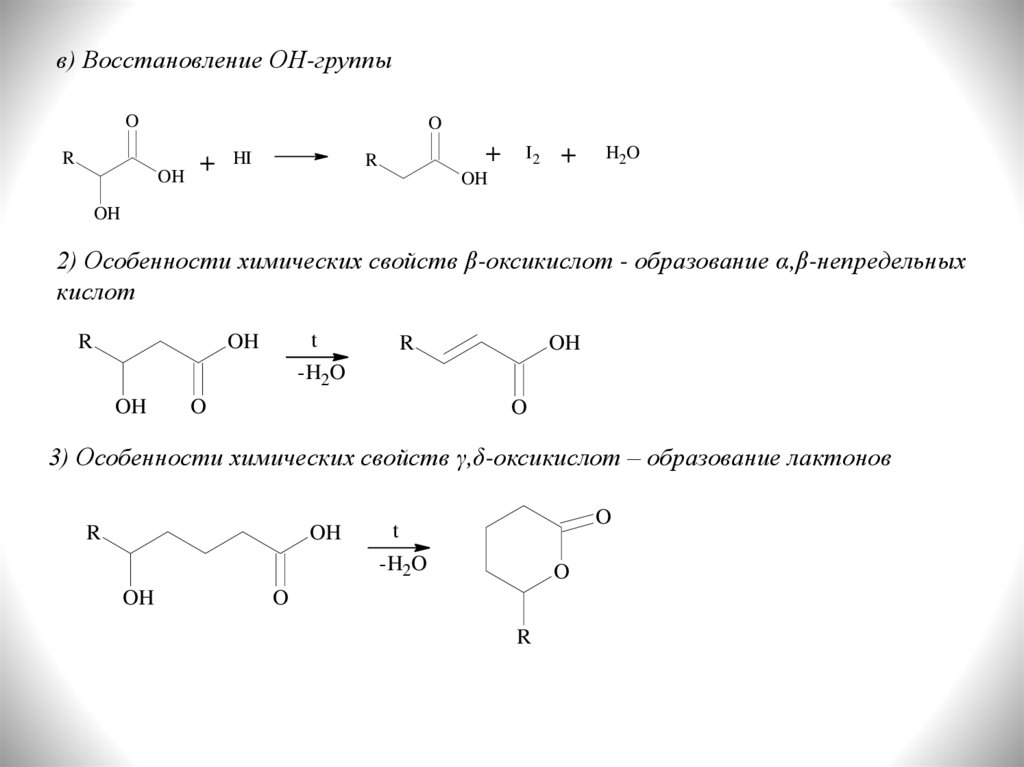
в) Восстановление ОН-группыO
O
R
OH
+
HI
+
R
I2
+
H2O
OH
OH
2) Особенности химических свойств β-оксикислот - образование α,β-непредельных
кислот
R
t
OH
R
OH
-H2O
OH
O
O
3) Особенности химических свойств γ,δ-оксикислот – образование лактонов
R
OH
O
t
-H2O
OH
O
O
R
36.
В целом для всех оксикислот характерны реакции, связанные с проявлениемсвойств вторичных спиртов (SN, образование простых эфиров) и предельных
монокарбоновых кислот
IV Оксокислот
1) Особенности химических свойств α-оксокислот
а) Окислительное декарбоксилирование
O
Ag 2O, t
R
OH
-H2O
O
CO2
+
R
OH
O
б) Кислотное декарбоксилирование (H2SO4 разб., 150 С)
O
H2SO4 (разб)б 150C
R
OH
O
O
+
R
OH
CO2
37.
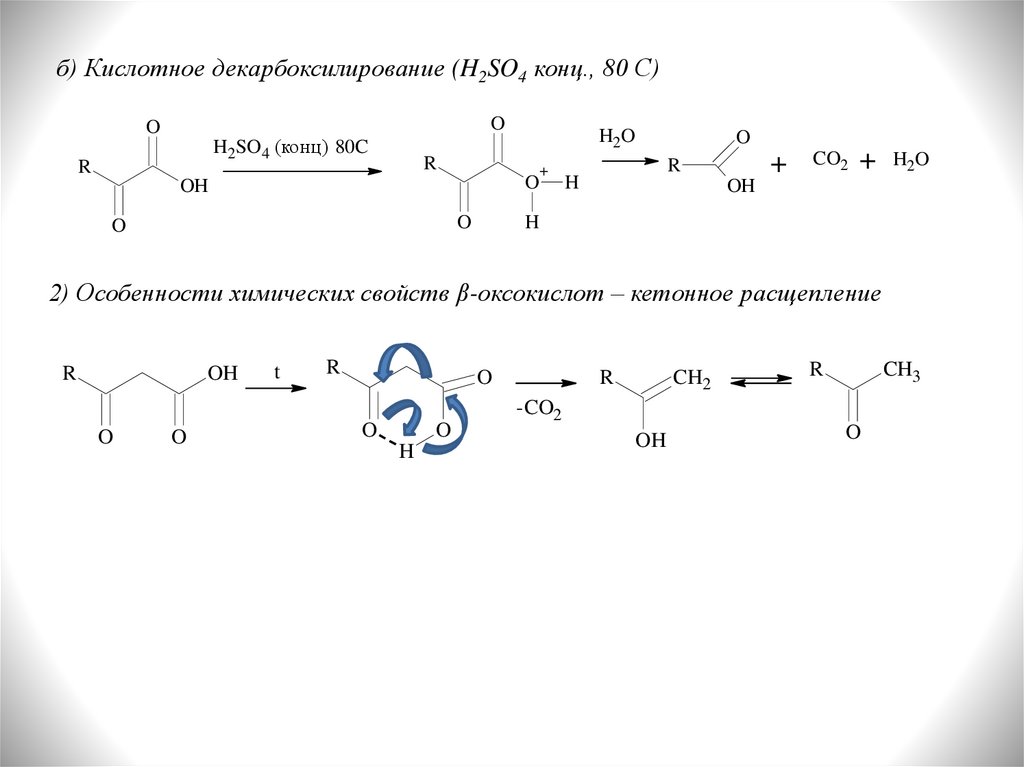
б) Кислотное декарбоксилирование (H2SO4 конц., 80 С)O
O
H2SO4 (конц) 80C
R
R
H2O
+
O
OH
O
O
O
+
R
H
CO2
+
H2O
OH
H
2) Особенности химических свойств β-оксокислот – кетонное расщепление
R
OH
O
O
t
R
O
O
O
H
R
CH2
R
CH3
-CO2
OH
O

























 chemistry
chemistry








