Similar presentations:
Карбоновые кислоты
1.
КАРБОНОВЫЕ КИСЛОТЫКарбоновые кислоты органические соединения, молекулы которых
содержат одну или несколько карбоксильных групп –СООН, связанных с
O
углеводородным радикалом.
R C
OH
Классификация карбоновых кислот
1. По числу карбоксильных групп кислоты подразделяются на:
•одноосновные или монокарбоновые R-COOH (общая формула СnН2nО2
или CnH2n+1COOH):
CH3 COOH
H COOH
уксусная кислота
муравьиная кислота
•многоосновные (дикарбоновые R(COOH)2, трикарбоновые R(COOH)3 и
т.д.)
HOOC COOH
щавелевая кислота
HOOC CH2 COOH
малоновая кислота
CH2 COOH
HO C COOH
CH2 COOH
лимонная кислота
2. По характеру углеводородного радикала различают кислоты:
•предельные (например, CH3CH2CH2-COOH – бутановая кислота);
•непредельные (CH2=CH-COOH – акриловая кислота);
•ароматические (C6H5-COOH – бензойная кислота).
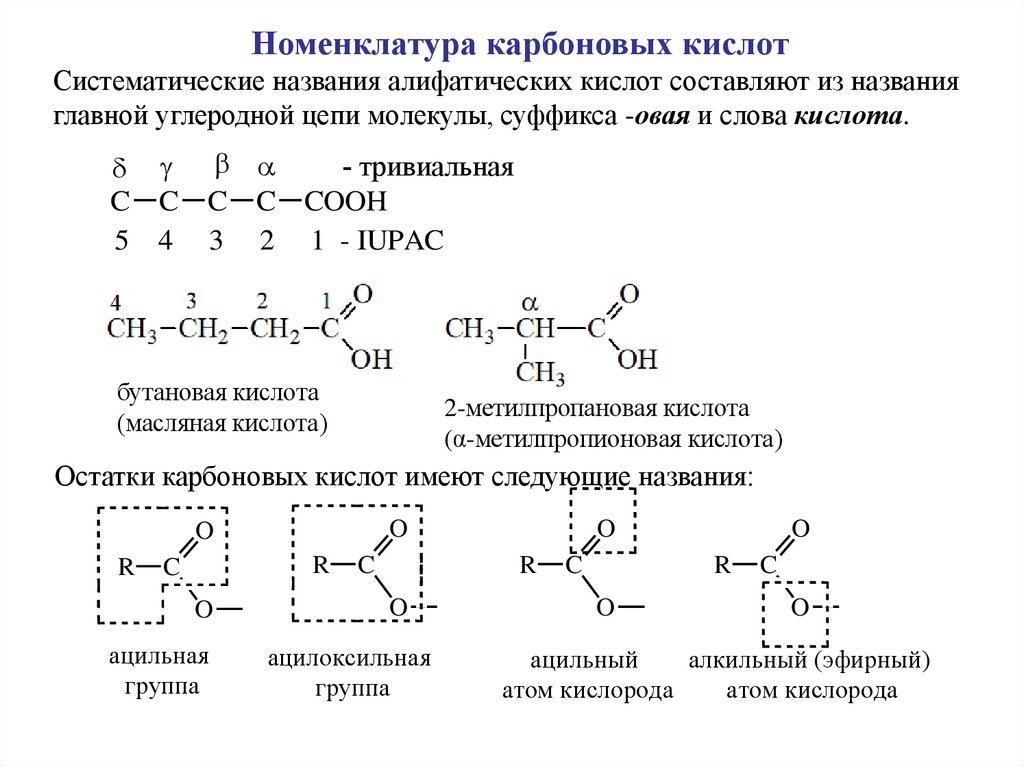
2.
Номенклатура карбоновых кислотСистематические названия алифатических кислот составляют из названия
главной углеродной цепи молекулы, суффикса -овая и слова кислота.
- тривиальная
C C C C COOH
5 4 3 2 1 - IUPAC
бутановая кислота
(масляная кислота)
2-метилпропановая кислота
(α-метилпропионовая кислота)
Остатки карбоновых кислот имеют следующие названия:
O
O
R
R
C
O
ацильная
группа
C
O
R
O
ацилоксильная
группа
C
O
R
O
C
O
ацильный
алкильный (эфирный)
атом кислорода
атом кислорода
3.
Часто применяются также тривиальные названия кислот.Например, муравьиная (метановая) кислота, уксусная (этановая)
кислота, бензойная (бензолкарбоновая) кислота и т.д.
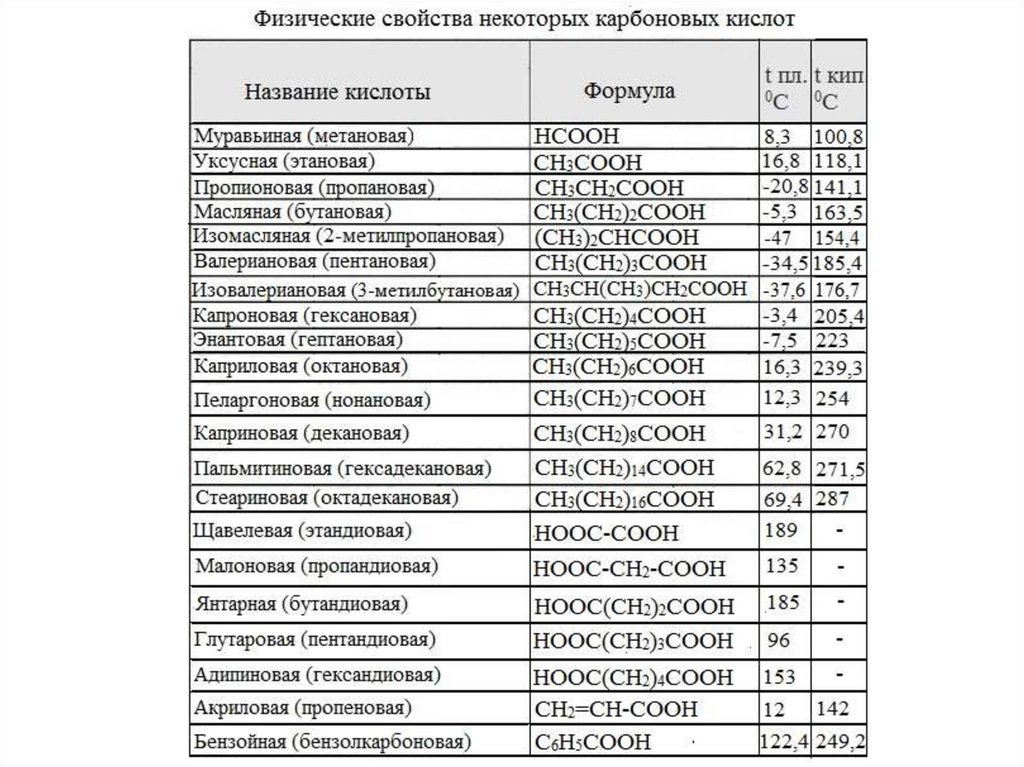
Названия некоторых предельных одноосновных кислот
Формула
систематическое
HCOOH
CH3COOH
C2H5COOH
C3H7COOH
C4H9COOH
C5H11COOH
C15H31COOH
C17H35COOH
метановая
этановая
пропановая
бутановая
пентановая
гексановая
гексадекановая
октадекановая
Название
тривиальное
муравьиная
уксусная
пропионовая
масляная
валерьяновая
капроновая
пальмитиновая
стеариновая
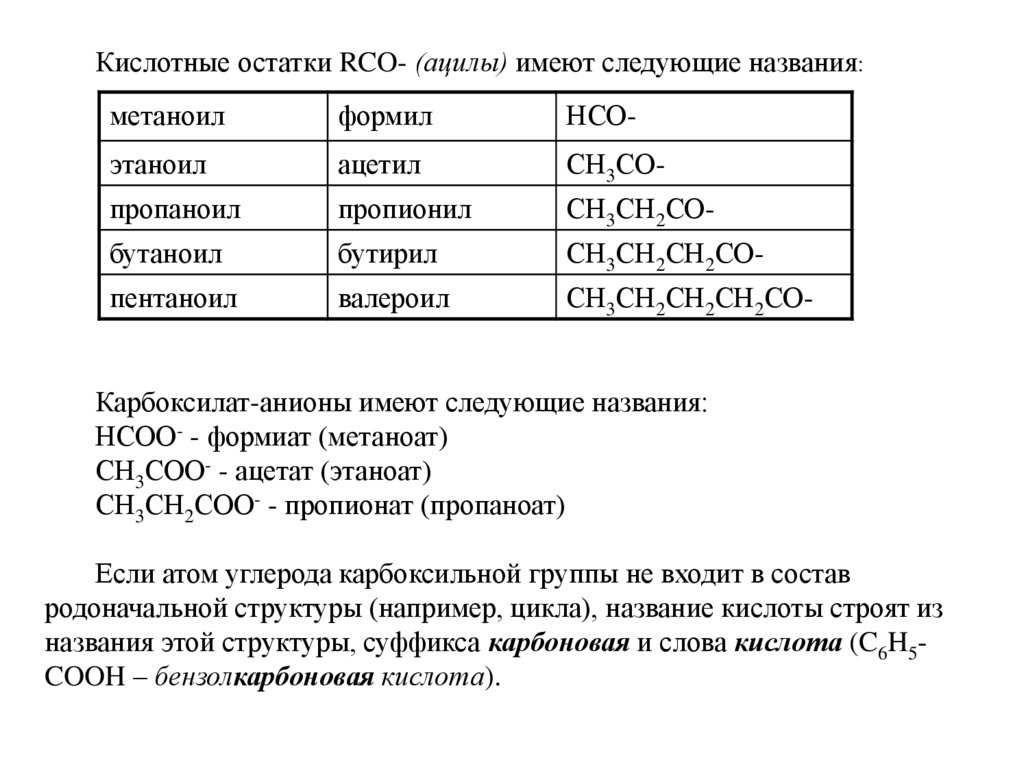
4.
Кислотные остатки RCO- (ацилы) имеют следующие названия:метаноил
формил
НСО-
этаноил
ацетил
СН3СО-
пропаноил
пропионил
СН3СН2СО-
бутаноил
бутирил
СН3СН2СН2СО-
пентаноил
валероил
СН3СН2СН2СН2СО-
Карбоксилат-анионы имеют следующие названия:
НСОО- - формиат (метаноат)
СН3СОО- - ацетат (этаноат)
СН3СН2СОО- - пропионат (пропаноат)
Если атом углерода карбоксильной группы не входит в состав
родоначальной структуры (например, цикла), название кислоты строят из
названия этой структуры, суффикса карбоновая и слова кислота (C6H5COOH – бензолкарбоновая кислота).
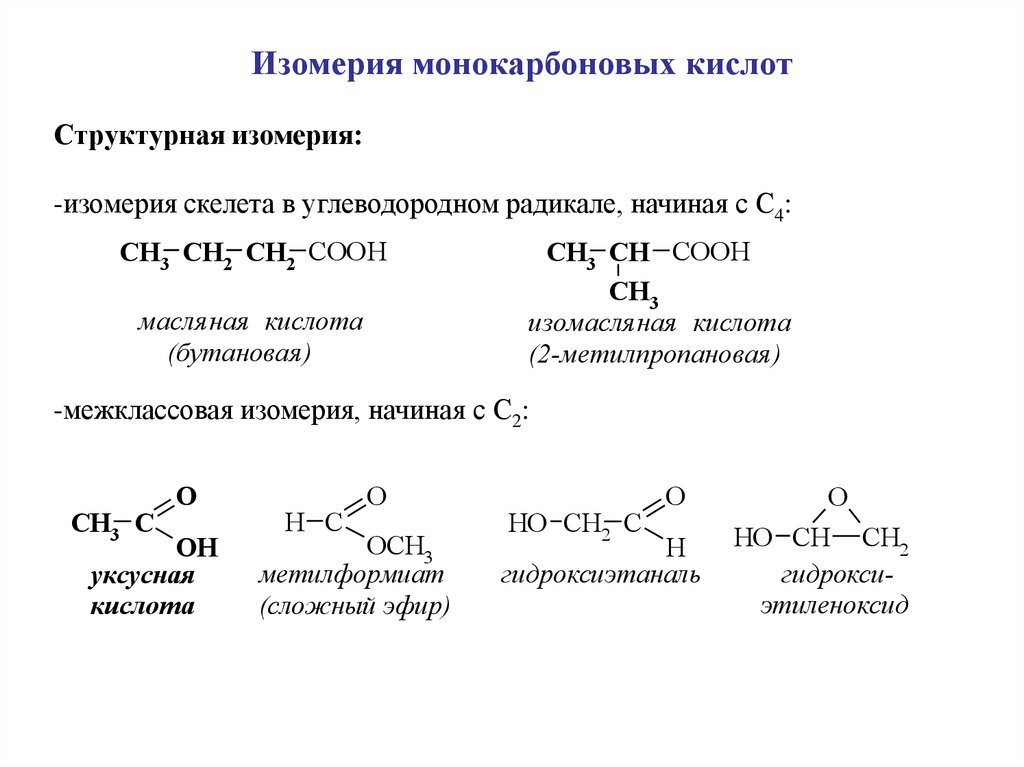
5.
Изомерия монокарбоновых кислотCтруктурная изомерия:
-изомерия скелета в углеводородном радикале, начиная с C4:
CH3 CH2 CH2 COOH
масля ная кислота
(бутановая )
CH3 CH COOH
CH3
изомасля ная кислота
(2-метилпропановая )
-межклассовая изомерия, начиная с C2:
CH3 C
O
OH
уксусная
кислота
H C
O
OCH3
метилформиат
(сложный эфир)
HO CH2 C
O
H
гидроксиэтаналь
O
HO CH CH2
гидроксиэтиленоксид
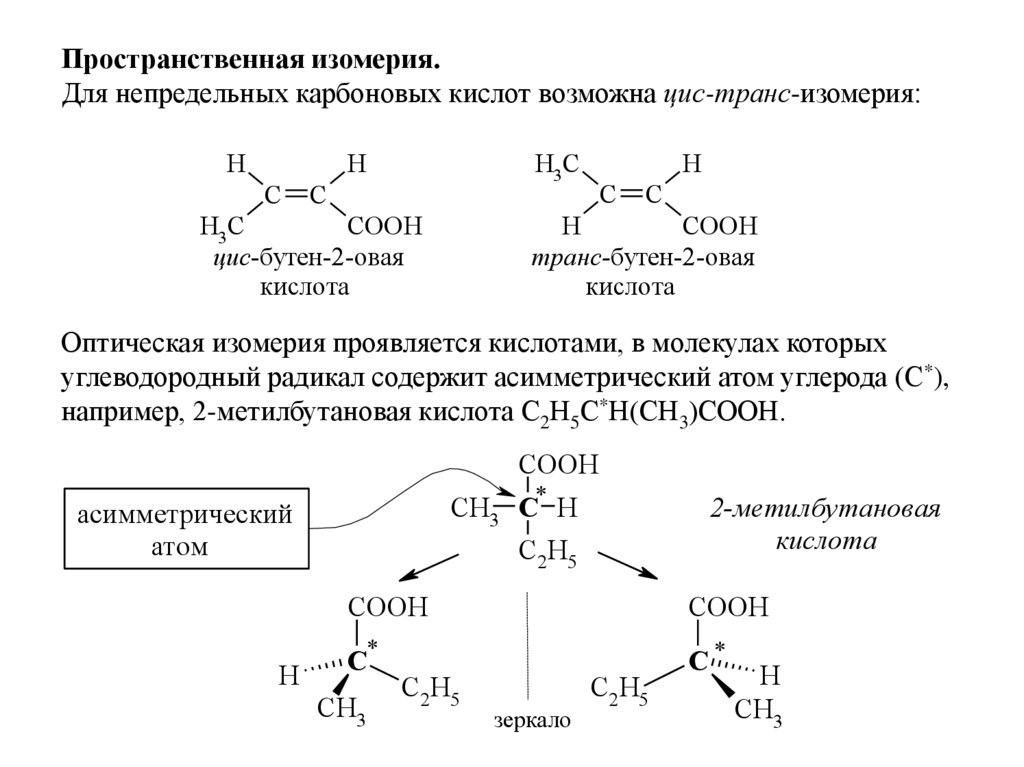
6.
Пространственная изомерия.Для непредельных карбоновых кислот возможна цис-транс-изомерия:
H
H3C
H
C
C
H
C
C
COOH
H
транс-бутен-2-овая
кислота
COOH
H3C
цис-бутен-2-овая
кислота
Оптическая изомерия проявляется кислотами, в молекулах которых
углеводородный радикал содержит асимметрический атом углерода (С*),
например, 2-метилбутановая кислота С2Н5С*Н(СН3)СООН.
COOH
CH3 C* H
C2 H5
асимметрический
атом
H
2-метилбутановая
кислота
COOH
COOH
C*
C*
CH3
C2 H5
зеркало
C2 H5
H
CH3
7.
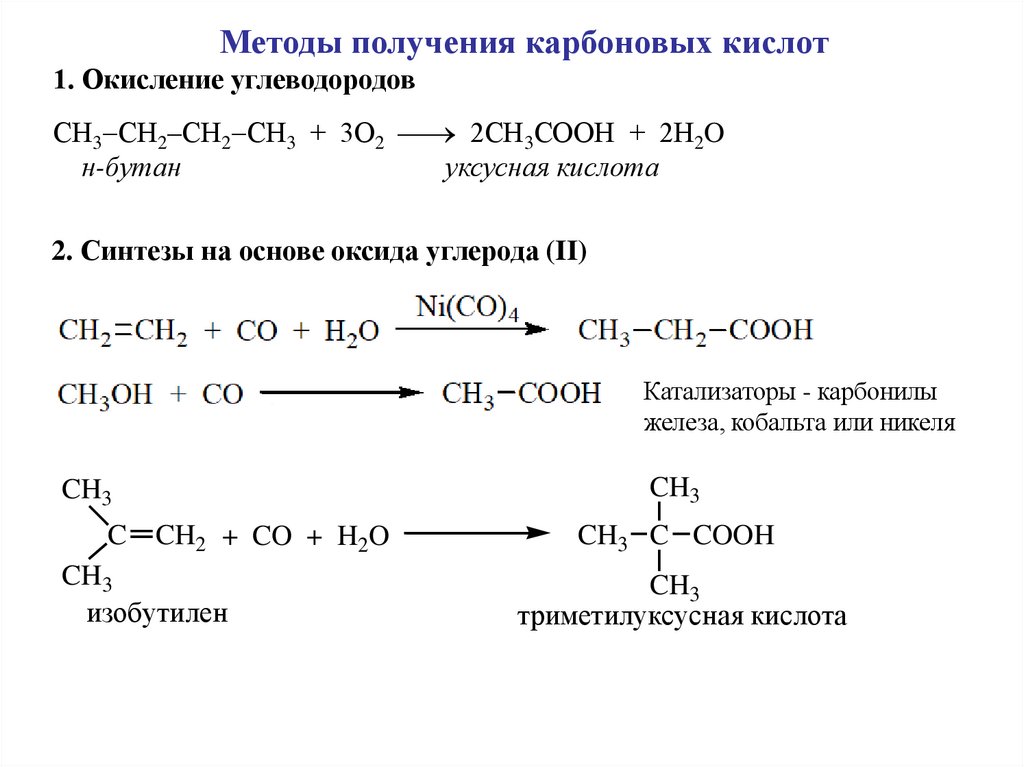
Методы получения карбоновых кислот1. Окисление углеводородов
СН3 СН2–СН2 СН3 + 3О2 2СН3СООН + 2H2O
н-бутан
уксусная кислота
2. Синтезы на основе оксида углерода (II)
Катализаторы - карбонилы
железа, кобальта или никеля
CH3
C CH2 + CO + H2O
CH3
изобутилен
CH3
CH3 C COOH
CH3
триметилуксусная кислота
8.
3. Синтез ГриньяраCH3CH2COO (MgBr)
CH3CH2MgBr + CO2
CH3CH2COO (MgBr) + HCl
CH3CH2COOH + MgBrCl
4. Окисление первичных спиртов
RCH2OH + [O]
RCHO + H2O
RCHO + [O]
RCOOH
5. Окисление альдегидов и кетонов
CH3CHO + O2
CH3COOH + H2O
CH3 CH2 C CH2 CH3 + O2
CH3CH2COOH + CH3COOH
O
CH3 CH C CH2 CH3 + O2
CH3 C CH3 + CH3CH2COOH
CH3 O
O
9.
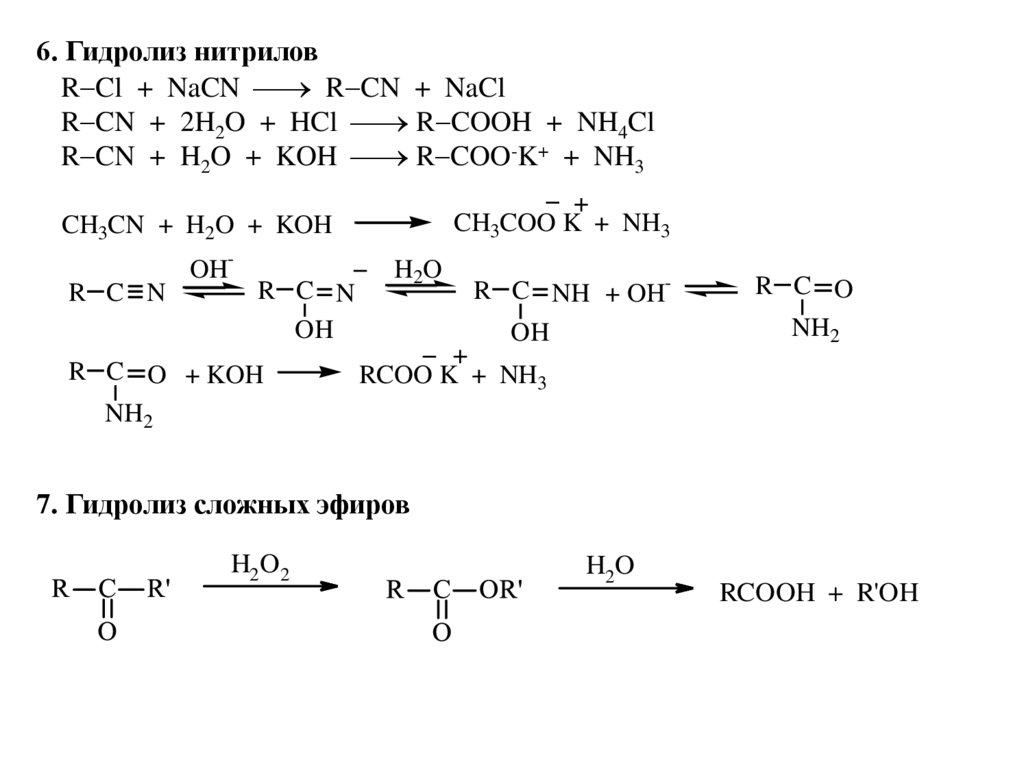
6. Гидролиз нитриловR Cl + NaCN R CN + NaCl
R CN + 2H2O + HCl R COOH + NH4Cl
R CN + H2O + KOH R COO-K+ + NH3
CH3COO K + NH3
CH3CN + H2O + KOH
R C N
OH-
R C N
OH
R C O + KOH
NH2
H2O
R C NH + OHOH
R C O
NH2
RCOO K + NH3
7. Гидролиз сложных эфиров
H2O2
H2O
RCOOH + R'OH
10.
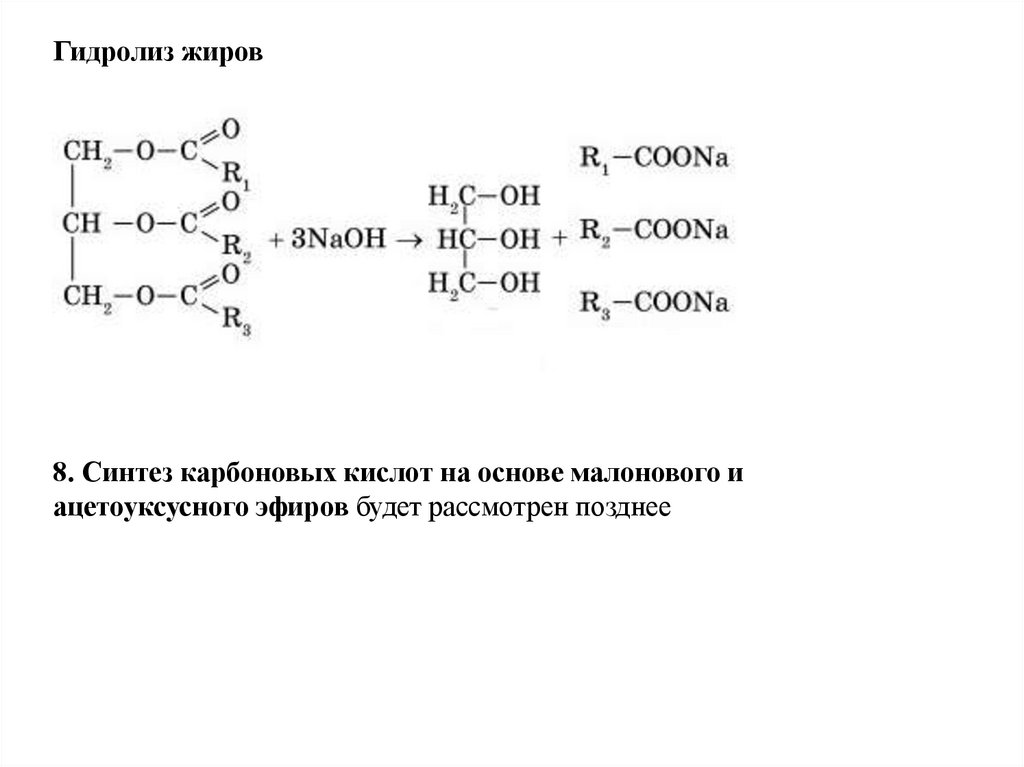
Гидролиз жиров8. Синтез карбоновых кислот на основе малонового и
ацетоуксусного эфиров будет рассмотрен позднее
11.
12.
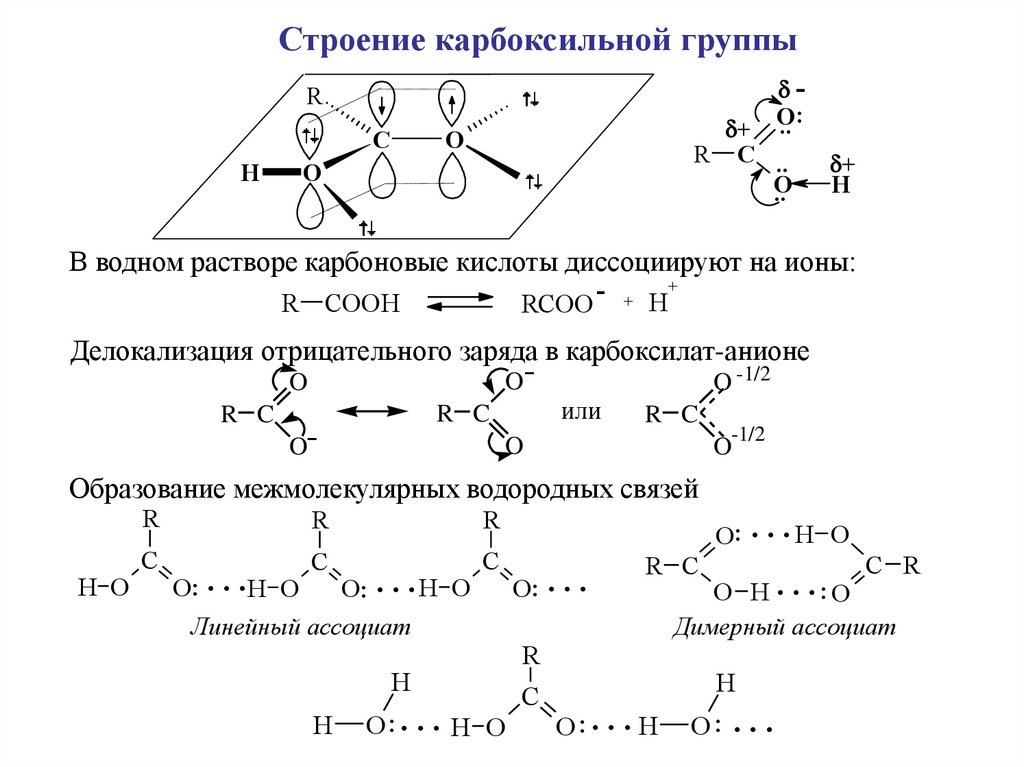
Строение карбоксильной группы.. :
+ O
R C ..
+
O
H
..
R
C
H
O
O
В водном растворе карбоновые кислоты диссоциируют на ионы:
+
+
H
RCOO
R COOH
Делокализация отрицательного заряда в карбоксилат-анионе
O -1/2
O
O
или
R C
R C
R C
O
O
-1/2
O
Образование межмолекулярных водородных связей
R
H O
C
R
R
O: . . . H O
C
O: . . . H O
C
O: . . . H O
O: . . .
Линейный ассоциат
H
H
O:. . . H O
R
C
C R
R C
O H . . . :O
Димерный ассоциат
H
O:. . . H
O: . . .
13.
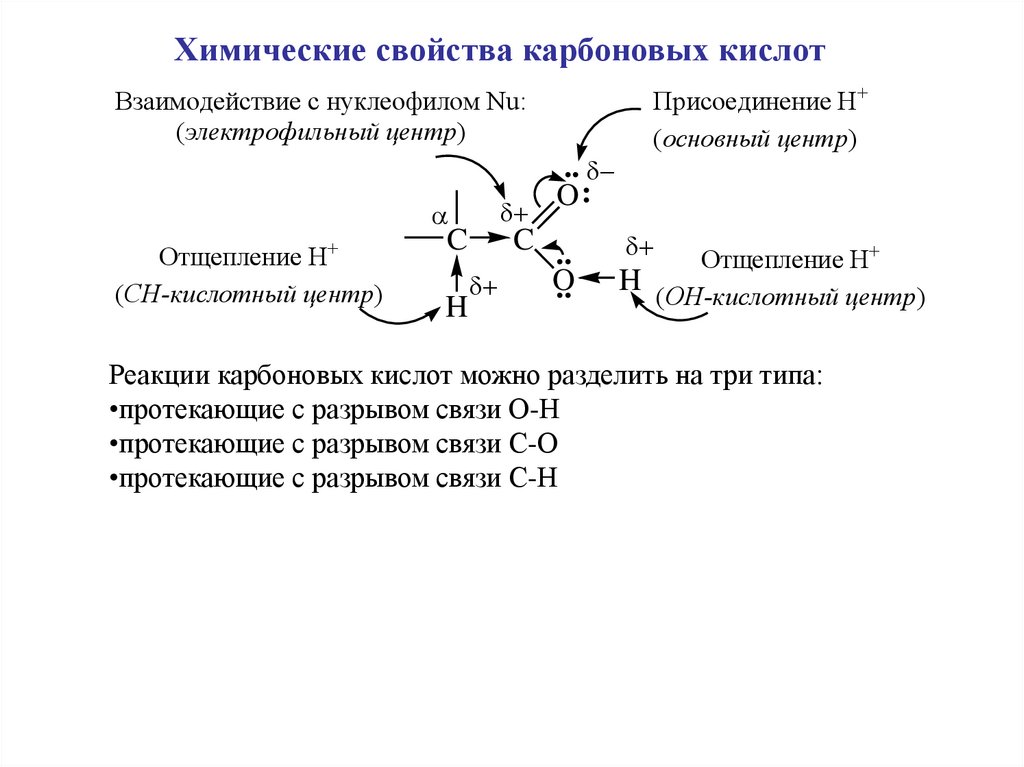
Химические свойства карбоновых кислотПрисоединение Н+
(основный центр)
Взаимодействие с нуклеофилом Nu:
(электрофильный центр)
Отщепление Н+
(СН-кислотный центр)
C
H
..
O:
C ..
O
..
Отщепление Н+
H (ОН-кислотный центр)
Реакции карбоновых кислот можно разделить на три типа:
•протекающие с разрывом связи О-Н
•протекающие с разрывом связи С-О
•протекающие с разрывом связи С-Н
14.
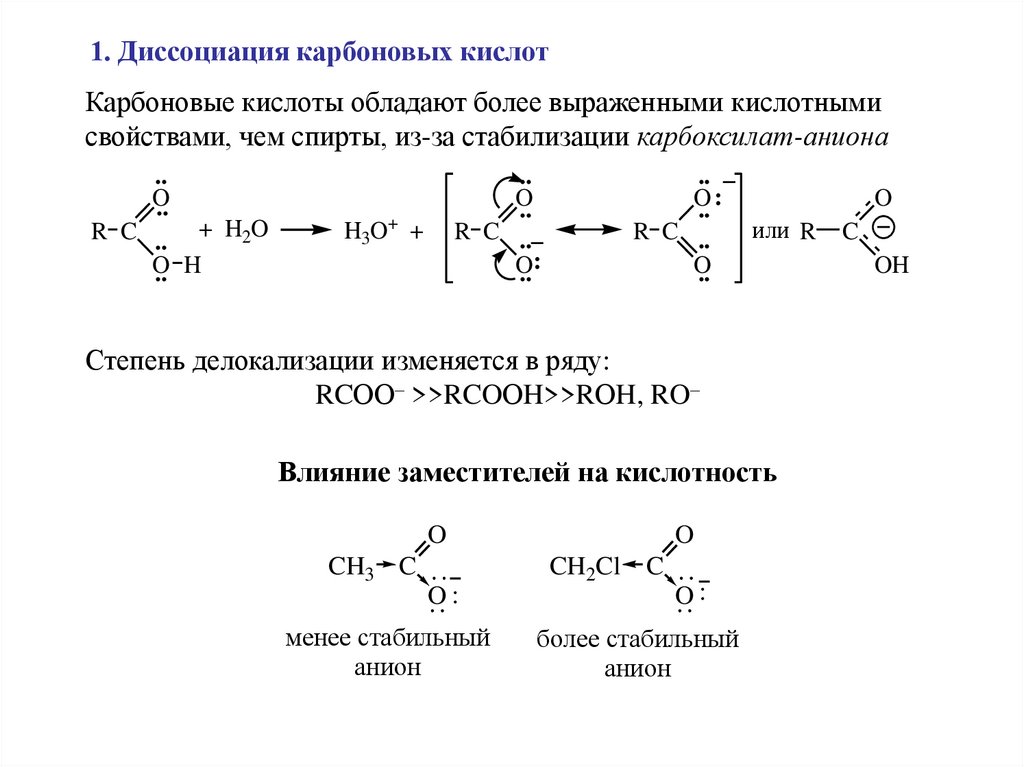
1. Диссоциация карбоновых кислотКарбоновые кислоты обладают более выраженными кислотными
свойствами, чем спирты, из-за стабилизации карбоксилат-аниона
..
O
..
R C .. + H2O
O
.. H
..
O
..
R C ..
:
O
..
H3O+ +
..
:
O
..
R C ..
O
..
O
или R
Степень делокализации изменяется в ряду:
RCОО– >>RCOОH>>RОH, RO–
Влияние заместителей на кислотность
O
CH3 C
O
CH2Cl C
O:
менее стабильный
анион
O:
более стабильный
анион
C
OH
15.
Влияние заместителей на кислотностьКислота
рКа
СН3СООН
4.8
СН3СН2СООН
4.8
ClСН2СООН
2.9
Cl2СНСООН
1.3
Сl3CСООН
0.7
FСН2СООН
2.6
F3CСООН
0.2
16.
2. Образование солей карбоновых кислотпроисходит при действии на карбоновые кислоты:
а) активных металлов и аммиака
2RCOOH + Mg (RCOO–)2Mg2+ + H2
RCOOH + NH3 RCOO–NH4+
б) основных оксидов
2RCOOH + CaO (RCOO–)2Ca2+ + H2O
в) гидроксидов металлов
RCOOH + NaOH RCOO–Na+ + H2O
г) солей слабых кислот
RCOOH + NaHCO3 RCOO–Na+ + H2O + CO2
17.
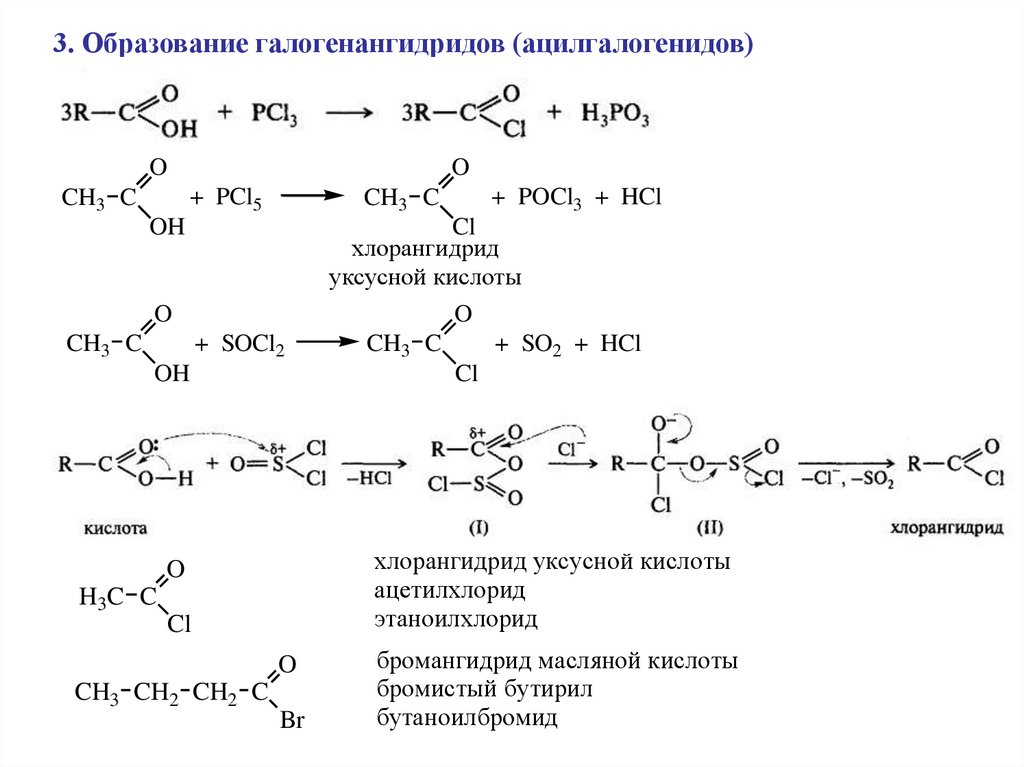
3. Образование галогенангидридов (ацилгалогенидов)O
O
+ PCl5
CH3 C
CH3 C
OH
O
+ SOCl2
CH3 C
OH
+ POCl3 + HCl
Cl
хлорангидрид
уксусной кислоты
O
+ SO2 + HCl
CH3 C
Cl
хлорангидрид уксусной кислоты
ацетилхлорид
этаноилхлорид
O
H3C C
Cl
O
CH3 CH2 CH2 C
Br
бромангидрид масляной кислоты
бромистый бутирил
бутаноилбромид
18.
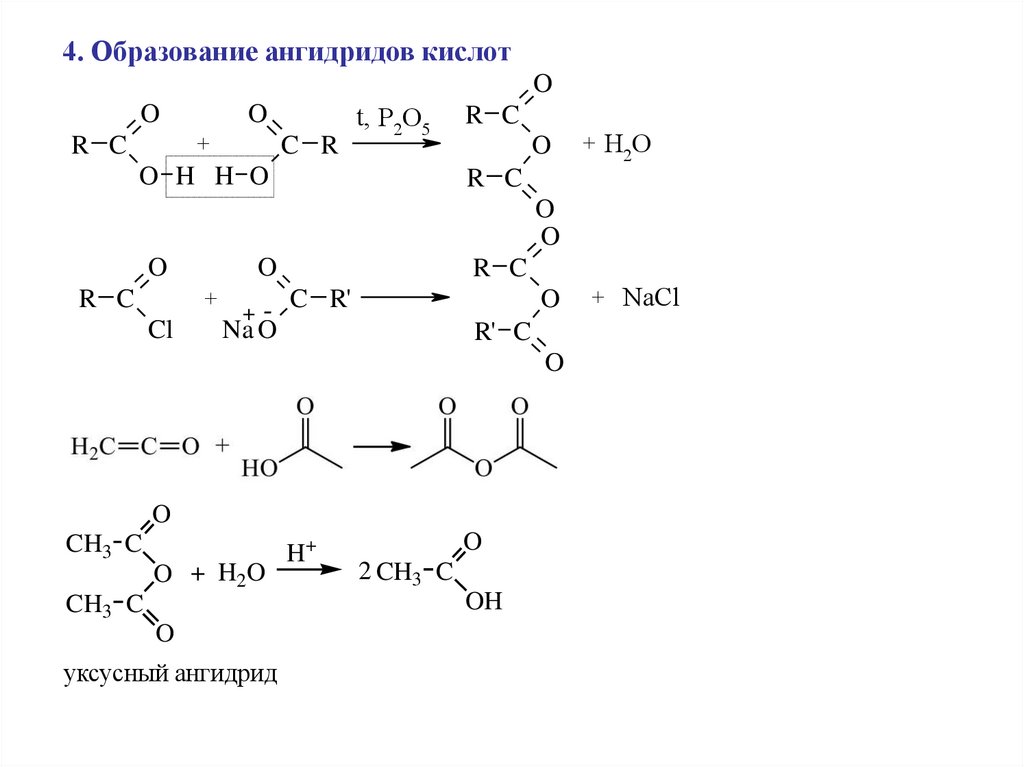
4. Образование ангидридов кислотO
O
O
+
R C
C R
t, P2O5
O H H O
R C
O
+ H2O
R C
O
O
O
O
+
R C
Cl
+-
R C
C R'
O
Na O
R' C
O
O
CH3 C
O + H2O
H+
O
2 CH3 C
OH
CH3 C
O
уксусный ангидрид
+ NaCl
19.
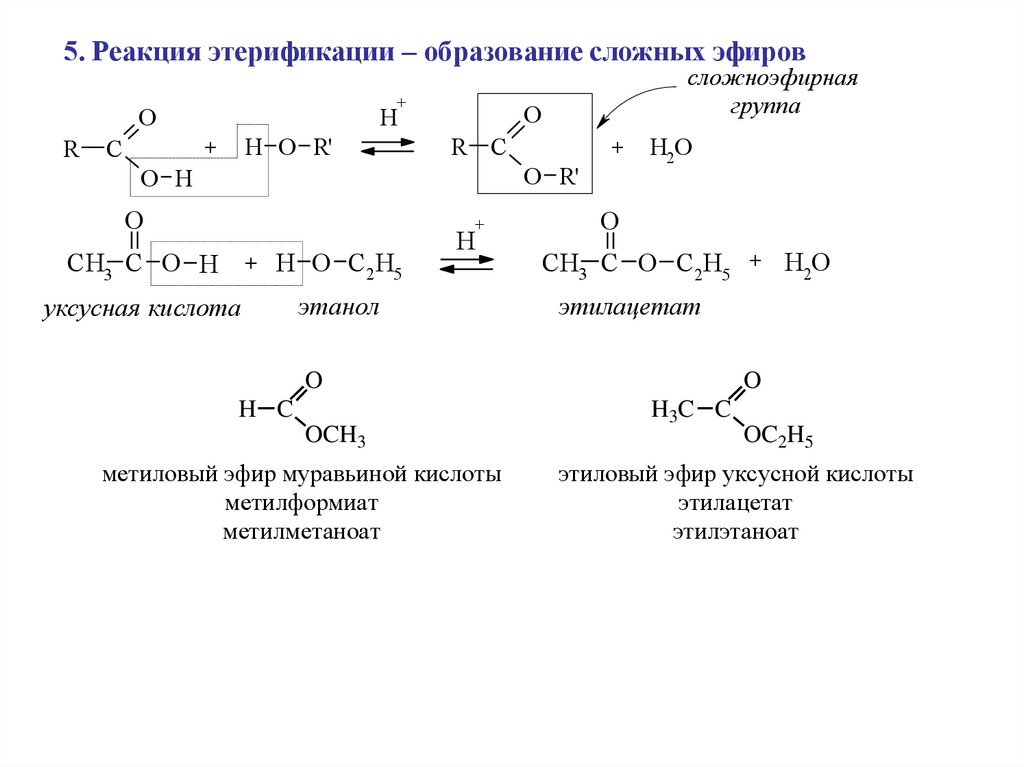
5. Реакция этерификации – образование сложных эфиров+
O
R
C
O
H
H O R'
+
сложноэфирная
группа
R C
+
O R'
O H
O
+
CH3 C O H
+ H O C2 H5
уксусная кислота
этанол
H
H2O
O
CH3 C O C2H5 + H2O
этилацетат
O
H C
OCH3
метиловый эфир муравьиной кислоты
метилформиат
метилметаноат
O
H3C C
OC2H5
этиловый эфир уксусной кислоты
этилацетат
этилэтаноат
20.
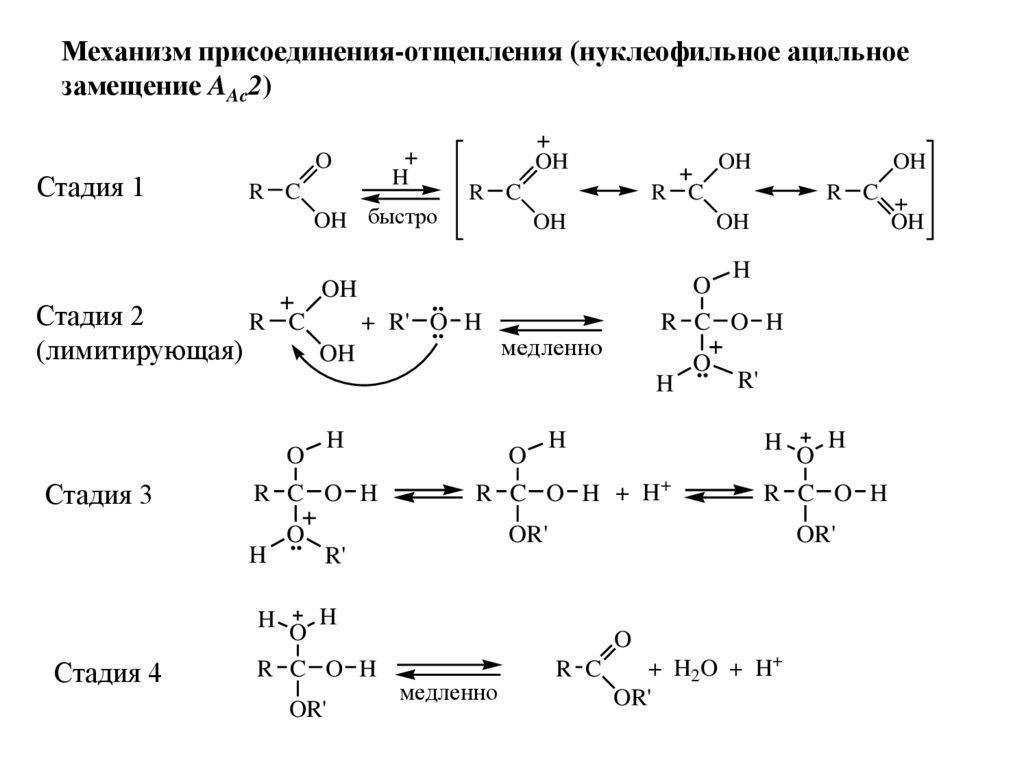
Механизм присоединения-отщепления (нуклеофильное ацильноезамещение AAc2)
Стадия 1
O
R C
H
OH быстро
OH
OH
R C
R C
OH
H
Стадия 3
R C O H
H
O
..
O
H
OR'
R'
H
OR'
O
медленно
O
R C O H
OR'
H
Стадия 4
O
..
H
R C O H + H+
R'
H
O
R C O H
OH
H
O
R C O H
..
Стадия 2
+ R' O
R C
.. H
медленно
(лимитирующая)
OH
H
R C
OH
OH
O
OH
R C
+ H2O + H+
OR'
21.
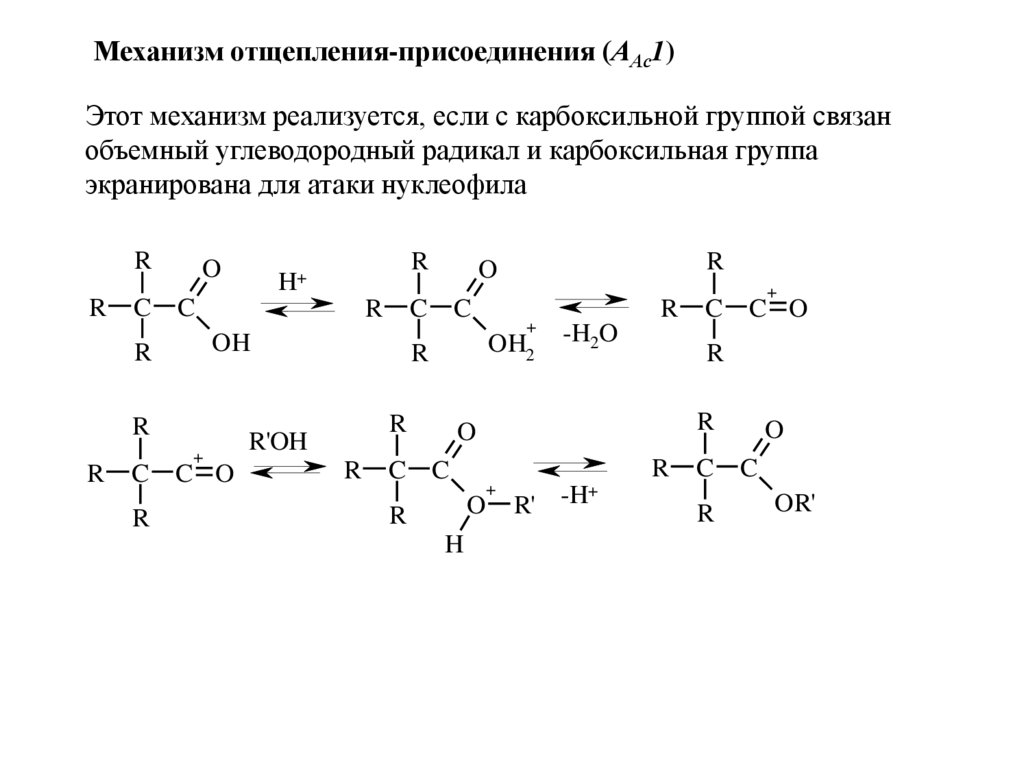
Механизм отщепления-присоединения (ААс1)Этот механизм реализуется, если с карбоксильной группой связан
объемный углеводородный радикал и карбоксильная группа
экранирована для атаки нуклеофила
R
R
C
O
C
R
R
C
R
+
C O
C
R
R
C
+
OH2
R
R'OH
R
O
C
OH
R
R
R
H+
R
-H2O
R
R
O
R
H
+
C O
R
O
C
C
+
+
R' -H
C
R
O
C
OR'
22.
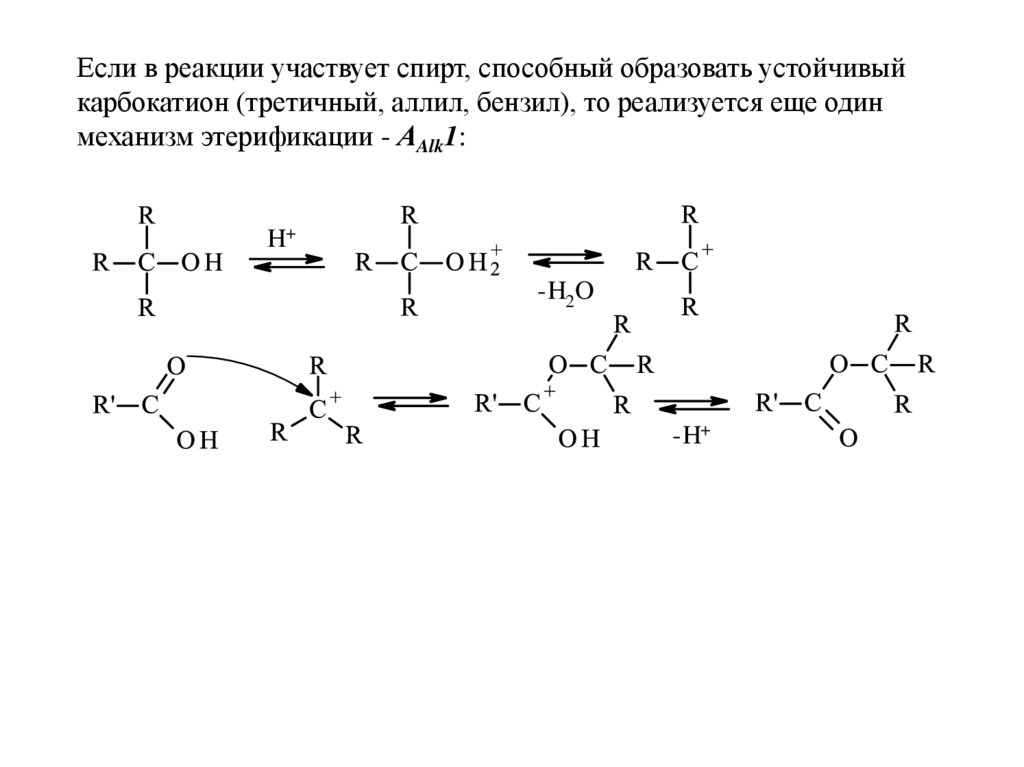
Если в реакции участвует спирт, способный образовать устойчивыйкарбокатион (третичный, аллил, бензил), то реализуется еще один
механизм этерификации - АAlk1:
H+
-H2O
-H+
23.
6. Реакция карбоновых кислот с аммиаком и аминами.Амиды карбоновых кислот R-СОNН2
O
O
O
t
R C
R C
R C
+ NH3
+
H
O
NH2
O NH4
2
O H
кислота
амид
соль аммония
O
H C
NH2
формамид
метанамид
O
O
CH3 C
NH2
ацетамид
этанамид
O
HO C OH
угольная кислота
CH3 CH2 CH2 C
NH2
бутирамид
бутанамид
O
H2N C NH2
карбамид (мочевина)
амидная
группа
24.
7. Декарбоксилирование карбоновых кислот1) образование углеводородов
Реакция происходит в присутствии различных катализаторов, содержащих
медь (например, Cu/хинолин).
CH3СН2СООН CH3CH3 + CO2
К реакциям декарбоксилирования также относится синтез Кольбе (синтез
алканов в результате электролиза растворов солей карбоновых кислот )
2) образование кетонов
Катализаторы - оксиды тория (IV) или марганца (IV)
Аналогичные результаты получаются при нагревании кальциевых,
бариевых, ториевых солей, а также солей железа (II):
3) реакция Бородина-Хунсдикера
25.
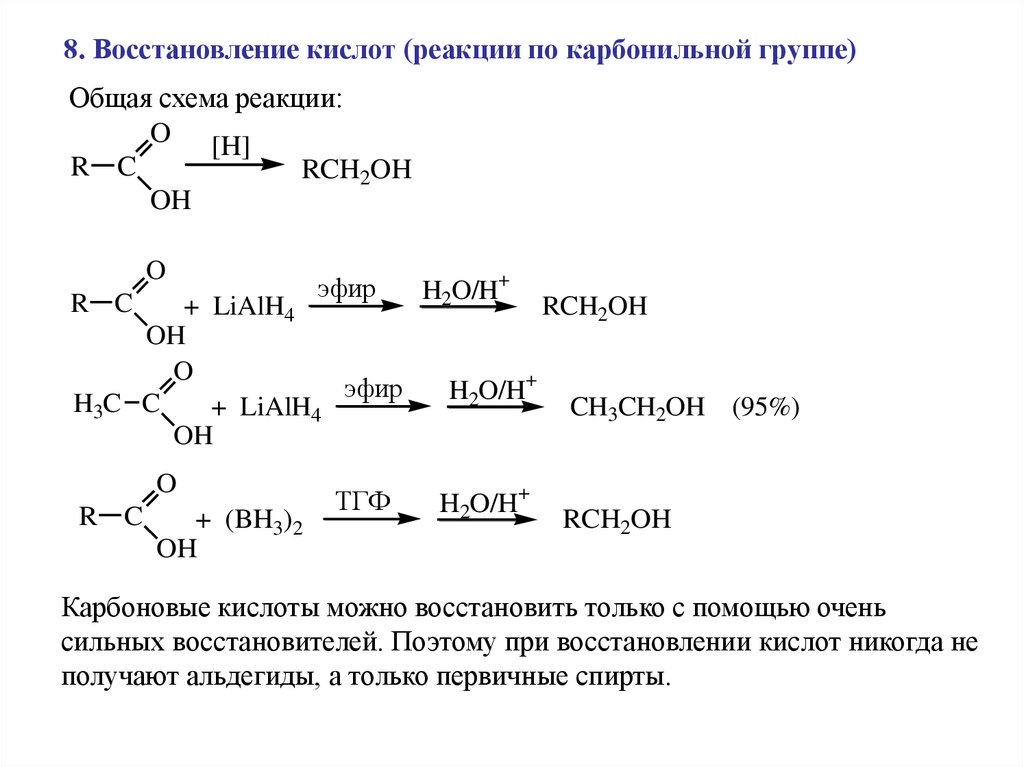
8. Восстановление кислот (реакции по карбонильной группе)Общая схема реакции:
O [H]
R C
RCH2OH
OH
O
R C
эфир
+ LiAlH4
OH
O
эфир
H3C C
+ LiAlH4
OH
O
R C
+ (BH3)2
OH
ТГФ
H2O/H+
H2O/H+
H2O/H+
RCH2OH
CH3CH2OH (95%)
RCH2OH
Карбоновые кислоты можно восстановить только с помощью очень
сильных восстановителей. Поэтому при восстановлении кислот никогда не
получают альдегиды, а только первичные спирты.
26.
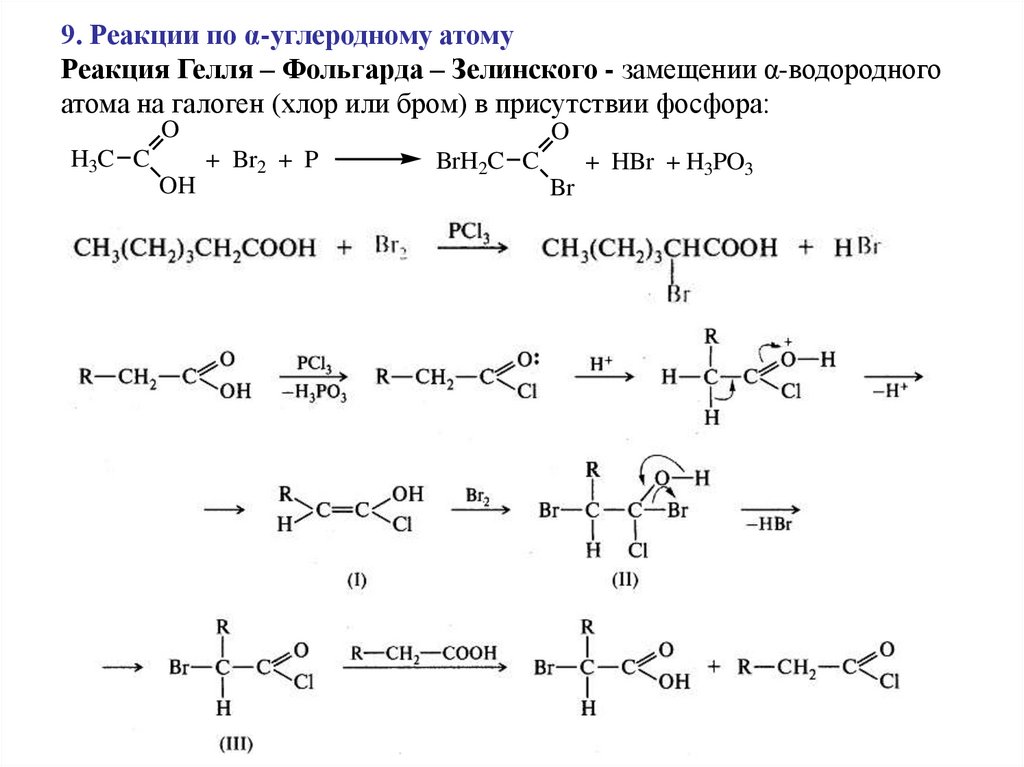
9. Реакции по α-углеродному атомуРеакция Гелля – Фольгарда – Зелинского - замещении α-водородного
атома на галоген (хлор или бром) в присутствии фосфора:
O
H3C C
OH
O
+ Br2 + P
BrH2C C
Br
+ HBr + H3PO3
27.
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТO
R C
X
Х
Типы производных
Х
Типы производных
-OR’
Сложные эфиры
-NH2, -NHR,
-NR2
Амиды
-OOH
Пероксикислоты
-NHOH
Гидроксамовые
кислоты
-OC(O)R
Ангидриды
-NHNH2
Гидразиды
-SR’
Тиоэфиры
-NHC(O)NH2 Уреиды
-Hal
Галогенангидриды
-N3
Ацилазиды
К функциональным производным карбоновых кислот также относятся
OR'
соли, нитрилы, ортоэфиры:
O
R C
R C N
O Na
R C OR'
OR'
28.
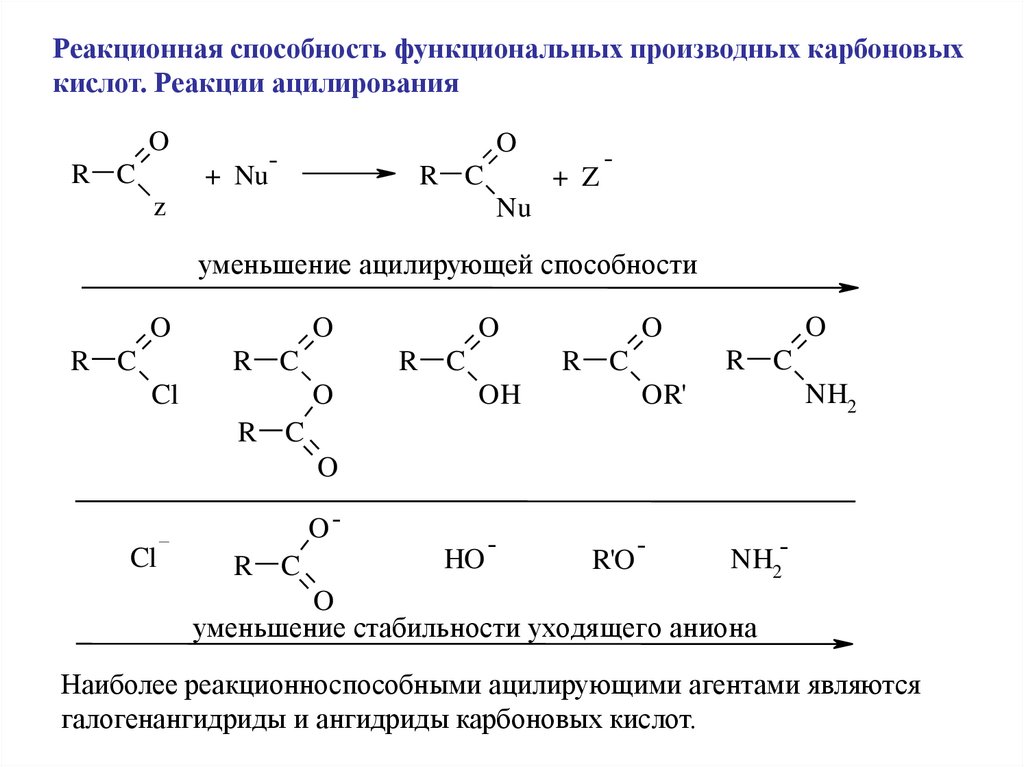
Реакционная способность функциональных производных карбоновыхкислот. Реакции ацилирования
O
R C
+ Nu
O
-
R C
z
+ Z
-
Nu
уменьшение ацилирующей способности
O
R C
O
R C
Cl
O
R C
O
O
O
R C
R C
NH2
OR'
OH
R C
O
OCl
R C
HO
-
R'O
-
NH2-
O
уменьшение стабильности уходя щего аниона
Наиболее реакционноспособными ацилирующими агентами являются
галогенангидриды и ангидриды карбоновых кислот.
29.
Галогенангидриды карбоновых кислотO
R C
X
где Х = F, Cl, Br, I
хлорангидрид уксусной кислоты
ацетилхлорид
этаноилхлорид
O
H3C C
Cl
O
CH3 CH2 CH2 C
Br
бромангидрид масляной кислоты
бромистый бутирил
бутаноилбромид
СПОСОБЫ ПОЛУЧЕНИЯ
а) из карбоновых кислот действием PCl5, PCl3, PBr3, SOCl2
O
O
+ SOCl2
R C
OH
+ SO2 + HCl
R C
Cl
б) присоединением НХ к кетенам
O
CH2 C O + HBr
бромангидрид уксусной кислоты
CH3 C
Br
30.
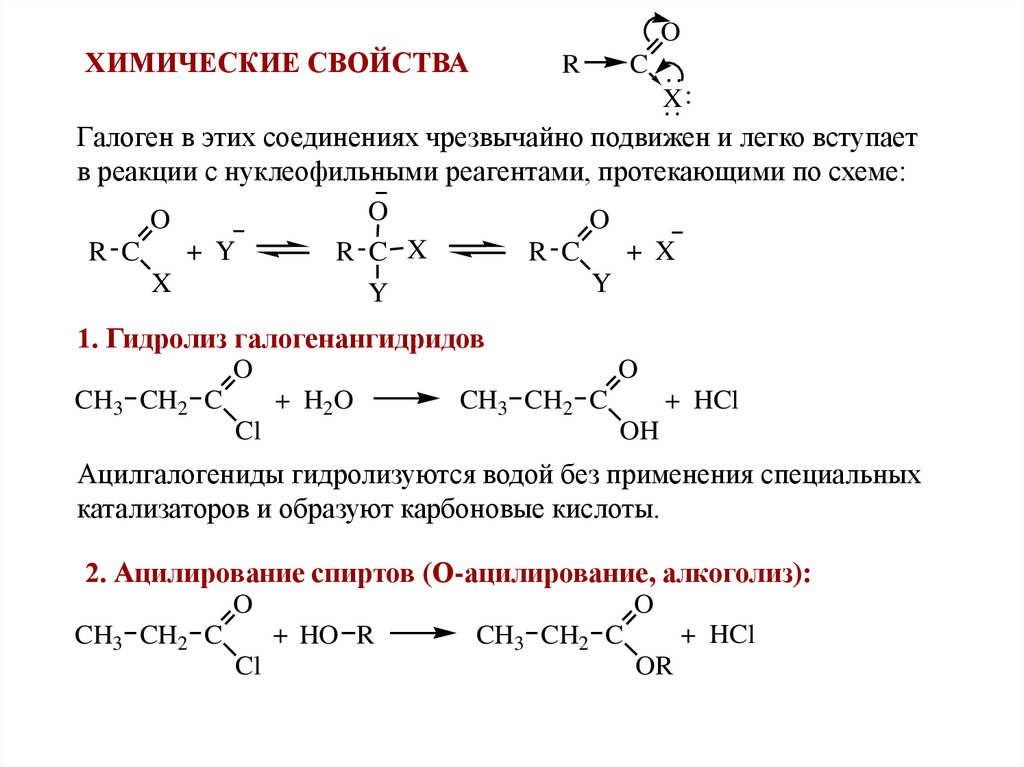
OХИМИЧЕСКИЕ СВОЙСТВА
R
C
X:
Галоген в этих соединениях чрезвычайно подвижен и легко вступает
в реакции с нуклеофильными реагентами, протекающими по схеме:
O
O
O
+ Y
+ X
R C
R C X
R C
X
Y
Y
1. Гидролиз галогенангидридов
O
O
+ H2O
CH3 CH2 C
Cl
+ HCl
CH3 CH2 C
OH
Ацилгалогениды гидролизуются водой без применения специальных
катализаторов и образуют карбоновые кислоты.
2. Ацилирование спиртов (О-ацилирование, алкоголиз):
O
O
+ HO R
CH3 CH2 C
Cl
+ HCl
CH3 CH2 C
OR
31.
3. Ацилирование аминов и их производных (N-ацилирование, аммонолиз)O
O
+ NH3
CH3 CH2 C
CH3 CH2 C
Cl
O
NH2
O
+ H3C NH2
CH3 CH2 C
+ HCl
CH3 CH2 C
Cl
NHCH3
O
O
NH3+Cl-
+ HCl
NH C
C
Cl
+
4. Ацилирование ароматических соединений (С-ацилирование, реакция
Фриделя-Крафтса)
O
CH3 CH2 C
+
Cl
AlCl3
O
CH3 CH2 C
32.
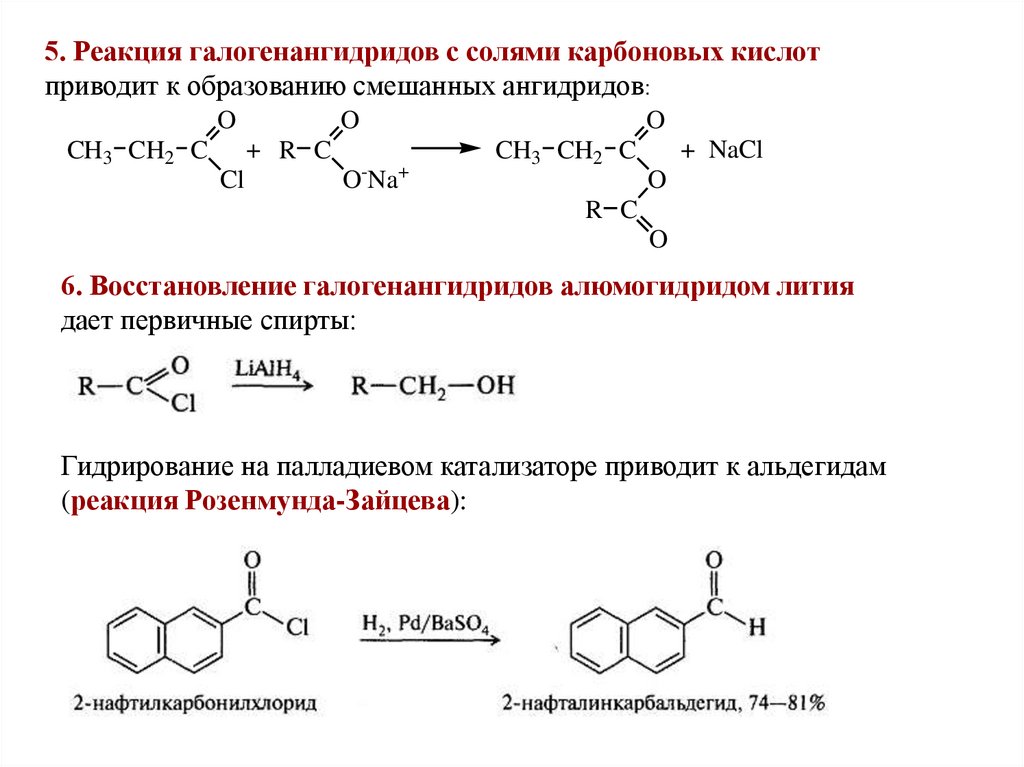
5. Реакция галогенангидридов с солями карбоновых кислотприводит к образованию смешанных ангидридов:
O
O
+ R C
CH3 CH2 C
Cl
O-Na+
O
+ NaCl
CH3 CH2 C
O
R C
O
6. Восстановление галогенангидридов алюмогидридом лития
дает первичные спирты:
Гидрирование на палладиевом катализаторе приводит к альдегидам
(реакция Розенмунда-Зайцева):
33.
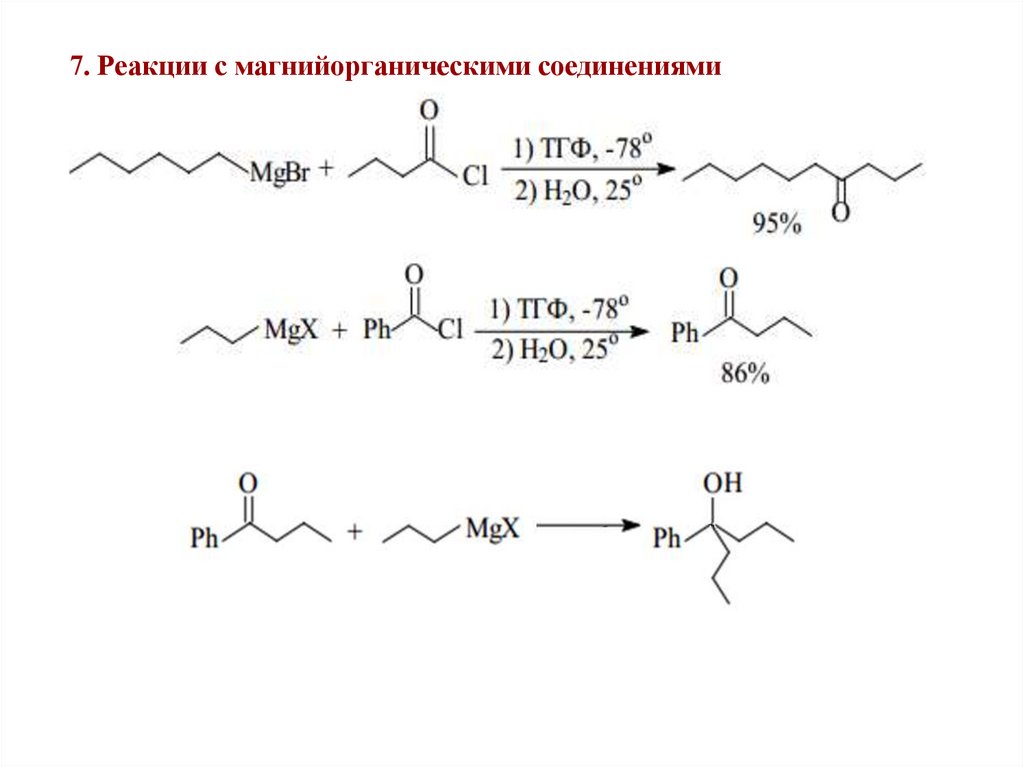
7. Реакции с магнийорганическими соединениями34.
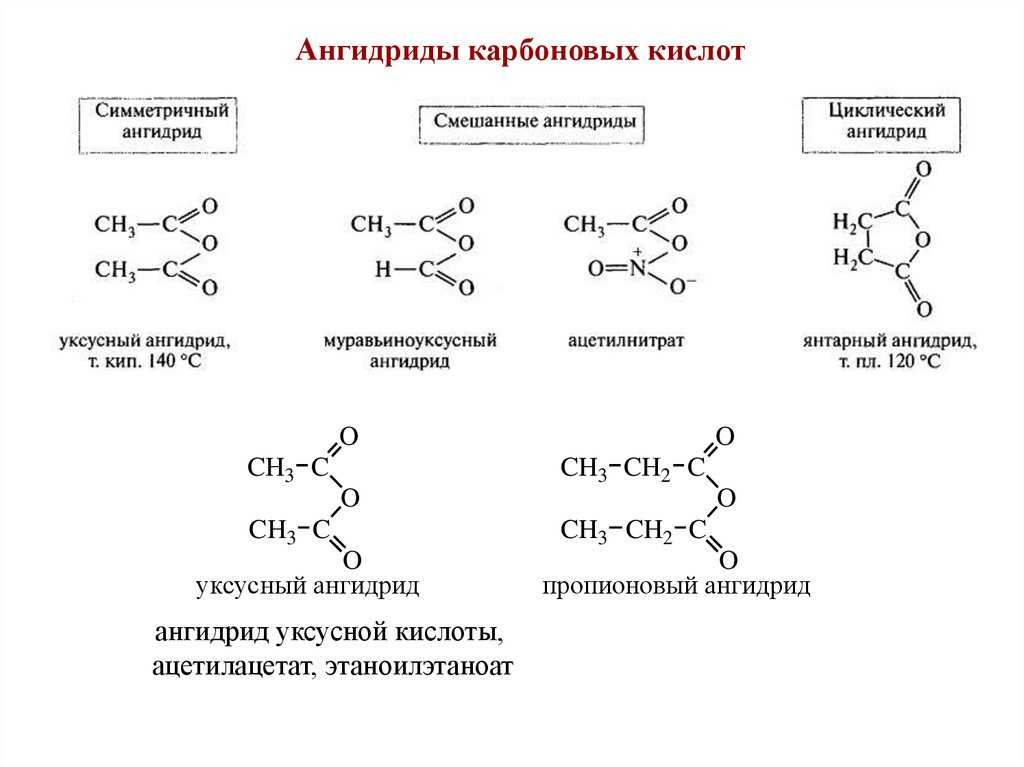
Ангидриды карбоновых кислотO
CH3 C
O
CH3 CH2 C
O
CH3 C
O
уксусный ангидрид
ангидрид уксусной кислоты,
ацетилацетат, этаноилэтаноат
O
CH3 CH2 C
O
пропионовый ангидрид
35.
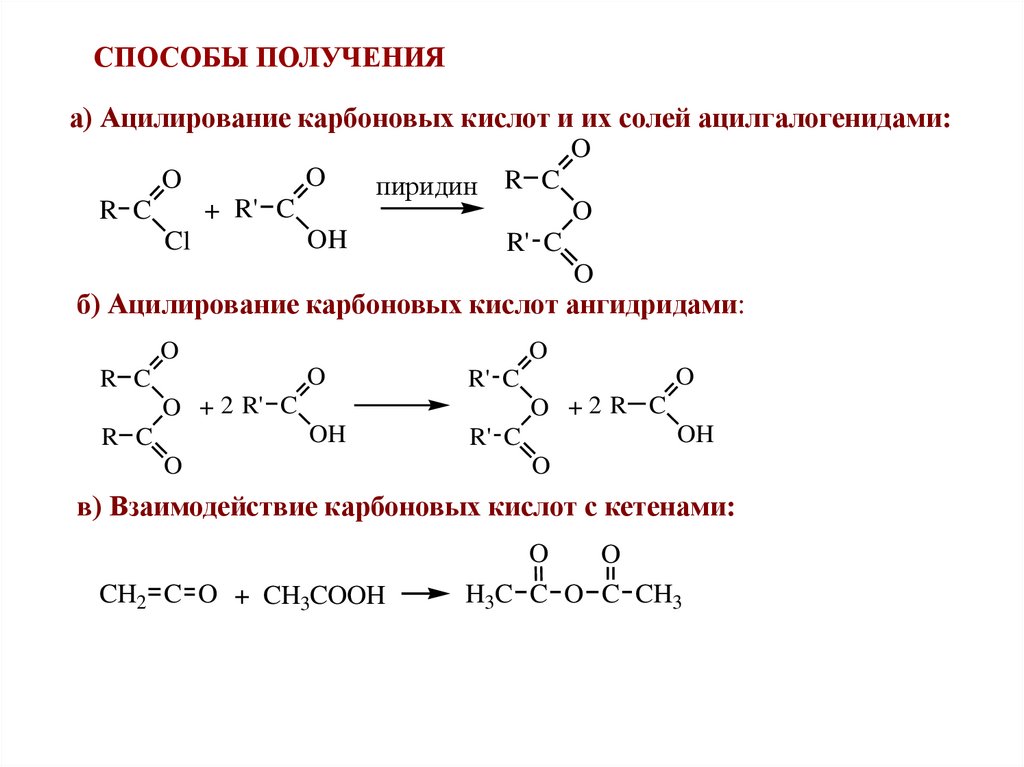
СПОСОБЫ ПОЛУЧЕНИЯа) Ацилирование карбоновых кислот и их солей ацилгалогенидами:
O
O
O
пиридин R C
+ R' C
R C
O
OH
Cl
R' C
O
б) Ацилирование карбоновых кислот ангидридами:
O
O
O
R C
O + 2 R' C
O +2 R C
OH
R C
O
R' C
O
OH
R' C
O
в) Взаимодействие карбоновых кислот с кетенами:
CH2 C O + CH3COOH
O
O
H3C C O C CH3
36.
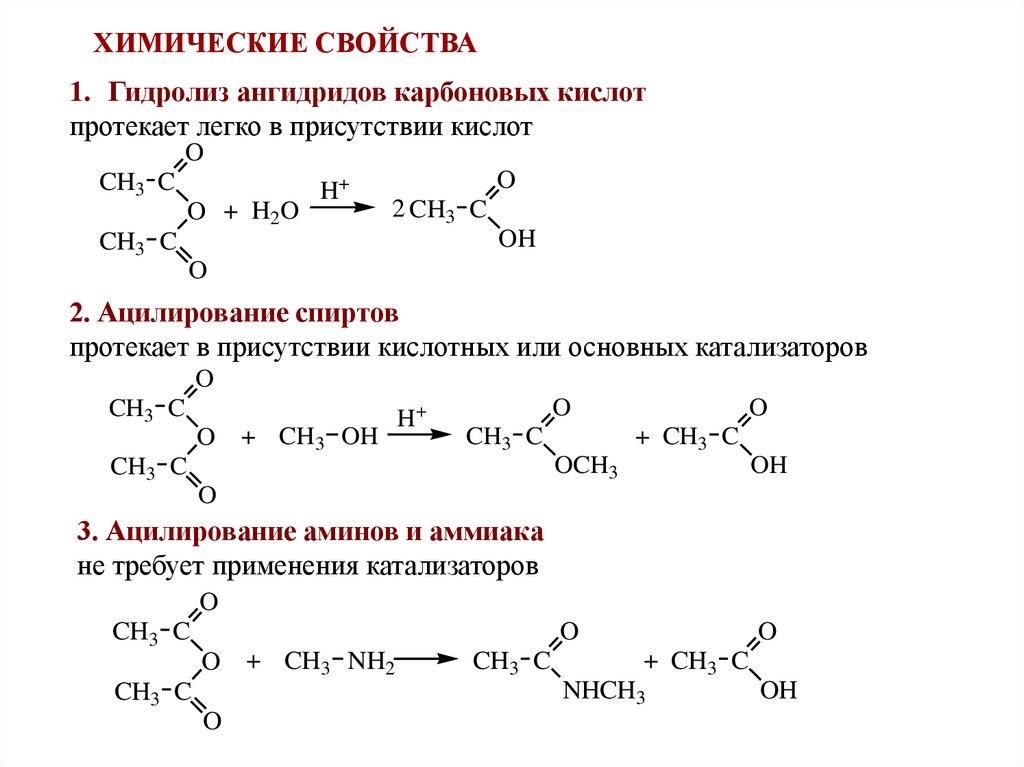
ХИМИЧЕСКИЕ СВОЙСТВА1. Гидролиз ангидридов карбоновых кислот
протекает легко в присутствии кислот
O
CH3 C
O + H2O
H+
O
2 CH3 C
OH
CH3 C
O
2. Ацилирование спиртов
протекает в присутствии кислотных или основных катализаторов
O
CH3 C
O
+ CH3 OH
H+
O
+ CH3 C
CH3 C
CH3 C
O
OCH3
OH
O
O
O
3. Ацилирование аминов и аммиака
не требует применения катализаторов
O
CH3 C
O + CH3 NH2
CH3 C
+ CH3 C
NHCH3
CH3 C
O
OH
37.
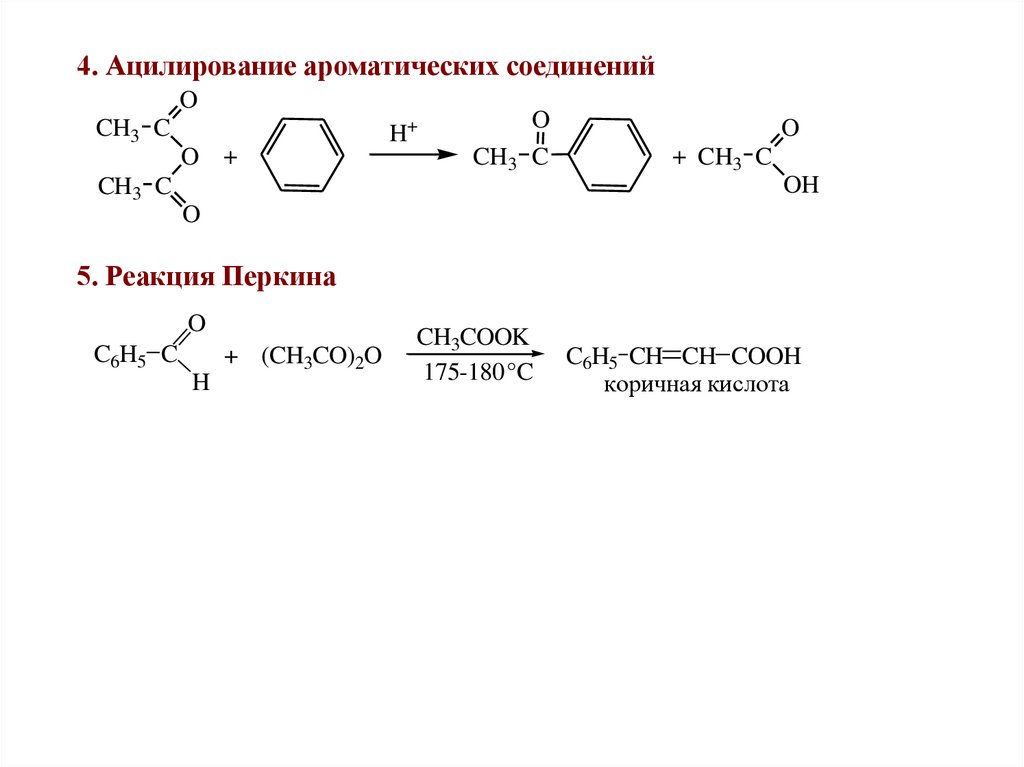
4. Ацилирование ароматических соединенийO
CH3 C
O +
H+
O
CH3 C
O
+ CH3 C
OH
CH3 C
O
5. Реакция Перкина
O
C6H5 C
H
+ (CH3CO)2O
CH3COOK
175-180 °C
C6H5 CH CH COOH
коричная кислота
38.
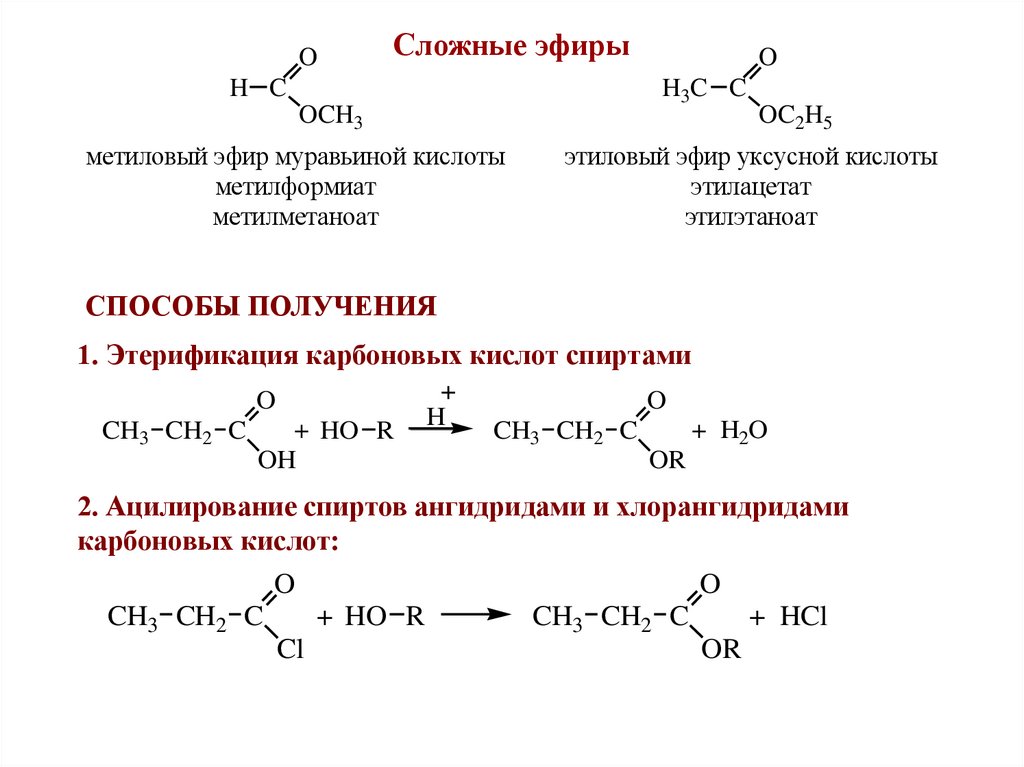
OСложные эфиры
H C
O
H3C C
OCH3
метиловый эфир муравьиной кислоты
метилформиат
метилметаноат
OC2H5
этиловый эфир уксусной кислоты
этилацетат
этилэтаноат
СПОСОБЫ ПОЛУЧЕНИЯ
1. Этерификация карбоновых кислот спиртами
O
CH3 CH2 C
+ HO R
OH
H
O
+ H2O
CH3 CH2 C
OR
2. Ацилирование спиртов ангидридами и хлорангидридами
карбоновых кислот:
O
O
+ HO R
+ HCl
CH3 CH2 C
CH3 CH2 C
Cl
OR
39.
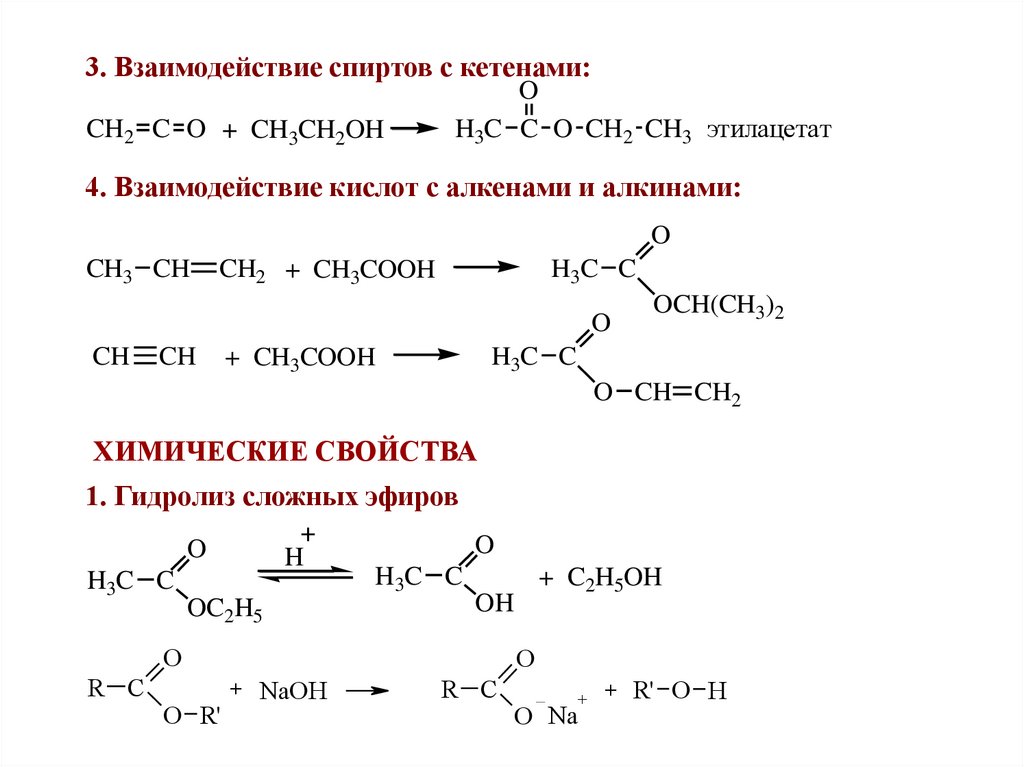
3. Взаимодействие спиртов с кетенами:CH2 C O + CH3CH2OH
O
H3C C O CH2 CH3 этилацетат
4. Взаимодействие кислот с алкенами и алкинами:
O
CH3 CH
CH2 + CH3COOH
H3C C
O
CH
CH
OCH(CH3)2
H3C C
+ CH3COOH
O CH CH2
ХИМИЧЕСКИЕ СВОЙСТВА
1. Гидролиз сложных эфиров
O
H3C C
H
OC2H5
O
H3C C
OH
O
R C
O R'
+ C2H5OH
O
+ NaOH
R C
+
O Na
+ R' O H
40.
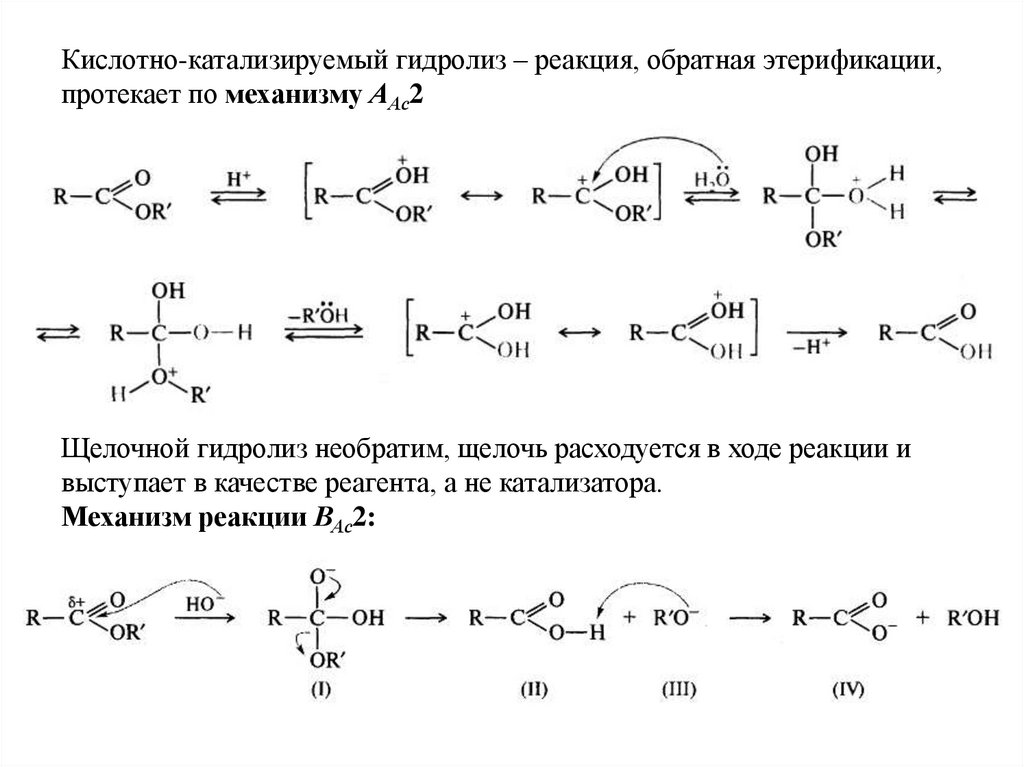
Кислотно-катализируемый гидролиз – реакция, обратная этерификации,протекает по механизму ААс2
Щелочной гидролиз необратим, щелочь расходуется в ходе реакции и
выступает в качестве реагента, а не катализатора.
Механизм реакции ВАс2:
41.
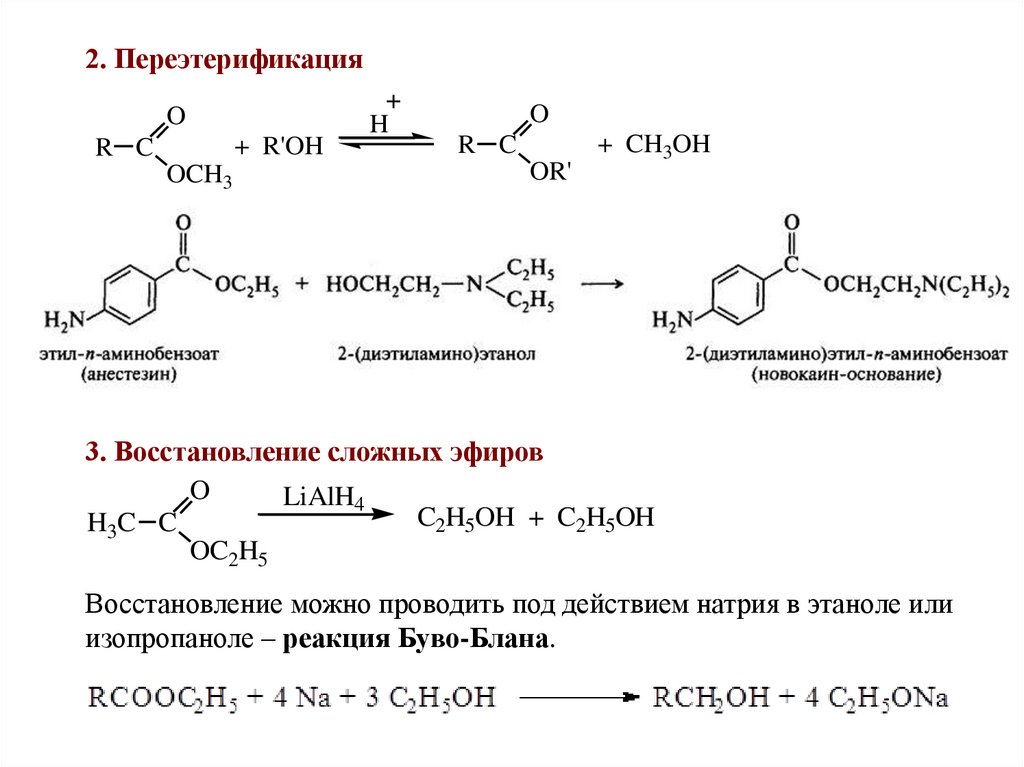
2. ПереэтерификацияO
+ R'OH
R C
OCH3
H
O
R C
OR'
+ CH3OH
3. Восстановление сложных эфиров
O
LiAlH4
C2H5OH + C2H5OH
H3C C
OC2H5
Восстановление можно проводить под действием натрия в этаноле или
изопропаноле – реакция Буво-Блана.
42.
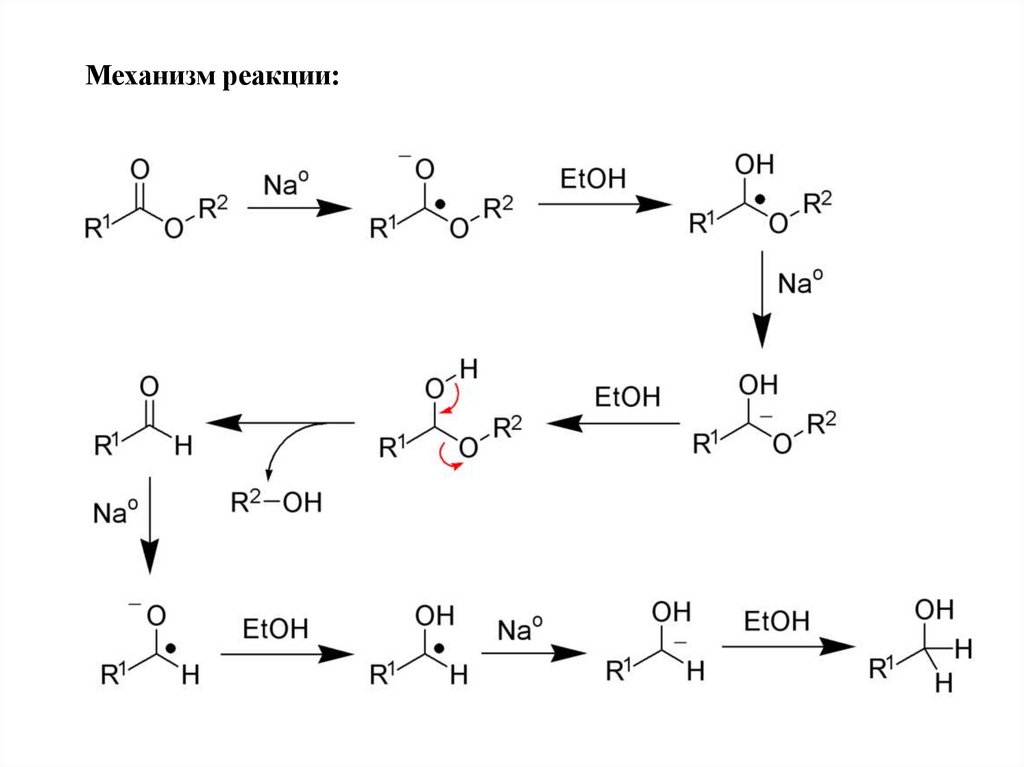
Механизм реакции:43.
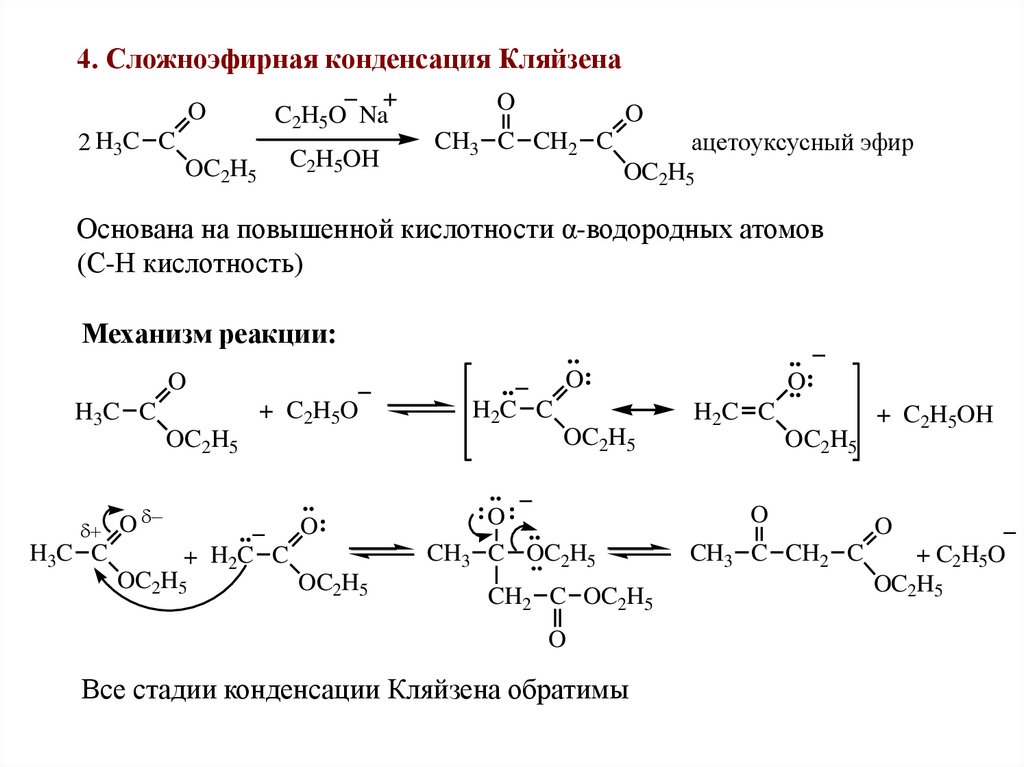
4. Сложноэфирная конденсация КляйзенаO
C2H5O Na
OC2H5
C2H5OH
2 H3C C
O
O
ацетоуксусный эфир
CH3 C CH2 C
OC2H5
Основана на повышенной кислотности α-водородных атомов
(С-Н кислотность)
Механизм реакции:
O
+ C2H5O
H3C C
OC2H5
OC2H5
H3C C
O
..
H
C
+ 2 C
OC2H5
..
H2C C
..
O:
..
O:
OC2H5
..
:O:
..
CH3 C OC
.. 2H5
CH2 C OC2H5
O
Все стадии конденсации Кляйзена обратимы
H2C C
..
O
.. :
OC2H5
O
CH3 C CH2 C
+ C2H5OH
O
+ C2H5O
OC2H5
44.
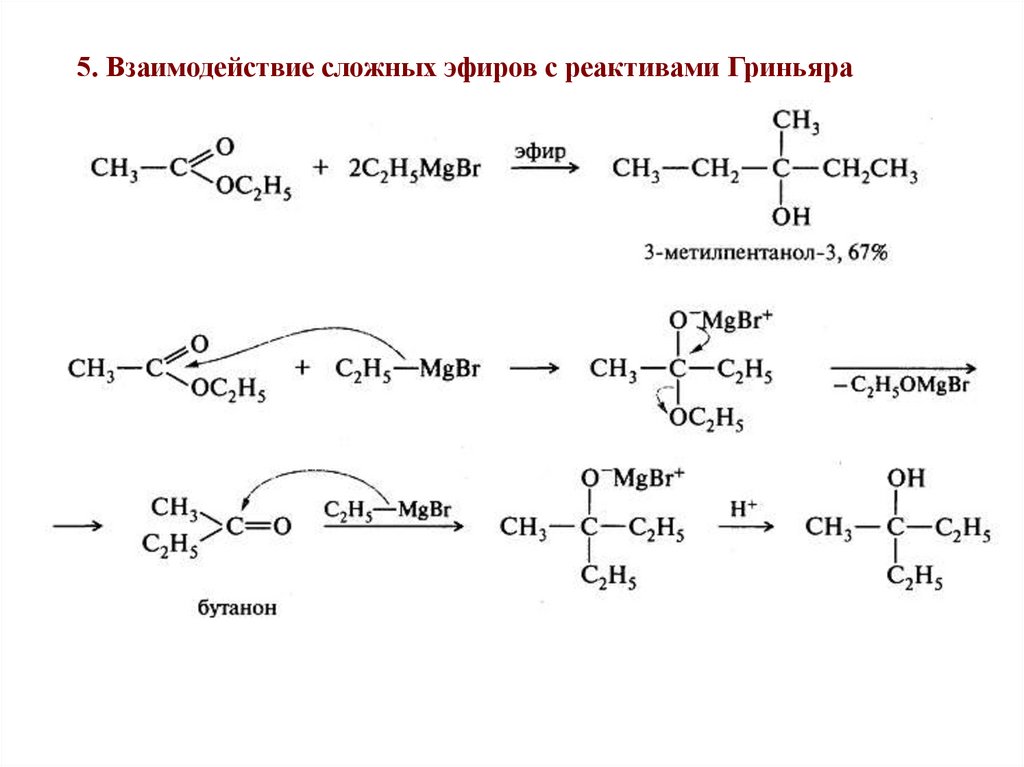
5. Взаимодействие сложных эфиров с реактивами Гриньяра45.
Жиры сложные эфиры трехатомного спирта глицерина и высшиходноатомных карбоновых кислот.
CH2 O H
CH O H
CH2 O H
глицерин
+
HO
CO R
CH2 O CO R
HO
CO R'
CH O CO R'
HO CO R''
карбоновые кислоты
-3H2O
CH2 O CO R''
триацилглицерин
В состав жиров (триацилглицеринов) входят остатки
насыщенных кислот:
и ненасыщенных:
масляной C3H7COOH
олеиновой C17H33COOH
пальмитиновой C15H31COOH
линолевой C17H31COOH
стеариновой C17H35COOH и др
линоленовой С17Н29СООН
арахидоновой С19Н31СООН
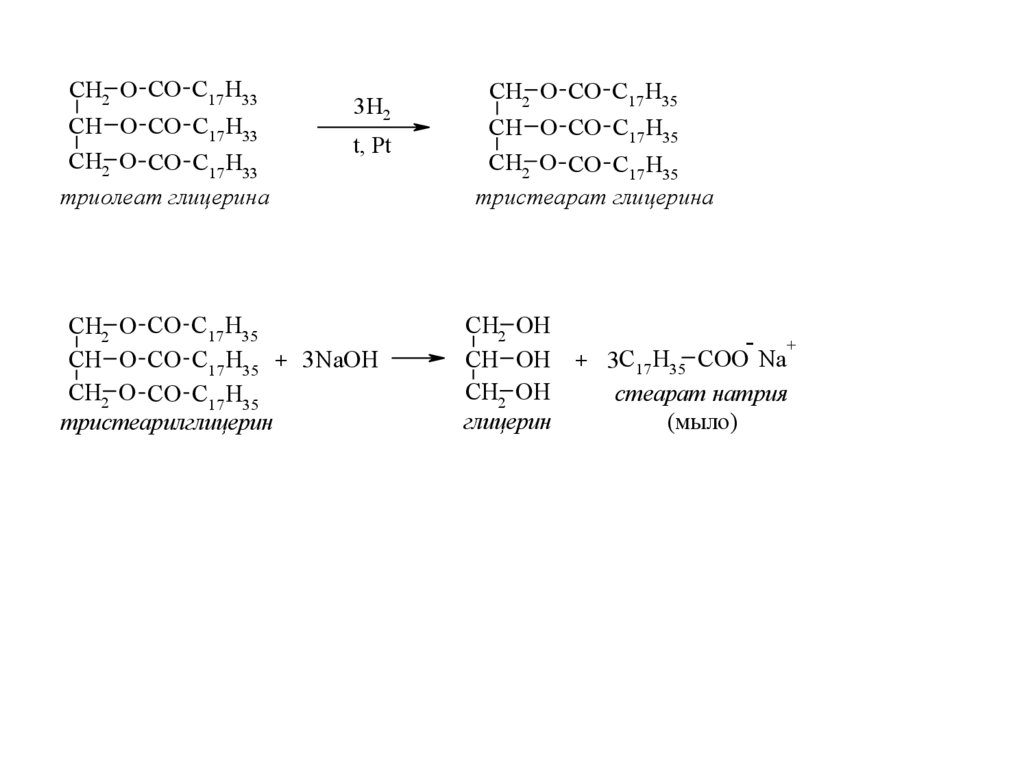
46.
CH2 O CО C17 H33CH O CО C17 H33
CH2 O CО C17 H33
3H2
CH2 O CО C17 H35
триолеат глицерина
CH O CО C17 H35
CH2 O CО C17 H35
тристеарат глицерина
CH2 O CО C17H35
CH O CО C17H35 + 3 NaOH
CH2 O CО C17H35
тристеарилглицерин
CH2 OH
CH OH
CH2 OH
глицерин
t, Pt
-
+
+ 3C17 H35 COO Na
стеарат натрия
(мыло)
47.
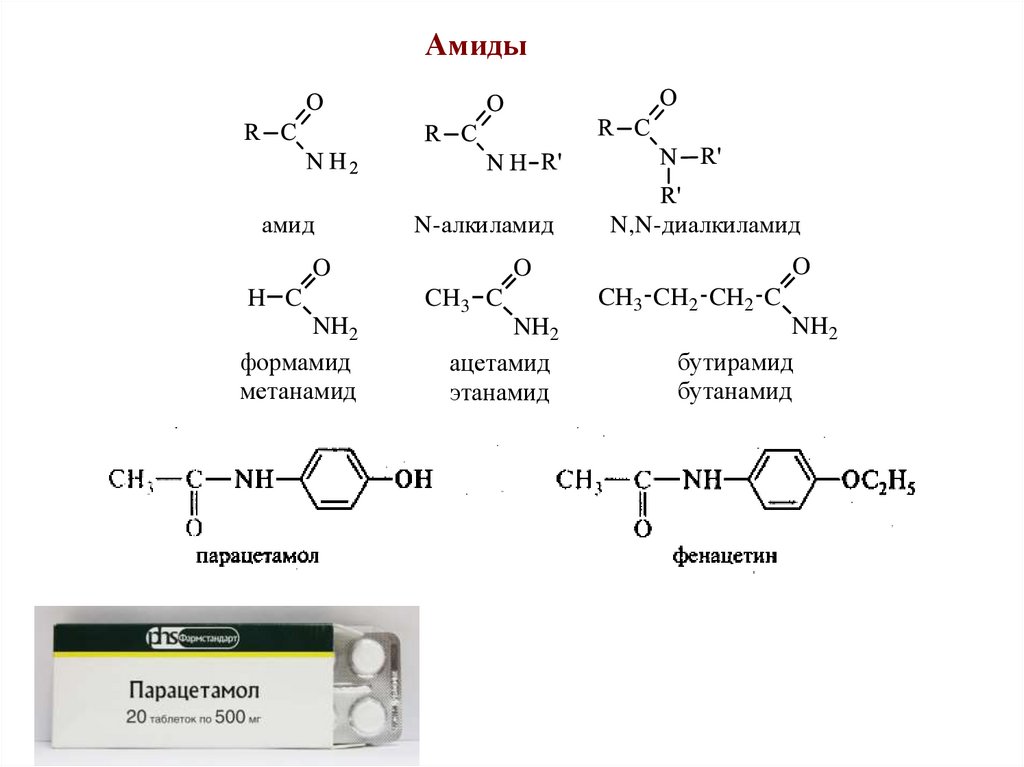
Амидыамид
N-алкиламид
O
H C
NH2
формамид
метанамид
N,N-диалкиламид
O
O
CH3 C
NH2
ацетамид
этанамид
CH3 CH2 CH2 C
NH2
бутирамид
бутанамид
48.
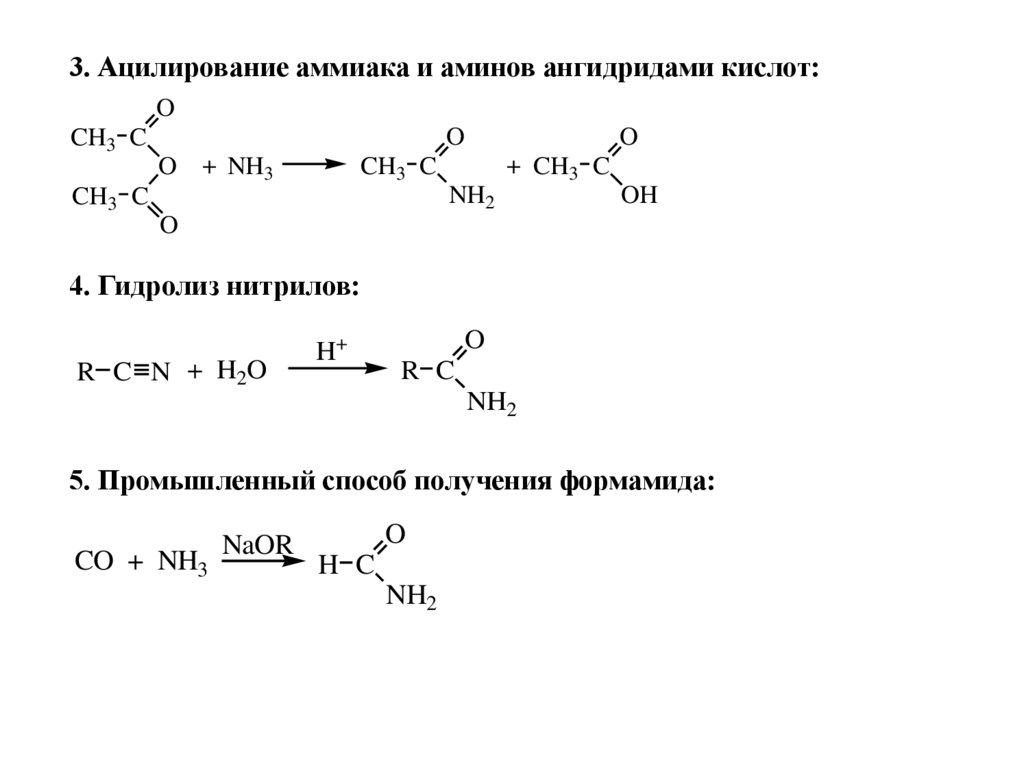
СПОСОБЫ ПОЛУЧЕНИЯ1. Ацилирование аммиака и аминов галогенангидридами кислот:
Чтобы сократить расход амина, реакцию проводят в присутствии
щелочи – метод Шоттена - Баумана
2. Ацилирование аммиака и аминов сложными эфирами:
O
O
+ NH3
+ C2H5OH
CH3 CH2 C
CH3 CH2 C
OC2H5
NH2
49.
3. Ацилирование аммиака и аминов ангидридами кислот:O
O
CH3 C
O
+ NH3
O
+ CH3 C
CH3 C
NH2
CH3 C
OH
O
4. Гидролиз нитрилов:
R C N + H2O
H+
O
R C
NH2
5. Промышленный способ получения формамида:
CO + NH3
NaOR
O
H C
NH2
50.
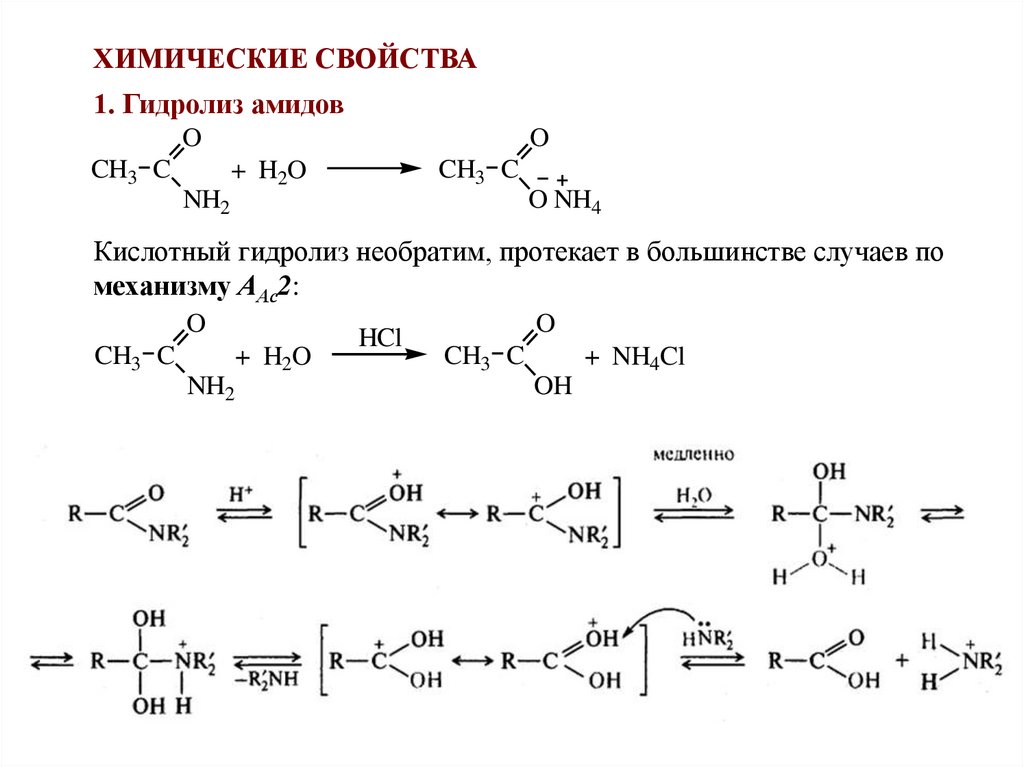
ХИМИЧЕСКИЕ СВОЙСТВА1. Гидролиз амидов
O
CH3 C
O
CH3 C
+ H2O
NH2
O NH4
Кислотный гидролиз необратим, протекает в большинстве случаев по
механизму ААс2:
O
CH3 C
+ H2O
NH2
HCl
O
CH3 C
+ NH4Cl
OH
51.
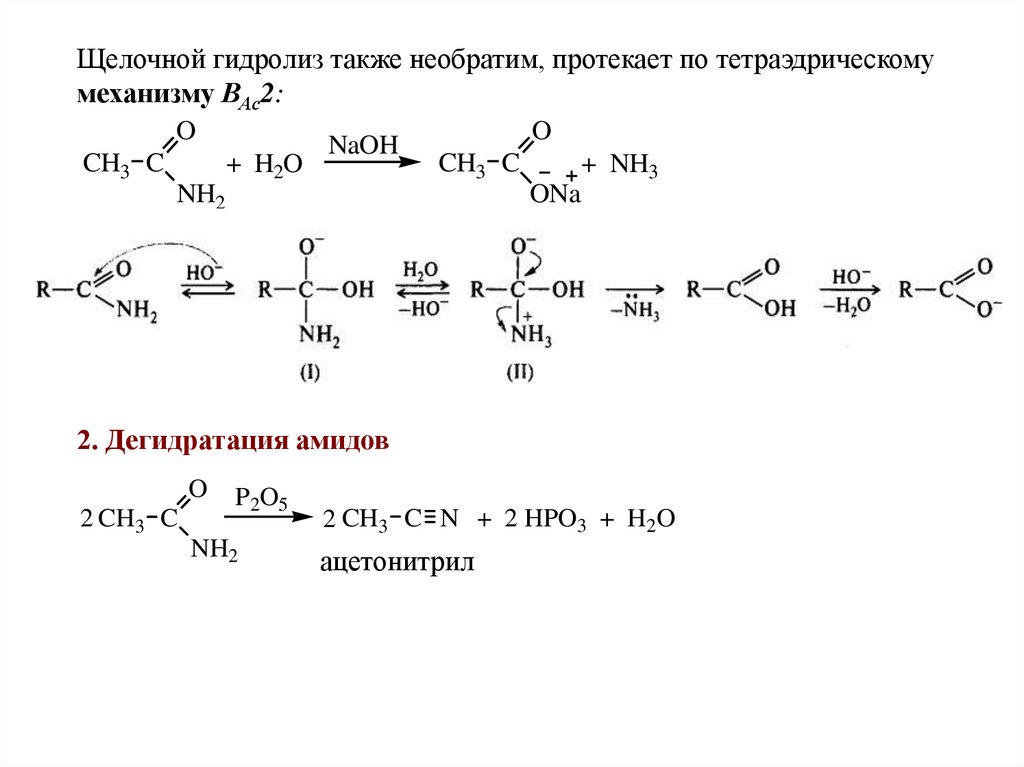
Щелочной гидролиз также необратим, протекает по тетраэдрическомумеханизму ВАс2:
O
CH3 C
+ H2O
NaOH
O
CH3 C
NH2
+ NH3
ONa
2. Дегидратация амидов
O
2 CH3 C
P2O5
NH2
2 CH3 C N + 2 HPO3 + H2O
ацетонитрил
52.
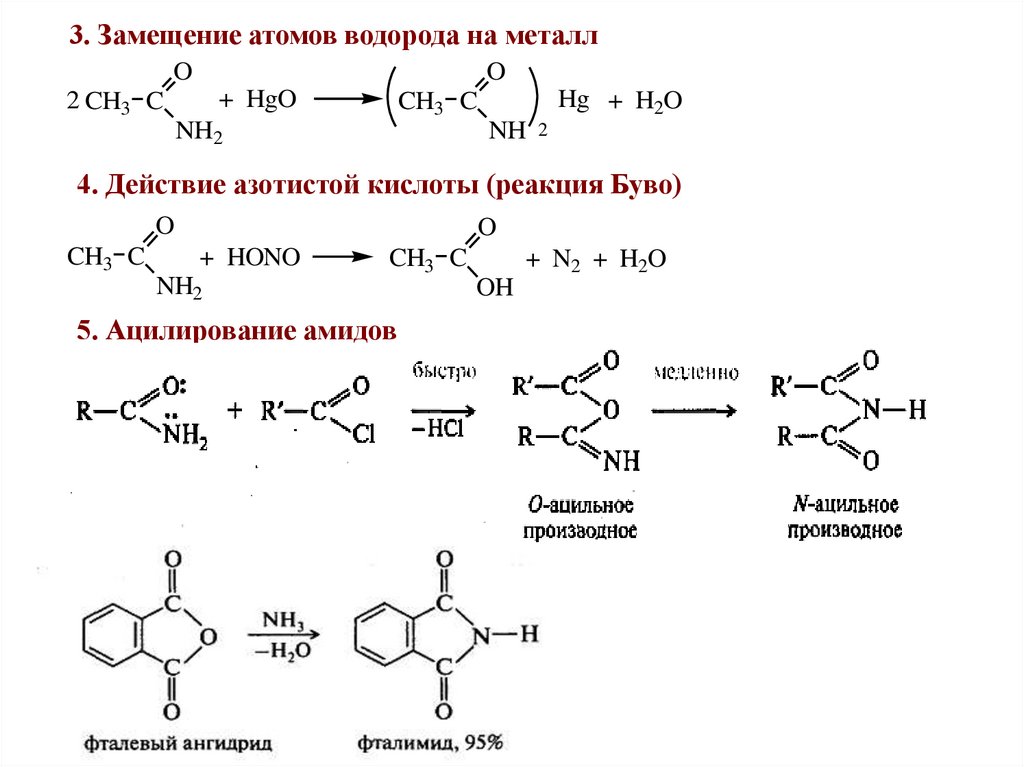
3. Замещение атомов водорода на металлO
O
+ HgO
2 CH3 C
Hg + H2O
CH3 C
NH2
NH 2
4. Действие азотистой кислоты (реакция Буво)
O
CH3 C
O
+ HONO
CH3 C
NH2
5. Ацилирование амидов
+ N2 + H2O
OH
53.
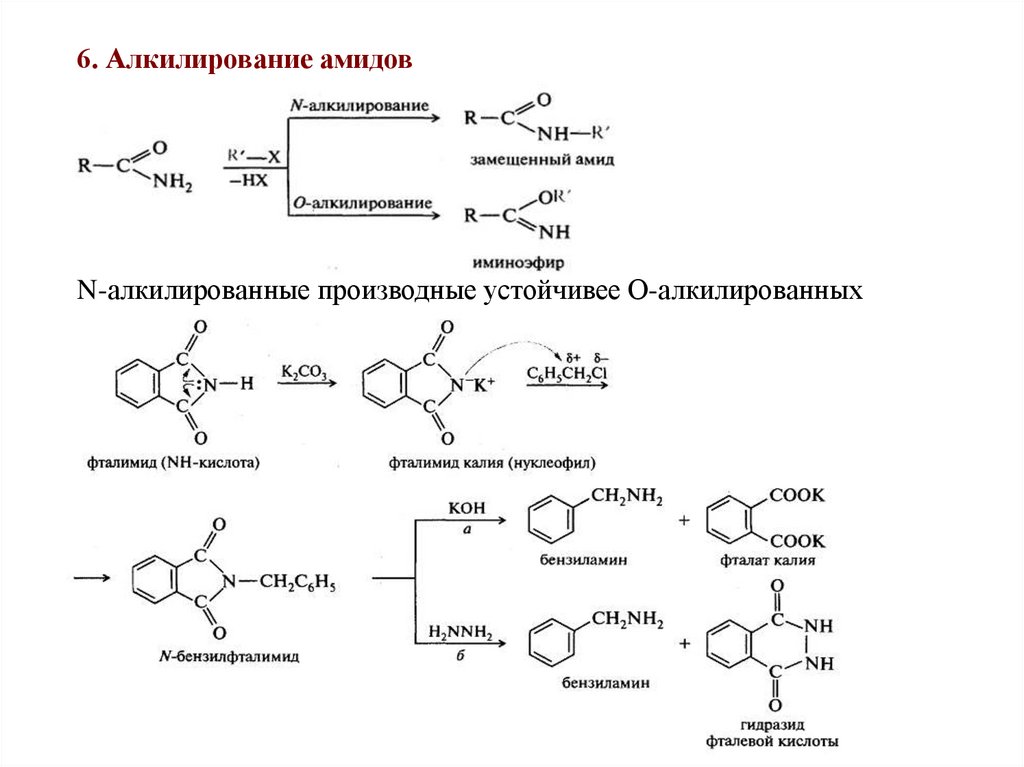
6. Алкилирование амидовN-алкилированные производные устойчивее О-алкилированных
54.
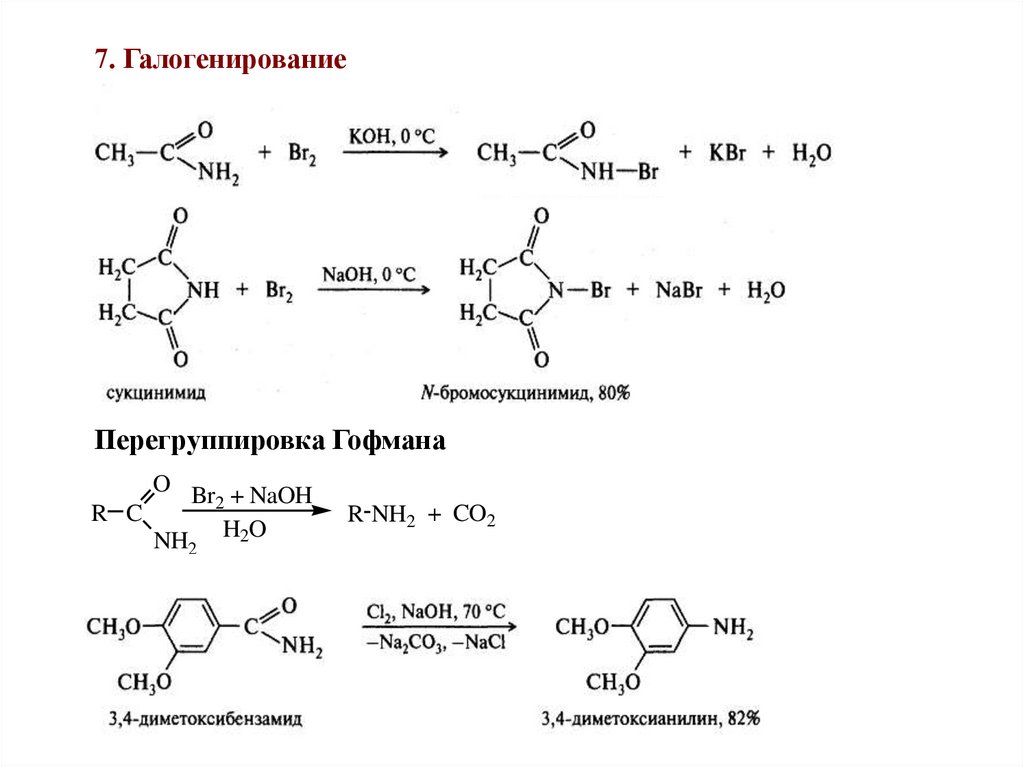
7. ГалогенированиеПерегруппировка Гофмана
O Br + NaOH
2
R C
NH H2O
2
R NH2 + CO2
55.
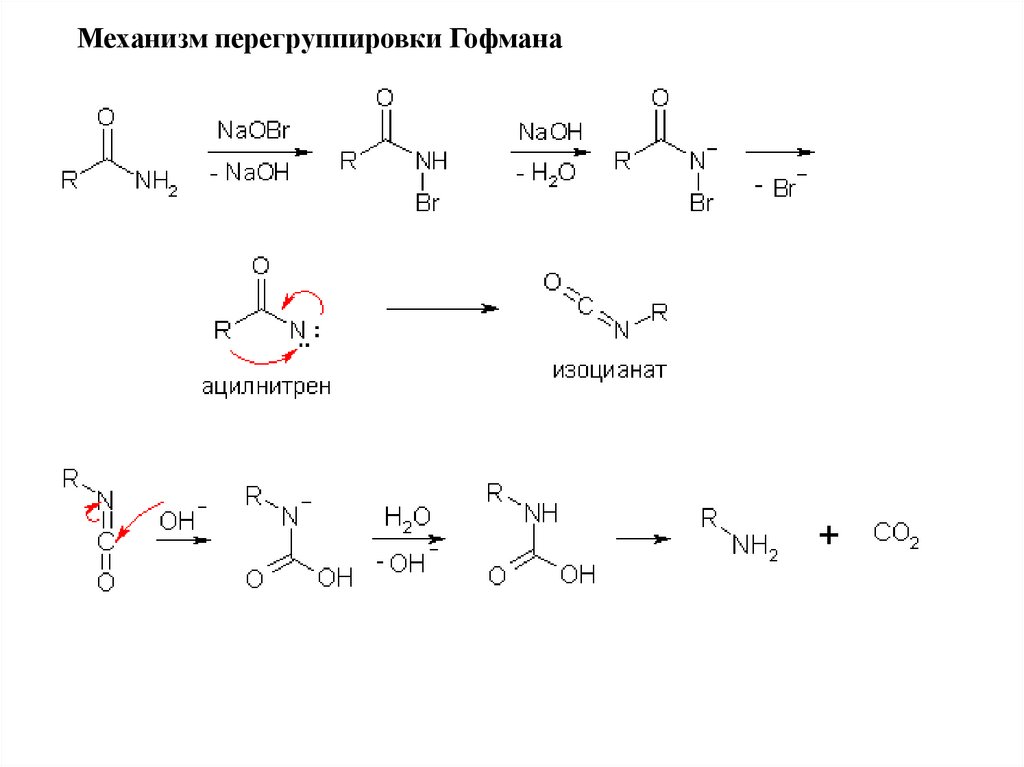
Механизм перегруппировки Гофмана56.
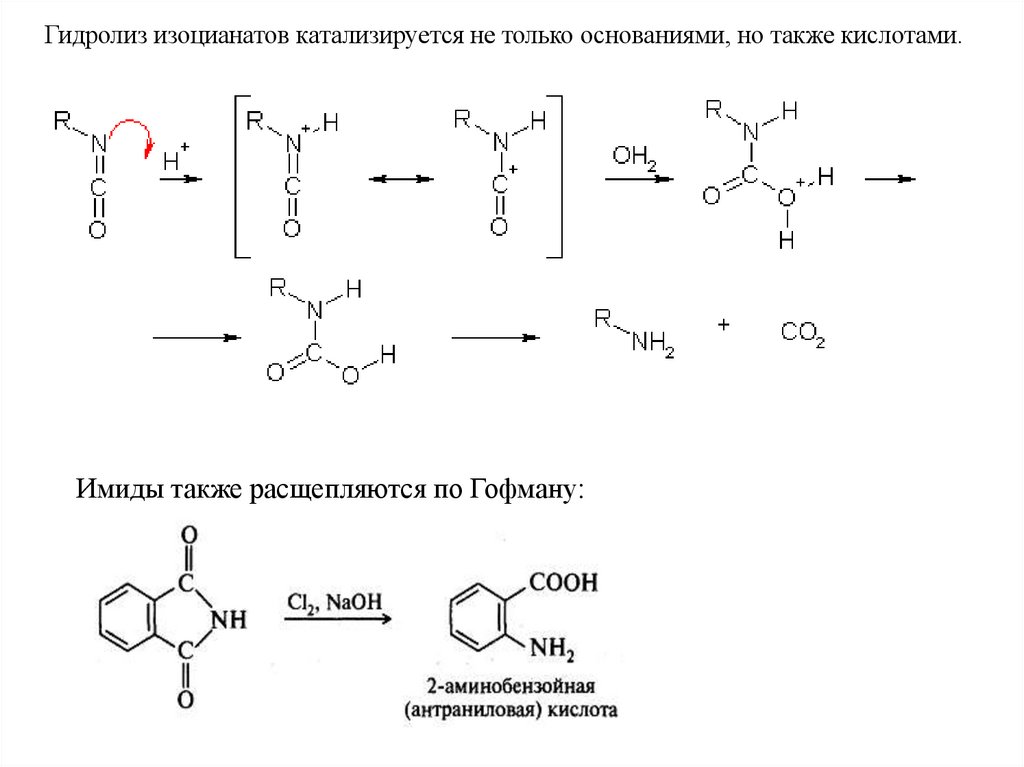
Гидролиз изоцианатов катализируется не только основаниями, но также кислотами.Имиды также расщепляются по Гофману:
57.
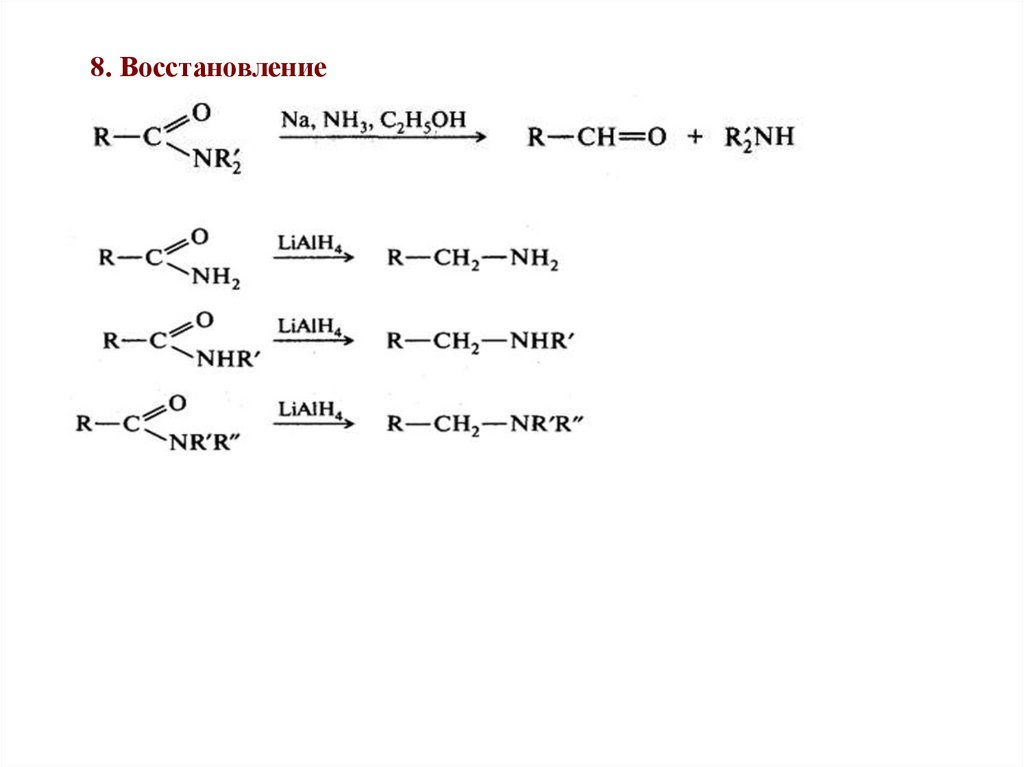
8. Восстановление58.
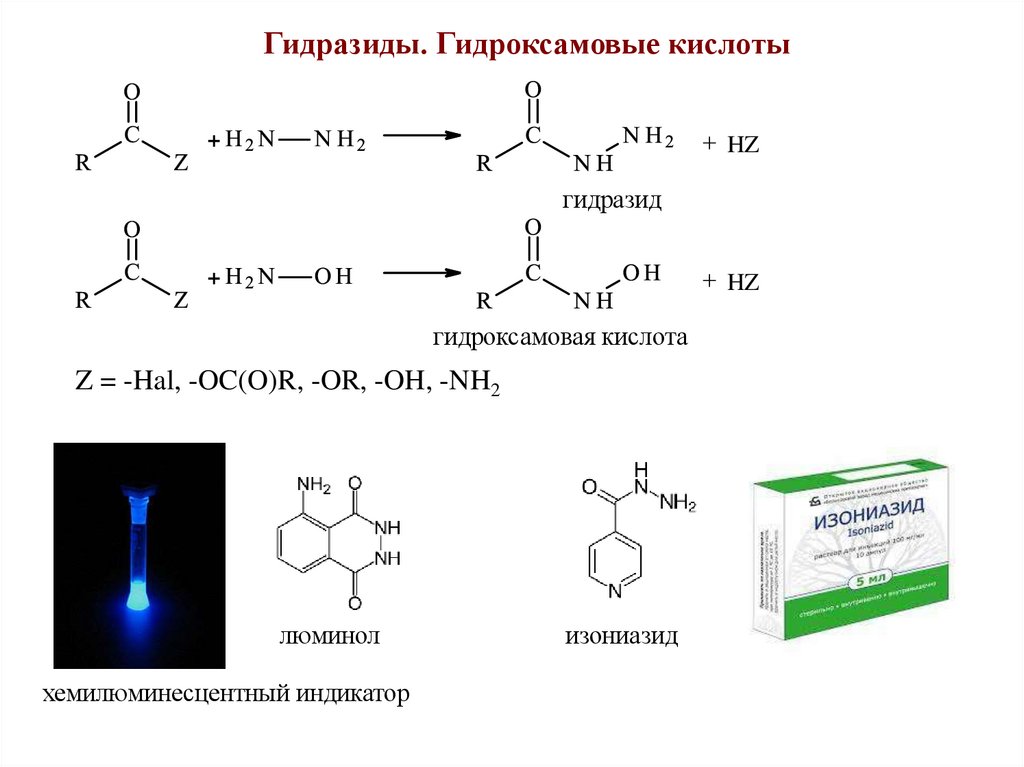
Гидразиды. Гидроксамовые кислотыHZ
гидразид
HZ
гидроксамовая кислота
Z = -Hal, -OC(O)R, -OR, -OH, -NH2
люминол
хемилюминесцентный индикатор
изониазид
59.
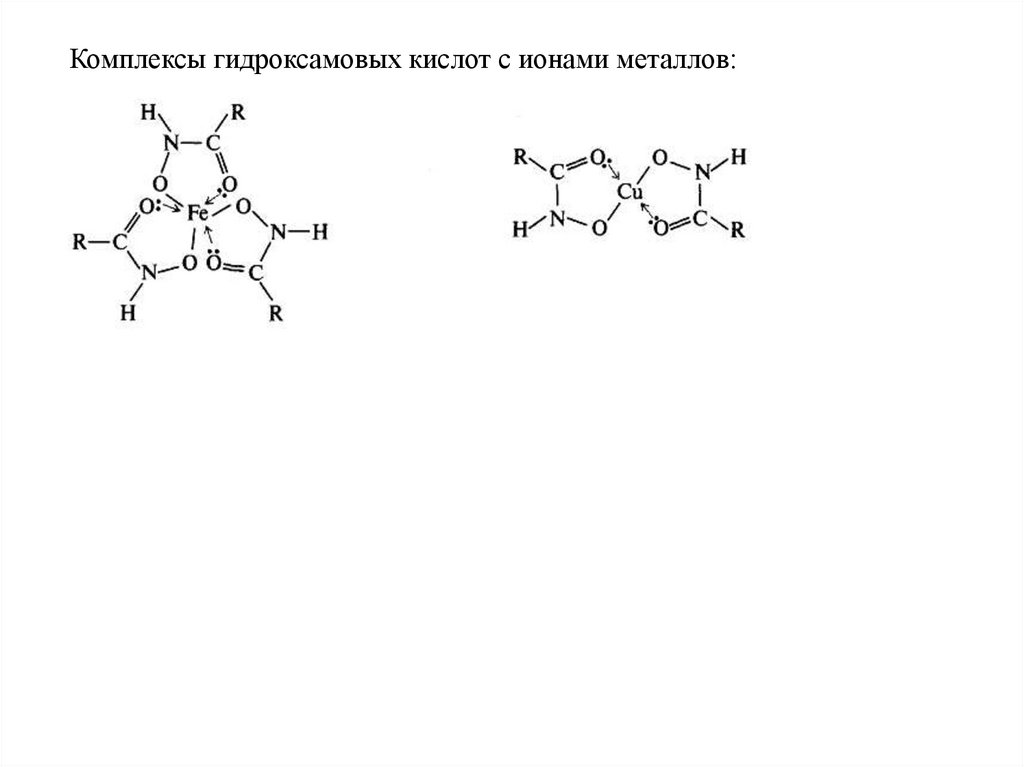
Комплексы гидроксамовых кислот с ионами металлов:60.
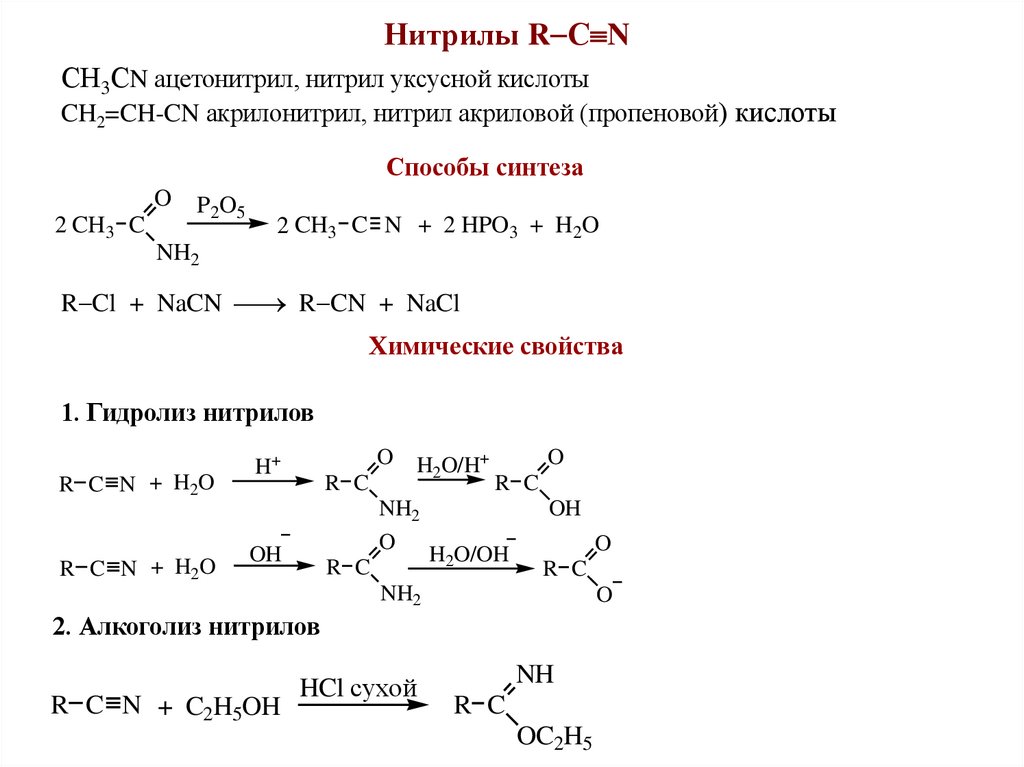
Нитрилы R С NСН3СN ацетонитрил, нитрил уксусной кислоты
CH2=CH-CN акрилонитрил, нитрил акриловой (пропеновой) кислоты
Способы синтеза
O
2 CH3 C
P2O5
2 CH3 C N + 2 HPO3 + H2O
NH2
R Cl + NaCN R CN + NaCl
Химические свойства
1. Гидролиз нитрилов
R C N + H2O
R C N + H2O
O
H+
R C
H2O/H+
NH2
O
OH
R C
O
R C
OH
H2O/OH
O
R C
NH2
O
2. Алкоголиз нитрилов
R C N + C2H5OH
HCl сухой
NH
R C
OC2H5
61.
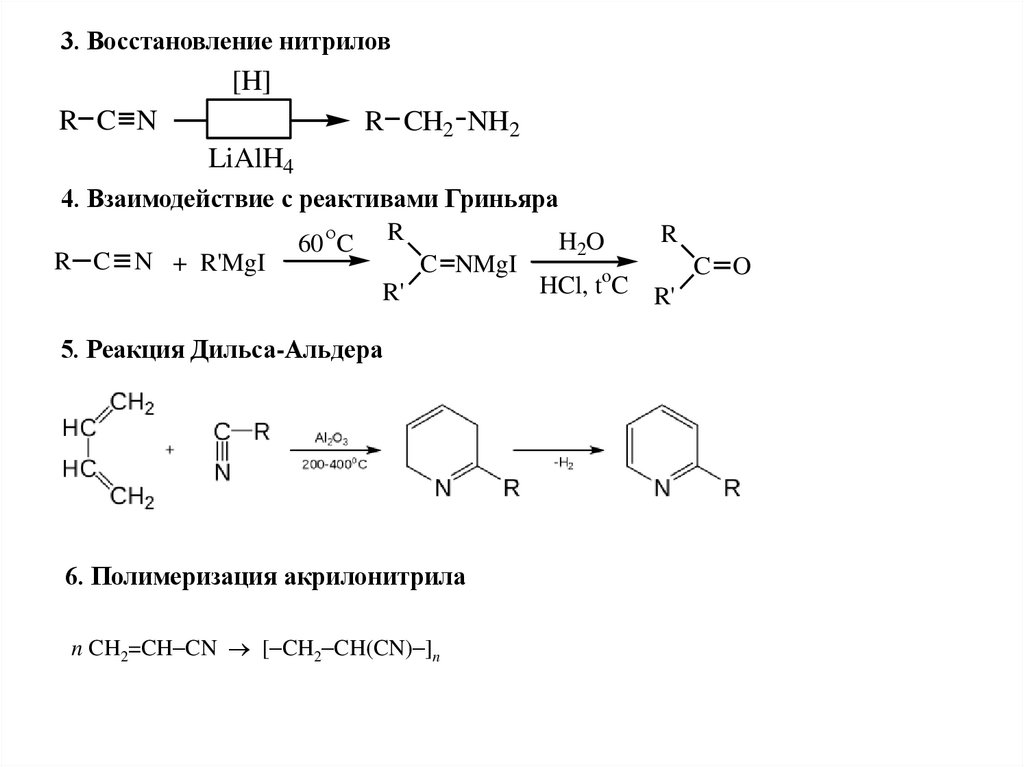
3. Восстановление нитрилов[H]
R C N
R CH2 NH2
LiAlH4
4. Взаимодействие с реактивами Гриньяра
R
H2O
60 C R
R C N + R'MgI
C NMgI
C O
o
HCl,
t
C
R'
R'
5. Реакция Дильса-Альдера
6. Полимеризация акрилонитрила
n CH2=CH CN [ CH2 CH(CN) ]n
62.
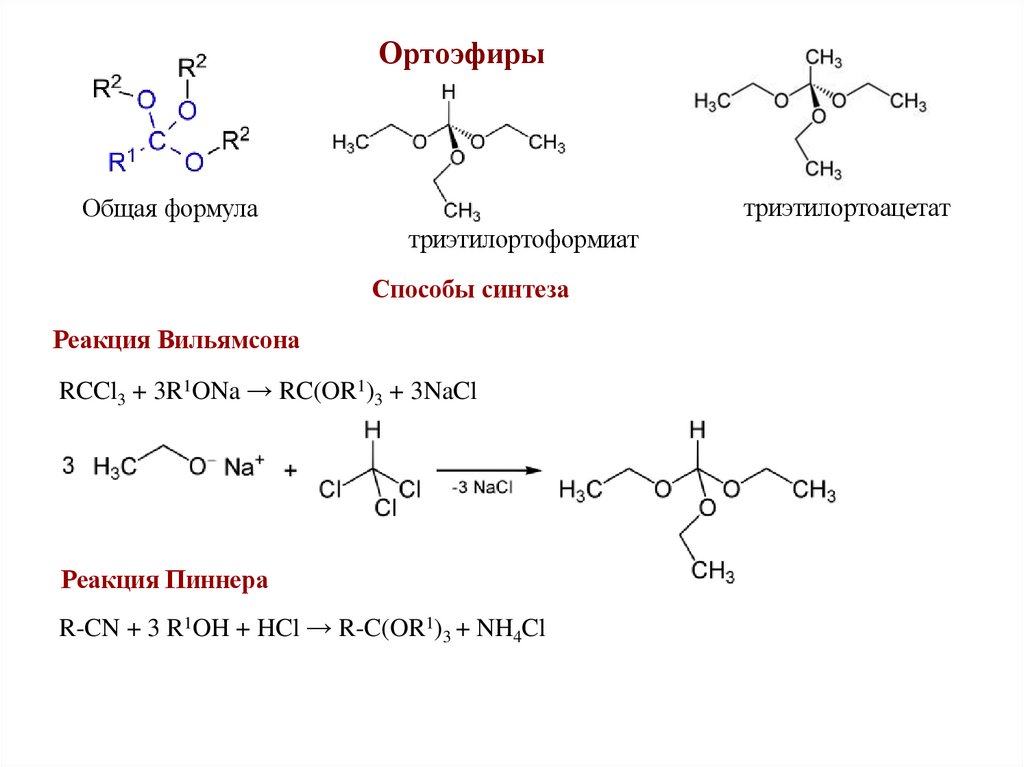
Ортоэфирытриэтилортоацетат
Общая формула
триэтилортоформиат
Способы синтеза
Реакция Вильямсона
RCCl3 + 3R1ONa → RC(OR1)3 + 3NaCl
Реакция Пиннера
R-CN + 3 R1OH + HCl → R-C(OR1)3 + NH4Cl
63.
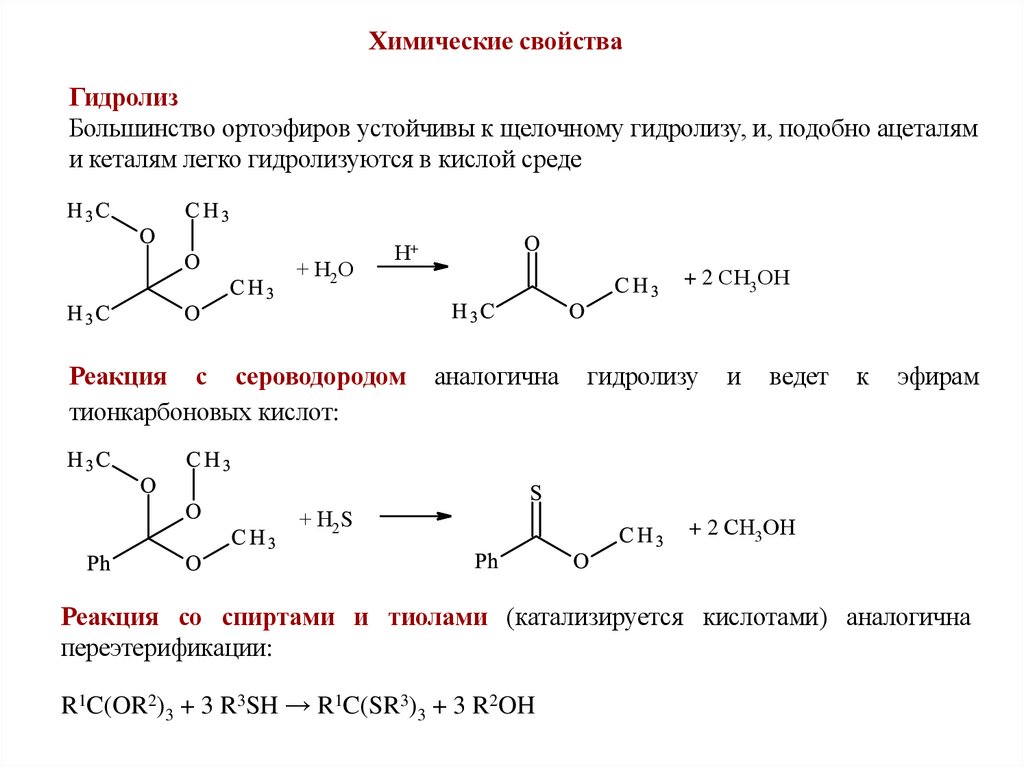
Химические свойстваГидролиз
Большинство ортоэфиров устойчивы к щелочному гидролизу, и, подобно ацеталям
и кеталям легко гидролизуются в кислой среде
+ Н2О
Н+
Реакция с сероводородом
тионкарбоновых кислот:
+ 2 СН3ОН
аналогична
+ Н2S
гидролизу
и
ведет
к
эфирам
+ 2 СН3ОН
Реакция со спиртами и тиолами (катализируется кислотами) аналогична
переэтерификации:
R1C(OR2)3 + 3 R3SH → R1C(SR3)3 + 3 R2OH
64.
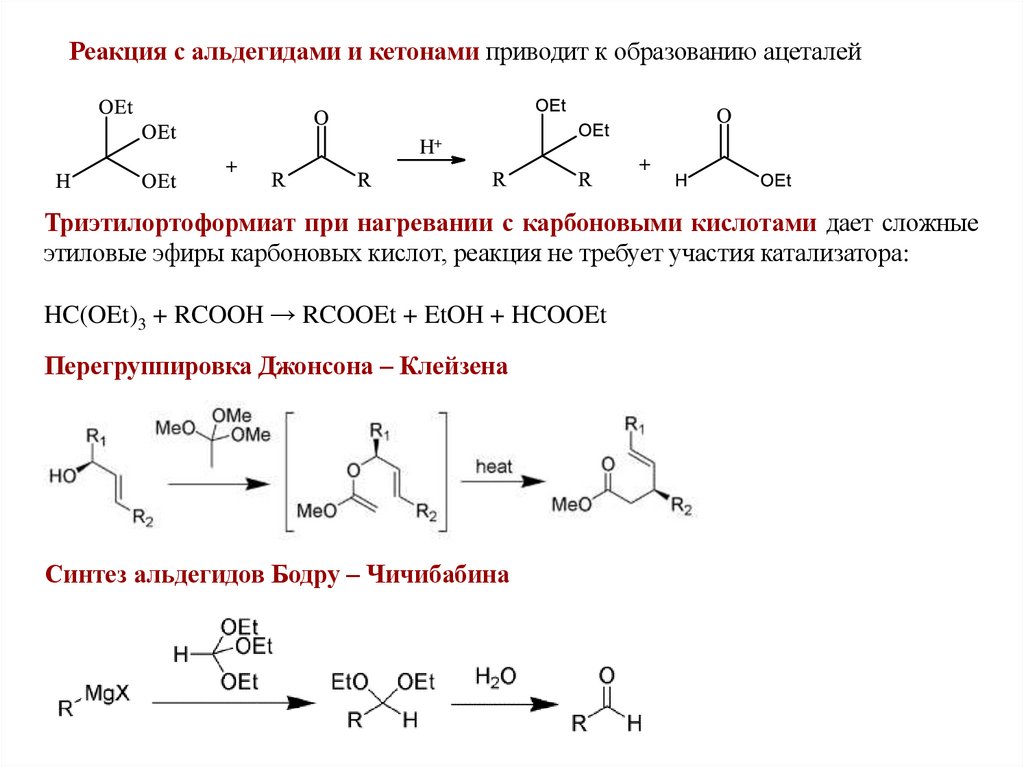
Реакция с альдегидами и кетонами приводит к образованию ацеталей+
H+
+
Триэтилортоформиат при нагревании с карбоновыми кислотами дает сложные
этиловые эфиры карбоновых кислот, реакция не требует участия катализатора:
HC(OEt)3 + RCOOH → RCOOEt + EtOH + HCOOEt
Перегруппировка Джонсона – Клейзена
Синтез альдегидов Бодру – Чичибабина
65.
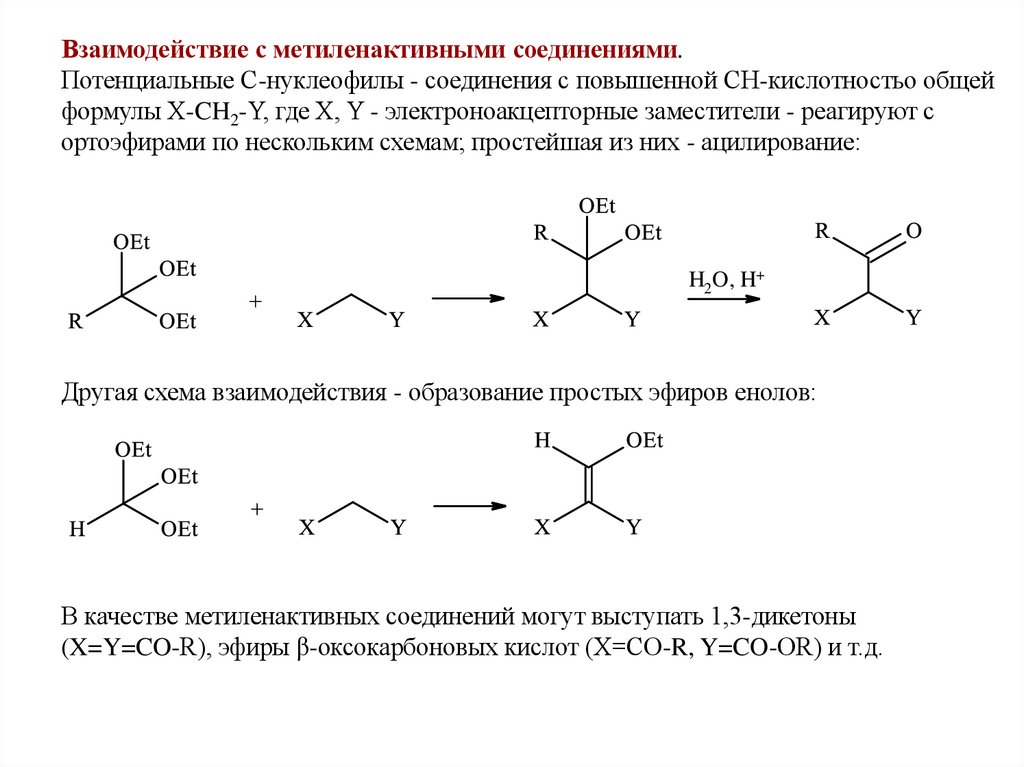
Взаимодействие с метиленактивными соединениями.Потенциальные С-нуклеофилы - соединения с повышенной СН-кислотностьо общей
формулы X-CH2-Y, где X, Y - электроноакцепторные заместители - реагируют с
ортоэфирами по нескольким схемам; простейшая из них - ацилирование:
H2O, H+
Другая схема взаимодействия - образование простых эфиров енолов:
В качестве метиленактивных соединений могут выступать 1,3-дикетоны
(X=Y=CO-R), эфиры β-оксокарбоновых кислот (X=CO-R, Y=CO-OR) и т.д.












 chemistry
chemistry








