Similar presentations:
Неметаллы в природе и жизни человека
1.
Неметаллы в природе ижизни человека
2.
«Мощь и сила науки – вомножестве фактов, цель – в
обобщении этого множества»
Д.И.Менделеев
3.
Неметаллы –химические элементы,
которые образуют в
свободном виде
простые вещества, не
обладающие
физическими
свойствами металлов
4.
Пери –оды
I
II
1
Н
2
Li
6.939
3
Na
22,9898
3
Литий
Натрий
Калий
29
Сu
Ag
107,86
8Серебро
Cs
Аu
79
196,96
7Золото
Высшие
оксиды
ЛВС
Fr
Магний
[223]
87
Франций
R2О
В
5
Бор
30
65,37
40,08
200,59
Rа
Иттрий
Сd In
114,82
138,81
VI
204,37
91,22
RO
Zr
Цирконий
Sn
Олово
81
Таллий
Pb
V
VIII
VII
41
92,906
73
Rf
Та
180,94
8Тантал
[262]
Db
Актиний РезерфордийДубний
R2O3
RO2
RH4
R2 O 5
RH3
44,956
Хром
Селен
95,94
W
Sg
Сиборгий
RO3
RH2
Со
58,933
2Кобальт
44
101,07
Ru
Рутений
45
Rh
102,90
5Родий
186,2
Re
Рений
[262]
39,948
76
190,2
Оs
Осмий
77
192,2
Ir
Иридий
Bh
R2O7
RH
18
Аргон
28
58,71
Ni
Никель
46
106,4
108
[265]
Hs
Хассий
109
[266]
36
83,80
P
d 54
Палладий
78
195,09
131,30
Мt
Мейтнерий
RO4
Рt
Платина
Rn
210
Борий
10
Ксенон
85
Астат
107
Ar
Xe
53
75
20,183
Криптон
126,9044
Йод
Nе
2
Кr
79,904
Технеций
84 At
[210]
Железо
27
35
52 I
78,96
Полоний
[263]
Мn 55,847 Fe
26
Мо 43
Тс
[99]
Вольфрам
106
17
Бром
4.0026
Неон
35,453
34 Br
78,96
Теллур
183.85
18,9984
Марганец
Молибден
74
Хлор
Не
Гелий
9
Фтор
Cr 25
51,996
83 Ро
208,980
Висмут
105
24
42
F
17 Cl
32,064
Сера
51 Тe
121,75
Сурьма
82 Вi
207,19
Свинец
Nb
Ниобий
8
15,9994
Кислород
33 Se
74,9216
Мышьяк
50 Sb
118,69
Гафний
104
**
88 89
138,81 Ас [261]
Радий
32 As
72,59
О
15 S
30,9738
Фосфор
Ванадий
Германий
40
7
14,0067
50,942
Титан
La 72
178.49 Hf
Лантан
Hg ТI
[226]
49
Индий
57
*
56
137.34
Ртуть
Y
Азот
Ti 23
47,90
31 Ge
26,9815
38 39
88,905
87,62
Барий
80
Скандий
N
14 P
28,086
Sc 22
Галлий
Кадмий
6
12,01115
Углерод
13 Si
44,956
Zn Ga
Стронций
112,40
С
26,9815
20 21
Цинк
48
10,811
Алюминий Кремний
Кальций
55 Ва
132,905
Цезий
4
9,0122
Бериллий
37 Sr
85,47
Рубидий
47
Ве
19 Сa
39,102
Rb
7
V
(Н)
11 Мg 24,31212 Al
Медь
6
IV
1
63,546
5
III
1,00797
Водород
К
4
Группы элементов
Радон
86
[222]
5.
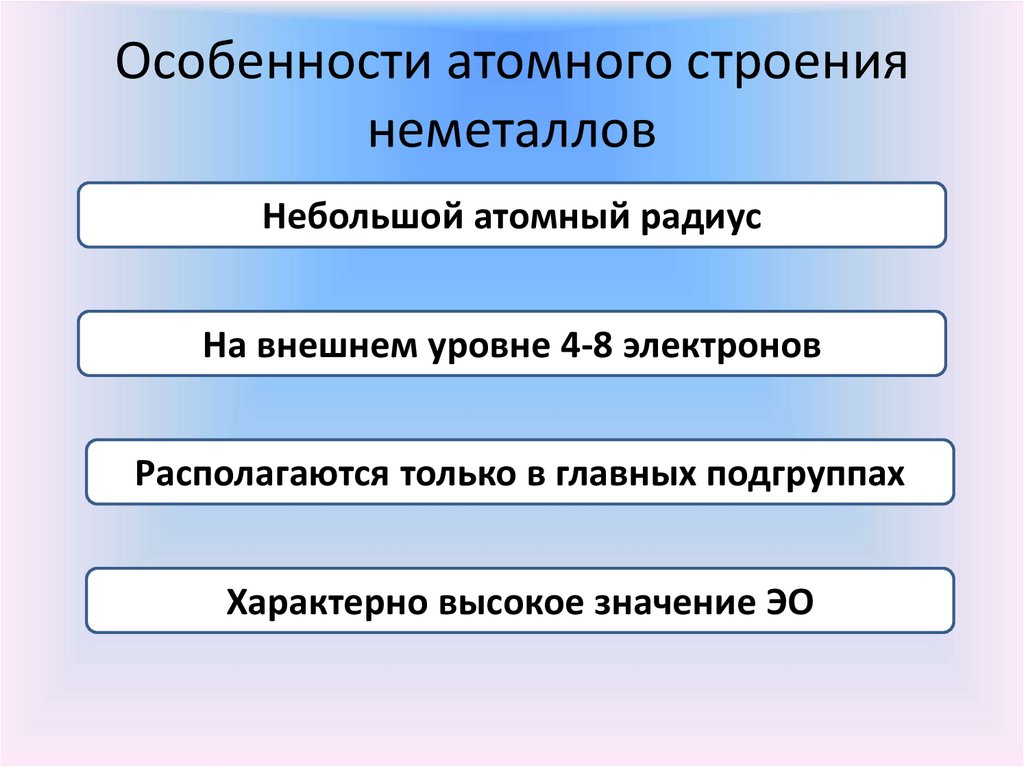
Особенности атомного строениянеметаллов
Небольшой атомный радиус
На внешнем уровне 4-8 электронов
Располагаются только в главных подгруппах
Характерно высокое значение ЭО
6.
Химическая связьВ простых веществах атомы неметаллов связаны ковалентной
неполярной связью. Благодаря этому формируется более устойчивая
электронная система, чем у изолированных атомов. При этом
образуются одинарные (например, в молекулах водорода H2,
галогенов F2, Br2, I2), двойные (например, в молекулах кислорода O2),
тройные (например, в молекулах N2) ковалентные связи.
H H
O O
N N
одинарные
двойные
тройные
7.
1. Ковкость отсутствует2. Блеска нет
3.Теплопроводность (только графит)
4. Цвет разнообразный: желтый, желтовато-зеленый,
красно-бурый.
5.Электропроводность (только графит и черный
Фосфор.)
6. Агрегатное состояние:
• газообразное (H2, O2, Cl2 ,F2, O3)
• твердое (Р, С)
• жидкое (Br )
8.
9.
ЖЕЛТЫЙ (S)10.
11.
Типы кристаллических решетокЧастицы в
узлах
решетки
Связь между
частицами
Примеры
Физические
свойства
Молекулярная решетка
Атомная решетка
Молекулы
Атомы
Слабые межмолекулярные
взаимодействия
Прочная ковалентная связь
Кислород Азот
Фосфор
Сера
Йод
Углерод (алмаз)
Кремний
Бор
Малая прочность
Низкие температуры кипения
и плавления
Высокая летучесть
Высокие температуры
кипения и плавления,
большая твердость
12.
АллотропияОпределение: Аллотропия - это
существование
одного и того же химического
элемента в виде нескольких
простых веществ.
Причины: различное строение
кристаллической решетки,
разное число атомов в
молекулах.
13.
Аллотропия• Разное типы кристаллических решеток
Р - фосфор
Красный фосфор - атомная
Белый фосфор - молекулярная
14.
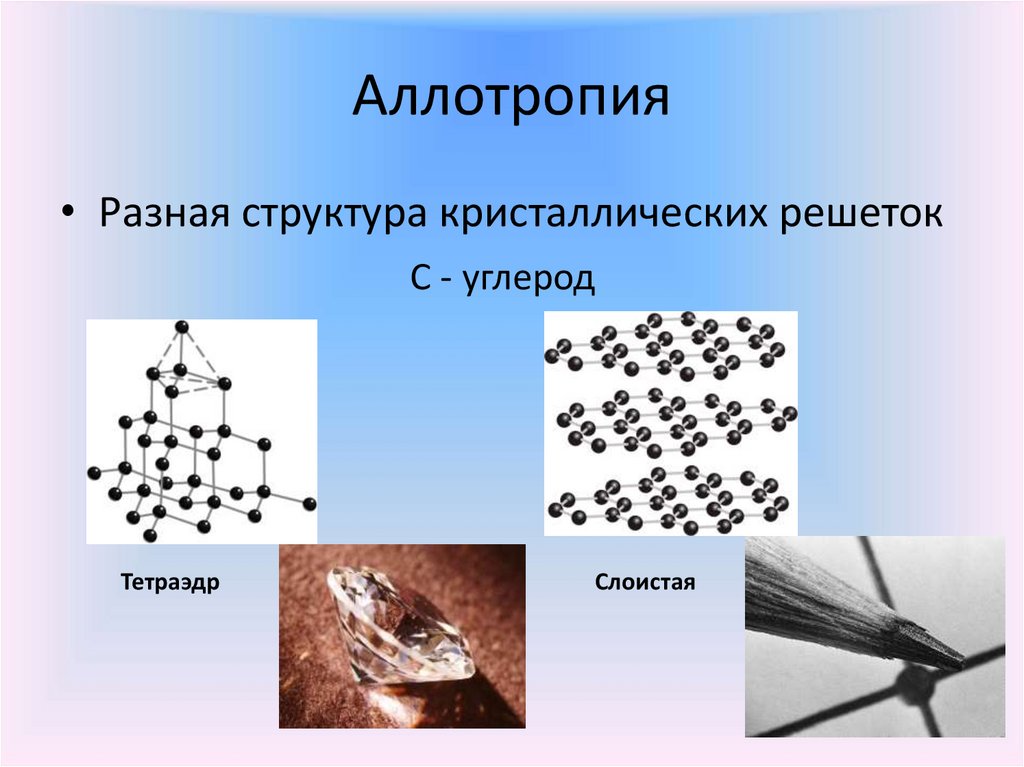
Аллотропия• Разная структура кристаллических решеток
С - углерод
Тетраэдр
Слоистая
15.
Аллотропия• Разный состав молекул
О - кислород
Кислород
Озон
16.
Озон О3• Светло - синий газ с сильным запахом
• Имеет запах свежести
• Появляется после грозы
17.
Озон в природеСодержится в воздухе сосновых лесов и
морского побережья
18.
Получение озона в лаборатории• Получают в специальных приборах –
озонаторах при действии на кислород
электрическим разрядом без искр
19.
Значение озона для Земли• Задерживает ультрафиолетовые лучи,
которые разрушительно действуют на
клетки живых организмов
• Озоновый слой расположен на высоте 20 –
25 км
20.
В конце 18 века А-Л. Лавуазьеустановил, что воздух –
не простое вещество.
а смесь газов
21.
Состав воздуха22.
Постоянные составные воздуха• Азот
• Кислород
• Благородные
газы
23.
Переменные составные воздуха• Углекислый газ
• Водяные пары
• Озон
24.
Случайные составные воздуха• Пыль
• Микроорганизмы
• Пыльца растений
• Оксиды серы и азота
25.
Химические свойстваДля атомов неметаллов, а следовательно, и для образованных
ими простых веществ характерны как окислительные, так и
восстановительные свойства.
Увеличиваются окислительные свойства
F2 ˃ O3 ˃ Cl2 ˃ O2 ˃ I2 ˃ C ˃ Si ˃ P ˃ N2 ˃ S ˃ H2
Увеличиваются восстановительные свойства
26.
Окислительные свойстваОкислительные свойства неметаллов проявляются, в первую
очередь, при их взаимодействии с металлами (металлы всегда
восстановители):
2Na0+ S0= Na+2S
2












































 chemistry
chemistry








