Similar presentations:
Неметаллы: общая характеристика
1. Неметаллы: общая характеристика.
2.
3.
Положение неметаллов в ПСХЭСтроение атомов
Строение простых веществ: вид
химической связи и тип
кристаллической решетки
Физические свойства: агрегатное
состояние, цвет и др.
Химические свойства
Водородные соединения
неметаллов
Кислородные соединения
Применение
4. Неметаллы – химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя
благодаряналичию 4 и более
электронов и малому
атомному радиусу по
сравнению с металлами.
5.
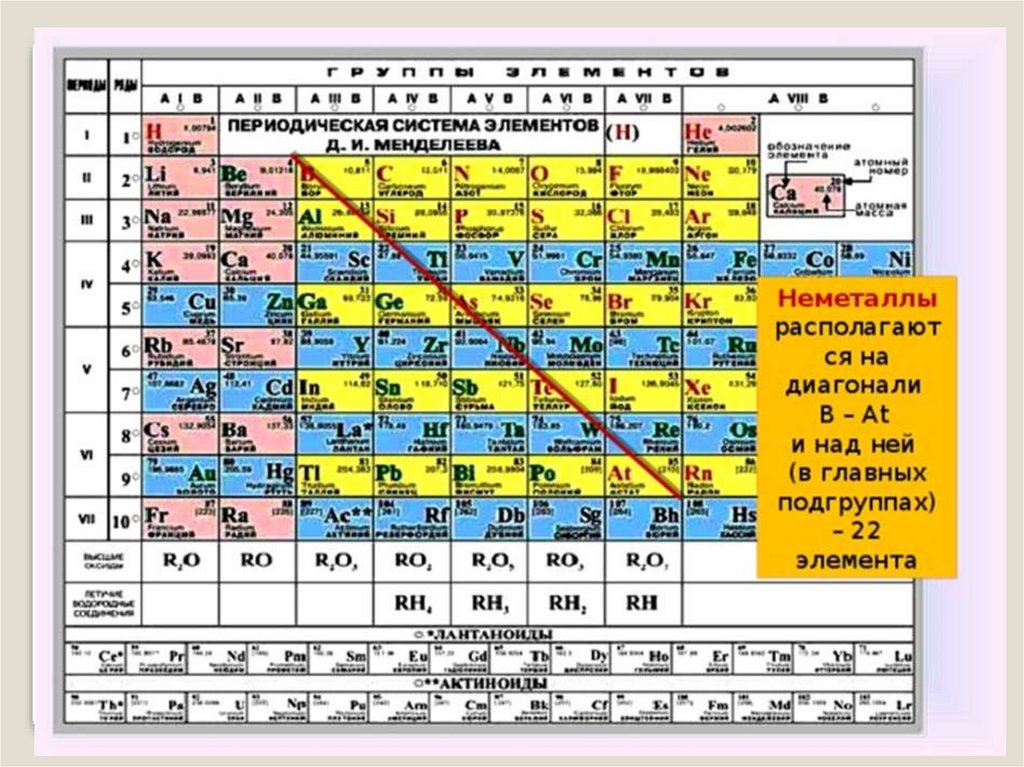
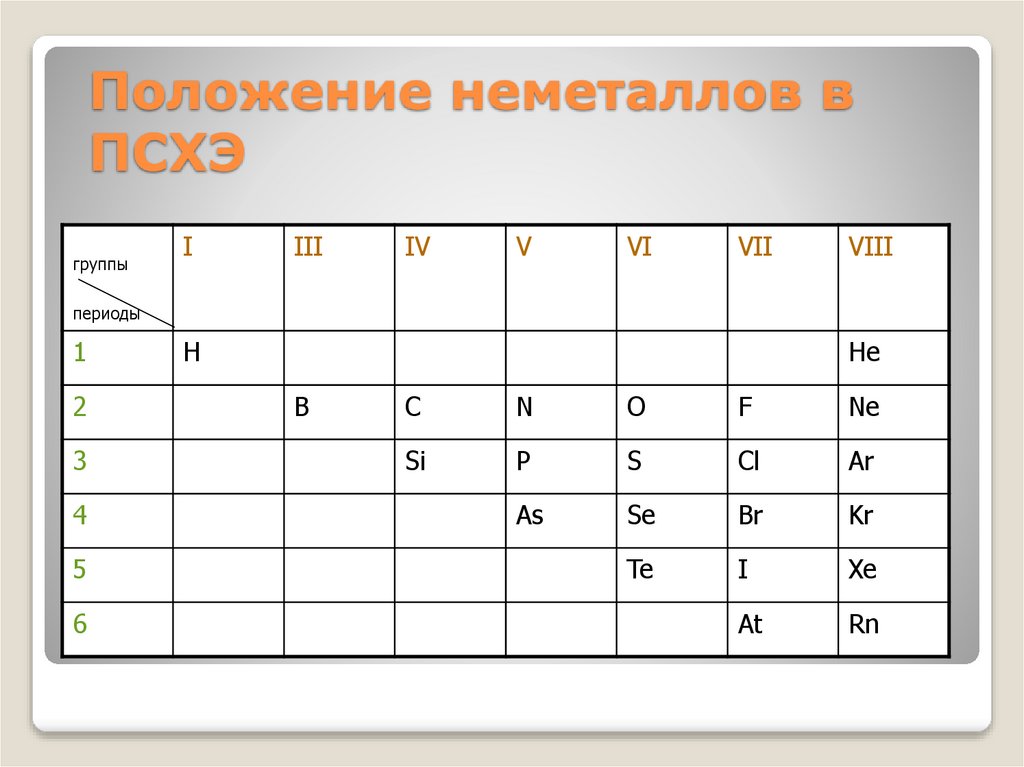
6. Положение неметаллов в ПСХЭ
группыI
III
IV
V
VI
VII
VIII
периоды
1
2
3
4
5
6
H
He
B
C
N
O
F
Ne
Si
P
S
Cl
Ar
As
Se
Br
Kr
Te
I
Xe
At
Rn
7.
Небольшой атомный радиусНа внешнем уровне 4-8 электронов
Характерно высокое значение ЭО
Являются окислителями
8. Электронная формула атомов неметаллов
9. Типы кристаллических решеток
Молекулярнаярешетка
Атомная решетка
Частицы в
узлах
решетки
Молекулы
Атомы
Связь
между
частицами
Слабые
межмолекулярные
взаимодействия
Прочная ковалентная
связь
Примеры
Кислород
Фосфор
Йод
Азот
Сера
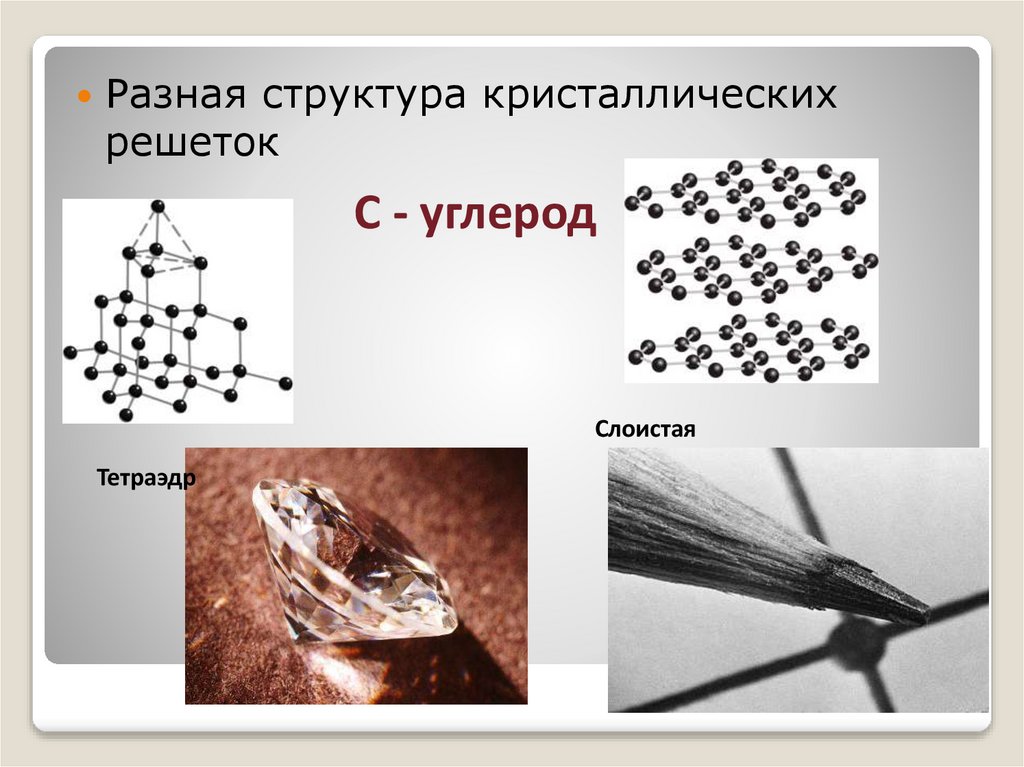
Углерод (алмаз)
Кремний
Бор
Малая прочность
Высокие температуры
Низкие температуры
кипения и плавления
кипения и плавления
Типы кристаллических
решеток
Высокая летучесть
Физически
е свойства
10. ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
11. Цвет простых веществ - неметаллов
12.
КРАСНЫЙЖЕЛТЫЙ
ФИОЛЕТОВЫЙ
ФОСФОР
СЕРА
ЙОД
БЕСЦВЕТНЫЙ
УГЛЕРОД
13.
БЕЛЫЙЧЕРНЫЙ
ФОСФОР
ГРАФИТ
ФОСФОР
ЖЕЛТО-ЗЕЛЕНЫЙ
ХЛОР
14.
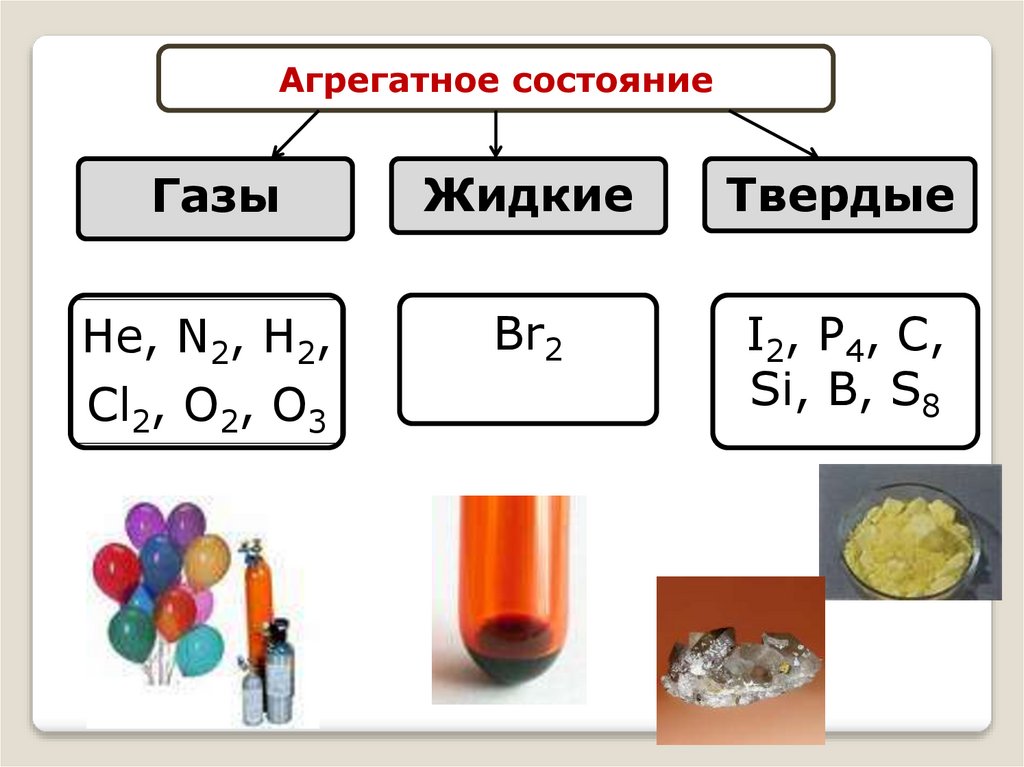
Агрегатное состояниеГазы
Жидкие
Твердые
Не, N2, Н2,
Cl2, O2, O3
Br2
I2, P4, C,
Si, B, S8
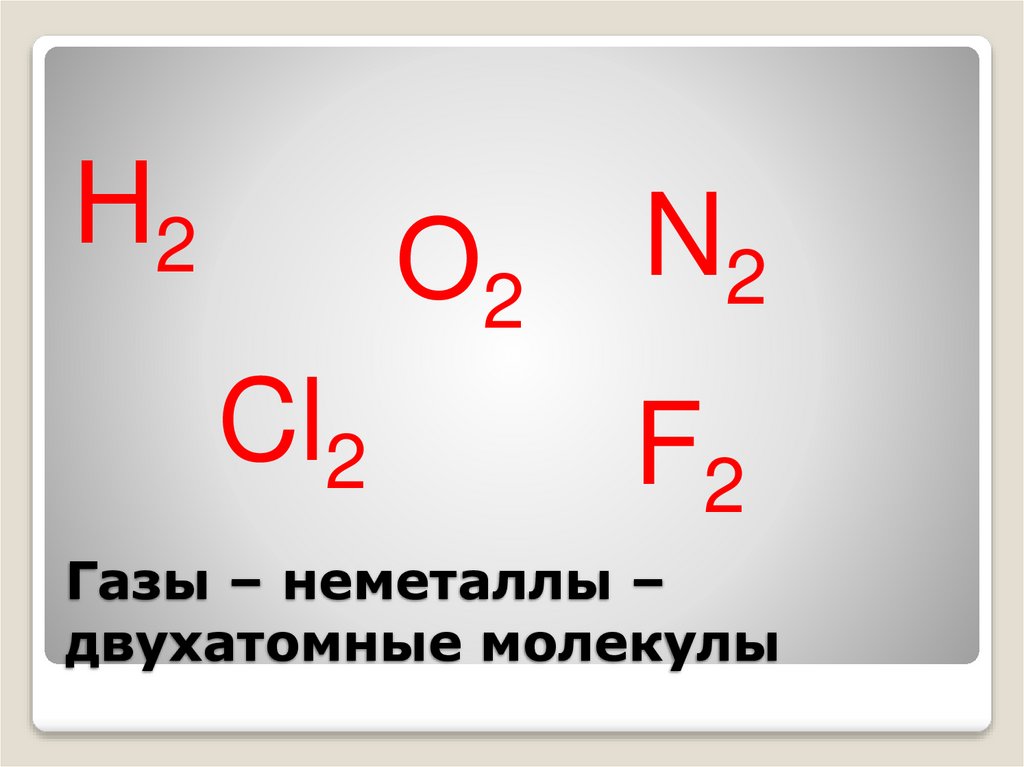
15. Газы – неметаллы – двухатомные молекулы
Н2О2
Cl2
N2
F2
Газы – неметаллы –
двухатомные молекулы
16. Температура плавления
3 8000 С – у графита- 2100 С - азота
Температура плавления
17. Способность атомов одного химического элемента образовывать несколько простых веществ называют аллотропией, а эти простые
вещества – аллотропнымивидоизменениями или
модификациями
18.
Разное типы кристаллических решетокР - фосфор
Красный фосфор - атомная
Белый фосфор - молекулярная
19.
Разная структура кристаллическихрешеток
С - углерод
Слоистая
Тетраэдр
20.
Разный состав молекулО - кислород
Кислород
Озон
21. Значение озона для Земли
• Задерживает ультрафиолетовыелучи, которые разрушительно
действуют на клетки живых
организмов
• Озоновый слой расположен на
высоте 20 – 25 км
Значение озона для Земли
22. Озон О3
Светло - синий газ с сильнымзапахом
Имеет запах свежести
Появляется после грозы
Озон О3
23. Озон в природе
Содержится в воздухе сосновыхлесов и морского побережья
Озон в природе
24. Получение озона в лаборатории
Получают в специальных приборах– озонаторах при действии на
кислород электрическим разрядом
без искр
Получение озона в лаборатории
25.
В конце 18 века А-Л.Лавуазье
установил, что воздух –
не простое вещество.
а смесь газов
26. Состав воздуха
27. Постоянные составные воздуха
• Азот• Кислород
• Благородные
газы
Постоянные составные воздуха
28. Переменные составные воздуха
Углекислыйгаз
Водяные
пары
Озон
Переменные составные воздуха
29. Случайные составные воздуха
ПыльМикроорганизмы
Пыльца растений
Оксиды серы и
азота
Случайные составные воздуха
30. Химические свойства неметаллов
сметаллами
неметалл
с
неметаллами
со
сложными
веществами
31.
Характерными для большинстванеметаллов являются окислительные
свойства. Как окислители они
реагируют
с металлами:
Ca + Cl2 = CaCl2
4Li + O2 = 2Li2O
2Na + S = Na2S
32.
с неметаллами:H2 + S = H2S
P4 + 5O2 = 2P2O5
2P + 5Cl2 = 2PCl5
со сложными веществами:
2FeCl2 + Cl2 = 2FeCl3
СН4 + Cl2
=СН3Cl+НCl
33.
34.
ДОМАШНЕЕ ЗАДАНИЕСоставить презентацию на
выбор
«Распространение неметаллов
в природе»
«Биологическая роль
неметаллов»
«Применение неметаллов»





























 chemistry
chemistry








