Similar presentations:
Общая характеристика неметаллов
1. ОБЩАЯ ХАРАКТЕРИСТИКА НЕМЕТАЛЛОВ
2. НЕМЕТАЛЛЫ- ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ ,У КОТОРЫХ НА ПОСЛЕДНЕМ ЭНЕРГИТИЧЕСКОМ УРОВНЕ НАХОДИТСЯ ОТ 4 ДО 8 ЭЛЕКТРОНОВ
СЛОВАРЬНЕМЕТАЛЛЫ- ХИМИЧЕСКИЕ
ЭЛЕМЕНТЫ ,У КОТОРЫХ НА
ПОСЛЕДНЕМ ЭНЕРГИТИЧЕСКОМ
УРОВНЕ НАХОДИТСЯ ОТ 4 ДО 8
ЭЛЕКТРОНОВ
3.
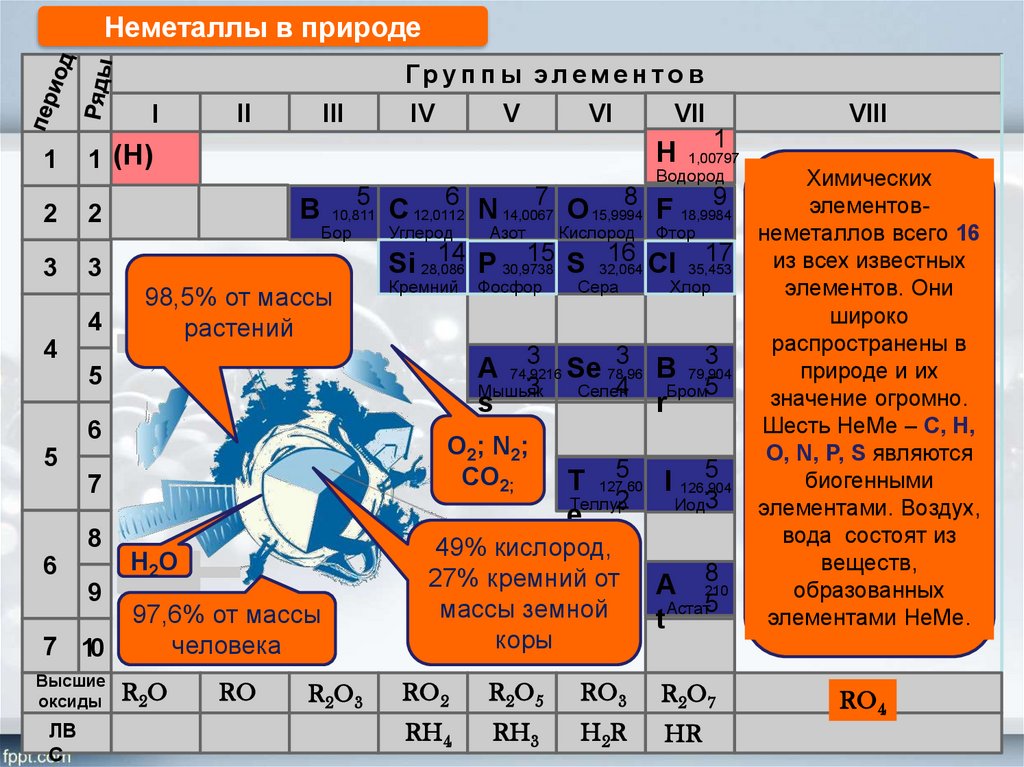
Неметаллы в природеГруп п ы элем е н то в
I
II
III
IV
V
VI
VII
VIII
1
Н 1,00797
1
1 (H)
2
2
5
6
7
8
9
В 10,811
С 12,0112
N 14,0067
O 15,9994
F 18,9984
3
3
14 Р 15 S 16 Cl 17
Si 28,086
30,9738
32,064
35,453
4
4
Бор
98,5% от массы
растений
Углерод
Кремний
6
7
9
Н2О
7 10
97,6% от массы
человека
Высшие
оксиды
R2O
ЛВ
С
Фосфор
O2; N2;
CO2;
5
6
Азот
Кислород
Сера
A 8210
Астат5
t
RO4
Фтор
Хлор
3
3
3
A 74,9216
Se 78,96
B 79,904
3 Селен4 Бром5
Мышьяк
s
r
5
8
Химических
элементовнеметаллов всего 16
из всех известных
элементов. Они
широко
распространены в
природе и их
значение огромно.
Шесть НеМе – С, Н,
О, N, P, S являются
биогенными
элементами. Воздух,
вода состоят из
веществ,
образованных
элементами НеМе.
Водород
RO
R2O 3
5
5
T 127,60
I 126,904
2
Теллур
Иод3
e
49% кислород,
27% кремний от
массы земной
коры
RO2
R2O 5
RO3
R2O 7
RH4
RH3
H2R
HR
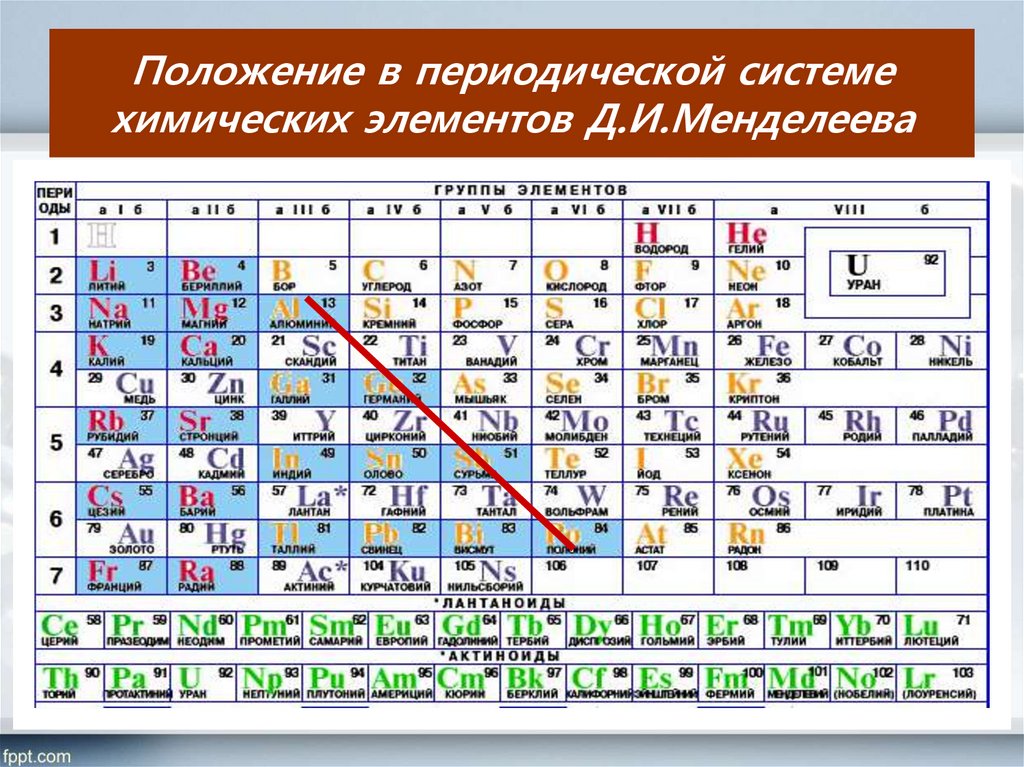
4. Положение в периодической системе химических элементов Д.И.Менделеева
5. Положение в периодической системе химических элементов Д.И.Менделеева
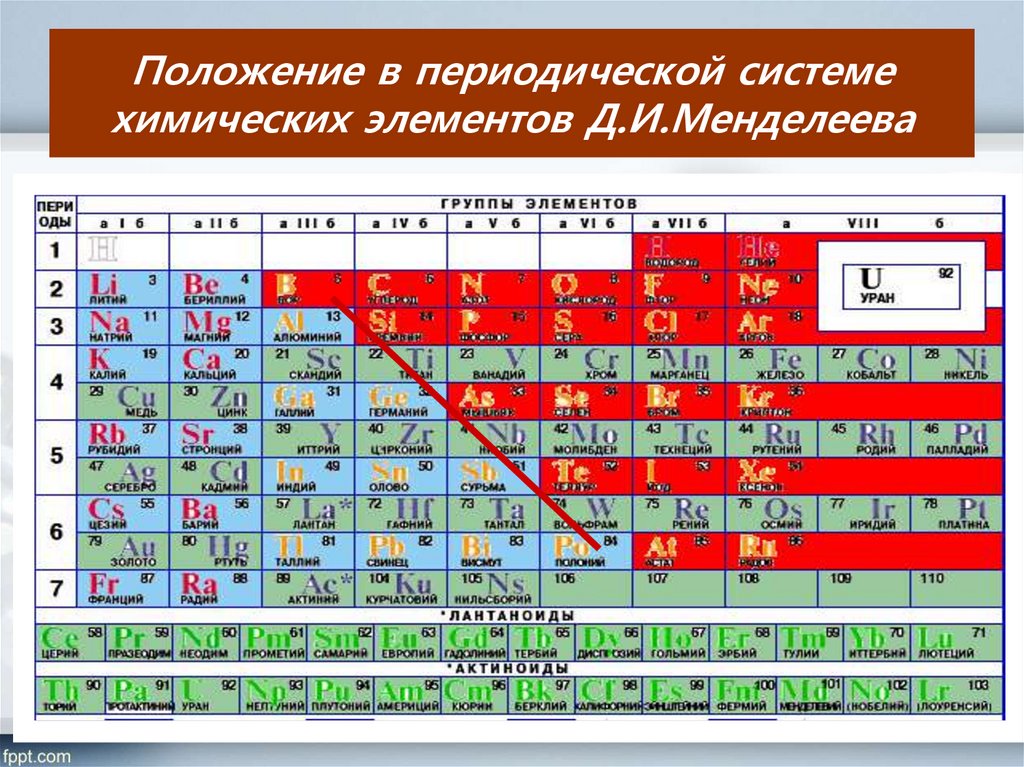
6. Положение в периодической системе химических элементов Д.И.Менделеева
7. Положение в периодической системе химических элементов Д.И.Менделеева
8. Особенности атомного строения неметаллов
Небольшой атомный радиусНа внешнем уровне 4-8 электронов
Располагаются только в главных подгруппах
Характерно высокое значение ЭО
9. Электроотрицательность – это свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие
электронные пары(мера неметалличности, т.е. чем более
электроотрицателен данный химический элемент, тем
ярче выражены неметаллические свойства).
H Si P C S Br Cl N O F
усиление
ЭО
10. ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
11.
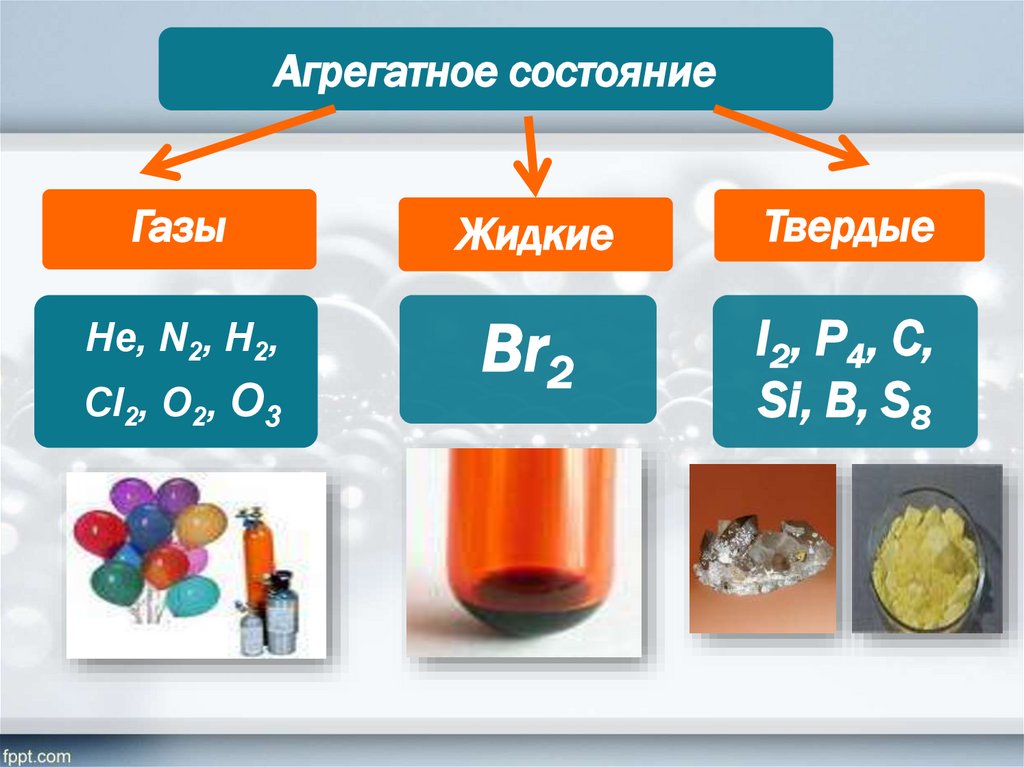
Агрегатное состояниеГазы
Жидкие
Твердые
Не, N2, Н2,
Br2
I2, P4, C,
Si, B, S8
Cl2, O2, O3
12. Цвет неметаллов
КРАСНЫЙЖЕЛТЫЙ
ФИОЛЕТОВЫЙ
ФОСФОР
СЕРА
ЙОД
УГЛЕРОД
БЕСЦВЕТНЫЙ
13.
В чем причинаразнообразия
физических свойств
у неметаллов ?
14.
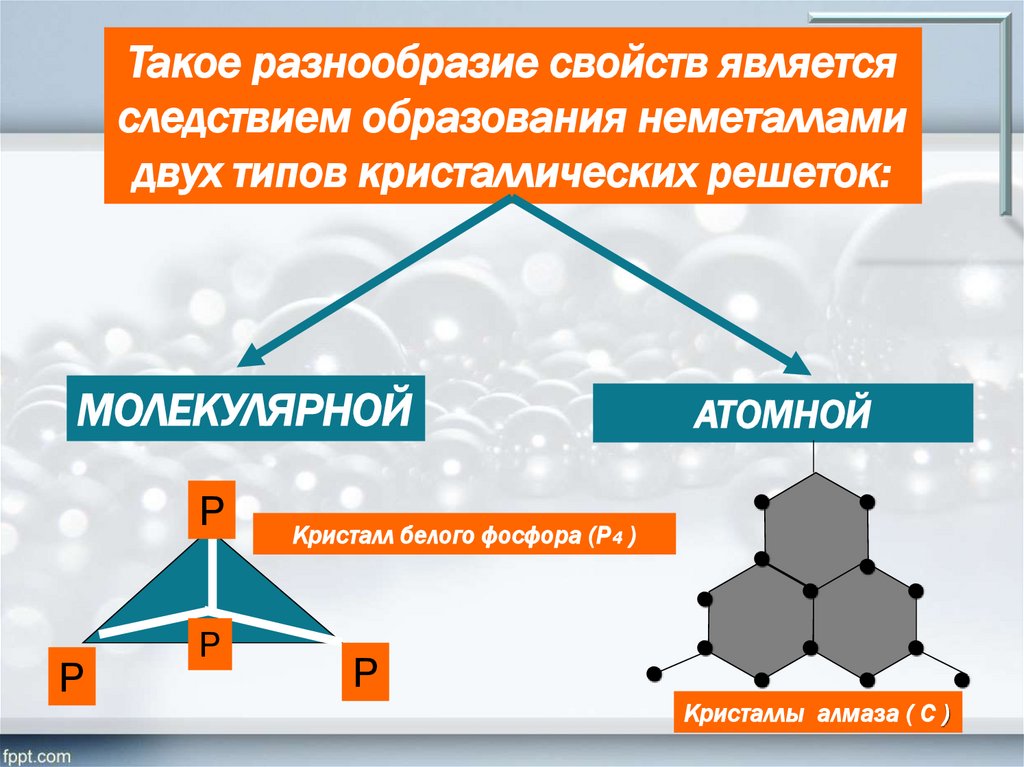
Такое разнообразие свойств являетсяследствием образования неметаллами
двух типов кристаллических решеток:
МОЛЕКУЛЯРНОЙ
Р
Р
Р
АТОМНОЙ
Кристалл белого фосфора (Р4 )
Р
●
Кристаллы алмаза ( С )
15.
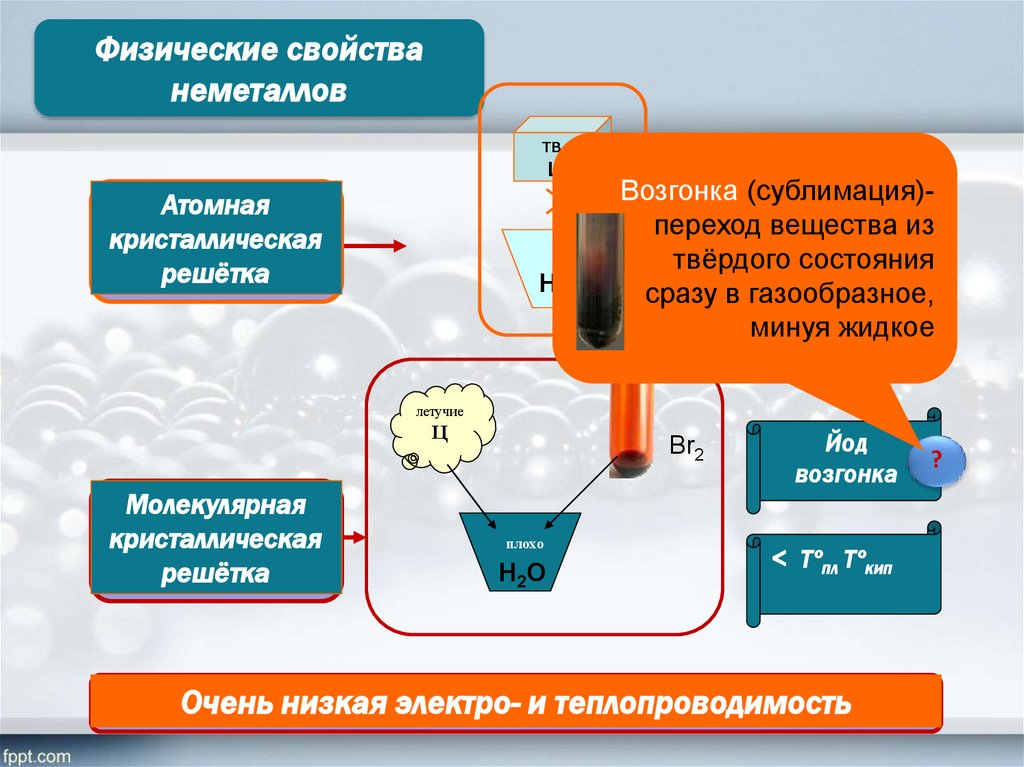
Физические свойстванеметаллов
тв.
Ц
Атомная
кристаллическая
решётка
Н2О
Возгонка (сублимация)переход вещества
> Tºпл Tºкипиз
твёрдого состояния
сразу в газообразное,
минуя жидкое
летучие
Ц
Молекулярная
кристаллическая
решётка
Br2
плохо
Н2О
Йод
возгонка
< Tºпл Tºкип
Очень низкая электро- и теплопроводимость
?
16.
словарьАллотро́пия (от др-греч. αλλος —
«другой», τροπος — «поворот,
свойство») — существование одного
и того же химического элемента в
виде двух и более простых веществ,
различных по строению и
свойствам: так называемых
аллотропических модификаций или
аллотропических форм.
17. Причины аллотропии:
Разные типы кристаллических решеток(белый фосфор Р4 – молекулярная, красный
фосфор Р – атомная).
Разная структура кристаллической решетки
(алмаз – тетраэдрическая, графит – слоистая).
Разный состав молекул аллотропных
модификаций (О2 и О3).
18.
Элементарный фосфор в обычных условиях представляетсобой несколько устойчивых аллотропных модификаций;
вопрос аллотропии фосфора сложен и до конца не решён.
Обычно выделяют четыре модификации простого вещества —
белый, красный, чёрный и металлический фосфор.
19.
Ромбическая(a - сера) - S8
t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее
устойчивая модификация.
Моноклинная
(b - сера) - S8
темно-желтые иглы,
t°пл. = 119°C;
ρ = 1,96 г/см3.
Устойчивая при
температуре более 96°С; при обычных
условиях превращается в
ромбическую.
Пластическая
Sn
коричневая резиноподобная
(аморфная) масса. Неустойчива, при
затвердевании превращается в
ромбическую.
20.
Кислород- газ, без цвета, вкуса и запаха,плохо растворим в воде, в жидком
состоянии светло-голубой, в твердом –
синий, необходим для жизни.
Озон- светло-синий газ, темно-голубая
жидкость, в твердом состоянии темнофиолетовый, имеет сильный запах, в 10
раз лучше, чем кислород, растворим в
воде.













 chemistry
chemistry








