Similar presentations:
Общая характеристика неметаллов
1. Неметаллы: общая характеристика.
2.
3.
Положение неметаллов в ПСХЭСтроение атомов
Строение простых веществ: вид
химической связи и тип
кристаллической решетки
Физические свойства: агрегатное
состояние, цвет и др.
Химические свойства
Водородные соединения
неметаллов
Кислородные соединения
Применение
4. Неметаллы – химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя
благодаряналичию 4 и более
электронов и малому
атомному радиусу по
сравнению с металлами.
5.
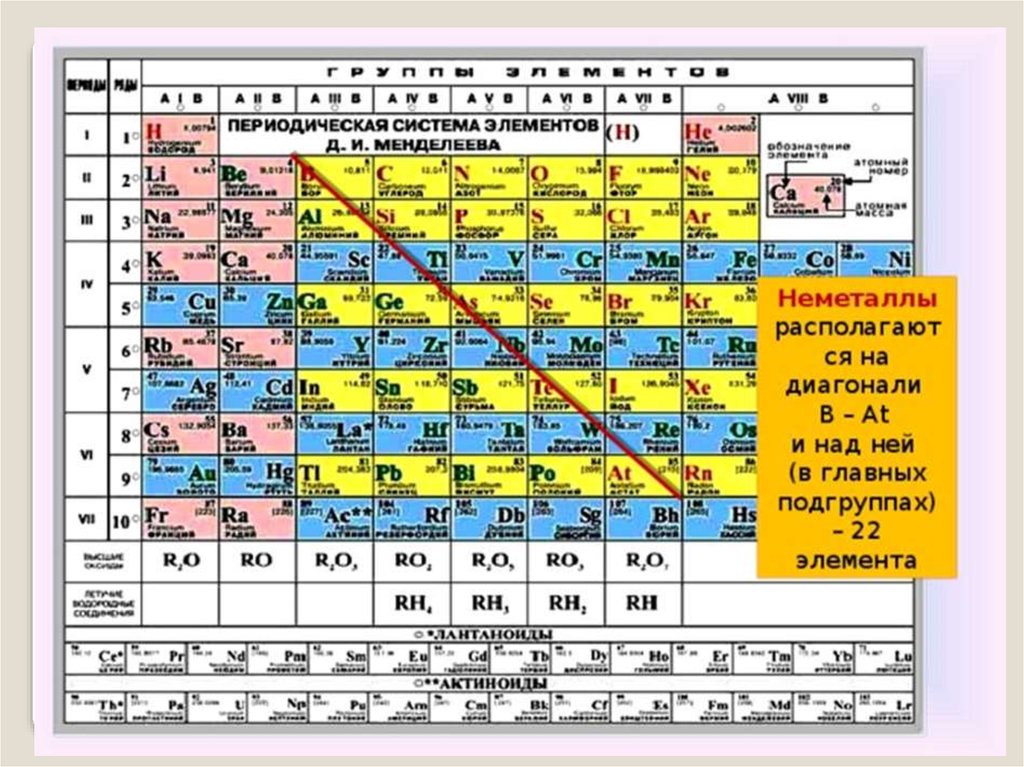
Периодическая система Д. И. Менделеева6.
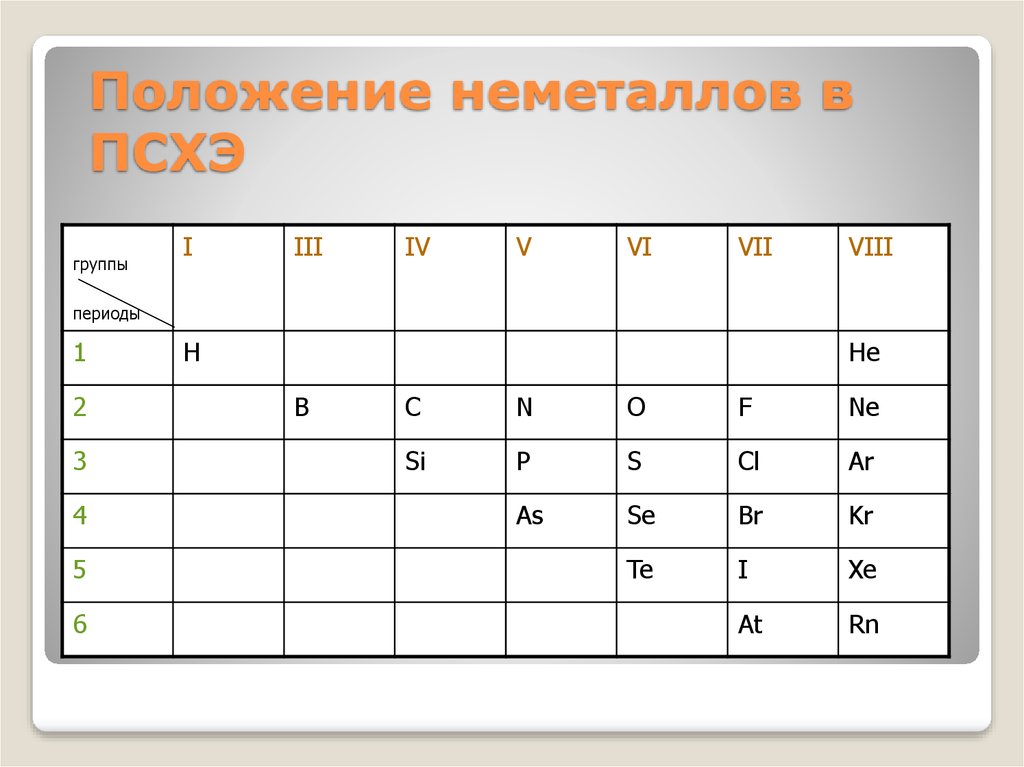
7. Положение неметаллов в ПСХЭ
группыI
III
IV
V
VI
VII
VIII
периоды
1
2
3
4
5
6
H
He
B
C
N
O
F
Ne
Si
P
S
Cl
Ar
As
Se
Br
Kr
Te
I
Xe
At
Rn
8.
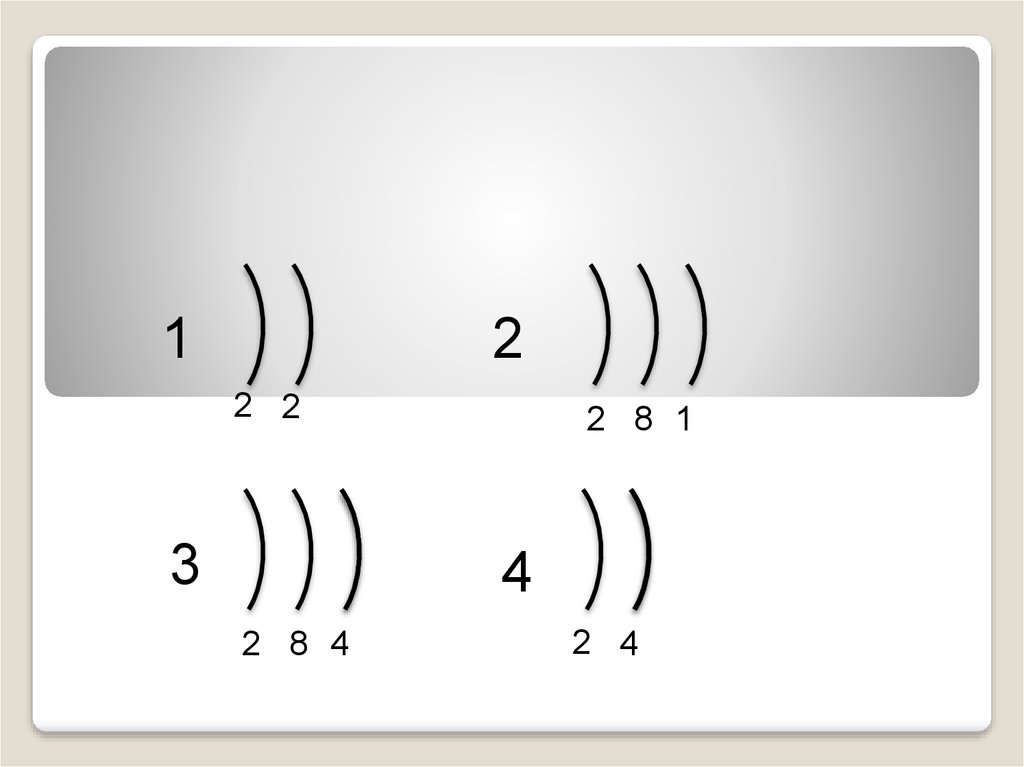
12
2 2
3
2 8 1
4
2 8 4
2 4
9.
Небольшой атомный радиусНа внешнем уровне 4-8 электронов
Характерно высокое значение ЭО
Являются окислителями
10. Электронная формула атомов неметаллов
11. Типы кристаллических решеток
Молекулярнаярешетка
Атомная решетка
Частицы в
узлах
решетки
Молекулы
Атомы
Связь
между
частицами
Слабые
межмолекулярные
взаимодействия
Прочная ковалентная
связь
Примеры
Кислород
Фосфор
Йод
Физически
е свойства
Типы
Азот
Сера
Углерод (алмаз)
Кремний
Бор
Малая прочность
Высокие температуры
Низкие температуры
кипения и плавления
кипения и плавления
кристаллических
решеток
Высокая летучесть
12. ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
13. Цвет простых веществ - неметаллов
14.
КРАСНЫЙФОСФОР
БЕСЦВЕТНЫЙ
ЖЕЛТЫЙ
ФИОЛЕТОВЫЙ
СЕРА
ЙОД
УГЛЕРОД
15.
БЕЛЫЙЧЕРНЫЙ
ФОСФОР
ГРАФИТ
ФОСФОР
ЖЕЛТО-ЗЕЛЕНЫЙ
ХЛОР
16.
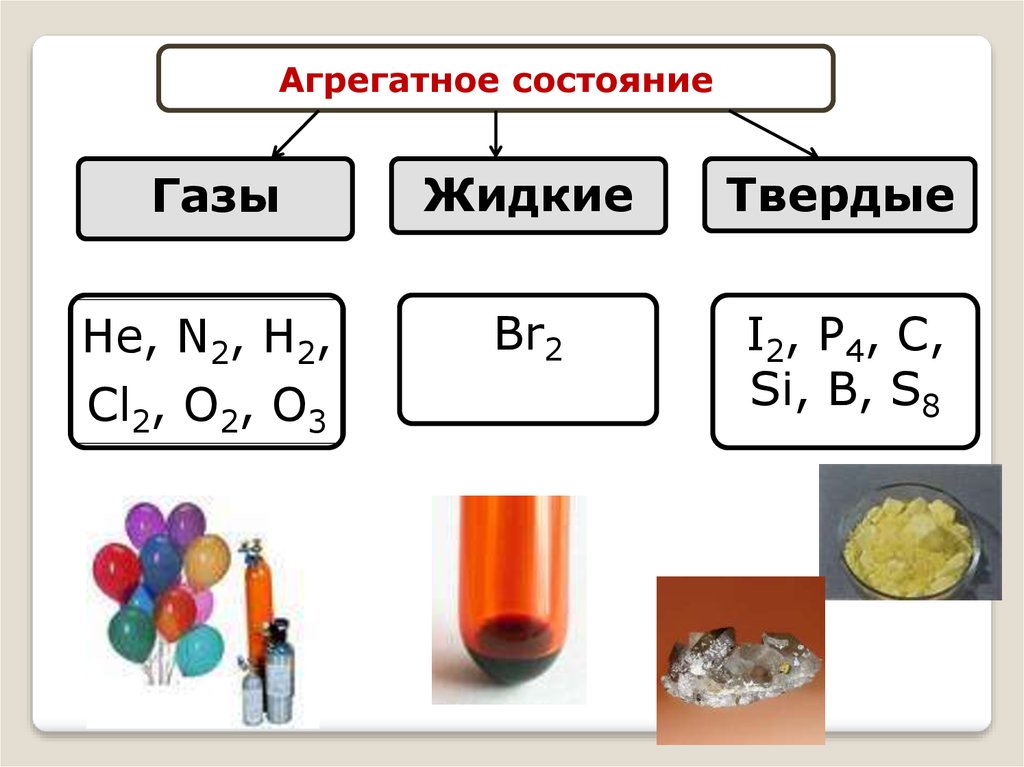
Агрегатное состояниеГазы
Жидкие
Твердые
Не, N2, Н2,
Cl2, O2, O3
Br2
I2, P4, C,
Si, B, S8
17. Газы – неметаллы – двухатомные молекулы
Н2О2
Cl2
N2
F2
Газы – неметаллы –
двухатомные молекулы
18. Температура плавления
3 8000 С – у графита- 2100 С - азота
Температура плавления
19.
ЧЕГО БОЛЬШЕ:ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
ИЛИ ПРОСТЫХ ВЕЩЕСТВ
20. Способность атомов одного химического элемента образовывать несколько простых веществ называют аллотропией, а эти простые
вещества – аллотропнымивидоизменениями или
модификациями
21.
Разное типы кристаллических решетокР - фосфор
Красный фосфор - атомная
Белый фосфор - молекулярная
22.
Разная структура кристаллическихрешеток
С - углерод
Слоистая
Тетраэдр
23.
Разный состав молекулО - кислород
Кислород
Озон
24. Значение озона для Земли
Задерживает ультрафиолетовыелучи, которые разрушительно
действуют на клетки живых
организмов
• Озоновый слой расположен на
высоте 20 – 25 км
Значение озона для Земли
25. Озон О3
Светло - синий газ с сильнымзапахом
Имеет запах свежести
Появляется после грозы
Озон О3
26. Озон в природе
Содержится в воздухе сосновыхлесов и морского побережья
Озон в природе
27. Получение озона в лаборатории
Получают в специальных приборах– озонаторах при действии на
кислород электрическим разрядом
без искр
Получение озона в лаборатории
28.
В конце 18 века А-Л.Лавуазье
установил, что воздух –
не простое вещество.
а смесь газов
29. Состав воздуха
30. Постоянные составные воздуха
Азот
Кислород
Благородные
газы
Постоянные составные воздуха
31. Переменные составные воздуха
Углекислыйгаз
Водяные
пары
Озон
Переменные составные воздуха
32. Случайные составные воздуха
ПыльМикроорганизмы
Пыльца растений
Оксиды серы и
азота
Случайные составные воздуха
33. Химические свойства неметаллов
сметаллами
неметалл
с
неметаллами
со
сложными
веществами
34.
Характерными для большинстванеметаллов являются окислительные
свойства. Как окислители они
реагируют
с металлами:
Ca
+ Cl2 = CaCl2
4Li + O2 = 2Li2O
2Na + S = Na2S
35.
с неметаллами:H2
+ S = H2S
P4 + 5O2 = 2P2O5
2P + 5Cl2 = 2PCl5
со сложными веществами:
2FeCl2
+ Cl2 = 2FeCl3
СН4 + Cl2 =СН3Cl+НCl
36.
ВАРИАНТ 1ВАРИАНТ -2
1-А
2-Б
3–В
4–Б
5-А
37.
38.
ДОМАШНЕЕ ЗАДАНИЕстр.226- 236,
упр. 1-4 устно,
упр. 5 (1-5) письменно
презентации
«Распространение неметаллов в
природе»
«Биологическая роль
неметаллов»
«Применение неметаллов»
































 chemistry
chemistry








