Similar presentations:
Неметаллы: общая характеристика. 9 класс
1.
Неметаллы:общая характеристика
9 класс
2.
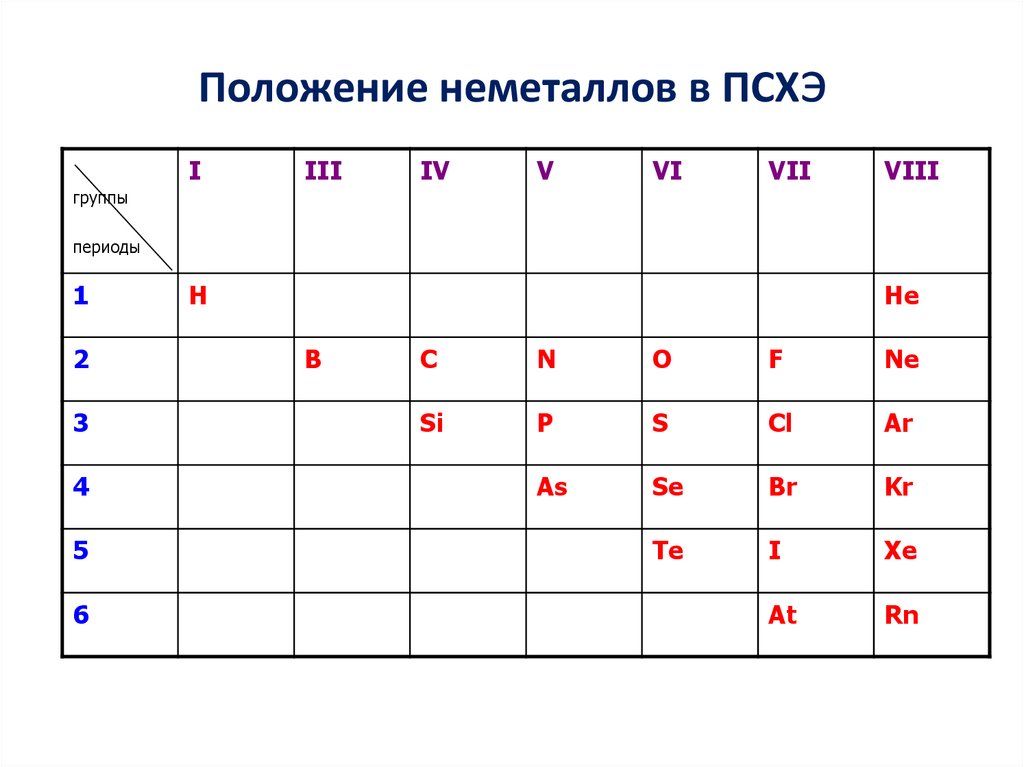
Положение неметаллов в ПСХэI
III
IV
V
VI
VII
VIII
группы
периоды
1
2
3
4
5
6
H
He
B
C
N
O
F
Ne
Si
P
S
Cl
Ar
As
Se
Br
Kr
Te
I
Xe
At
Rn
3.
Особенности атомного строения неметалловНебольшой атомный радиус
На внешнем уровне 4-8 электронов
Располагаются только в главных подгруппах
Характерно высокое значение ЭО
4.
• Электроотрицательность – свойствоатомов химических элементов поляризовать
химическую связь, оттягивать к себе общие
электронные пары.
• Ряд электроотрицательности неметаллов
характеризует их окислительные способности,
т.е. меру их неметалличности.
• Чем выше значение Э.О., тем:
• больше способность оттягивать электронную
плотность от атомов других х.э.;
• сильнее выражены неметаллические
свойства;
• больше окислительная способность.
Назовите самый активный неметалл
5.
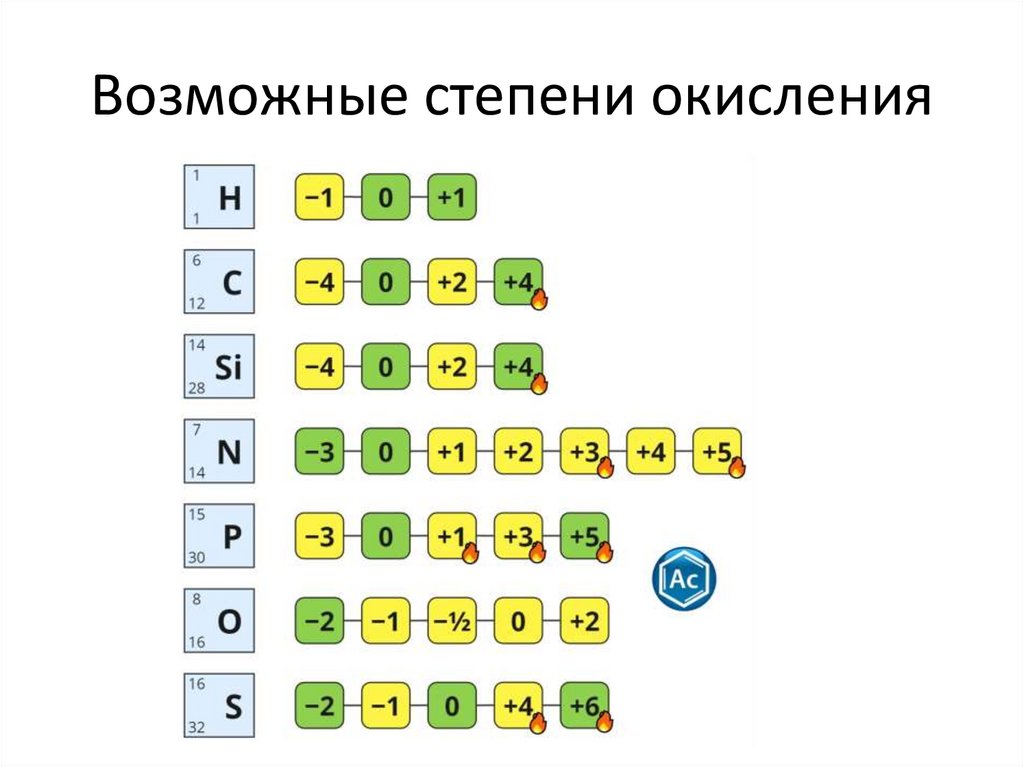
Возможные степени окисления6.
Простые веществаДвухатомные молекулы:
• водород Н2
• азот N2
• кислород О2
• галогены:
фтор F2
хлор Cl2
бром Br2
йод I2
7.
ФИЗИЧЕСКИЕ СВОЙСТВАНЕМЕТАЛЛОВ
8.
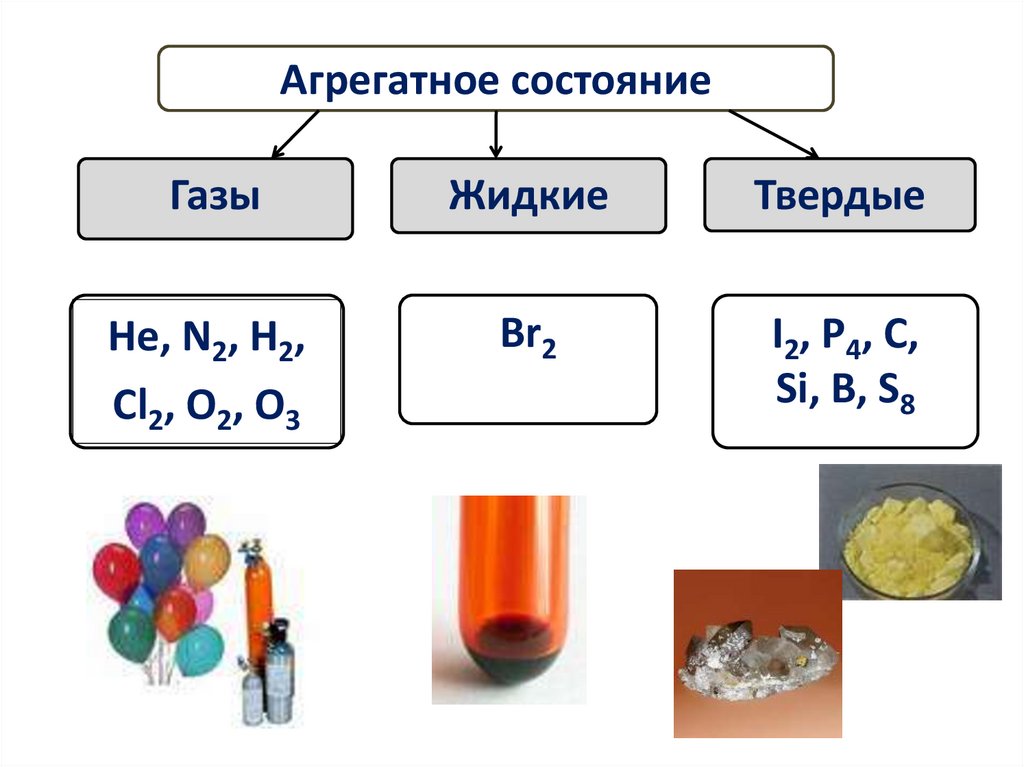
Агрегатное состояниеГазы
Жидкие
Твердые
Не, N2, Н2,
Cl2, O2, O3
Br2
I2, P4, C,
Si, B, S8
9.
Цвет неметалловЧЕРНЫЙ
БЕЛЫЙ
ФОСФОР
ФОСФОР
ГРАФИТ
ЖЕЛТО-ЗЕЛЕНЫЙ
ХЛОР
10.
Цвет неметалловКРАСНЫЙ
ЖЕЛТЫЙ
ФИОЛЕТОВЫЙ
ФОСФОР
СЕРА
ЙОД
БЕСЦВЕТНЫЙ
УГЛЕРОД
11.
Температура плавления• 38000 С – у графита
• - 2100 С - азота
12.
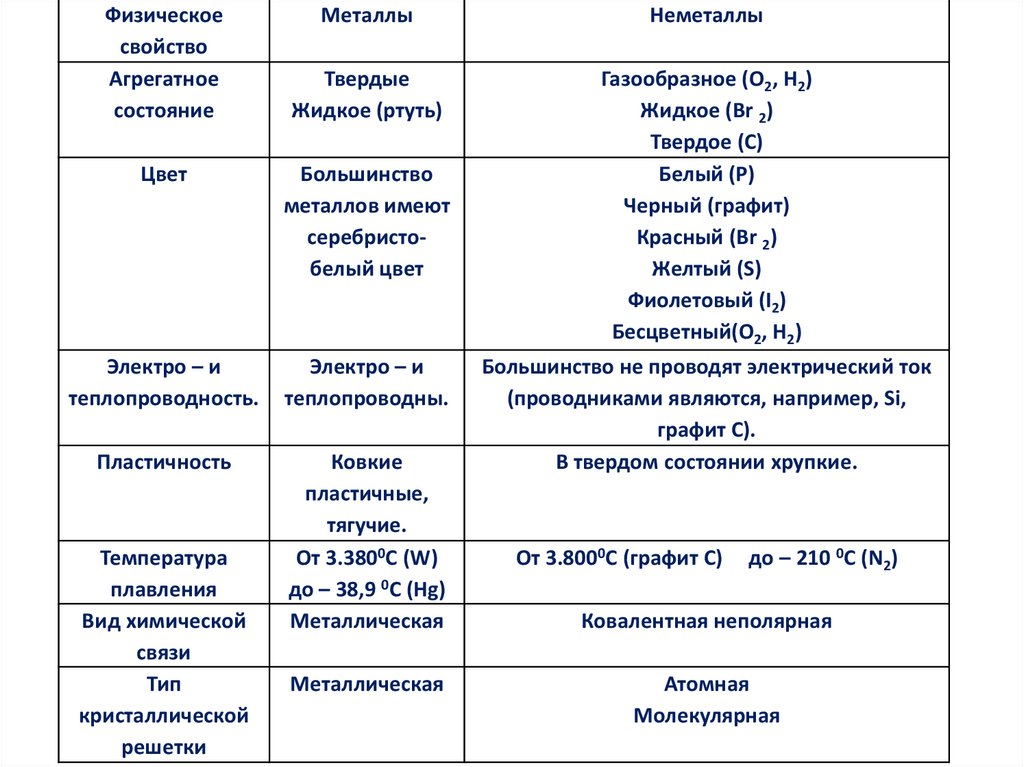
Физическоесвойство
Агрегатное
состояние
Металлы
Неметаллы
Твердые
Жидкое (ртуть)
Газообразное (О2, Н2)
Жидкое (Br 2)
Твердое (C)
Белый (Р)
Черный (графит)
Красный (Br 2)
Желтый (S)
Фиолетовый (I2)
Бесцветный(О2, Н2)
Цвет
Большинство
металлов имеют
серебристобелый цвет
Электро – и
теплопроводность.
Электро – и
теплопроводны.
Пластичность
Ковкие
пластичные,
тягучие.
От 3.3800С (W)
до – 38,9 0С (Hg)
Металлическая
Температура
плавления
Вид химической
связи
Тип
кристаллической
решетки
Металлическая
Большинство не проводят электрический ток
(проводниками являются, например, Si,
графит С).
В твердом состоянии хрупкие.
От 3.8000С (графит С)
до – 210 0С (N2)
Ковалентная неполярная
Атомная
Молекулярная
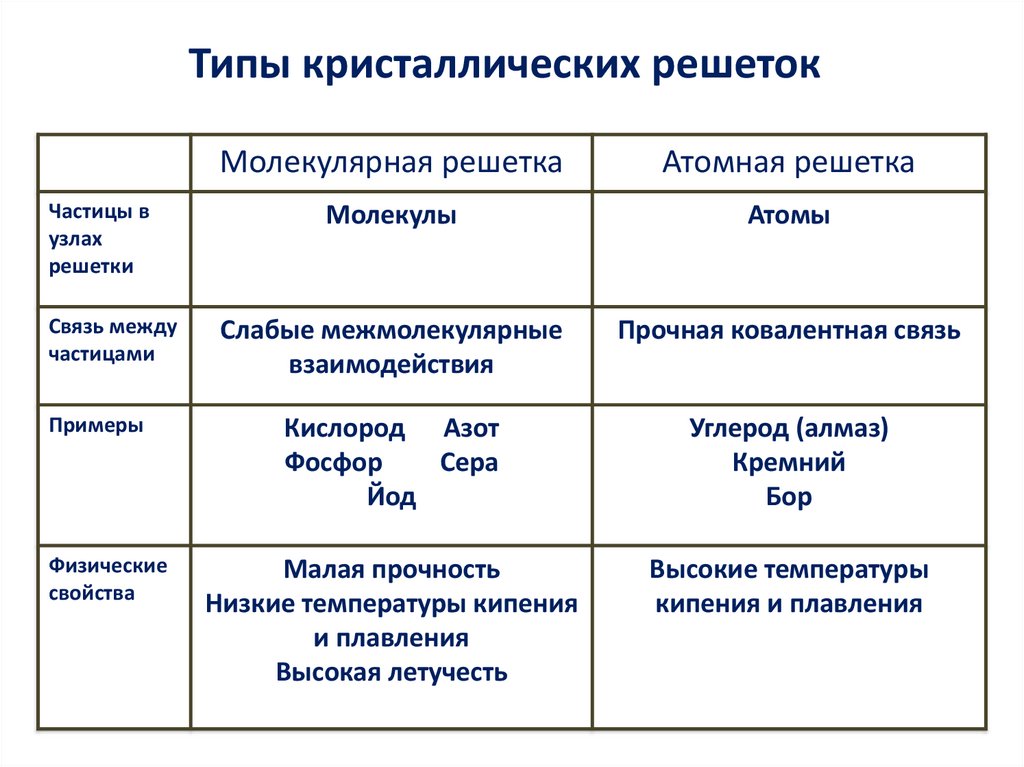
13.
Типы кристаллических решетокМолекулярная решетка
Атомная решетка
Частицы в
узлах
решетки
Молекулы
Атомы
Связь между
частицами
Слабые межмолекулярные
взаимодействия
Прочная ковалентная связь
Примеры
Кислород Азот
Фосфор
Сера
Йод
Углерод (алмаз)
Кремний
Бор
Физические
свойства
Малая прочность
Низкие температуры кипения
и плавления
Высокая летучесть
Высокие температуры
кипения и плавления
14.
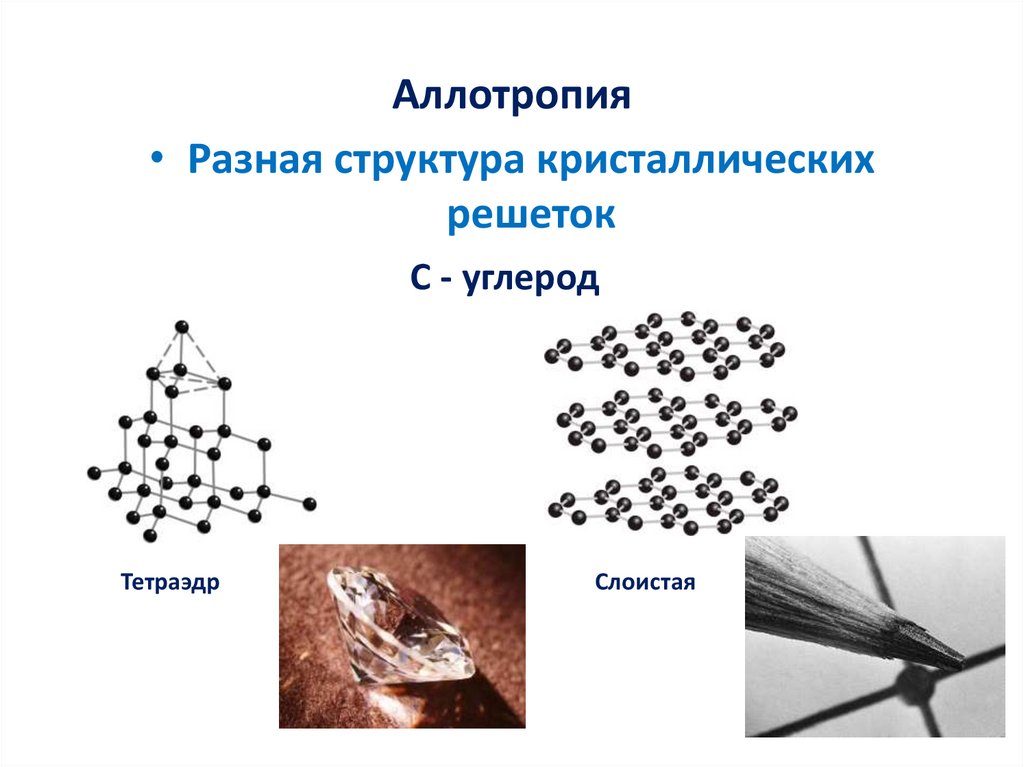
Аллотропия• Разная структура кристаллических
решеток
С - углерод
Тетраэдр
Слоистая
15.
Аллотропия• Разные типы кристаллических решеток
Р - фосфор
Красный фосфор - атомная
Белый фосфор - молекулярная
16.
Аллотропия• Разный состав молекул
О - кислород
Кислород
Озон
17.
Озон в природеСодержится в воздухе сосновых лесов и
морского побережья
18.
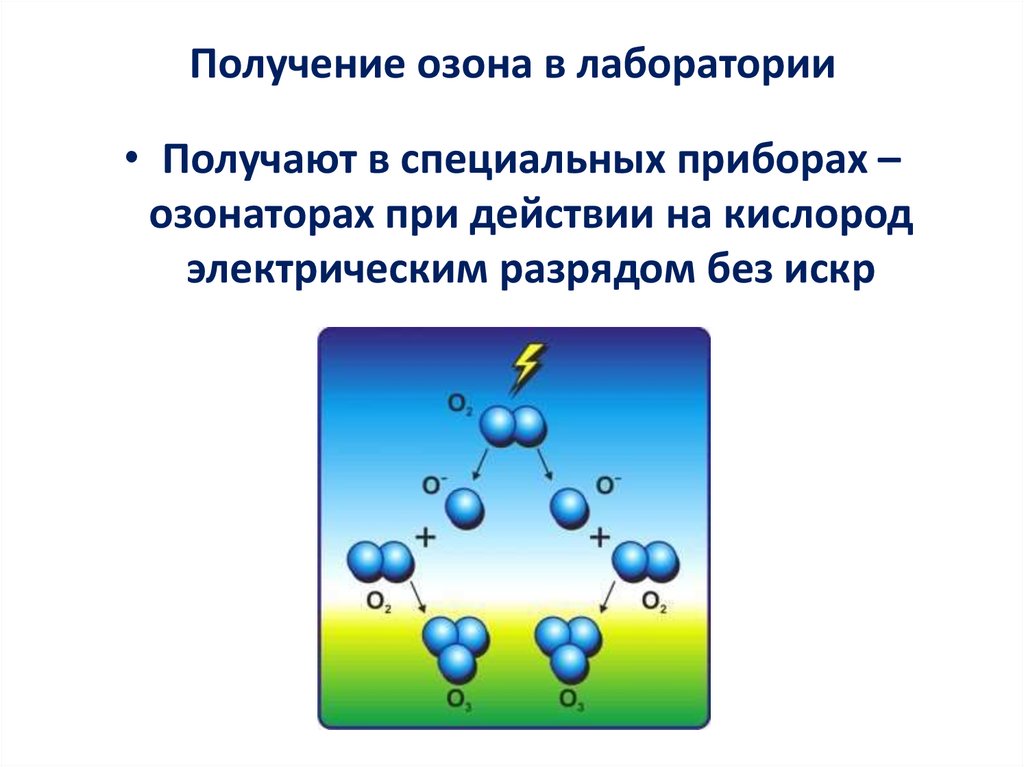
Получение озона в лаборатории• Получают в специальных приборах –
озонаторах при действии на кислород
электрическим разрядом без искр
19.
Значение озона для Земли• Задерживает ультрафиолетовые лучи, которые
разрушительно действуют на клетки живых организмов
• Озоновый слой расположен на высоте 20 – 25 км
20.
В конце 18 века Лавуазье установил, что воздух –не простое вещество, а смесь газов
М(возд.)= 29 г/моль; ρ(возд.)= 1,29 г/л; ϕ(О2 )=21%.
21.
Постоянные составляющие воздуха• Азот
• Кислород
• Благородные
газы
22.
Состав воздуха23.
Переменные составляющие воздуха• Углекислый газ
• Водяные пары
• Озон
24.
Случайные составляющие воздуха• Пыль
• Микроорганизмы
• Пыльца растений
• Оксиды серы и азота
25.
Химические свойства• Реагируют с металлами, образуя
бинарные соединения.
• В целом, химические свойства неметаллов
разнообразны. Некоторые из них могут
реагировать с водой, кислотами, щелочами,
другими неметаллами, различными
сложными соединениями.
26.
Типичные окислители• Фтор
• Кислород
• Галогены
27.
Типичные восстановители• Водород
• Углерод




















 chemistry
chemistry








