Similar presentations:
Неметаллы: общая характеристика. 9 класс
1.
Сера, фосфор, углерод,Кремний, кислород, азот.
Свойства их нам все известны.
Примененье – интересно.
Им сплошные комплименты!
2.
Неметаллы:общая характеристика.
9 класс
3.
Положение неметаллов в ПССтроение атомов неметаллов
Кристаллическое строение неметаллов –
простых веществ
Аллотропия
Физические свойства простых веществ – неметаллов
Особенности химических свойств неметаллов
Химические свойства неметаллов и их соединений
4.
Группы элементовПери –
оды
I
1
Н
2
Li
3
Na
6.939
11 Мg
22,9898
Калий
85,47
79
ЛВС
Алюминий
Скандий
VIII
VII
Иттрий
114,82
55 Ва
Индий
56 57
137.34
Барий
*
138,81
204,37
[223]
Ртуть
87 Rа[226]
Таллий
88 89
138,81
F
Сера
Nе
9
Фтор
17 Cl
32,064
33 Se
74,9216
Мышьяк
41
92,906
Хлор
18,9984
10
20,183
Неон
Ar
17
35,453
18
Аргон
Свинец
** Ас 104 Rf
[261]
Селен
51 Тe
121,75
Сурьма
82 Вi
34 Br
78,96
Молибден
Тантал
207,19
Марганец
Бром
39,948
74
183.85
83 Ро
208,980
Висмут
[262]
Радий
Актиний Резерфордий Дубний
R2О
RO
R2O3
45 Rh 46 Pd
Ru 102,905
106,4
Рутений
Родий
84 At
[210]
Полоний
[263]
Сиборгий
Осмий
210
Иридий
Астат
107 Bh 108 Hs 109 Мt
Борий
RO2
R2O5
RO3
R2O7
RH4
RH3
RH2
RH
54
131,30
Ксенон
78
195,09
Рt
Платина
Rn
85
[262]
Палладий
Xe
75 Re 76 Оs 77 Ir
W 186,2
190,2
192,2
105 Db 106 Sg
Франций
44
101,07
126,9044
Рений
36
83,80
Криптон
Йод
Вольфрам
Никель
Кr
53
78,96
Теллур
Кобальт
35
Технеций
52 I
Железо
79,904
42 Мо 43 Тс
Nb 95,94
[99]
Ниобий
50 Sb
118,69
Гафний
81 Pb
Кислород
Хром
72 Hf 73 Та
La 178.49
180,948
Лантан
80 Hg ТI
Аu 200,59
Фосфор
32 As
72,59
Цирконий
Олово
8
15,9994
15 S
30,9738
Ванадий
Германий
49 Sn
Гелий
7 О
14,0067
2
4.0026
23
24
25 Мn 26 Fe 27 Со 28
Ti 50,942
V 51,996
Cr 44,956
55,847
58,9332
58,71 Ni
40 Zr
Y 91,22
88,905
48 Сd In
Ag 112,40
132,905
Кремний
31 Ge
Азот
14 P
28,086
Титан
26,9815
38 39
Кадмий
Углерод
22
Sc 47,90
Галлий
87,62
6 N
12,01115
13 Si
26,9815
44,956
Стронций
Золото
Fr
Бор
20 21
Кальций
37 Sr
Цезий
196,967
40,08
Цинк
Серебро
Cs
5 С
10,811
30 Zn Ga
Сu 65,37
Рубидий
47
В
12 Al
24,312
Магний
19 Сa
39,102
29
4
9,0122
Бериллий
Натрий
107,868
Высшие
оксиды
VI
Не
Не
3 Ве
Литий
Rb
7
V
Водород
Медь
6
IV
1
63,546
5
III
1,00797
К
4
II
[265]
Хассий
[266]
Мейтнерий
RO4
Радон
86
[222]
5.
Особенности атомного строениянеметаллов
Небольшой атомный радиус
На внешнем уровне 4-8 электронов
Располагаются только в главных подгруппах
Характерно высокое значение ЭО
Ковалентная химическая связь
6.
Для вещества с ковалентной связью характерны два типакристаллических решеток (совокупность точек пространства, в
которых располагаются частицы, образующие кристалл) :
Молекулярные
Атомные
7.
Очень прочныеИмеют высокие t пл и t кип
Только твердые веществ
Неэлектропроводны (искл. графит)
Не обладают высокой
прочностью
Имеют низкие t пл t кип
Летучие вещества
Неэлектропроводны
Задание:
Выпишите отдельно формулы веществ с молекулярной и
атомной кристаллической решеткой
Вг2; Н2; Сl2; Si; P4(красный); C4(алмаз, графит).
8.
Аллотро́пия— существование одного итого же химического элемента в виде двух и
более простых веществ, различных по
строению и свойствам: так называемых
аллотропических модификаций или
аллотропических форм.
Модификации фосфора
9.
Причины аллотропии:1. Различное число атомов элемента в молекулах простых веществ
кислород
озон
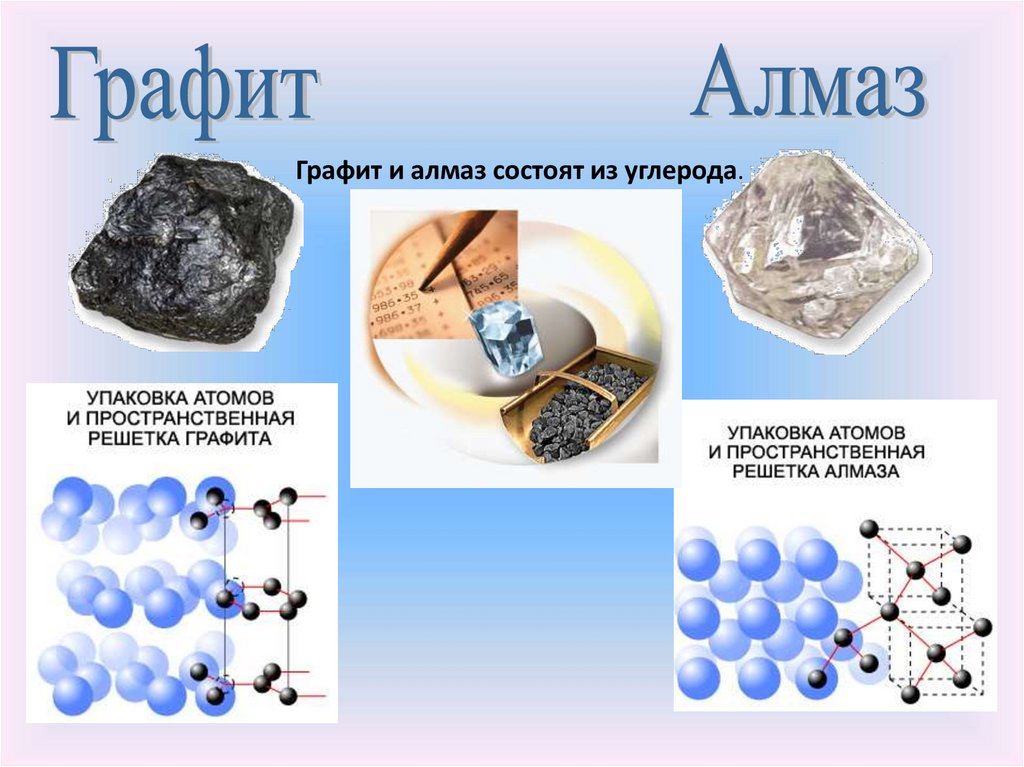
2.Различное строение кристаллической решетки.
Графит
Алмаз
10.
Графит и алмаз состоят из углерода.11.
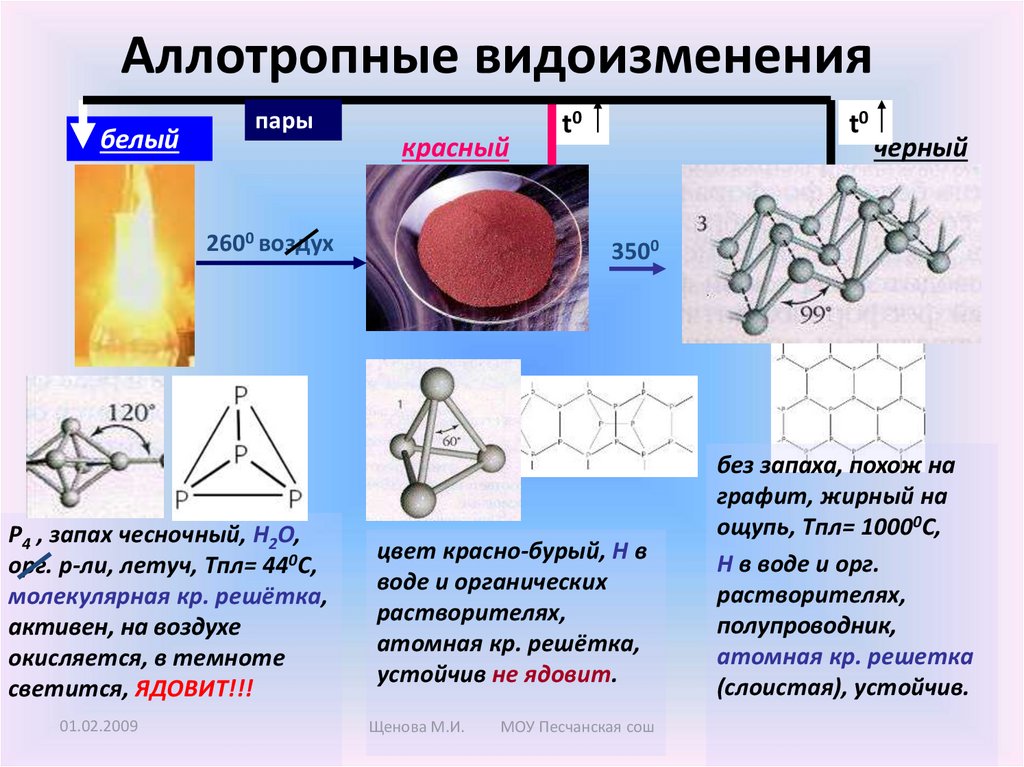
Аллотропные видоизменениябелый
пары
красный
2600 воздух
P4 , запах чесночный, H2O,
орг. р-ли, летуч, Tпл= 440С,
молекулярная кр. решётка,
активен, на воздухе
окисляется, в темноте
светится, ЯДОВИТ!!!
01.02.2009
t0
t0
черный
3500
цвет красно-бурый, Н в
воде и органических
растворителях,
атомная кр. решётка,
устойчив не ядовит.
Щенова М.И.
МОУ Песчанская сош
без запаха, похож на
графит, жирный на
ощупь, Tпл= 10000С,
Н в воде и орг.
растворителях,
полупроводник,
атомная кр. решетка
(слоистая), устойчив.
12.
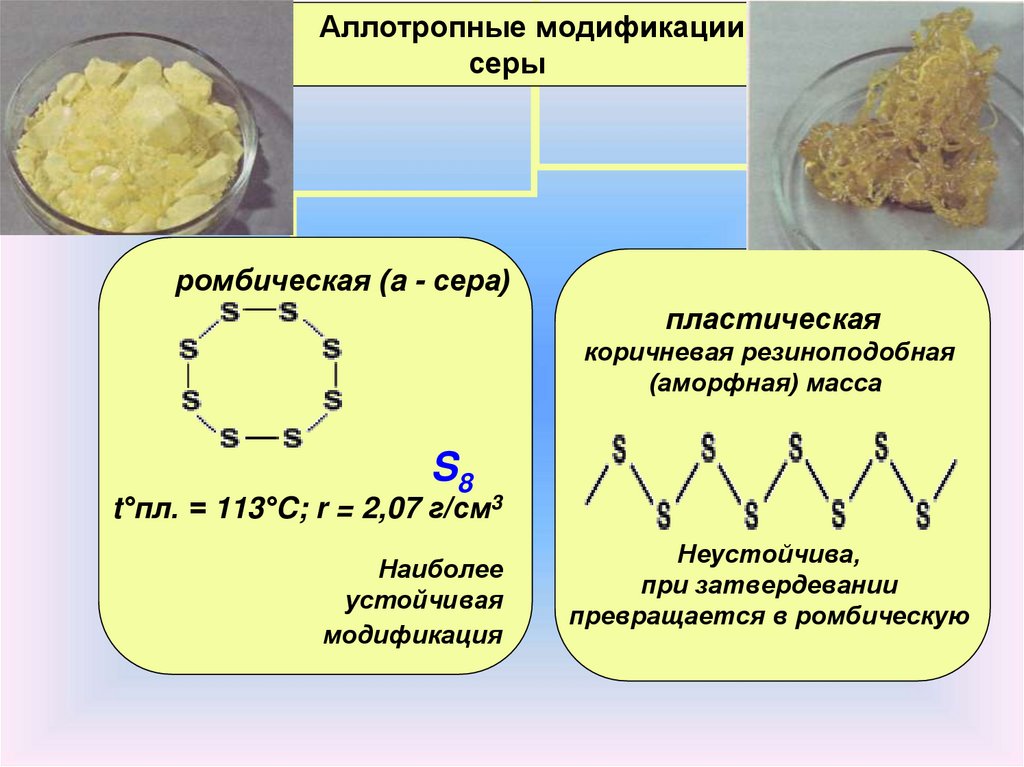
Аллотропные модификациисеры
ромбическая (a - сера)
пластическая
коричневая резиноподобная
(аморфная) масса
S8
t°пл. = 113°C; r = 2,07 г/см3
Наиболее
устойчивая
модификация
Неустойчива,
при затвердевании
превращается в ромбическую
13.
ФИЗИЧЕСКИЕ СВОЙСТВАПРОСТЫХ ВЕЩЕСТВ
14.
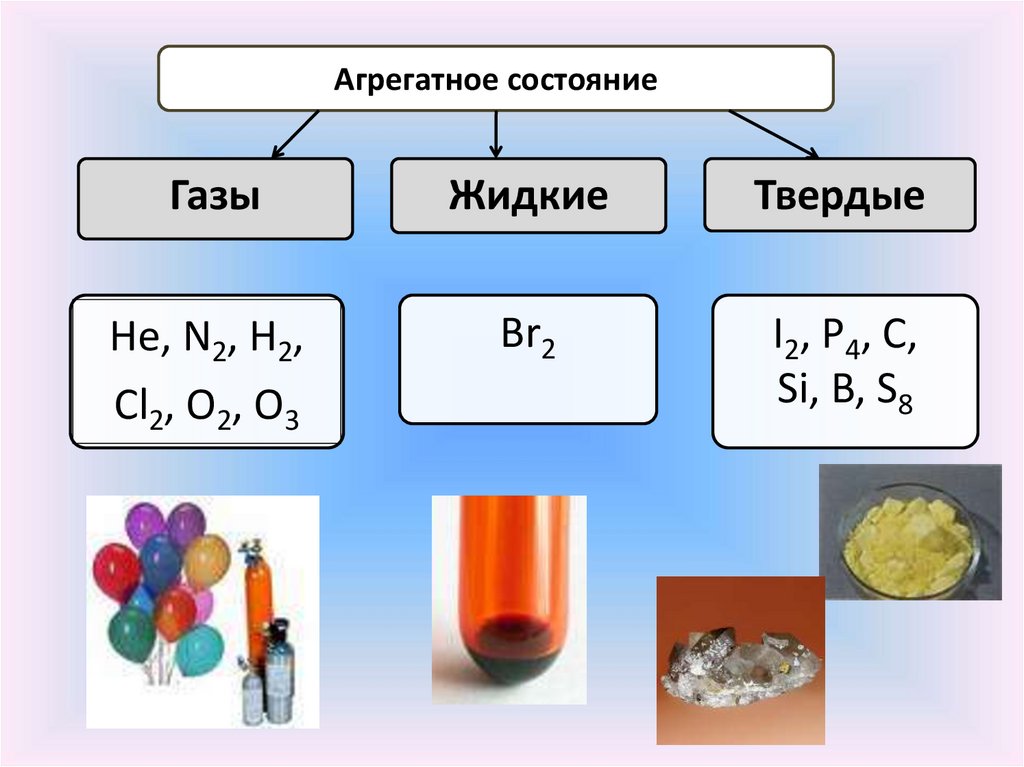
Агрегатное состояниеГазы
Жидкие
Твердые
Не, N2, Н2,
Cl2, O2, O3
Br2
I2, P4, C,
Si, B, S8
15.
Цвет неметалловЧЕРНЫЙ
БЕЛЫЙ
ФОСФОР
ФОСФОР
ГРАФИТ
ЖЕЛТО-ЗЕЛЕНЫЙ
ХЛОР
16.
Цвет неметалловКРАСНЫЙ
ЖЕЛТЫЙ
ФИОЛЕТОВЫЙ
ФОСФОР
СЕРА
ЙОД
БЕСЦВЕТНЫЙ
УГЛЕРОД
17.
Химические свойства• Неметаллы – окислители.
Э0 + nē Э-n
а) с металлами
Na + S
Al + CI2
Zn + O2
б) с водородом
H2 + S
P + Н2
CI + H2
• Неметаллы – восстановители
Э- n ē Э+ n
а) с кислородом
S + O2
Р + O2
N2 + O2
б) c кислотами - окислителями:
S + 2H2SO4(конц) 3SO2 + 2H2O
в) с оксидами металлов
MgO + Si
CuO + C
с другими неметаллами
S + Cl2
18.
ВЫВОДЫ1) Элементы-неметаллы расположены в главных подгруппах IVVII групп ПС Д.И. Менделеева, занимая её верхний правый угол.
2) На внешнем электронном слое атомов элементов-неметаллов
находятся от 4 до 8 электронов.
3) Неметаллические свойства элементов усиливаются в периодах
и ослабевают в подгруппах с увеличением порядкового номера
элемента.
4) Высшие кислородные соединения неметаллов
имеют кислотный характер.
5) Атомы элементов-неметаллов способны
как принимать электроны, проявляя окислительные функции, так
и отдавать их, проявляя восстановительные функции.
19.
Домашнее задание• § 10
• Составить кроссворд по неметаллам















 chemistry
chemistry








