Similar presentations:
Аминокислоты. Определение молекулярной формулы органического вещества
1.
Определите молекулярнуюформулу органического
вещества, содержащего 32%
углерода, 6,66% водорода,
42,67% кислорода и 18,67%
азота.
С2Н5O2N
2.
3.
Аминокислоты – гетерофункциональныесоединения, которые обязательно содержат
две функциональные группы: аминогруппу –
NH2 и карбоксильную группу –COOH,
связанные с углеводородным радикалом.
• Общая формула
NH2 – CH – COOH
R
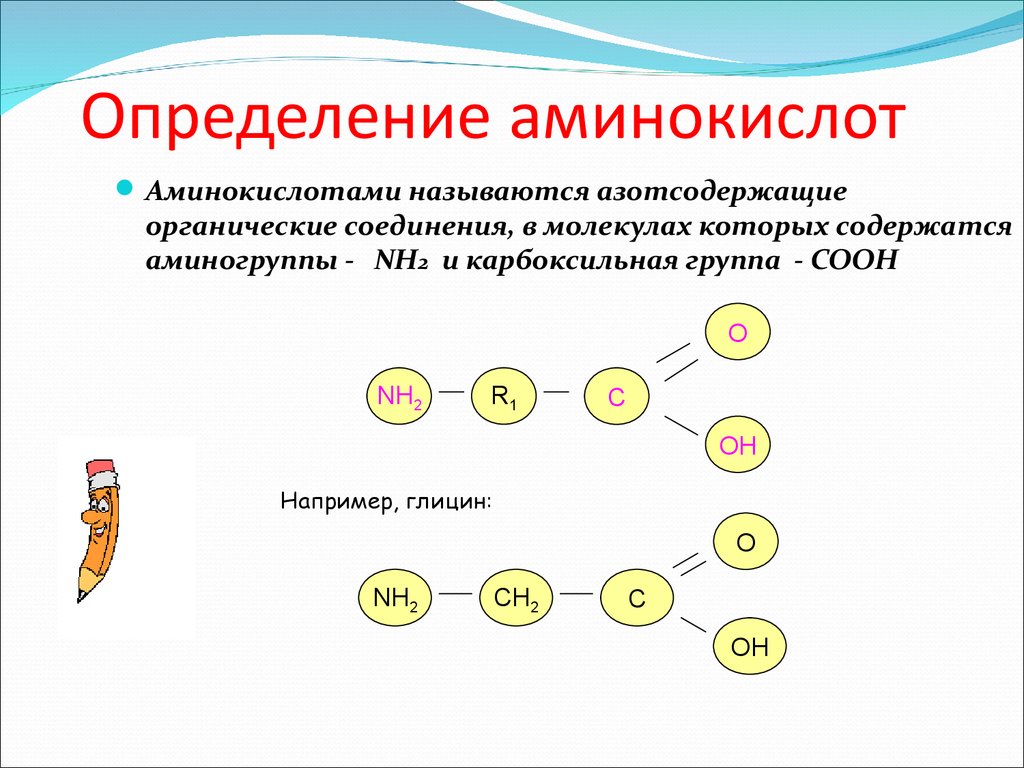
4. Определение аминокислот
Аминокислотами называются азотсодержащиеорганические соединения, в молекулах которых содержатся
аминогруппы - NH2 и карбоксильная группа - СООН
O
NH2
R1
C
OH
Например, глицин:
O
NH2
CH2
C
OH
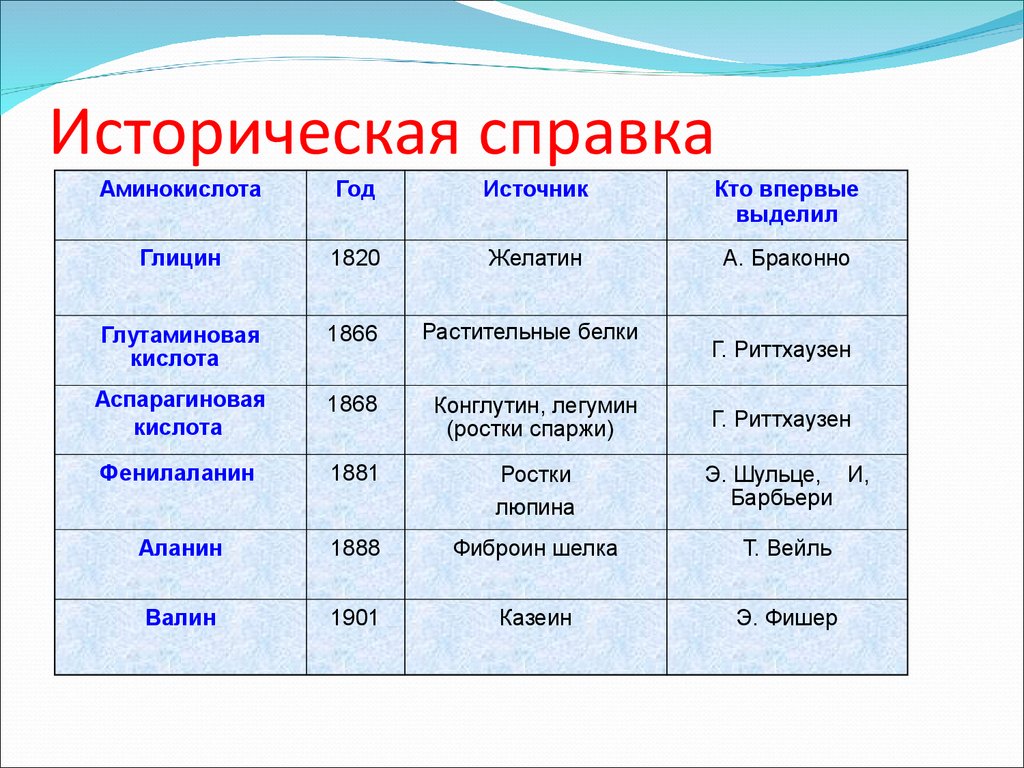
5. Историческая справка
АминокислотаГод
Источник
Кто впервые
выделил
Глицин
1820
Желатин
А. Браконно
Глутаминовая
кислота
1866
Растительные белки
Аспарагиновая
кислота
1868
Конглутин, легумин
(ростки спаржи)
Г. Риттхаузен
Фенилаланин
1881
Ростки
люпина
Э. Шульце, И,
Барбьери
Аланин
1888
Фиброин шелка
Т. Вейль
Валин
1901
Казеин
Э. Фишер
Г. Риттхаузен
6. Классификация
1.По взаимному расположению
функциональных групп:
γ β α
С – С – С – С – СООН
|
NH2
γ β α
С – С – С – С – СООН
|
NH2
γ β α
С – С – С – С – СООН
|
NH2
7. Классификация
2. По количеству функциональных групп :моноаминомонокарбоновые
С – С – СООН
|
NH2
3-аминопропановая кислота
β -аминопропионовая кислота
диаминомонокарбоновые
С-С-С-С-С -СООН
׀
׀
NH2
NH2
2,6-диаминогексановая кислота
8. Изомерия аминокислот
Для аминокислот характерны следующие виды изомерии:а) углеродного скелета:
СН3 – СН2– СН – СООН
|
NH2
2-аминобутановая кислота
СН3
|
СН3 – С – СООН
|
NH2
2-метил, 2-аминобутановая кислота
9. Изомерия аминокислот
б) расположения функциональной группы :γ
β
α
СН3 – СН2– СН- СООН
|
NH2
γ
β
α
СН3 – СН2– СН – СООН
|
NH2
в) межклассовая
α- аминомасляная кислота
β- аминомасляная кислота
10. Физические свойства
Аминокислоты:бесцветные кристаллические вещества
сладкие на вкус
хорошо растворяются в воде
имеют температуру плавления
2200- 3150 С.
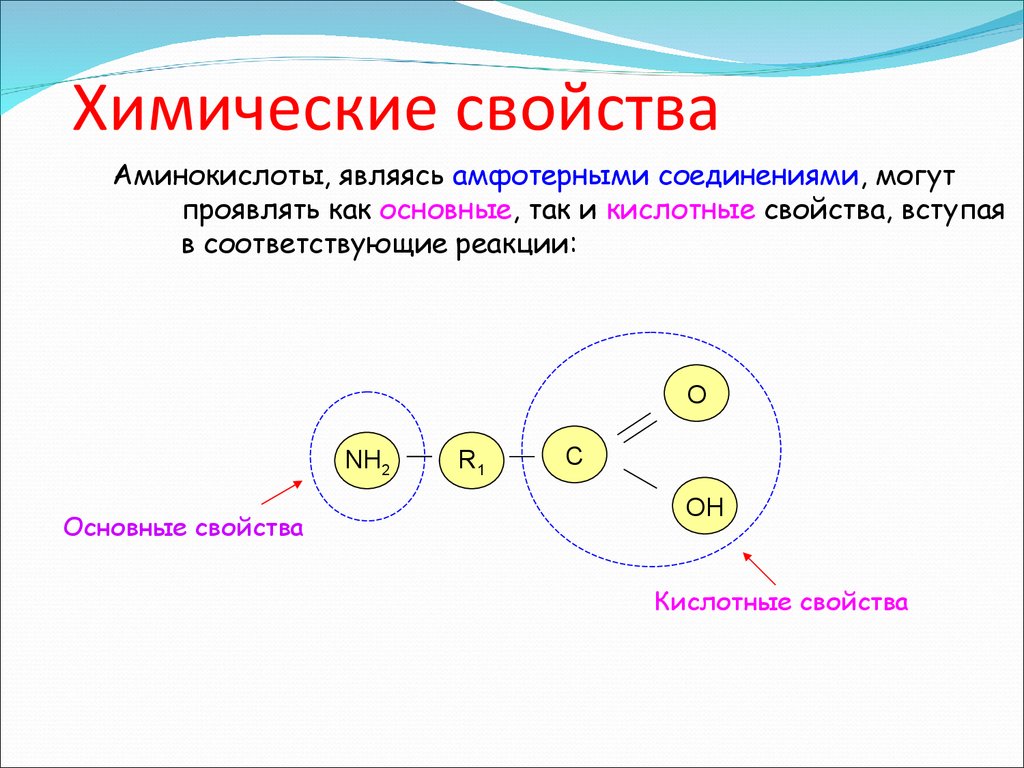
11. Химические свойства
Аминокислоты, являясь амфотерными соединениями, могутпроявлять как основные, так и кислотные свойства, вступая
в соответствующие реакции:
О
NH2
Основные свойства
R1
C
OH
Кислотные свойства
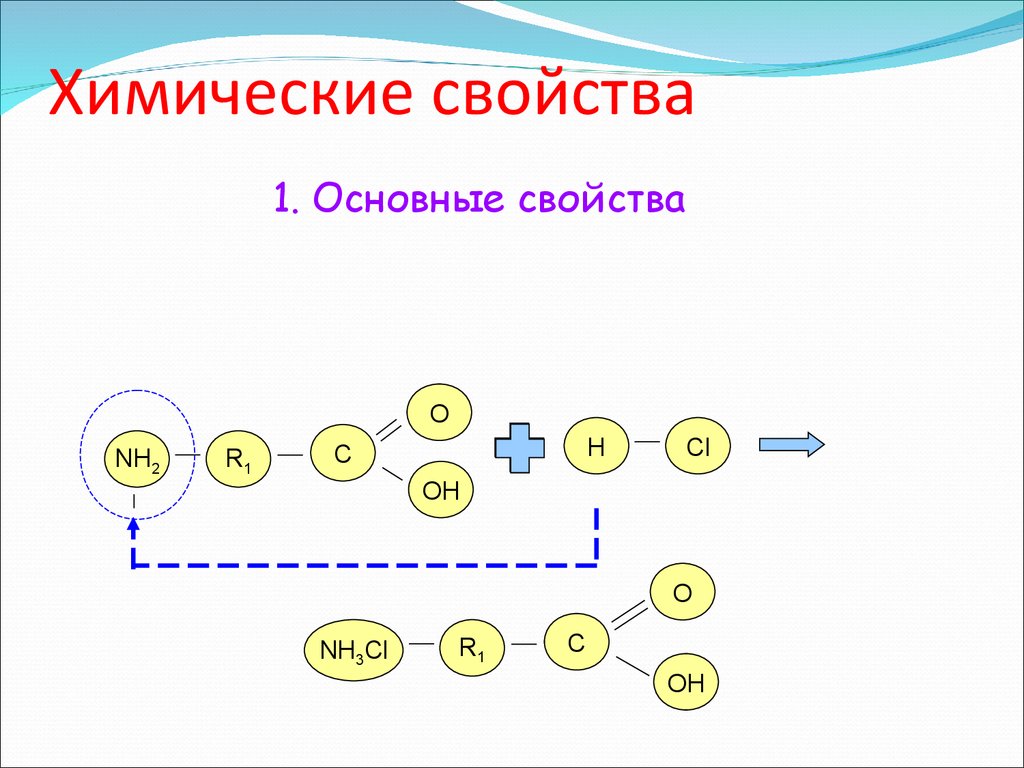
12. Химические свойства
1. Основные свойстваО
NH2
R1
H
C
Cl
OH
О
NH3Cl
R1
C
OH
13. Химические свойства
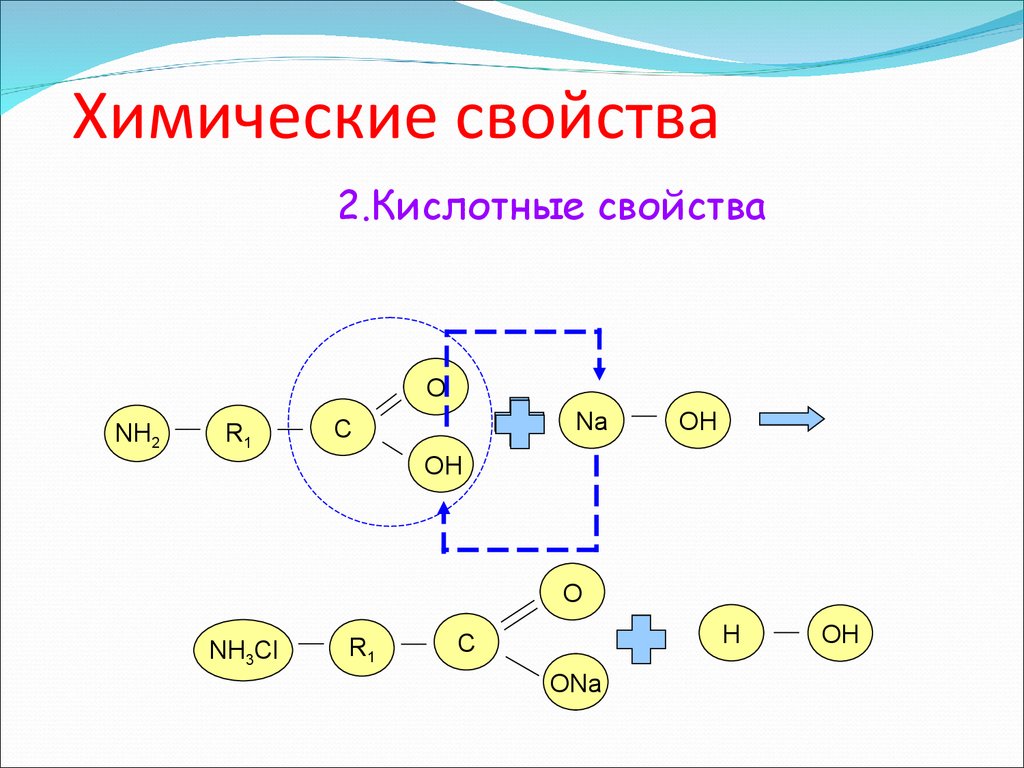
2.Кислотные свойстваО
NH2
R1
Na
C
OH
OH
О
NH3Cl
R1
H
C
ONa
OH
14. Химические свойства
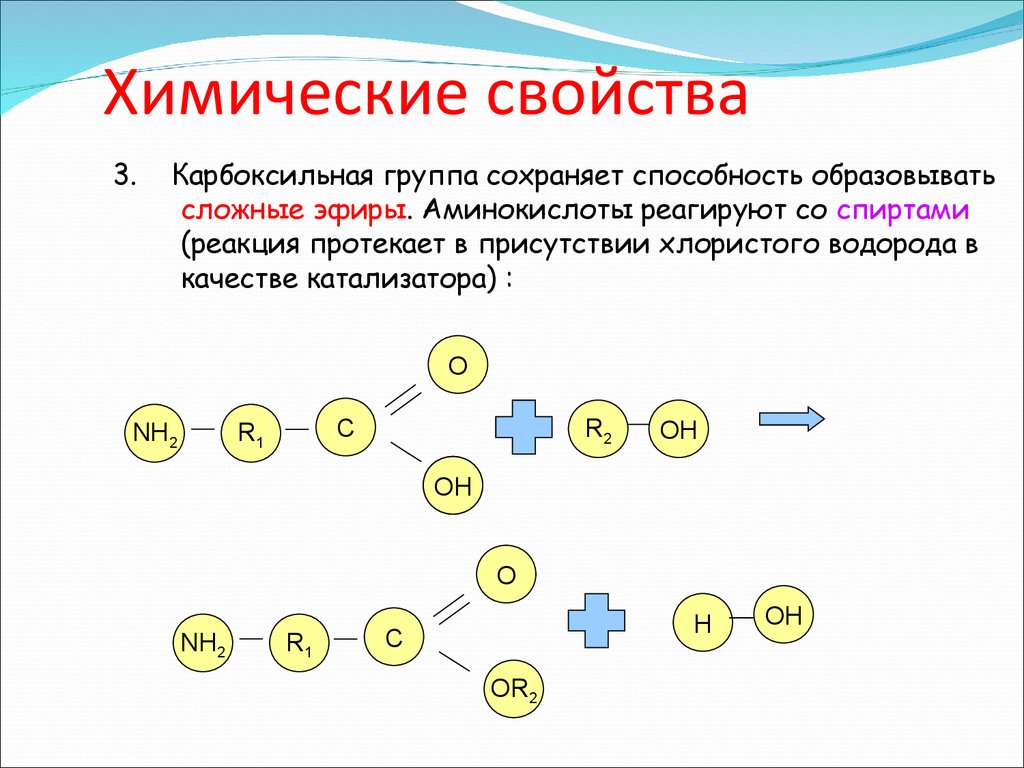
3.Карбоксильная группа сохраняет способность образовывать
сложные эфиры. Аминокислоты реагируют со спиртами
(реакция протекает в присутствии хлористого водорода в
качестве катализатора) :
О
NH2
R2
C
R1
OH
OH
H
О
NH2
R1
H
C
OR2
OH
15. Химические свойства
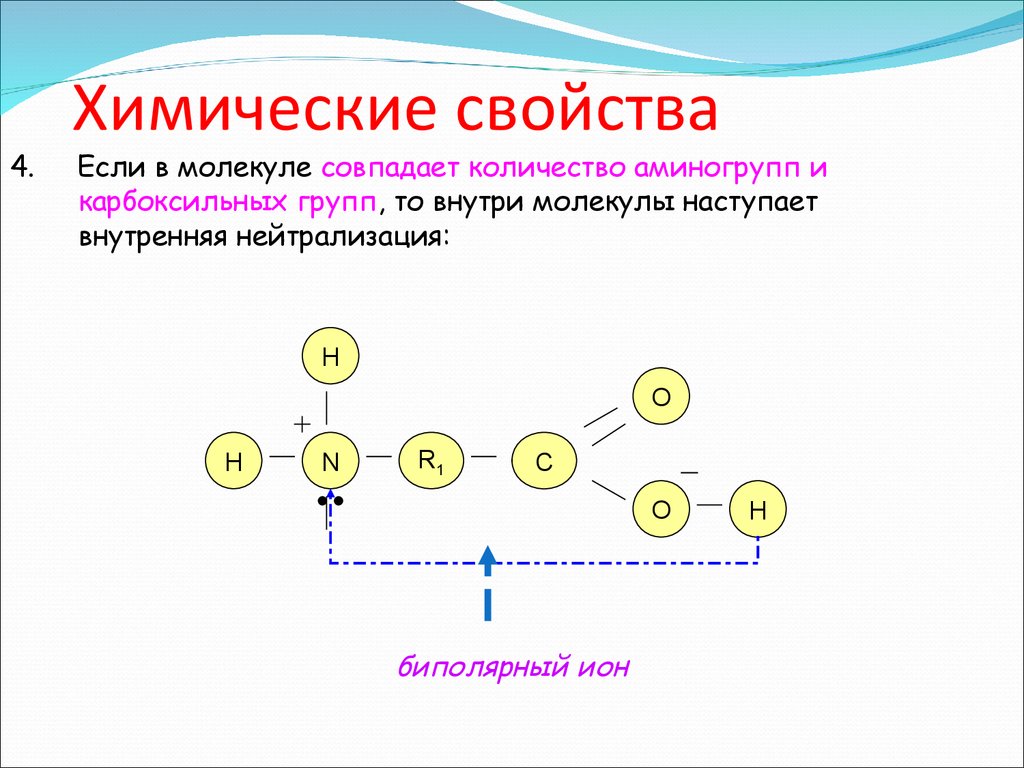
4.Химические свойства
Если в молекуле совпадает количество аминогрупп и
карбоксильных групп, то внутри молекулы наступает
внутренняя нейтрализация:
H
O
H
N
R1
C
O
биполярный ион
H
16. Химические свойства
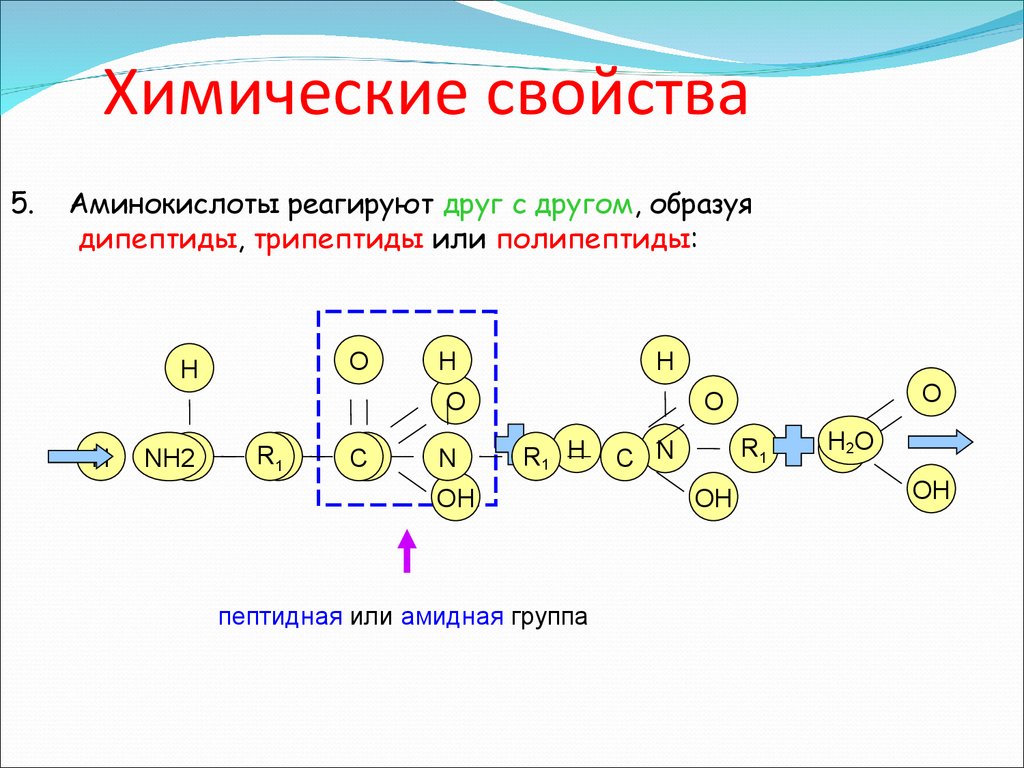
5.Аминокислоты реагируют друг с другом, образуя
дипептиды, трипептиды или полипептиды:
O
H
H
H
O
H
NH2
N
RR11
CC
N
O
O
R1 H
OH
пептидная или амидная группа
R1
C N
OH
HC2O
OH
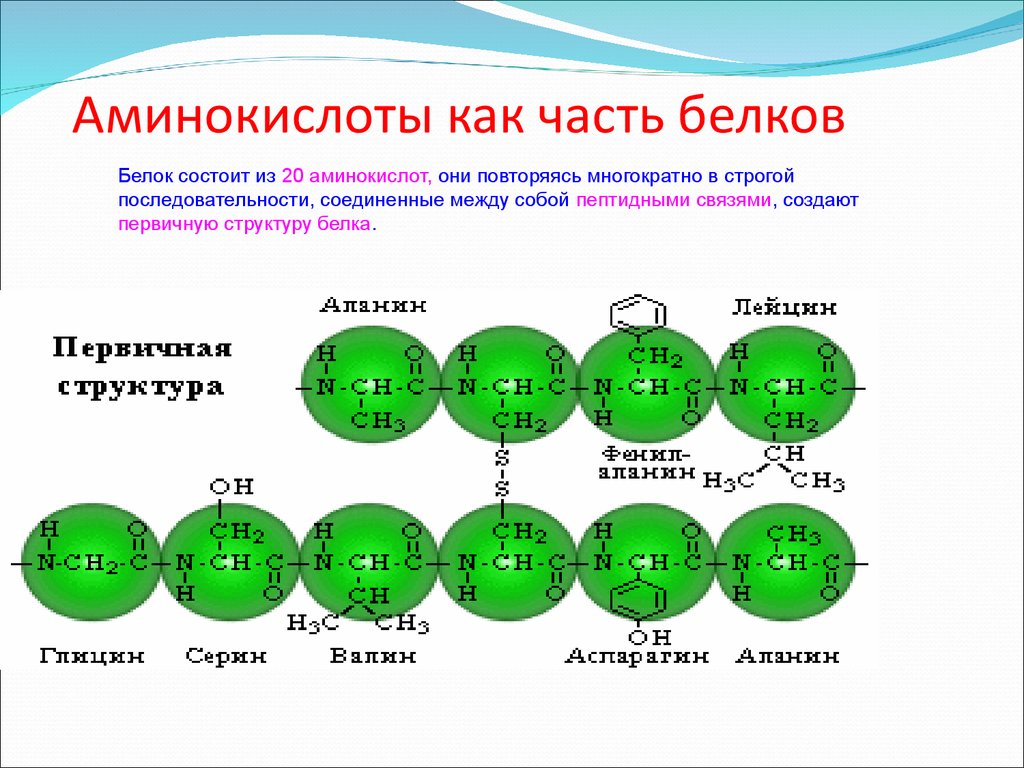
17. Аминокислоты как часть белков
Белок состоит из 20 аминокислот, они повторяясь многократно в строгойпоследовательности, соединенные между собой пептидными связями, создают
первичную структуру белка.
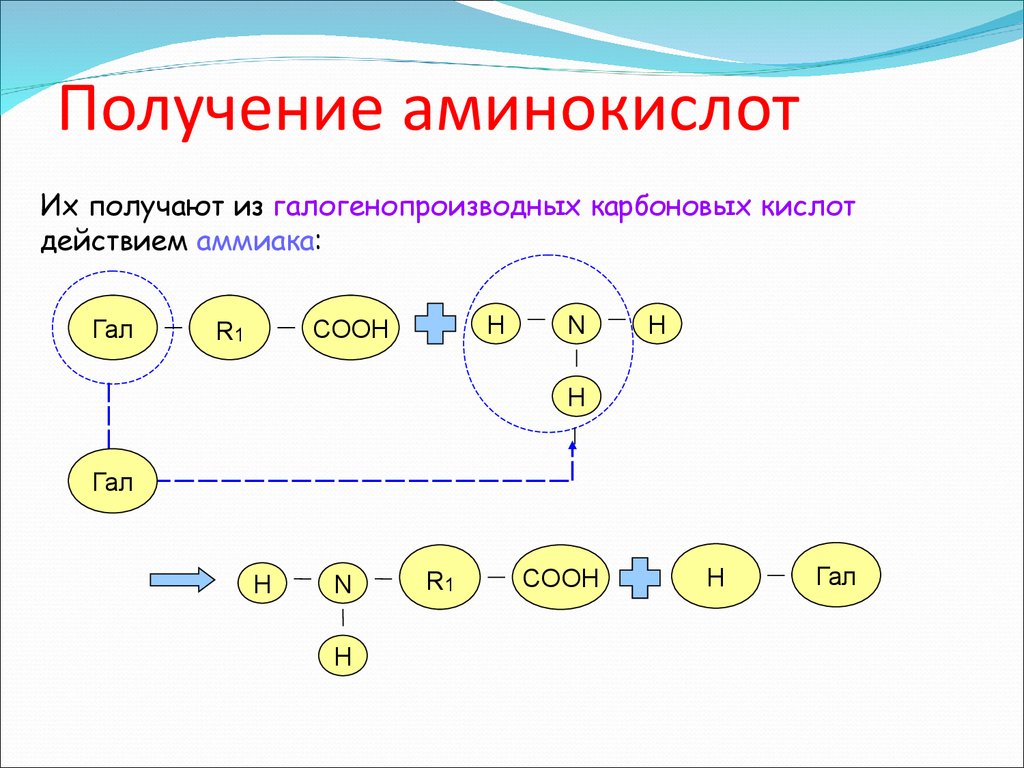
18. Получение аминокислот
Их получают из галогенопроизводных карбоновых кислотдействием аммиака:
Гал
H
COOH
R1
N
H
H
Гал
H
N
H
R1
COOH
Н
Гал
19. Получение аминокислот
в промышленности гидролизом белков.Смесь аминокислот обычно получают
кислотным гидролизом белков.
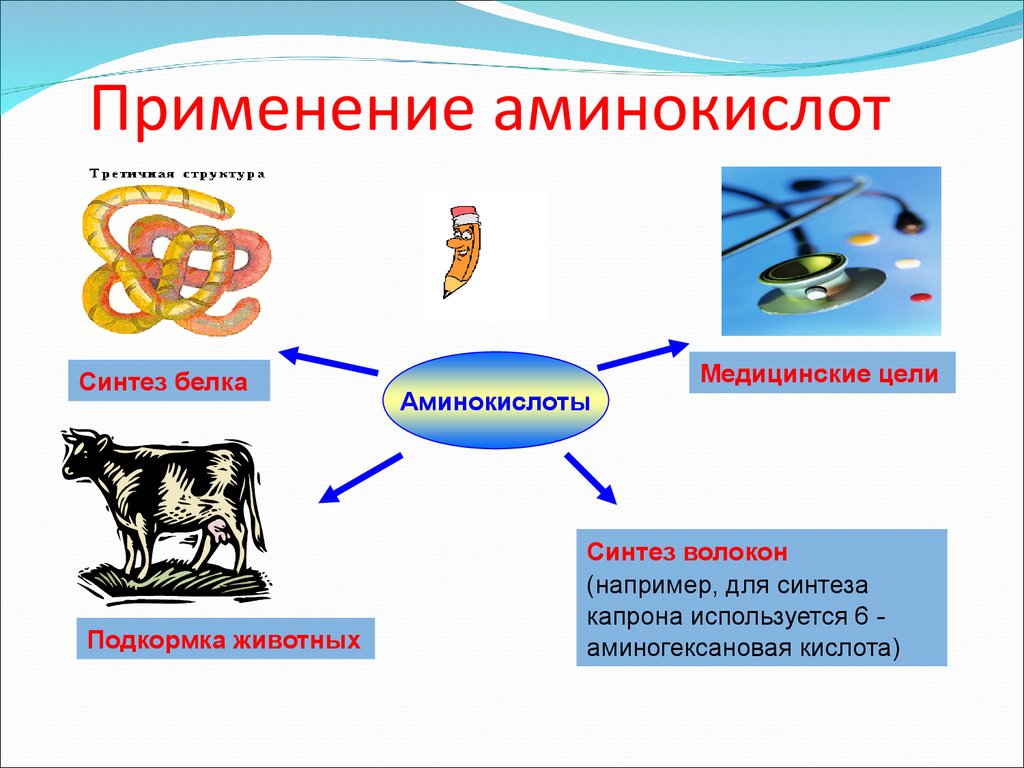
20. Применение аминокислот
Синтез белкаПодкормка животных
Аминокислоты
Медицинские цели
Синтез волокон
(например, для синтеза
капрона используется 6 аминогексановая кислота)









 biology
biology chemistry
chemistry








