Similar presentations:
Аминокислоты
1. «Аминокислоты»
2. Аминокислоты
N H2 – C H – C O O HR
Производные карбоновых кислот,
содержащие в своем составе одну или
несколько аминогрупп.
3. Аминокислоты
ПриродныеИх около 150, они были
обнаружены в живых
организмах, около 20 из
них входят в состав
белков.–
Синтетические
Получают кислотным
гидролизом белков
либо из карбоновых
кислот, воздействуя на
них галогеном
и, далее, аммиаком.
4.
Заменимыеаминокислоты –
это такие аминокислоты,
которые могут поступать в наш
организм с белковой пищей
либо же образовываться в
организме из других
аминокислот.
Незаменимые
аминокислоты – это такие
аминокислоты, которые наш
организм не может
самостоятельно вырабатывать,
они обязательно должны
поступать с белковой пищей.
5. Некоторые важнейшие α-аминокислоты общей формулы NH2 - CH - COOH R
Некоторые важнейшие α-аминокислоты общейформулы
Аминокислота
Глицин
NH2 - CH - COOH
R
Сокращенное
Радикал
обозначение
Gly
–Н
Аланин
Ala
CH3
Фенилаланин
Phe
CH2–C6H5
Валин
Val
–СH(CH3)2
Лейцин
Leu
–CH2–CH(CH3)2
Серин
Ser
–CH2OH
6.
НоменклатураПо систематической номенклатуре названия
аминокислот образуются из названий соответствующих
кислот прибавлением приставки амино- и указанием
места расположения аминогруппы по отношению
к карбоксильной группе.
7. Номенклатура
Часто используется другой способ построения названийаминокислот, согласно которому к тривиальному
названию карбоновой кислоты добавляется приставка
амино- с указанием положения аминогруппы буквой
греческого алфавита.
8. Номенклатура
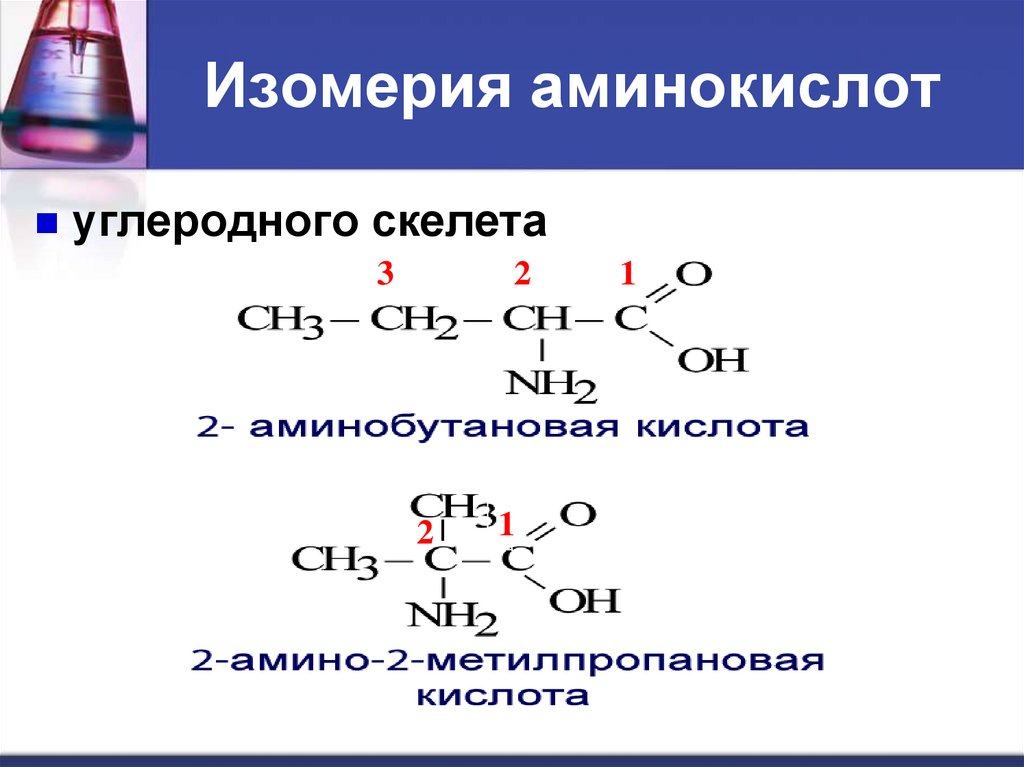
Изомерия аминокислотуглеродного
скелета ;
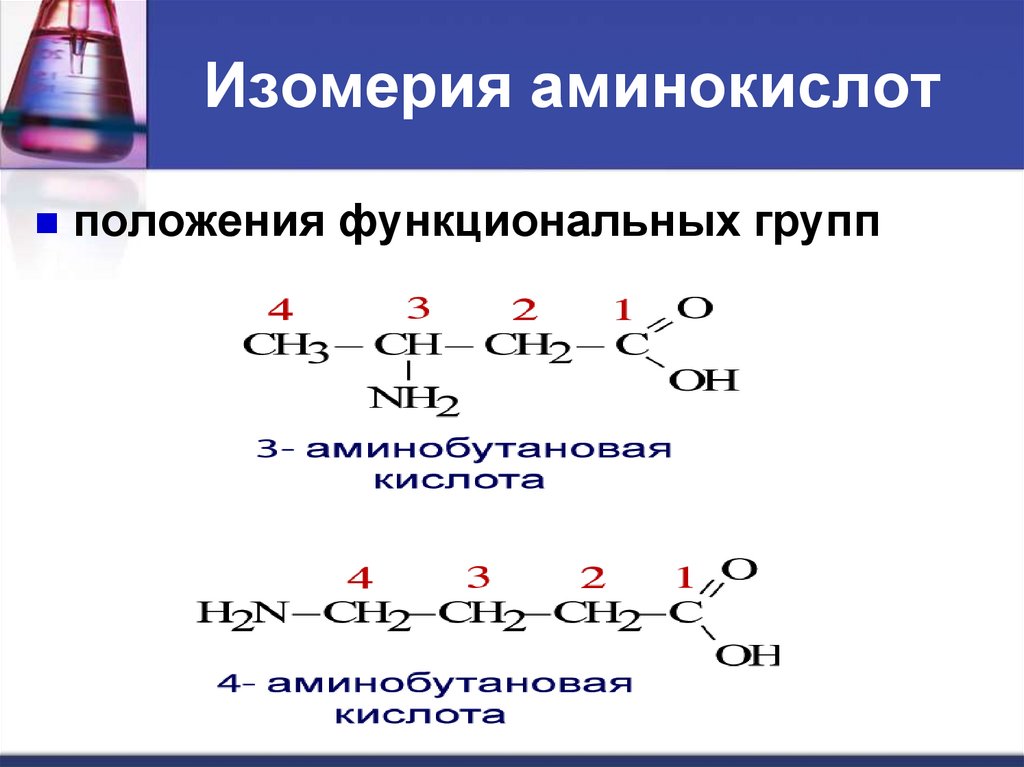
положения функциональных групп ;
межклассовая (нитросоединения);
оптическая.
9. Изомерия аминокислот
углеродного скелета3
2
2
1
1
10. Изомерия аминокислот
положения функциональных групп11. Изомерия аминокислот
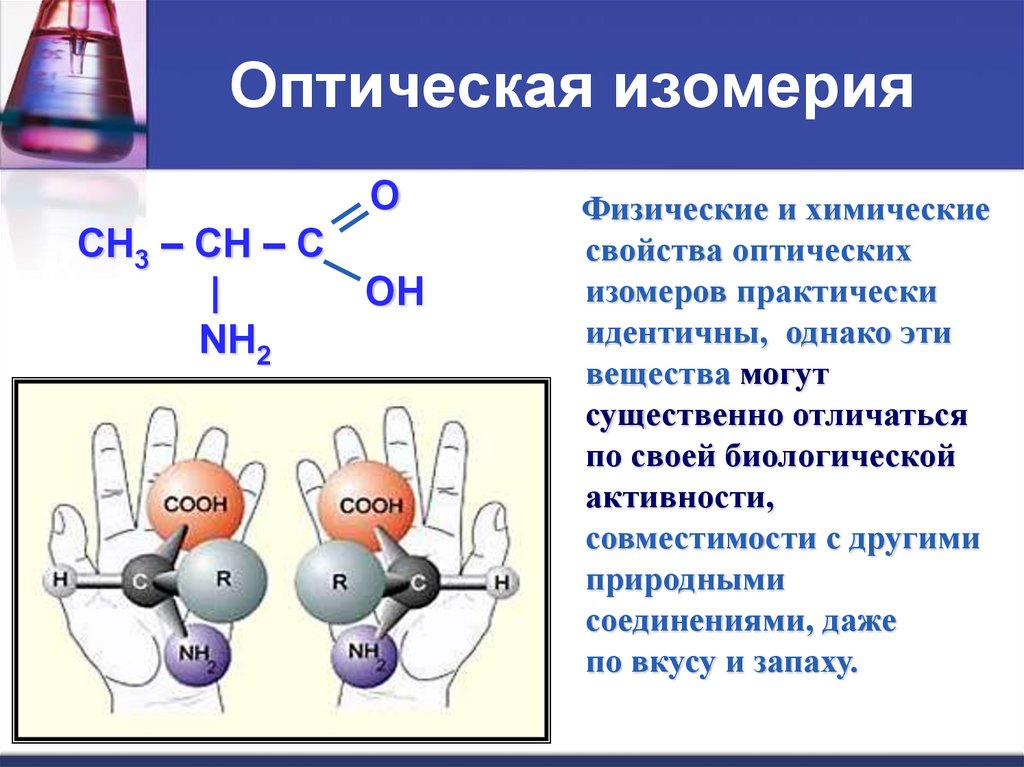
Оптическая изомерияO
CH3 – CH – C
|
OH
NH2
2- аминопропановая кислота
Физические и химические
свойства оптических
изомеров практически
идентичны, однако эти
вещества могут
существенно отличаться
по своей биологической
активности,
совместимости с другими
природными
соединениями, даже
по вкусу и запаху.
12. Оптическая изомерия
Физические свойстваАминокислоты:
бесцветные кристаллические вещества
сладкие на вкус
хорошо растворяются в воде
имеют температуру плавления
0
0
220 - 315 С.
13. Физические свойства
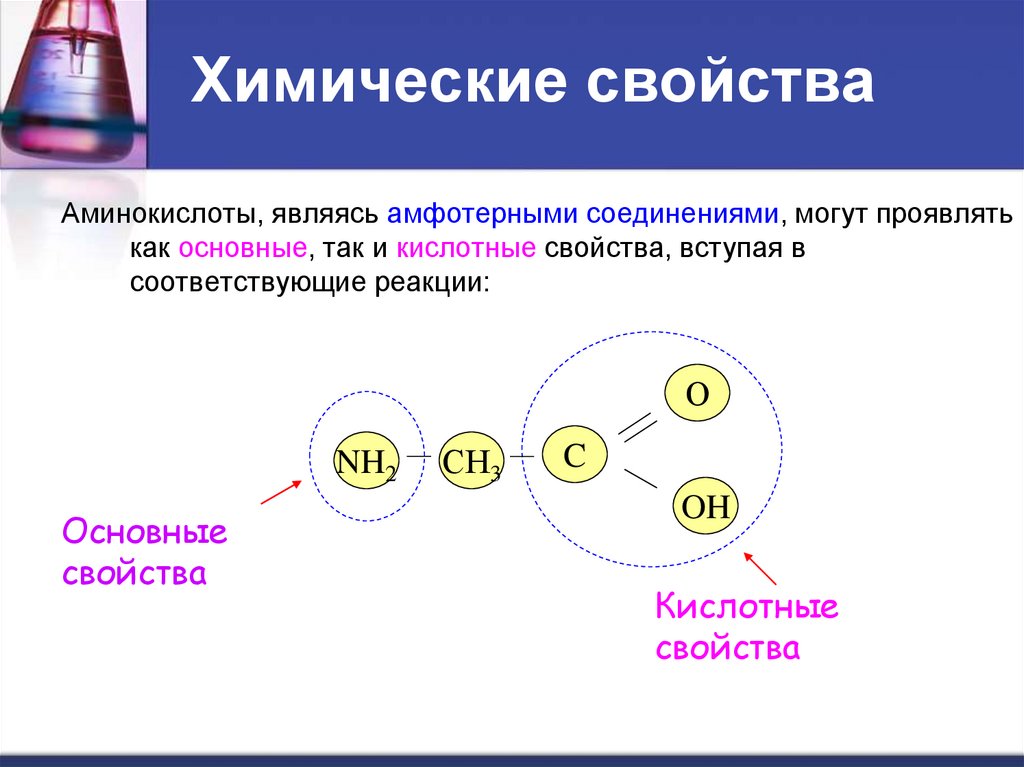
Химические свойстваНаличие аминои карбоксильной групп
определяет двойственность
химических свойств
аминокислот.
Амфотерность (от греч.
amphуteros – «и тот и другой») –
способность некоторых веществ
в зависимости от условий
проявлять либо кислотные,
либо основные свойства;
амфотерные вещества иногда
называют амфолитами.
14. Химические свойства
Аминокислоты, являясь амфотерными соединениями, могут проявлятькак основные, так и кислотные свойства, вступая в
соответствующие реакции:
О
NH2
Основные
свойства
СН3
C
OH
Кислотные
свойства
15. Химические свойства
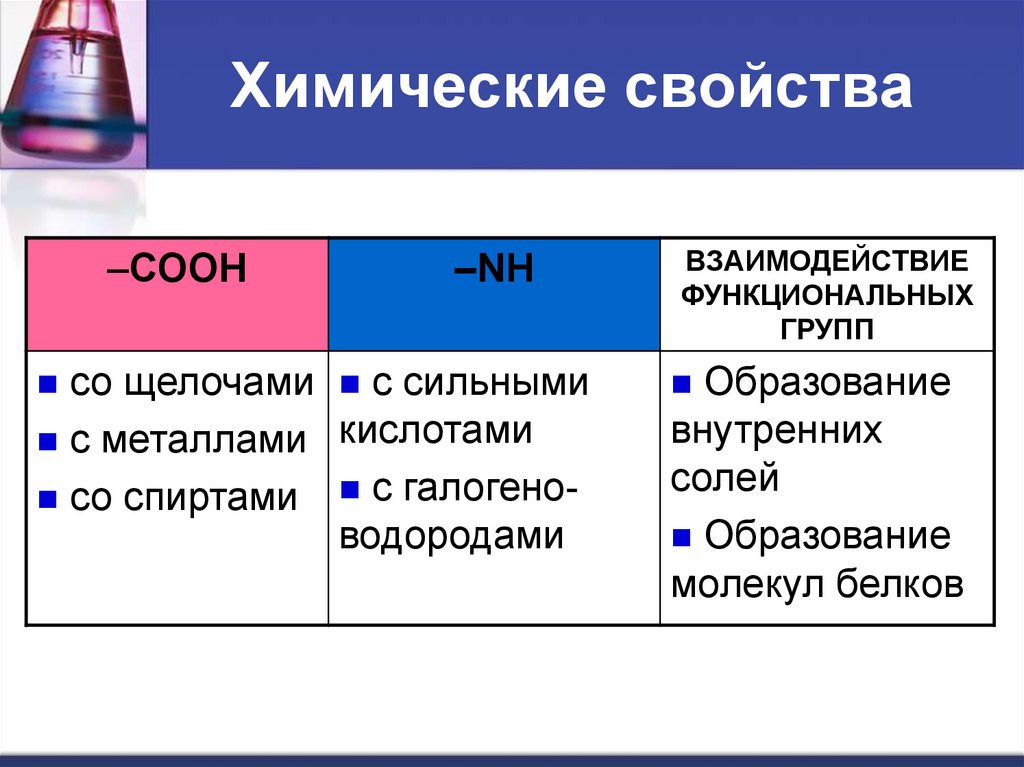
–СООН–NH
со щелочами с сильными
с металлами кислотами
со спиртами с галогеноводородами
ВЗАИМОДЕЙСТВИЕ
ФУНКЦИОНАЛЬНЫХ
ГРУПП
Образование
внутренних
солей
Образование
молекул белков
16. Химические свойства
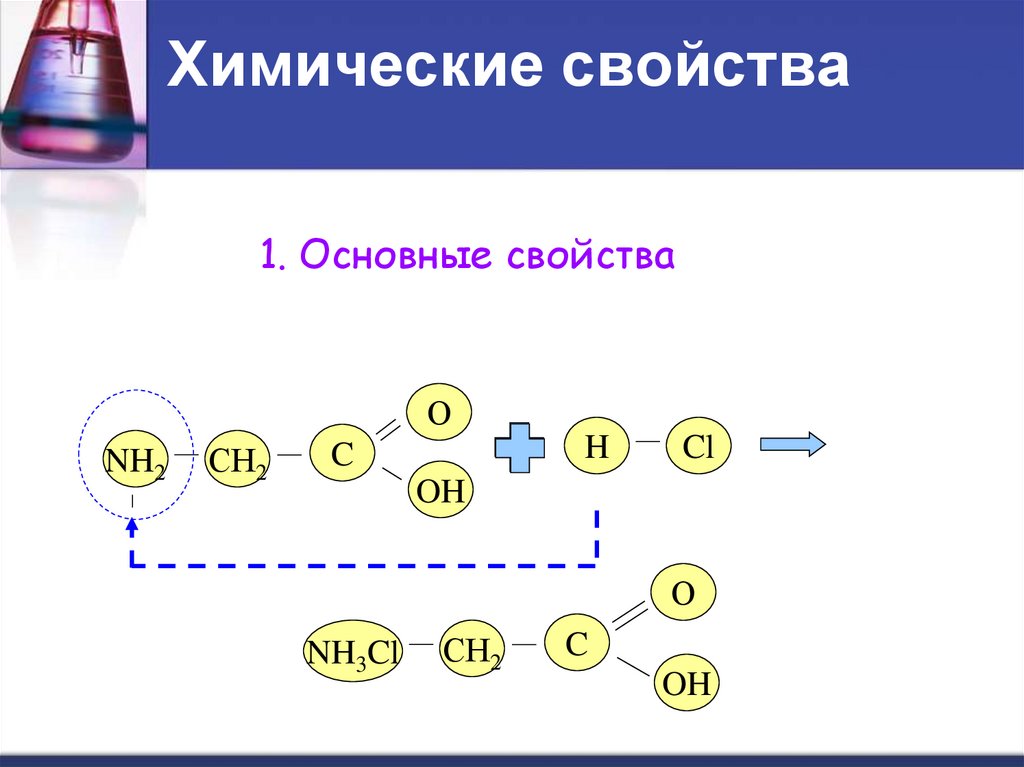
1. Основные свойстваО
NH2
СН2
H
C
Cl
OH
О
NH3Cl
СН2
C
OH
17. Химические свойства
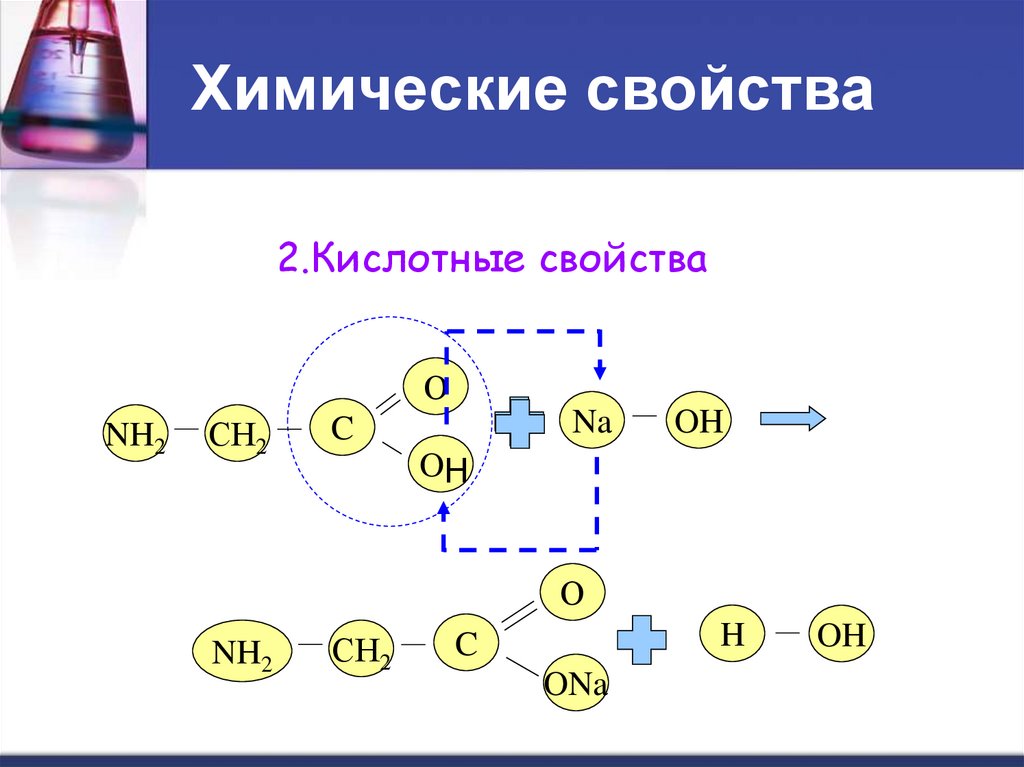
2.Кислотные свойстваО
NH2
СН2
Na
C
OH
OH
О
NH2
СН2
H
C
ONa
OH
18. Химические свойства
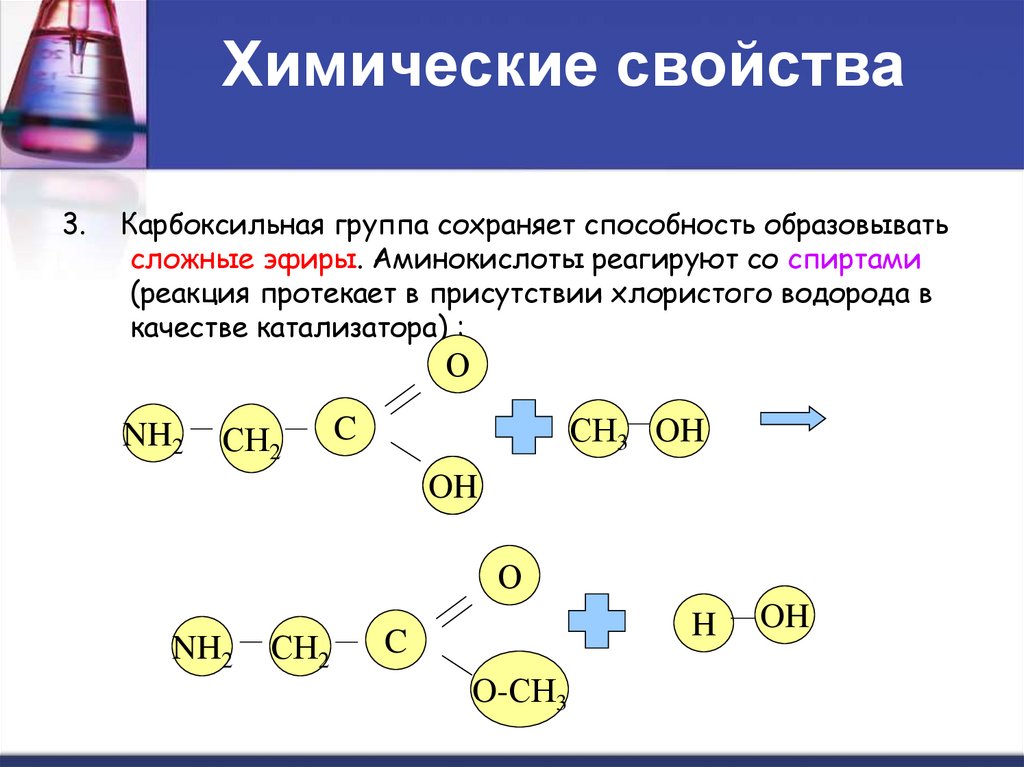
3.Карбоксильная группа сохраняет способность образовывать
сложные эфиры. Аминокислоты реагируют со спиртами
(реакция протекает в присутствии хлористого водорода в
качестве катализатора) :
О
NH2
СН2
СН3 OH
C
OH
H
О
NH2
СН2
H
C
O-СН3
OH
19. Химические свойства
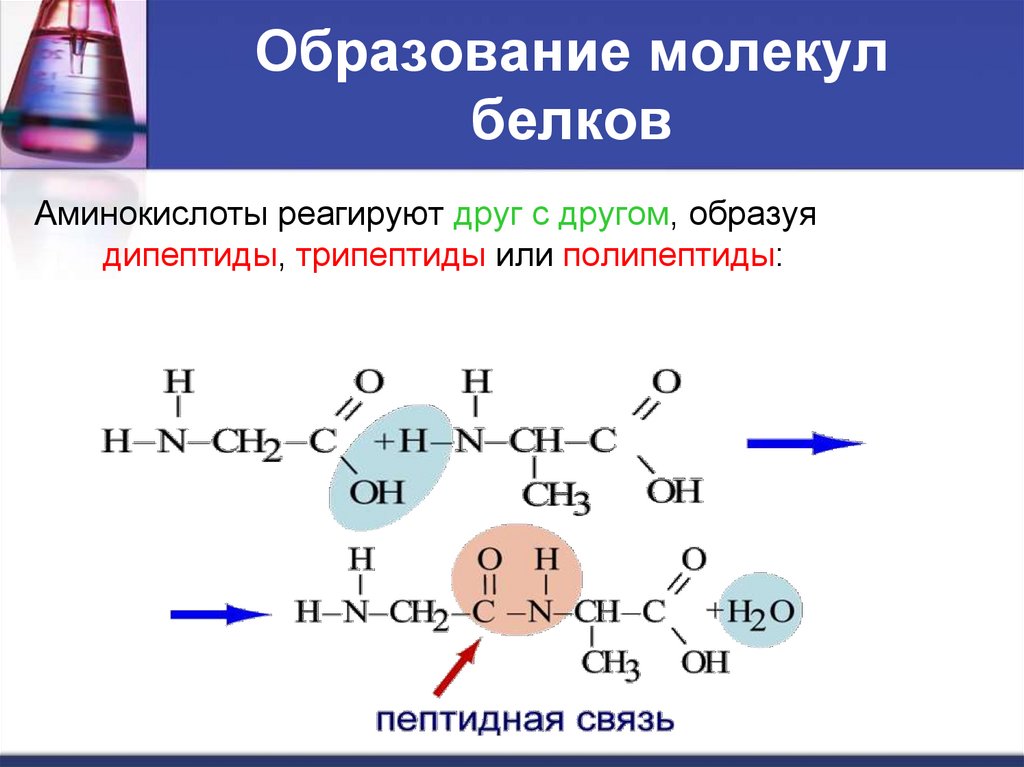
Образование молекулбелков
Аминокислоты реагируют друг с другом, образуя
дипептиды, трипептиды или полипептиды:
20. Образование молекул белков
Образование биполярногоиона
Молекулы аминокислот существуют в виде
внутренних солей, которые образуются за счет
переноса протона от карбоксила к аминогруппе.
21. Образование биполярного иона
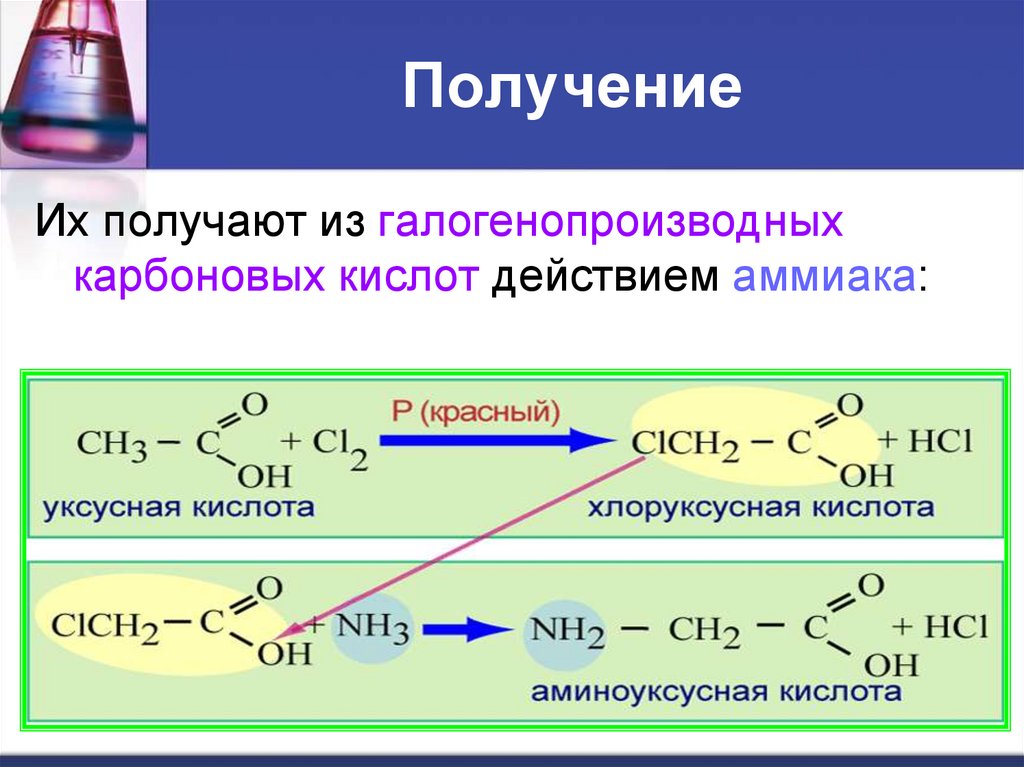
ПолучениеИх получают из галогенопроизводных
карбоновых кислот действием аммиака:
22. Получение
аминокислотв промышленности гидролизом
белков.
Смесь аминокислот обычно получают
кислотным гидролизом белков.
23. Получение аминокислот
Аминокислоты как частьбелков
Белок состоит из 20 аминокислот, они повторяясь
многократно в строгой последовательности, соединенные
между собой пептидными связями, создают первичную
структуру белка.
24. Аминокислоты как часть белков
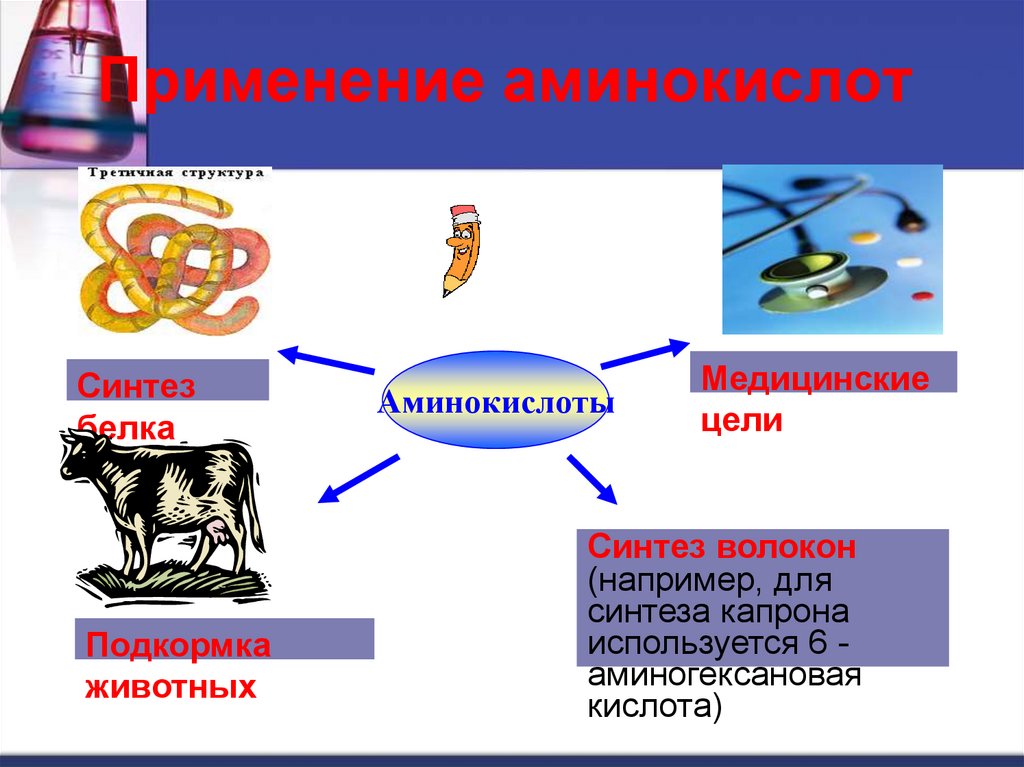
Применение аминокислотСинтез
белка
Подкормка
животных
Аминокислоты
Медицинские
цели
Синтез волокон
(например, для
синтеза капрона
используется 6 аминогексановая
кислота)
25. Применение аминокислот
ЗначениеАминокислоты являются основным "строительным
материалом" для синтеза специфических тканевых белков,
ферментов, пептидных гормонов и других физиологически
активных соединений. Помимо того, что аминокислоты
образуют белки, некоторые из них:
Выполняют роль нейромедиаторов или являются их
предшественниками. Нейромедиаторы - это химические
вещества, передающие нервный импульс с одной нервной
клетки на другую. Таким образом, некоторые аминокислоты
необходимы для нормальной работы головного мозга.
Аминокислоты способствуют тому, что витамины и минералы
адекватно выполняют свои функции.
Некоторые аминокислоты непосредственно снабжают энергией
мышечную ткань.














 chemistry
chemistry








