Similar presentations:
Производные фурана, пиррола, тиофена
1. Химия гетероциклических соединений
ЛЕКЦИЯ 3Производные фурана,
пиррола, тиофена
2.
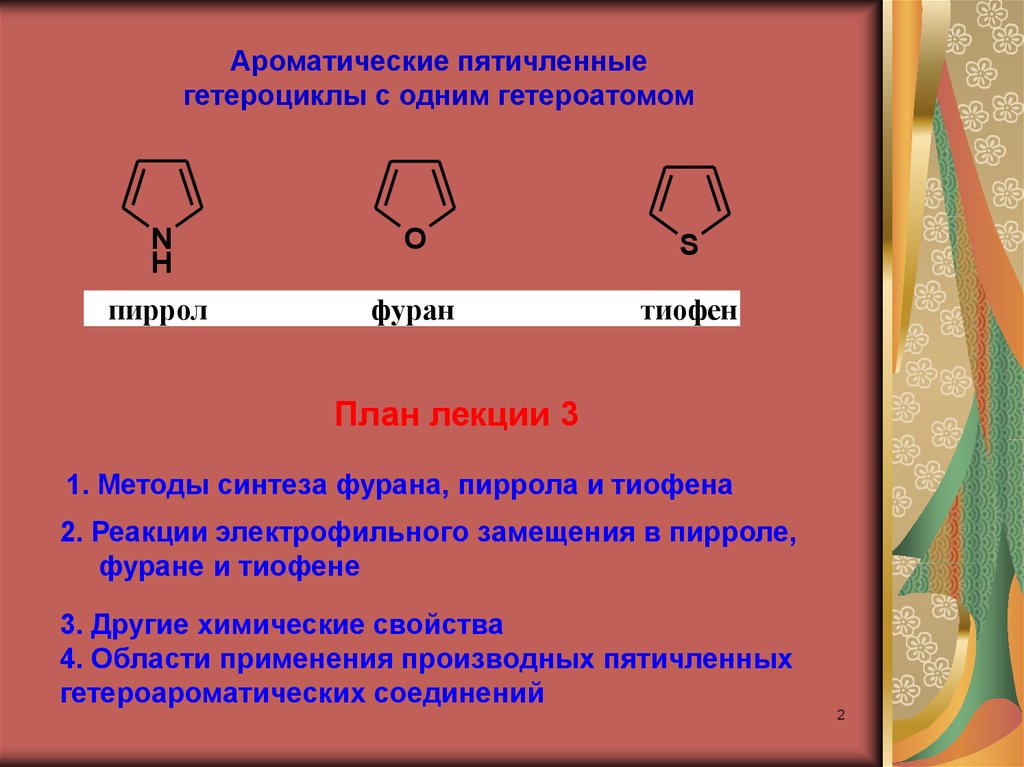
Ароматические пятичленныегетероциклы с одним гетероатомом
N
H
O
S
пиррол
фуран
тиофен
План лекции 3
1. Методы синтеза фурана, пиррола и тиофена
2. Реакции электрофильного замещения в пирроле,
фуране и тиофене
3. Другие химические свойства
4. Области применения производных пятичленных
гетероароматических соединений
2
3.
I. Методы синтеза фурана, пиррола и тиофенаСинтез из 1,4-дикетонов
Cинтез фурана
внутримолекулярной циклизацией дикетона
Вспомните,
что такое
«кето-енольная
таутомерия»
R
3
R
2
H
R
R
4
O O
R
H+
H
3
R
R
2
1
- HOH
R
4
O
R
1
R
3
R
2
R
4
O
O
H
H
1
условная схема
TsOH =
3
4.
Cинтез пирролов из 1,4-дикетонов и аммиака (или амина)R
3
R
2
H
H
R
R
R
4
O O
1
5
R
3
R
R
2
3
R
NH2
- 2 HOH
R
4
R
N
R
5
1
R
2
R
4
OH HO
H
H
N
R
1
условная схема
5
Механизм
4
5.
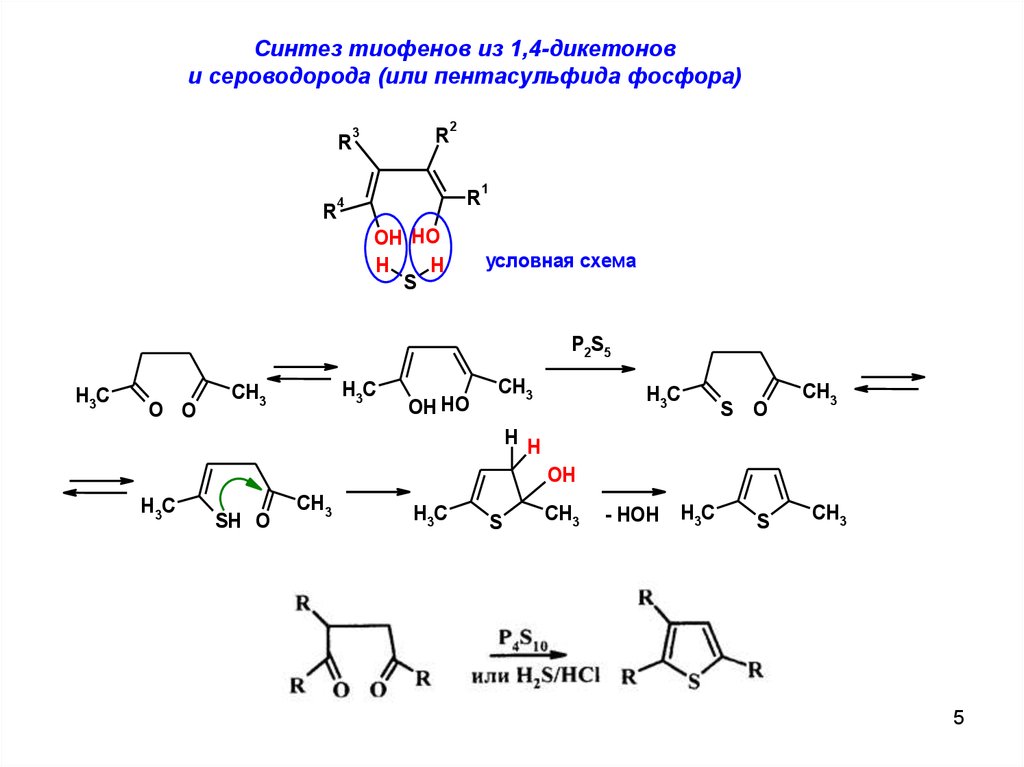
Cинтез тиофенов из 1,4-дикетонови сероводорода (или пентасульфида фосфора)
R
R
3
R
2
R
4
OH HO
H
H
S
1
условная схема
P2S5
H3C
O O
H3C
CH3
OH HO
CH3
H3C
S O
CH3
H H
OH
H3C
SH O
CH3
H3C
S
CH3
- HOH
H3C
S
CH3
5
6.
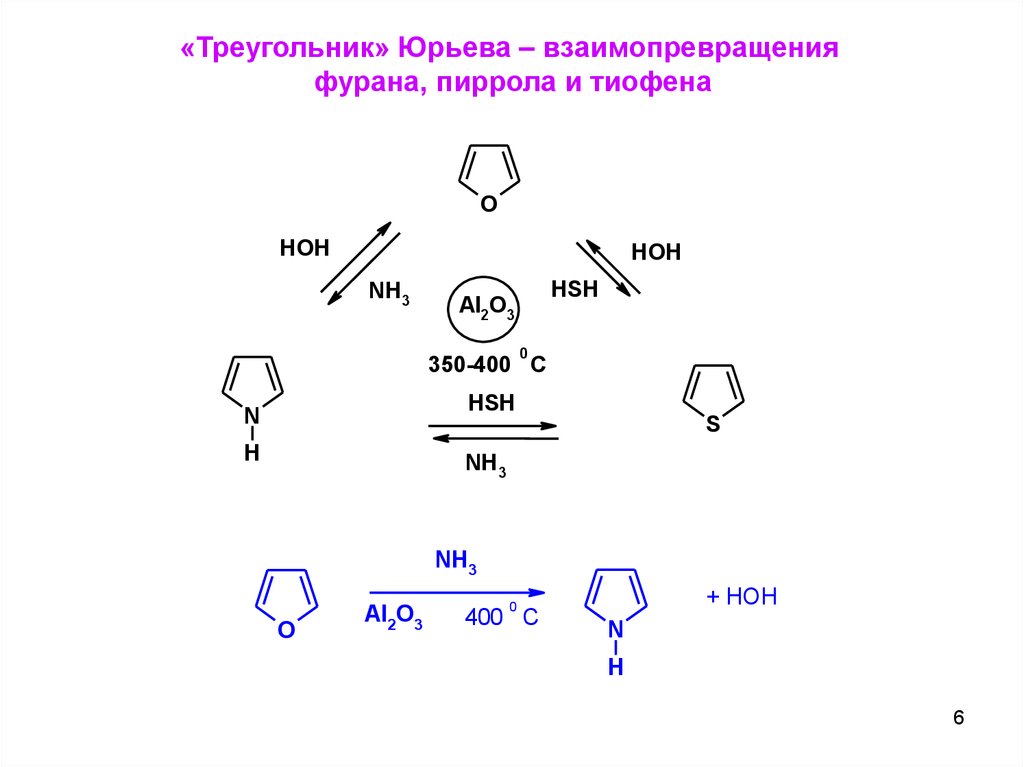
«Треугольник» Юрьева – взаимопревращенияфурана, пиррола и тиофена
O
HOH
HOH
NH3
HSH
Al2O3
0
350-400 C
HSH
N
S
H
NH3
NH3
O
Al2O3
+ HOH
0
400 C
N
H
6
7.
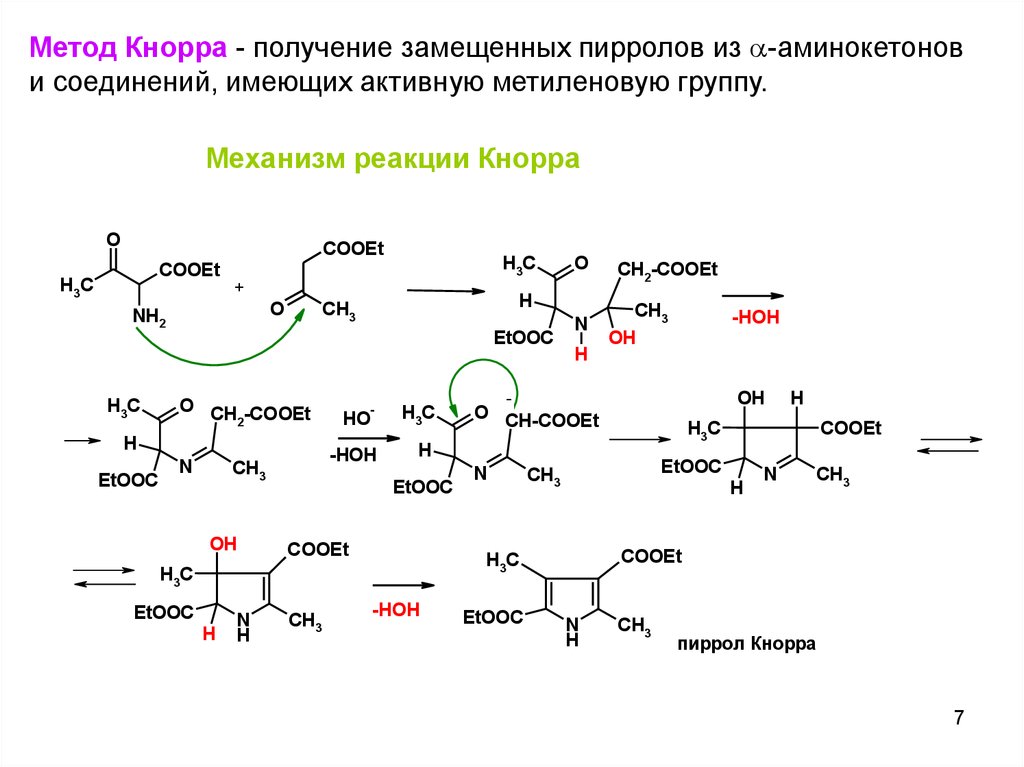
Метод Кнорра - получение замещенных пирролов из -аминокетонови соединений, имеющих активную метиленовую группу.
Механизм реакции Кнорра
O
COOEt
H3C
COOEt
H3C
+
O
NH2
H
CH3
EtOOC
H3C
O CH -COOEt
2
H
EtOOC
N
OH
-
HO
-HOH
CH3
H3C
H
N
H
EtOOC
COOEt
CH3
N
H
CH2-COOEt
CH3
OH
N
OH
EtOOC
H
H3C
COOEt
EtOOC
CH3
H
N
CH3
COOEt
H3C
-HOH
-HOH
O CH-COOEt
H
H3C
EtOOC
O
N
H
CH3
пиррол Кнорра
7
8.
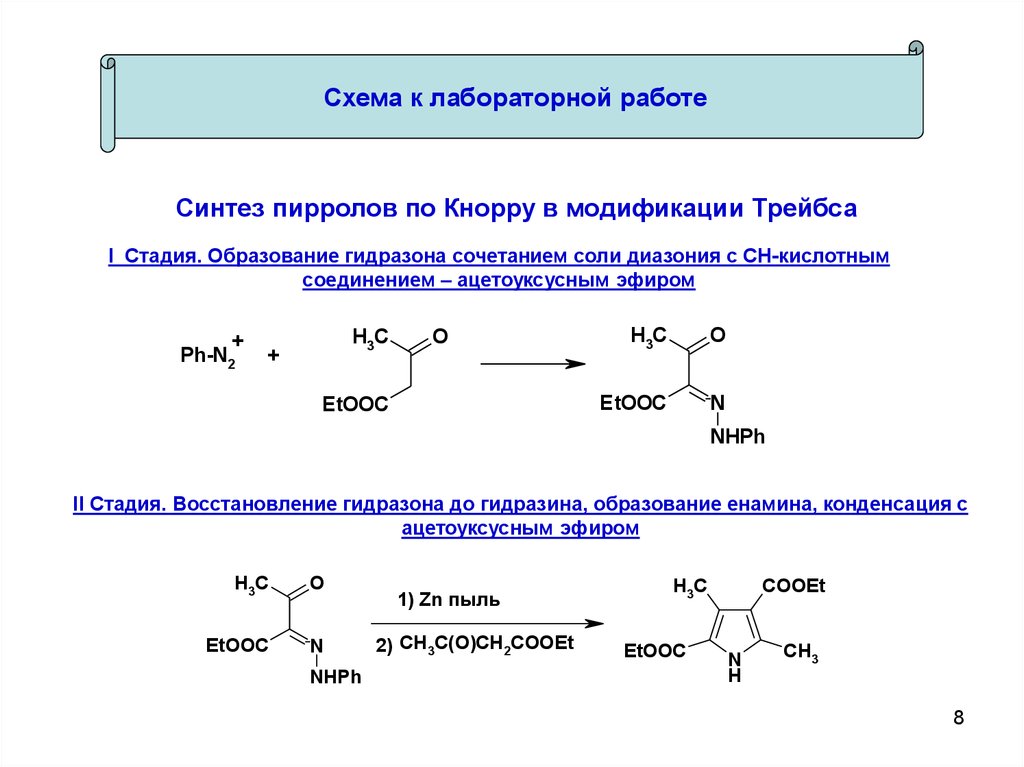
Схема к лабораторной работеСинтез пирролов по Кнорру в модификации Трейбса
I Стадия. Образование гидразона сочетанием соли диазония с СН-кислотным
соединением – ацетоуксусным эфиром
+
Ph-N2
H3C
+
O
EtOOC
H3C
O
EtOOC
N
NHPh
II Стадия. Восстановление гидразона до гидразина, образование енамина, конденсация с
ацетоуксусным эфиром
H3C
O
EtOOC
N
NHPh
1) Zn пыль
2) CH3C(O)CH2COOEt
H3C
EtOOC
COOEt
N
H
CH3
8
9.
Сухая перегонка аммониевой соли слизевой кислотыHO
H4NOOC
OH
+ 4HOH + 2 CO2 + NH3
N
H
COONH4
H
HO
H4NOOC
OH
COONH4
- NH3
H
HO
OH
HOOC
COOH
- 2 HOH
NH3
HOOC
-2 CO2
COOH
N
H
[O]
Перегонка имида янтарной
кислоты с цинковой пылью
выход 40-50%
Zn, t
O
N
H
O
HO
N
H
OH
Пропускание аммиака и паров 1,4-бутиндиола над смесью
оксидов алюминия (95%) и тория (5%) при 300 0С
HOCH2
Конденсация ацетилена с аммиаком
N
H
CH2OH
NH3
- 2HOH
N
H
NH3
2 HC CH
Fe2O3, t
N
H
9
10.
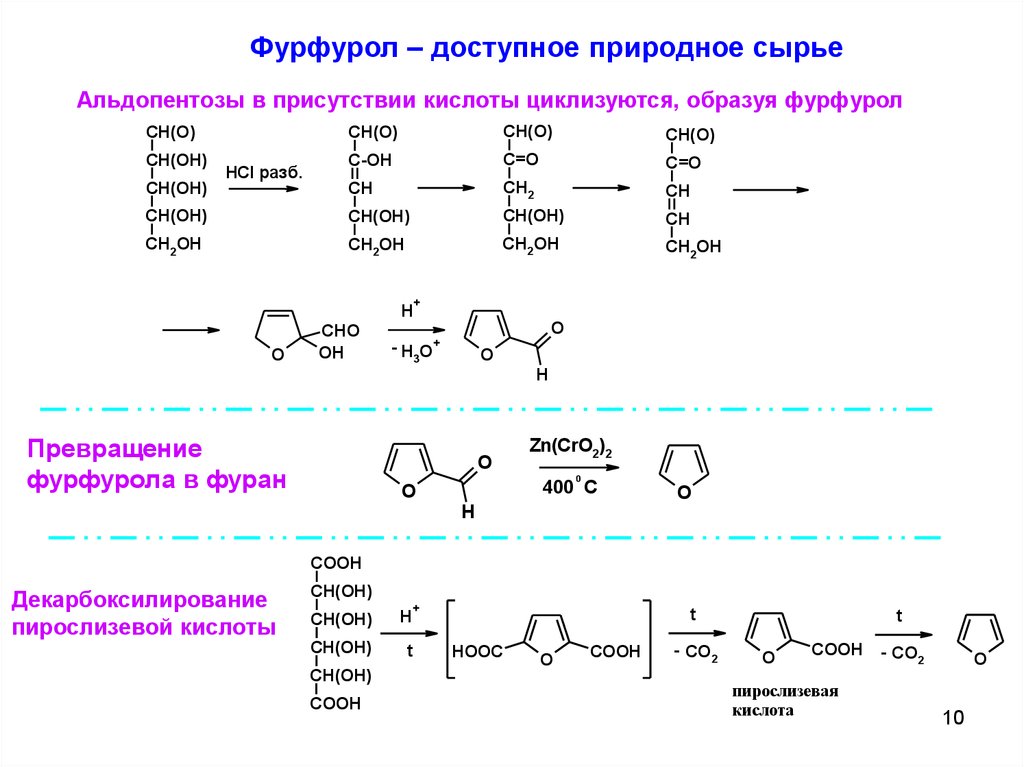
Фурфурол – доступное природное сырьеАльдопентозы в присутствии кислоты циклизуются, образуя фурфурол
CH(O)
CH(O)
CH(O)
C-OH
C=О
C=О
CH
CH2
CH
CH(OH)
CH(OH)
CH(OH)
CH
CH2OH
CH2OH
CH2OH
CH2OH
CH(O)
CH(OH)
CH(OH)
HCl разб.
H
O
CHO
OH
+
O
-H O
3
+
O
H
Превращение
фурфурола в фуран
O
Zn(CrO2)2
0
400 C
O
O
H
COOH
Декарбоксилирование
пирослизевой кислоты
CH(OH)
+
CH(OH)
H
CH(OH)
t
CH(OH)
COOH
t
HOOC
O
COOH
- CO2
t
O
COOH
пирослизевая
кислота
- CO2
O
10
11.
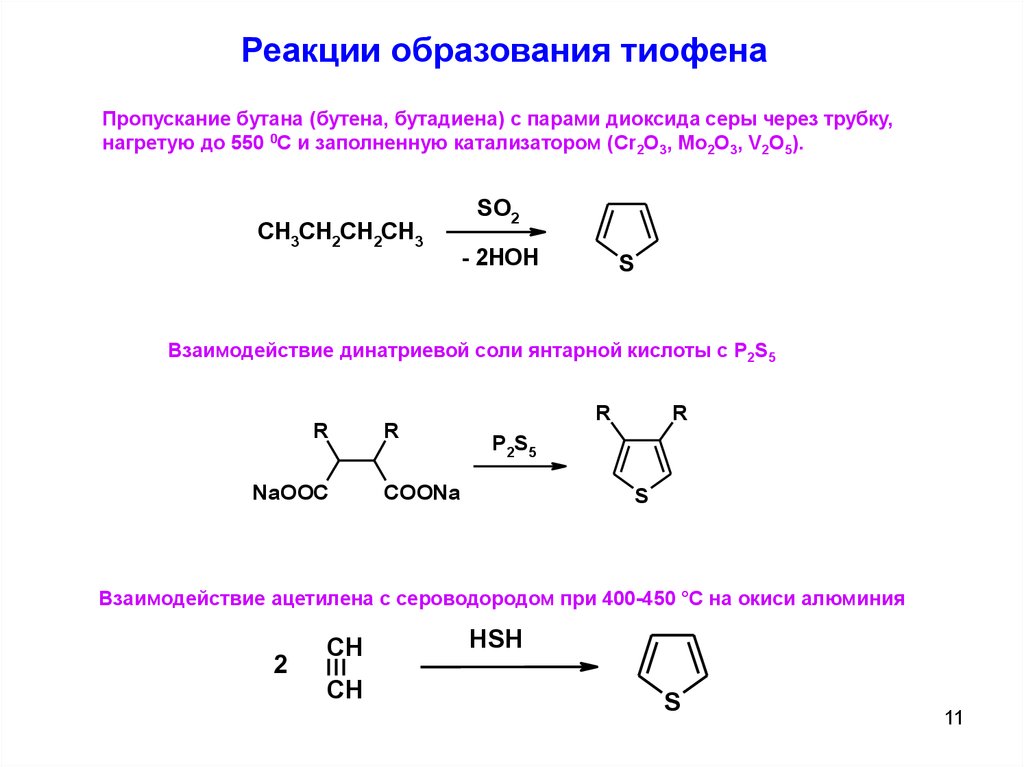
Реакции образования тиофенаПропускание бутана (бутена, бутадиена) с парами диоксида серы через трубку,
нагретую до 550 0С и заполненную катализатором (Cr2O3, Mo2O3, V2O5).
CH3CH2CH2CH3
SO2
- 2HOH
S
Взаимодействие динатриевой соли янтарной кислоты с P2S5
R
NaOOC
R
R
R
P2S5
COONa
S
Взаимодействие ацетилена с сероводородом при 400-450 °С на окиси алюминия
2
CH
CH
HSH
S
11
12.
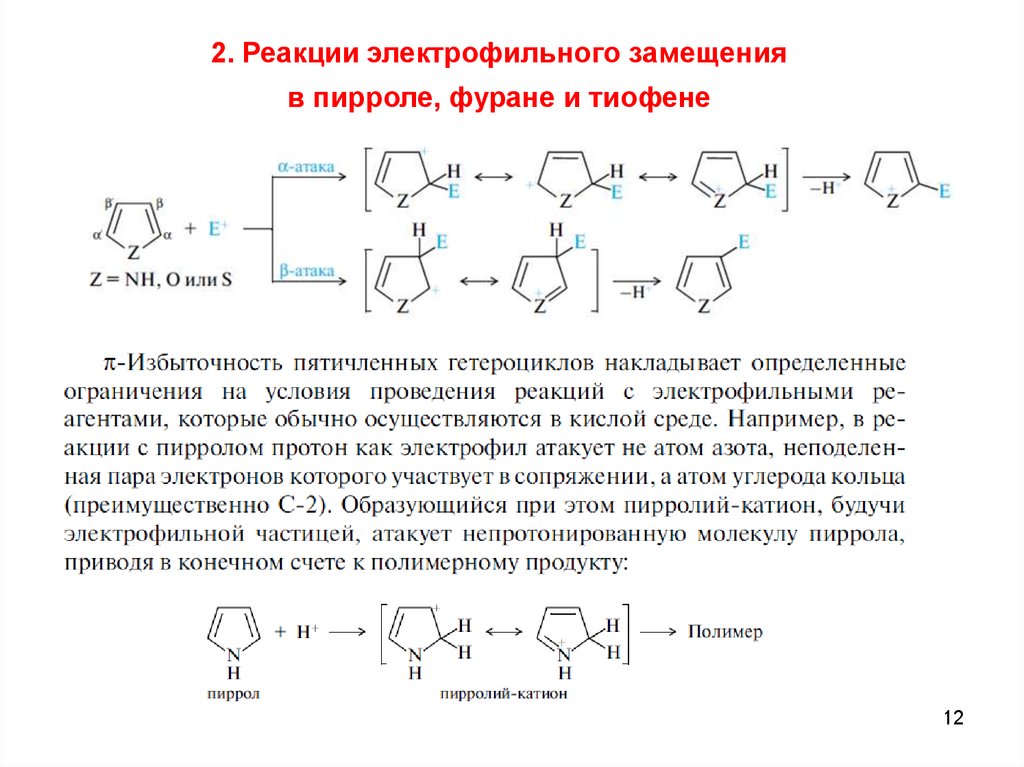
2. Реакции электрофильного замещенияв пирроле, фуране и тиофене
12
13.
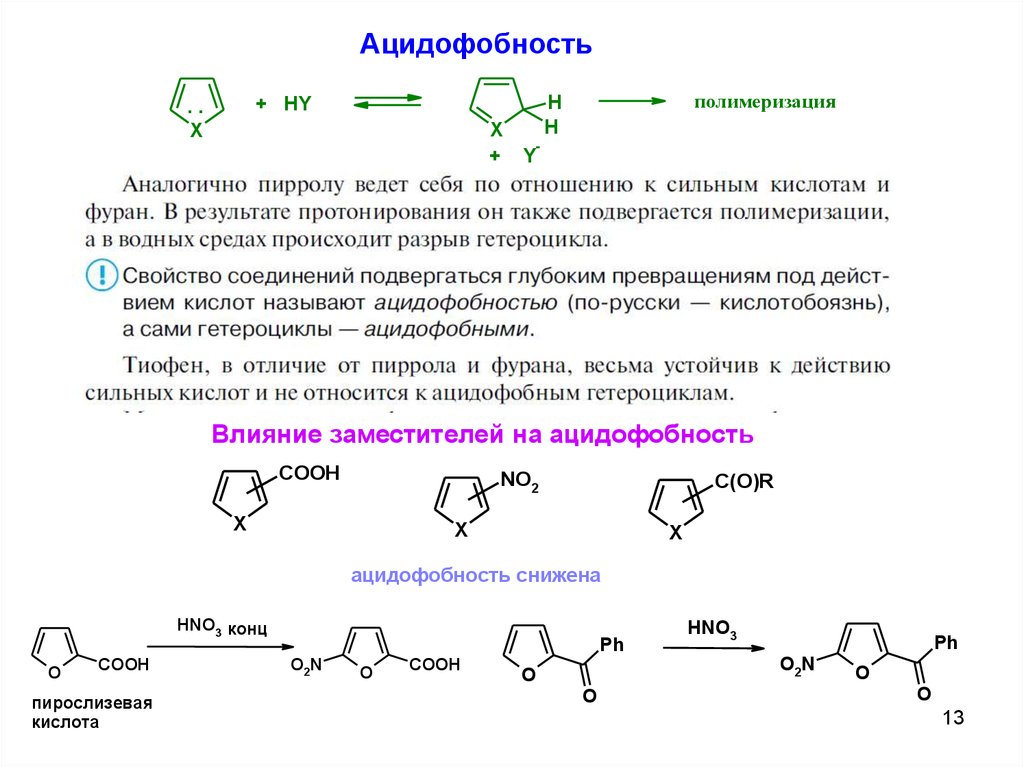
АцидофобностьX
+
полимеризация
H
H
+ HY
..
X
-
Y
Влияние заместителей на ацидофобность
COOH
NO2
X
C(O)R
X
X
ацидофобность снижена
HNO3 конц
O
COOH
пирослизевая
кислота
Ph
O2N
O
COOH
HNO3
Ph
O2N
O
O
O
O
13
14.
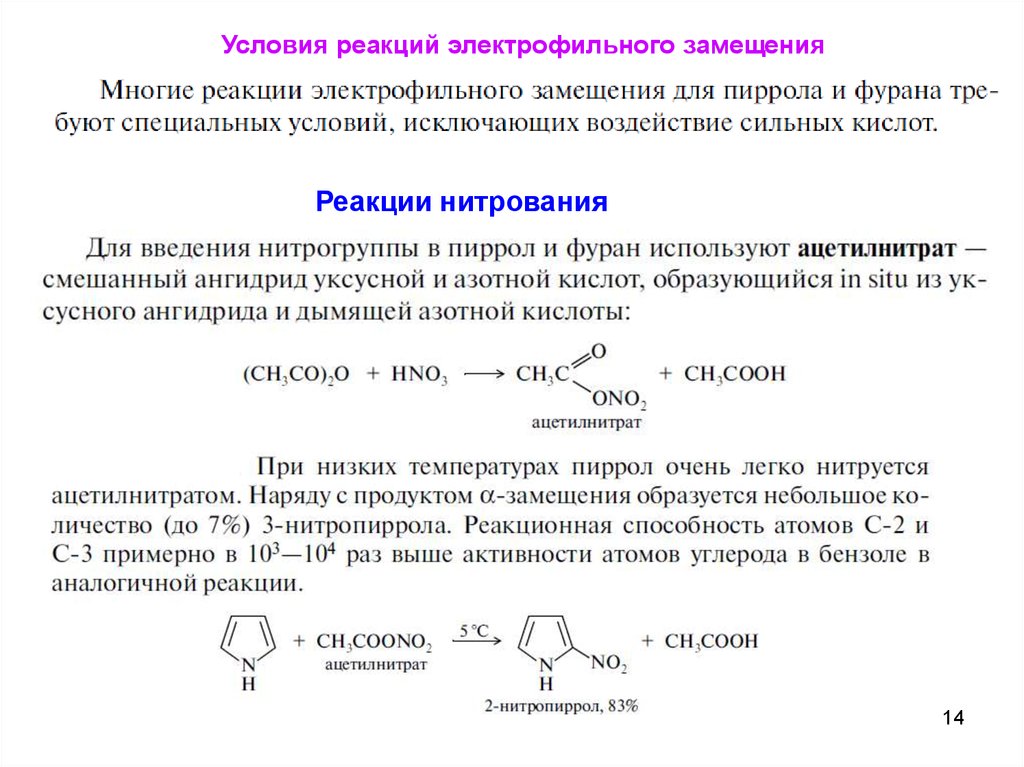
Условия реакций электрофильного замещенияРеакции нитрования
14
15.
Реакции сульфирования+
X
X = NH, O
-
X
+N
SO2-O
+
SO2-O
+N
H
Реакции азосочетания
Ar-N2
N
H
+
N
H
N N Ar
15
16.
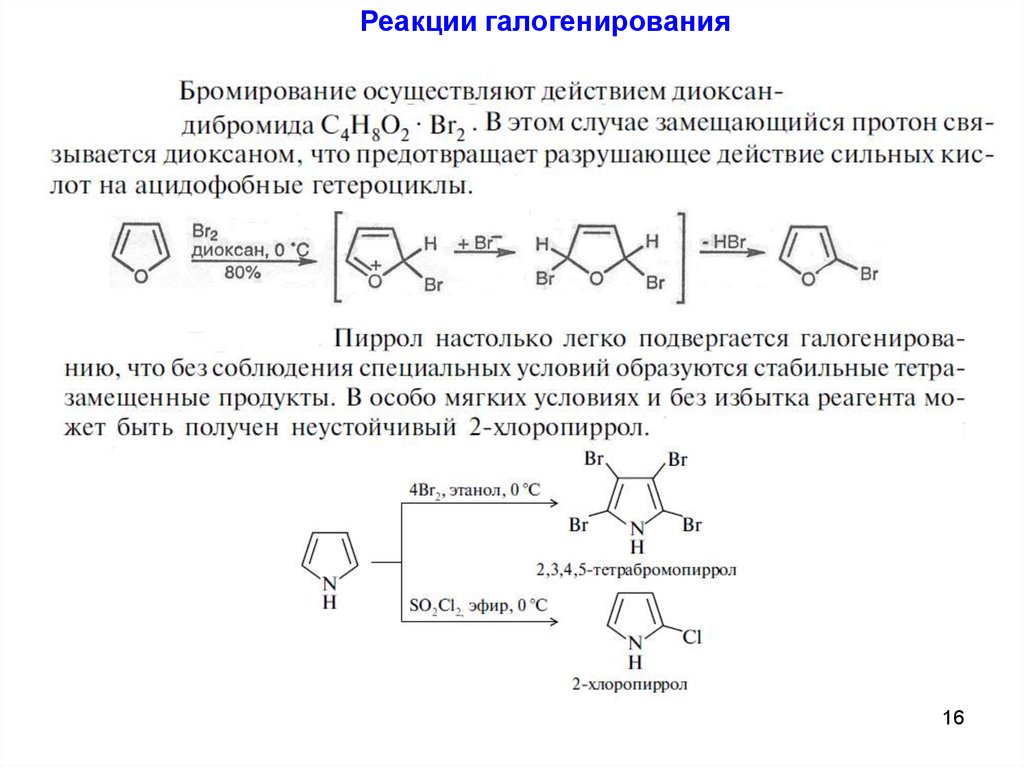
Реакции галогенирования16
17.
Реакции ацилирования и алкилированияКовалентные соли
алкилируются по атому
углерода
RX
N
N
H
MgBr
R
RX
Ионные соли
алкилируются по атому азота
-
N
K
+
R = Alk, Ar, SiMe3
N
R
17
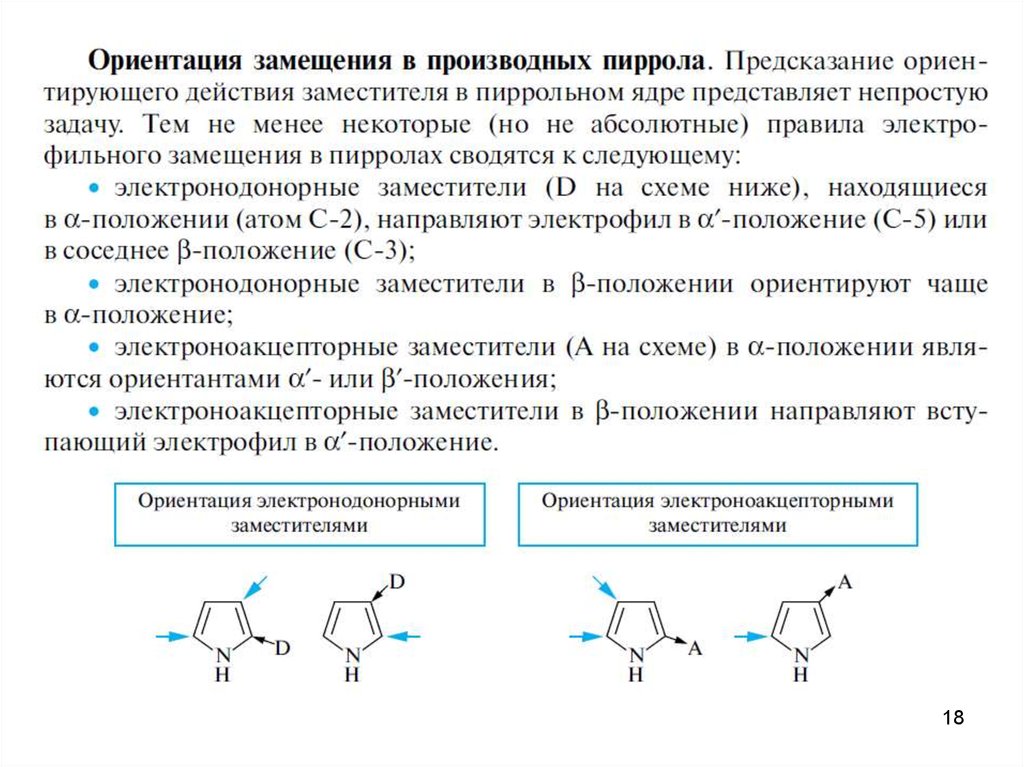
18.
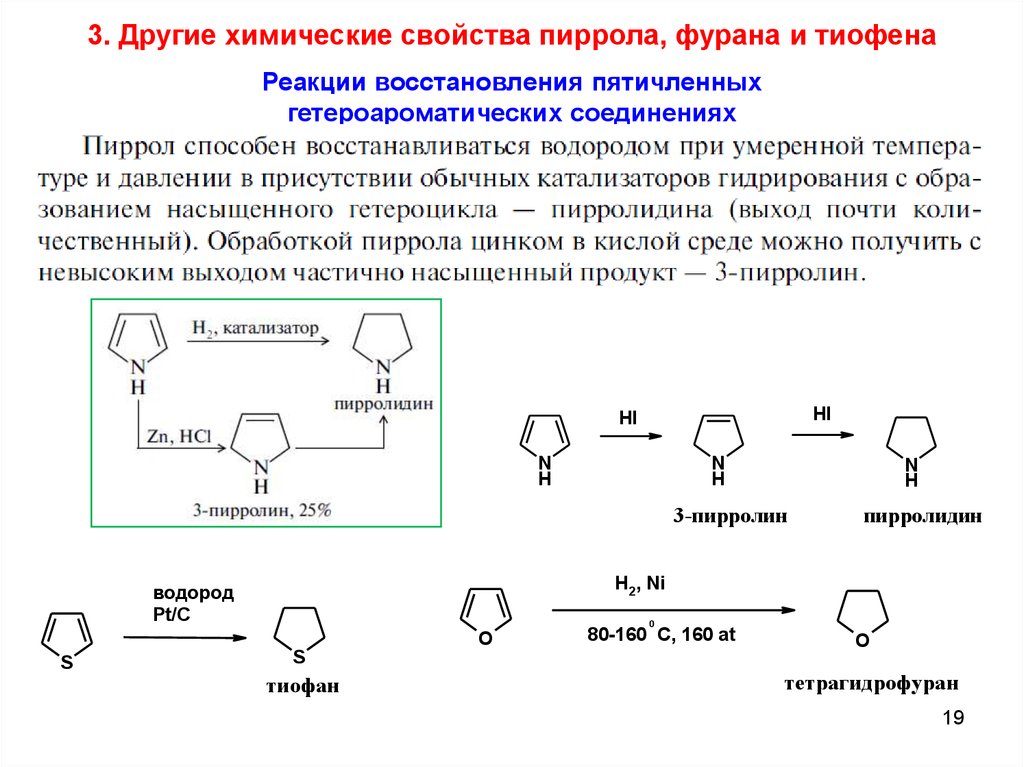
1819.
3. Другие химические свойства пиррола, фурана и тиофенаРеакции восстановления пятичленных
гетероароматических соединениях
HI
HI
N
H
N
H
N
H
3-пирролин
H2, Ni
водород
Pt/C
0
O
S
пирролидин
S
тиофан
80-160 C, 160 at
O
тетрагидрофуран
19
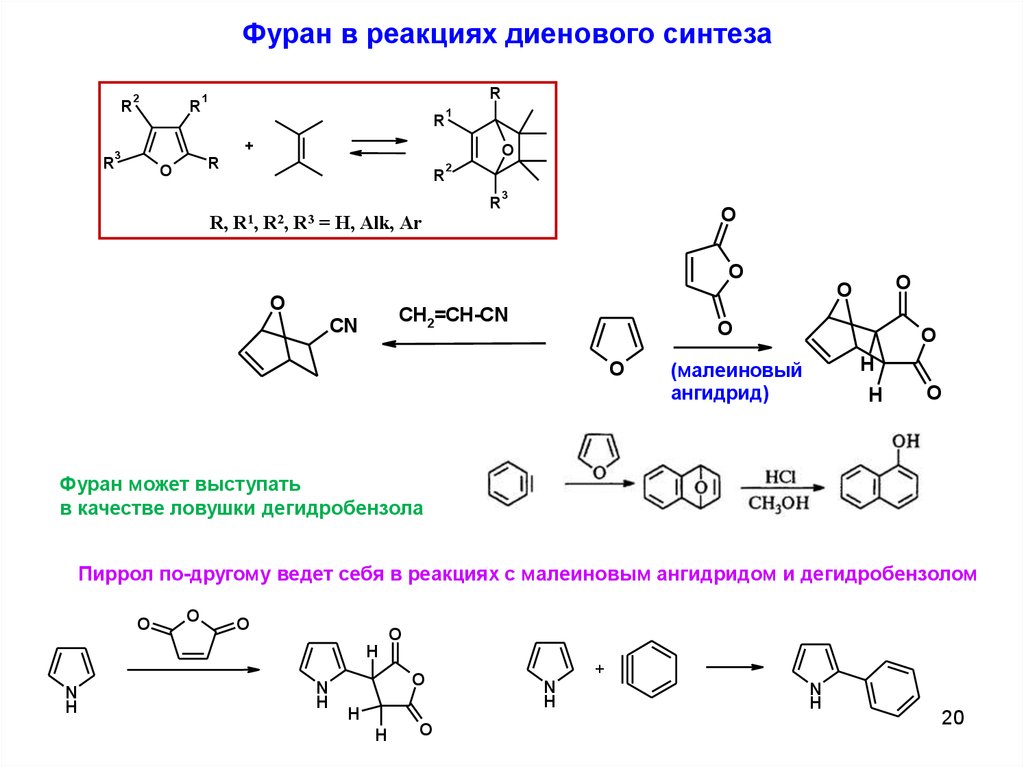
20.
Фуран в реакциях диенового синтезаR
R
2
R
R
1
R
1
+
3
O
R
O
R
R, R1, R2, R3 = H, Alk, Ar
2
R
3
O
O
O
O
O
CH2=CH-CN
CN
O
O
O
H
(малеиновый
ангидрид)
H
O
Фуран может выступать
в качестве ловушки дегидробензола
Пиррол по-другому ведет себя в реакциях с малеиновым ангидридом и дегидробензолом
O
O
O
O
H
N
H
N
H
O
H
H
O
+
N
H
N
H
20
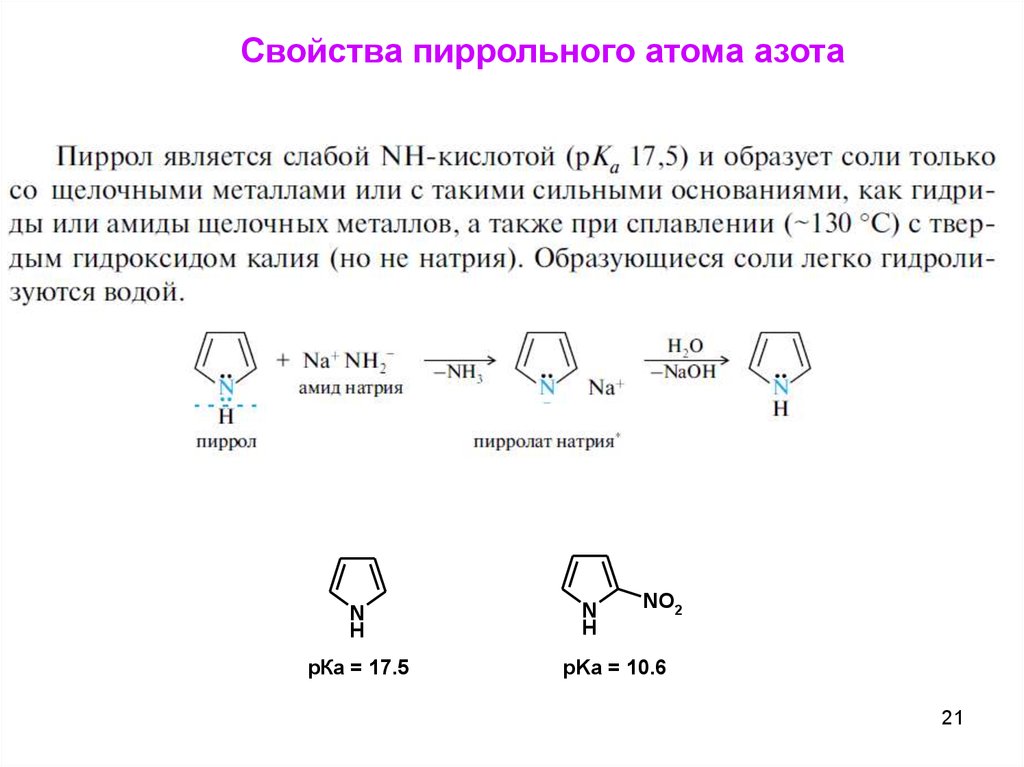
21.
Свойства пиррольного атома азотаN
H
рКа = 17.5
N
H
NO2
pKa = 10.6
21
22.
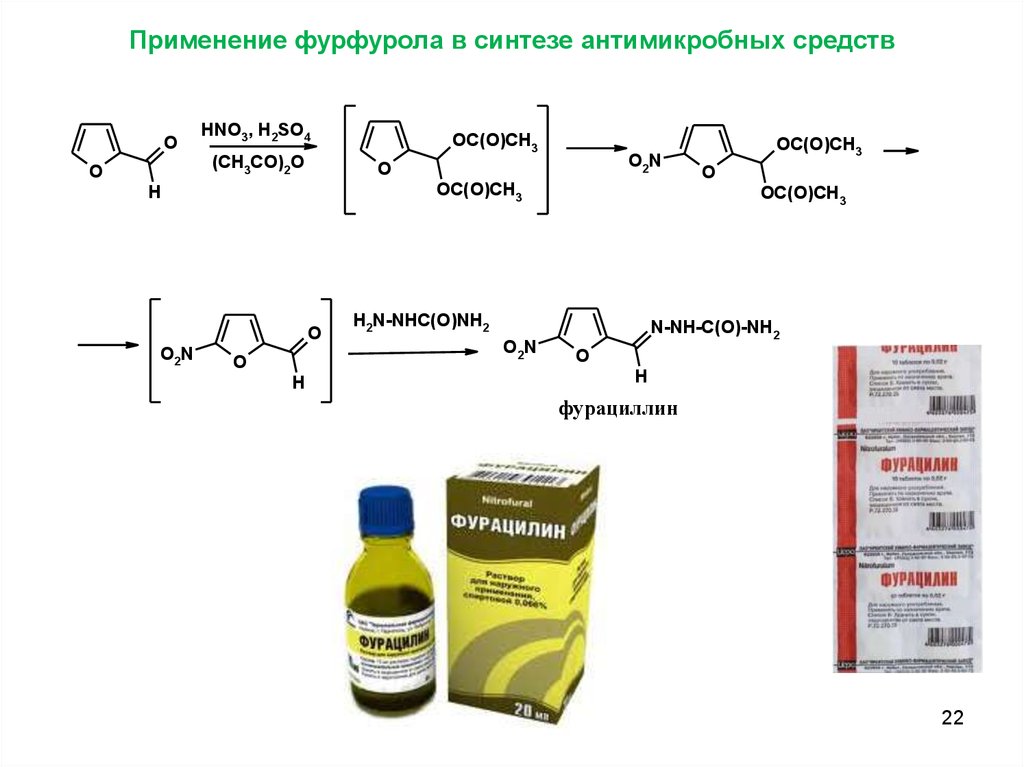
Применение фурфурола в синтезе антимикробных средствO
HNO3, H2SO4
(CH3CO)2O
O
O2N
O
OC(O)CH3
H
O
O2N
OC(O)CH3
O
H
O
OC(O)CH3
H2N-NHC(O)NH2
O2N
OC(O)CH3
N-NH-C(O)-NH2
O
H
фурациллин
22
23.
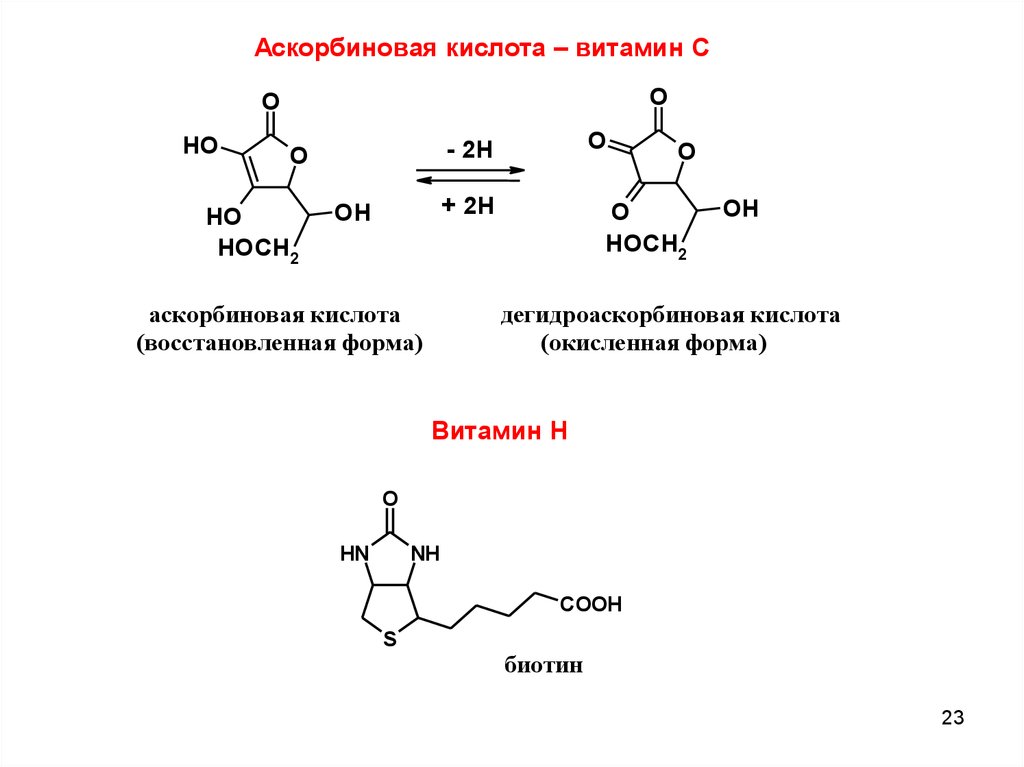
Аскорбиновая кислота – витамин СO
O
HO
HO
HOCH2
O
- 2H
O
+ 2H
OH
аскорбиновая кислота
(восстановленная форма)
O
O
HOCH2
OH
дегидроаскорбиновая кислота
(окисленная форма)
Витамин Н
O
HN
NH
COOH
S
биотин
23
24.
ПОРФИРИНЫ – производные порфинаПорфин-тетрапиррольное макроциклическое соединение, в котором четыре
остатка пиррола поочередно соединены с метиновыми мостиковыми группами.
N
H
N
HN
NH
N
N
N
H
N
Порфин является устойчивой ароматической системой. Плоский макроцикл порфина
представляет собой сопряженную систему из 26 p-электронов (11 двойных связей и 2
неподеленных пары электронов атомов азота). Большая энергия сопряжения (840
кДж/моль) свидетельствует о высокой стабильности порфина.
24
25.
Дипирролилметаны и дипирролилметеныR'
R'
R'
R
+
R
+
H2C=OH
протонированный
формальдегид
N
H
-H+
R
R
N
H
N
H
-
HO
R
CH2OH
N
H
H
+
N
H
OH
CH2O
R
H
+
N
H
дипирролилметан
N
H
R'
R
R
N
H
R
CH2
R'
R
N
H
N
H
ClCH2Cl
HCOOH
FeCl3
O
N
H
K
+
N -
H
N
N
H
дипирролилметен
25
26.
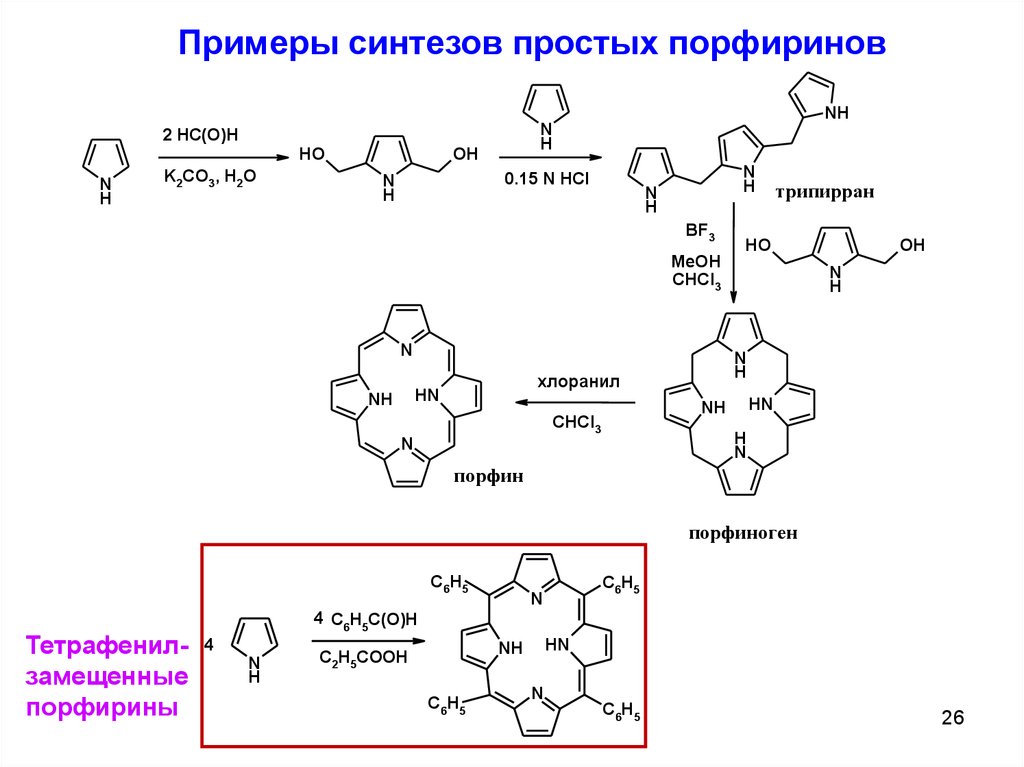
Примеры синтезов простых порфириновHO
N
H
K2CO3, H2O
OH
N
H
NH
N
H
2 HC(O)H
0.15 N HCl
N
H
N
H
BF3
трипирран
HO
MeOH
CHCl3
N
HN
NH
CHCl3
N
N
H
N
H
хлоранил
HN
NH
OH
H
N
порфин
порфиноген
C6H5
Тетрафенилзамещенные
порфирины
C6H5
N
4 C6H5C(O)H
4
N
H
HN
NH
C2H5COOH
C6H5
N
C6H5
26
27.
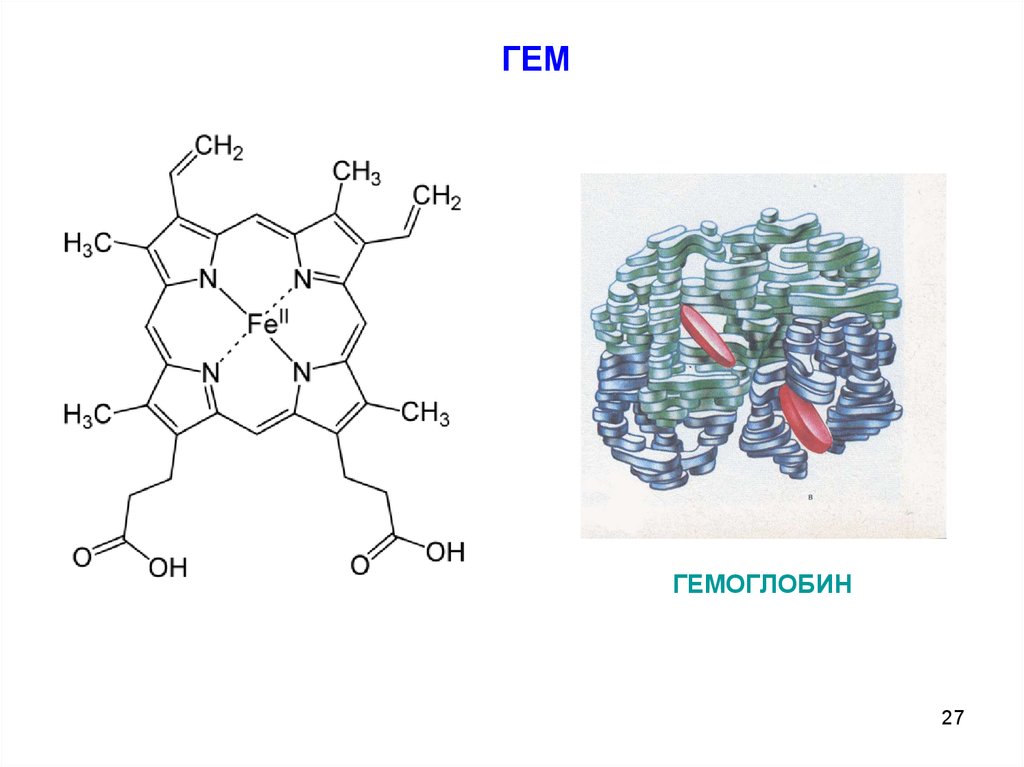
ГЕМГЕМОГЛОБИН
27
28.
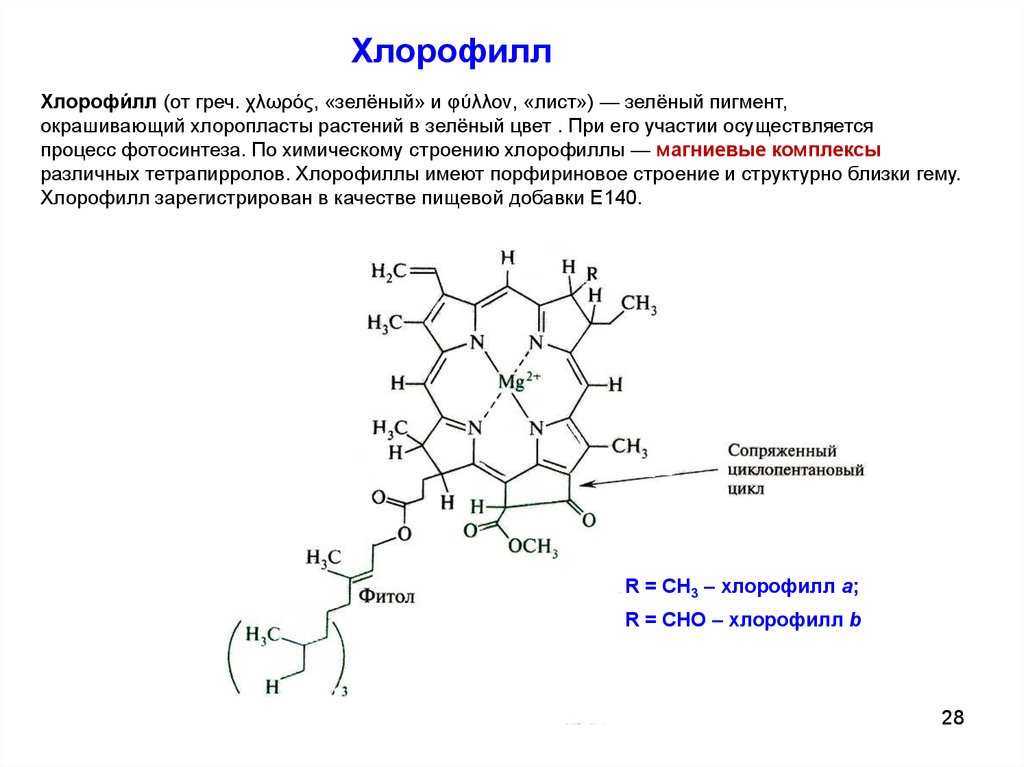
ХлорофиллХлорофи́лл (от греч. χλωρός, «зелёный» и φύλλον, «лист») — зелёный пигмент,
окрашивающий хлоропласты растений в зелёный цвет . При его участии осуществляется
процесс фотосинтеза. По химическому строению хлорофиллы — магниевые комплексы
различных тетрапирролов. Хлорофиллы имеют порфириновое строение и структурно близки гему.
Хлорофилл зарегистрирован в качестве пищевой добавки Е140.
R = CH3 – хлорофилл a;
R = CHO – хлорофилл b
28
29.
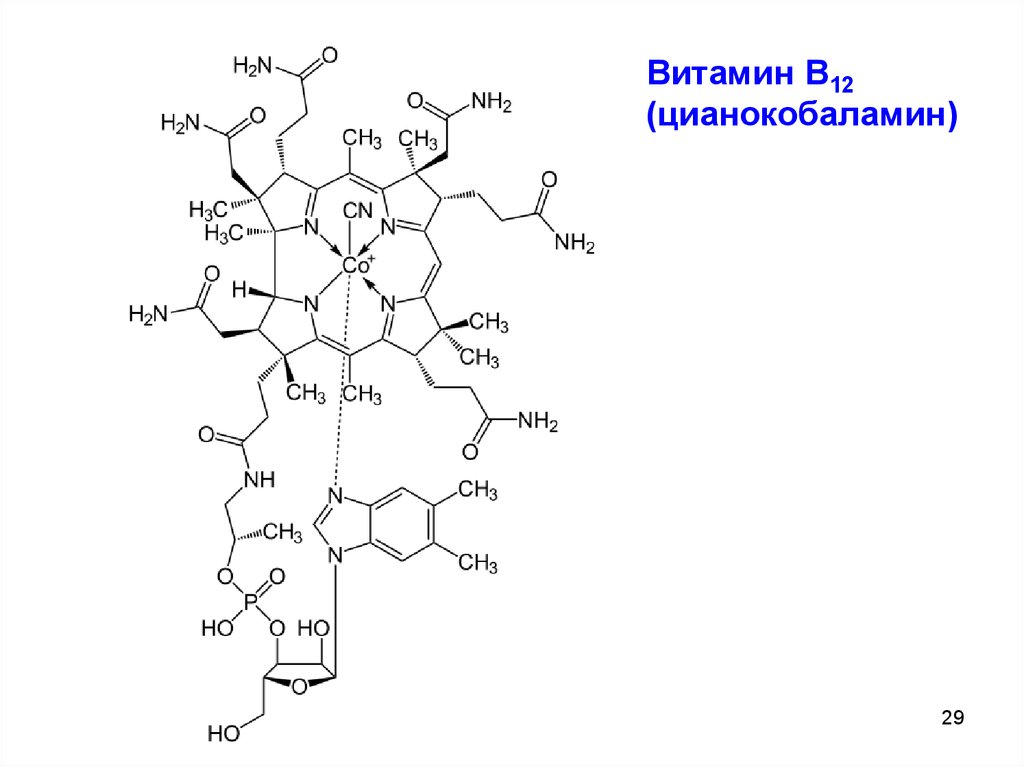
Витамин В12(цианокобаламин)
29
30.
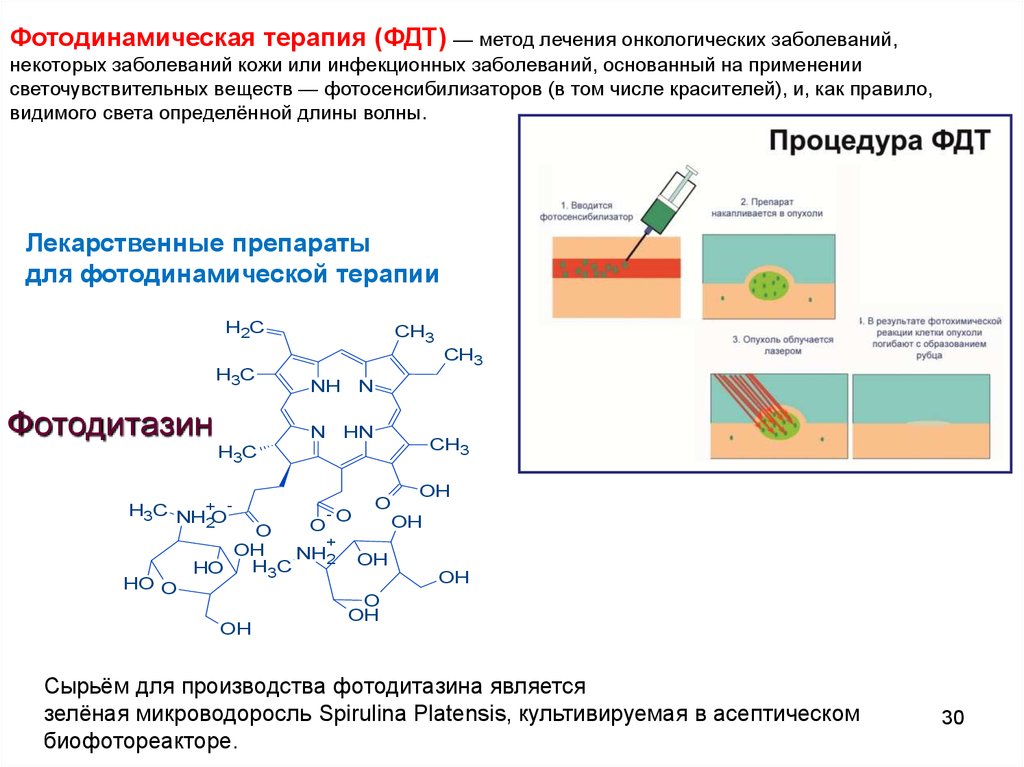
Фотодинамическая терапия (ФДТ) — метод лечения онкологических заболеваний,некоторых заболеваний кожи или инфекционных заболеваний, основанный на применении
светочувствительных веществ — фотосенсибилизаторов (в том числе красителей), и, как правило,
видимого света определённой длины волны.
Лекарственные препараты
для фотодинамической терапии
H2C
H3C
Фотодитазин
CH3
CH3
NH
N
N
HN
CH3
H3C
H3C NH+O2
HO O
O
OH
-O
OH
O
O
+
OH
NH2 OH
H3C
HO
OH
OH
O
OH
Сырьём для производства фотодитазина является
зелёная микроводоросль Spirulina Platensis, культивируемая в асептическом
биофотореакторе.
30
31.
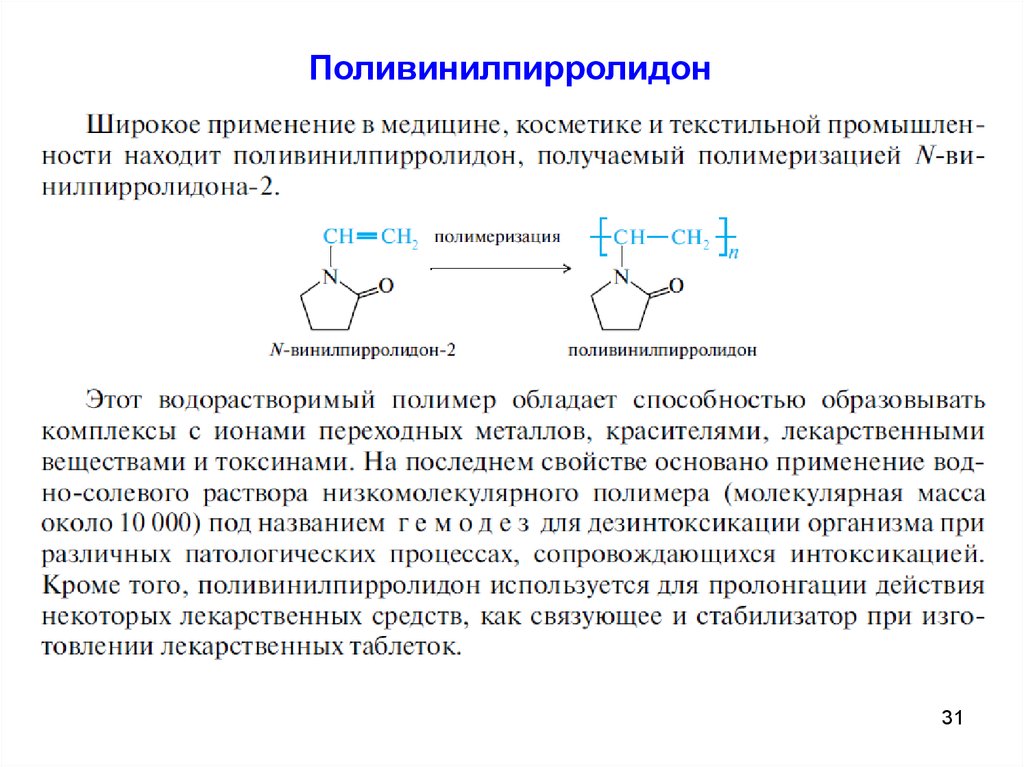
Поливинилпирролидон31
32.
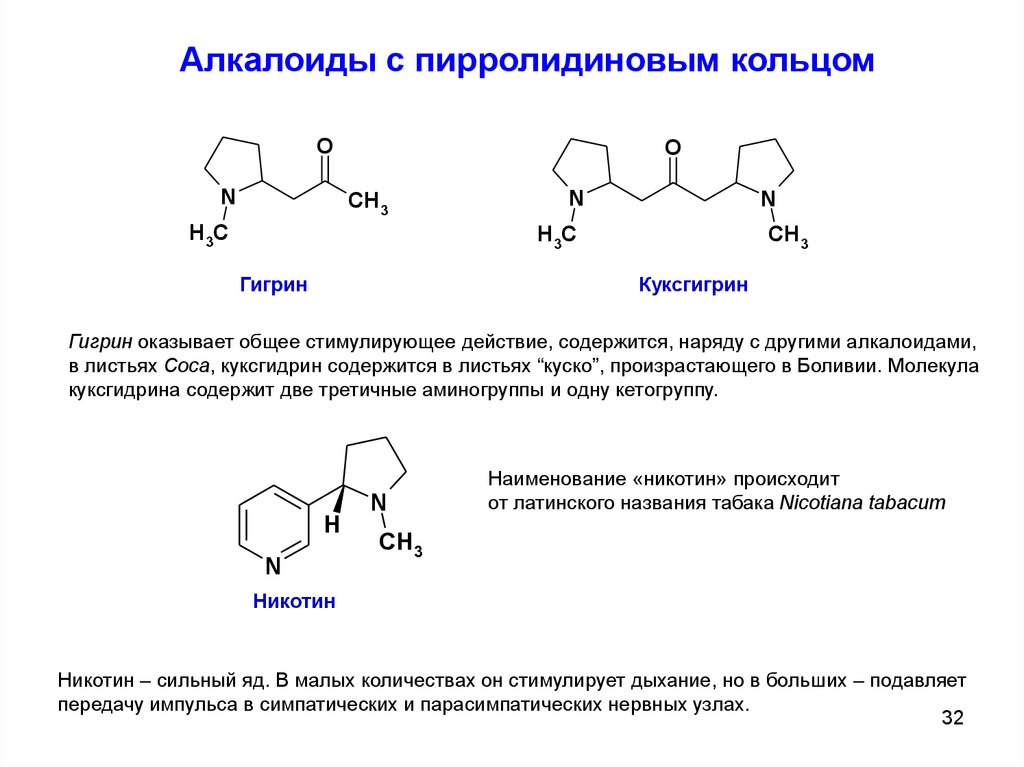
Алкалоиды с пирролидиновым кольцомO
N
O
CH3
H3C
N
N
H3C
Гигрин
CH3
Куксгигрин
Гигрин оказывает общее стимулирующее действие, содержится, наряду с другими алкалоидами,
в листьях Cоса, куксгидрин содержится в листьях “куско”, произрастающего в Боливии. Молекула
куксгидрина содержит две третичные аминогруппы и одну кетогруппу.
N
H
N
Наименование «никотин» происходит
от латинского названия табака Nicotiana tabacum
CH3
Никотин
Никотин – сильный яд. В малых количествах он стимулирует дыхание, но в больших – подавляет
передачу импульса в симпатических и парасимпатических нервных узлах.
32
33.
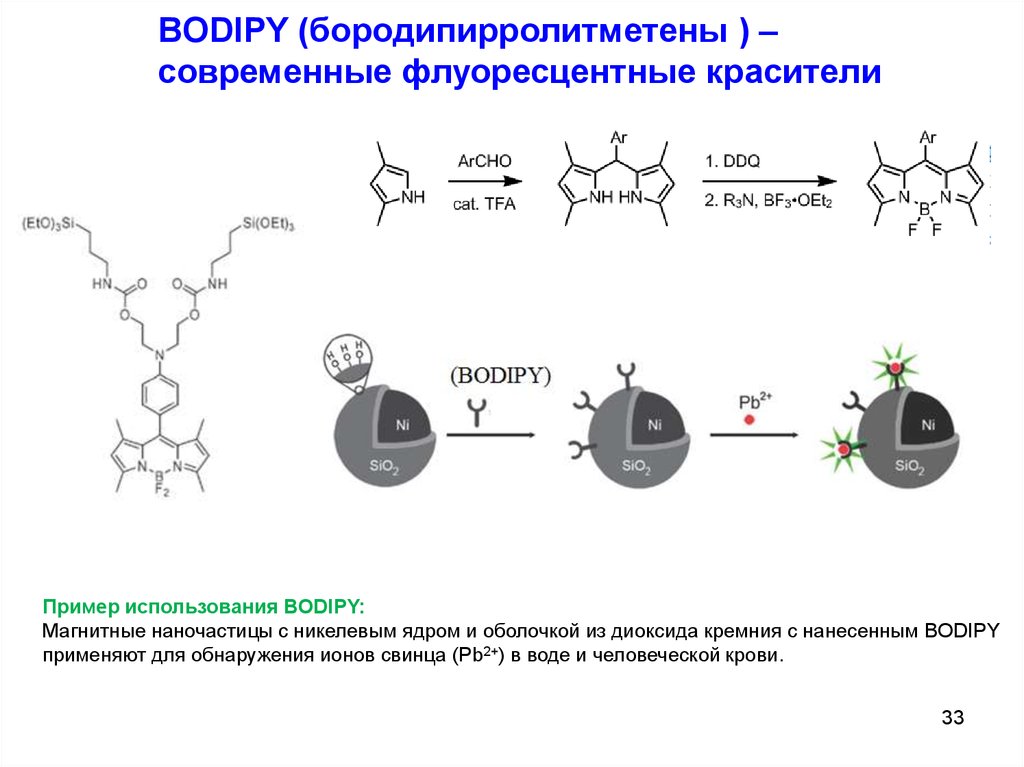
BODIPY (бородипирролитметены ) –современные флуоресцентные красители
Пример использования BODIPY:
Магнитные наночастицы с никелевым ядром и оболочкой из диоксида кремния с нанесенным BODIPY
применяют для обнаружения ионов свинца (Pb2+) в воде и человеческой крови.
33
34.
Красители для солнечных батарейСолнечный свет поступает сквозь электропроводящий стеклянный электрод,
насыщенный красителем, где поглощается. Когда краситель поглощает свет,
один из электронов его молекулы переходит из основного
состояния в возбуждённое состояние. Это явление называется
«фотовозбуждение». Возбуждённый электрон перемещается от красителя
в зону проводимости TiO2. Переход происходит очень быстро; он занимает
только 10−15секунды. В TiO2 электрон диффундирует через TiO2-плёнку,
достигает стеклянного электрода и далее по проводнику стекает во второй
электрод. Молекула красителя с потерей электрона окисляется.
Восстановление молекулы красителя в первоначальное состояние происходит
путём получения электрона от иодид-иона, превращая его в молекулу иода,
которая в свою очередь диффундирует к противоположному электроду,
получает от него электрон и снова становится иодид-ионом. По такому
принципу цветосенсибилизированная солнечная батарея преобразует
солнечную энергию в электрический ток, протекающий по внешнему
проводнику.
34
35.
Курс лекций является частью учебно-методического комплекса«Химия гетероциклических соединений»
автор:
Носова Эмилия Владимировна, д.х.н., доцент кафедры органической химии УГТУ-УПИ –
лектор
Учебно-методический комплекс подготовлен на кафедре органической и биомолеклярной
химии химико-технологического института УрФУ
Никакая часть презентации не может быть воспроизведена в
какой бы то ни было форме без письменного разрешения авторов
35 20










 chemistry
chemistry