Similar presentations:
Гетероароматичность. Пятичленные гетероциклы с одним гетероатомом. (Лекция 2)
1.
Химия биологическиактивных веществ
ЛЕКЦИЯ 2
Гетероароматичность.
Пятичленные гетероциклы
с одним гетероатомом
1
2.
ПЛАН ЛЕКЦИИ1. Строение гетероароматических соединений.
Концепция -избыточности и -дефицитности.
-Амфотерные гетероциклы (азолы).
2. Пятичленные гетероароматические
соединения: фуран, пиррол, тиофен:
- Методы синтеза
- Реакции электрофильного замещения
2
2
3.
Понятие об ароматичностиАроматическими свойствами обладают плоские циклические
полиеновые системы, имеющие непрерывную цепь сопряжений, в
которых число -электронов определяется правилом Хюккеля
Правило Хюккеля: число -электронов = 4n + 2
бензол
катион тропилия
циклопентадиенильный анион
-
+
длина каждой грани 0.140 нм
тиофен
пиррол
S
N
H
O
0.959
0.951
0.962
фуран
циклопентадиен
ароматичность уменьшается в ряду:
тиофен > пиррол > фуран
0.913
соотношение длин связей С(2)-С(3)/С(3)-С(4)
3
4.
Относительная ароматичность карбоциклическихи гетероциклических соединений
Соединение
Бензол
O
16 ккал/моль
80 кДж/моль
Ароматичность, %
100
Тиофен
45
Пиррол
37
Фуран
12
Циклопентадиен
0
Пиридин
82
N
H
22 ккал/моль
29 ккал/моль
110 кДж/моль
120 кДж/моль
S
энергия
сопряжения
повышение ароматических свойств
повышение диеновых свойств
4
5.
-Избыточные гетероциклыX
X = NH, O, S
-избыточные
гетероциклы
-
X
X
+
X
+
X
+
X
+
-
5
6.
-Дефицитные гетероциклы+
N
N
N
-
+
N
-
+
N
-
6
7.
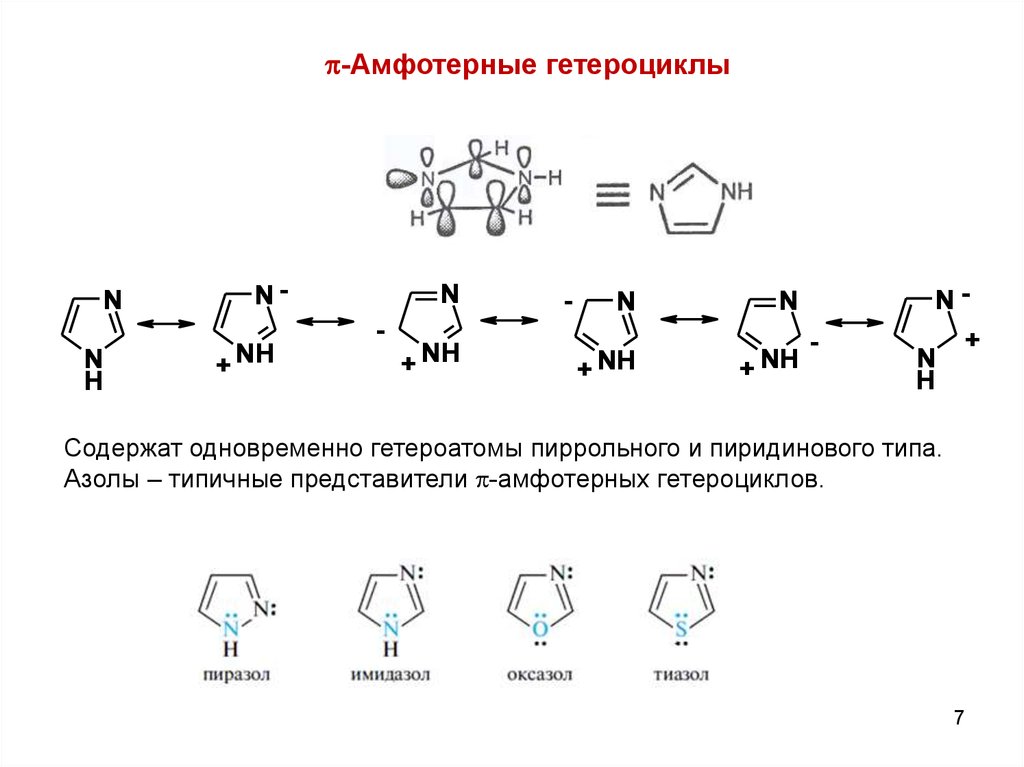
-Амфотерные гетероциклыN
N
H
N+ NH
N
-
+ NH
-
N
N
+ NH
+ NH
-
N+
N
H
Содержат одновременно гетероатомы пиррольного и пиридинового типа.
Азолы – типичные представители -амфотерных гетероциклов.
7
8.
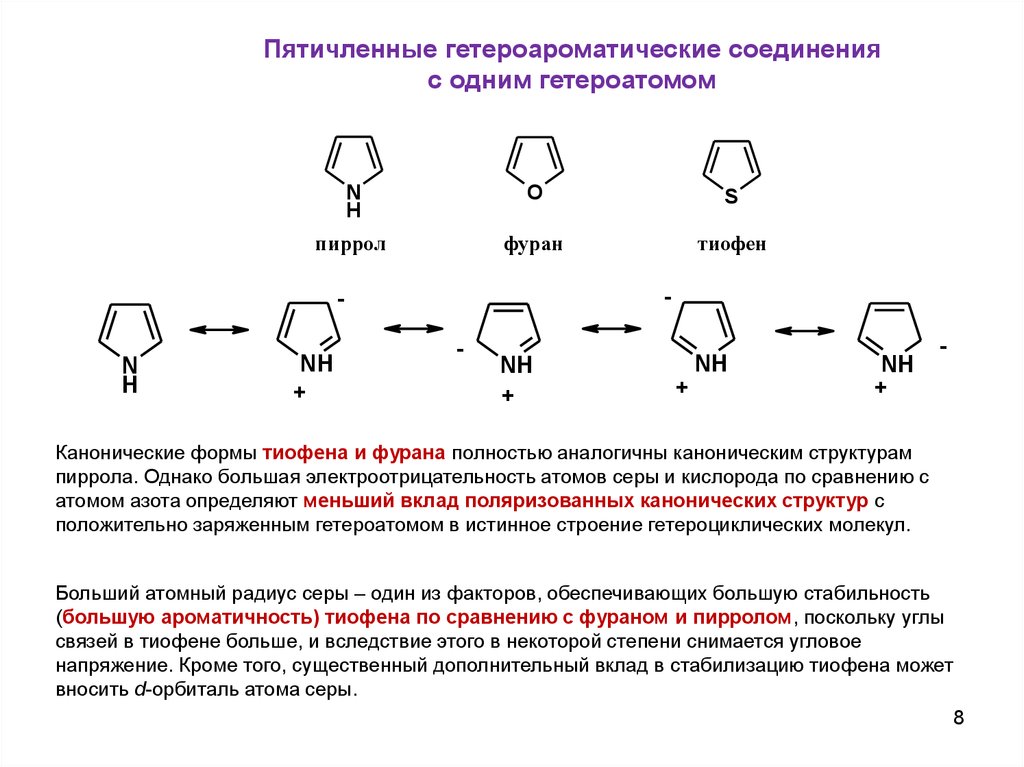
Пятичленные гетероароматические соединенияс одним гетероатомом
N
H
O
S
пиррол
фуран
тиофен
-
N
H
NH
+
-
NH
+
NH
+
NH
+
-
Канонические формы тиофена и фурана полностью аналогичны каноническим структурам
пиррола. Однако большая электроотрицательность атомов серы и кислорода по сравнению с
атомом азота определяют меньший вклад поляризованных канонических структур с
положительно заряженным гетероатомом в истинное строение гетероциклических молекул.
Больший атомный радиус серы – один из факторов, обеспечивающих большую стабильность
(большую ароматичность) тиофена по сравнению с фураном и пирролом, поскольку углы
связей в тиофене больше, и вследствие этого в некоторой степени снимается угловое
напряжение. Кроме того, существенный дополнительный вклад в стабилизацию тиофена может
вносить d-орбиталь атома серы.
8
9.
Методы синтеза фурана, пиррола, тиофенаСинтез Пааля-Кнорра
R
3
R
2
R
H+
H
H
R
4
R
3
R
R
2
3
R
2
H
1
- HOH
R
O O
4
R
O
1
R
R
H
R
4
1
5
R
3
R
NH2
- 2 HOH
R
4
R
N
O O
R
5
P2S5
H3C
O O
H3C
CH3
OH HO
CH3
- HOH
H3C
S
CH3
Реакция Юрьева
O
HOH
пиррол можно синтезировать из фурана:
HOH
NH3
Al2O3
HSH
NH3
HSH
N
H
NH3
O
O
Al2O3
+ HOH
0
450 C
2
N
H
9
1
10.
Специфические методы синтеза пирролаМетод Кнорра
O
CH3-C(O)CH2COOEt
NH2
H3C
- 2 HOH
COOEt
COOEt
H3C
EtOOC
N
H
O
CH2-COOEt
CH3
Механизм реакции Кнорра
O
COOEt
H3C
COOEt
H3C
+
O
NH2
H
CH3
EtOOC
H3C
O CH -COOEt
2
H
EtOOC
N
CH3
OH
-
H3C
-HOH
H
HO
EtOOC
COOEt
H
N
H
CH3
H
-HOH
CH3
OH
-HOH
O CH-COOEt
N
EtOOC
OH
H
H3C
COOEt
EtOOC
CH3
H
N
CH3
COOEt
H3C
H3C
EtOOC
N
N
H
CH3
пиррол Кнорра
10
11.
Применение монооксима a-кетоальдегидав качестве предшественника аминокетона
Сухая перегонка аммониевой соли слизевой кислоты:
COONH4
CH(OH)
CH(OH)
CH(OH)
N
H
+ 4HOH + 2 CO2 + NH3
CH(OH)
COONH4
11
12.
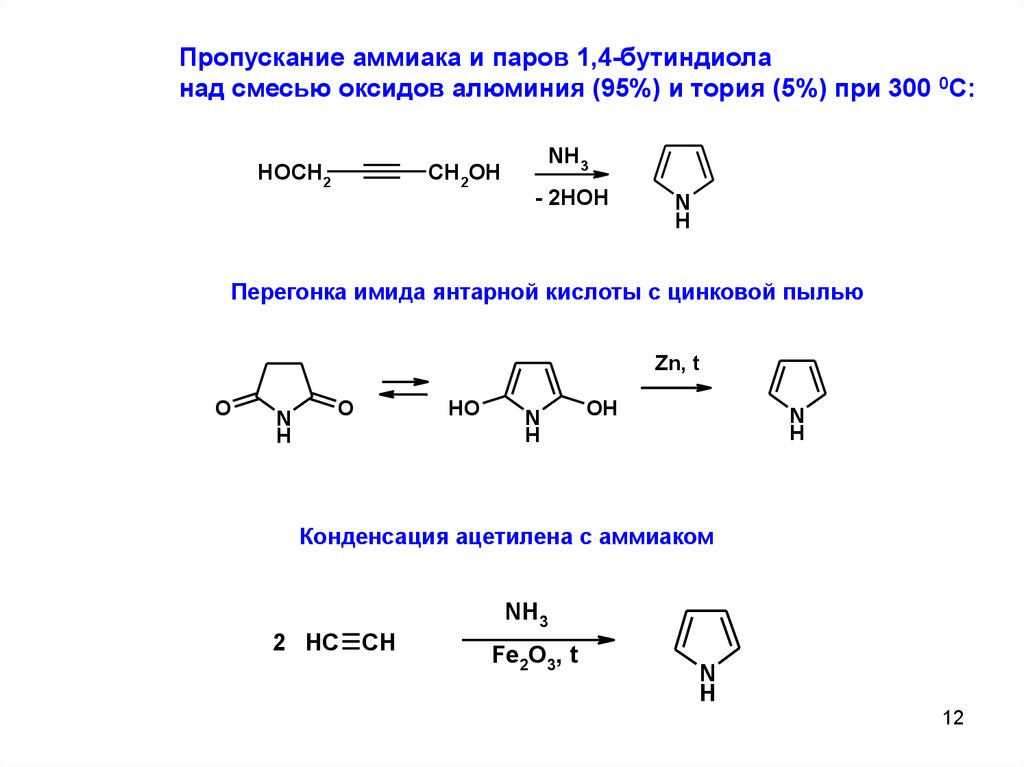
Пропускание аммиака и паров 1,4-бутиндиоланад смесью оксидов алюминия (95%) и тория (5%) при 300 0С:
HOCH2
CH2OH
NH3
- 2HOH
N
H
Перегонка имида янтарной кислоты с цинковой пылью
Zn, t
O
N
H
O
HO
N
H
OH
N
H
Конденсация ацетилена с аммиаком
NH3
2 HC CH
Fe2O3, t
N
H
12
13.
Специфические методы синтеза фуранаФурфурол получают из растительных продуктов, содержащих полисахариды
пентозаны, при обработке их кислотой.
CH(O)
CH(O)
CH(OH)
CH(O)
C-OH
CH(O)
C=О
CH
C=О
CH(OH)
CH2
CH(OH)
CH
CH2OH
CH(OH)
CH2OH
CH
CH2OH
CH2OH
CH(OH)
HCl разб.
H
O
CHO
OH
+
O
- H O+
3
O
H
Образование 5-гидроксиметилфурфурола при обработке фруктозы кислотой
5-Гидроксиметилфурфурол
13
14.
В промышленности фуран получают декарбонилированием фурфуролана цинкхромовом катализаторе:
O
Zn(CrO2)2
0
400 C
O
O
H
Сахарные кислоты циклизуются в присутствии кислоты,
образуя 2-фуранкарбоновую кислоту (пирослизевую кислоту),
декарбоксилированием которой можно получить фуран.
COOH
CH(OH)
+
CH(OH)
H
CH(OH)
t
CH(OH)
COOH
t
HOOC
O
COOH
- CO2
t
O
COOH
- CO2
O
пирослизевая
кислота
14
15.
Специфические методы синтеза тиофенаПропускание бутана (бутена, бутадиена) с парами диоксида серы через трубку,
нагретую до 550 0С и заполненную катализатором (Cr2O3, Mo2O3, V2O5)
CH3CH2CH2CH3
SO2
- 2HOH
S
Взаимодействие ацетилена с сероводородом при 400-450 °С на окиси алюминия
HSH
CH
2
CH
S
Реакция эфиров тиогликолевой кислоты с 1,3-дикарбонильными соединениями
O
O
R'
R''
HSCH2COOMe
R'
-2 HOH
R'
R'
R''
S
COOMe
Метод Хинсберга включает две последовательно протекающие конденсации
1,2-дикарбонильного соединения с диэтилтиодиацетатом
R
R
t-BuOK
+
O
O
MeOOC
S
R
R
0
R
R
Cu, 300 C
COOMe
MeOOC
S
COOH
MeOOC
S
15
16.
Реакции электрофильного замещенияв пирроле, фуране и тиофене
Интермедиат, образующийся при присоединении электрофила в a-положение стабильнее,
чем интермедиат, образующийся при присоединении электрофила в b-положение
При взаимодействии фурана и пиррола с кислотой происходит осмоление
(полимеризация). Ацидофобность (кислотобоязнь) этих соединений связана с
присоединением протона, в большинстве случаев к a-углеродному атому,
приводящим к нарушению циклической сопряженной системы и дальнейшим
превращениям возникшей активной диеновой системы.
..
X
H
H
+ HY
+
X
-
Y
полимеризация
16
17.
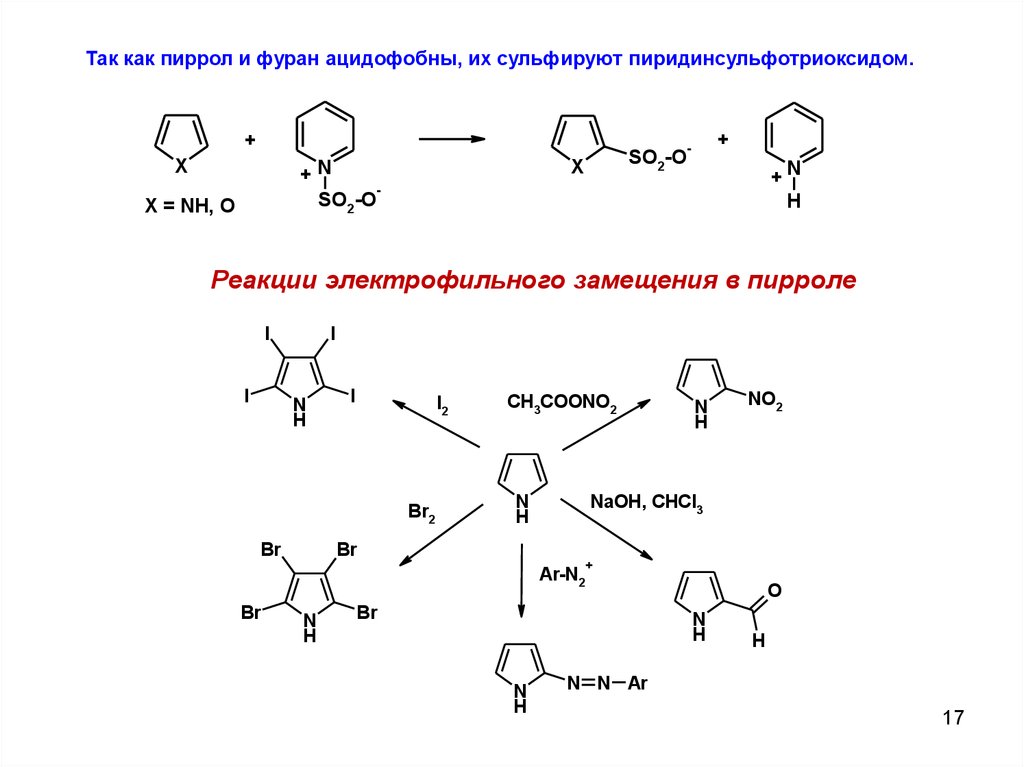
Так как пиррол и фуран ацидофобны, их сульфируют пиридинсульфотриоксидом.+
+
-
X
X = NH, O
SO2-O
X
+N
SO2-O
+N
H
Реакции электрофильного замещения в пирроле
I
I
I
N
H
I
I2
Br2
Br
CH3COONO2
N
H
NO2
NaOH, CHCl3
Br
Ar-N2
Br
N
H
N
H
+
Br
O
N
H
N
H
H
N N Ar
17
18.
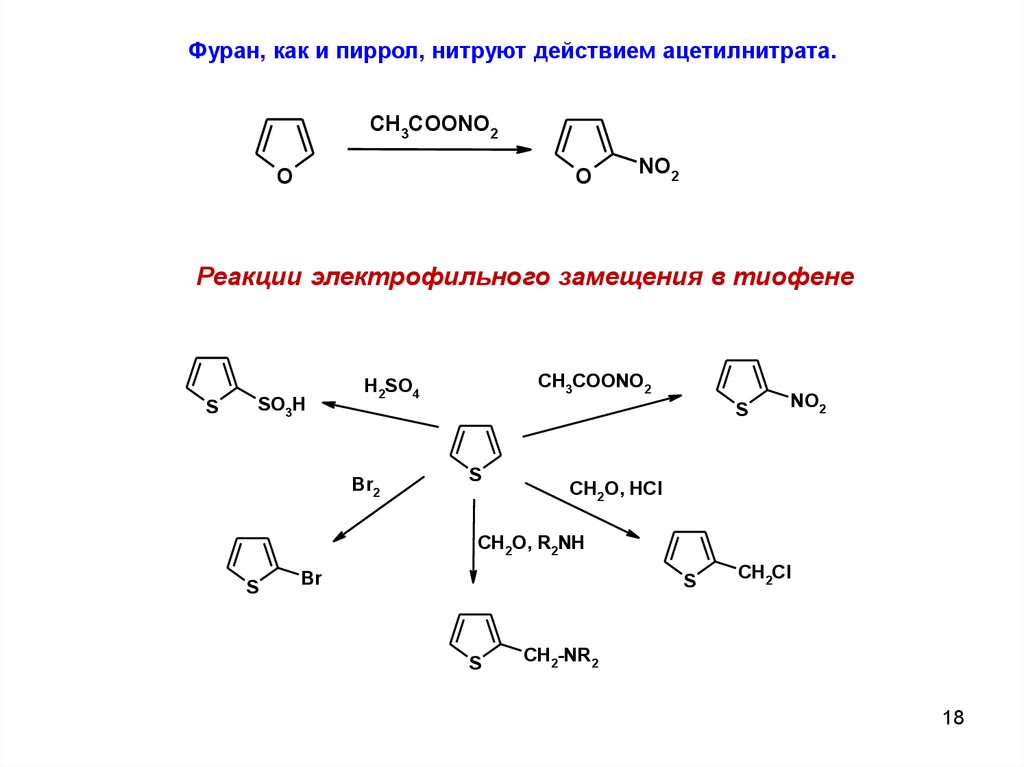
Фуран, как и пиррол, нитруют действием ацетилнитрата.CH3COONO2
O
O
NO2
Реакции электрофильного замещения в тиофене
S
SO3H
CH3COONO2
H2SO4
S
Br2
S
NO2
CH2O, HCl
CH2O, R2NH
S
Br
S
S
CH2Cl
CH2-NR2
18
19.
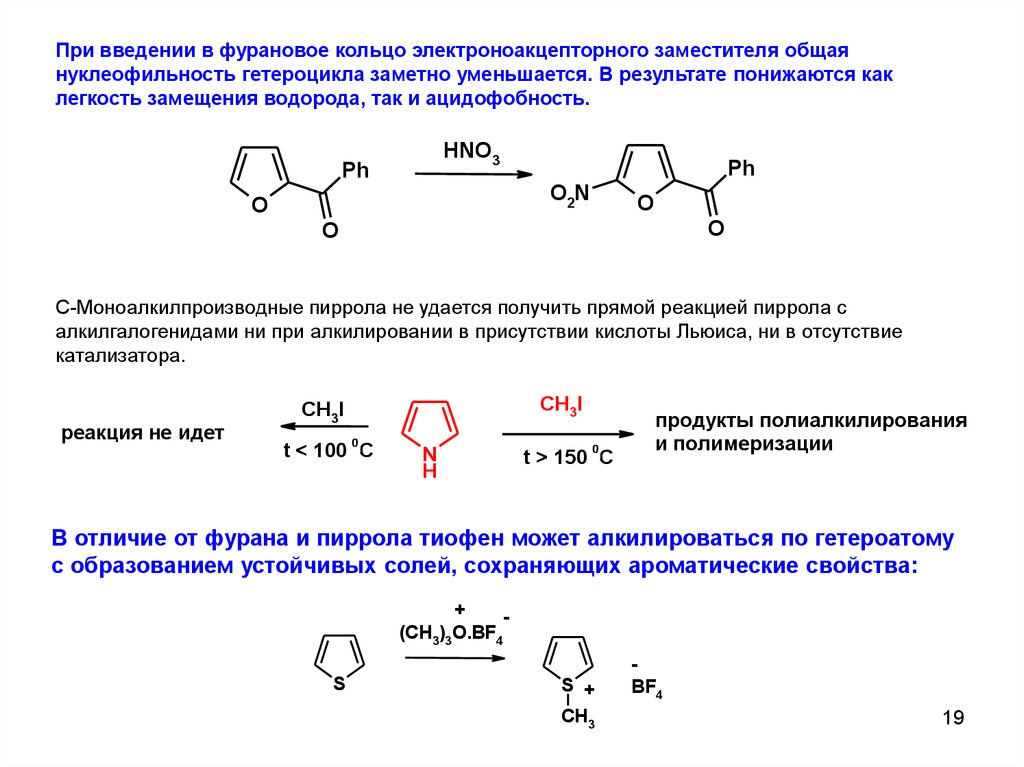
При введении в фурановое кольцо электроноакцепторного заместителя общаянуклеофильность гетероцикла заметно уменьшается. В результате понижаются как
легкость замещения водорода, так и ацидофобность.
HNO3
Ph
Ph
O2N
O
O
O
O
C-Моноалкилпроизводные пиррола не удается получить прямой реакцией пиррола с
алкилгалогенидами ни при алкилировании в присутствии кислоты Льюиса, ни в отсутствие
катализатора.
реакция не идет
CH3I
CH3I
0
t < 100 C
N
H
0
t > 150 C
продукты полиалкилирования
и полимеризации
В отличие от фурана и пиррола тиофен может алкилироваться по гетероатому
с образованием устойчивых солей, сохраняющих ароматические свойства:
+
(CH3)3O.BF4
S
S +
CH3
BF4
19
20.
Реакция гидроксиметилирования пирролаR'
R'
R'
R
+
H2C=OH
+
R
N
H
протонированный
формальдегид
-H+
R'
R
R
R
N
H
R
CH2
CH2OH
N
H
R
R
R
N
H
H
+
R'
N
H
R
Ориентирующие свойства заместителей (менее всего проявляются в случае фурана)
побочный
донорная
группа
X
главный
побочный
акцепторная
группа
X
побочный
акцепторная
группа
донорная
группа
X
побочный
главный
главный
главный
X
20
21.
Курс лекций является частью учебно-методического комплекса«Химия биологически активных веществ»
автор:
Носова Эмилия Владимировна, д.х.н., доцент кафедры органической химии ХТИ УрФУ
Учебно-методический комплекс подготовлен на кафедре органической химии
химико-технологического института УрФУ
Никакая часть презентации не может быть воспроизведена в
какой бы то ни было форме без письменного разрешения автора
21 22















 biology
biology chemistry
chemistry








