Similar presentations:
Левоглюкозенон в синтезе хиральных полициклических соединений
1.
БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТХИМИЧЕСКИЙ ФАКУЛЬТЕТ
КАФЕДРА ОРГАНИЧЕСКОЙ И БИООРГАНИЧЕСКОЙ ХИМИИ
УФИМСКИЙ ИНСТИТУТ ХИМИИ РАН
ЛАБОРАТОРИЯ ФАРМАКОФОРНЫХ ЦИКЛИЧЕСКИХ СИСТЕМ
ЛЕВОГЛЮКОЗЕНОН В СИНТЕЗЕ ХИРАЛЬНЫХ
ПОЛИЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
ИСАНБАЕВА ГАЛИЯ ГАЛИЕВНА
Работа выполнена в лаборатории фармакофорных циклических систем УфИХ УФИЦ РАН
2.
OHO
O
0
1. LDA, THF, -78 C;
Cl
2. F3CSO2Cl
OCH3
0
KH, 18-краун-6,
1. (E)-1-литий-2-метил-1,3-бутадиен, -78 C;
1. NaBH4, CeCl3, CH3OH
O
OCH3
THF
0
2. литий изопропенилацетилид, 0 C;
3. LiAlH4, 57%.
OCH3
3
1
2. PtO2, H2
0
3. Ac2O, Py; Li, EtNH2, -78 C
4. AcOMs, CH3CN
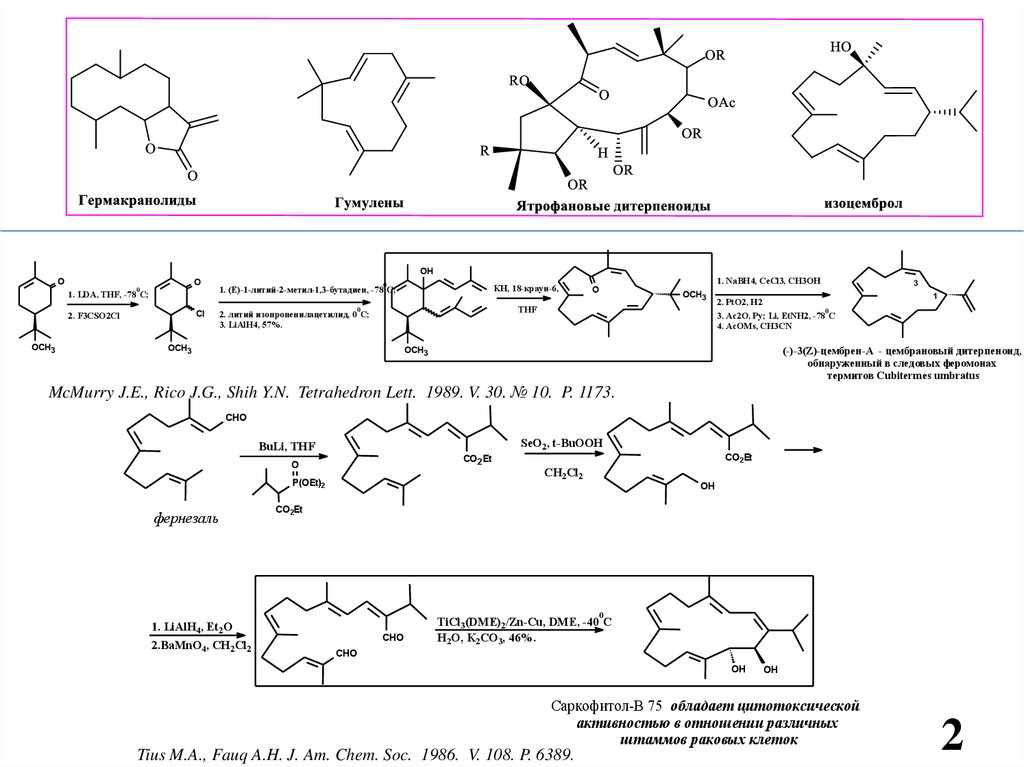
(-)-3(Z)-цембрен-А - цембрановый дитерпеноид,
обнаруженный в следовых феромонах
термитов Cubitermes umbratus
OCH3
McMurry J.E., Rico J.G., Shih Y.N. Tetrahedron Lett. 1989. V. 30. № 10. P. 1173.
CHO
SeO2, t-BuOOH
BuLi, THF
CO2Et
O
P(OEt)2
фернезаль
OH
CO2Et
0
1. LiAlH4, Et2O
2.BaMnO4, CH2Cl2
CO2Et
СН2Cl2
CHO
TiCl3(DME)2/Zn-Cu, DME, -40 С
H2O, K2CO3, 46%.
CHO
OH
OH
Саркофитол-В 75 обладает цитотоксической
активностью в отношении различных
штаммов раковых клеток
Tius M.A., Fauq A.H. J. Am. Chem. Soc. 1986. V. 108. P. 6389.
2
3.
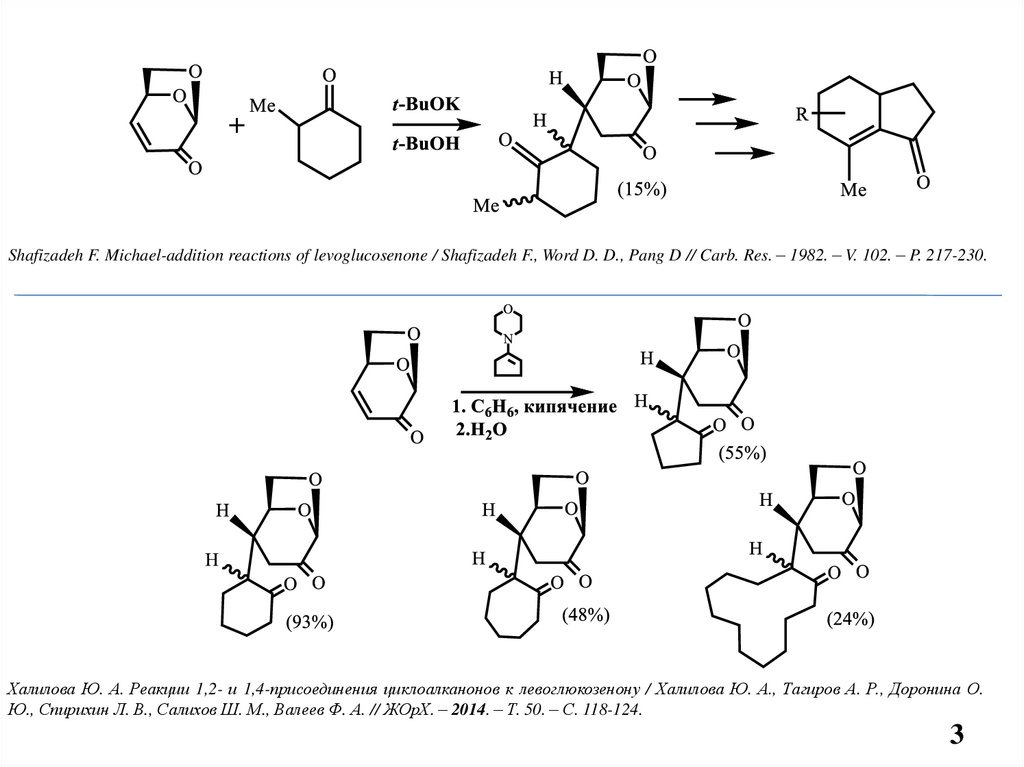
Shafizadeh F. Michael-addition reactions of levoglucosenone / Shafizadeh F., Word D. D., Pang D // Carb. Res. – 1982. – V. 102. – P. 217-230.Халилова Ю. А. Реакции 1,2- и 1,4-присоединения циклоалканонов к левоглюкозенону / Халилова Ю. А., Тагиров А. Р., Доронина О.
Ю., Спирихин Л. В., Салихов Ш. М., Валеев Ф. А. // ЖОрХ. – 2014. – Т. 50. – С. 118-124.
3
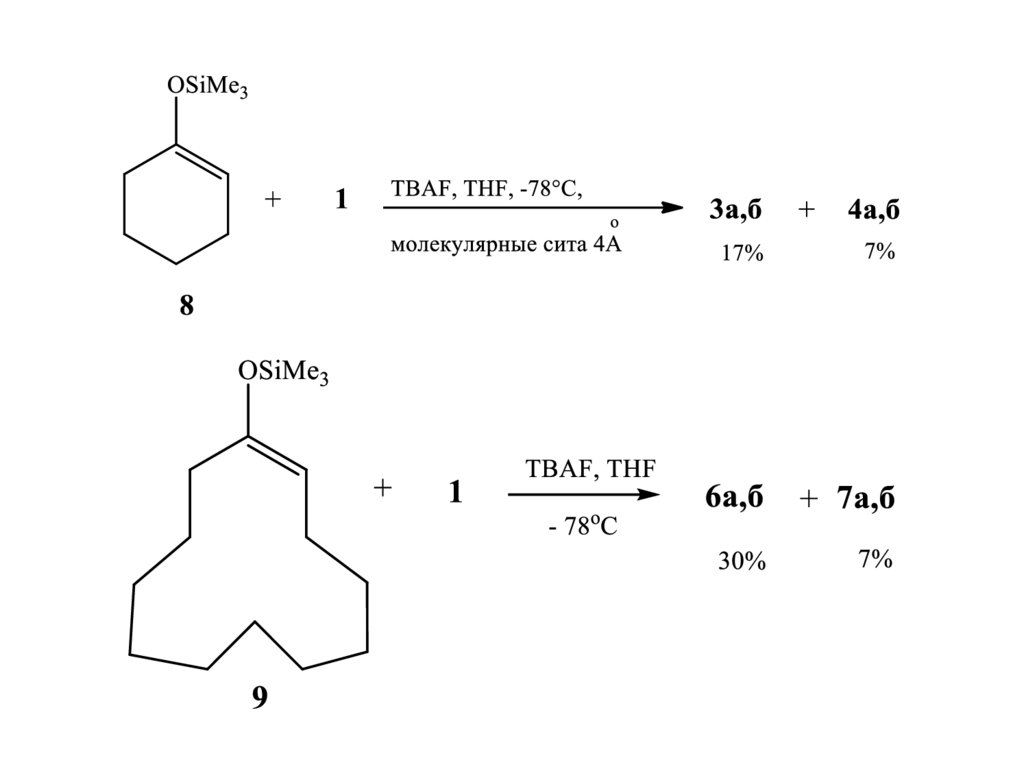
4.
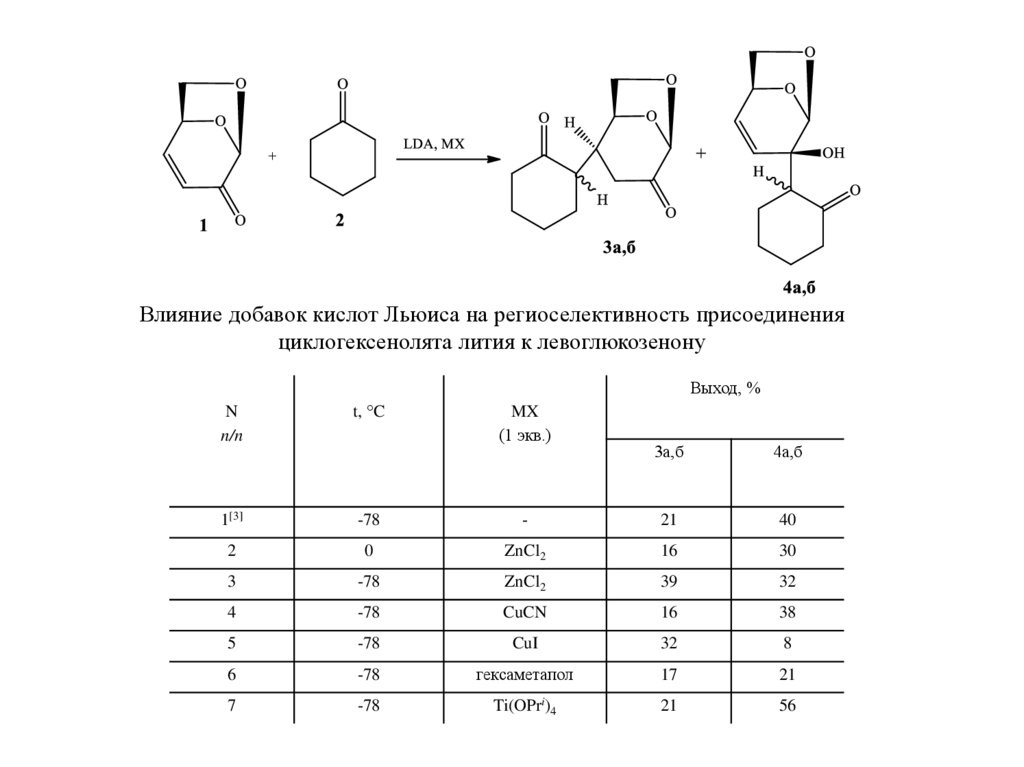
Влияние добавок кислот Льюиса на региоселективность присоединенияциклогексенолята лития к левоглюкозенону
Выход, %
N
n/n
t, °C
1[3]
-78
2
MX
(1 экв.)
3а,б
4а,б
-
21
40
0
ZnCl2
16
30
3
-78
ZnCl2
39
32
4
-78
CuCN
16
38
5
-78
CuI
32
8
6
-78
гексаметапол
17
21
7
-78
Ti(OPri)4
21
56
5.
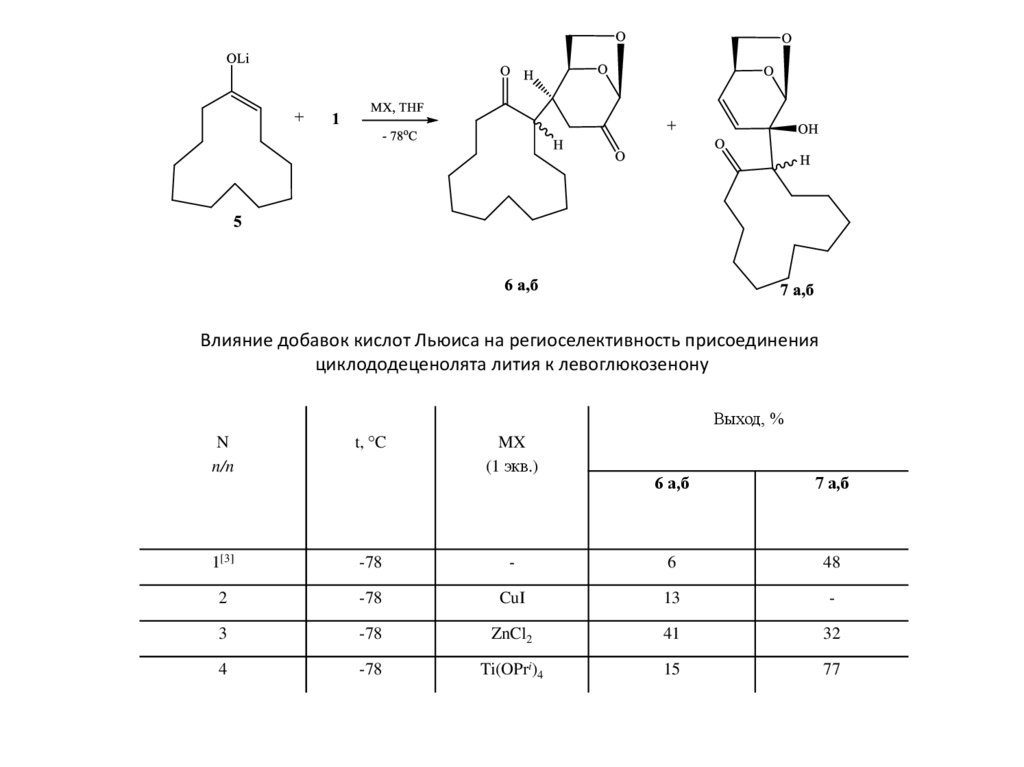
Влияние добавок кислот Льюиса на региоселективность присоединенияциклододеценолята лития к левоглюкозенону
Выход, %
N
n/n
t, °C
1[3]
-78
2
MX
(1 экв.)
6 а,б
7 а,б
-
6
48
-78
CuI
13
-
3
-78
ZnCl2
41
32
4
-78
Ti(OPri)4
15
77
6.
7.
Результат реакцииретро-реакция Михаэля
Реагенты
Et3N-C6H6
DBU-C6H6
осмоление реакционной смеси
NaH-THF
BF3·Et2O- CH2Cl2
образование трудноразделяемой смеси
HMDSLi-THF
продуктов реакции
KOH-EtOH-H2O,
внутримолекулярная карбоциклизация
30%
TMG-CH2Cl2, 48%
DMSO, NaHCO3,
86%
7
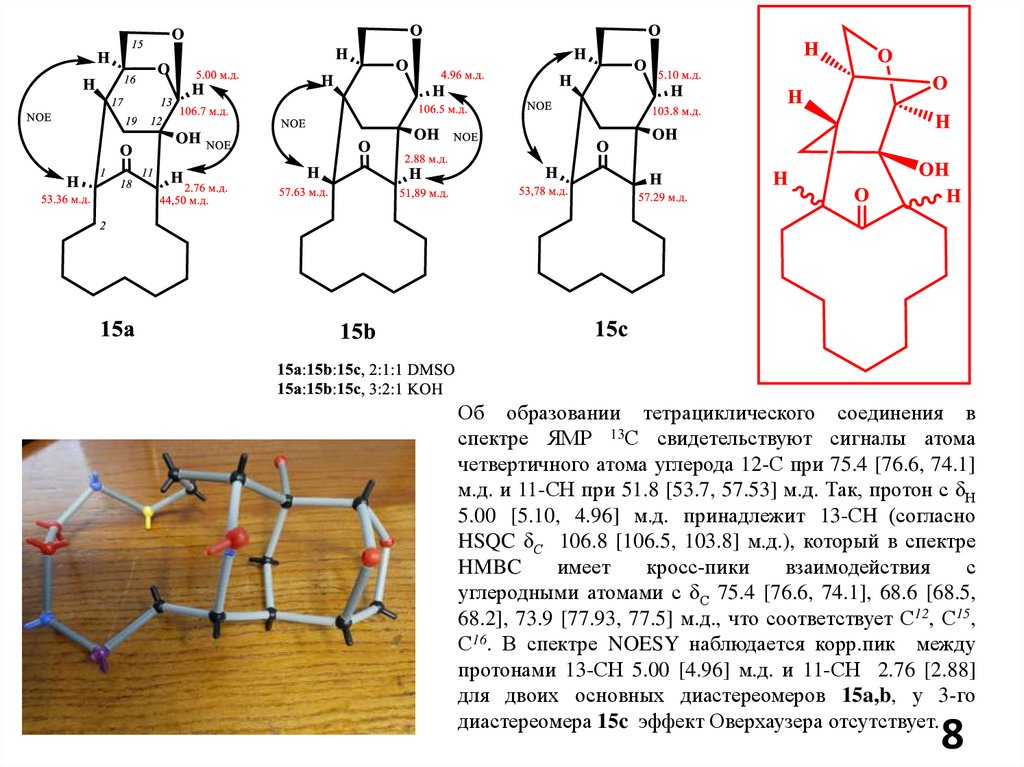
8.
Об образовании тетрациклического соединения вспектре ЯМР 13С свидетельствуют сигналы атома
четвертичного атома углерода 12-С при 75.4 [76.6, 74.1]
м.д. и 11-СН при 51.8 [53.7, 57.53] м.д. Так, протон с δН
5.00 [5.10, 4.96] м.д. принадлежит 13-СH (согласно
HSQC δС 106.8 [106.5, 103.8] м.д.), который в спектре
HMBC
имеет
кросс-пики
взаимодействия
с
углеродными атомами с δС 75.4 [76.6, 74.1], 68.6 [68.5,
68.2], 73.9 [77.93, 77.5] м.д., что соответствует С12, С15,
С16. В спектре NOESY наблюдается корр.пик между
протонами 13-СН 5.00 [4.96] м.д. и 11-СН 2.76 [2.88]
для двоих основных диастереомеров 15a,b, у 3-го
диастереомера 15c эффект Оверхаузера отсутствует.
8
9.
ВЫВОДЫ1. Оптимальным путем получения аддуктов Михаэля левоглюкозенона с
циклогексаноном и -додеканоном является взаимодействие енолятов лития с
левоглюкозеноном при -78°С в присутствии ZnCl2. Дополнительные количества
аддукта Михаэля можно получить после обработки LDA раствора продукта 1,2присоединения.
2. Разработан способ внутримолекулярной альдольной конденсации в
диастереомерных аддуктах Михаэля левоглюкозенона и циклододеканона
действием KOH-EtOH-H2O или TMG-CH2Cl2 или DMSO, NaHCO3. Полученные
диастереомеры 10a,b,c перспективны в синтезе цембраноидов и аналогов для
изучения взаимосвязи структура-активность.
9
10.
Благодарю за внимание!10