Similar presentations:
Синтез высокомолекулярных соединений. Полимеризация
1. СИНТЕЗ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ
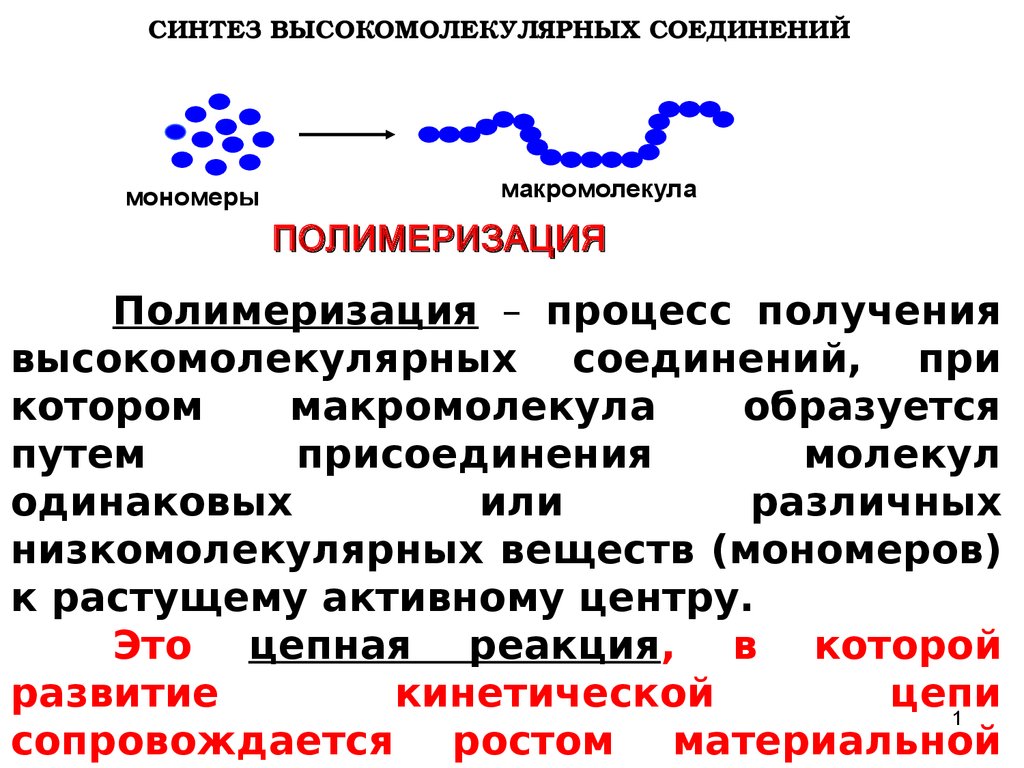
СИНТЕЗ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙмономеры
макромолекула
ПОЛИМЕРИЗАЦИЯ
Полимеризация – процесс получения
высокомолекулярных соединений, при
котором
макромолекула
образуется
путем
присоединения
молекул
одинаковых
или
различных
низкомолекулярных веществ (мономеров)
к растущему активному центру.
Это цепная реакция, в которой
развитие
кинетической
цепи
1
сопровождается ростом материальной
2. Новые возможности радикальной полимеризации в контролируемом синтезе макромолекул
Новые возможности радикальнойполимеризации в контролируемом синтезе
макромолекул
Классическая радикальная
полимеризация
инициирование
I 2 R1 .
рост
R1 . + M P .
P . + nM Pn+1 .
обрыв
Pp . + Pn. P
передача
P . + SH PH +S .
3. Возможности контролируемой радикальной полимеризации
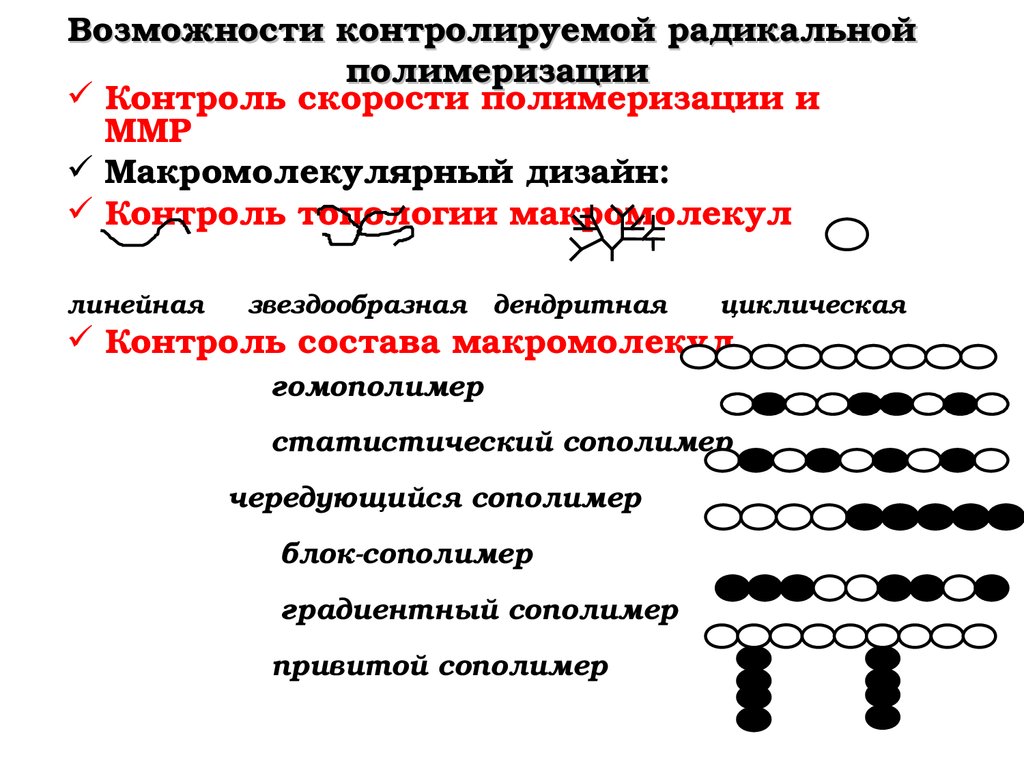
Возможности контролируемой радикальнойполимеризации
Контроль скорости полимеризации и
ММР
Макромолекулярный дизайн:
Контроль топологии макромолекул
линейная звездообразная дендритная циклическая
Контроль состава макромолекул
гомополимер
статистический сополимер
чередующийся сополимер
блоксополимер
градиентный сополимер
привитой сополимер
4.
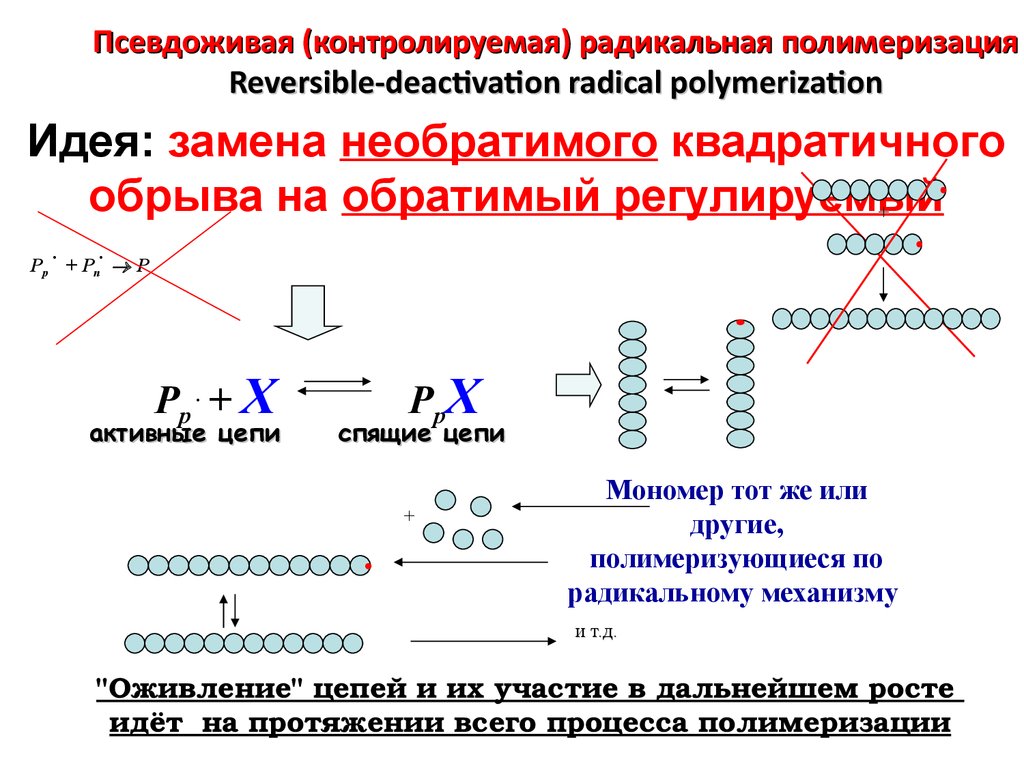
Псевдоживая (контролируемая) радикальная полимеризацияReversible-deactivation radical polymerization
Идея: замена необратимого квадратичного
обрыва на обратимый регулируемый
+
.
.
Pp + Pn P
Pp . + X
активные цепи
PpX
спящие цепи
+
Мономер тот же или
другие,
полимеризующиеся по
радикальному механизму
и т.д.
"Оживление" цепей и их участие в дальнейшем росте
идёт на протяжении всего процесса полимеризации
5.
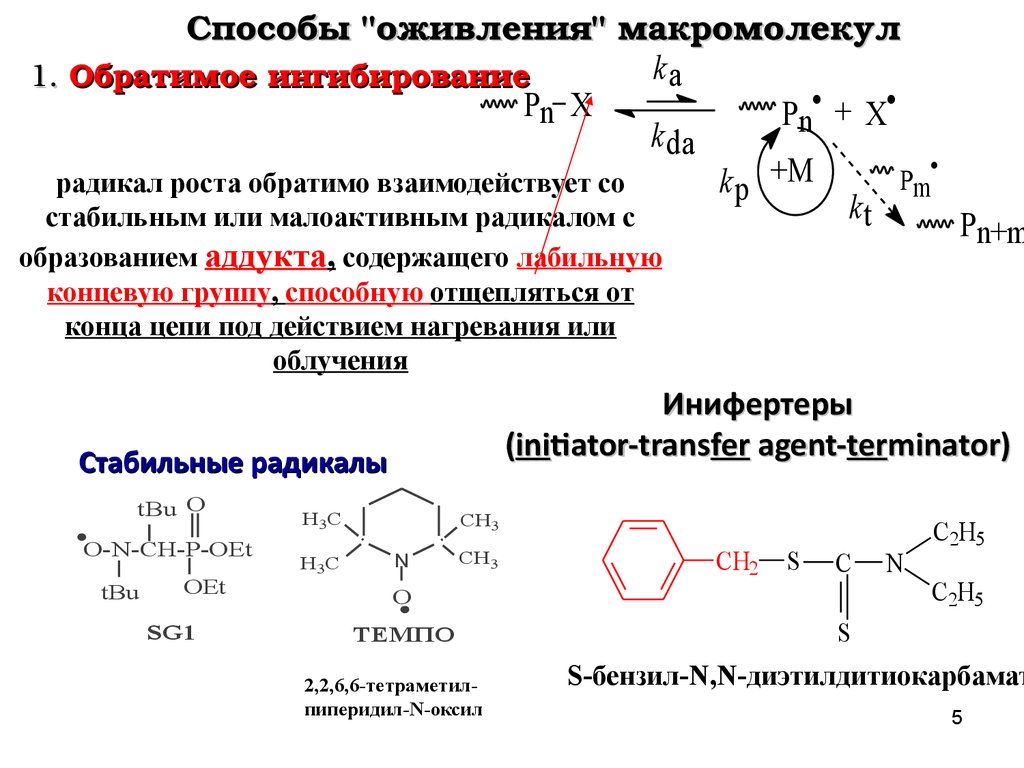
Способы "оживления" макромолекулka
1. Обратимое ингибирование
Pn X
Pn• + X
k da
Pm
радикал роста обратимо взаимодействует со
k p +M
kt
стабильным или малоактивным радикалом с
Pn+m
образованием аддукта, содержащего лабильную
концевую группу, способную отщепляться от
конца цепи под действием нагревания или
облучения
Инифертеры
(initiator-transfer agent-terminator)
Стабильные радикалы
tBu O
O-N-CH-P-OEt
tBu
OEt
SG1
H3C
H3C
CH3
N
CH3
CH2
S
C
O
ТЕМПО
2,2,6,6-тетраметилпиперидил-N-оксил
N
C2H5
C2H5
S
S-бензил-N,N-диэтилдитиокарбамат
5
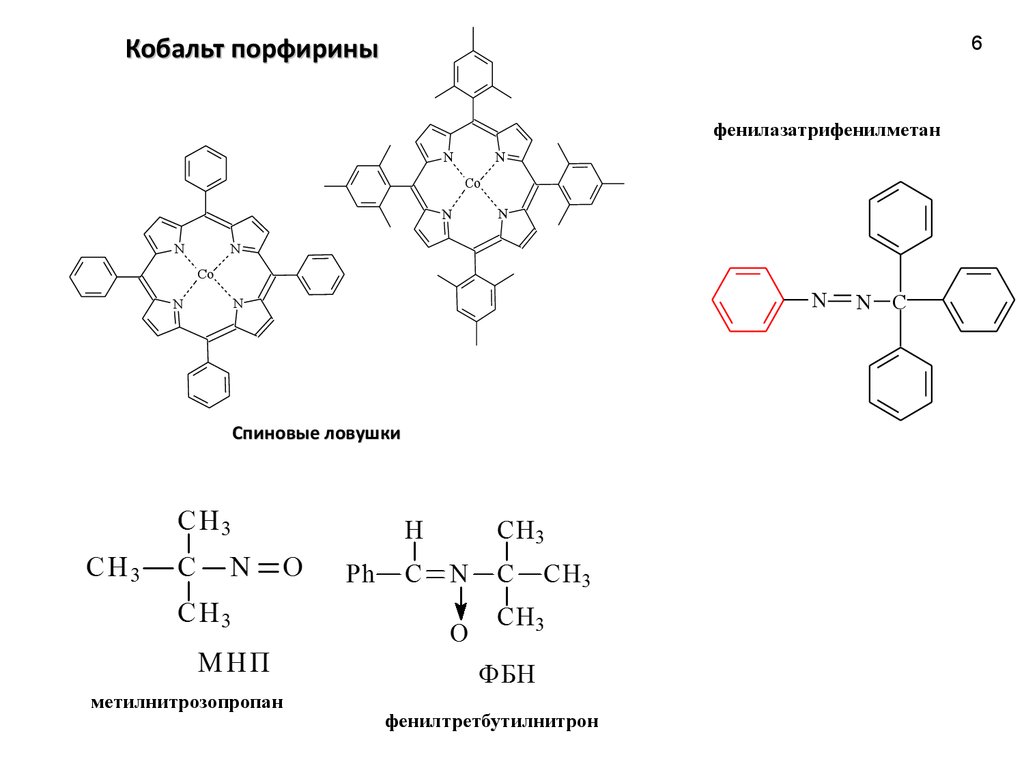
6.
Кобальт порфирины6
фенилазатрифенилметан
N
N
Co
N
N
N
N
Co
N
N
N
Спиновые ловушки
метилнитрозопропан
фенилтретбутилнитрон
N C
7.
Способы "оживления" макромолекул2. Обратимый перенос атома
(ATRP)- англ.аббревиатура
Pn X + Y
макрорадикал обратимо взаимодействует со
специальной добавкой (катализатором)
посредством окислительновосстановительной реакции
Pn
Br
+M
+
N
N
Cu
N
N
ka
k da
Pn• + X Y
k p +M
kt
N
ka ~ 1 M-1•s-1
Pn
kda ~ 107 M-1•s-1
+M
+ Br Cu
N
Pm
Pn+m
N
N
в качестве катализатора используют соединение переходного металла, а в
качестве инициатора обычно алкилгалогенид (чаще бромид),
химическая структура которого близка к структуре полимеризующегося
мономера
7
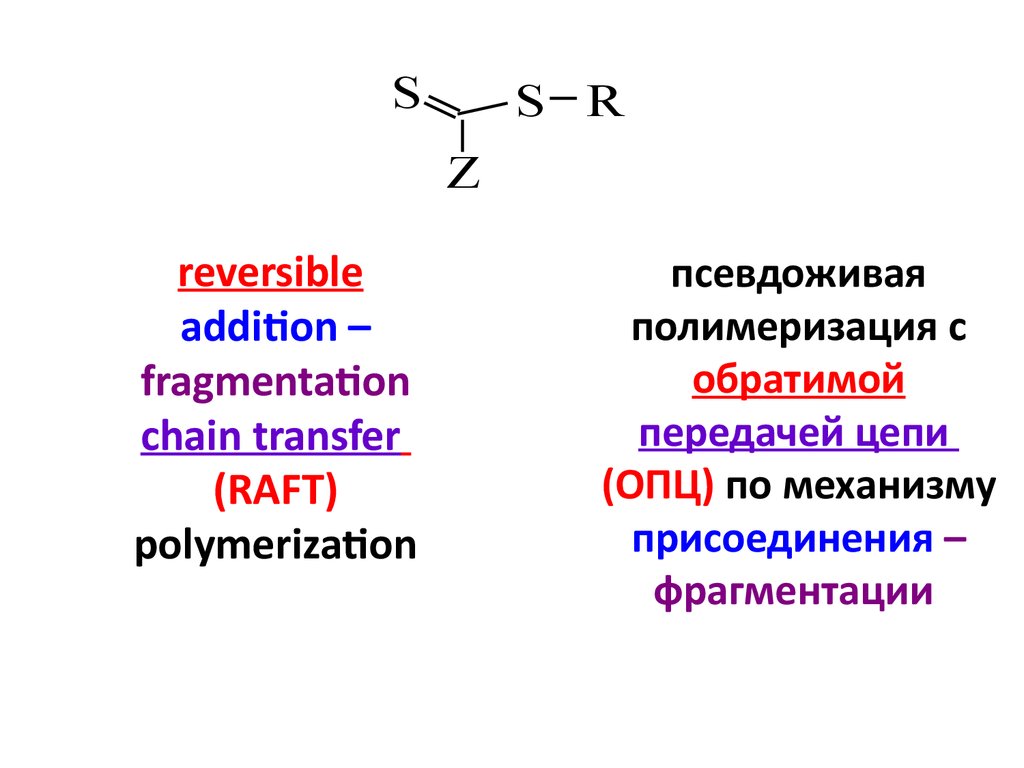
8. псевдоживая полимеризация с обратимой передачей цепи (ОПЦ) по механизму присоединения – фрагментации
SS R
Z
reversible
addition –
fragmentation
chain transfer
(RAFT)
polymerization
псевдоживая
полимеризация с
обратимой
передачей цепи
(ОПЦ) по механизму
присоединения –
фрагментации
9.
Способы "оживления" макромолекулPm
Pn X +
3. Обратимая передача
цепи
радикал обратимо
взаимодействует с агентом
обратимой передачи цепи,
содержащим лабильный атом
или группу атомов
Pn
Pn+m
k exch
kt
Pn• + X Pm
k p +M
+M k p
ka
k da
ka
kt
k da
Pn X Pm
Pm
Pn+m
Обратимая передача цепи
R`• + X
X R
Z
R` X
X R
X R` + R
X
Z
Z
Кобальт порфирины
Органические соединения Te, Ti, As, Sb или Bi
9
10.
Где в России исследуют закономерностипсевдоживых процессов?
10
11.
ИНИЦИИРОВАНИЕИнициирование – превращение небольшой доли молекул мономера в активные центры под
действием специально вводимых веществ (инициаторов и катализаторов) или излучения
высоких энергий (радиационная полимеризация), или света (фотополимеризация) и др.
Радикальная полимеризация
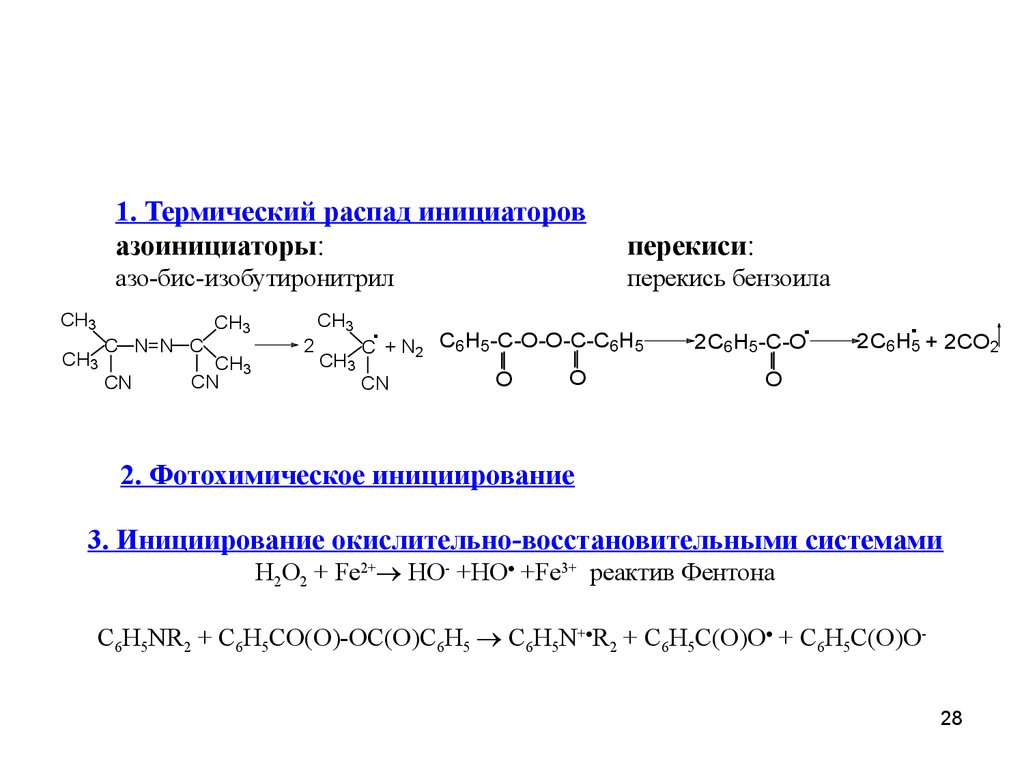
1. Термический распад инициаторов
азоинициаторы:
перекиси:
азо-бис-изобутиронитрил
перекись бензоила
CH3
CH3
C N=N C
CH3
CH3
CN
CN
CH3
2
CH3
.
C + N2 C6H5-C-O-O-C-C6H5
CN
O
O
чистый мономер
M+h M*
фотолитическая диссоциация инициаторов
I+h I*
фотосенсибилизаторы (бензофенон)
Z+h Z*
Z*+C
C*
Z+C*
R +R'
2C6H5 + 2CO2
O
2. Фотохимическое инициирование
.
.
2C6H5-C-O
3. Инициирование окислительно-восстановительными
системами
H2O2 + Fe2+ HO- +HO +Fe3+ реактив Фентона
ROOR + Fe2+ RO- + RO (Cr2+, V2+, Ti3+, Co2+)
RCH2OH + Ce4+ RC HOH + H+ + Ce3+
O3S-O-O-SO3- + S2O32- SO42- +SO4 +S2O3
C6H5NR2 + C6H5CO(O)-OC(O)C6H5 C6H5N+ R2 + C6H5C(O)O + C6H5C(O)O-
11
12.
ДЛИНА КИНЕТИЧЕСКОЙ И МАТЕРИАЛЬНОЙ ЦЕПИКинетическая цепь – число
молекул мономера,
присоединившихся к одному
образовавшемуся радикалу Rn
до его гибели при обрыве цепи
Материальная цепь
(среднечисловая степень
полимеризации) Pn – число
элементарных актов
присоединения мономеров на
один акт гибели радикала Rn при
обрыве и передаче цепи
Vp
Vи
n
k p [ R ][M ]
2 fkин [ I ]
Vp
Pn
Vo Vп
12
13.
В зависимости от природы активного центра и от механизмаакта роста цепи выделяют
РАДИКАЛЬНУЮ активный центр свободный
радикал – частица с неспаренным электроном.
(радикал роста, макрорадикал)
КАТИОННУЮ концевой атом растущей цепи имеет
полный положительный заряд
АНИОННУЮ концевой атом растущей цепи имеет
полный отрицательный заряд
КООРДИНАЦИОННОИОННУЮ если противоион,
входящий в состав активного центра, принимает
участие в акте роста, образуя с присоединяющейся
молекулой мономера координационный комплекс
или циклическое переходное состояние
13
14.
МОНОМЕРЫв радикальной полимеризации:
- образуются высокомолекулярные продукты, если использованы:
Виниловые мономеры CH2=CHX
Винилиденовые мономеры CH2=C(X)Y
X, Y алкил, галоген, COOH, COOR, OCOR, CN, CONH2,
C6H5, арил, CH=CH2
- образуются олигомерные продукты, если использованы:
Аллиловые мономеры CH2=CHCH2X
Виниловые эфиры CH2=CHOR
- не полимеризуются, если использованы :
Виниленовые мономеры CHX=CHX (за исключением X = F)
Соединения с кратной связью С = гетероатом
14
15.
ТЕПЛОВЫЕ ЭФФЕКТЫ ПОЛИМЕРИЗАЦИИ И ЭНЕРГИЯ СВЯЗЕЙтепловой эффект химической реакции ( Q = H) обусловлен
изменением внутренней энергии системы, например,
разрушаются одни связи и образуются другие, изменяются
межмолекулярные взаимодействия и пр.
Полимеризация по кратным связям
а) С = С
б) С = гетероатом (О)
( мало используют)
Полимеризация с раскрытием цикла
C
C
C O
C
C*
C O*
X
X*
Полимеризация по двойной С С связи
(исчезает 1 двойная связь и образуются 2 одинарных связей)
Тепловой эффект реакции при постоянном
давлении:
Q = 2Dод – Dдв (D – энергия диссоциации связи)
15
16.
ТЕРМОДИНАМИКА ПОЛИМЕРИЗАЦИИТермодинамическая возможность образования макромолекул при
постоянном давлении описывается
уравнением
изменения изобарно-изотермического потенциала
реакционной системы G:
G = H T S
H – изменение энтальпии системы ( H = Q),
Т – абсолютная температура
S – изменение энтропии системы
G <0
При
полимеризация
термодинамически разрешена
При
G = 0
в системе устанавливается
термодинамическое равновесие
16
17.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЕЛИЧИНУ Q:при полимеризации виниловых мономеров:
1. Объемные боковые заместители в мономерном звене Q уменьшается
2. Уменьшение электронной плотности на двойной связи способствует
снижению энергии двойной связи в мономере и, как следствие, Q
увеличивается
3. Увеличение энергии двойной связи вследствие сопряжения в
мономере Q уменьшается
Полимеризация с раскрытием цикла
При полимеризации с раскрытием цикла природа
связей не изменяется и Q определяется
напряженностью цикла (разность внутренних
энергий цикла и линейной структуры), которая
зависит от его размеров.
17
18.
Полимеризация по двойной связиполимеризации С гетероатом
мономеров, двойная связь которых
При
образована атомом углерода и гетероатомом, закономерности
изменения Q те же, но абсолютные значения Q меньше.
ЭТИЛЕН
Q = 94.3 кДж/моль
CH2O
Q = 69.9 кДж/моль
CH3CHO
Q = 46.1 кДж/моль объемный заместитель
CF3CHO
Q = 64.5 кДж/моль взаимодействие электронов
заместителя и двойной связи
CCl3CHO
Q = 68.7 кДж/моль
18
19.
ЭТИЛЕНQ = 94.3 кДж/моль
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЕЛИЧИНУ Q:
1. Объемные боковые заместители в полимерной цепи Q уменьшается
Бутен1
Q = 85.9 кДж/моль
Метилакрилат
Q = 78.8 кДж/моль
Изобутилен
Q = 54.5 кДж/моль
2. Взаимодействие электронов заместителя и двойной связи:
при уменьшении плотности электронов на двойной связи энергия двойной
связи в мономере уменьшается Q увеличивается
Винилхлорид
Q = 130 кДж/моль
Винилиденфторид Q = 147 кДж/моль
Тетрафторэтилен Q = 172 кДж/моль
НО!!!
Винилиденхлорид
Q = 101 кДж/моль (см. п.1)
3. Увеличение энергии диссоциации двойной связи вследствие сопряжения
в мономере Q уменьшается
Стирол
Q = 75.8 кДж/моль
Метилстирол
Q = 33.5 кДж/моль (см. п.1)
4. Сопряжение двойных связей в полимере Q увеличивается
19
Ацетилен
Q = 75.8 кДж/моль
20.
ЭНТРОПИЯ ПОЛИМЕРИЗАЦИИЭнтропия характеризует меру упорядоченности
системы.
S = Sпост. + Sвращ. + Sколеб. + Sвн.вращ.
Уменьшение
энтропии при полимеризации происходит
главным образом вследствие:
- потери поступательных степеней свободы и вращательного
движения молекул как целого,
- появления степени свободы внутренних вращений звеньев
макромолекулы.
S слабо зависит от химической природы
виниловых и винилиденовых мономеров
Стирол
S = 196 Дж/моль К
При полимеризации гетероциклов свобода внутренних вращений при
раскрытии цикла может увеличиться настолько, что перекроет эффект
уменьшения свободы поступательного движения S может возрасти
Капролактам
S = 4.6 Дж/моль К
20
21.
ВЕРХНЯЯ ПРЕДЕЛЬНАЯ ТЕМПЕРАТУРА ПОЛИМЕРИЗАЦИИВ большинстве случаев при полимеризации H < 0 и S < 0
с повышением температуры (Т) G увеличивается
При определенной температуре, называемой верхней предельной
температурой полимеризации (Тпр)
Тпр GТ = HТ Тпр SТ =
0
Тпр = HТ/ SТ
1. T<Тпр образование высокомолекулярного
вещества термодинамически возможно.
2. T > Тпр более выгодна деполимеризация
3. Т=Тпр устанавливается полимеризационно–
деполимеризационное равновесие.
Метилстирол Тпр = 67оС Q = 33.5 кДж/моль
Формальдегид (г)
Тпр = 119оС
Q = 69.9 кДж/моль
Метилметакрилат
Тпр = 197оС
Q = 58.2 кДж/моль
Тетрафторэтилен
Тпр = 1097оС
Q = 172 кДж/моль
21
22.
НИЖНЯЯ ПРЕДЕЛЬНАЯ ТЕМПЕРАТУРА ПОЛИМЕРИЗАЦИИЕсли при полимеризации H > 0 и S > 0 , то с увеличением
температуры (Т) G понижается
При
температуре,
называемой
нижней
предельной
температурой полимеризации
Тпр GТ = HТ Тпр SТ = 0 Тпр = HТ/ SТ
1.
2.
3.
T < Тпр более выгодна деполимеризация
T > Тпр идет полимеризация.
Т=Тпр устанавливается полимеризационно–
деполимеризационное равновесие.
Сера, Селен
22
23.
ПОЛИМЕРИЗАЦИОННО – ДЕПОЛИМЕРИЗАЦИОННОЕ РАВНОВЕСИЕмежду концентрациями мономера, макрорадикала Rn и
макрорадикала Rn+1
Rn + M
kp
kä åï
Rn+1
Допущения:
1) Степень полимеризации Pn>>1
2) Активность Rn* не зависит от Pn
при Т = Тпр Vp = Vдеп
K
kp
k деп
[ Rn* 1 ]
[ M ][ Rn* ]
G G o RT ln K
G 0
1
K
[M ]
G o RT ln K RT ln(1 / M ) RT ln M
G o H o T S o RT ln M
o
ΔH
Tпр o
ΔS R ln [M]
ΔH o
[M]пр exp
RTпр
o
ΔS
R
23
24.
Способность мономера к полимеризации наряду стермодинамическими факторами определяется и
кинетическими факторами
24
25.
РАДИКАЛЬНАЯ ПОЛИМЕРИЗАЦИЯОсновные стадии полимеризации:
1. Инициирование
2. Рост цепи
необходимы для кинетической характеристики
3. Обрыв цепи
4. Передача цепи
Инициирование – включает 2 элементарных акта:
а) генерирование радикалов R. из инициатора I
б) взаимодействие радикала R. с мономером
R +CH2
CH
X
k'è
R
kи
I
2R
CH2 CH
X
Часть радикалов R. может расходоваться на побочные реакции, для учета
этого вводят параметр эффективности инициирования f, равный
отношению числа радикалов, участвовавших в реакции (б) к числу
радикалов, образовавшихся по реакции (а).
Скорость инициирования
Vи = kи 2f [I]
25
26.
ДЛИНА КИНЕТИЧЕСКОЙ И МАТЕРИАЛЬНОЙ ЦЕПИКинетическая цепь – число
молекул мономера,
присоединившихся к одному
образовавшемуся радикалу Rn
до его гибели при обрыве цепи
Материальная цепь
(среднечисловая степень
полимеризации) Pn – число
элементарных актов
присоединения мономеров на
один акт гибели радикала Rn при
обрыве и передаче цепи
Vp
Vи
n
k p [ R ][M ]
2 fkин [ I ]
Vp
Pn
Vo Vп
26
27.
ДЛИНА КИНЕТИЧЕСКОЙ И МАТЕРИАЛЬНОЙ ЦЕПИКинетическая цепь – число
молекул мономера,
присоединившихся к одному
образовавшемуся радикалу Rn
до его гибели при обрыве цепи
Материальная цепь
(среднечисловая степень
полимеризации) Pn – число
элементарных актов
присоединения мономеров на
один акт гибели радикала Rn при
обрыве и передаче цепи
Vp
Vи
n
k p [ R ][M ]
2 fkин [ I ]
Vp
Pn
Vo Vп
27
28.
1. Термический распад инициаторовазоинициаторы:
перекиси:
азо-бис-изобутиронитрил
перекись бензоила
CH3
CH3
C N=N C
CN
CH3
CH3
CN
CH3
2
CH3
.
C +N
2
CN
C6H5-C-O-O-C-C6H5
O
O
.
2C6H5-C-O
.
2C6H5 + 2CO2
O
2. Фотохимическое инициирование
3. Инициирование окислительно-восстановительными системами
H2O2 + Fe2+ HO- +HO +Fe3+ реактив Фентона
C6H5NR2 + C6H5CO(O)-OC(O)C6H5 C6H5N+ R2 + C6H5C(O)O + C6H5C(O)O28
29.
МЕХАНИЗМ И КИНЕТИКА ПОЛИМЕРИЗАЦИИДопущения, принимаемые для вывода кинетических
уравнений полимеризации
1. Малые конверсии мономера
2. Pn >>1 (действительно идёт реакция полимеризации)
3. Активность растущих макромолекул не зависит от
их степени полимеризации (принцип Флори)
4. Если время жизни активных частиц мало по
сравнению
со
временем
полимеризации
используют принцип квазистационарности –
скорость инициирования равна скорости обрыва
цепи
29
30.
Рост цепиR CH2
]
V p k p[M ][Rn
kp
Rn M
Rn 1
CH
X
+
CH2
CH
X
kð
R CH2
CH CH2 CH
X
X
Реакционная способность мономера и макрорадикала
определяется
Сопряжением кратной сязи с заместителем
Полярностью заместителя
Объёмом заместителя (стерический фактор)
Сопряжение с заместителем снижает активность
макрорадикала в большей степени, чем повышает
активность мономера.
АКТИВНЫЕ МОНОМЕРЫ: с большой энергией сопряжения
(мономеры, у которых двойная связь сопряжена с ненасыщенной
группой заместителя).
НЕАКТИВНЫЕ МОНОМЕРЫ: сопряжение отсутствует или его
энергия мала.
30
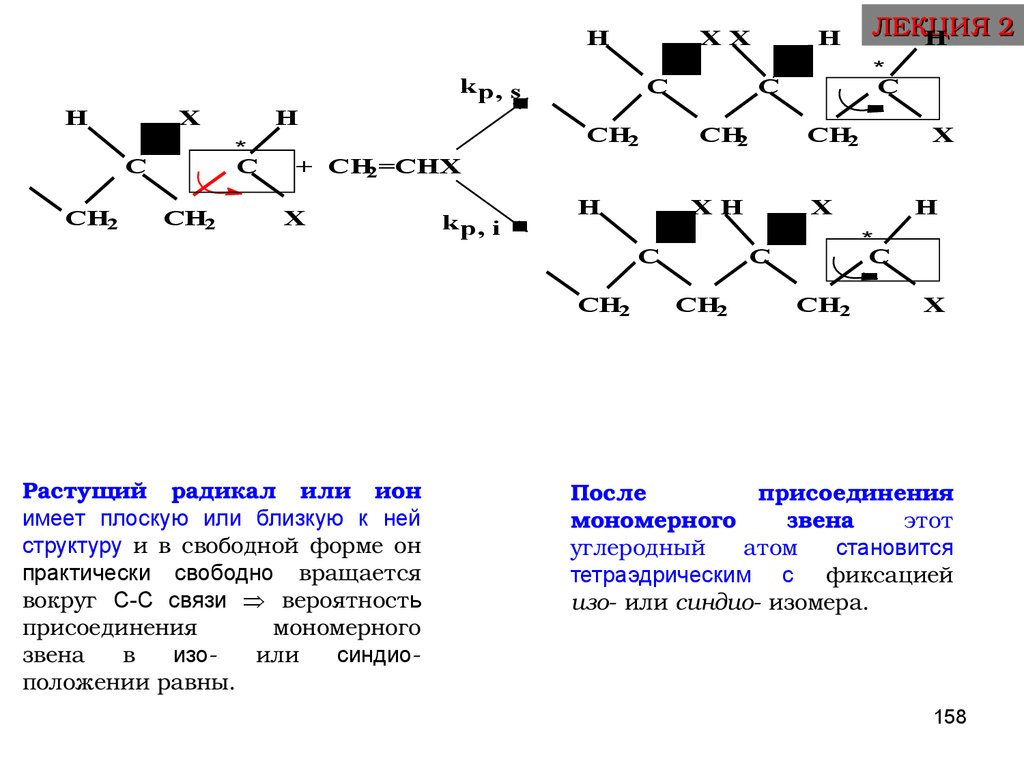
31. ПРАВИЛО АНТИБАТНОСТИ: чем более активен мономер, тем менее активен образовавшийся из него радикал, вследствие его стабилизации
RCH2
CH
X
Реакционная способность радикалов (и
соответственно kp) уменьшается в ряду:
X = OAlk > OCOCH3 > Alk > COOCH3 > CN > CH=CH2 > C6H5
16
32.
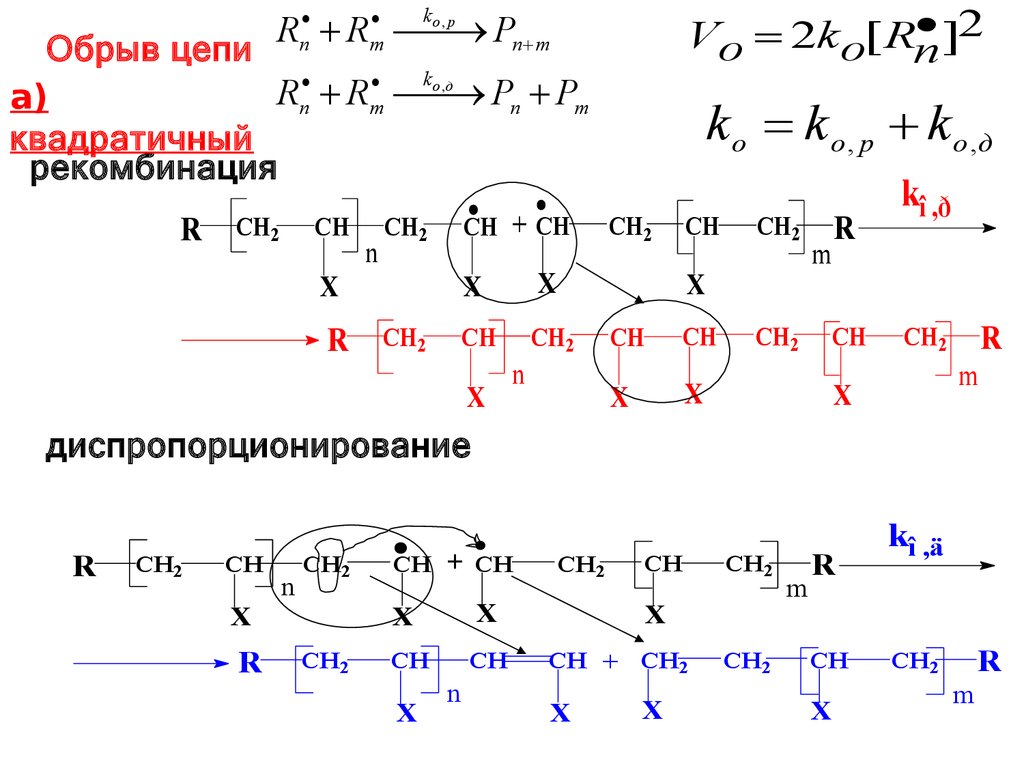
]2Vo 2ko[ Rn
ko , р
R R Pn m
n
m
Обрыв цепи
ko , д
R
R
Pn Pm
а)
n
m
квадратичный
рекомбинация
R
CH2
CH
n
CH + CH
CH2
X
R
CH2
X
X
CH
CH2
X
k o k o , p k o ,д
CH2
CH
CH2
X
n
CH
CH
X
X
m
CH2
R
CH
kî ,ð
R
CH2
m
X
диспропорционирование
R
CH2
CH
n
CH2
X
R
CH + CH
X
X
CH2
CH
X
CH2
CH
n
CH
CH2
X
CH + CH2
X
X
CH2
m
R
CH
X
kî ,ä
R
CH2
m
33.
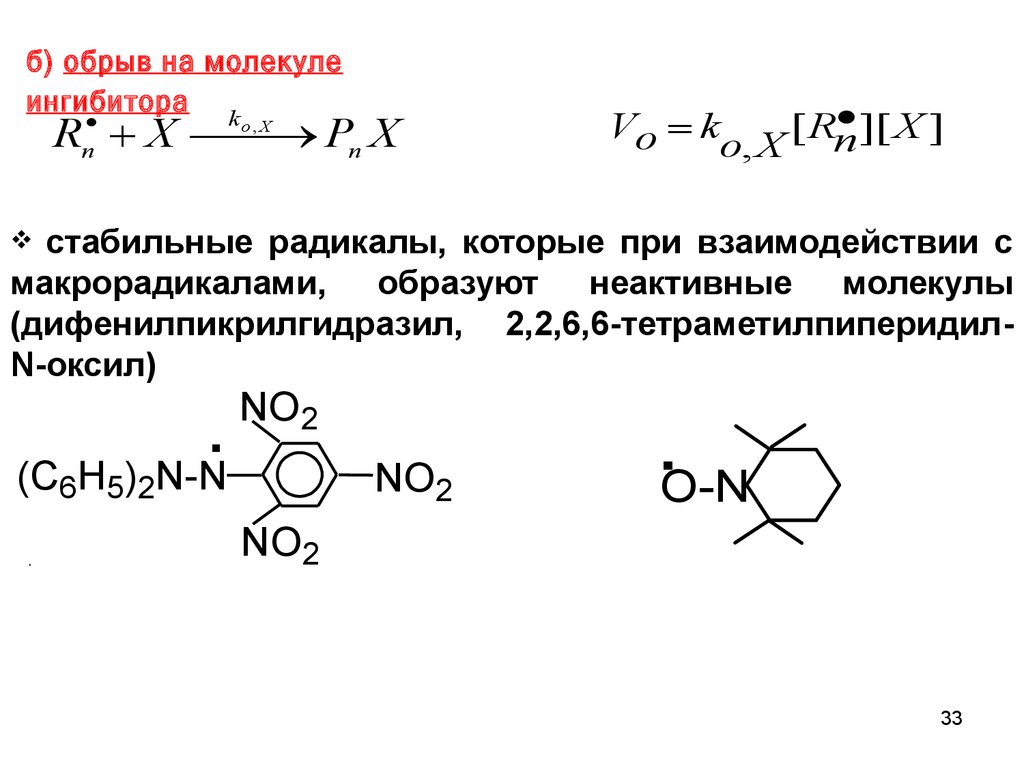
б) обрыв на молекулеингибитора
Rn X Pn X
ko , X
][ X ]
Vo k
[ Rn
o, X
стабильные радикалы, которые при взаимодействии с
макрорадикалами, образуют неактивные молекулы
(дифенилпикрилгидразил, 2,2,6,6-тетраметилпиперидилN-оксил)
.
(C H ) N-N
NO2
NO2
6 5 2
.O-N
NO2
33
34.
Передача цепииграет роль в регулировании длины материальной
цепи (степени полимеризации)
R S Pn S
n
kп ,S
VS kS [ Rn ][S ]
На растворитель (S)
R
CH2
CH
n
CH2
X
R
O
CH
n
CH2
C OCH3
R
O
CH2
O
CCl3
ks
R
CH2
CH
CH +
C
CH
C
CH2
OCH3
n
n
CH2
X
X
На мономер (М)
CH2
CH + Cl
CH2
O
CH
C
Cl + CCl3
X
kì
OCH2
H
CH2 +
C
OCH3
O
CH
CH2
OCH3
O
CH
C
OCH2
35.
Передача цепииграет роль в регулировании длины материальной
цепи (степени полимеризации)
На другую макромолекулу
R
CH2
CH
n
CH2
CH + R
C OC4H9 C OC4H9
O
O
R
CH2
CH
n
CH2
CH2
CH
n
CH2
kï
CH2
C OC4H9 C OC4H9
O
O
CH2 + R
C OC4H9 C OC4H9
O
O
CH2
CH
n
CH2
C
CH2
CH2
C OC4H9 C OC4H9 C OC4H9
O
O
O
35
36.
КИНЕТИКА РАДИКАЛЬНОЙ ПОЛИМЕРИЗАЦИИПоскольку мономер расходуется в основном на стадии роста, то
скорость этой реакции совпадает с общей скоростью
полимеризации
d
R
n
0
dt
dM
Vp
k
dt
p[M ][ Rn ]
Условие квазистационарности
Vи Vo 2 fkи [ I ] 2k o [ Rn ]2 0
[Rn ]
kи1/ 2 [I]1/ 2
1/ 2
ko
kи1/ 2k p 1/ 2
полимеризации
V p 1/ 2 [I] [M] Скорость
ko
пропорциональна [I]0.5 и [M]
Ea E p 1 Eин 1 Eo 0
2
2
Скорость полимеризации
увеличивается с ростом
температуры при Т<<Тпр 36
37.
Доля обрыва цепей диспропорционированиемk о ,д
k о ,д k о , р
Доля обрыва цепей рекомбинацией 1
Vp
Pn
Vo Vп
Pn
k p[ Rn ][M ]
1(1 )k [ R ]2 k [ R ]2 k [ R ][M ] k [ R ][S ]
o n
o n
п.м n
п.s n
2
1
(1 )k o1 / 2 k и1 / 2 [ I ]1 / 2
k п. м k п.s [ S ]
1 2
Pn
k p [M ]
k p k p [M ]
1
1
[S ]
CM CS
Pn Pn , 0
[M ]
37
38.
11/ 2 1/ 2
1/ 2
(1 )k o k и [ I ]
k п. м k п. s [ S ]
1 2
Pn
k p [M ]
k p k p [M ]
1
1
[S ]
CM CS
Pn Pn , 0
[M ]
Pn ~ [ M ]
1
[ I ]1 / 2
1
Pn ~
CМ
Pn ~
Степень полимеризации прямо пропорциональна М,
обратно пропорциональна кв.корню из концентрации
инициатора и обратно пропорциональна константе
самопередачи цепи (передачи на мономер)
Ea E p 1 Eин 1 Eo 0
2
2
Степень полимеризации уменьшается с
ростом температуры при Т<<Тпр
38
39.
Vп k п [ M ][ Rn ] k пV p k p [ M ][ Rn ] k p
k п. м .
10 4
k р.
Мономер
Метилметакрилат
CH2
CH3
C
k п. s .
10 4
k р.
0.07-0.18
0.075 (бензол)
2.4 (CCl4)
0.3
2.4 (бензол)
35.7 (Et-бензол)
0.6-0.11
0.018 (бензол)
90 (CCl4)
28
55 (Et-бензол)
1000 (CCl4)
COOCH3
Акрилонитрил
CH2
CH
CN
CH2
стирол
CH2
Винилацетат
CH
CH
O
C
CH3
O
аллиловые мономеры!
1600
39
40.
Полимеризация аллиловых мономеров.I2 2I
Инициирование:
I + CH2
I
CH2
CH
CH
I
CH2Cl
CH2Cl + CH2
CH2
CH
CH
CH2Cl
I
CH2
CH
CH2Cl + CH2
I
CH2
CH2
CH2Cl + CH2
CH
CH
CH2Cl
H
полимеризация Должна быть, НО!!!
CHCl
CHCl
Неактивный аллильный радикал
Вырожденная (деградационная) передача цепи на
мономер, который превращается в неактивный
аллильный радикал, неспособный присоединять
к себе мономер.
Скорость квадратичного обрыва радикалов в этих
условиях много меньше скорости передачи цепи на
мономер, поэтому условие квазистационарности
записывается:
Vин=Vп
kин[I]=kпм[R ][M]
kин [ I ]
kин [ I ] V p k p
k пм
[R ]
k пм [ M ]
Pn
Vp
Vпм
kp
k пм
Мономер не участвует в полимеризации
41.
Полимеризация при термическоминициировании:
Vин=Vo
kин[M]2=ko[R ]2
1/ 2
kин
V p k p [ M ]
ko
2
k ин
[ R ] [ M ]
k
o
Pn
Vp
Vo
1/ 2
kp
( k ин ko )1 / 2
27
Полимеризация в присутствии ингибитора
Vин=Vo
Vp
kин[I]=ko[R ][Z]
kин [ I ]
k p [M ]
ko [ Z ]
[R ]
Pn
Vp
Vo
k ин [ I ]
ko [ Z ]
k p [M ]
ko [ Z ]
42.
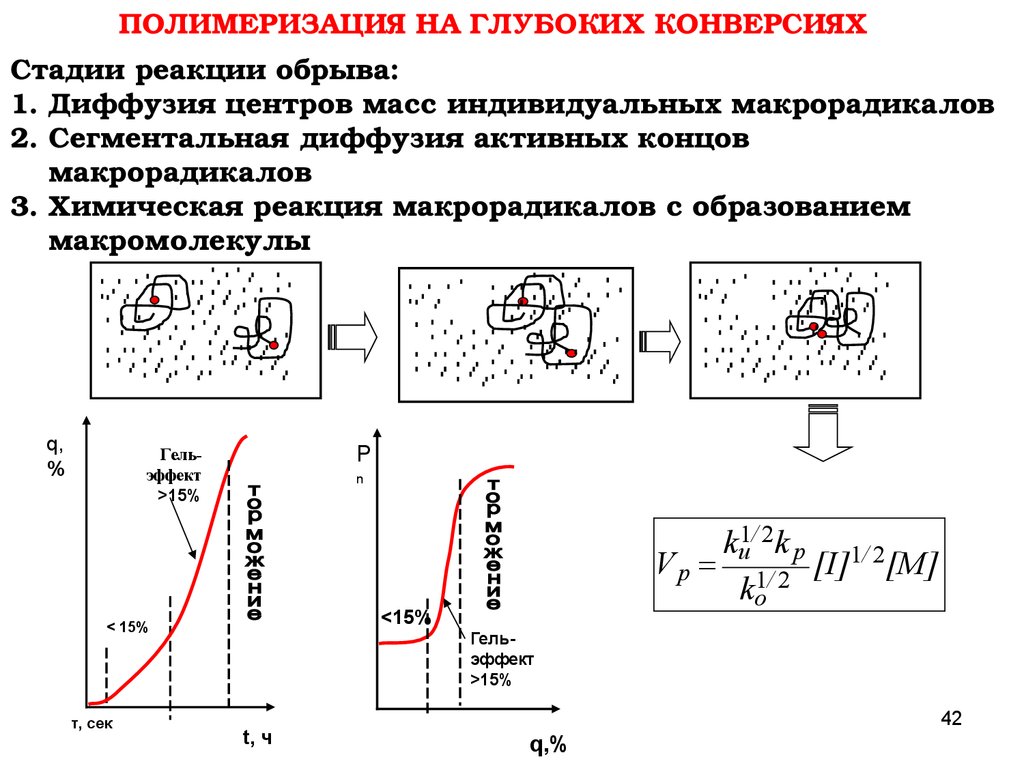
ПОЛИМЕРИЗАЦИЯ НА ГЛУБОКИХ КОНВЕРСИЯХСтадии реакции обрыва:
1. Диффузия центров масс индивидуальных макрорадикалов
2. Сегментальная диффузия активных концов
макрорадикалов
3. Химическая реакция макрорадикалов с образованием
макромолекулы
q,
%
P
Гельэффект
>15%
n
<15%
< 15%
τ, сек
kи1/ 2k p 1/ 2
V p 1/ 2 [I] [M]
ko
Гельэффект
>15%
t, ч
42
q,%
43.
• Ионная полимеризация44.
Анионнаяполимеризация
ИНИЦИИРОВАНИЕ
Инициируют металлалкилы, алкоксиды и амиды металлов, щелочи и
другие реагенты основного характера.
K+ + NH2-
KNH2
kèí
C4H9-Li + CH2=CH
C4H9 CH2 CH Li
C6H5
k
NH2- + CH2=CH è í
C6H5
NH2 CH2 CH
C6H5
C6H5
При использовании щелочных металлов или систем на основе щелочного
металла с полициклическими углеводородами (дифенил, нафталин,
антрацен) инициирование происходит по механизму переноса электрона. В
результате образуются анион-радикалы мономера, которые
рекомбинируют с образованием дианиона.
k
e
Na + CH2=CH è í
.
2 CH2
C6H5
CH Na
C6H5
.
CH2
CH Na
C6H5
Na CH
C6H5
CH2
CH2
CH Na
C6H5
44
45.
Анионная полимеризацияМономеры ( C=C)
Олефины с ярко выраженными электроноакцепторными свойствами:
CH2=C(X)Н (X NO2, COOR, CN, C6H5, арил, CH=CH2
C=О
Среди ненасыщенных кислородсодержащих мономеров
высокую активность проявляют альдегиды
Циклические мономеры
циклические простые эфиры: под действием основных
катализаторов полимеризуются лишь напряженные окиси
3 – 5-членные
циклические сложные эфиры (лактоны) и амиды
45
(лактамы)
46.
АНИОННАЯ ПОЛИМЕРИЗАЦИЯОсновные стадии полимеризации:
1. Инициирование
2. Рост цепи
3. Обрыв цепи
4. Передача цепи
часто отсутствуют, но характерны для
полярных сред и полярных мономеров
Инициирование
присоединение к мономеру :
а) части молекулы инициатора (A –B+) + M AM- + B+ (алкилы, алкоксиды
щелочных металлов)
Б) свободного аниона
A- + M AM- (NaNH2 в NH3 (жидк.))
в) перенос на молекулу мономера электрона с инициирующего анион-радикала
A. + M AM. (щелочные металлы с полициклическими ароматическими
углеводородами )
Г)металла
Ме + M Ме+ + M. (щелочные металлы в эфирных растворителях)
Аналогично катионной полимеризации в анионной полимеризации
могут участвовать несколько типов активных центров,
находящихся в равновесии друг с другом.
46
47.
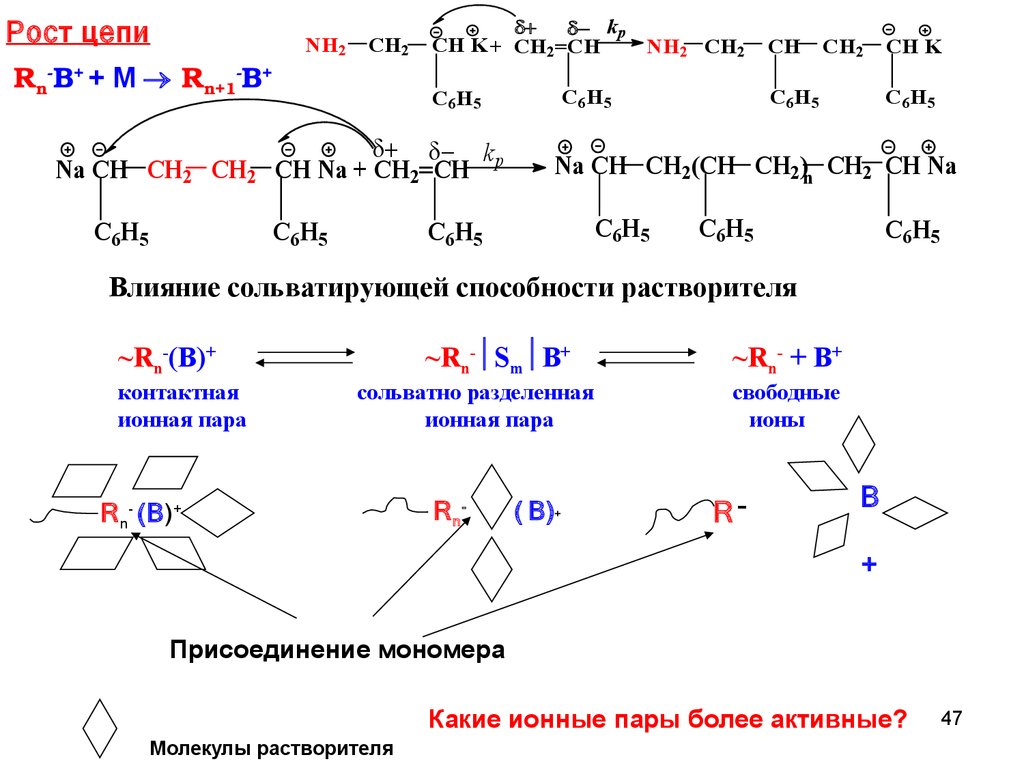
Рост цепиRnB+ + M Rn+1B+
Na CH CH2 CH2
C6H5
NH2
CH2
kp
CH K + CH2=CH
NH2 CH2
C6H5
C6H5
kp
CH Na + CH2=CH
C6H5
CH
CH2
C6H5
CH K
C6H5
Na CH CH2(CH CH2)n CH2 CH Na
C6H5
C6H5
C6H5
C6H5
Влияние сольватирующей способности растворителя
~Rn- Sm B+
~Rn-(B)+
контактная
ионная пара
сольватно разделенная
ионная пара
R n- (B)+
R n-
( B)+
~Rn- + B+
свободные
ионы
R-
B
+
Присоединение мономера
Какие ионные пары более активные?
Молекулы растворителя
47
48.
Реакции обрыва в анионной полимеризации1. перенос гидридиона с конца растущей цепи на противоион
(полимеризация акрилонитрила)
~(CH2-CH)n
CN
CH
CH Li
H
CN
CH
~(CH2-CH)n
CH + LiH
CN
CN
2. перенос гидридиона с конца растущей цепи на мономер
(винилхлорид, винилиденхлорид, хлоропрен – перенос хлорид иона)
~(CH2-CH)n
Cl
CH2
На мономер
~(CH2-CH)n
CH Li
CH
CH2 + LiCl
Cl
Cl
3. отрыв протона растущей цепью от растворителя (полимеризация
стирола или бутадиена в толуоле или жидком аммиаке)
NH2-(CH2-CH)n
C6H5
CH2
CH K
C6H5
H
NH2
NH2-(CH2-CH)n
C6H5
CH2
+
CH2 + K NH2
C6H5
Реакции обрыва в анионной полимеризации реализуются с очень
большим трудом, они энергетически не выгодны
48
живые цепи
49.
Полимеризация ненасыщенных углеводородов(стирол, диены)
отсутствие
реакций
кинетического
обрыва
цепи
при
незначительной роли или полном отсутствии актов передачи цепи. Живые
цепи, способные к реакции роста вплоть до исчерпания мономера.
Кинетика такого процесса определяется соотношением констант
скоростей инициирования kи и роста цепи kp.
При kи >> kp
Vp = kp[M][I]0
Все цепи зарождаются практически одновременно. Образующиеся
полимеры характеризуются узким ММР (Mw/Mn~1).
Pn=nq[M]0/[I]0,
q – конверсия, n – число растущих концов в макромолекуле (n=1 или 2).
При kи << kp процесс протекает нестационарно и образующиеся
полимеры характеризуютя широким ММР.
49
50.
Катионная полимеризацияЭлектронная плотность на кратных связях в большей мере влияет на
активность мономеров, чем пространственные факторы.
C=C
Полимеризуются
только
олефины
с
ярко
выраженными
электронодонорными свойствами заместителей у кратной связи: простые
виниловые эфиры, 1,1-дизамещенные этилены, стирол
C=О
Среди ненасыщенных кислородсодержащих
активность проявляют альдегиды: формальдегид
мономеров
высокую
Циклические мономеры
Активность мономеров повышается с увеличением напряженности цикла:
циклоалканы , циклические простые эфиры, циклические сложные эфиры
(лактоны) и амиды (лактамы)
50
51.
КАТИОННАЯ ПОЛИМЕРИЗАЦИЯОсновные стадии полимеризации :
1. Инициирование
2. Рост цепи
3. Обрыв цепи
в ряде случаев могут отсутствовать
4. Передача цепи
Инициирование – 1) образование
первичных активных частиц:
а) катионы, реагирующие свободно или в составе
ионной пары
б) цвиттер-ионы (кислота Льюиса BF3 и мономер,
содержащий гетероатом, например, триоксан)
в) ион-радикалы (под действием излучения)
г) координационные комплексы, не имеющие ярко
выраженного ионного характера
и 2)
Активность этих частиц
различна.
В зависимости от условий
возможно одновременное
образование
первичных
частиц разного типа или
их переход друг в друга.
их присоединение к мономеру
51
52.
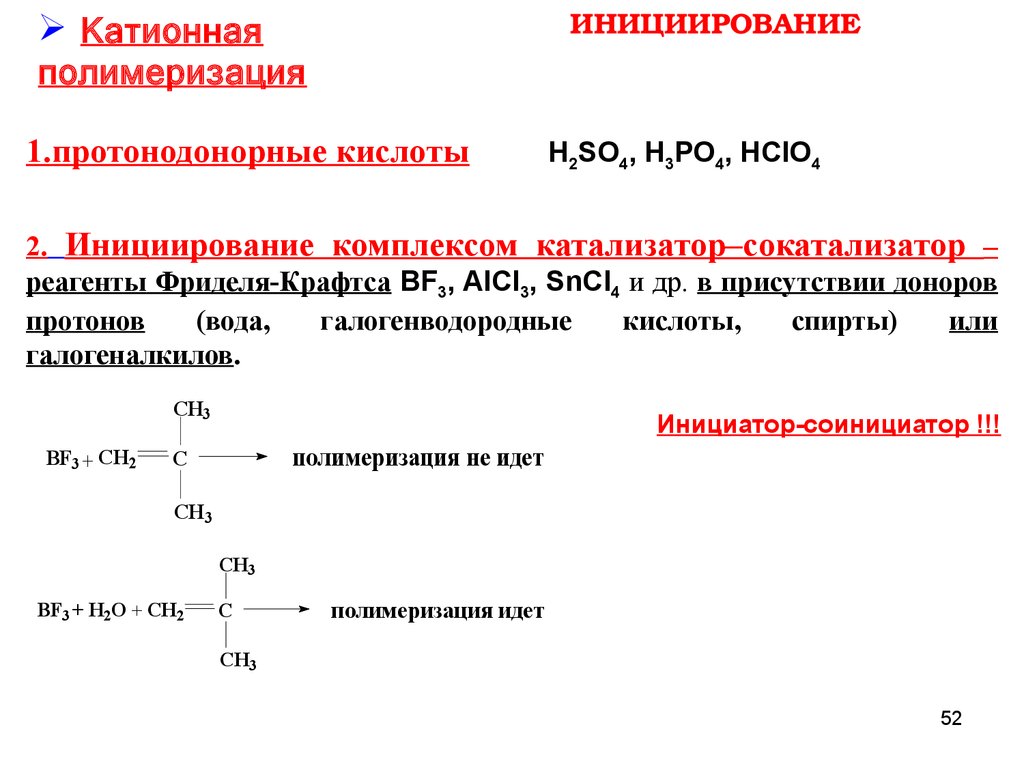
ИНИЦИИРОВАНИЕКатионная
полимеризация
1.протонодонорные кислоты
H2SO4, H3PO4, HClO4
2. Инициирование комплексом катализатор–сокатализатор –
реагенты Фриделя-Крафтса BF3, AlCl3, SnCl4 и др. в присутствии доноров
протонов
(вода,
галогенводородные
кислоты,
спирты)
или
галогеналкилов.
CH3
BF3 + CH2
Инициатор-соинициатор !!!
полимеризация не идет
C
CH3
CH3
BF3 + H2O + CH2
C
полимеризация идет
CH3
52
53.
Присоединение первичных активных частиц к мономеруK+ + M KM+
Структура KM+ зависит от природы первичной частицы и мономера,
а реакционная способность определяется его устойчивостью.
Если M ненасыщенное соединение, то при реакции с K+ образуется
карбкатион; если M гетероциклическое соединение, то могут
образовываться другие катионы , например, оксониевые и др.).
CH2
CH
+ H
[ClO4]
kèí
HCH2
OC4H9
O
O+ R
O + R+
O
[ClO4]
карбкатион
OC4H9
O
CH
O
Оксониевый катион
53
54.
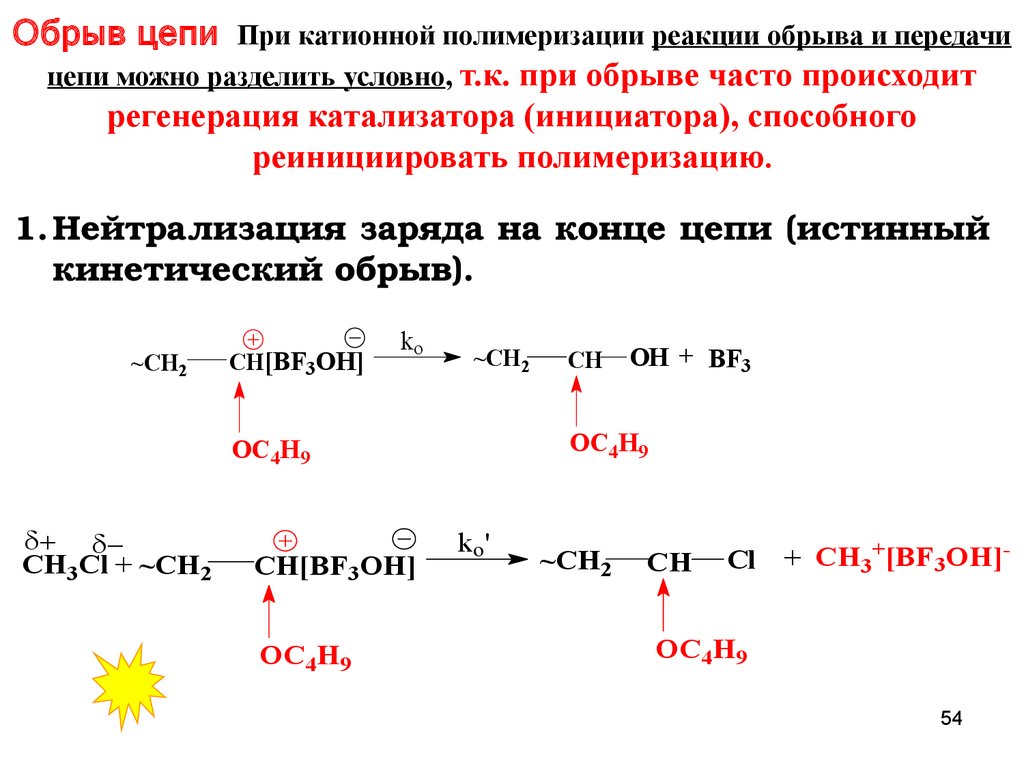
Обрыв цепи При катионной полимеризации реакции обрыва и передачицепи можно разделить условно, т.к. при обрыве часто происходит
регенерация катализатора (инициатора), способного
реинициировать полимеризацию.
1. Нейтрализация заряда на конце цепи (истинный
кинетический обрыв).
~CH2
CH[BF3OH]
ko
~CH2
CH[BF3OH]
OC4H9
OH + BF3
OC4H9
OC4H9
CH3Cl + ~CH2
CH
ko'
~CH2
CH
Cl
+ CH3+[BF3OH]-
OC4H9
54
55.
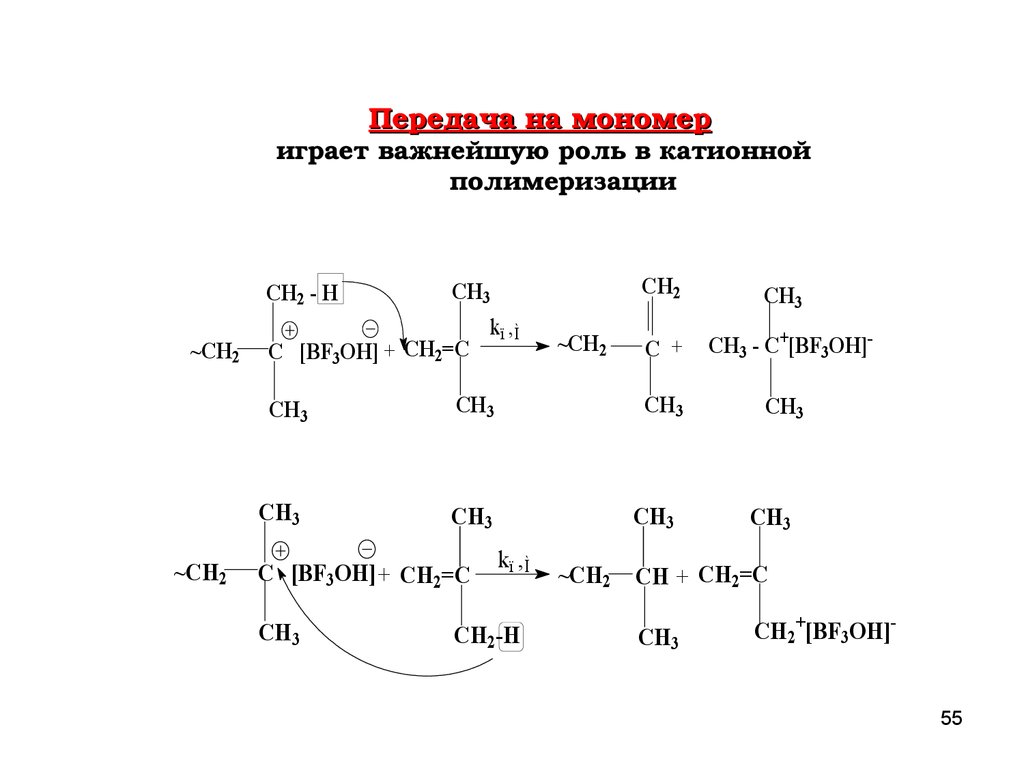
Передача на мономериграет важнейшую роль в катионной
полимеризации
CH2 - H
~CH2
C [BF3OH] + CH2=C
CH3
CH3
~CH2
kï ,Ì
~CH2
CH3
k ï ,Ì
CH2-H
~CH2
CH3
C +
CH3 - C+[BF3OH]-
CH3
CH3
CH3
CH3
C [BF3OH] + CH2=C
CH3
CH2
CH3
CH3
CH + CH2=C
CH3
CH2+[BF3OH]55
56.
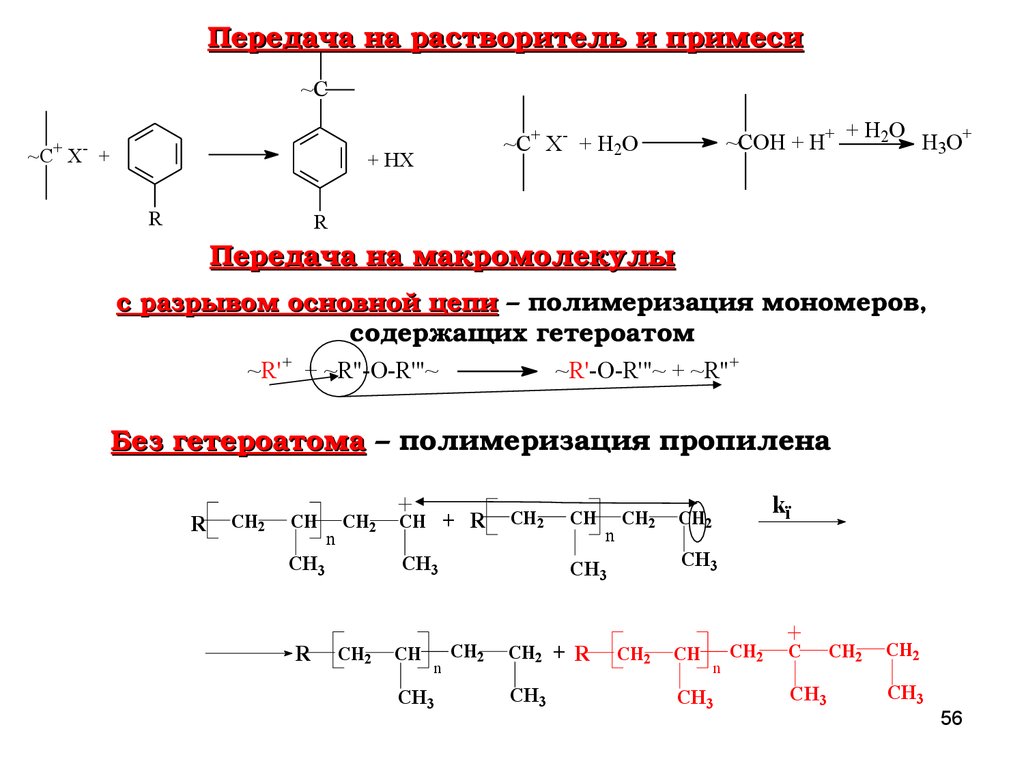
Передача на растворитель и примеси~C
+
-
~C X +
+ HX
R
~COH + H+
~C+ X- + H2O
+ H2O
H 3O +
R
Передача на макромолекулы
с разрывом основной цепи – полимеризация мономеров,
с разрывом основной цепи
содержащих гетероатом
~R'+ + ~R"-O-R'"~
~R'-O-R'"~ + ~R"+
Без гетероатома – полимеризация пропилена
Без гетероатома
R
CH2
CH
n
CH2
CH2
CH3
CH3
R
CH + R
CH2
CH
CH3
n
CH
n
CH2
CH3
CH3
CH2
CH2 + R
CH3
kï
CH2
CH2
CH
CH3
n
CH2
C
CH3
CH2
CH2
CH3
56
57.
СОПОЛИМЕРИЗАЦИЯ – совместная полимеризация 2х или более мономеров (классификацияРаспределение звеньев в макромолекулах сополимеров
~M1M1M2M1M2M2M1M1M1M2M1M1M2 ~
Статистические
сополимеры:
в
макромолекуле
сополимера
распределение мономерных звеньев описывается известным законом
статистики
Чередующиеся (для 2-х мономерных
сополимера мономерные звенья чередуются
~ M1M2M1M2M1M2M1M2M1M2M1M2~
звеньев):
в
макромолекуле
Периодические: упорядоченная последовательность из более, чем двух
мономерных звеньев
~ M1M2М3M1M2М3M1M2М3M1M2М3M1M2М3M1M2М3~
57
58. сополимеризация
Градиентные: состав макромолекулы изменяется непрерывно вдоль цепи~ M1M1М2M1M1М1M1M2М1M1M2М2M1M1М2M2M2М2~
Блок-сополимеры: линейные макромолекулы с длинными (полимерными)
блоками одинаковых звеньев, разделенными длинными (полимерными)
блоками других звеньев
~M1M1M1M1M1M1M1M1M1M1M1M1M2M2M2M2M2M2M2M2~
Привитые сополимеры: разветвленные макромолекулы, у которых
основная цепь состоит из звеньев одного мономера, а к ней ковалентно
присоединены одна или более боковых макромолекул, построенных из звеньев
другого мономера
~M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1~
M2M2M2M2M2M2M2M2M2M2M2M2M2M2~
59.
Различают :Композиционная неоднородность
макромолекул сополимеров
Мгновенную неоднородность, которая возникает в
результате статистического характера реакций обрыва цепи.
Конверсионную неоднородность, обусловленную
изменением
состава
мономерной
смеси
в
ходе
сополимеризации (кроме азеотропной сополимеризации).
При азеотропной сополимеризации составы
сополимера и мономерной смеси не меняются по ходу
реакции и остаются равными исходному составу
мономерной смеси, что приводит к получению продуктов,
композиционная неоднородность которых минимальна и
связана только с ее мгновенной составляющей.
59
60. Композиционная неоднородность макромолекул сополимеров
Эксплуатационныесвойства
сополимеров зависят от:
бинарных
среднего состава сополимера,
композиционной неоднородности
распределения мономерных
макромолекулах.
звеньев
в
Состав отдельной макромолекулы может
отличаться от среднего состава всего
образца, что приводит к композиционной
неоднородности сополимера.
61.
Реакция роста цепиКинетика реакции роста цепи определяет состав сополимеров
и весь комплекс их химических и физикомеханических свойств
Концевая модель (Майо и Льюис, Алфрей и Голдфингер)
учитывает влияние концевого звена на реакционную
способность
активного
центра
по
отношению
к
молекулам мономеров.
M1* + M1 M1M1* k11
V p ,11 k11[ M 1* ][ M 1 ]
M1* + M2 M1M2* k12
V p ,12 k12 [ M 1* ][ M 2 ]
M2* + M2 M2M2* k22
V p , 22 k 22 [ M 2* ][ M 2 ]
M2* + M1 M2M1* k21
V p , 21 k 21[ M 2* ][ M 1 ]
d[M 1 ]
[m1 ] V p ,11 V p , 21 k11 [ M 1* ][ M 1 ] k 21[ M 2* ][ M 1 ]
dt
d[M 2 ]
[m2 ] V p , 22 V p ,12 k 22 [ M 2* ][ M 2 ] k12 [ M 1* ][ M 2 ]
dt
m1 k11 [ M 1* ][ M 1 ] k 21 [ M 2* ][ M 1 ]
m2 k 22 [ M 2* ][ M 2 ] k12 [ M 1* ][ M 2 ]
61
62.
Допущения для вывода уравнения состава сополимераPn >>1 (действительно реакция полимеризации)
Реакционная способность M1* и M2* не зависит от Pn
Условие квазистационарности: Vp,12=Vp,21 k12[M1*][M2]= k21[M2*][M1]
малые конверсии
Уравнение описывает состав «мгновенного» сополимера, образующегося на
начальных конверсиях, когда изменением концентраций мономеров можно
пренебречь.
k11
[M 1 ] [M 2 ]
m1 [ M 1 ] k12
[ M 1 ] r1 [ M 1 ] [ M 2 ]
m2 [ M 2 ] k 22
[ M 2 ] r2 [ M 2 ] [ M 1 ]
[M 2 ] [M 1 ]
k 21
r и r – константы сополимеризации
1
2
k 22
r2
k 21
k11
r1
k12
k11, k22 – константы скорости присоединения радикала к своему мономеру
k12, k21 – константы скорости присоединения радикала к чужому мономеру
62
63.
Диаграмма составов сополимеровr 1= k 11 / k 12
r 2 = k 22 / k 21
1 ,0
состав сополимера, [m
1
]
1
3
4
2
0 ,5
5
0
0,5
1 ,0
состав смеси мономеров, [M1]
1) r1>1, r2<1
2) r1<1, r2>1
3) r1=1, r2=1
4) r1<1, r2<1
5) r1 >1, r2>1
Если r1>1 и r2<1, то сополимер обогащен
звеньями М1
Если r1<1 и r2>1, то сополимер обогащен
звеньями М2
Если r1=r2=1, то состав сополимера всегда равен
составу исходной смеси.
Если r1<1 и r2<1, то при малых содержаниях M1
в исходной смеси мономеров сополимер обогащен
звеньями М1, а при больших — звеньями M2
(тенденция к чередованию в сополимере звеньев
М1 и М2, которая тем больше, чем ближе к нулю
значения r1 и r2).
Если r1>1 и r2>1, то наблюдается тенденция к
раздельной полимеризации мономеров в смеси.
Если кривая состава пересекает диагональ
диаграммы составов; в точке пересечения,
называемой азеотропной, состав сополимера
63
равен составу сомономерной смеси.
64.
Радикальная сополимеризацияЗначения
r1 , r2 и состав сополимера обычно слабо
зависят от природы растворителя и мало меняются с
температурой.
Исключение составляют
явления, связанные c донорноакцепторными взаимодействиями
реагентов. Если один из мономеров оказывается сильным донором,
а другой – сильным акцептором, образуются чередующиеся
сополимеры.
Дополнительно
еще
сказываются
и
стерические
затруднения
Стирол – малеиновый ангидрид
r1=0
r2=0
сополимеризация ионогенных мономеров в зависимости от pH
Акриловая кислота – акриламид
pH =2
pH =9
r1=0.9
r1=0.3
r2=0.25,
r2=0.95
64
65.
Реакционная способность мономеровТеория идеальной реакционной способности – учёт только энергии сопряжения
в мономерах и радикалах.
в рамках этой теории
r1 r2=1, т.е. константы скоростей присоединения одного
из мономеров к обоим радикалам в одинаковое число раз больше констант
скоростей присоединения другого мономера к этим радикалам.
Чаще всего r1 r2<1, что связано с большим вкладом
полярных эффектов
стерических эффектов
М1
М2
r1
r2
стирол
бутадиен
0.80
1.12
стирол
ММА
0.52
0.46
стирол
винилацетат
55
0.01
стирол
Малеиновый ангидрид 0
0
винилацетат
винилхлорид
0.23
1.70
МА
винилхлорид
9
0.08
65
66.
Схема Q-eПолуэмпирическая схема, предложенная Алфреем и Прайсом,
используется для количественной характеристики реакционной
способности мономеров в радикальной сополимеризации.
k11 P1Q1 exp( e12 )
k 22 P2Q2 exp( e22 )
k12 P1Q2 exp( e1e2 )
k 21 P2Q1 exp( e2 e1 )
r1
k11 Q1
exp[ e1 ( e1 e2 )]
k12 Q2
r2
k22 Q2
exp[ e2 ( e2 e1 )]
k 21 Q1
Рi и Qj – параметры, соответствующие энергиям
сопряжения в радикале и мономере.
еi и еj учитывает поляризацию мономеров
(электронодонорный (e<0) или электроноакцепторный
(e>0) характер заместителей при двойной связи
мономера )
Величины Q и e вычисляют из опытных значений r1 и
r2.
Для стирола принято Q = 1 и е = 0,8.
66
67.
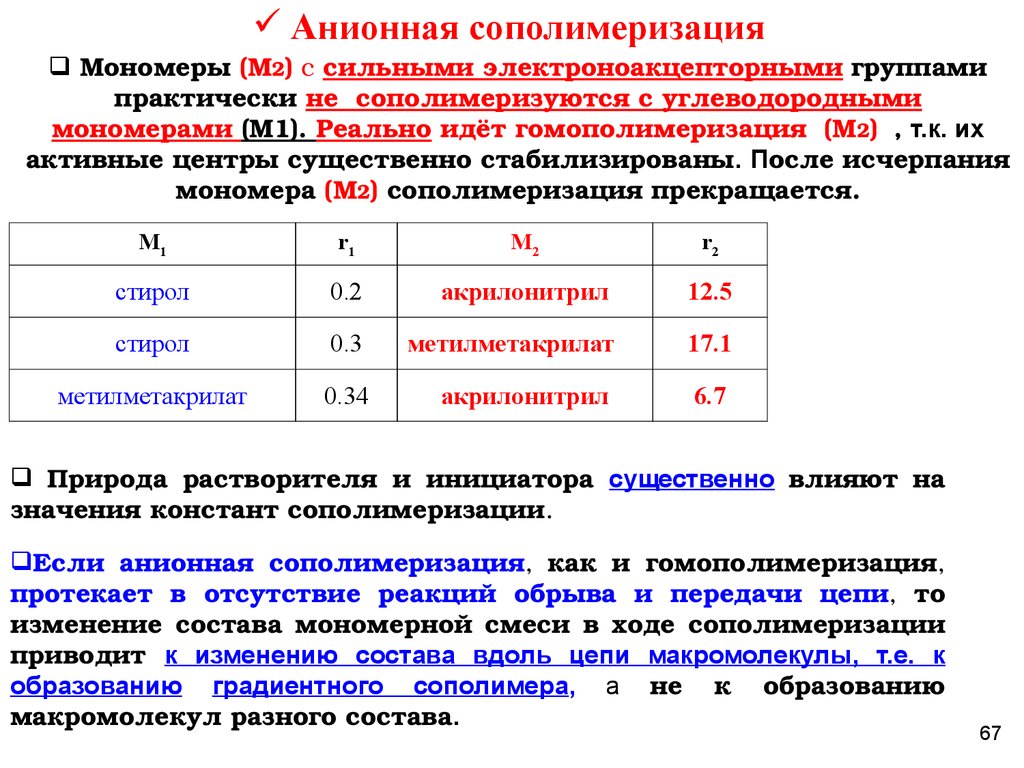
Анионная сополимеризацияМономеры (М2) с сильными электроноакцепторными группами
практически не сополимеризуются с углеводородными
мономерами (М1). Реально идёт гомополимеризация (М2) , т.к. их
активные центры существенно стабилизированы. После исчерпания
мономера (М2) сополимеризация прекращается.
M1
r1
M2
r2
стирол
0.2
акрилонитрил
12.5
стирол
0.3
метилметакрилат
17.1
метилметакрилат
0.34
акрилонитрил
6.7
Природа растворителя и инициатора существенно влияют на
значения констант сополимеризации.
Если анионная сополимеризация, как и гомополимеризация,
протекает в отсутствие реакций обрыва и передачи цепи, то
изменение состава мономерной смеси в ходе сополимеризации
приводит к изменению состава вдоль цепи макромолекулы, т.е. к
образованию градиентного сополимера, а не к образованию
макромолекул разного состава.
67
68.
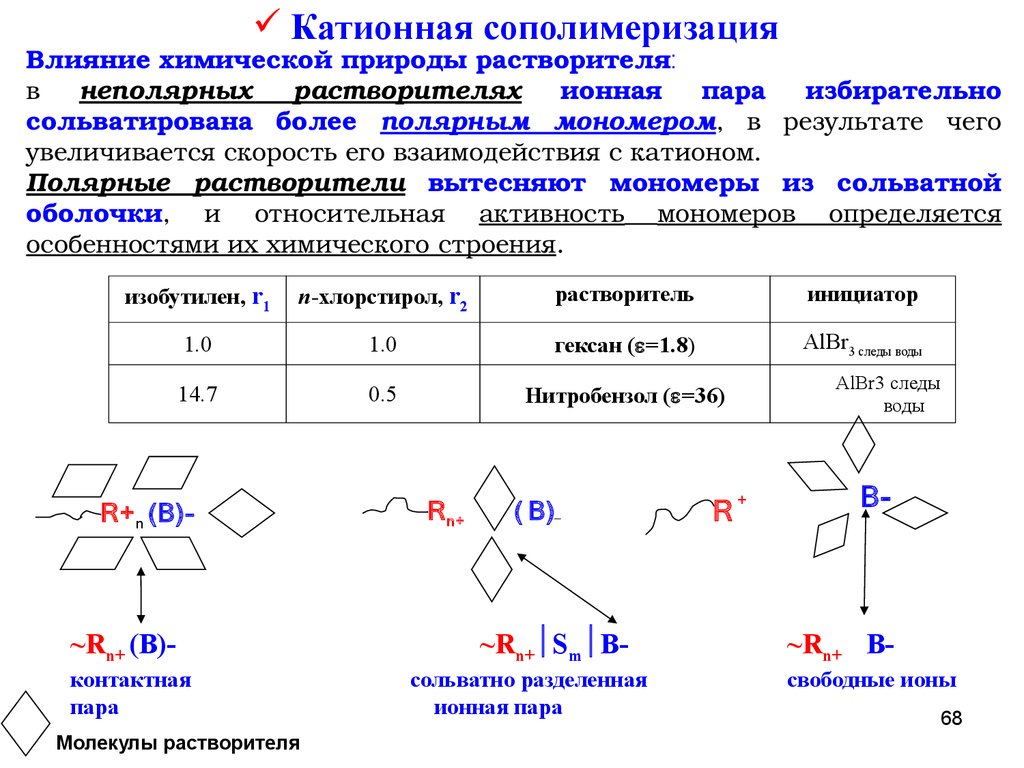
Катионная сополимеризацияВлияние химической природы растворителя:
в неполярных растворителях ионная пара избирательно
сольватирована более полярным мономером, в результате чего
увеличивается скорость его взаимодействия с катионом.
Полярные растворители вытесняют мономеры из сольватной
оболочки, и относительная активность мономеров определяется
особенностями их химического строения.
изобутилен, r1
п-хлорстирол, r2
растворитель
инициатор
1.0
1.0
гексан ( =1.8)
AlBr3 следы воды
14.7
0.5
Нитробензол ( =36)
R+ n (B)-
~Rn+ (B)контактная
пара
Молекулы растворителя
R n+
( B)_
~Rn+ Sm Bсольватно разделенная
ионная пара
R
AlBr3 следы
воды
+
B-
~Rn+ Bсвободные ионы
68
69.
Влияние природы противоиона: более характерно для неполярных
растворителей,
в полярных растворителях в ряде случаев
вообще не проявляется, т.к. в полярных
растворителях
ионы
разделены,
а
сольватная
оболочка
не
содержит
мономеров.
Стирол/
пметилстирол
Инициатор
содержание стирола в
(со следами
сополимере, %
воды)
толуол =2.4 нитробензол =36
SbCl5
AlBr3
SnCl4
46
34
28
28
28
27
70. поликонденсация
7071. Сравнительные характеристики реакций полимеризации и поликонденсации полимеризация поликонденсация
Сравнительные характеристики реакций полимеризации иполиконденсации
полимеризация
1. цепная реакция
присоединения активных
центров (радикалов, анионов ,
катионов) к кратным связям
мономеров.
2.не выделяется
низкомолекулярное вещество.
3. молекулярная масса
образующегося полимера
практически не зависит от
конверсии.
4. практически нет
промежуточных олигомеров.
поликонденсация
• 1.Ступенчатая реакция между
функциональными группами
многофункциональных
мономеров.
• 2.выделяется
низкомолекулярное вещество,
которое необходимо удалять
из реакционной среды.
• 3.молекулярная масса
полимера зависит от
конверсии, от константы
равновесия, от Са\Св, от конц.
низкомолекулярного вещества.
• 4. промежуточные олигомеры
стабильны и способны к
дальнейшим реакциям.
72.
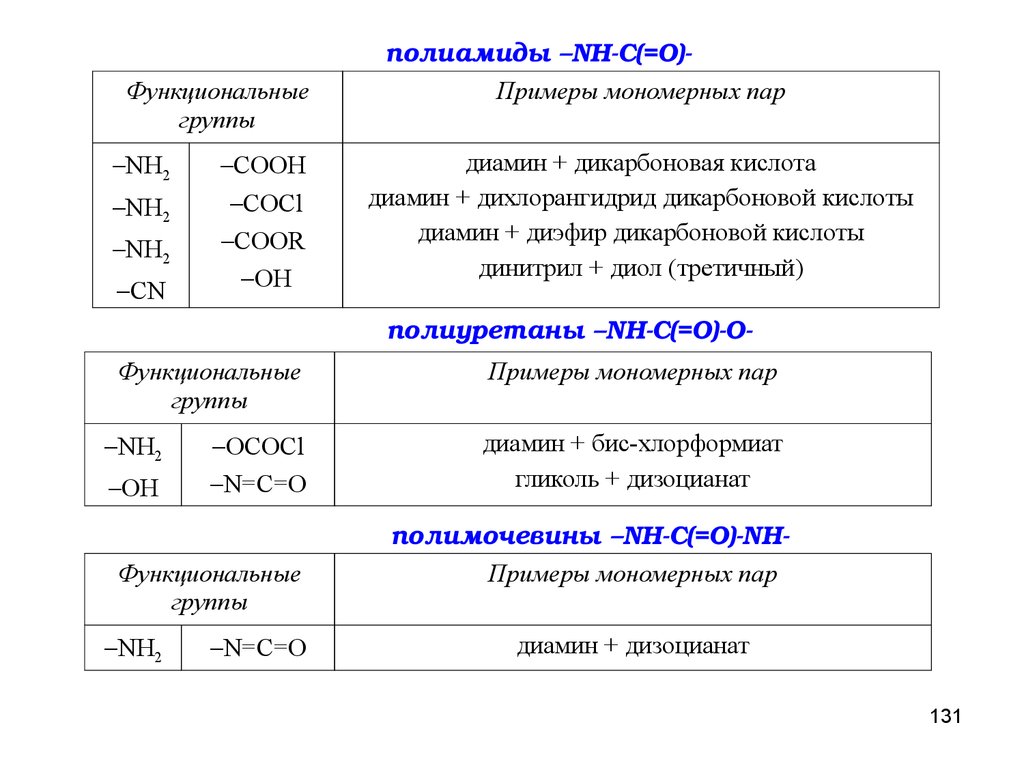
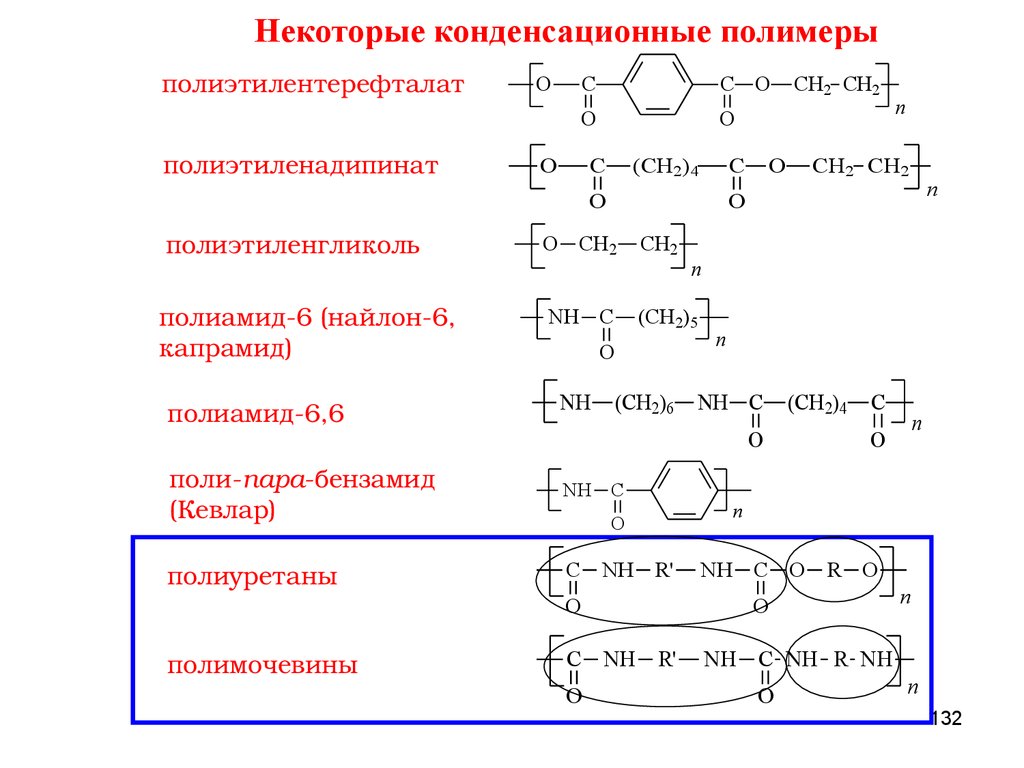
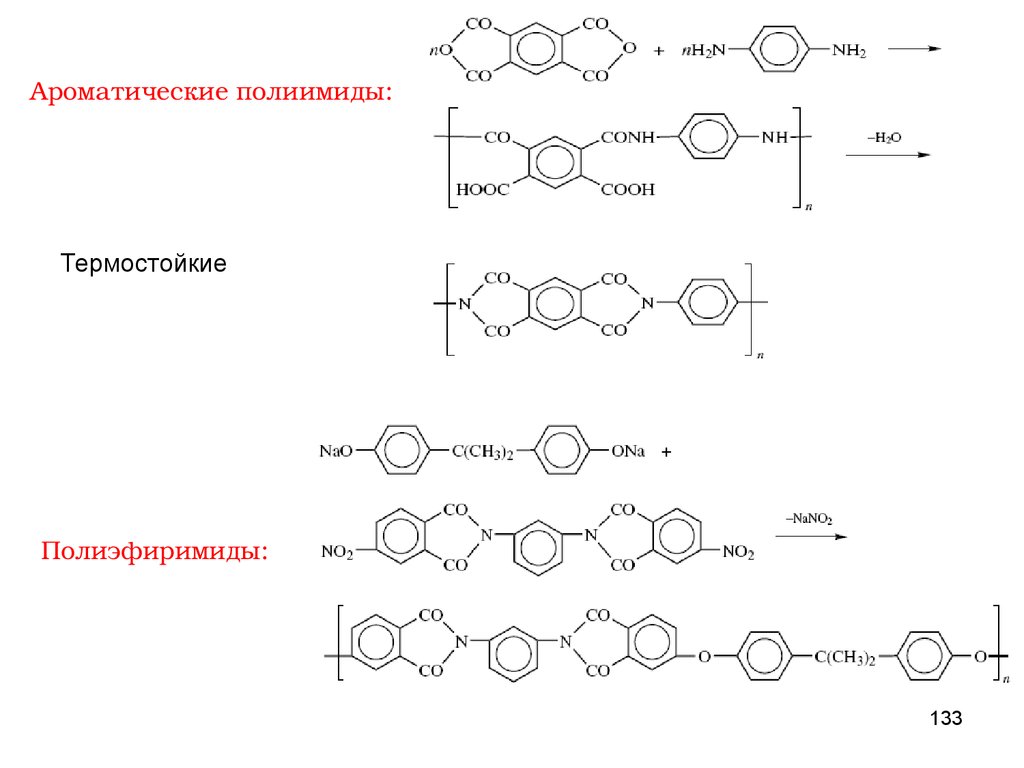
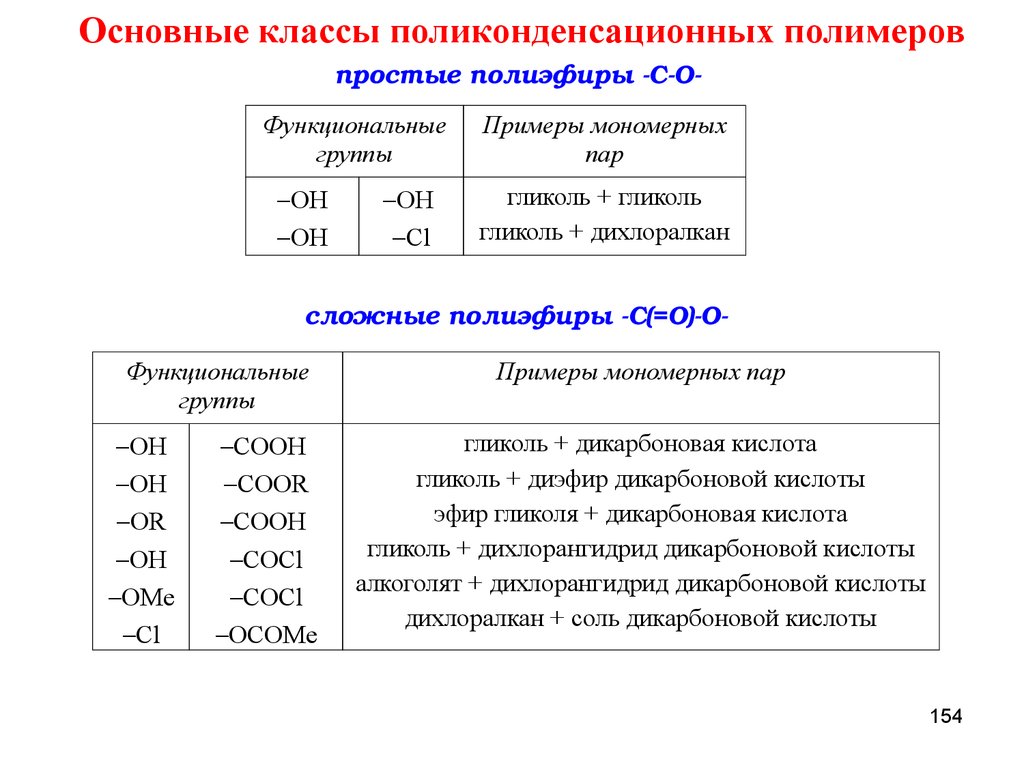
ПОЛИКОНДЕНСАЦИЯПоликонденсация – процесс образования макромолекул в результате
ступенчатого химического взаимодействия функциональных групп
многофункциональных мономеров и
реакции, а также молекул
n-меров, накапливающихся в ходе
n-меров между собой.
По типу участвующих в реакции мономеров мономеров поликонденсацию
подразделяют на:
ГОМОПОЛИКОНДЕНСАЦИЮ (1 мономер)
простые полиэфиры
n CH2
CH2
OH
OH
H+
o
TC
полиамиды
n NH2
CH2
R COOH
H+
o
CH2
NH
O
R
TC
n NH2
R COCl
H+
ToC
n H2 O
n +
CO
n H2O
n +
O
NH
R
CO
n HCl
n +
72
73.
СОПОЛИКОНДЕНСАЦИЮ (2 и болеемономеров)
простые полиэфиры
OH
R OH + OH R"
OH
O R O
R"
n+
n H2O
полиамиды
NH2
R COOH + NH2
R" COOH
NH
R
CO
NH
R"
O
NH2
R COCl + NH2
R" COCl
NH
R
CO
O
CO
O
NH
R"
CO
O
+ n H2O
n
+ n HCl
n
73
74.
ONH2
R
NH2
C
+
R'
O
R
NH2
полиамиды
R
- HCl
R'
C
C
R' C
O
O
RO
NH
Cl
O
C
+
Êàò., To
C
Cl
NH2
O
NH
Êàò., To
OR - ROH
сложные полиэфиры
O
HO
R
OH
+
O
C
R'
C
Cl
Cl
O
HO
R
+
OH
O
C
R'
C
OH
R"O
R
OR"
O
+
R'
HO
O
R
O
C
O
C
- HCl
Êàò., To
OH - H2O
O
C
Êàò., To
Êàò., To
OH - R"OH
R'
C
O
n
74
75.
ИНТЕРСОПОЛИКОНДЕНСАЦИЮ (3 мономера)полиамиды
NH2
R
NH2
+ NH2
O
R" NH2 +
O
C
R'
OH
NH
R
NH
C
O
R'
C
O
C
OH
NH R" NH C
O n
75
76.
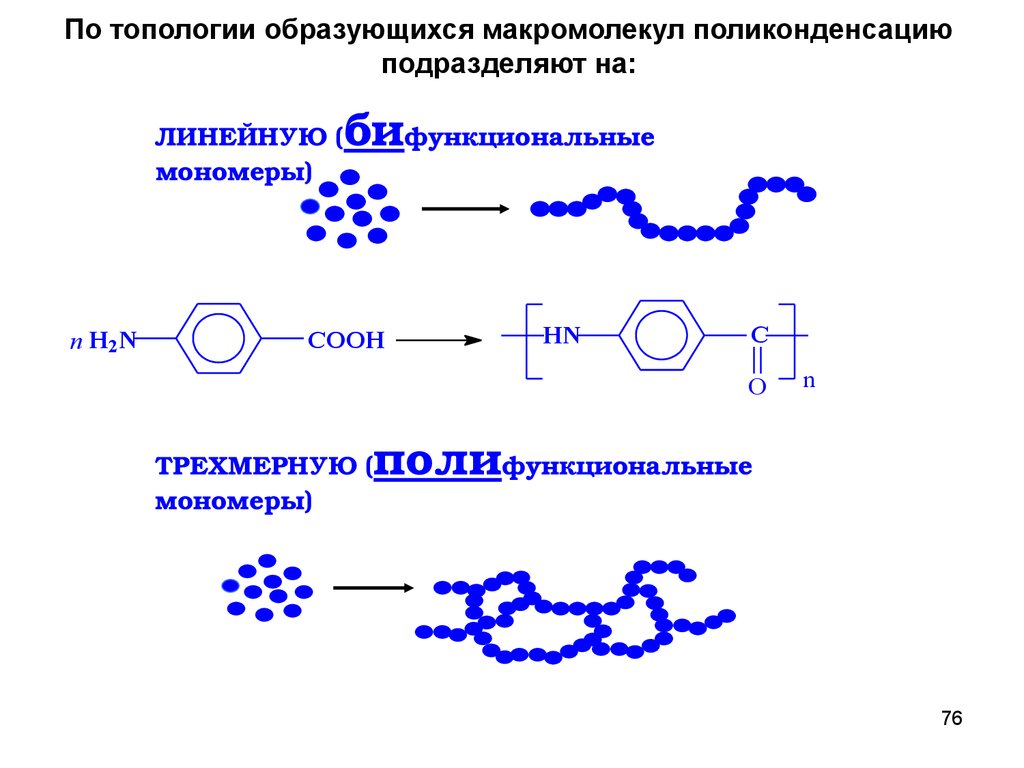
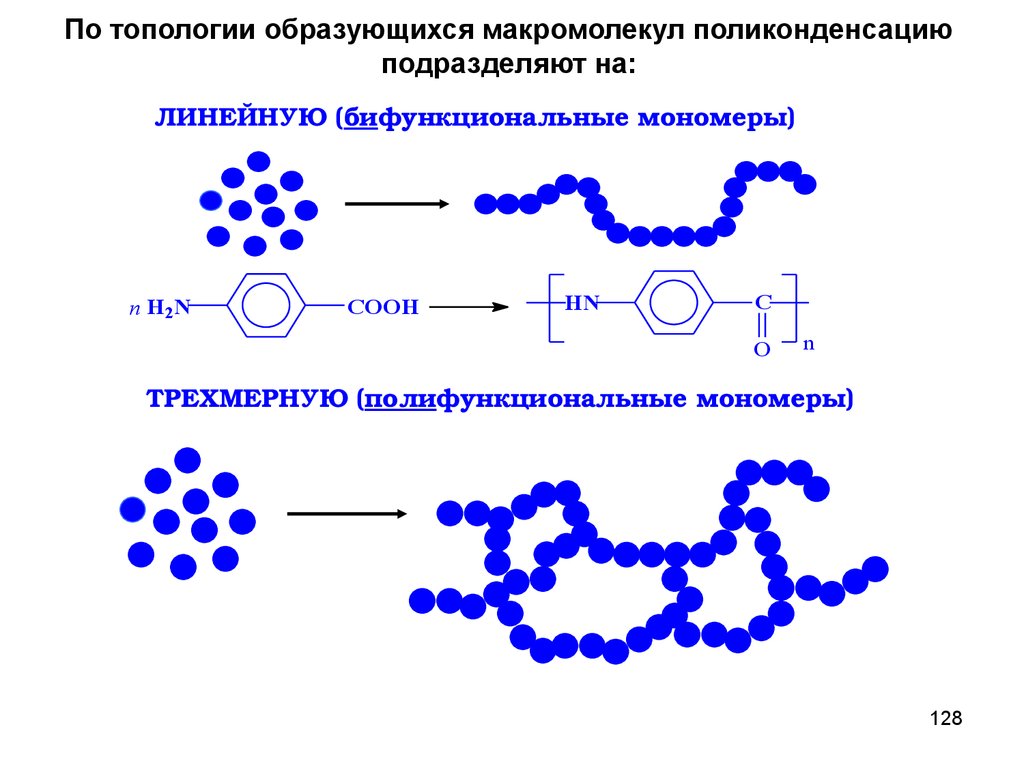
По топологии образующихся макромолекул поликонденсациюподразделяют на:
ЛИНЕЙНУЮ (
мономеры)
n H2N
бифункциональные
COOH
HN
C
O
n
полифункциональные
ТРЕХМЕРНУЮ (
мономеры)
76
77.
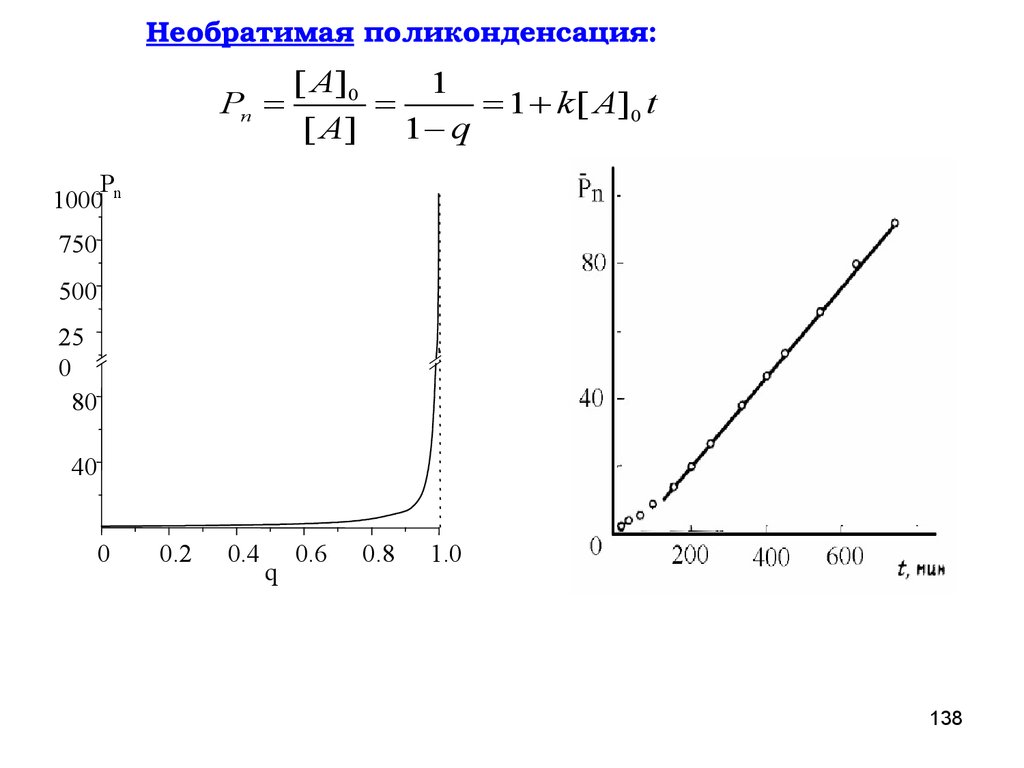
По значению константы поликонденсационного равновесияполиконденсацию подразделяют на:
n A+ n B
k1
k-1
A B A B A B
K
K = k1/k-1
равновесную (обратимую)
K 10 100
Степень завершенности реакции и степень
полимеризации лимитируются равновесными
концентрациями реагентов и продуктов реакции
неравновесную (необратимую)
К 103
Степень завершенности реакции и степень
полимеризации лимитируются не
термодинамическими, а кинетическими факторами
77
78.
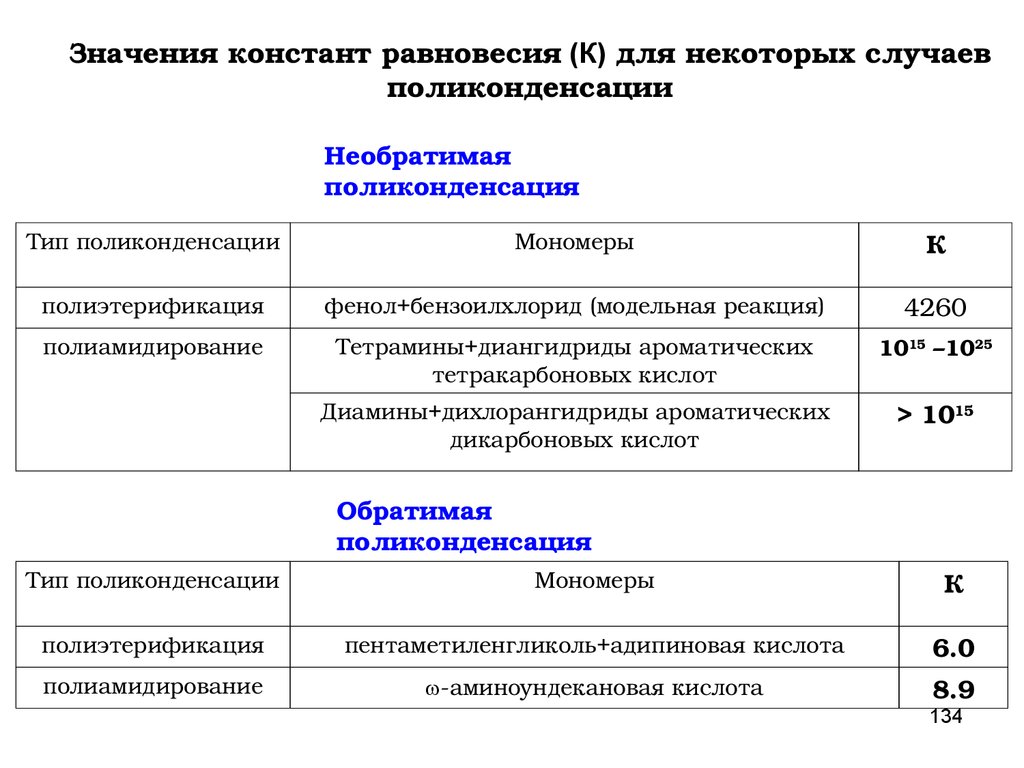
Значения констант равновесия (К) для некоторыхслучаев поликонденсации
Необратимая поликонденсация
Тип
поликонденсации
Мономеры
К
полиэтерификация
бисфенол+бисбензоилхлорид (модельная
реакция)
4260
полиамидирование
Тетрамины+диангидриды ароматических
тетракарбоновых кислот
1015 –1025
Диамины+дихлорангидриды
ароматических дикарбоновых кислот
> 1015
Обратимая поликонденсация
Тип
поликонденсации
Мономеры
К
полиэтерификация
пентаметиленгликоль+адипиновая кислота
6.0
полиамидирование
аминоундекановая кислота
8.9
78
79.
Побочные химические реакции , в результате которыхфункциональные группы утрачивают способность участвовать в
реакции роста.
1.
Взаимодействие
функциональных
групп
мономеров
с
монофункциональным
соединением, присутствующим в виде примеси
или сп





































































































































 chemistry
chemistry








