Similar presentations:
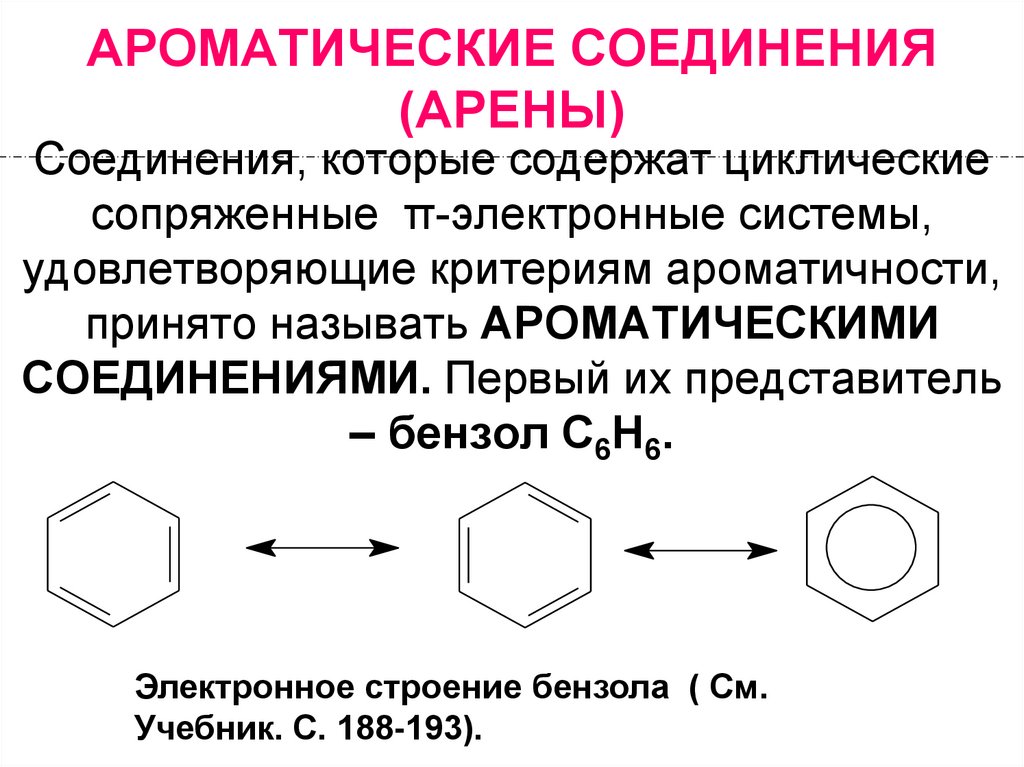
Ароматические соединения (арены)
1. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ (АРЕНЫ)
Соединения, которые содержат циклическиесопряженные π-электронные системы,
удовлетворяющие критериям ароматичности,
принято называть АРОМАТИЧЕСКИМИ
СОЕДИНЕНИЯМИ. Первый их представитель
– бензол С6Н6.
Электронное строение бензола ( См.
Учебник. С. 188-193).
2. Ароматичность как особое химическое качество характерно не только для бензола. Существуют соединения, не относящиеся к ряду
бензола, нообладающие ароматическими свойствами.
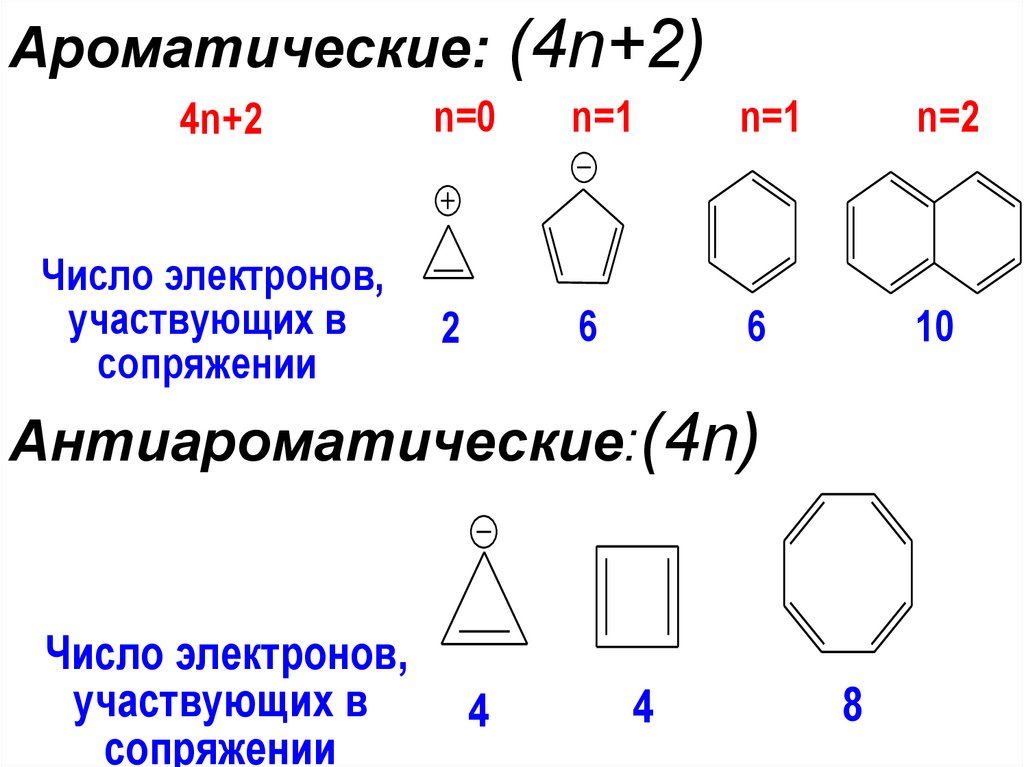
Правило ароматичности (правило Э.Хюккеля) :
Плоские циклические соединения,
содержащие замкнутую
сопряженную систему с (4n+2)
электронами, где n = 0,1,2,3 …,
являются ароматическими.
π-
3.
• Соединения, содержащие 4n πэлектронов в замкнутойсопряженной системе, являются
антиароматическими.
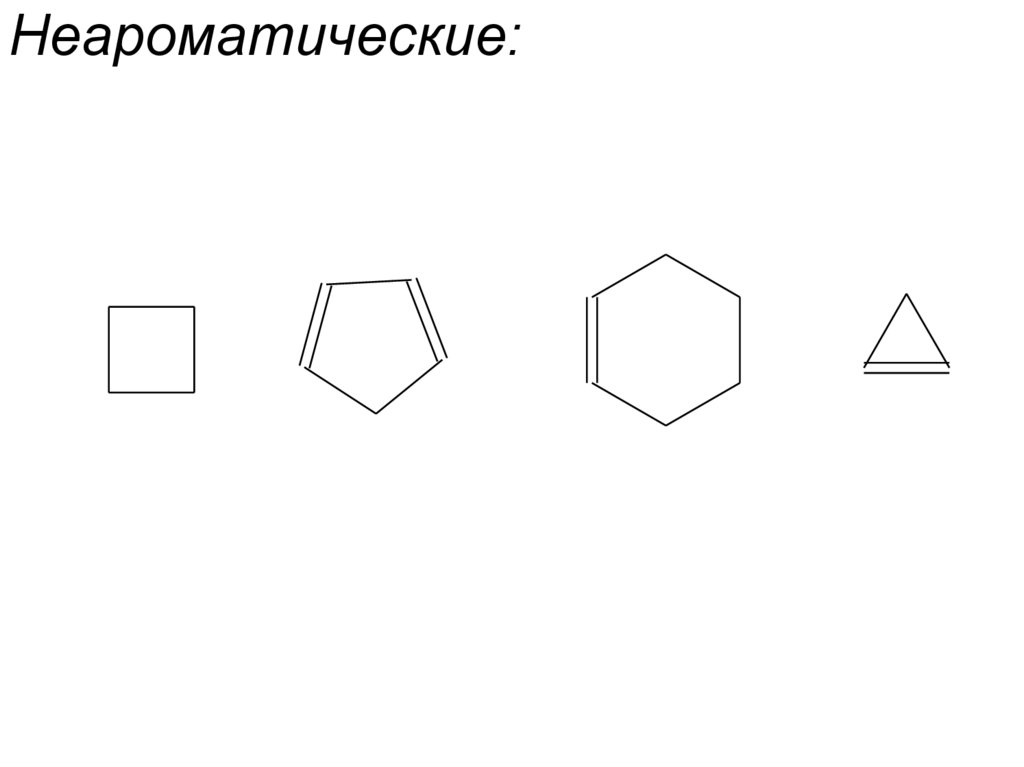
• Соединения,в которых отсутствует
циклическая система сопряженных
двойных связей, называют
неароматическими.
4. Ароматические: (4n+2)
4n+2Число электронов,
участвующих в
сопряжении
n=0
n=1
n=1
n=2
2
6
6
10
Антиароматические:(4n)
Число электронов,
участвующих в
сопряжении
4
4
8
5. Неароматические:
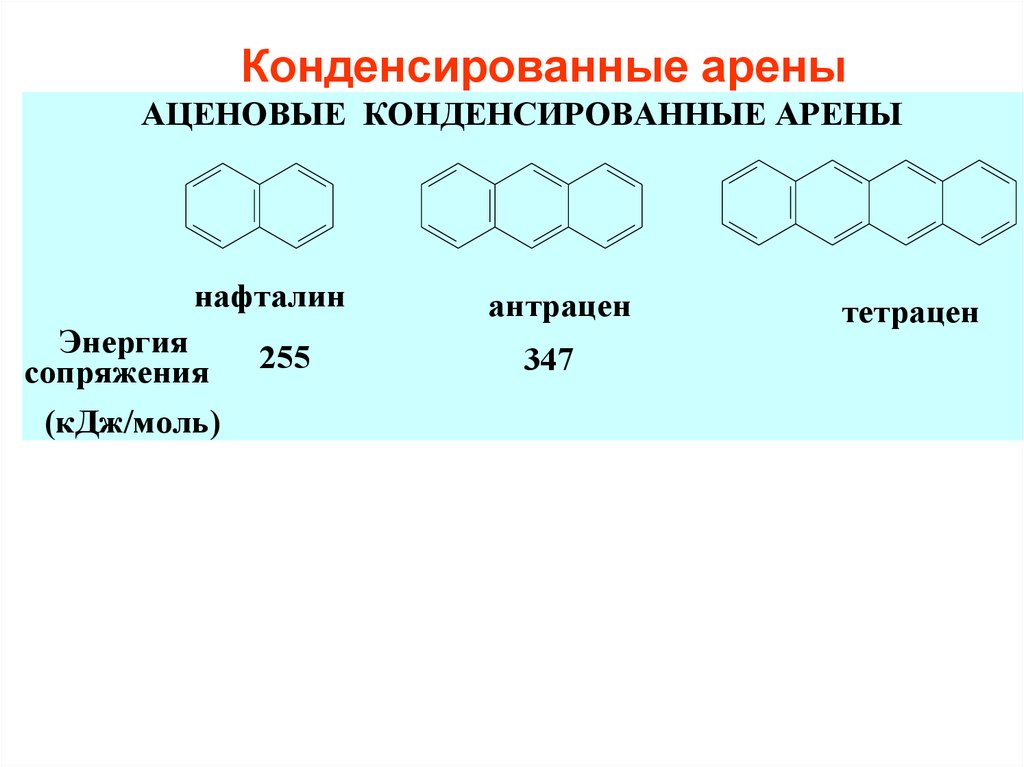
6. Конденсированные арены
АЦЕНОВЫЕ КОНДЕНСИРОВАННЫЕ АРЕНЫнафталин
Энергия
сопряжения
(кДж/моль)
255
антрацен
347
тетрацен
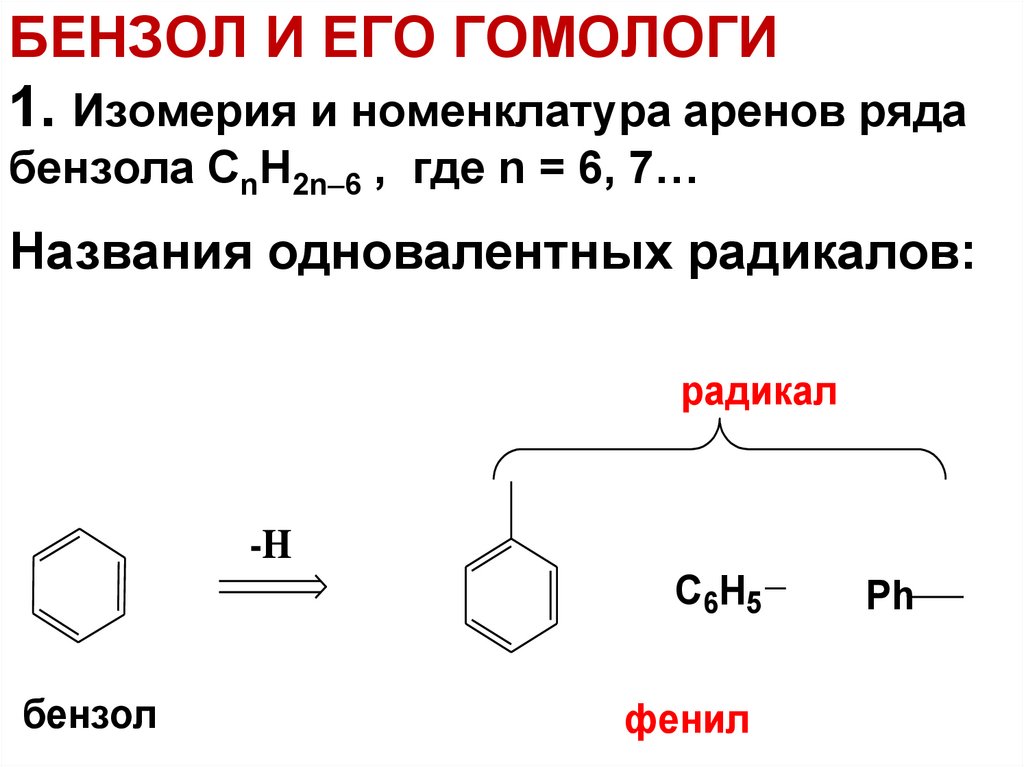
7. БЕНЗОЛ И ЕГО ГОМОЛОГИ 1. Изомерия и номенклатура аренов ряда бензола СnH2n6 , где n = 6, 7…
БЕНЗОЛ И ЕГО ГОМОЛОГИ1. Изомерия и номенклатура аренов ряда
бензола СnH2n 6 , где n = 6, 7…
Названия одновалентных радикалов:
радикал
-H
C6H5
бензол
фенил
Ph
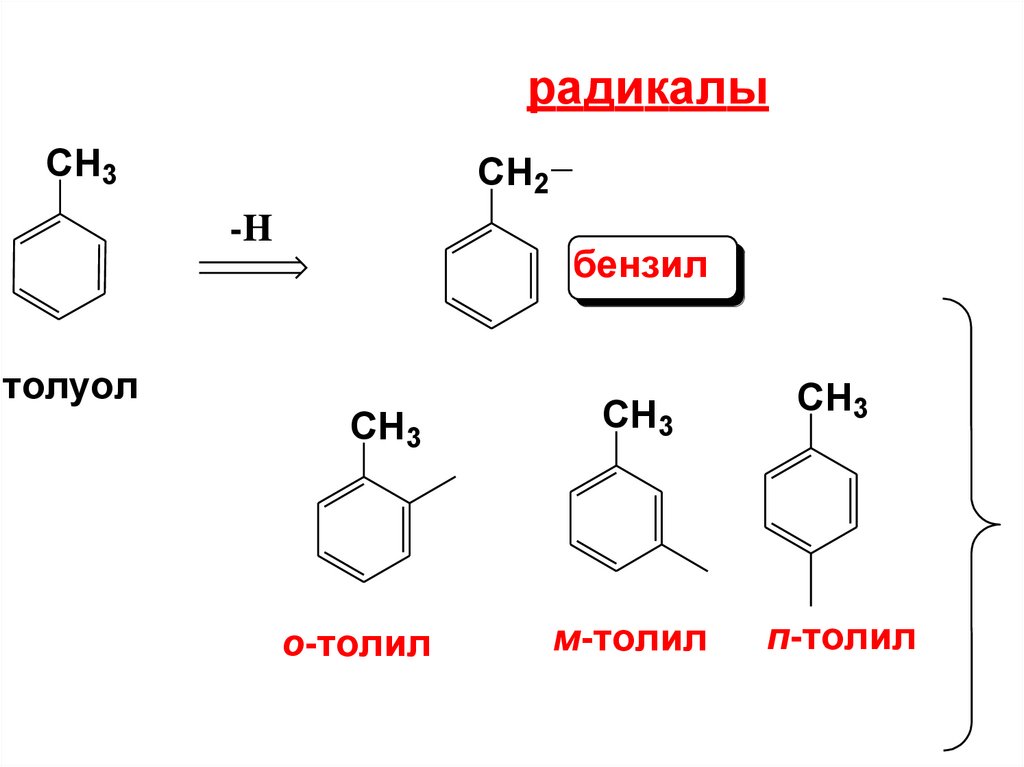
8.
радикалыCH3
CH2
-H
бензил
толуол
CH3
о-толил
CH3
CH3
м-толил
п-толил
9.
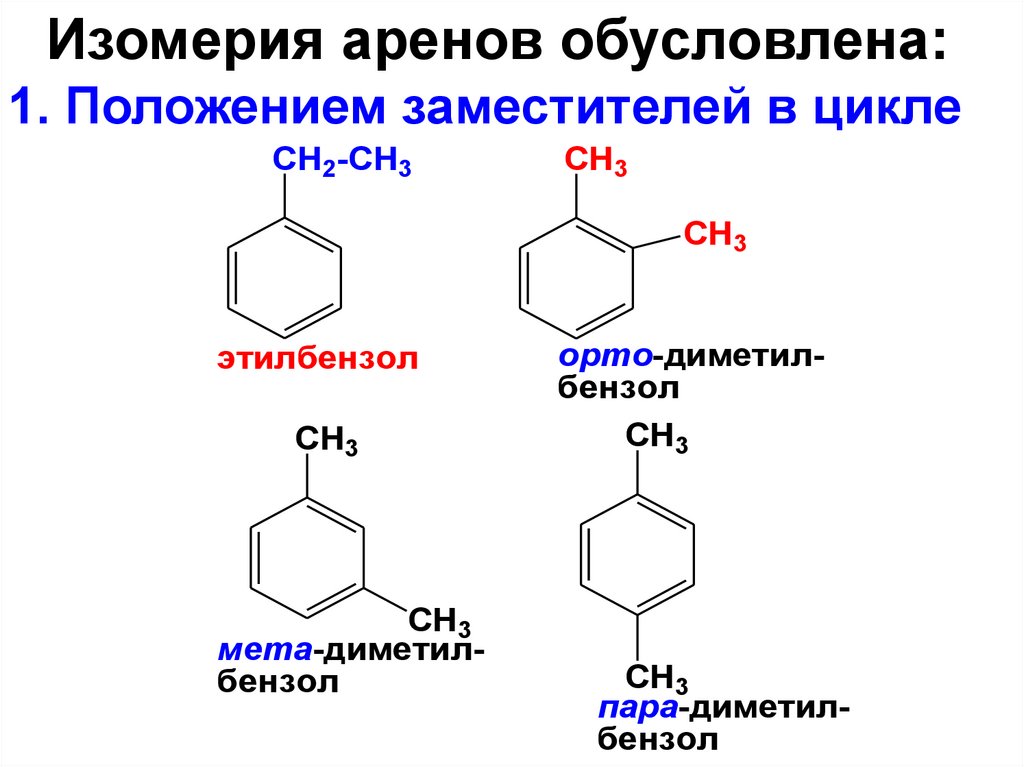
Изомерия аренов обусловлена:1. Положением заместителей в цикле
CH2-CH3
CH3
CH3
этилбензол
CH3
CH3
мета-диметилбензол
орто-диметилбензол
CH3
CH3
пара-диметилбензол
10.
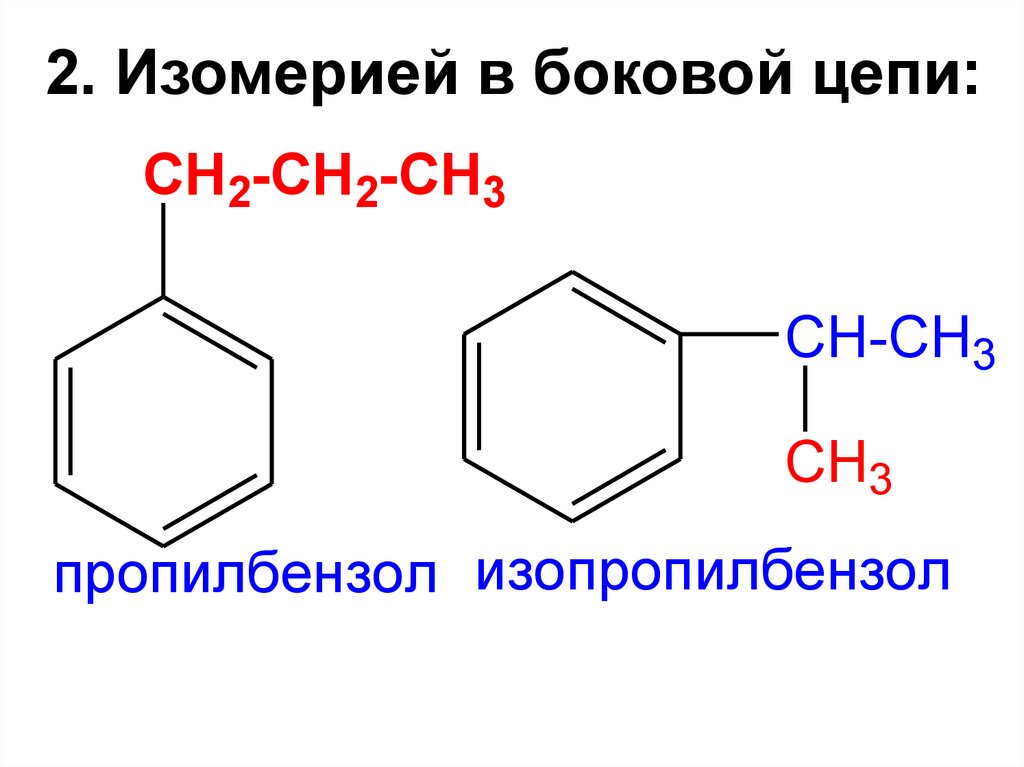
2. Изомерией в боковой цепи:CH2-CH2-CH3
CH-CH3
CH3
пропилбензол изопропилбензол
11. СПОСОБЫ ПОЛУЧЕНИЯ
• Ряд промышленных способов основан напереработке угля и нефти.
• Из 1 т угля в процессе коксования получают:
Продукт
Количество (кг)
Каменноугольная смола
55
бензол
0,9
нафталина
2,3
толуол
0,2
ксилолы
0,045
12.
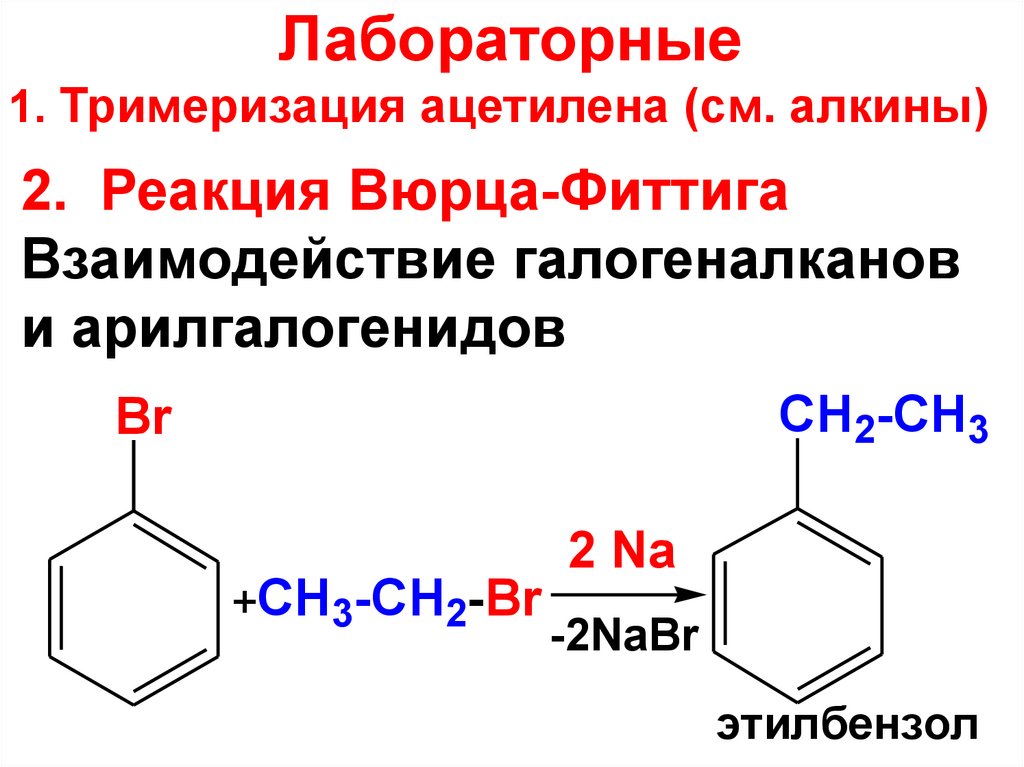
Лабораторные1. Тримеризация ацетилена (см. алкины)
2. Реакция Вюрца-Фиттига
Взаимодействие галогеналканов
и арилгалогенидов
CH2-CH3
Br
+CH3-CH2-Br
2 Na
-2NaBr
этилбензол
13.
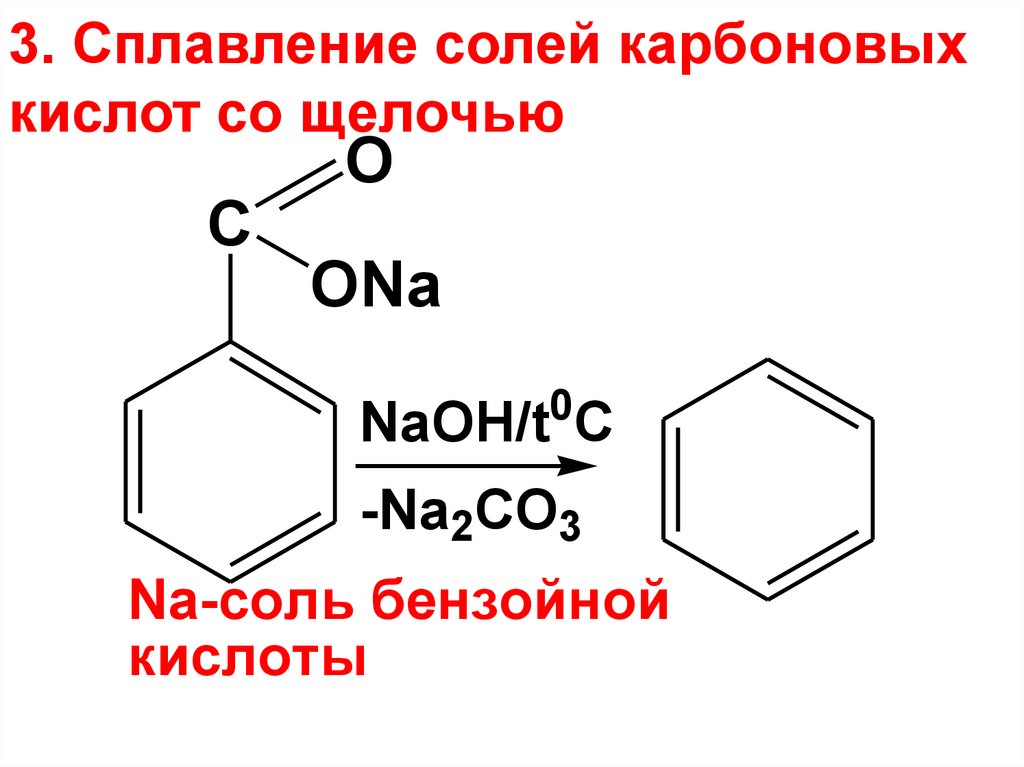
3. Сплавление солей карбоновыхкислот со щелочью
C
O
ONa
0
NaOH/t C
-Na2CO3
Na-соль бензойной
кислоты
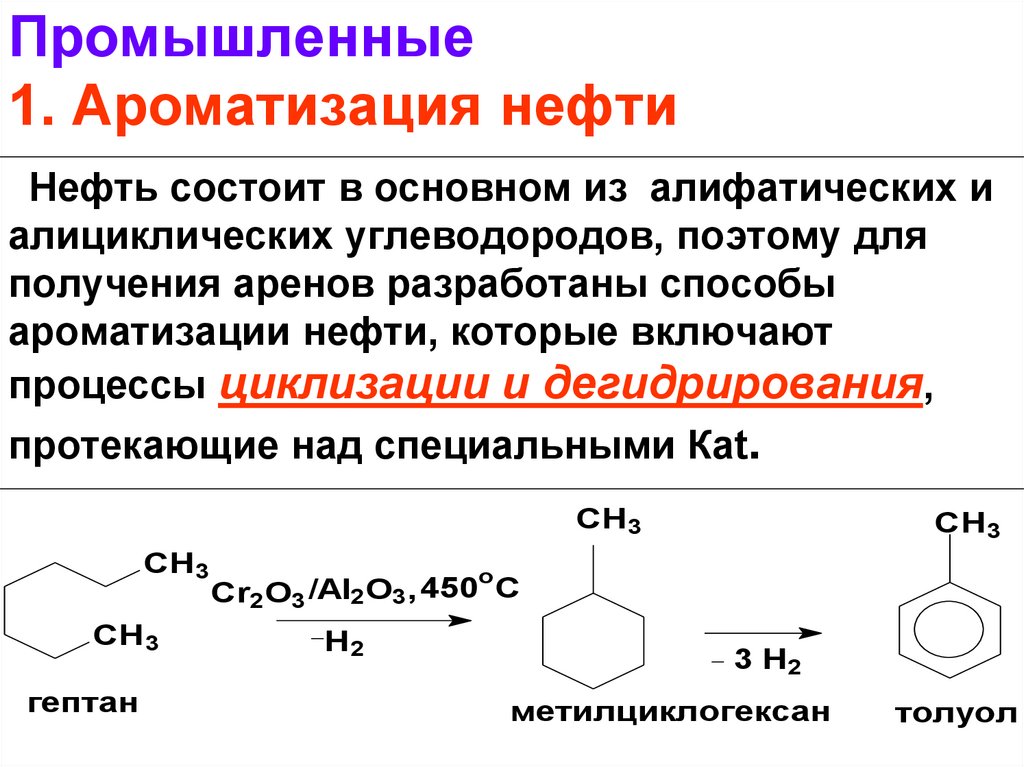
14. Промышленные 1. Ароматизация нефти
Нефть состоит в основном из алифатических иалициклических углеводородов, поэтому для
получения аренов разработаны способы
ароматизации нефти, которые включают
процессы циклизации и дегидрирования,
протекающие над специальными Кat.
СН3
CH3
o
Cr2O3 /Al2O3, 450 С
CH3
H2
гептан
CH3
3 H2
метилциклогексан
толуол
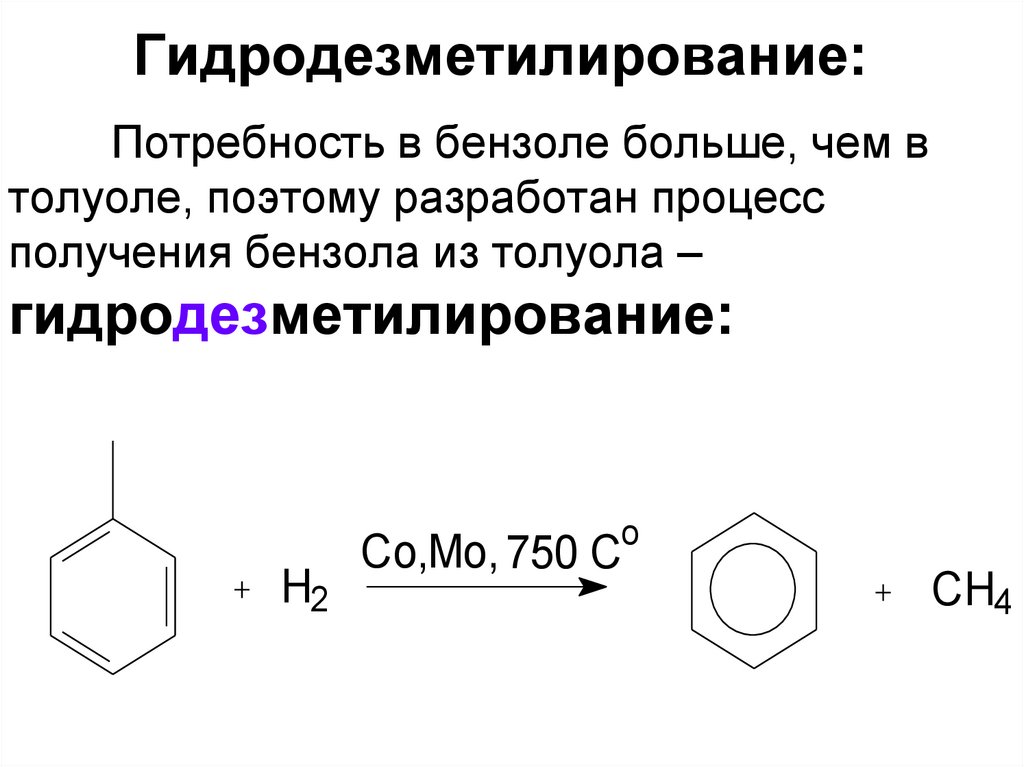
15. Гидродезметилирование:
Потребность в бензоле больше, чем втолуоле, поэтому разработан процесс
получения бензола из толуола –
гидродезметилирование:
o
H2
Co,Mo, 750 C
CH4
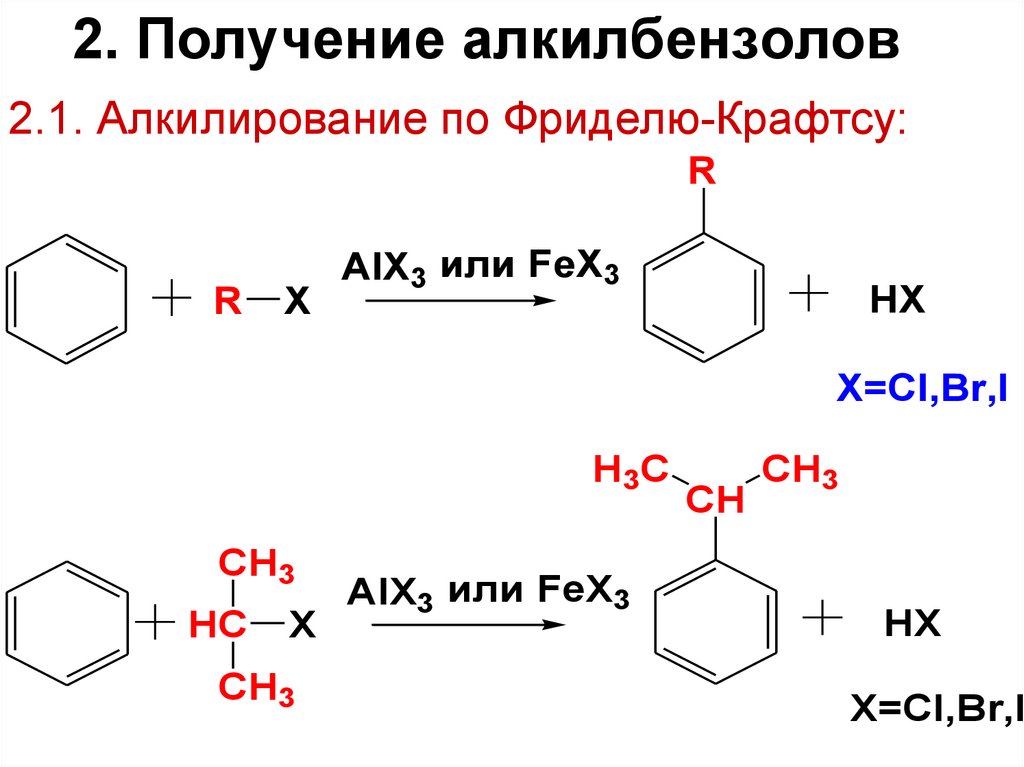
16. 2. Получение алкилбензолов
2.1. Алкилирование по Фриделю-Крафтсу:R
R
X
AlX3 или FeX3
HX
X=Cl,Br,I
H3C
CH3
HC
X
CH3
AlX3 или FeX3
CH
CH3
HX
X=Cl,Br,I
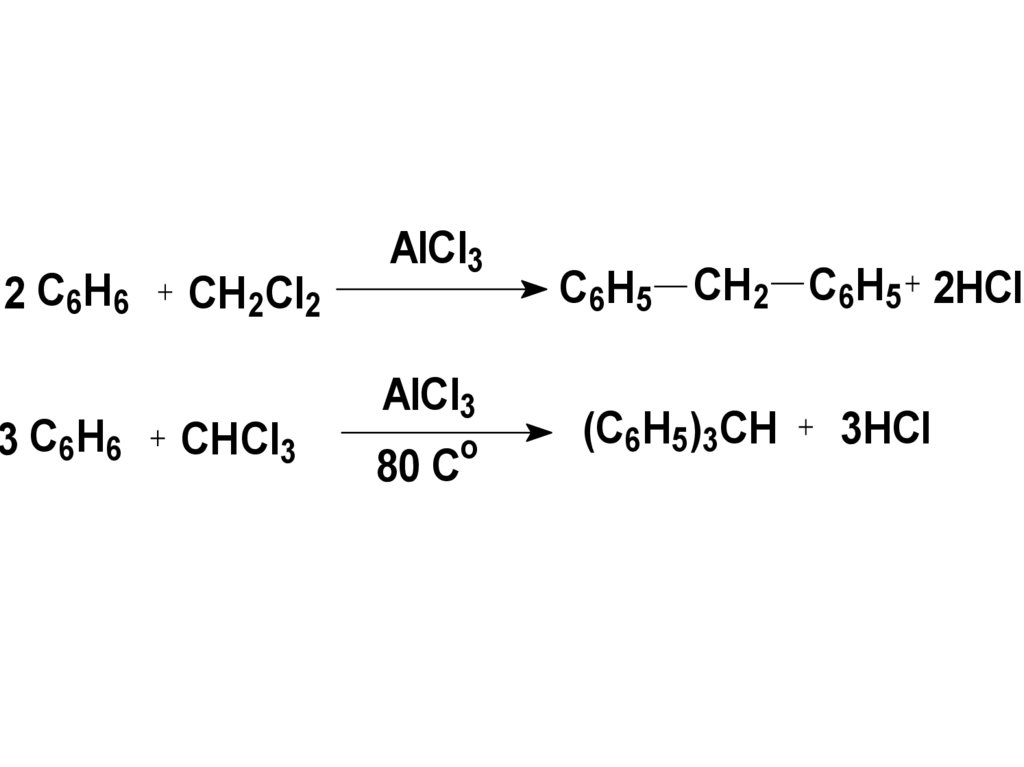
17.
2 C6H63 C6H6
CH2Cl2
CHCl3
AlCl3
AlCl3
o
80 C
C6H5 CH2 C6H5 2HCl
(C6H5)3CH
3HCl
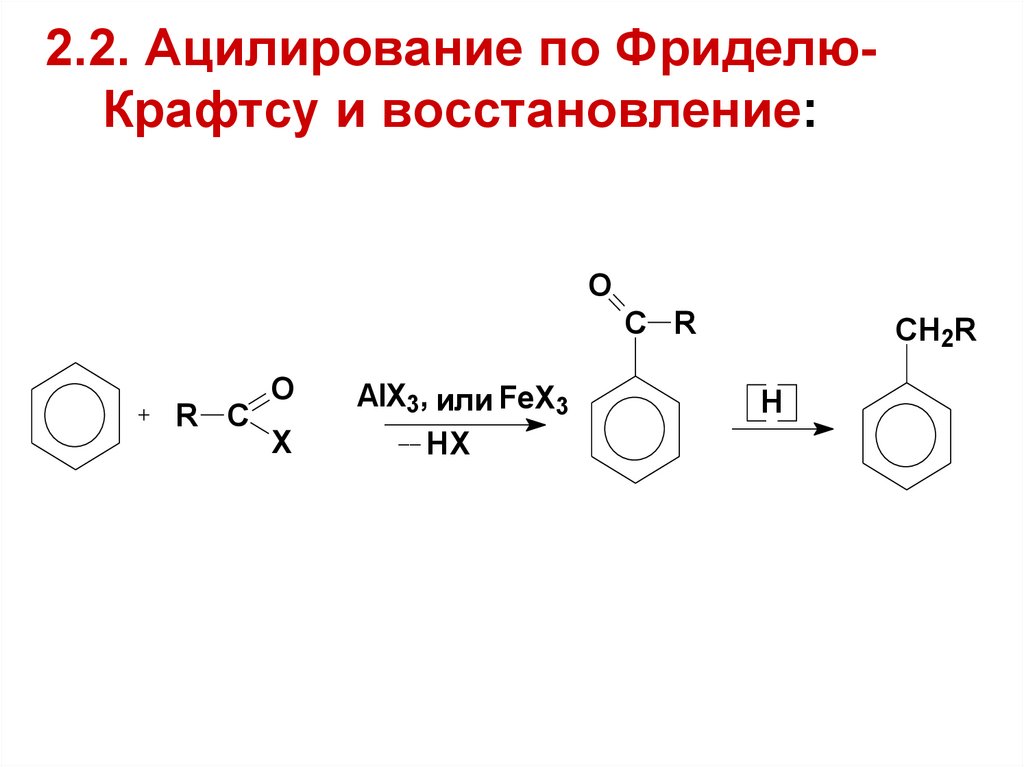
18. 2.2. Ацилирование по Фриделю-Крафтсу и восстановление:
2.2. Ацилирование по ФриделюКрафтсу и восстановление:O
C R
R C
O
X
AlX3, или FeX3
HX
CH2R
H
19. ХИМИЧЕСКИЕ СВОЙСТВА
Для аренов характерны:• Реакции электрофильного
замещения (SЕ).
• Реакции бензола с нарушением
ароматической системы.
• Реакции боковых цепей в
алкилбензолах.
20.
У аренов высокая степеньненасыщенности, но для аренов не
характерны реакции присоединения,
свойственные алкенам и алкинам.
Бензол не реагирует с бромной водой,
не реагирует с перманганатом калия в
щелочной среде (реакция Вагнера).
Наличие высокой энергии сопряжения
ароматической системы кольца обуславливает его устойчивость, поэтому
арены вступают предпочтительно в
реакции с сохранением
ароматичности, т. е. реакции
замещения.
21.
• Реакции галогенирования,нитрования и сульфирования
осуществляются почти со всеми
ароматическими соединениями,
• алкилирования и ацилирования –
только с соединениями, не
содержащими
электроноакцепторных
заместителей в кольце.
22.
1. Реакции электрофильногозамещения SE– замещение атома
водорода бензольного кольца на
электрофил.
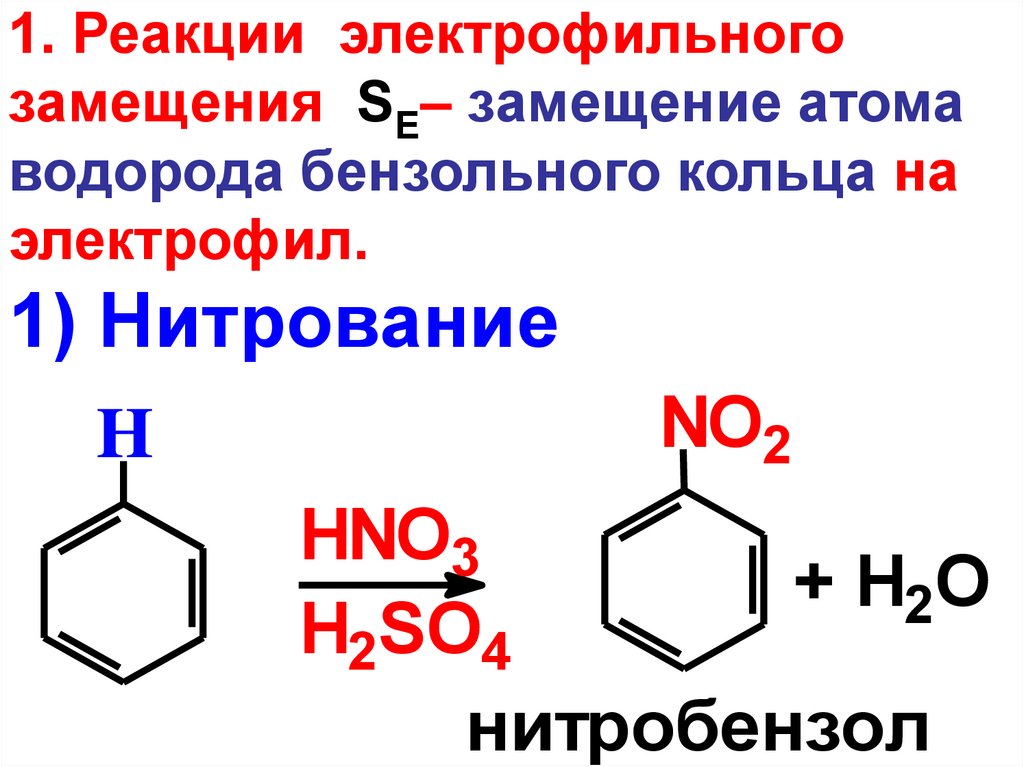
1) Нитрование
H
NO2
HNO3
+ H2O
H2SO4
нитробензол
23.
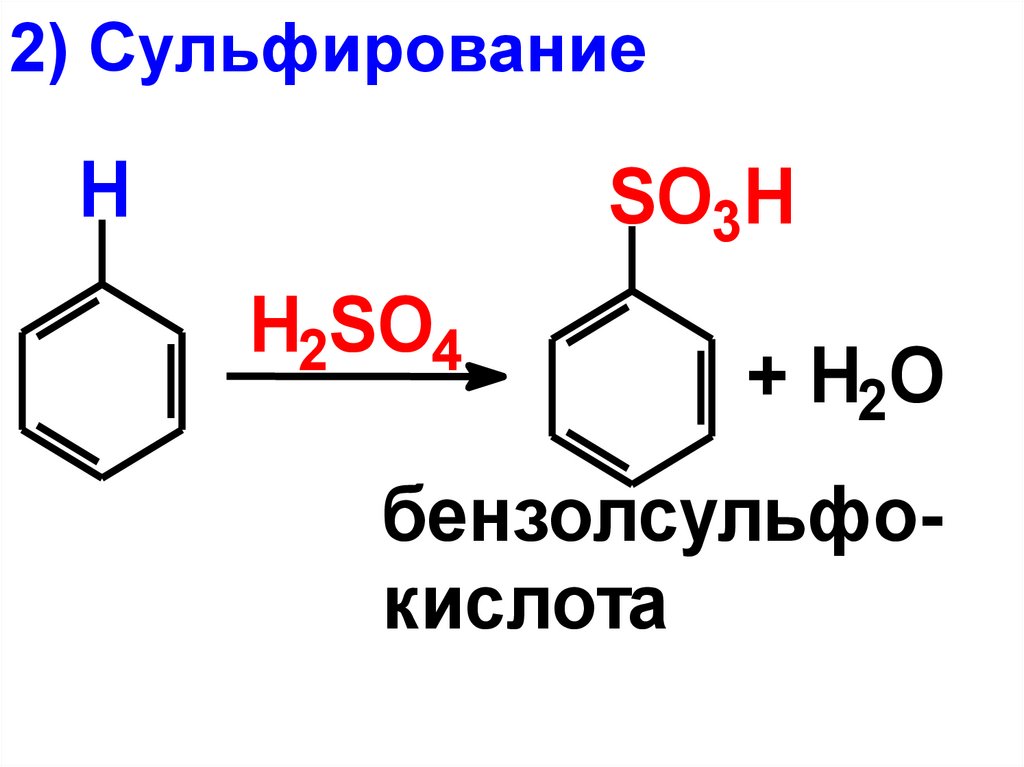
2) СульфированиеH
SO3H
H2SO4
+ H2O
бензолсульфокислота
24.
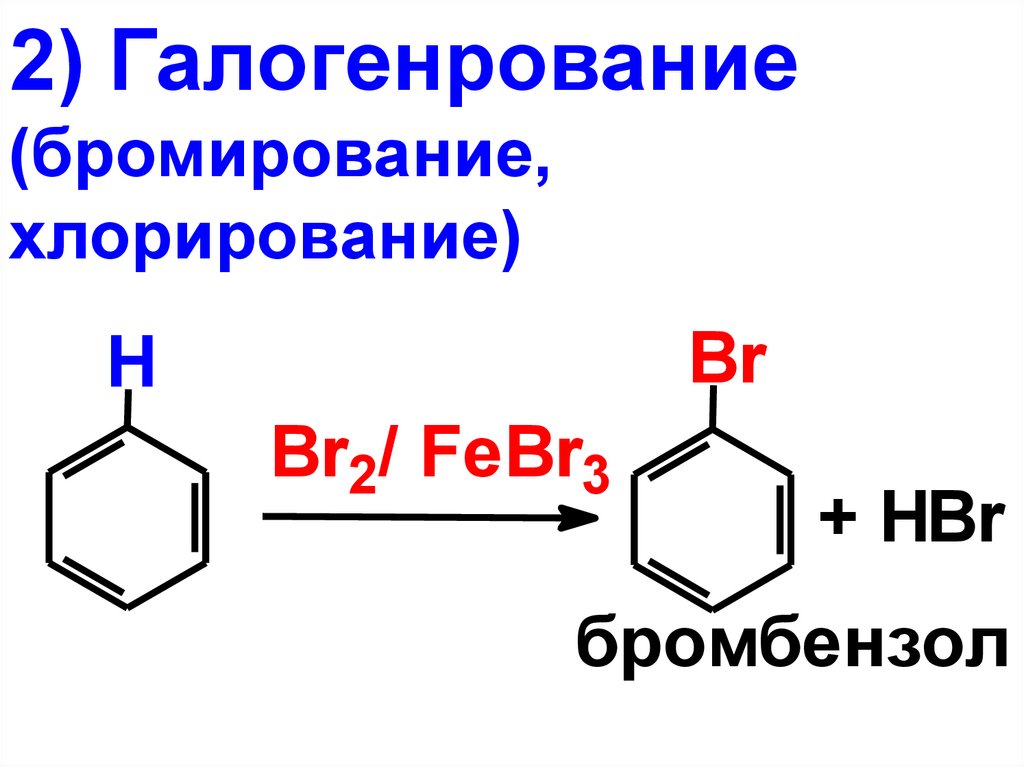
2) Галогенрование(бромирование,
хлорирование)
Br
H
Br2/ FeBr3
+ HBr
бромбензол
25.
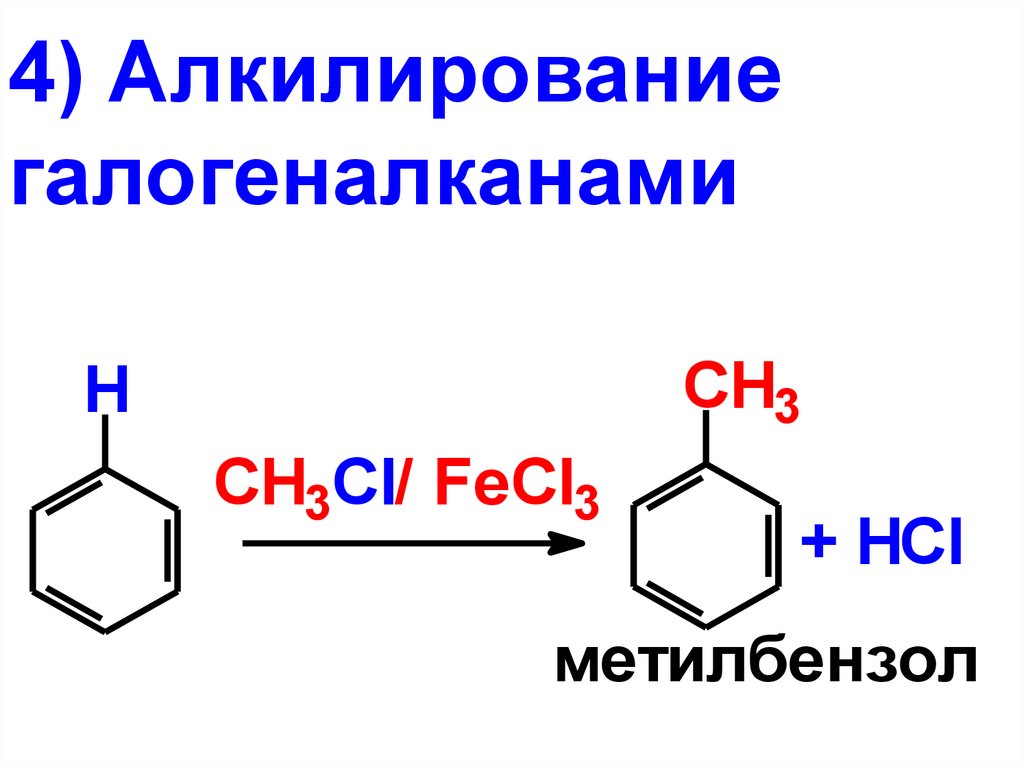
4) Алкилированиегалогеналканами
CH3
H
CH3Cl/ FeCl3
+ HСl
метилбензол
26.
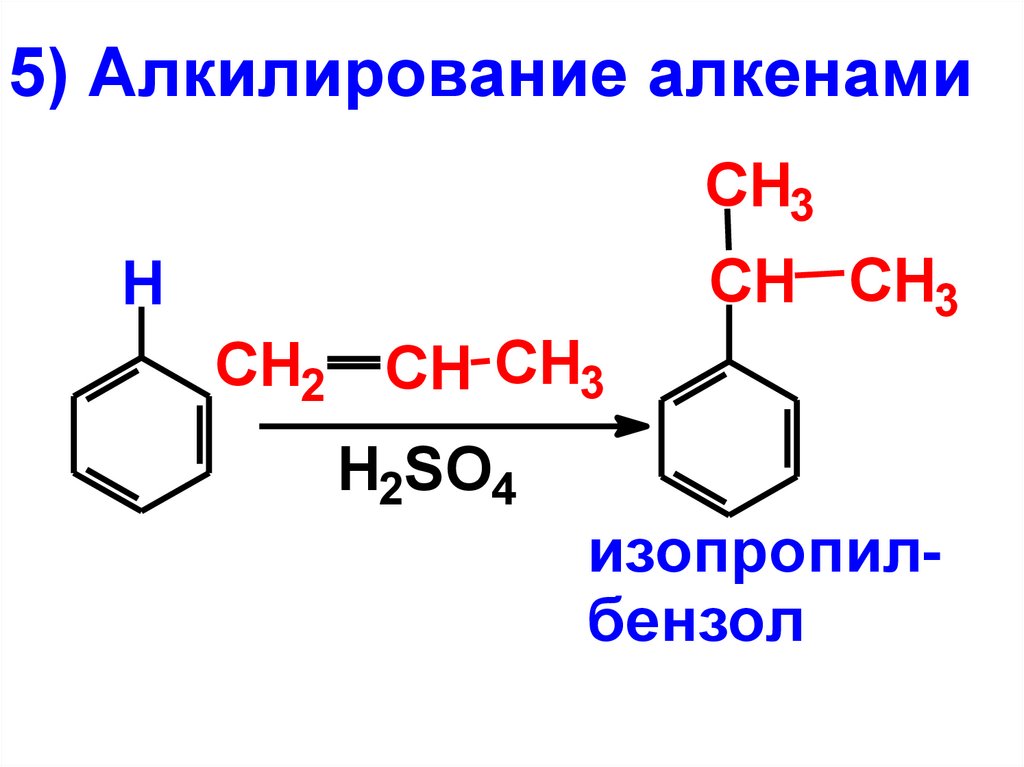
5) Алкилирование алкенамиCH3
CH CH3
H
CH2 CH CH3
H2SO4
изопропилбензол
27.
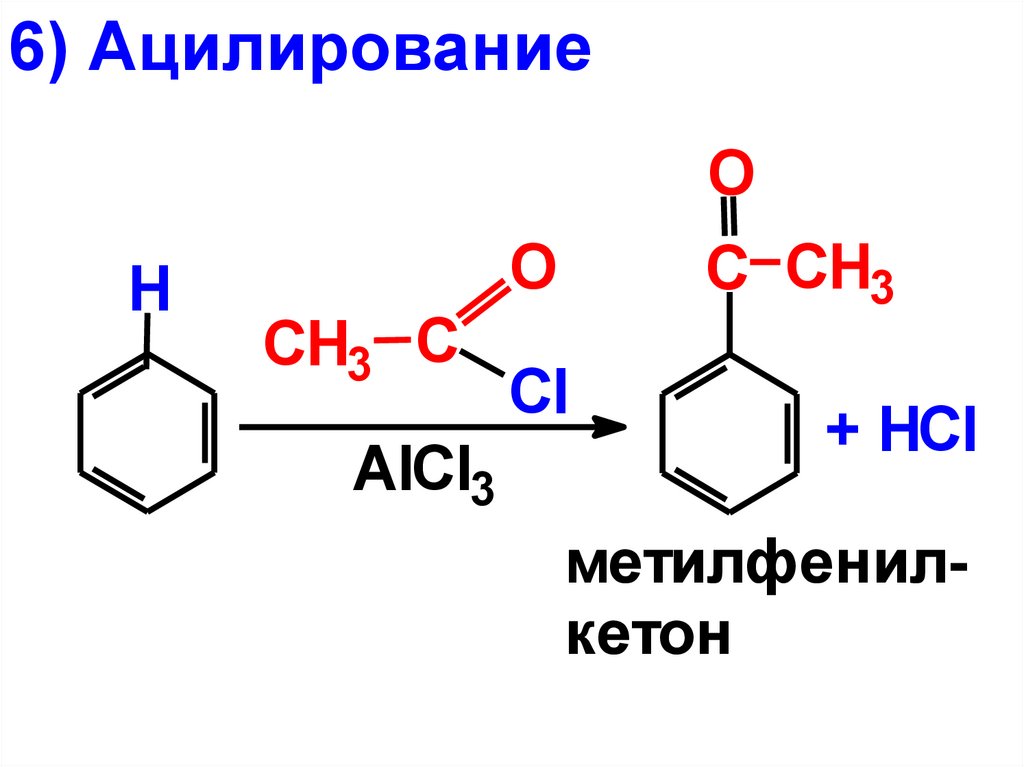
6) АцилированиеO
H
O
CH3 С
AlCl3
C CH3
Cl
+ HCl
метилфенилкетон
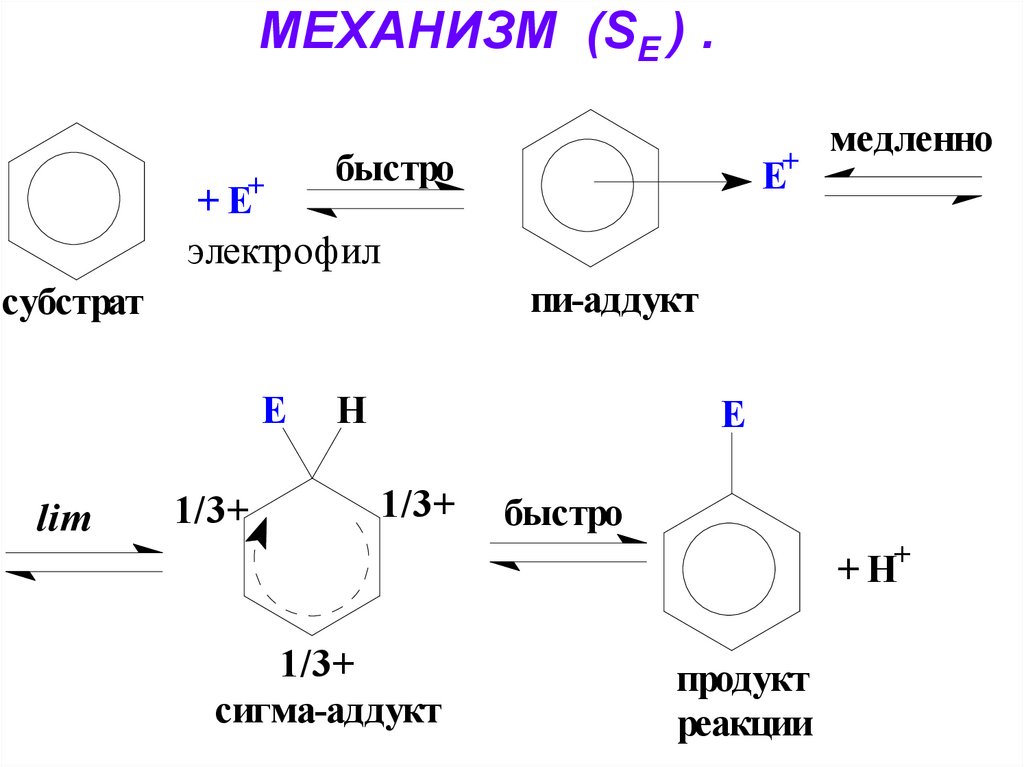
28. МЕХАНИЗМ РЕАКЦИЙ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ (SЕ).
( См. Учебник. С. 195-199).Стадии реакции:
1. Активация реагента
2. Стадия электрофильной атаки:
а) образование π-аддукта;
б) образование σ-аддукта.
3. Стадия отщепления протона.
29. МЕХАНИЗМ (SЕ ) .
Е+быстро
+ Е+
электрофил
пи-аддукт
субстрат
Е
lim
медленно
1/3+
Н
Е
1/3+
быстро
+ Н+
1/3+
сигма-аддукт
продукт
реакции
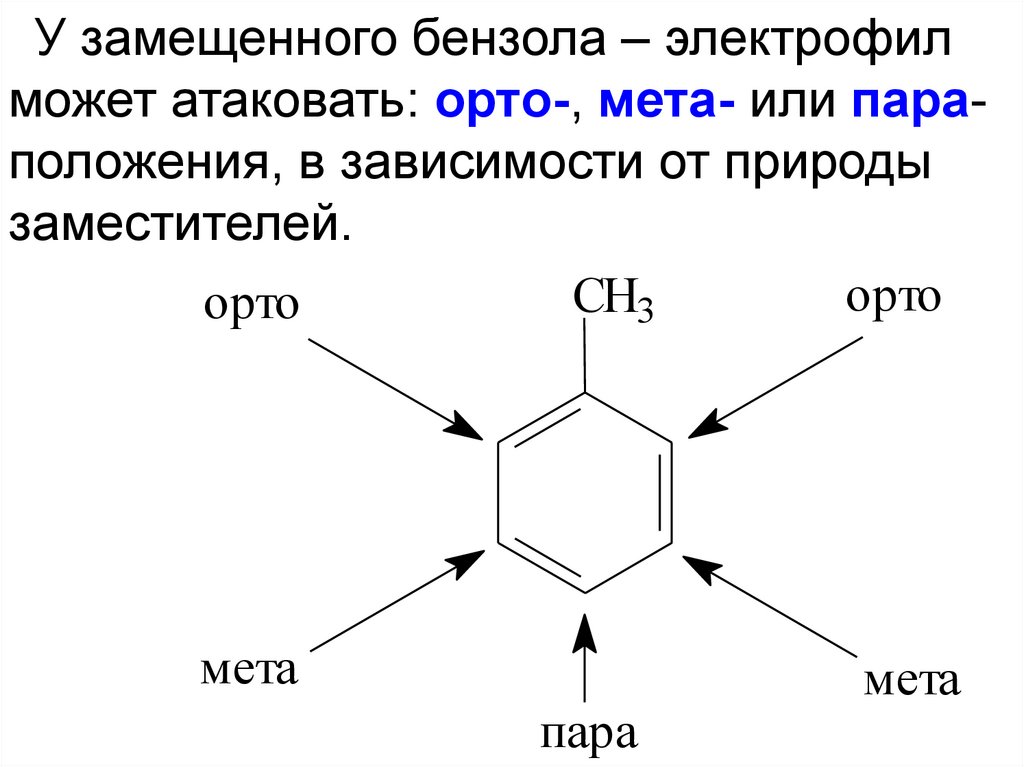
30. ЗАМЕСТИТЕЛИ БЕНЗОЛЬНОГО КОЛЬЦА И ИХ ВЛИЯНИЕ НА СКОРОСТЬ И НАПРАВЛЕНИЕ SЕ-реакций ( См. Учебник. С. 199-206).
Заместители в бензольном кольценарушают равномерность
распределения π-электронного
облака и оказывают влияние на его
реакционную способность. Если
бензольное кольцо содержит заместитель,
то положения, остающиеся свободными,
неравноценны.
31.
У замещенного бензола – электрофилможет атаковать: орто-, мета- или параположения, в зависимости от природы
заместителей.
орто
CH3
орто
мета
пара
мета
32.
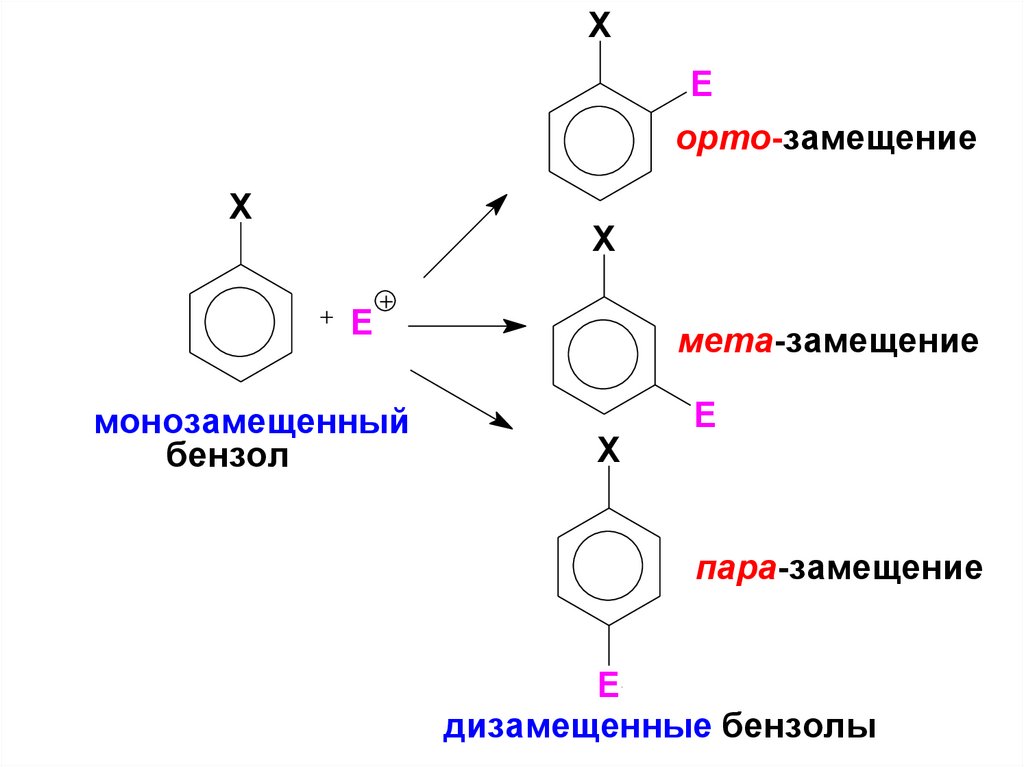
XE
орто-замещение
X
X
E
монозамещенный
бензол
мета-замещение
X
E
пара-замещение
E
дизамещенные бензолы
33.
При рассмотрении таких реакцийнадо решить два важных вопроса:
1) Какие изомеры преимущественно
образуются в результате замещения,
т.е. каково ориентирующее влияние
Х?
2) В каком случае выше скорость
реакции: в бензоле С6Н6 или в
замещенном бензоле С6Н5Х, то есть
какова относительная реакционная
способность?
34. Правила ориентации в монозамещенных аренах
По влиянию на ориентацию в SEреакциях все заместители делятся, на:
I рода (орто-, пара-ориентанты) и
II рода (мета-ориентанты), при этом
заместители в бензольном кольце по
отношению к реакциям SE в бензоле
могут выступать как активирующие
или дезактивирующие.
35.
Ориентирующее влияниезаместителей обусловлено их
электронными эффектами
(статический фактор) и
стабильностью σ-аддуктов, т.е.
промежуточно образующихся
аренониевых ионов
(динамический фактор).
36.
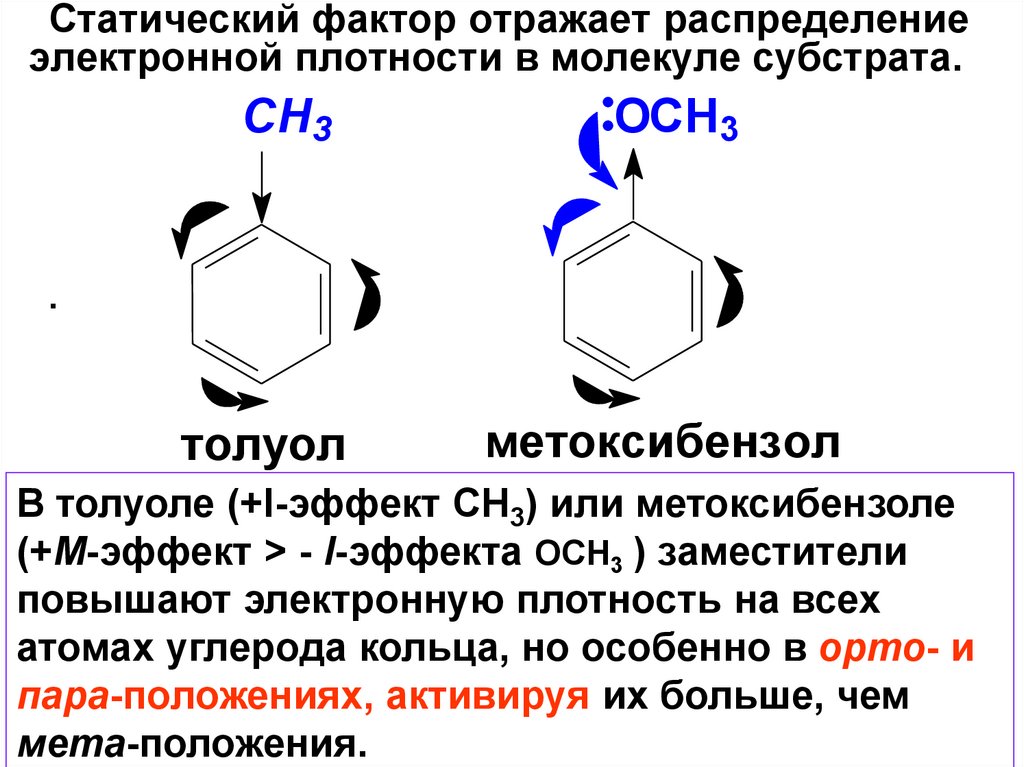
Статический фактор отражает распределениеэлектронной плотности в молекуле субстрата.
CH3
OCH3
.
толуол
метоксибензол
В толуоле (+I-эффект СН3) или метоксибензоле
(+М-эффект > - I-эффекта ОСН3 ) заместители
повышают электронную плотность на всех
атомах углерода кольца, но особенно в орто- и
пара-положениях, активируя их больше, чем
мета-положения.
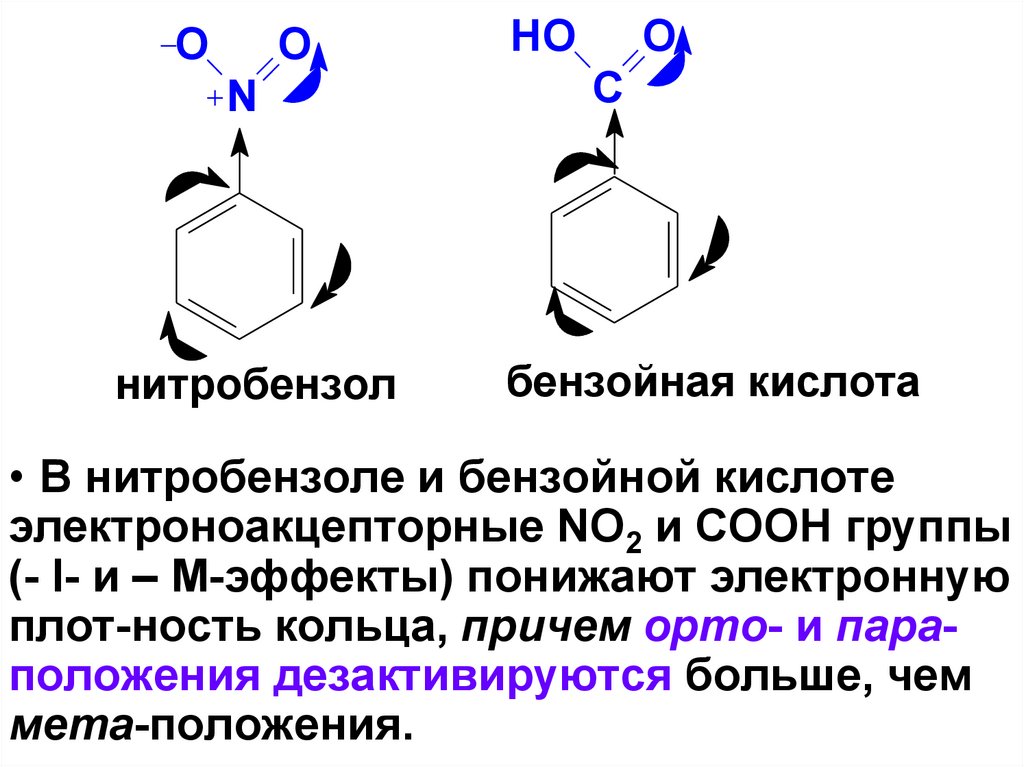
37.
OO
N
нитробензол
HO
O
C
бензойная кислота
• В нитробензоле и бензойной кислоте
электроноакцепторные NO2 и COOH группы
(- I- и – М-эффекты) понижают электронную
плот-ность кольца, причем орто- и параположения дезактивируются больше, чем
мета-положения.
38.
Динамический фактор, то естьстабилизирующее или дестабилизирующее
влияние заместителя на образующиеся в ходе
реакции аренониевые ионы, имеет важнейшее
значение. Заместители оказывают различное
влияние на энергию активации трех возможных
переходных состояний.
Дезактивирующие заместители
дестабилизируют σ-аддукт и увеличивают
энергию активации lim-стадии.
Активирующие бензольное кольцо группы,
стабилизируют σ-аддукт, понижают его
энергию и энергию активации образования σ-
аддукта
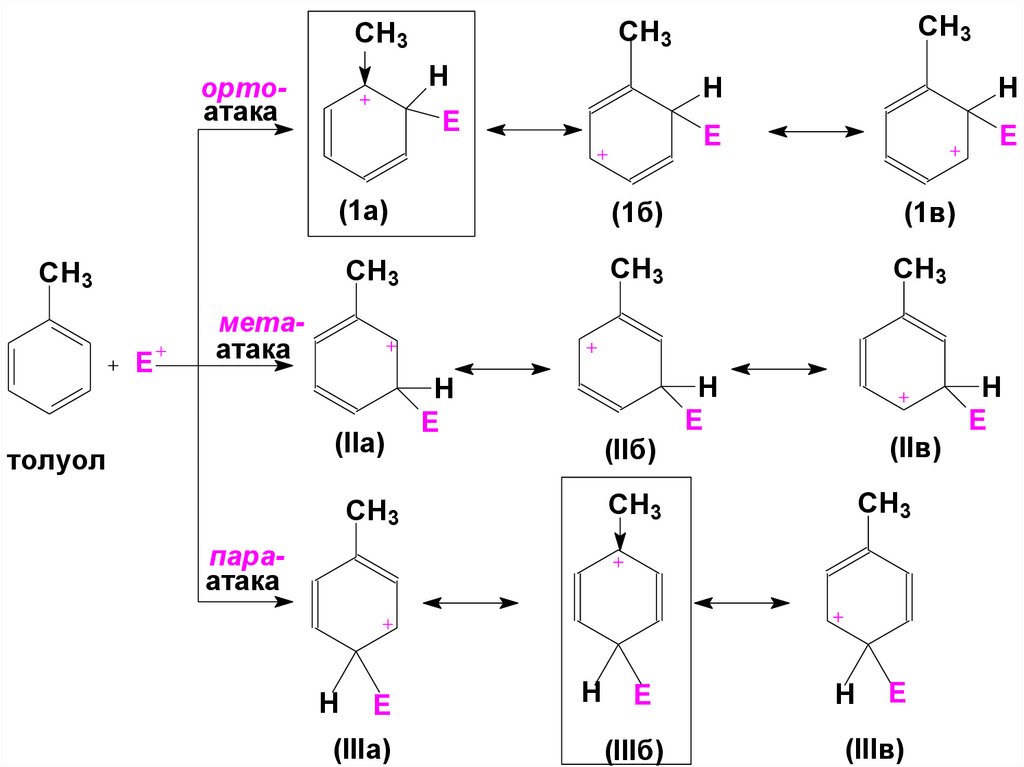
39. Граничные структуры σ-аддукта, вносящие вклад в его стабилизацию на примере толуола:
В структурах (1а) и (IIIб) +заметно компенсируется
заряд
40.
Hортоатака
E
H
H
E
E
(1а)
(1б)
(1в)
СH3
СH3
СH3
CH 3
E
CH 3
CH 3
СH3
метаатака
(IIa)
толуол
H
E
(IIб)
H
E
(IIв)
CH 3
СH3
CH3
параатака
H
E
(IIIa)
H
E
(IIIб)
H
E
(IIIв)
H
E
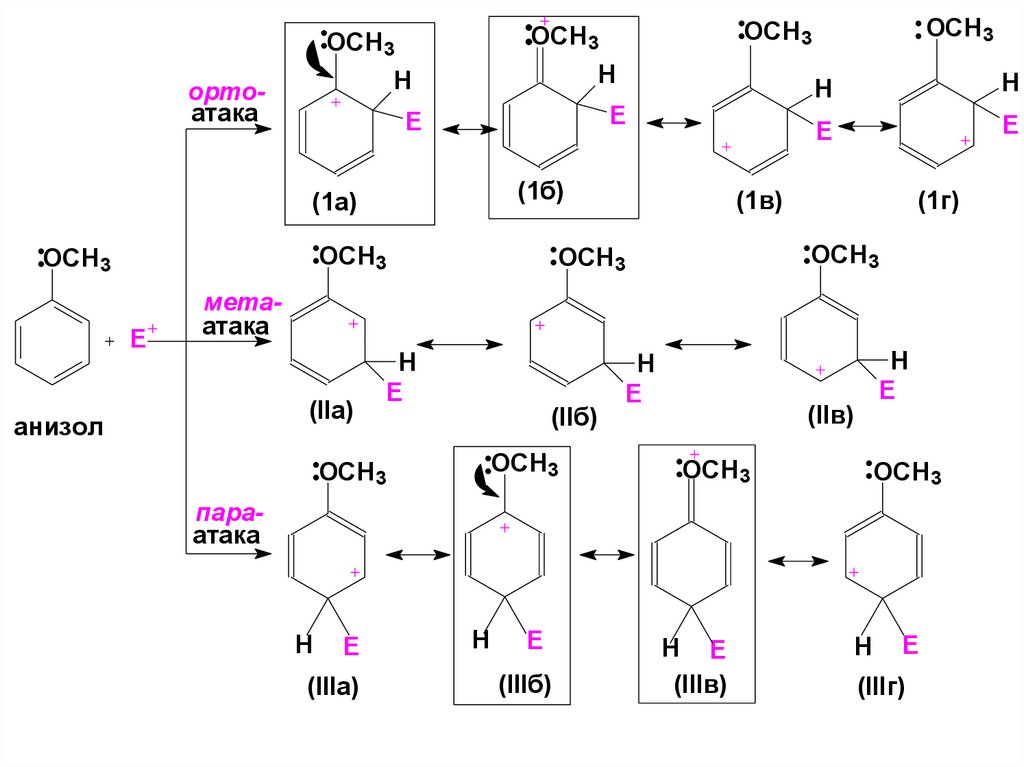
41. В анизоле (метоксибензоле) интермедиаты, образующиеся при атаке в орто- и пара – положения, стабилизированы больше
42.
HH
ортоатака
E
E
(1б)
(1а)
OСH3
OCH 3
E
OCH 3
OCH3
OСH 3
OСH3
H
H
E
E
(1в)
(1г)
OСH 3
OСH3
метаатака
(IIa)
анизол
H
E
(IIб)
OСH3
OCH3
H
E
H
E
(IIв)
OСH 3
OCH3
параатака
H
E
(IIIa)
H
E
(IIIб)
H E
(IIIв)
H
E
(IIIг)
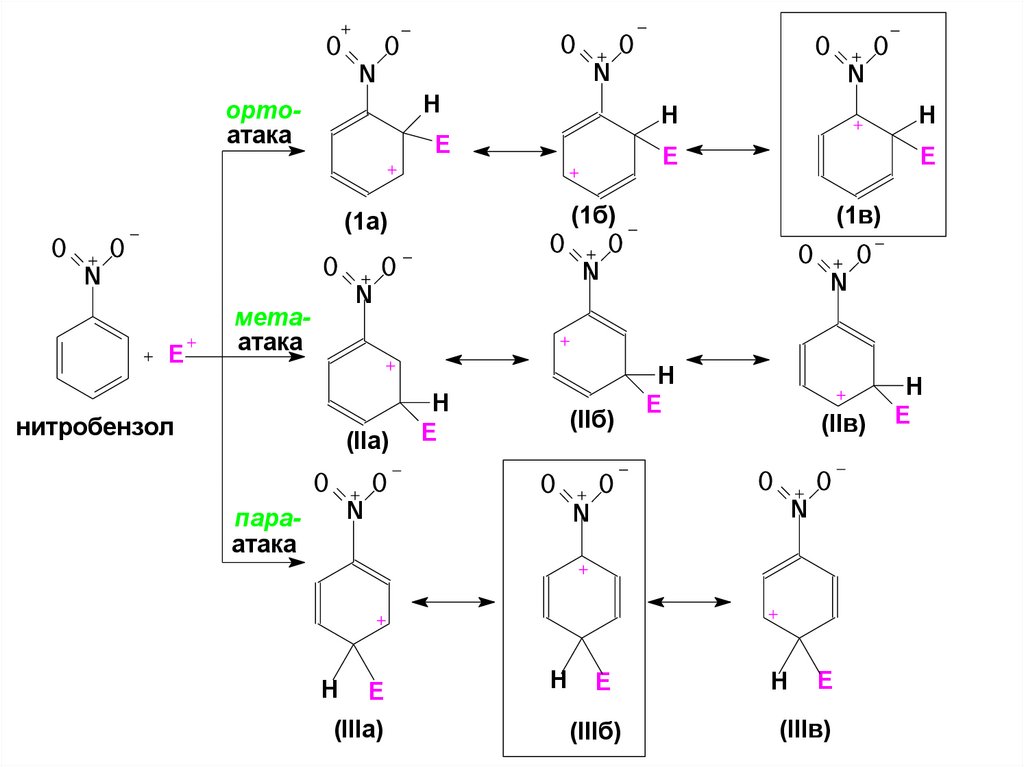
43. ЭА заместители дестабилизируют все три возможных σ-аддукта, но σ-аддукт, возникающий при атаке в мета-положение,
дестабилизирован меньше.44.
OO
O
H
ортоатака
E
O
N
E
O
N
метаатака
нитробензол
(IIa)
O
O
H
E
(IIб)
O
N
параатака
H
O
N
H
H
E
E
(1б)
O
O
N
(1а)
O
O
N
N
O
O
O
(1в)
O
N
H
E
(IIв)
O
O
N
N
E
(IIIa)
H
E
(IIIб)
O
H
E
(IIIв)
H
E
45.
• По влиянию статических идинамических факторов на
реакционную способность и
ориентацию в реакциях
электрофильного замещения
все заместители можно
разделить на следующие
типы:
46.
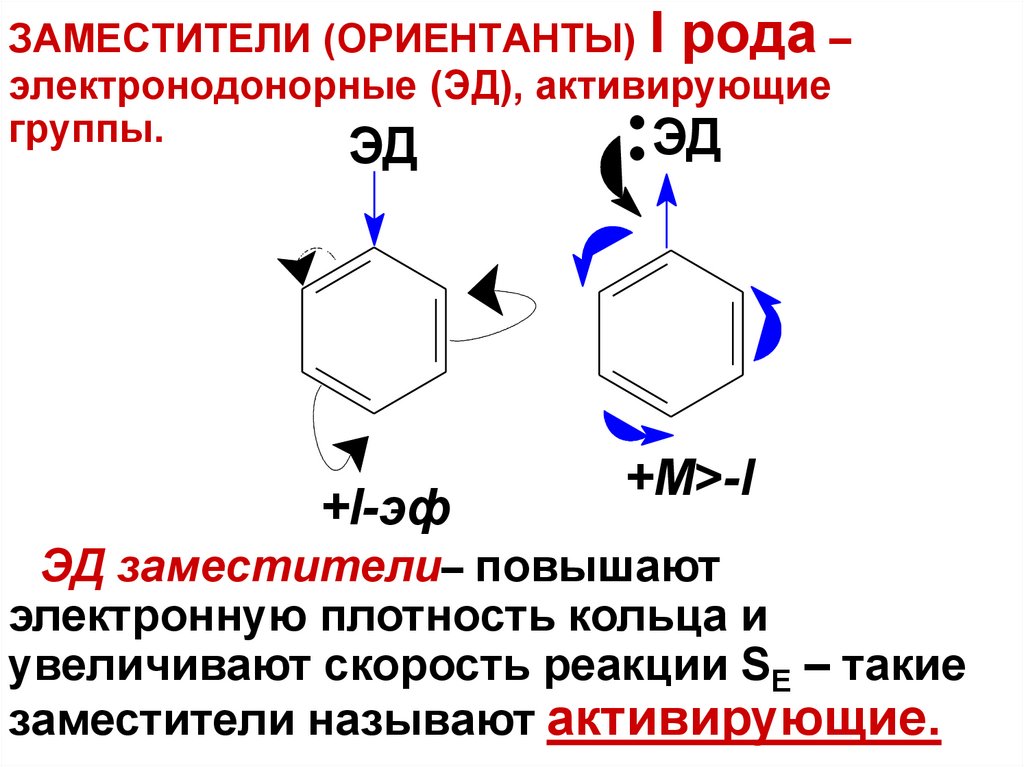
ЗАМЕСТИТЕЛИ (ОРИЕНТАНТЫ) I рода –электронодонорные (ЭД), активирующие
группы.
ЭД
ЭД
+I-эф
+М>-I
ЭД заместители– повышают
электронную плотность кольца и
увеличивают скорость реакции SE – такие
заместители называют активирующие.
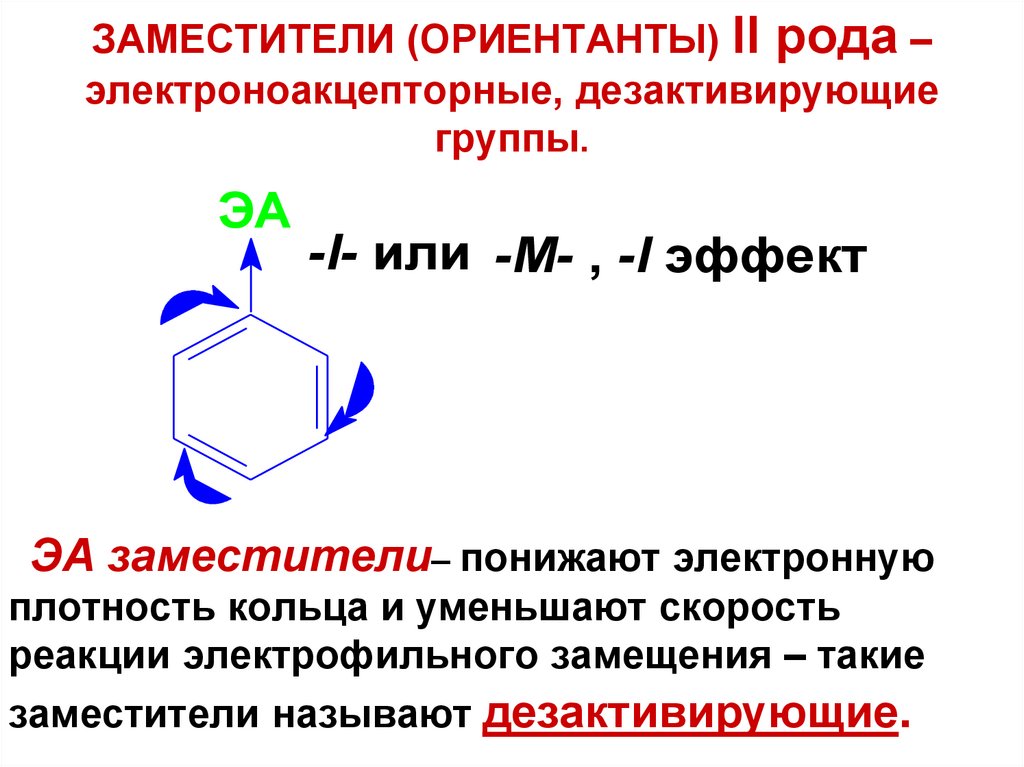
47. ЗАМЕСТИТЕЛИ (ОРИЕНТАНТЫ) II рода – электроноакцепторные, дезактивирующие группы.
ЭA-I- или -М- , -I эффект
ЭА заместители– понижают электронную
плотность кольца и уменьшают скорость
реакции электрофильного замещения – такие
заместители называют дезактивирующие.
48.
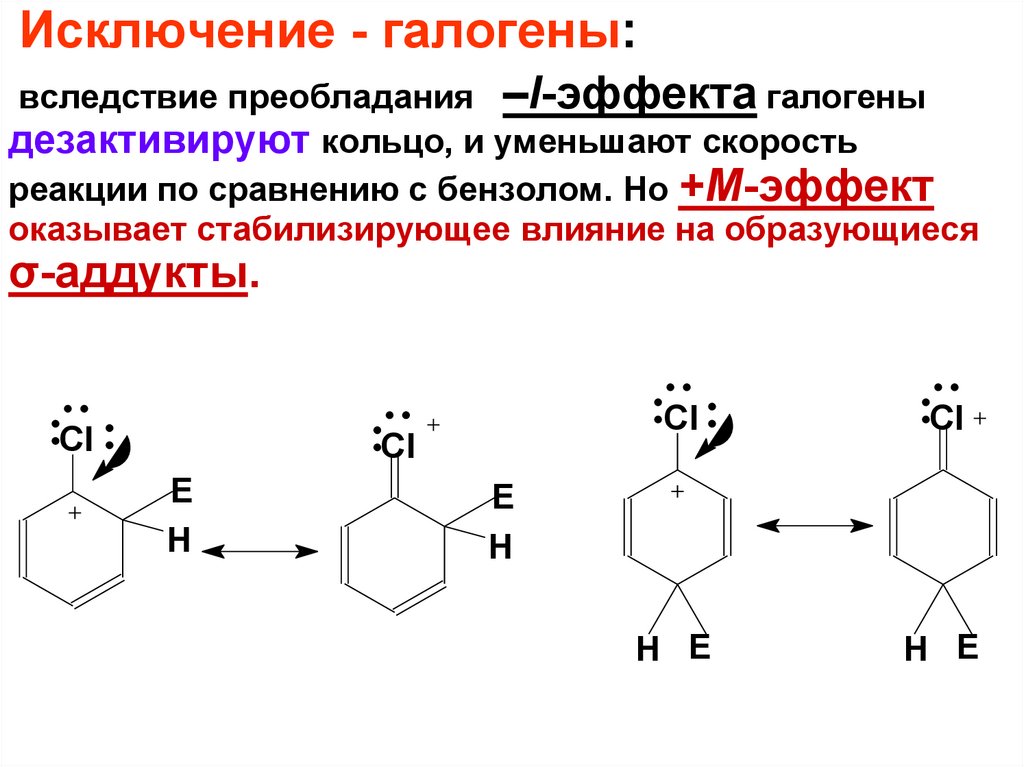
Исключение - галогены:вследствие преобладания –I-эффекта галогены
дезактивируют кольцо, и уменьшают скорость
реакции по сравнению с бензолом. Но +М-эффект
оказывает стабилизирующее влияние на образующиеся
σ-аддукты.
Cl
Cl
E
H
Cl
Cl
H E
H E
E
H
49. ВЛИЯНИЕ ЗАМЕСТИТЕЛЕЙ В БЕНЗОЛЬНОМ ЯДРЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ И ОРИЕНТАЦИЮ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ
ЗаместителиТип
эффекта
Влияние на
реакц.
способность
Заместители I
рода:
-NH2, -NHR, -NR2, -OH
-O-NHCOR, -OR
+M >> -I
+M, +I
+M > -I
-CH3 и другие
алкильные группы
-С6Н5, -СH=CH2
-F, -Cl, -Br, -I
+I
+M > -I
-I > +M
+++
+++
++
+
+
-
Преобладающее
ориентирующее
действие
орто- и
пара-
50.
ЗаместителиТип
Влияние Преобладающее
эффект на реакц. ориентирующее
способа
действие
ность
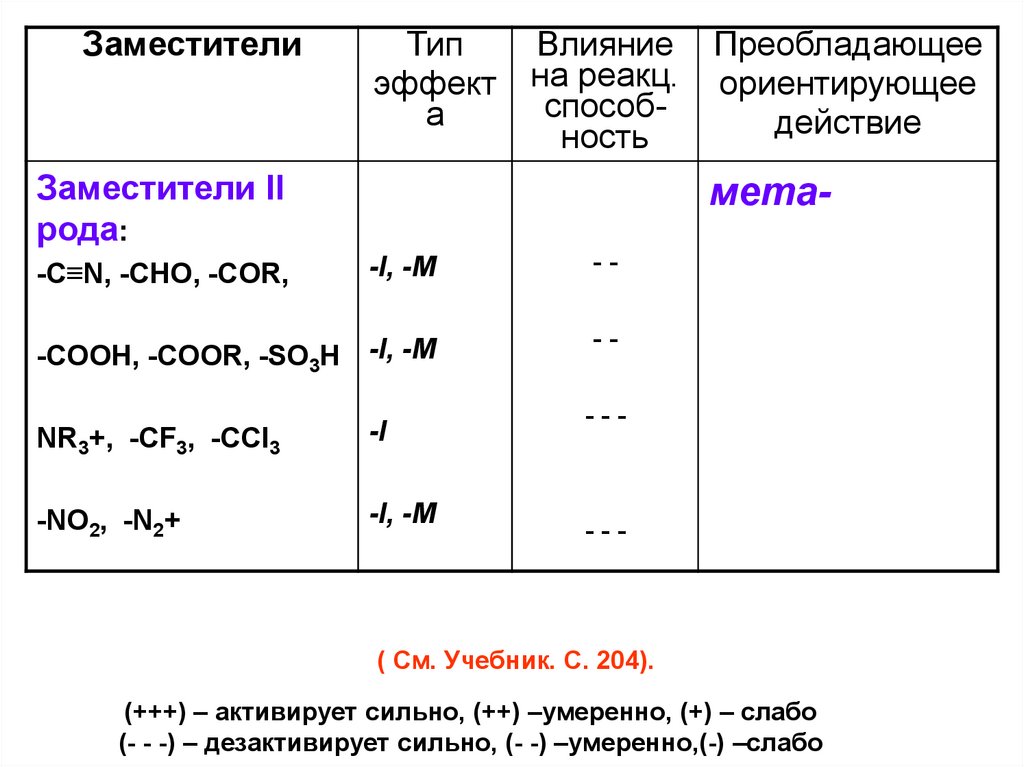
Заместители II
рода:
мета-I, -M
--
-COOH, -COOR, -SO3H -I, -M
--
-C≡N, -CHO, -COR,
NR3+, -CF3, -CCl3
-I
-NO2, -N2+
-I, -M
---
---
( См. Учебник. С. 204).
(+++) – активирует сильно, (++) –умеренно, (+) – слабо
(- - -) – дезактивирует сильно, (- -) –умеренно,(-) –слабо
51.
• Правила ориентации позволяютпредсказать преимущественное
направление реакции и преобладание
того или иного изомера в продуктах
реакции.
• Хотя в большинстве случаев
содержатся все три продукта.
• Когда присутствует заместитель 1
рода, то из-за стерического фактора,
как правило, образуется большее
количество пара-, а не орто- изомера.
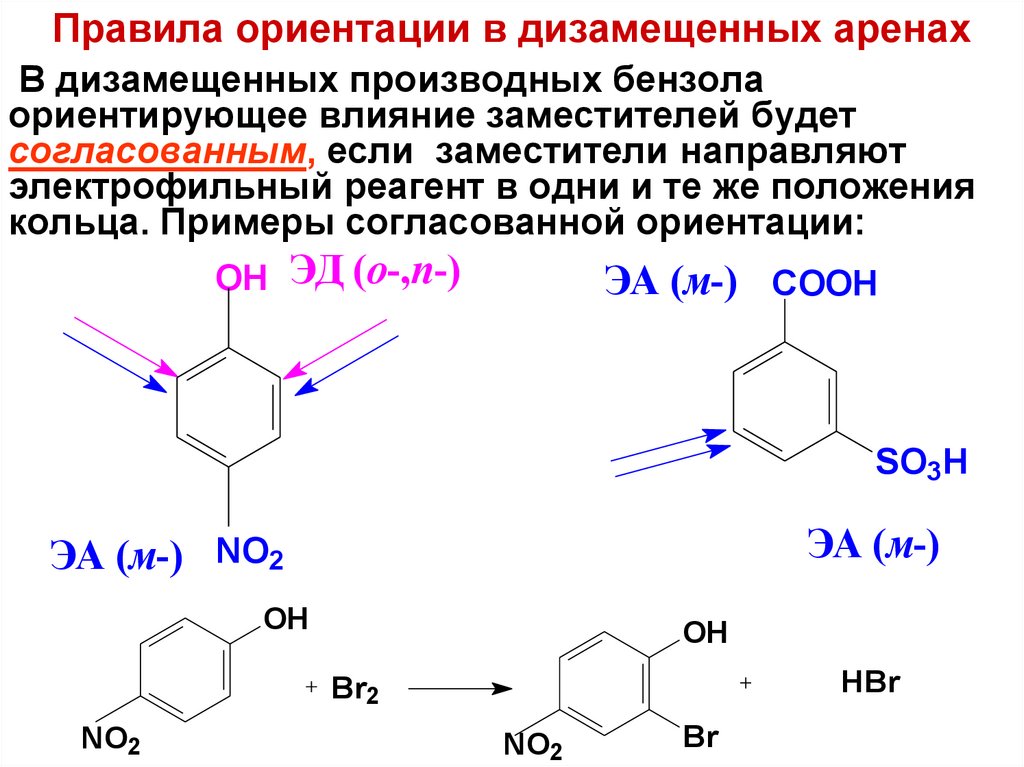
52. Правила ориентации в дизамещенных аренах
В дизамещенных производных бензолаориентирующее влияние заместителей будет
согласованным, если заместители направляют
электрофильный реагент в одни и те же положения
кольца. Примеры согласованной ориентации:
OH ЭД (о-,п-)
ЭА (м-) COOH
SO3H
ЭА (м-)
ЭА (м-) NO2
OH
OH
HBr
Br2
NO2
NO2
Br
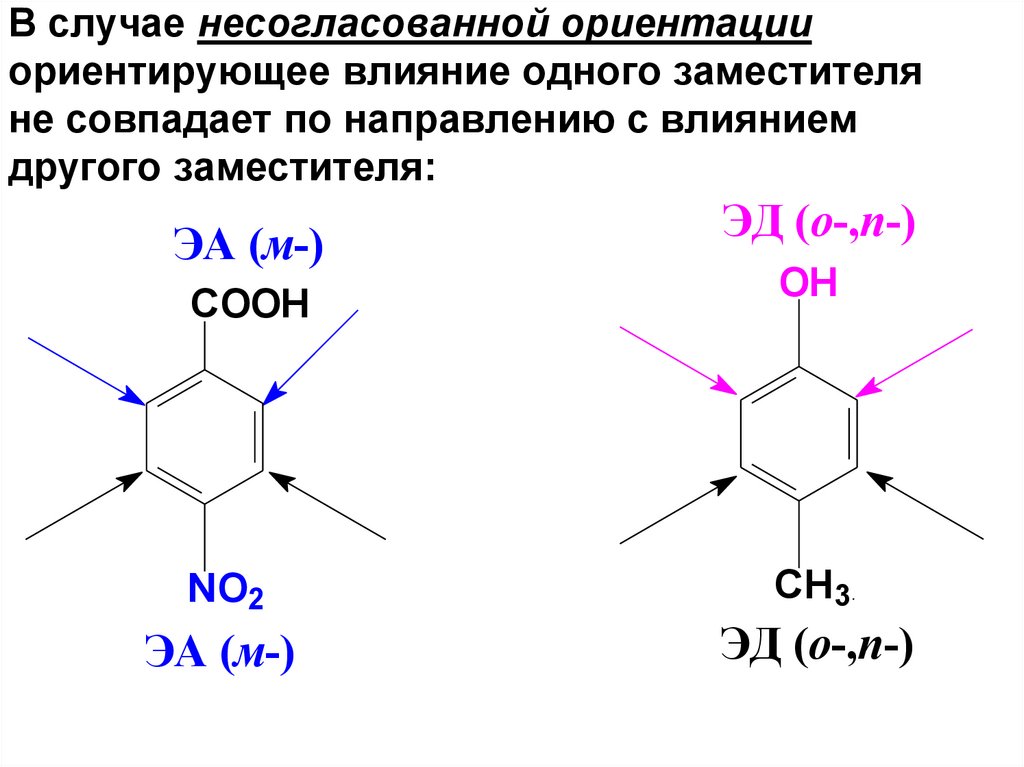
53. В случае несогласованной ориентации ориентирующее влияние одного заместителя не совпадает по направлению с влиянием другого
заместителя:ЭА (м-)
COOH
ЭД (о-,п-)
OH
NO2
CH3
ЭА (м-)
ЭД (о-,п-)
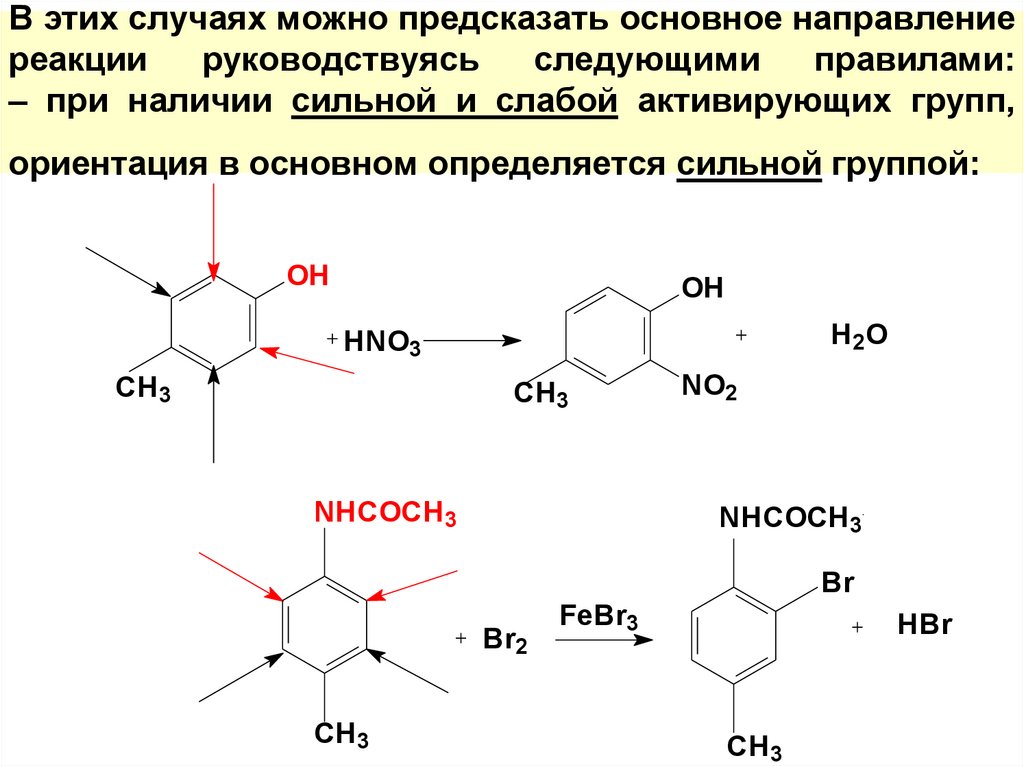
54. В этих случаях можно предсказать основное направление реакции руководствуясь следующими правилами: – при наличии сильной и
слабой активирующих групп,ориентация в основном определяется сильной группой:
OH
OH
H 2O
HNO3
CH3
CH3
NHCOCH3
NO2
NHCOCH3
Br
Br2
CH3
FeBr3
HBr
CH3
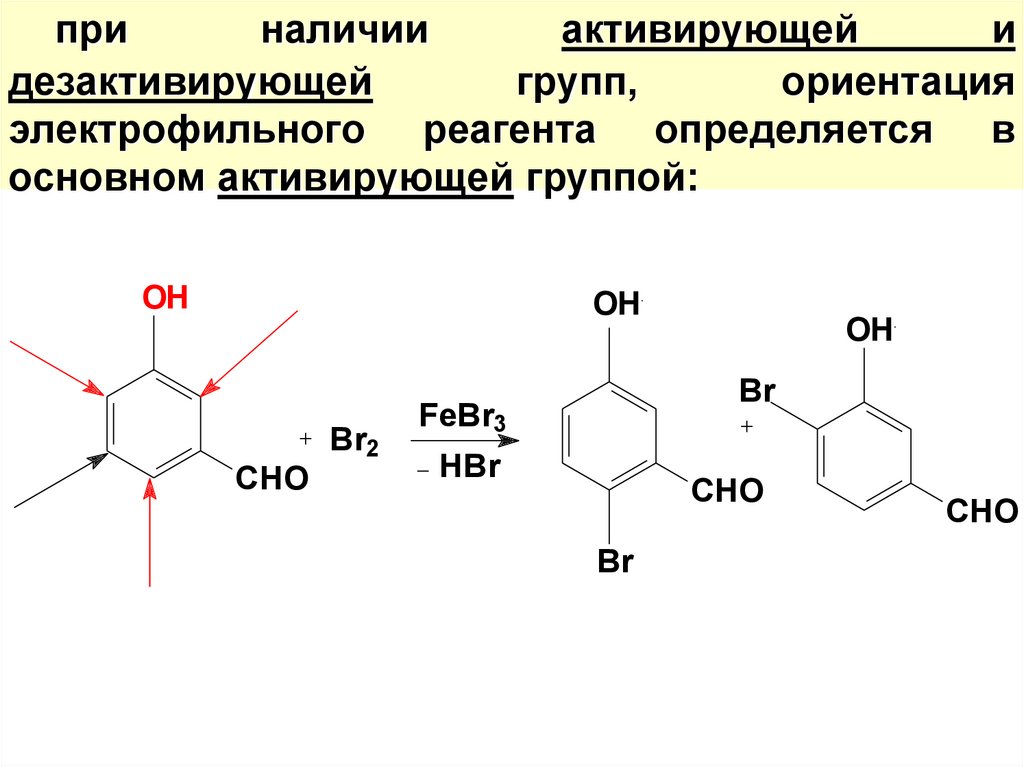
55. при наличии активирующей и дезактивирующей групп, ориентация электрофильного реагента определяется в основном активирующей
группой:OH
OH
Br2
CHO
OH
Br
FeBr3
HBr
CHO
Br
CHO
56.
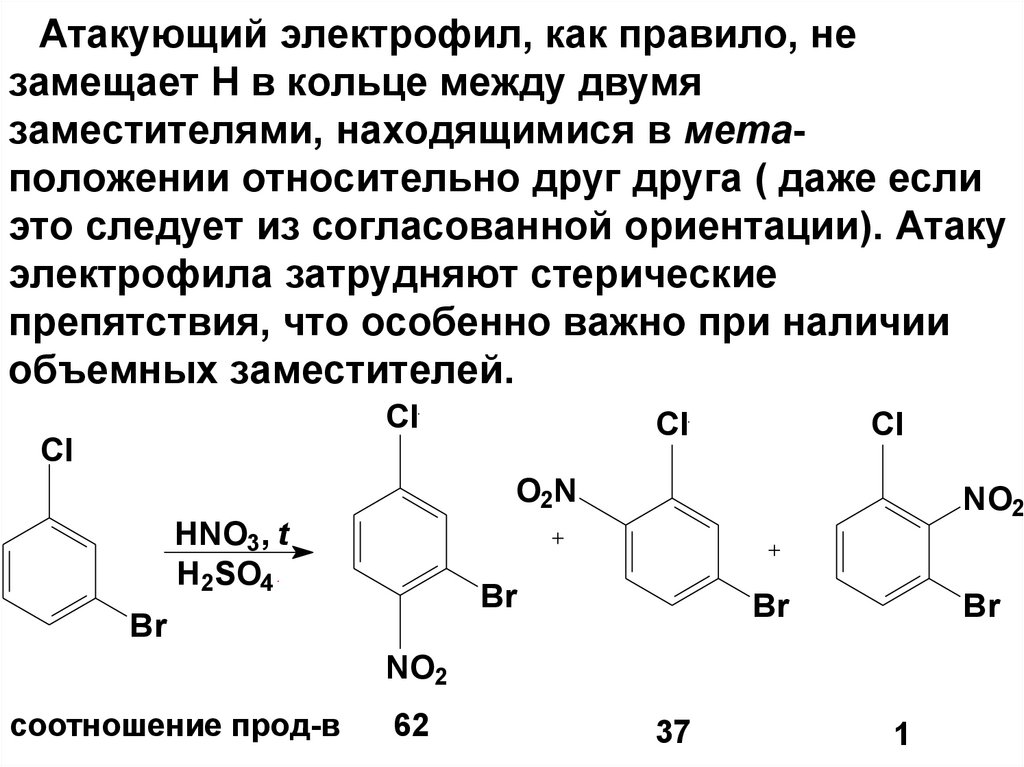
Атакующий электрофил, как правило, незамещает Н в кольце между двумя
заместителями, находящимися в метаположении относительно друг друга ( даже если
это следует из согласованной ориентации). Атаку
электрофила затрудняют стерические
препятствия, что особенно важно при наличии
объемных заместителей.
Cl
Cl
Cl
Cl
O2N
HNO3, t
H2SO4
NO2
Br
Br
Br
Br
NO2
соотношение прод-в
62
37
1
57. Важнейшие реакции SE
•1.1. Галогенирование.Бензол реагирует с Cl2 и Br2 в присутствии kаt
– кислот Льюиса:
безводных галогенидов Аl (AlCl3 , AlBr3),
Fe (FeCl3, FeBr3), Sn (SnCl4) и Ti (TiCl4).
Прямое фторирование можно осуществить
фтором (F2, разбавленным азотом) при -70oC.
В реакциях иодирования I2 реагирует только с
активными аренами – анилином, фенолом в
щелочной среде. Для иодирования других
aренов используют I-Cl или I2 / AgClO4.
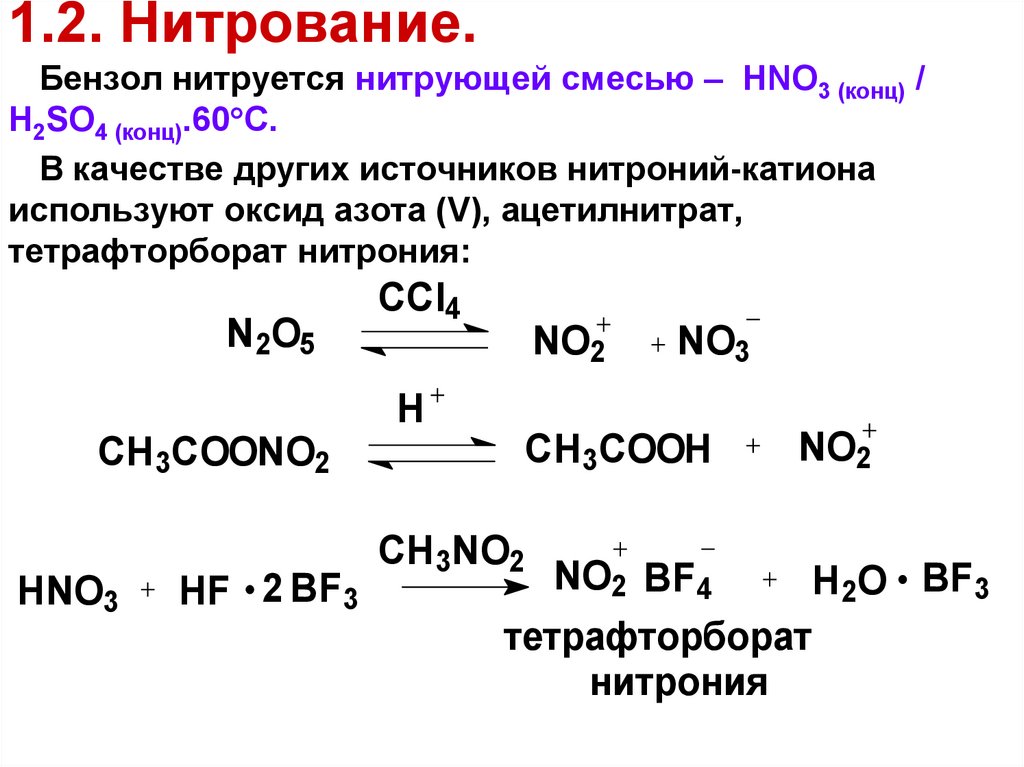
58. 1.2. Нитрование.
Бензол нитруется нитрующей смесью – HNO3 (конц) /H2SO4 (конц).60 С.
В качестве других источников нитроний-катиона
используют оксид азота (V), ацетилнитрат,
тетрафторборат нитрония:
N2O5
CCl4
NO2
NO3
H
CH3COOH
CH3COONO2
HNO3
HF 2 BF3
CH3NO2
NO2
NO2 BF4
H2O BF3
тетрафторборат
нитрония
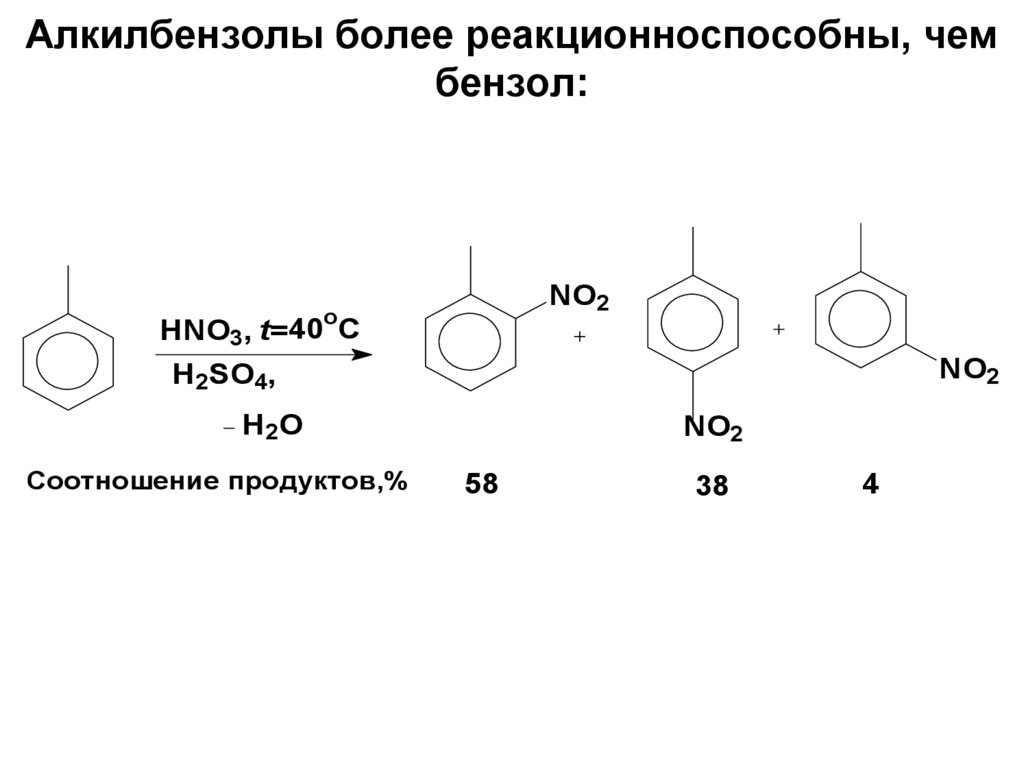
59. Алкилбензолы более реакционноспособны, чем бензол:
NO2o
HNO3, t= 40 C
NO2
H2SO4,
H 2O
Соотношение продуктов,%
NO2
58
38
4
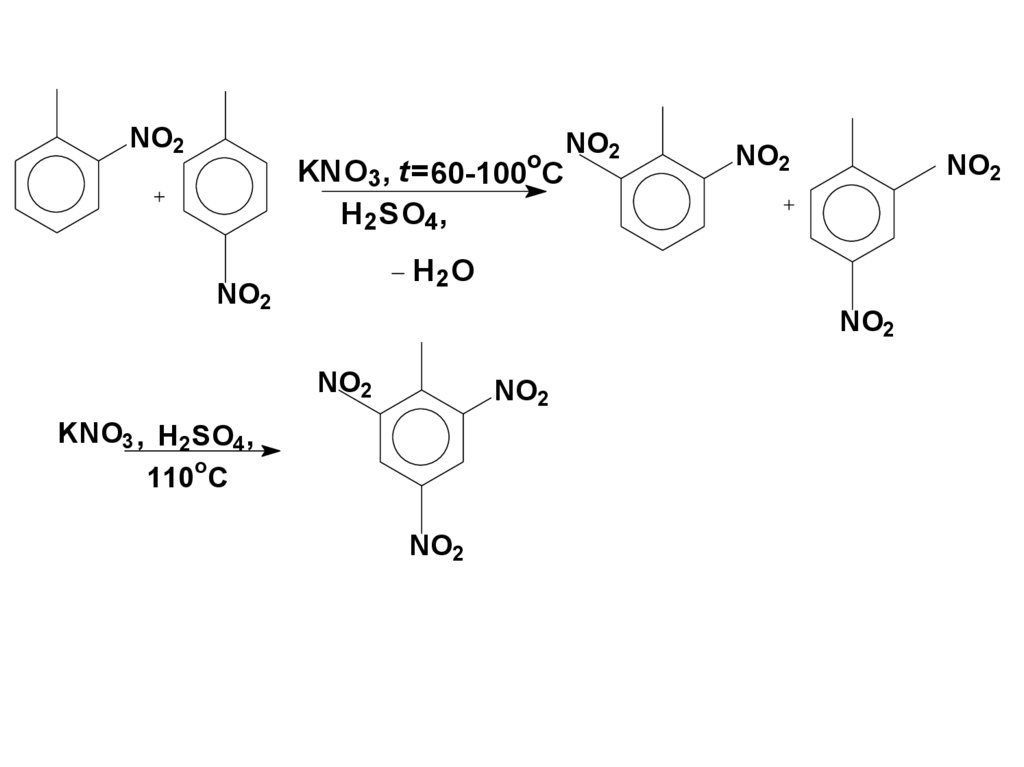
60.
NO2o
KNO3 , t= 60-100 C
H 2 SO4 ,
NO2
NO2
NO2
H2 O
NO2
NO2
NO2
NO2
KNO3 , H2SO4,
o
110 C
NO2
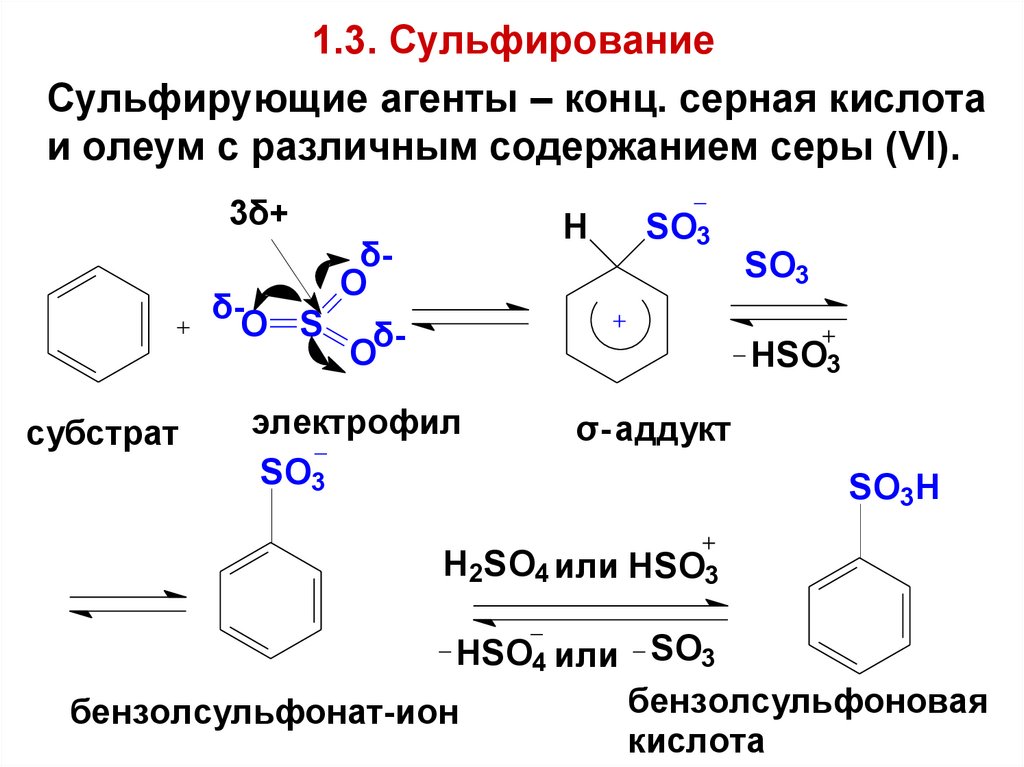
61. 1.3. Сульфирование
Сульфирующие агенты – конц. серная кислотаи олеум с различным содержанием серы (VI).
3δ+
H
δO
δO S δO
субстрат
SO3
SO3
HSO3
электрофил
SO3
σ- аддукт
SO3H
H 2SO4 или HSO3
HSO4 или SO3
бензолсульфоновая
бензолсульфонат-ион
кислота
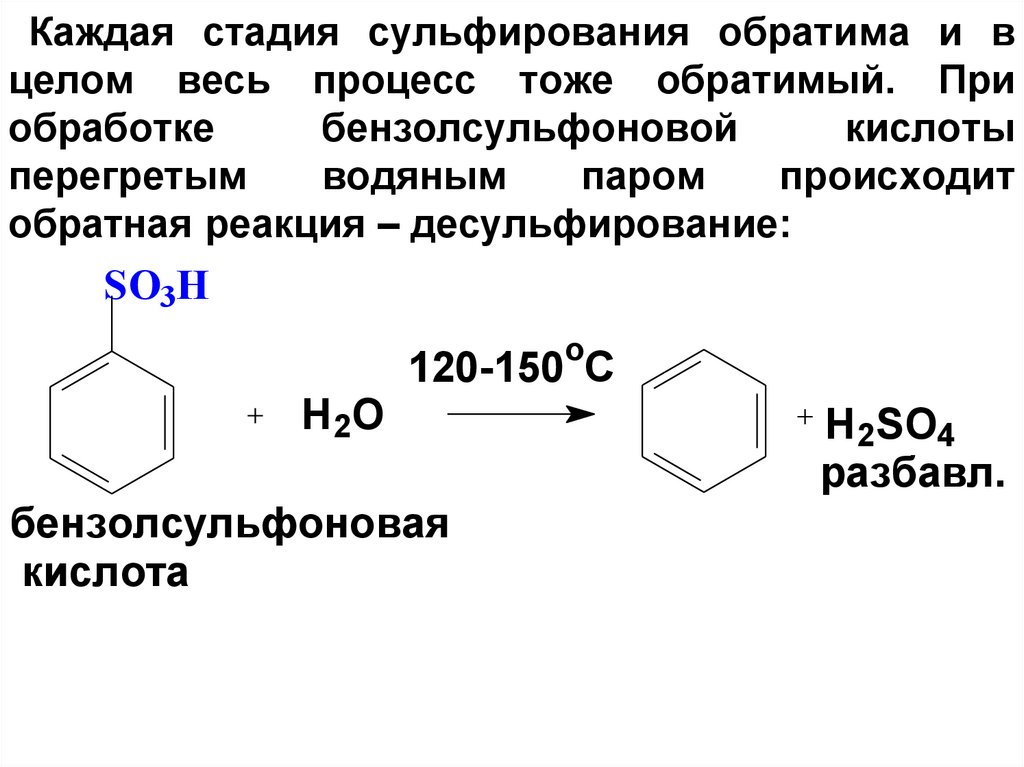
62. Каждая стадия сульфирования обратима и в целом весь процесс тоже обратимый. При обработке бензолсульфоновой кислоты перегретым
водянымпаром
происходит
обратная реакция – десульфирование:
SO3H
o
H2O
120-150 C
бензолсульфоновая
кислота
H2SO4
разбавл.
63.
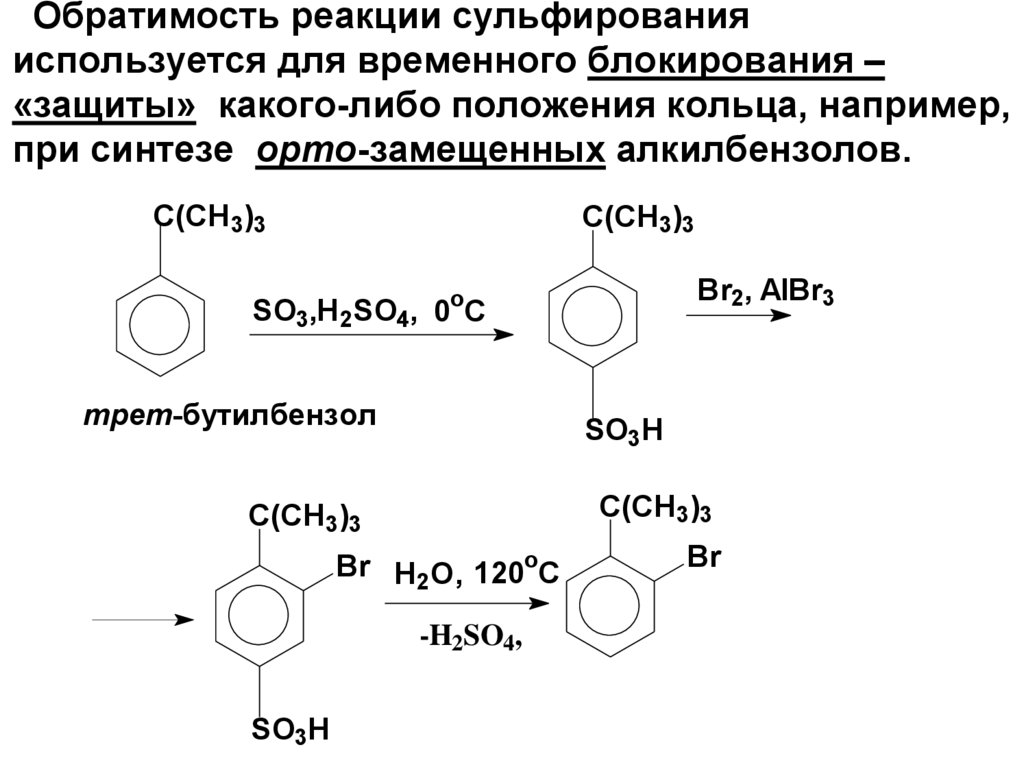
Обратимость реакции сульфированияиспользуется для временного блокирования –
«защиты» какого-либо положения кольца, например,
при синтезе орто-замещенных алкилбензолов.
C(CH 3)3
C(CH3)3
Br2, AlBr3
o
SO3,H 2SO4, 0 C
трет-бутилбензол
SO3H
C(CH 3)3
C(CH 3)3
Br H 2O , 120oC
-H2SO4,
SO3H
Br
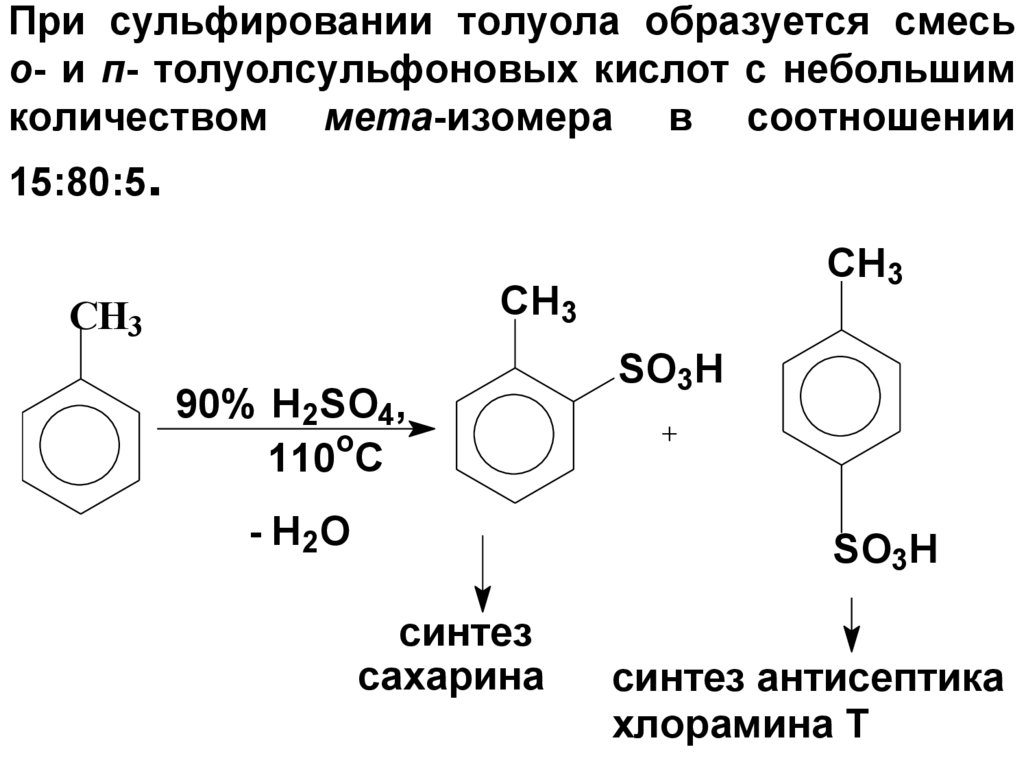
64. При сульфировании толуола образуется смесь о- и п- толуолсульфоновых кислот с небольшим количеством мета-изомера в соотношении
15:80:5.CH3
CH3
СН3
90% H2SO4,
o
110 C
- H2O
SO3H
SO3H
синтез
сахарина
синтез антисептика
хлорамина Т
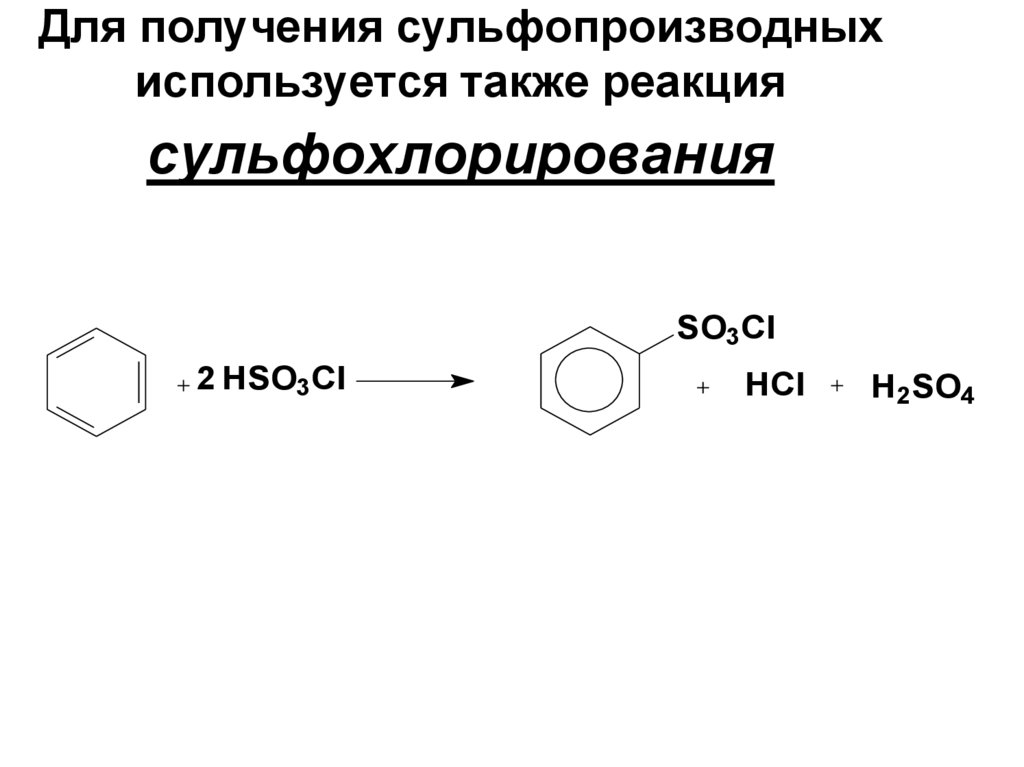
65. Для получения сульфопроизводных используется также реакция сульфохлорирования
SO3Cl2 HSO3Cl
HCl
H2SO4
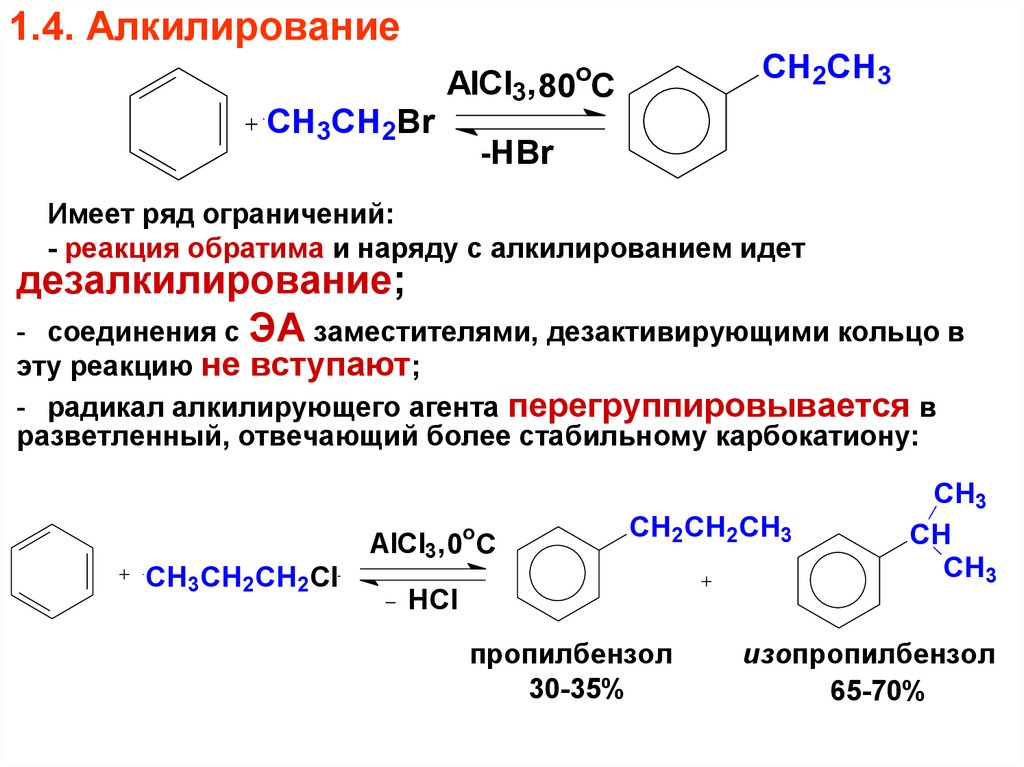
66. 1.4. Алкилирование
СH3CH2BrCH2CH3
AlCl3, 80oC
-HBr
Имеет ряд ограничений:
- реакция обратима и наряду с алкилированием идет
дезалкилирование;
- соединения с ЭА заместителями, дезактивирующими кольцо в
эту реакцию не вступают;
- радикал алкилирующего агента перегруппировывается в
разветленный, отвечающий более стабильному карбокатиону:
СH3CH2CH2Cl
AlCl3, 0oC
CH2CH2CH3
HCl
пропилбензол
30-35%
CH3
CH
CH3
изопропилбензол
65-70%
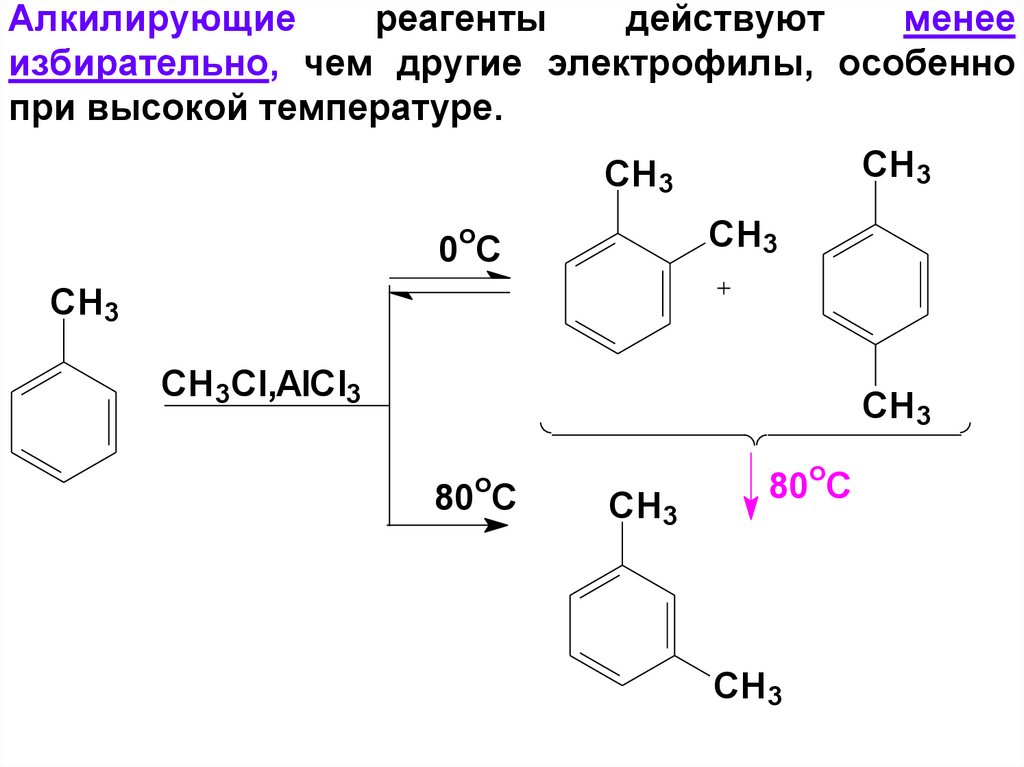
67. Алкилирующие реагенты действуют менее избирательно, чем другие электрофилы, особенно при высокой температуре.
СH3СH 3
CH 3
o
0 C
СH 3
CH 3Cl,AlCl3
CH3
o
80 C
СH 3
80oC
CH 3
68.
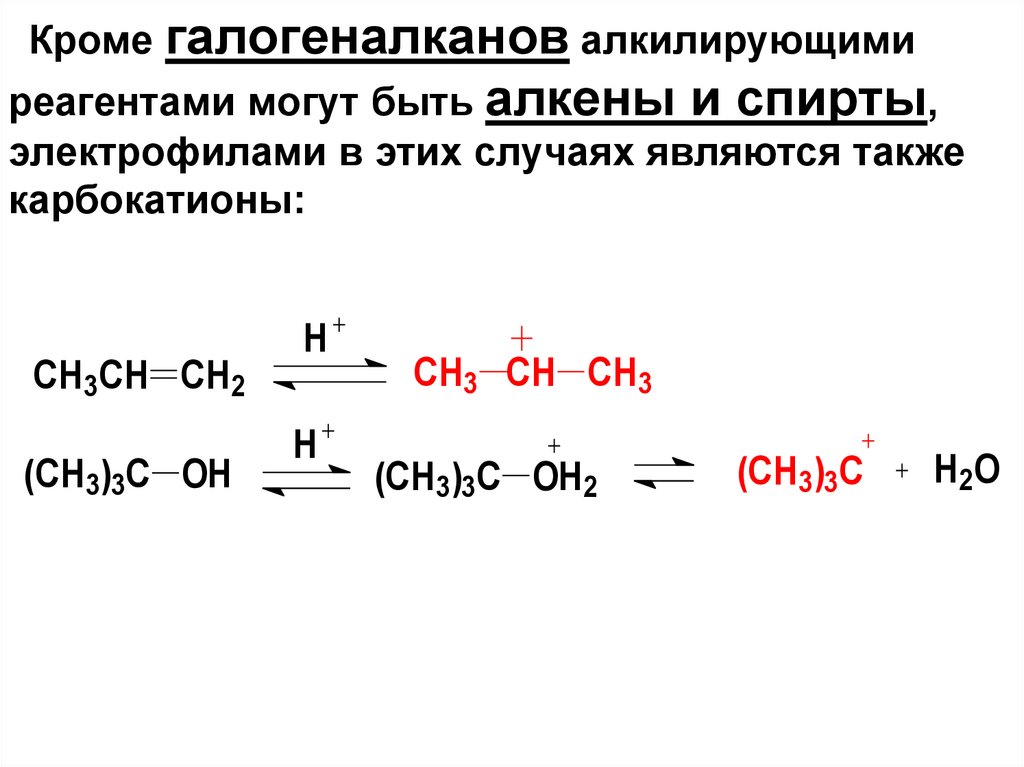
Кроме галогеналканов алкилирующимиреагентами могут быть алкены и спирты,
электрофилами в этих случаях являются также
карбокатионы:
CH3CH CH2
(CH3)3C OH
H
H
CH3 CH CH3
(CH3)3C OH2
(CH3)3C
H 2O
69.
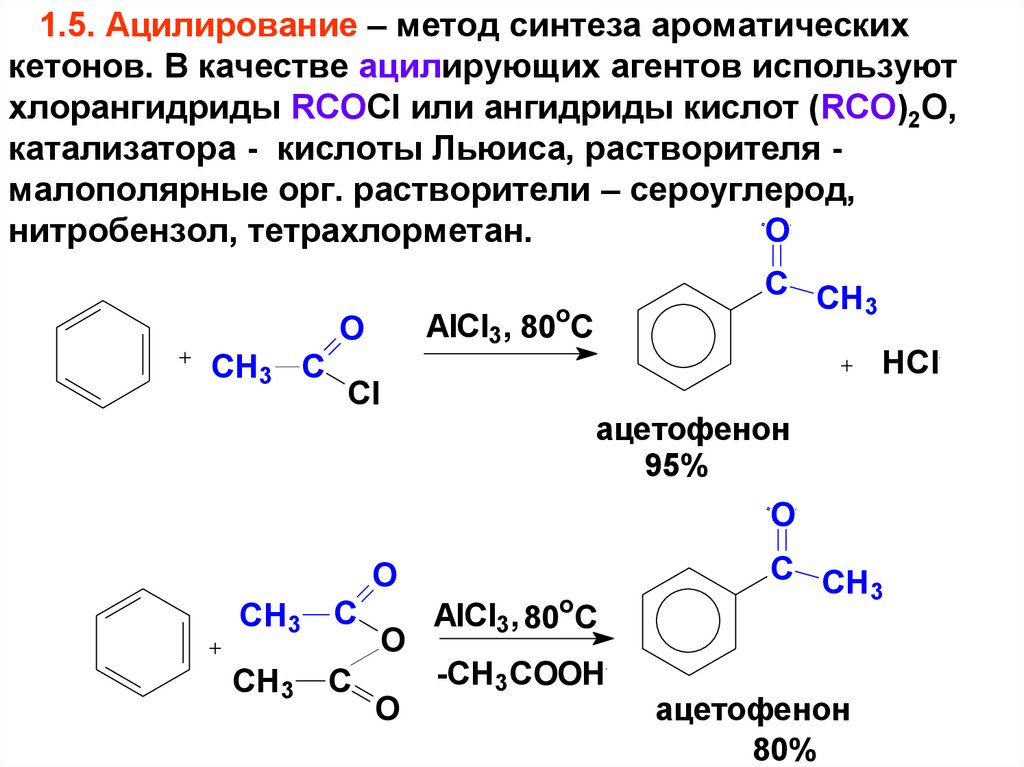
1.5. Ацилирование – метод синтеза ароматическихкетонов. В качестве ацилирующих агентов используют
хлорангидриды RCOCl или ангидриды кислот (RCO)2O,
катализатора - кислоты Льюиса, растворителя малополярные орг. растворители – сероуглерод,
O
нитробензол, тетрахлорметан.
AlCl3, 80oC
O
CH3 C
C CH
3
Cl
HCl
ацетофенон
95%
O
O
CH3
C
CH3
C
O
O
AlCl3, 80oC
-CH3COOH
C CH
3
ацетофенон
80%
70.
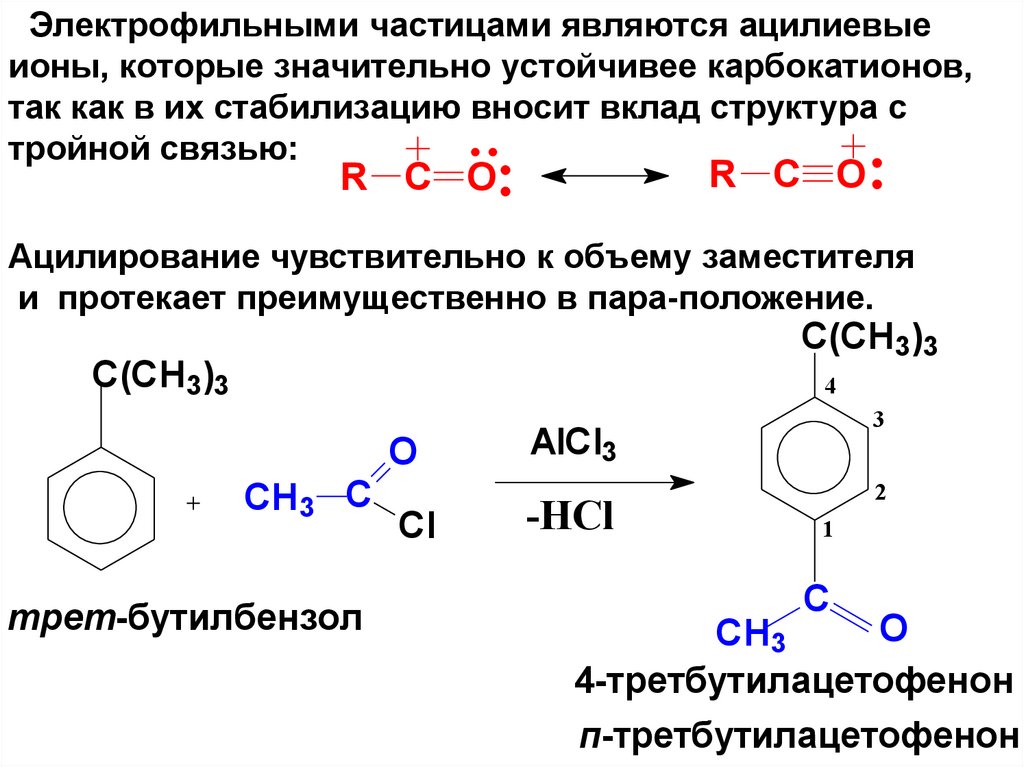
Электрофильными частицами являются ацилиевыеионы, которые значительно устойчивее карбокатионов,
так как в их стабилизацию вносит вклад структура с
тройной связью:
R C O
R C O
Ацилирование чувствительно к объему заместителя
и протекает преимущественно в пара-положение.
C(CH3)3
C(CH3)3
4
O
CH3 C
трет-бутилбензол
Cl
3
AlCl3
-НСl
2
1
C
O
CH3
4-третбутилацетофенон
п-третбутилацетофенон
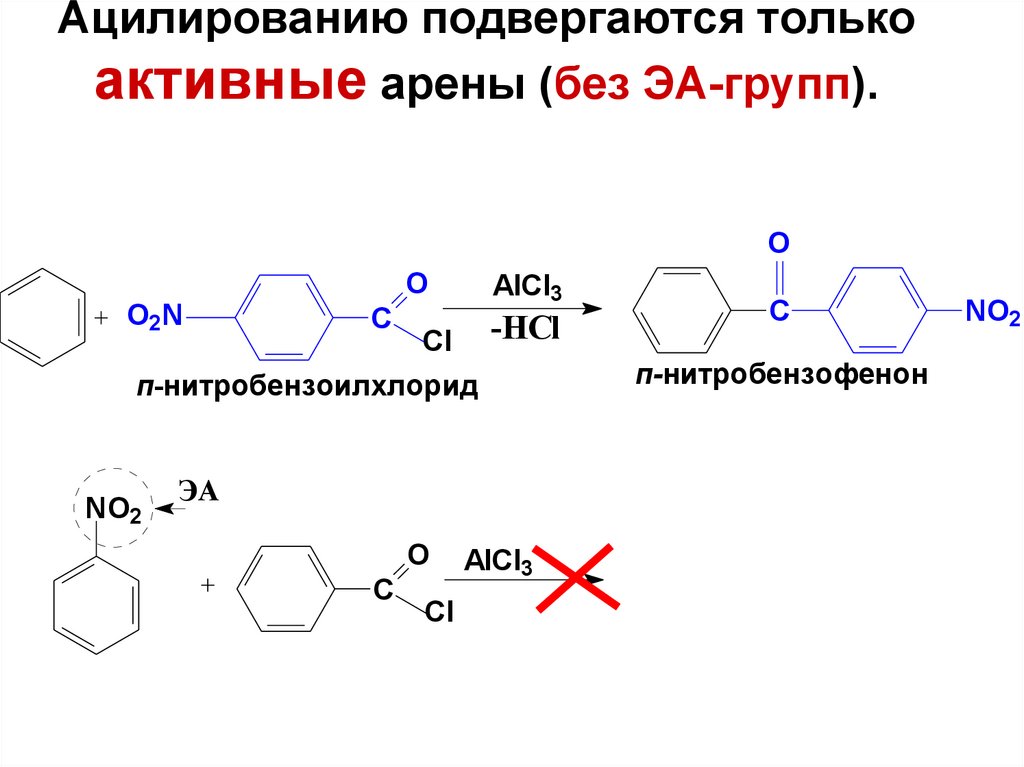
71. Ацилированию подвергаются только активные арены (без ЭА-групп).
OO2N
O
C
AlCl3
-НСl
Cl
п-нитробензоилхлорид
NO2
ЭА
O
C
Cl
AlCl3
C
п-нитробензофенон
NO2
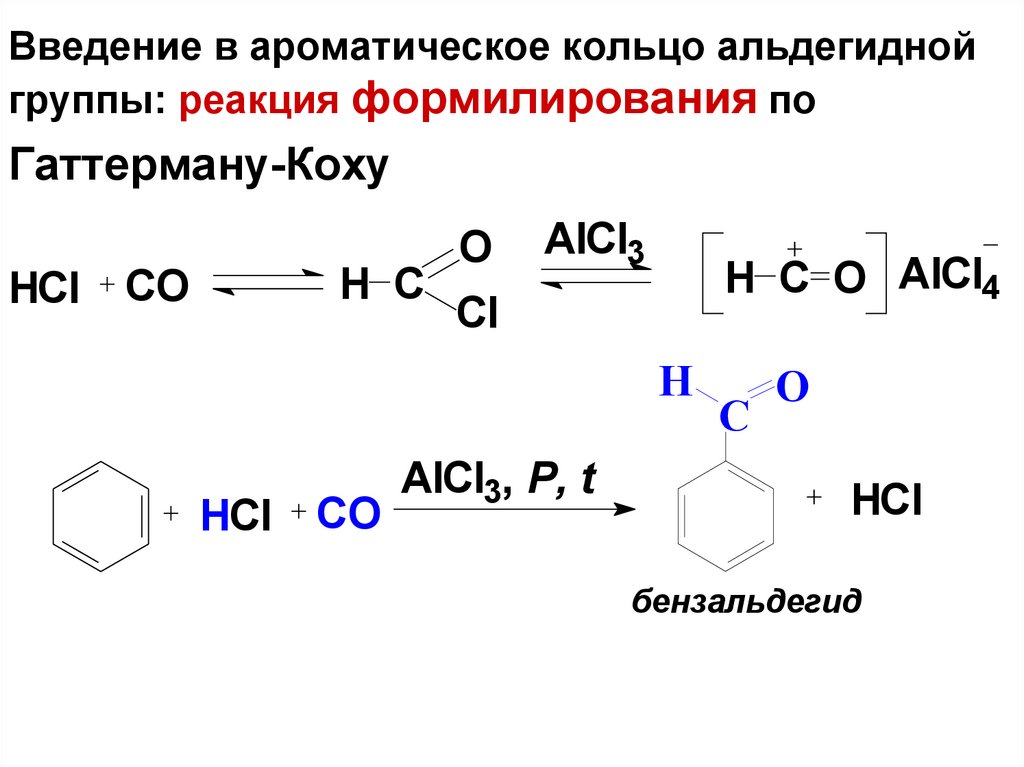
72. Введение в ароматическое кольцо альдегидной группы: реакция формилирования по Гаттерману-Коху
HClH C
CO
O
AlCl3
H C O AlCl4
Cl
H
HCl
CO
AlCl3, Р, t
C
O
HCl
бензальдегид
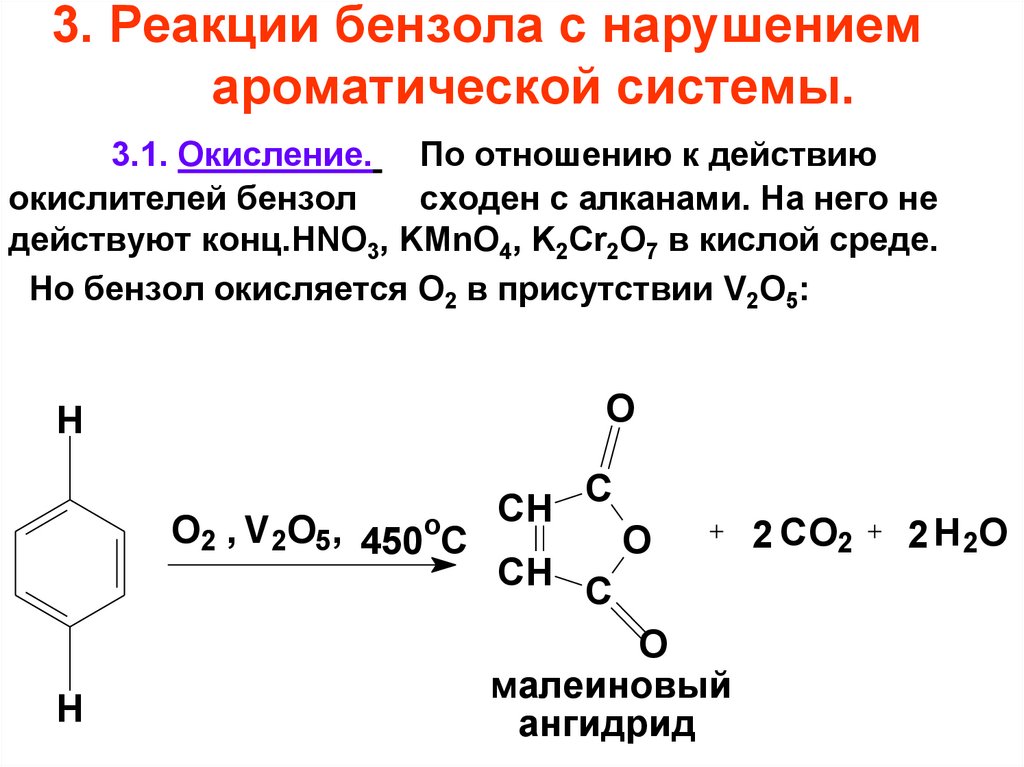
73. 3. Реакции бензола с нарушением ароматической системы.
3.1. Окисление. По отношению к действиюокислителей бензол
сходен с алканами. На него не
действуют конц.HNO3, KMnO4, K2Cr2O7 в кислой среде.
Но бензол окисляется O2 в присутствии V2O5:
O
H
O2 , V2O5, 450oC
H
CH
CH
C
O
C
O
малеиновый
ангидрид
2 CO2
2 H 2O
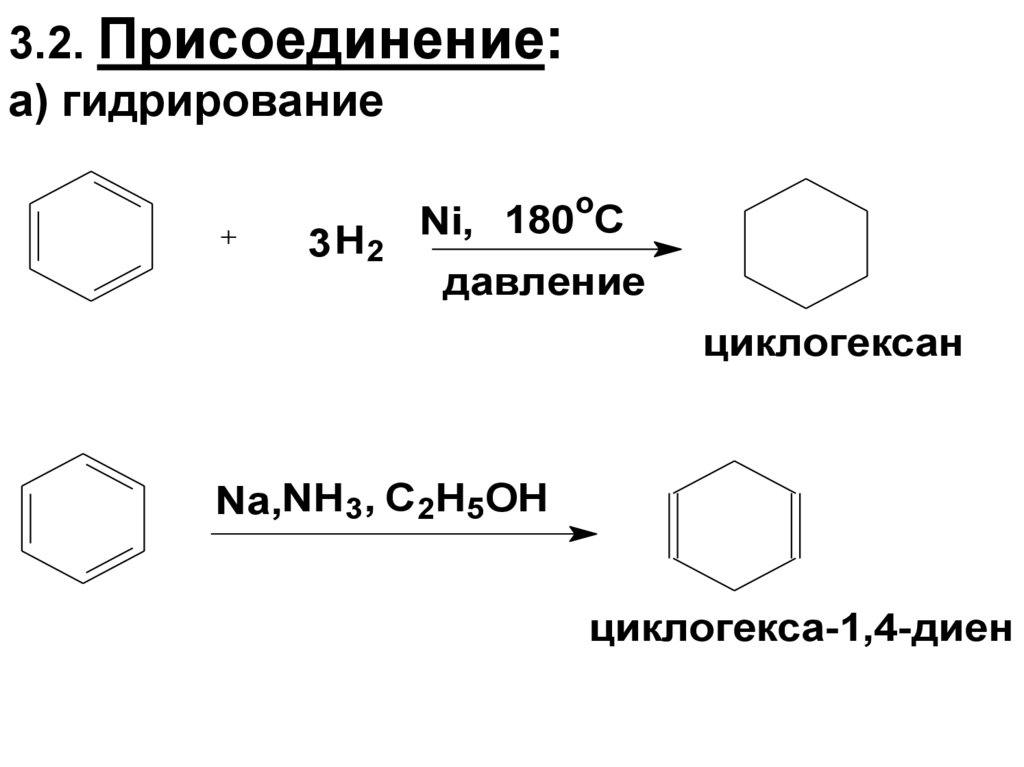
74. 3.2. Присоединение: а) гидрирование
3 H2o
Ni, 180 C
давление
циклогексан
Nа,NH3, C2H5OH
циклогекса-1,4-диен
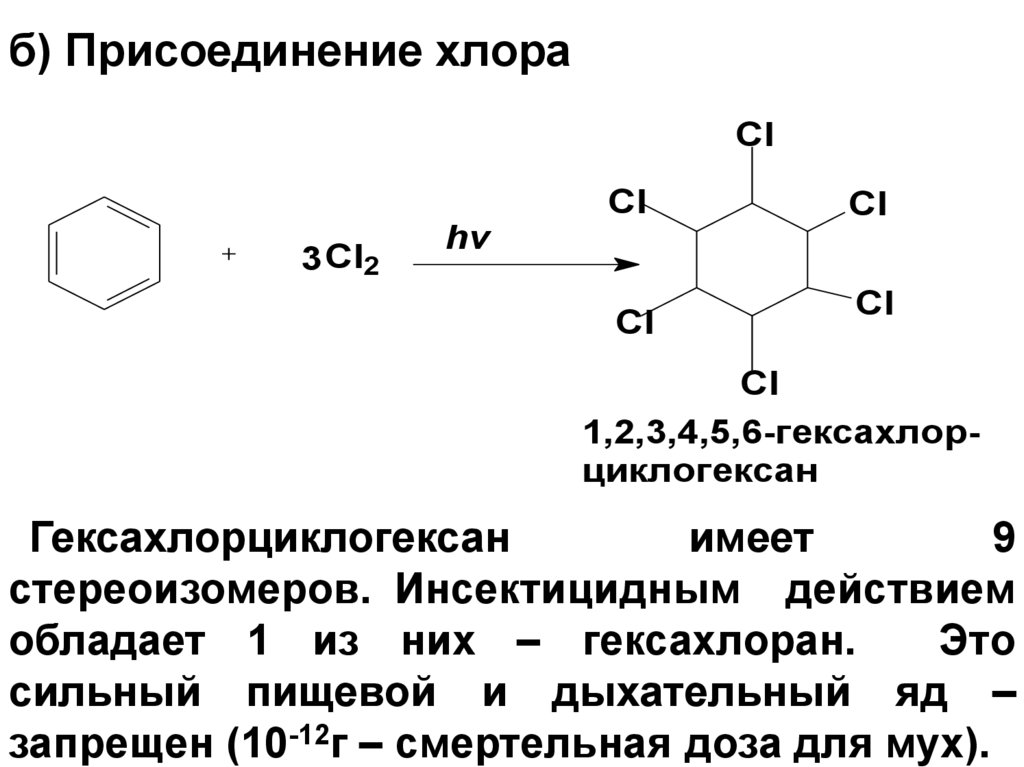
75. б) Присоединение хлора
Cl3 Cl2
hv
Cl
Cl
Cl
Cl
Cl
1,2,3,4,5,6-гексахлорциклогексан
Гексахлорциклогексан
имеет
9
стереоизомеров. Инсектицидным действием
обладает 1 из них – гексахлоран.
Это
сильный пищевой и дыхательный яд –
запрещен (10-12г – смертельная доза для мух).
76. 3.3. Реакции боковых цепей в алкилбензолах
3.3. Реакцииалкилбензолах
боковых
цепей
в
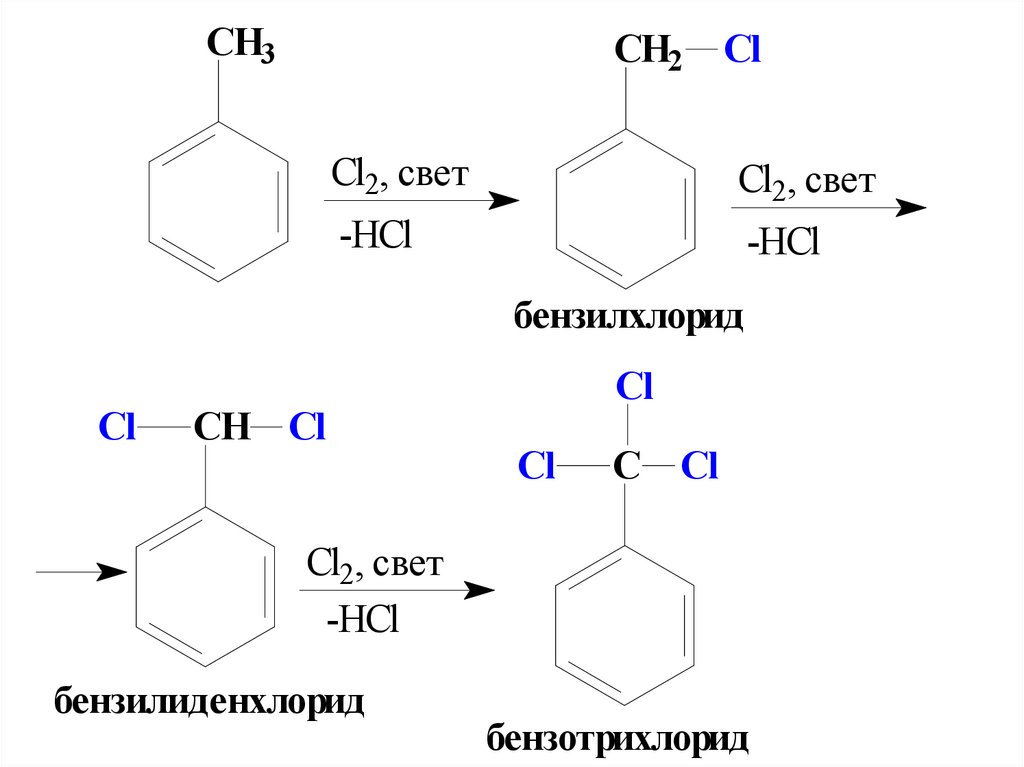
а) Галогенирование.Алкилбензолы
вступают в реакции радикального
хлорирования и бромирования боковой
цепи. Для инициирования образования
радикальных частиц используется
освещение ультрафиолотовым светом
(фотолиз) или высокие температуры 450-500ºС (термолиз).
При бромировании толуола возможно
замещение не более двух Н-атомов в
боковой цепи.
77.
СН3СН2
Cl
Cl2, свет
Cl2, свет
-НCl
-НCl
бензилхлорид
Cl
СН Cl
Cl
Cl
С Cl
Cl2, свет
-НCl
бензилиденхлорид
бензотрихлорид
78.
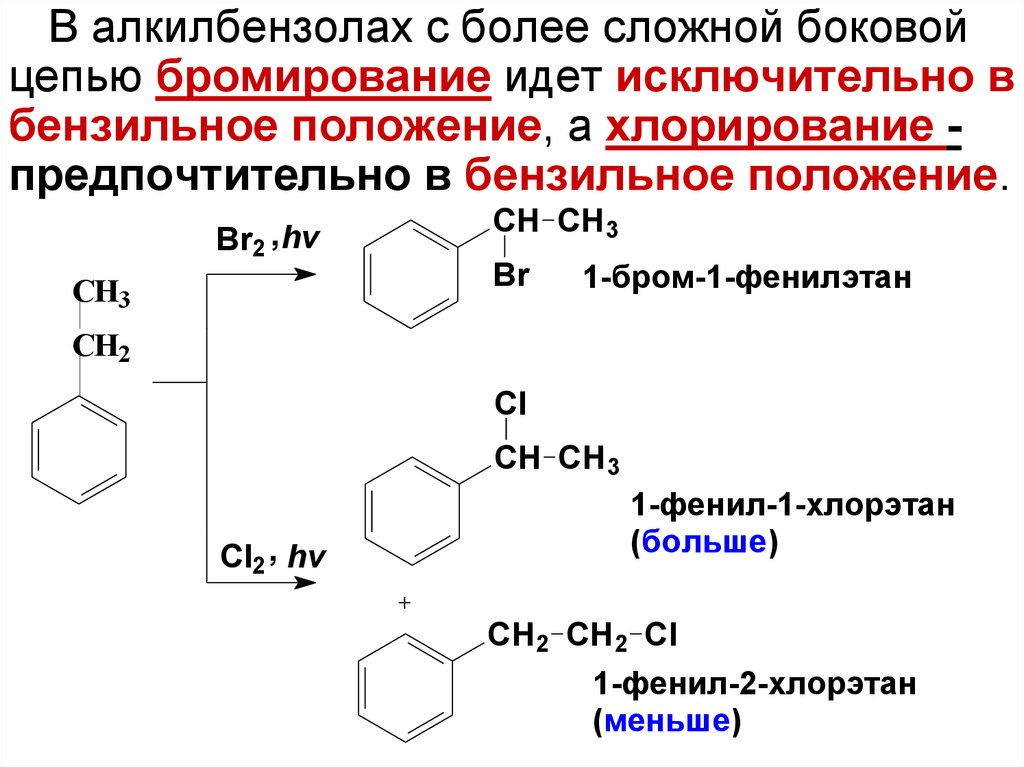
В алкилбензолах с более сложной боковойцепью бромирование идет исключительно в
бензильное положение, а хлорирование предпочтительно в бензильное положение.
Br2 , hv
СН3
CH CH 3
Br
1-бром-1-фенилэтан
СН2
Cl
CH CH3
Cl2 , hv
1-фенил-1-хлорэтан
(больше)
CH 2 CH2 Cl
1-фенил-2-хлорэтан
(меньше)
79.
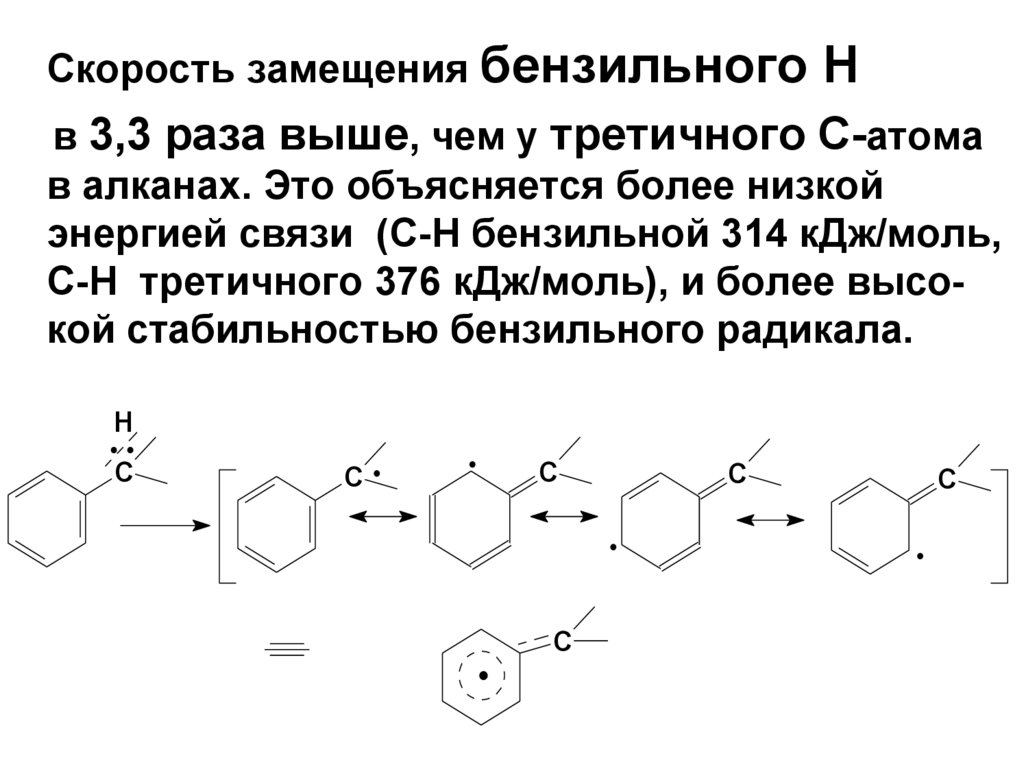
Скорость замещения бензильногоН
в 3,3 раза выше, чем у третичного С-атома
в алканах. Это объясняется более низкой
энергией связи (С-Н бензильной 314 кДж/моль,
С-Н третичного 376 кДж/моль), и более высокой стабильностью бензильного радикала.
Н
С
С
С
С
С
С
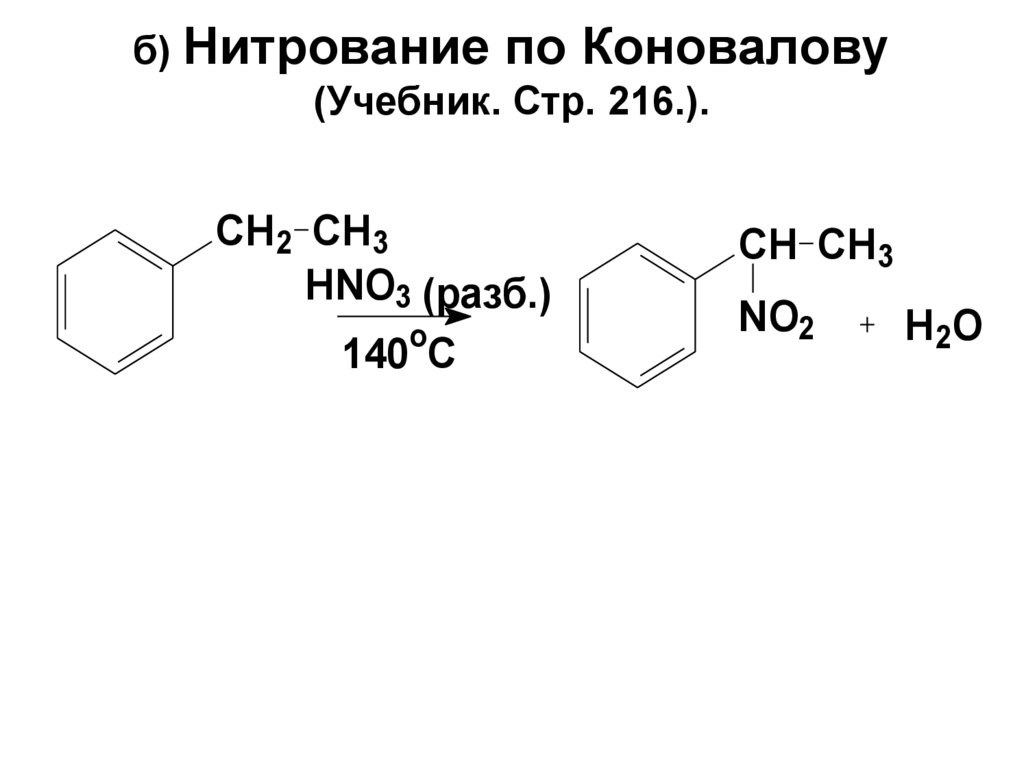
80. б) Нитрование по Коновалову (Учебник. Стр. 216.).
CH2 CH3HNO3 (разб.)
o
140 C
CH CH3
NO2
H2O
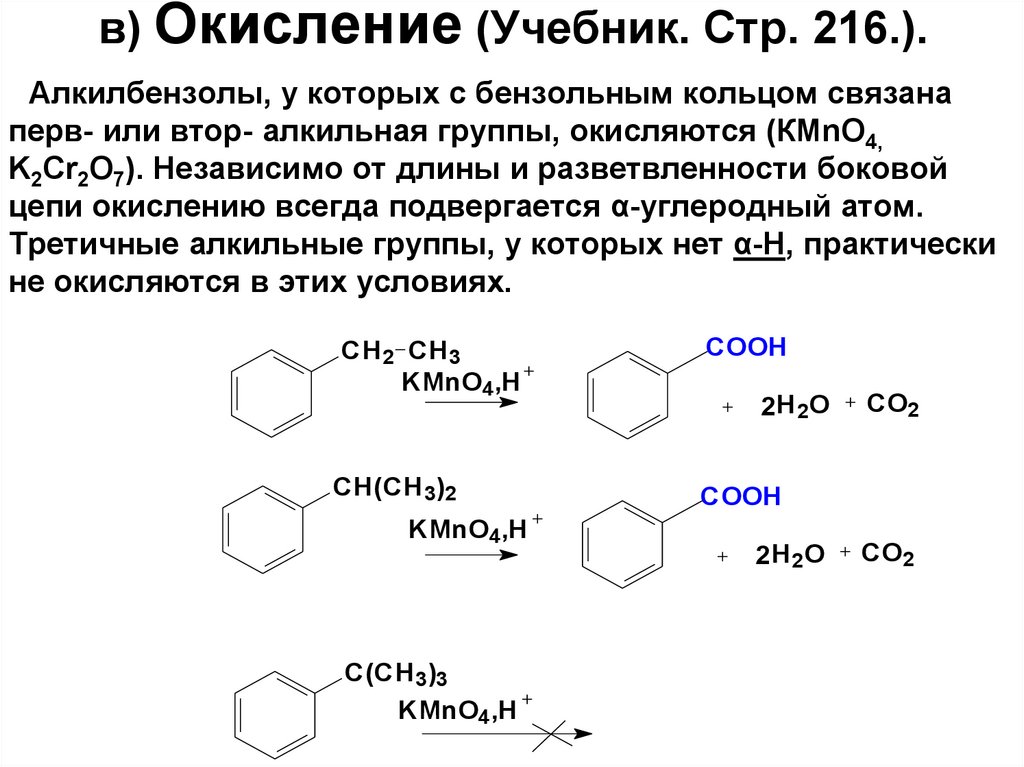
81. в) Окисление (Учебник. Стр. 216.).
Алкилбензолы, у которых с бензольным кольцом связанаперв- или втор- алкильная группы, окисляются (КМnO4,
K2Cr2O7). Независимо от длины и разветвленности боковой
цепи окислению всегда подвергается α-углеродный атом.
Третичные алкильные группы, у которых нет α-Н, практически
не окисляются в этих условиях.
CH 2 CH 3
KMnO4,H
CH(CH 3)2
KMnO4,H
C(CH 3)3
KMnO4,H
COOH
2H 2 O
CO2
COOH
2H 2 O
CO2
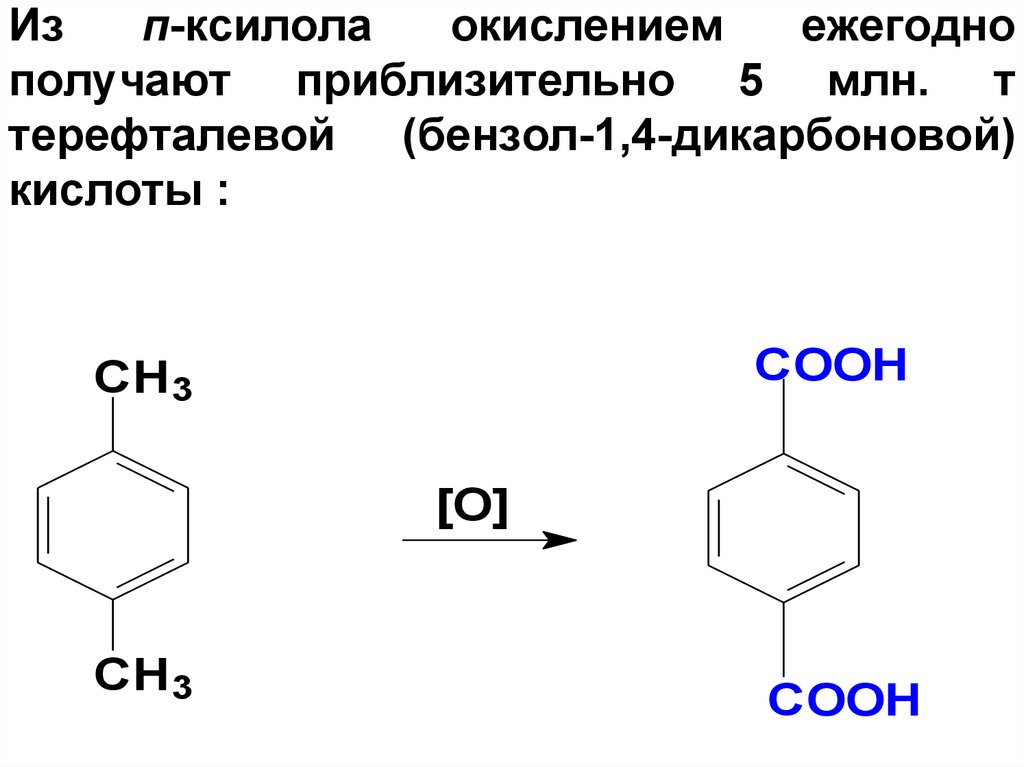
82. Из п-ксилола окислением ежегодно получают приблизительно 5 млн. т терефталевой (бензол-1,4-дикарбоновой) кислоты :
COOHCH3
[O]
CH3
COOH




















 chemistry
chemistry