Similar presentations:
Ароматические углеводороды (арены)
1. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
Общая формуламоноциклических аренов
СnH2n-6
2.
• Класс циклических ненасыщенныхуглеводородов ряда бензола
называется ароматическими
углеводородами или аренами
Арены классифицируются
- в зависимости от числа ароматических
циклов
- в зависимости от способа соединения
би-, три-, и т.д. полициклических аренов.
3.
• Простейшие арены –моноциклические арены ряда
бензола, т.е. гомологи бензола,
которые получаются в результате
замещения атомов водорода в
АРОМАТИЧЕСКОМ ЦИКЛЕ БЕНЗОЛА
или боковых цепях на алкильные
заместители
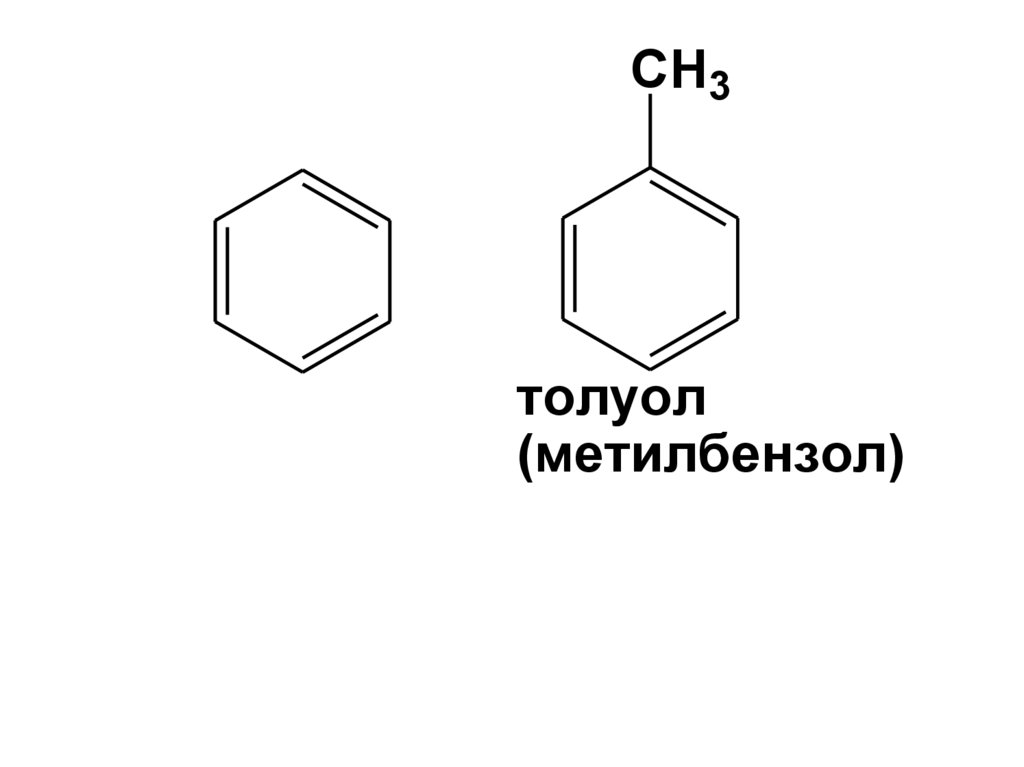
4.
CH3толуол
(метилбензол)
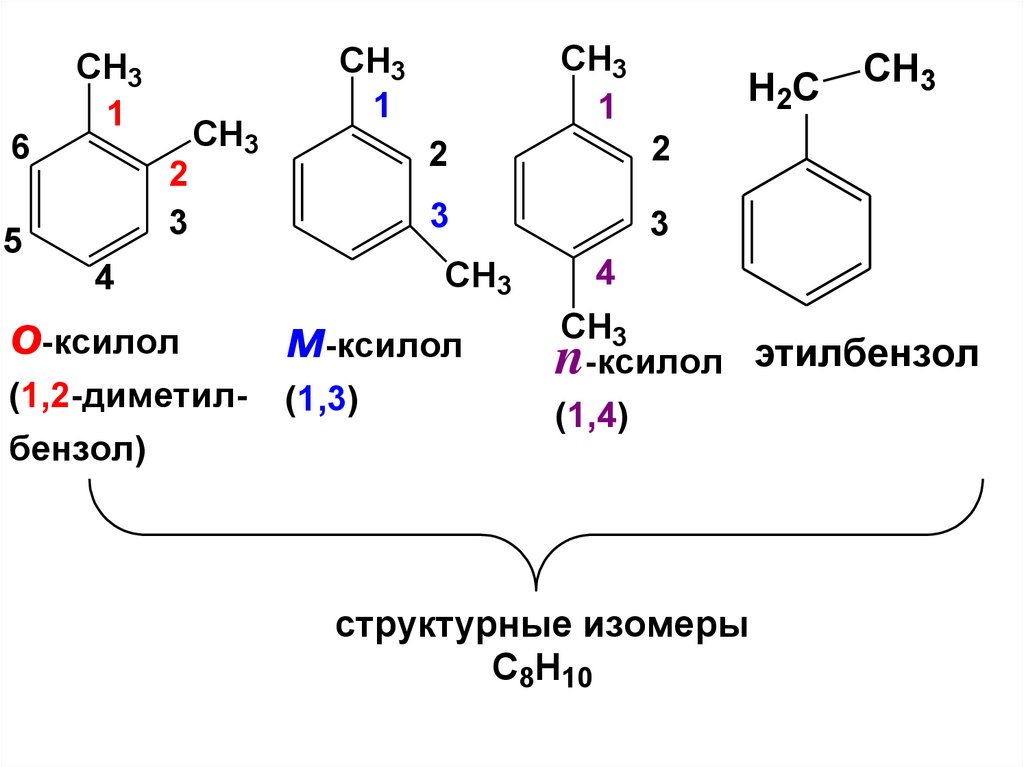
5.
CH31
6
CH3
2
3
5
CH3
1
CH3
1
2
2
3
3
CH3
4
o-ксилол
м-ксилол
(1,2-диметил-
(1,3)
бензол)
H2C
CH3
4
CH3
n-ксилол этилбензол
(1,4)
структурные изомеры
С8Н10
6.
ОРТОМЕТА
ПАРА
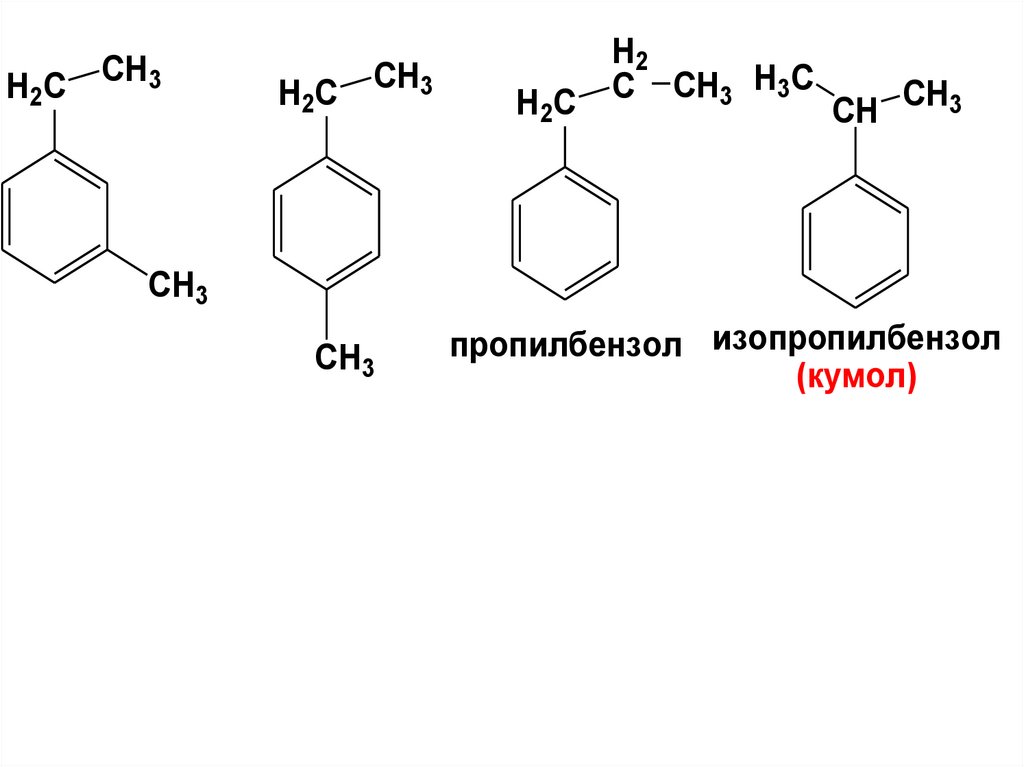
7.
H2 CCH3
H2C
CH3
H2 C
H2
C CH3 H3C
CH CH3
CH3
CH3
пропилбензол изопропилбензол
(кумол)
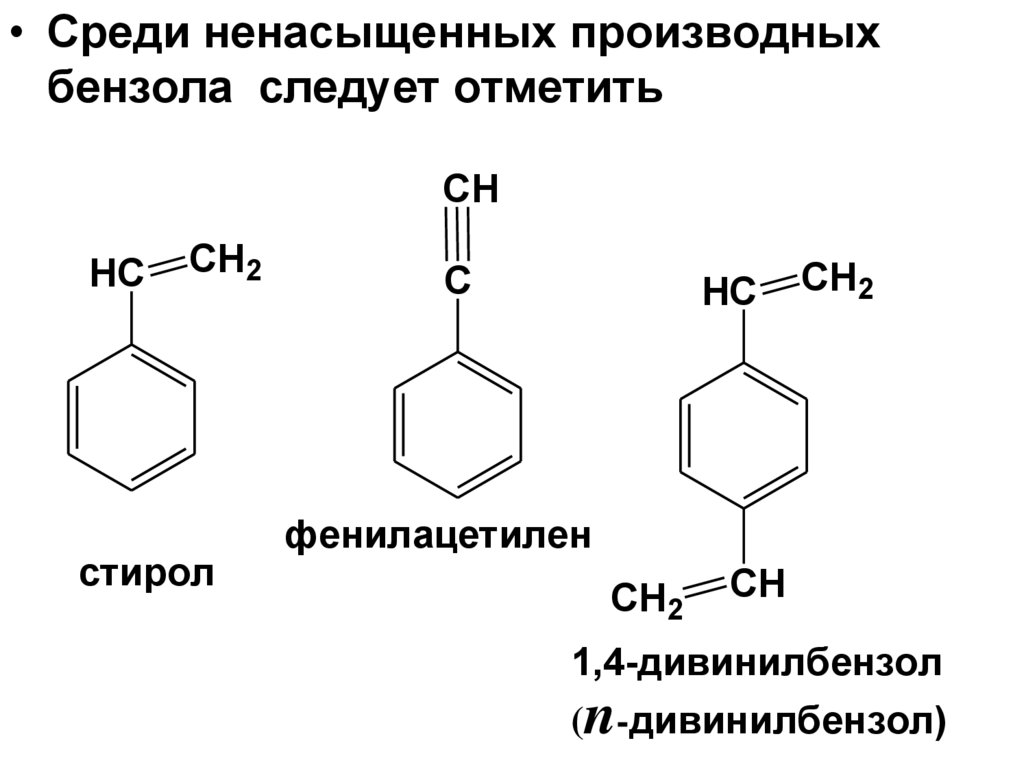
8.
• Среди ненасыщенных производныхбензола следует отметить
CH
HC
CH2
стирол
C
HC
CH2
фенилацетилен
CH2
CH
1,4-дивинилбензол
(n-дивинилбензол)
9.
• Современная номенклатура - требуетсяиспользовать для наименования ареногв
суффикс ен (бензен, толуен, ксилены и
т.д.), как в английском языке – benzene,
toluene
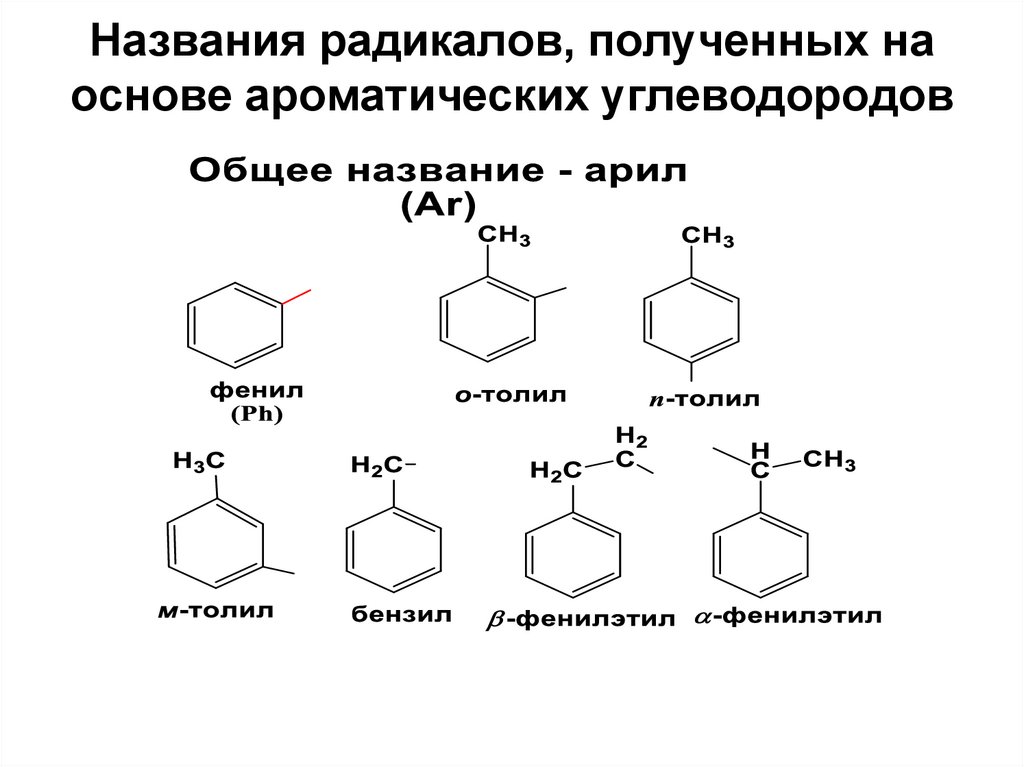
10. Названия радикалов, полученных на основе ароматических углеводородов
11. ФИЗИЧЕСКИЕ СВОЙСТВА
• Арены представляют собой бесцветныежидкости или кристаллические в-ва,
низшие обладают запахом, летучи,
нерастворимы в воде.
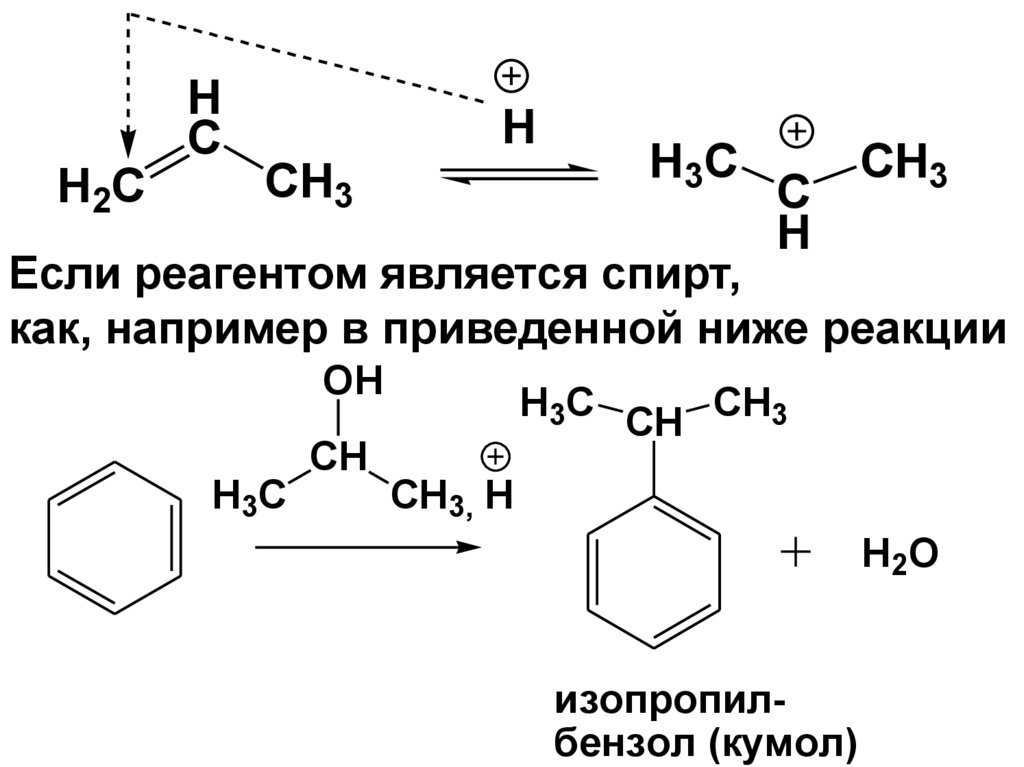
12.
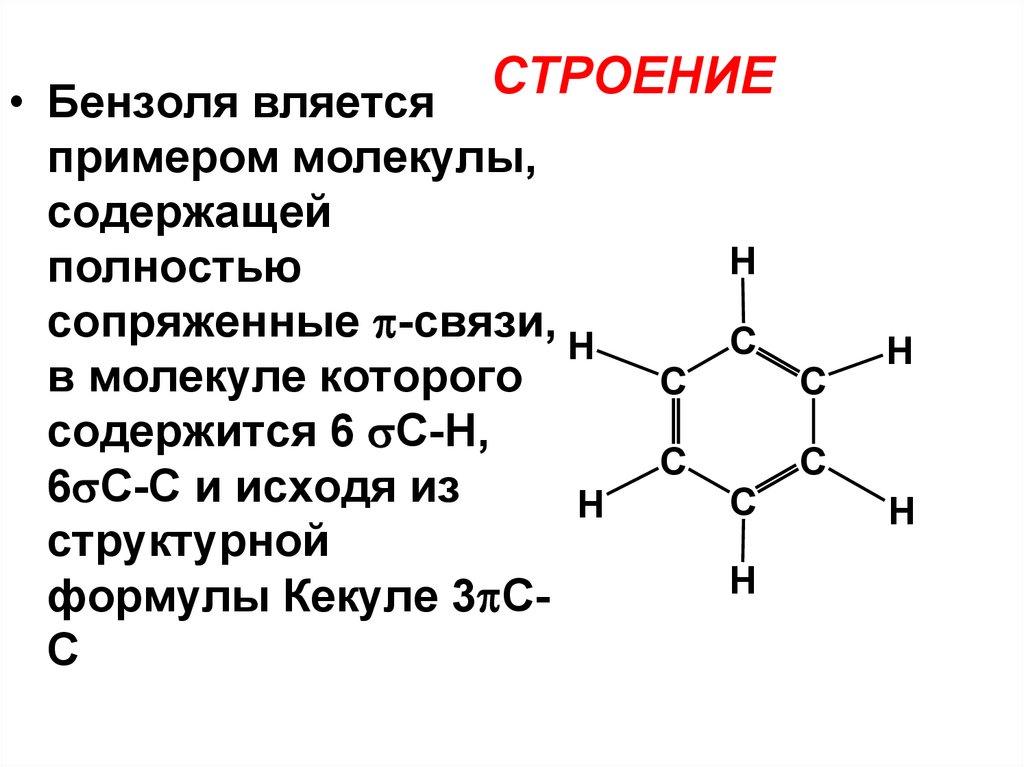
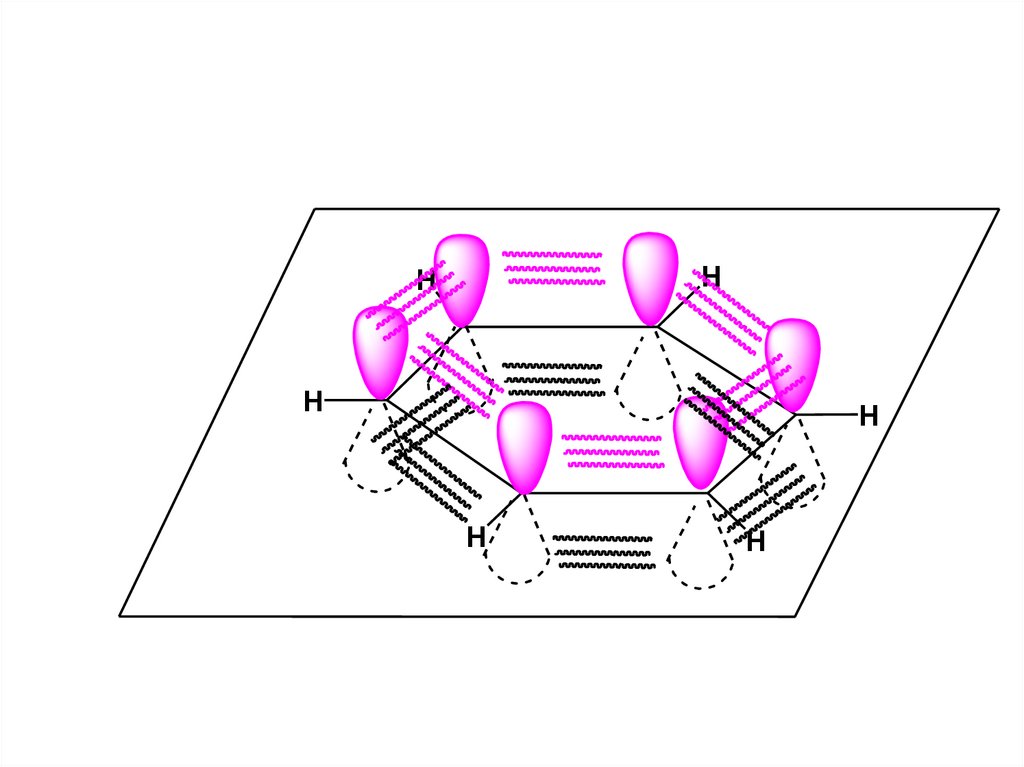
СТРОЕНИЕ• Бензоля вляется
примером молекулы,
содержащей
полностью
сопряженные -связи, H
в молекуле которого
содержится 6 С-Н,
6 С-С и исходя из
H
структурной
формулы Кекуле 3 СС
H
C
C
C
C
C
C
H
H
H
13.
HH
H
H
H
H
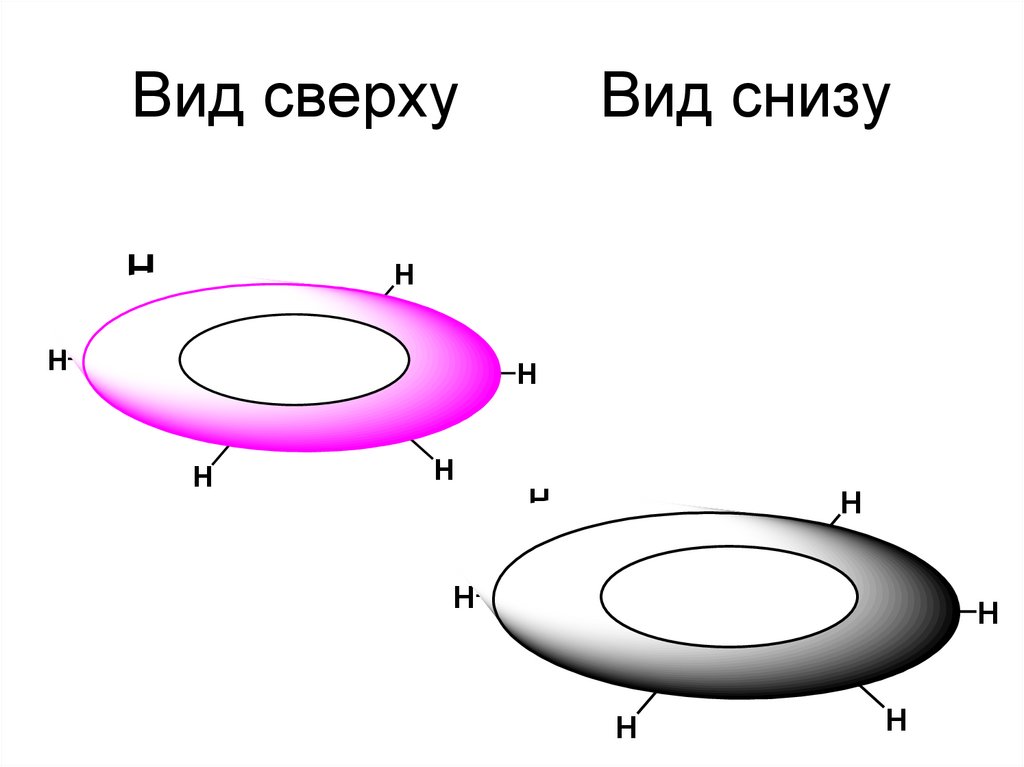
14. Вид сверху Вид снизу
Вид сверхуH
Вид снизу
H
H
H
H
H
H
H
H
H
H
H
15.
• Молекула бензола совершенносимметрична
Естаб. =150,1 кДж/моль
• Для описания систем с
делокализованными
(сопряженными) системами связей
используют метод МО
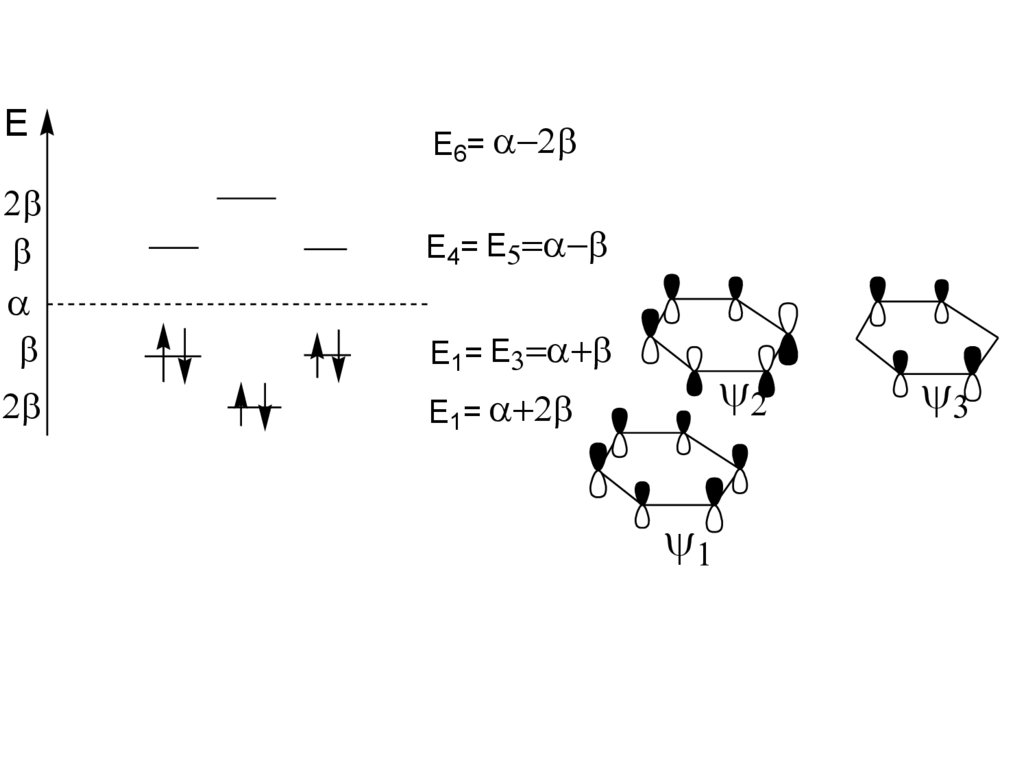
16.
EE6=
E4= E
E1= E
E1=
17.
• В молекуле бензола имеет местообразование сопряженной системы
- -типа, которая образуется
при чередовании кратных связей в
молекуле (через одну -связь)
18. БЕНЗОЛ
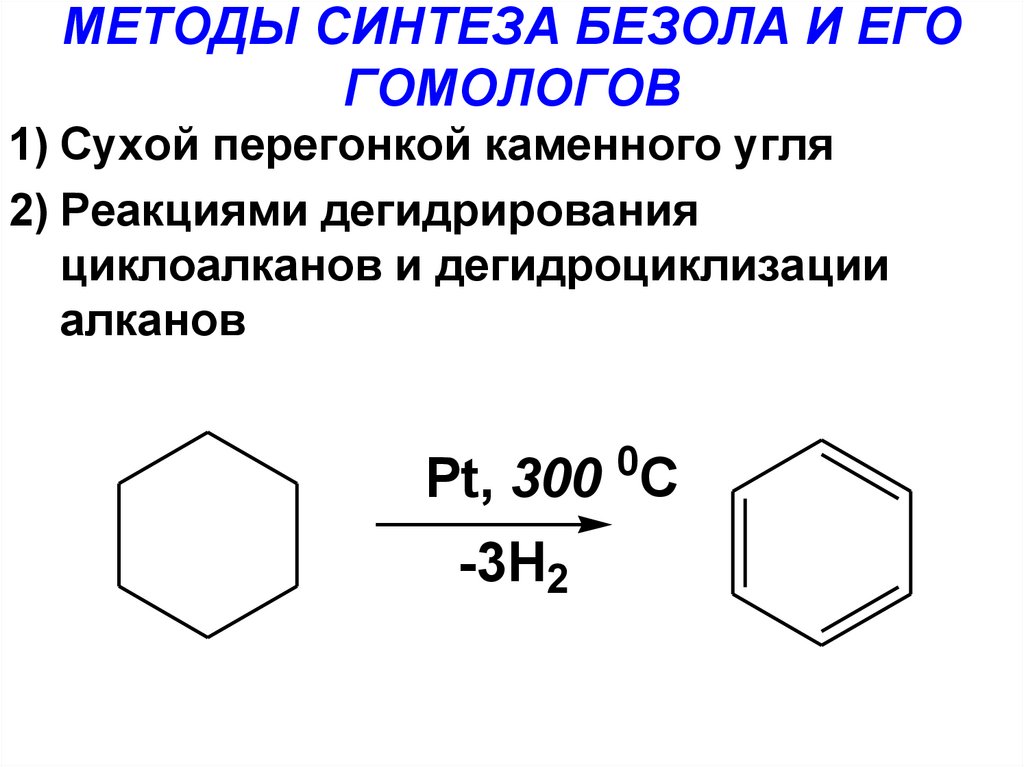
19. МЕТОДЫ СИНТЕЗА БЕЗОЛА И ЕГО ГОМОЛОГОВ
1) Сухой перегонкой каменного угля2) Реакциями дегидрирования
циклоалканов и дегидроциклизации
алканов
0
Pt, 300 C
-3H2
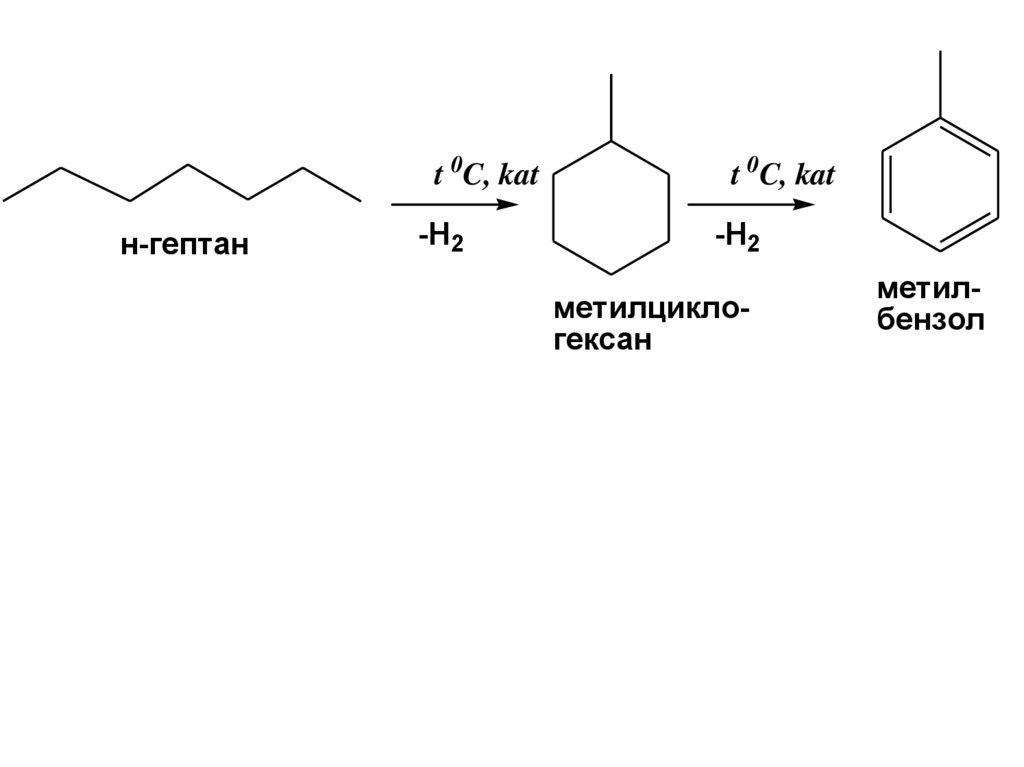
20.
t 0C, katн-гептан
-H2
t 0C, kat
-H2
метилциклогексан
метилбензол
21.
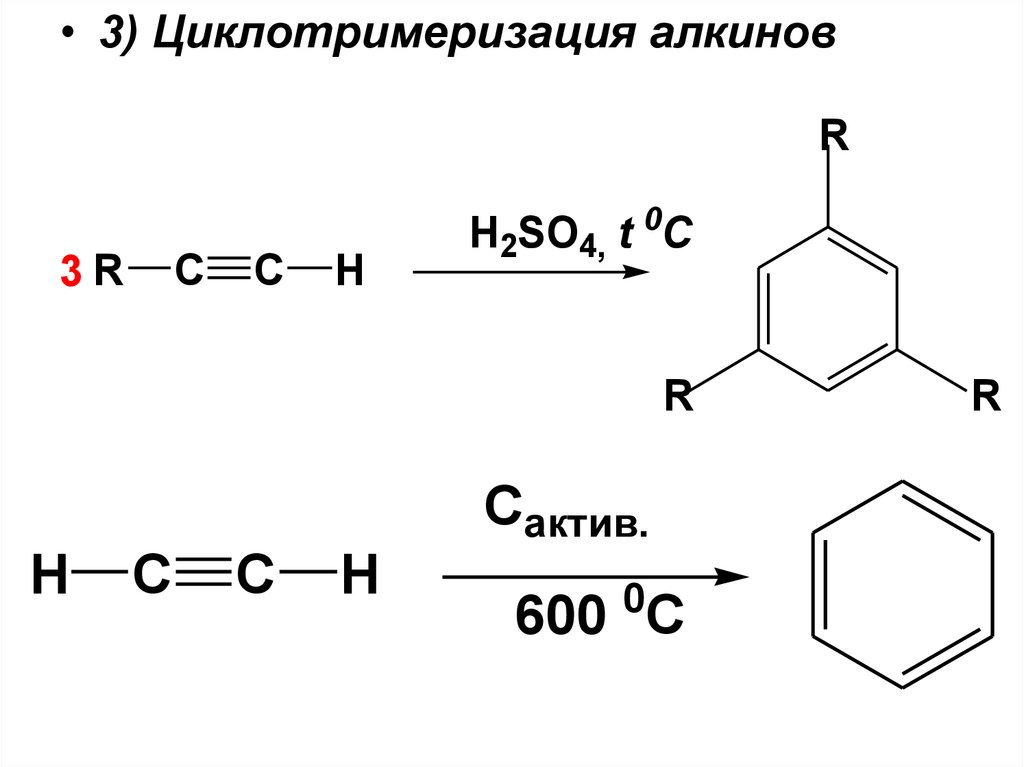
• 3) Циклотримеризация алкиновR
3R
C
C
H
H2SO4, t 0C
R
Сактив.
H
C
C
H
0
600 C
R
22.
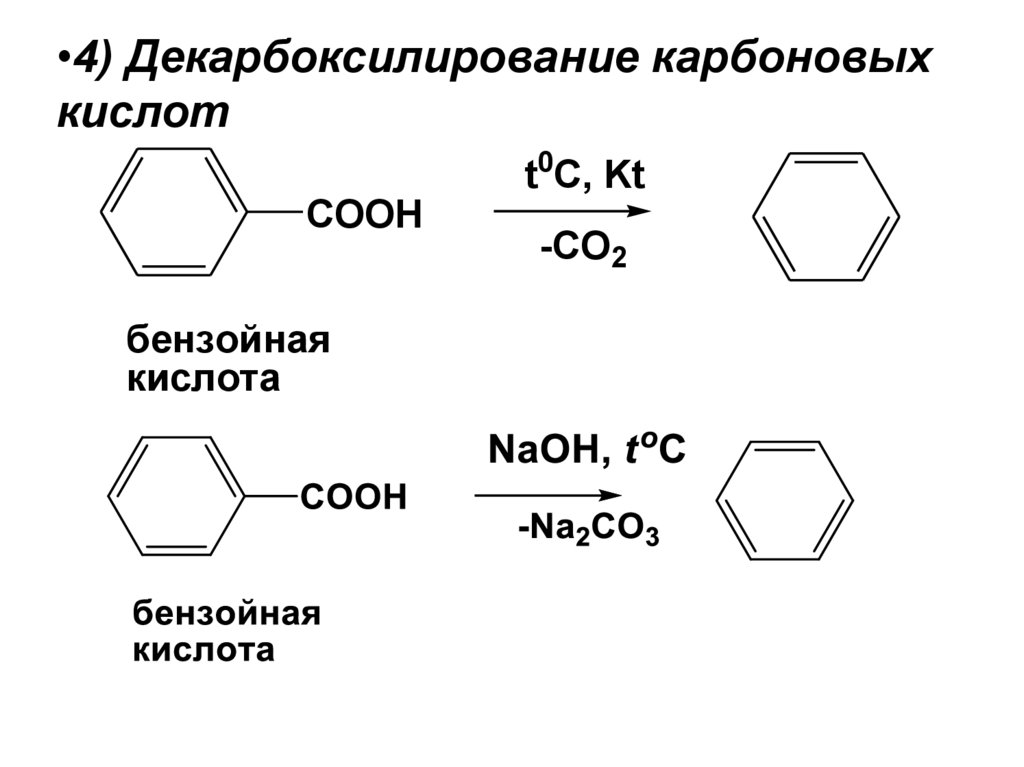
•4) Декарбоксилирование карбоновыхкислот
t0C, Kt
COOH
бензойная
кислота
-CO2
23. СПОСОБЫ ПОЛУЧЕНИЯ ГОМОЛОГОВ БЕНЗОЛА
• 1) Алкилирование бензола и егогомологов по Фриделю-Крафтсу
• АЛКИЛирование – введение в молекулу
алкильного заместителя (R-: метил,
этил, пропил и т.д.)
AlCl3
R
Cl
- HCl
R
24.
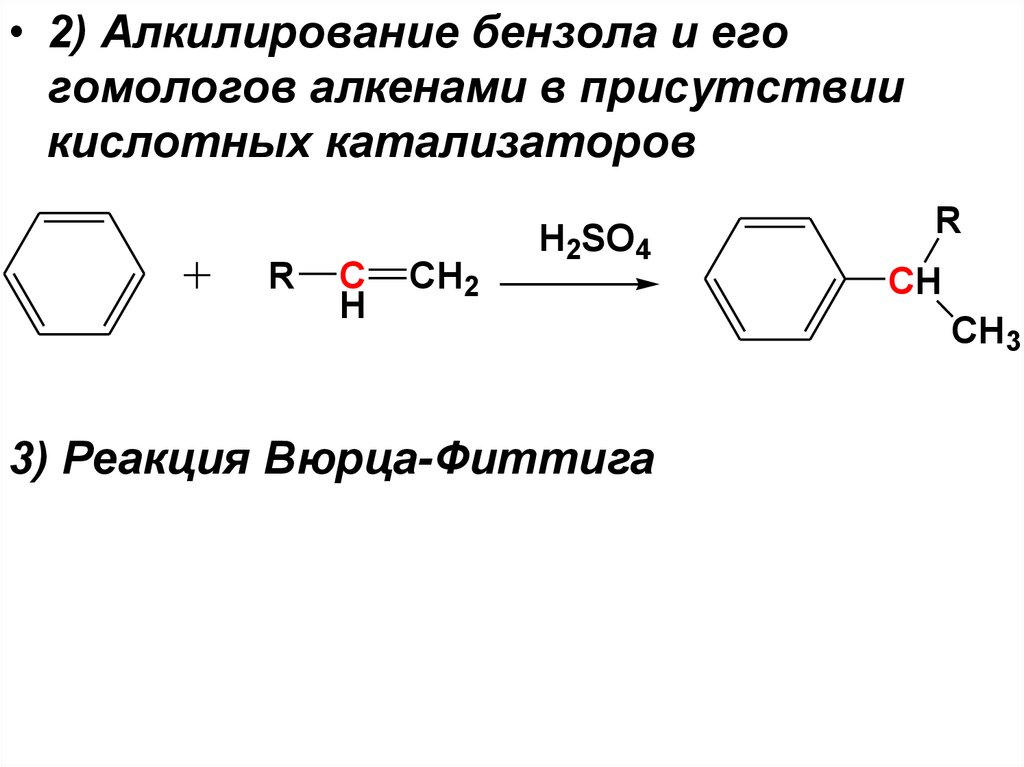
• 2) Алкилирование бензола и егогомологов алкенами в присутствии
кислотных катализаторов
R
C
H
CH2
H2SO4
3) Реакция Вюрца-Фиттига
R
CH
CH3
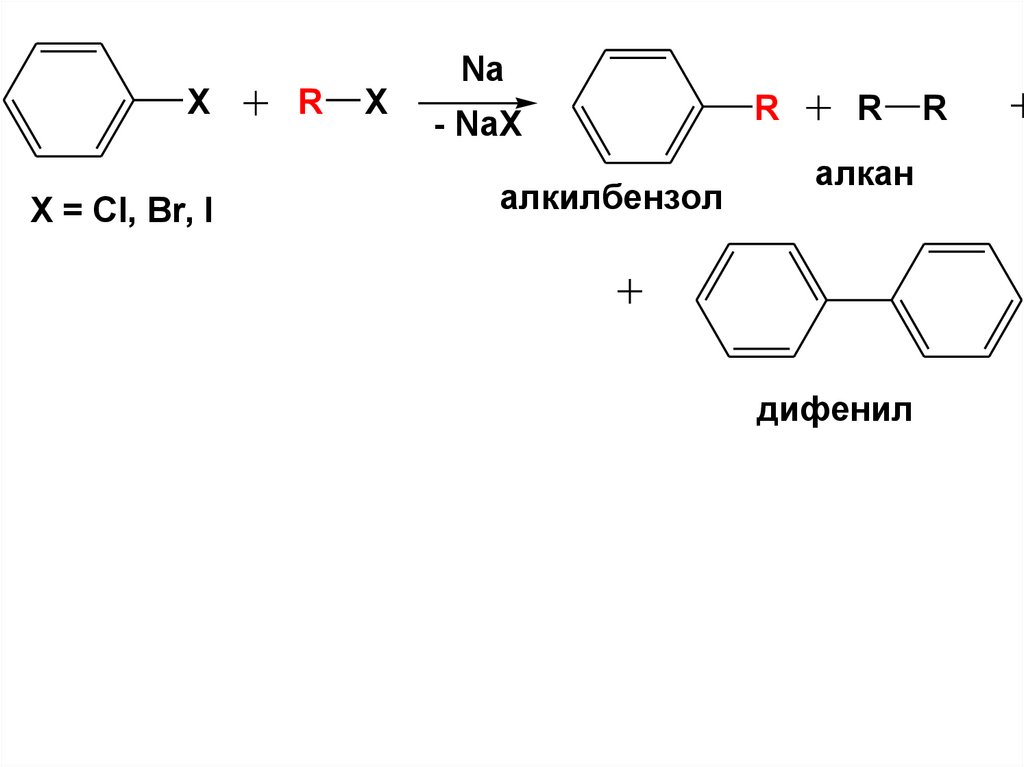
25.
NaX
X = Cl, Br, I
R
X
- NaX
алкилбензол
R
R
алкан
дифенил
R
26.
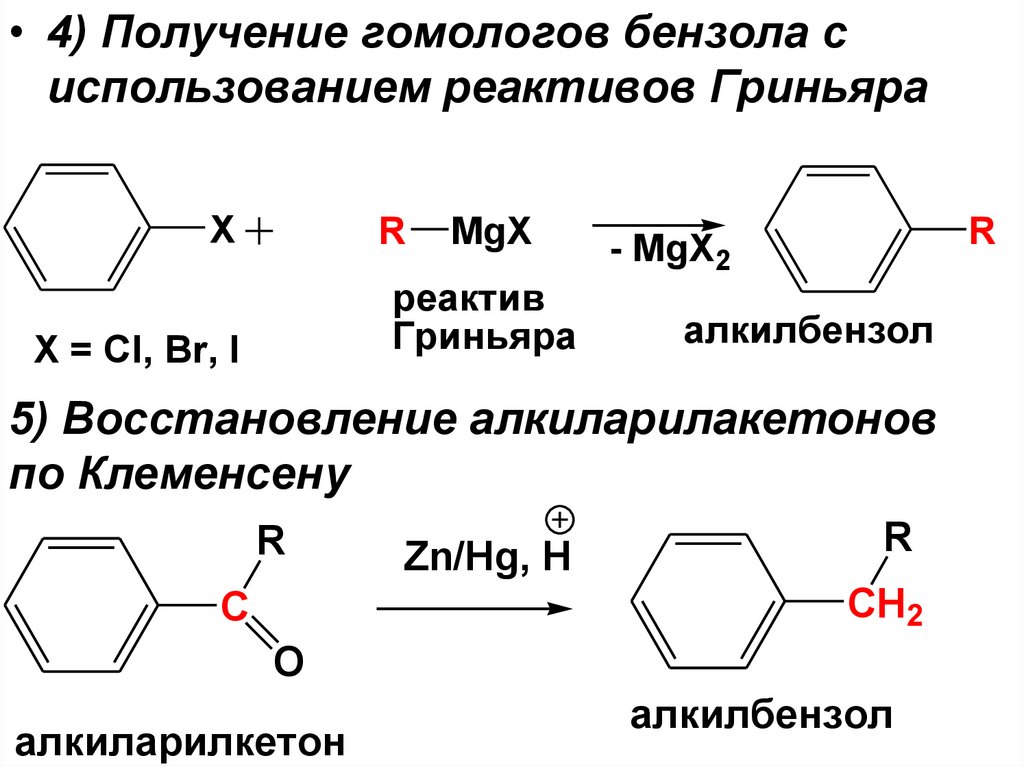
• 4) Получение гомологов бензола сиспользованием реактивов Гриньяра
X
R
MgX
реактив
Гриньяра
X = Cl, Br, I
R
- MgX2
алкилбензол
5) Восстановление алкиларилакетонов
по Клеменсену
R
Zn/Hg, H
R
CH2
C
O
алкиларилкетон
алкилбензол
27.
28. Химические свойства
•1) Для бензола и его гомологов, несмотряна его ненасыщенность, характерны
реакции электрофильного замещения (SE).
• 2) Для гомологов бензола характерны
реакции с участием боковых цепей
(углеводородных заместителей), причем
эти реакции идут по SR механизму.
•3)В жестких условиях в присутствии
специальных катализаторов и УФоблучения бензол и его гомологи
вступают в реакции радикального
присоединения (АR)
29. РЕАКЦИИ электрофильного Замещения - SE
РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГОЗАМЕЩЕНИЯ -
SE
• Относятся реакции нитрования,
сульфирования, галогенирования,
алкилирования, и ацилирования
ароматических соединений. Ниже
представлены соответствующие
уравнения реакций для бензола:
30.
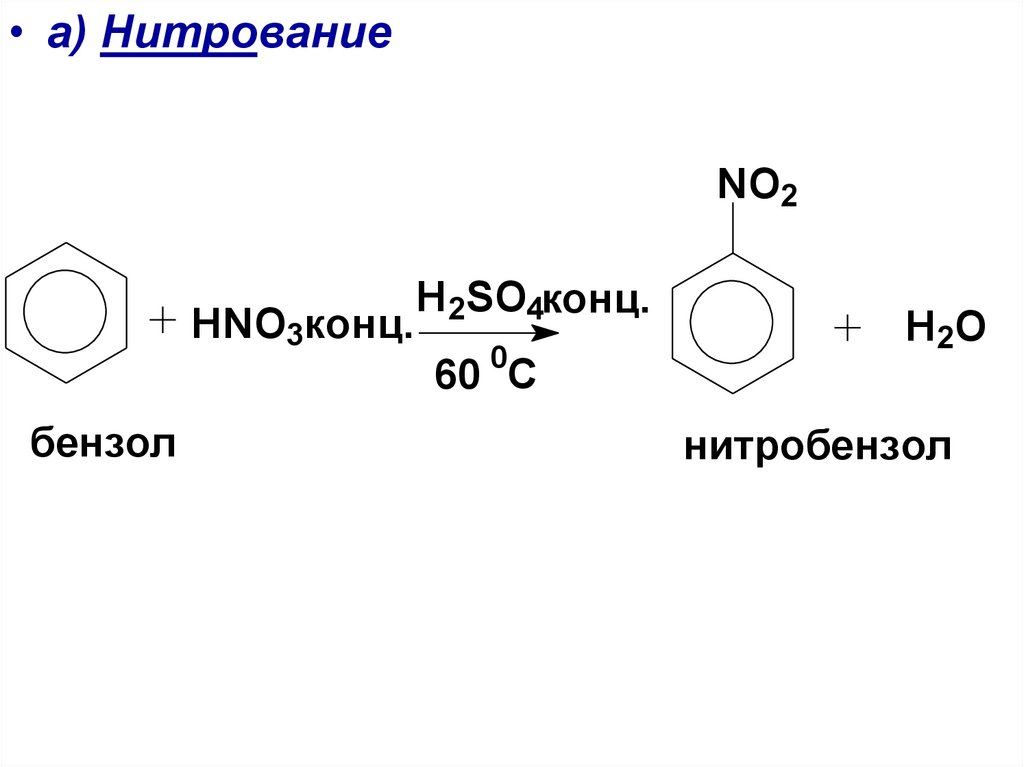
• а) НитрованиеNO2
HNO3конц.
бензол
Н2SO4конц.
0
60 С
H 2O
нитробензол
31.
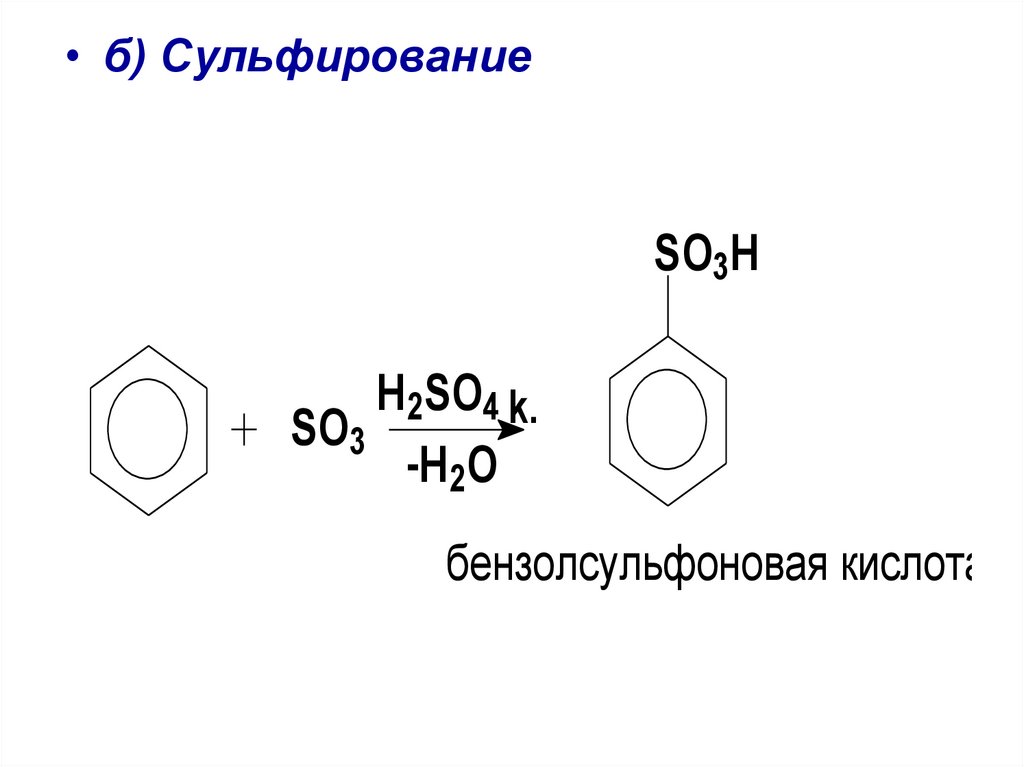
• б) СульфированиеSO3H
H2SO4 k.
SO3
-H 2 O
бензолсульфоновая кислота
32.
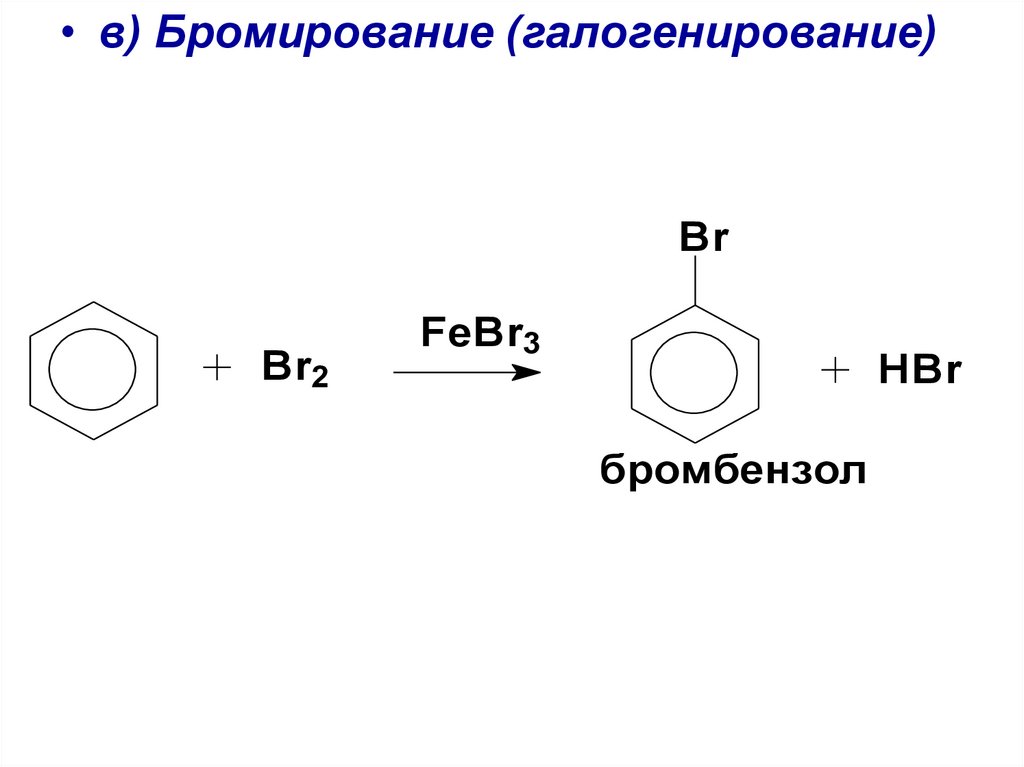
• в) Бромирование (галогенирование)Br
Br2
FeBr3
HBr
бромбензол
33.
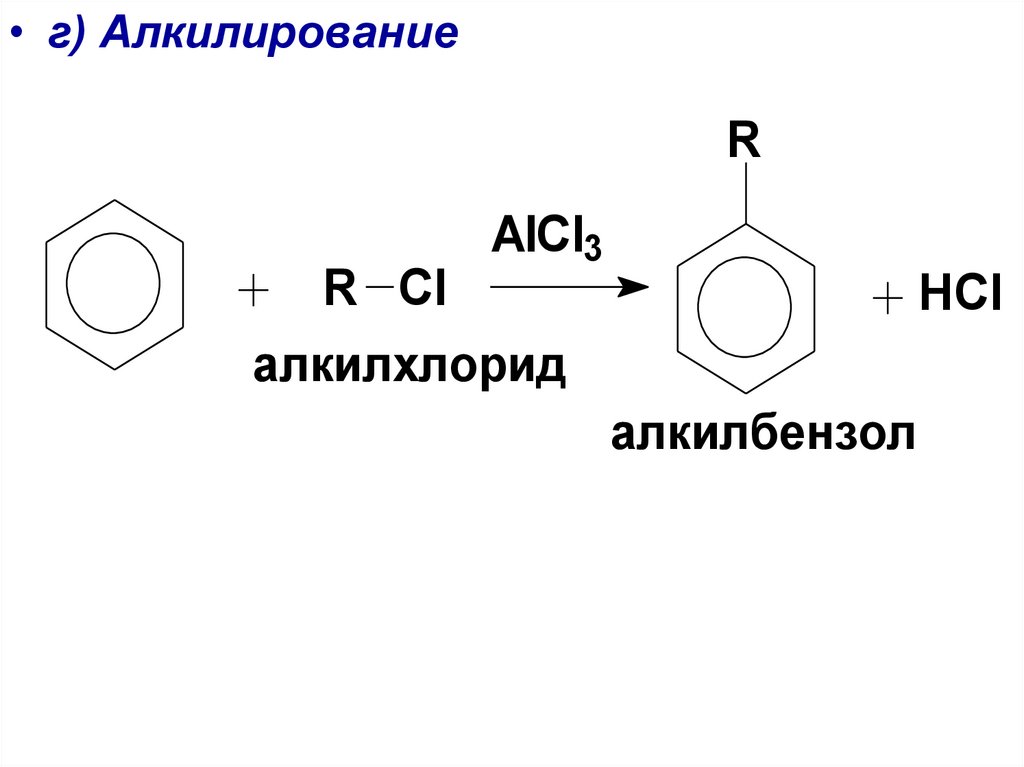
• г) АлкилированиеR
AlCl3
R Cl
алкилхлорид
HCl
алкилбензол
34.
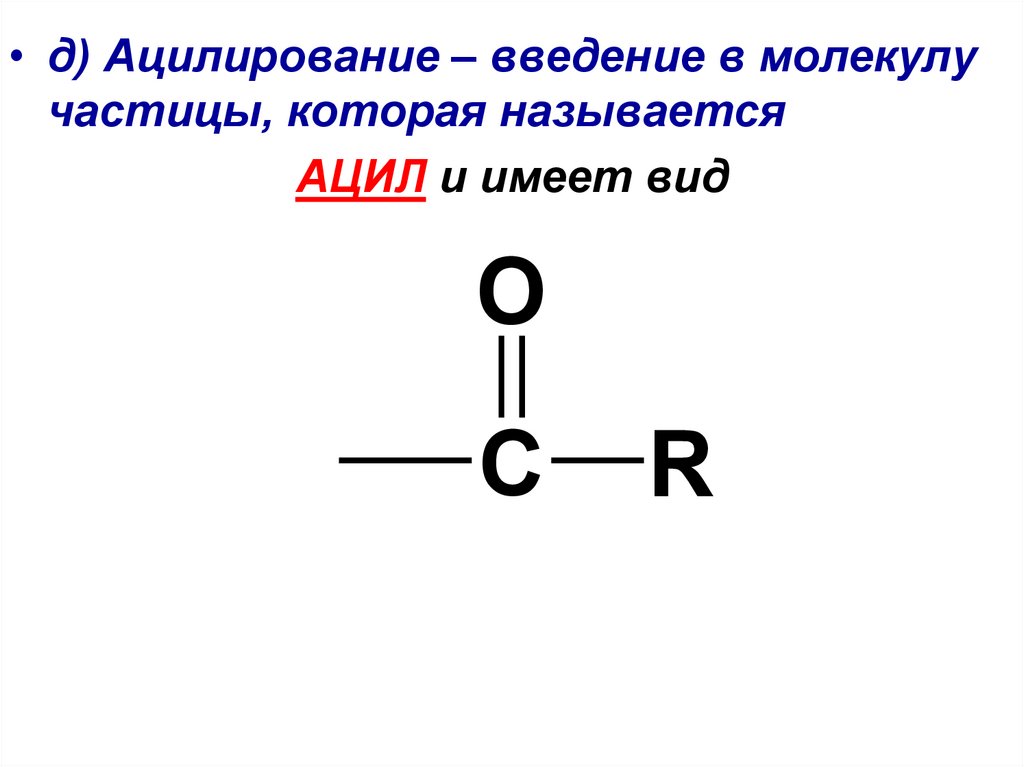
• д) Ацилирование – введение в молекулучастицы, которая называется
АЦИЛ и имеет вид
O
C
R
35.
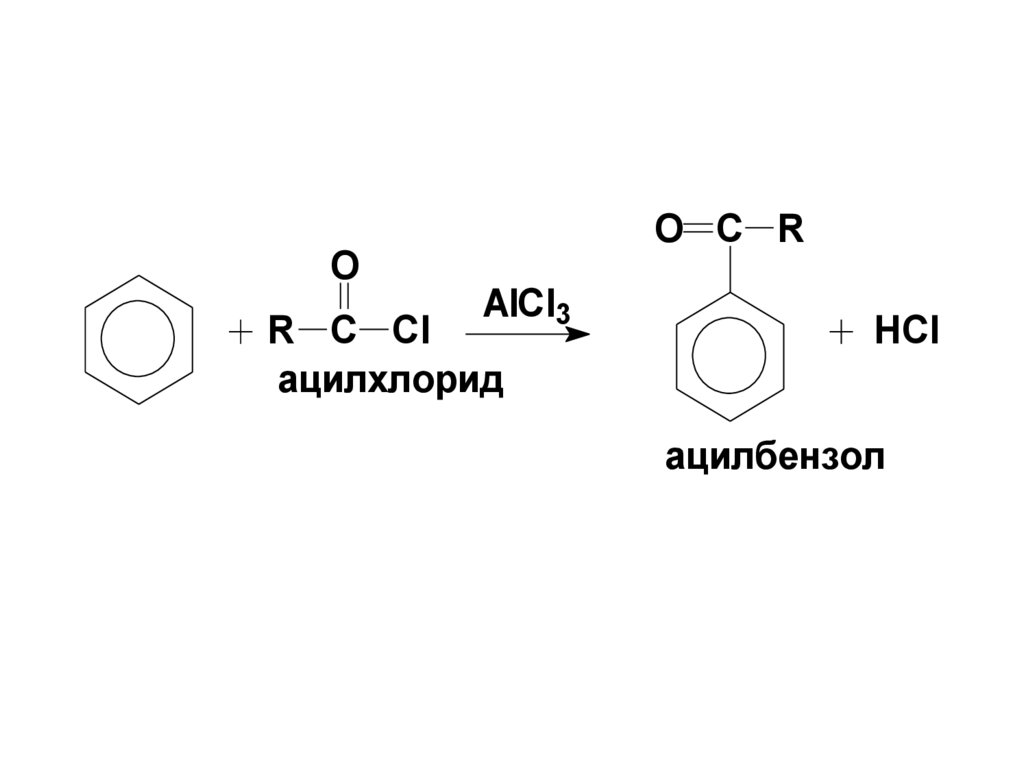
OO C R
AlCl3
R C Cl
ацилхлорид
HCl
ацилбензол
36.
• Электрофильные реагенты ( Е) частицы, обладающие высокимсродством к электронам.
• Могут быть как положительно
заряженные частицы (катионы NO2 ,
Br , CH3 и др.), так и нейтральные
молекулы, содержащие атомы с
вакантными атомными орбиталями
(SO3).
37.
• Склонность ароматическихсоединений к реакциям
электрофильного замещения
объясняется тем, что эти реакции,
в отличие от реакций
присоединения, не ведут к
нарушению устойчивой
ароматической системы и,
следовательно, не требуют
дополнительного расхода
энергии.
38.
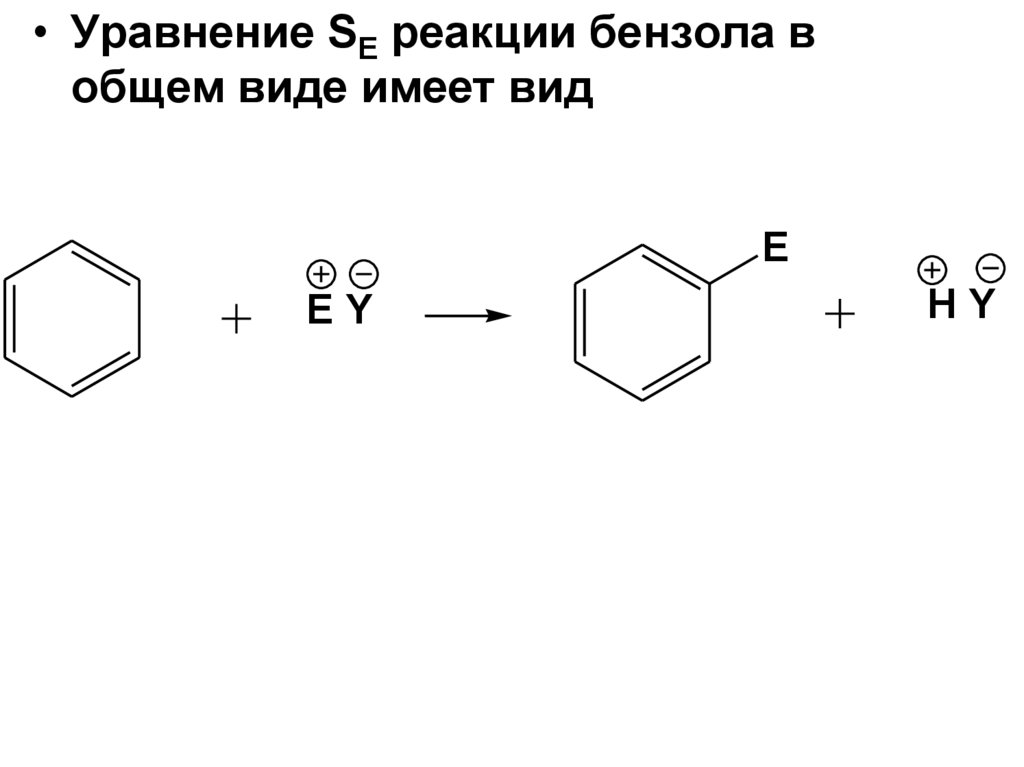
• Уравнение SE реакции бензола вобщем виде имеет вид
E
EY
HY
39.
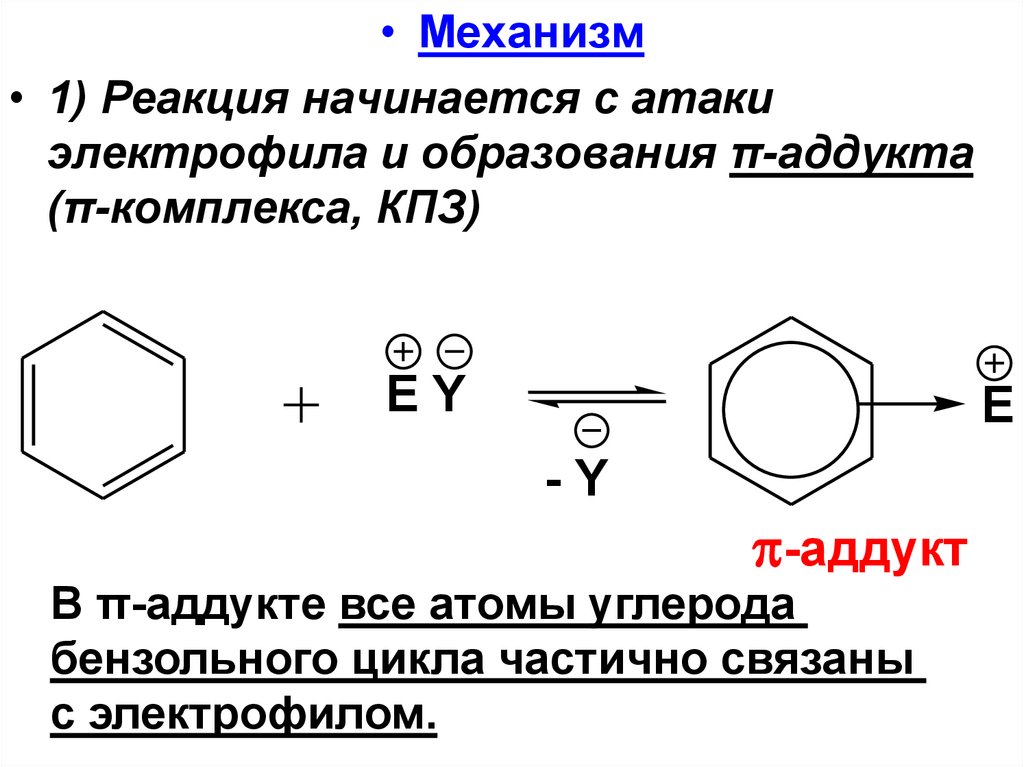
• Механизм• 1) Реакция начинается с атаки
электрофила и образования π-аддукта
(π-комплекса, КПЗ)
EY
E
-Y
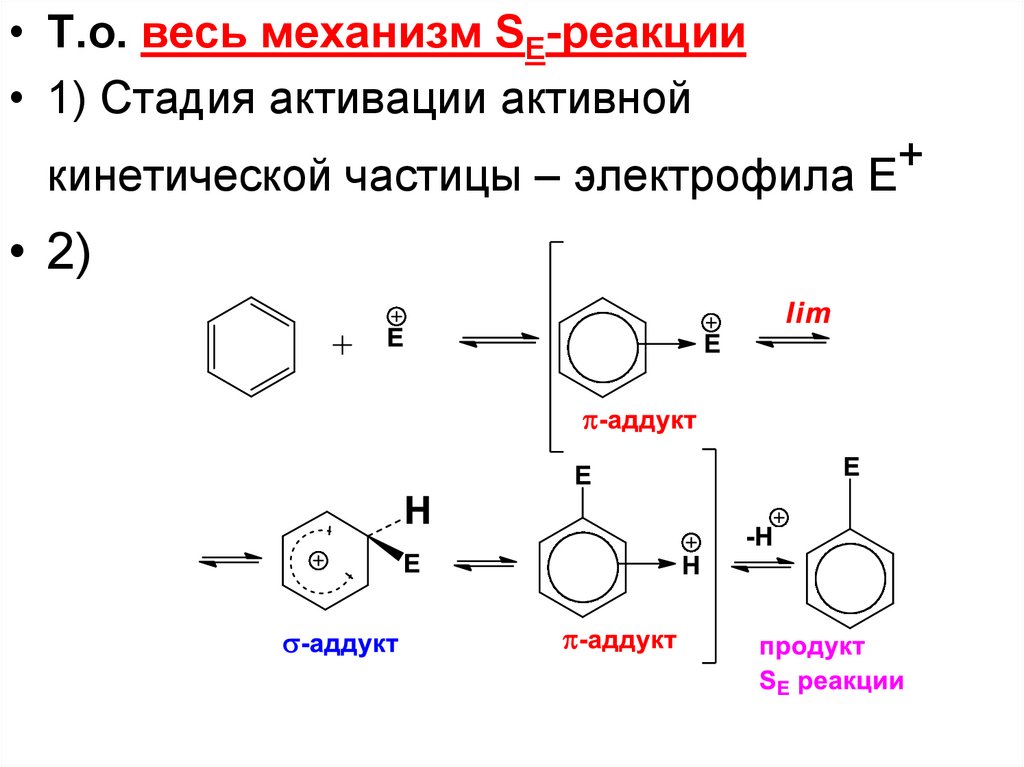
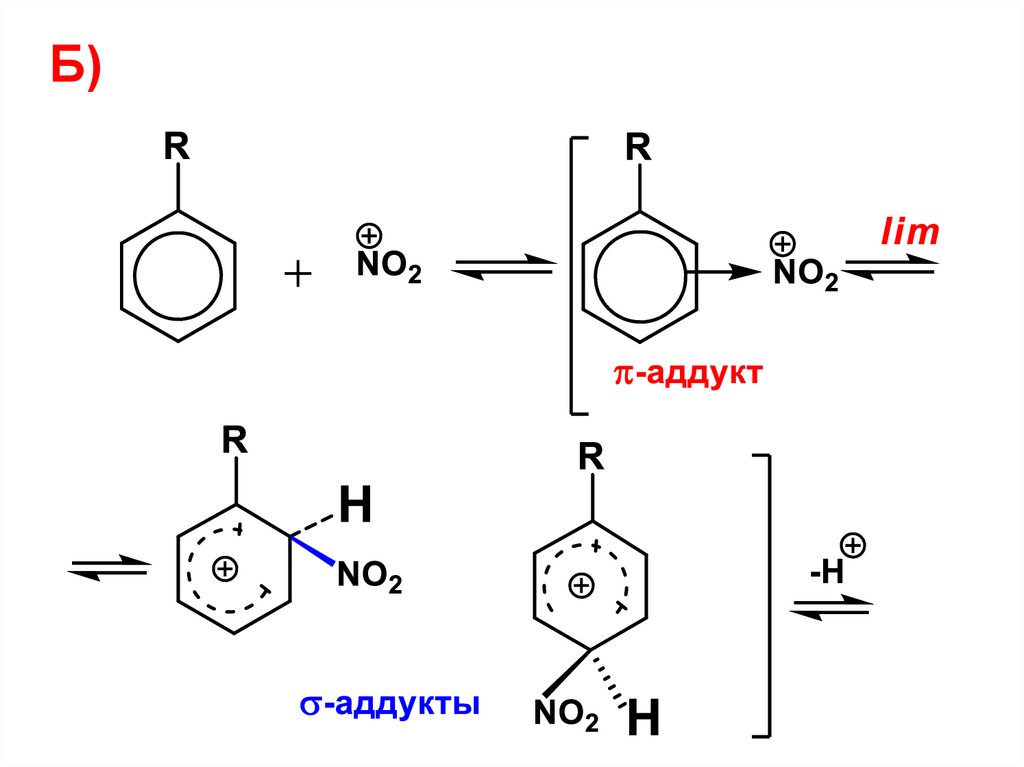
-аддукт
В π-аддукте все атомы углерода
бензольного цикла частично связаны
с электрофилом.
40.
• 2) π-аддукт, поглощая некотороеколичество энергии и преодолевая
энергетический барьер, превращается в
новую частицу, в которой возникает
новая σ-связь С-Е. Это - σ-аддукт.
• Прежде чем рассмотреть его строение
попытаемся понять, что происходит с
сопряженной системой ароматического
цикла при образовании новой σ-связи.
41.
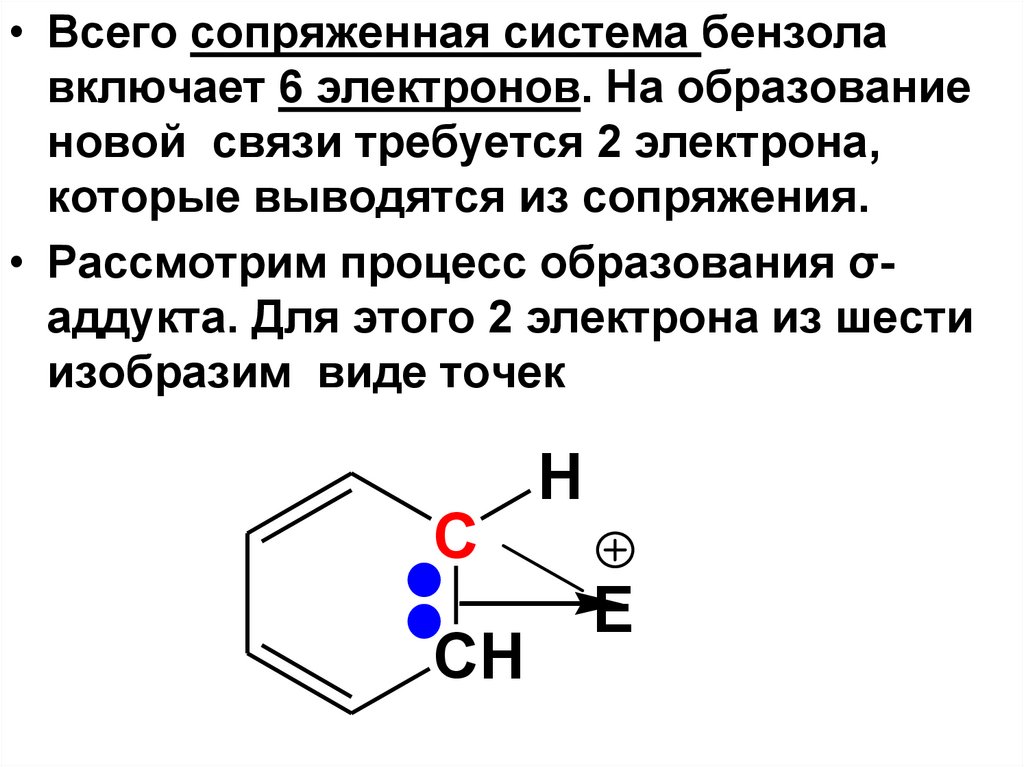
• Всего сопряженная система бензолавключает 6 электронов. На образование
новой связи требуется 2 электрона,
которые выводятся из сопряжения.
• Рассмотрим процесс образования σаддукта. Для этого 2 электрона из шести
изобразим виде точек
H
C
CH
E
42.
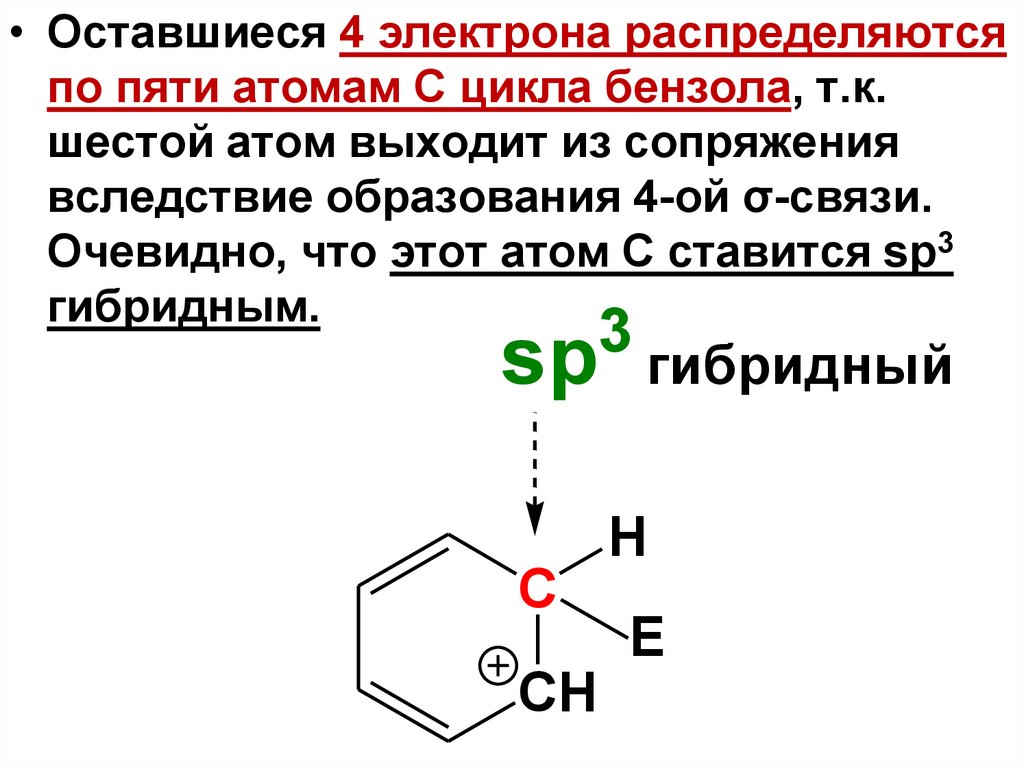
• Оставшиеся 4 электрона распределяютсяпо пяти атомам С цикла бензола, т.к.
шестой атом выходит из сопряжения
вследствие образования 4-ой σ-связи.
Очевидно, что этот атом С ставится sp3
гибридным.
3
sp
гибридный
H
C
CH
E
43.
HC
CH
E
C
C
H
C
E
C
C
C
Н
С Е
44.
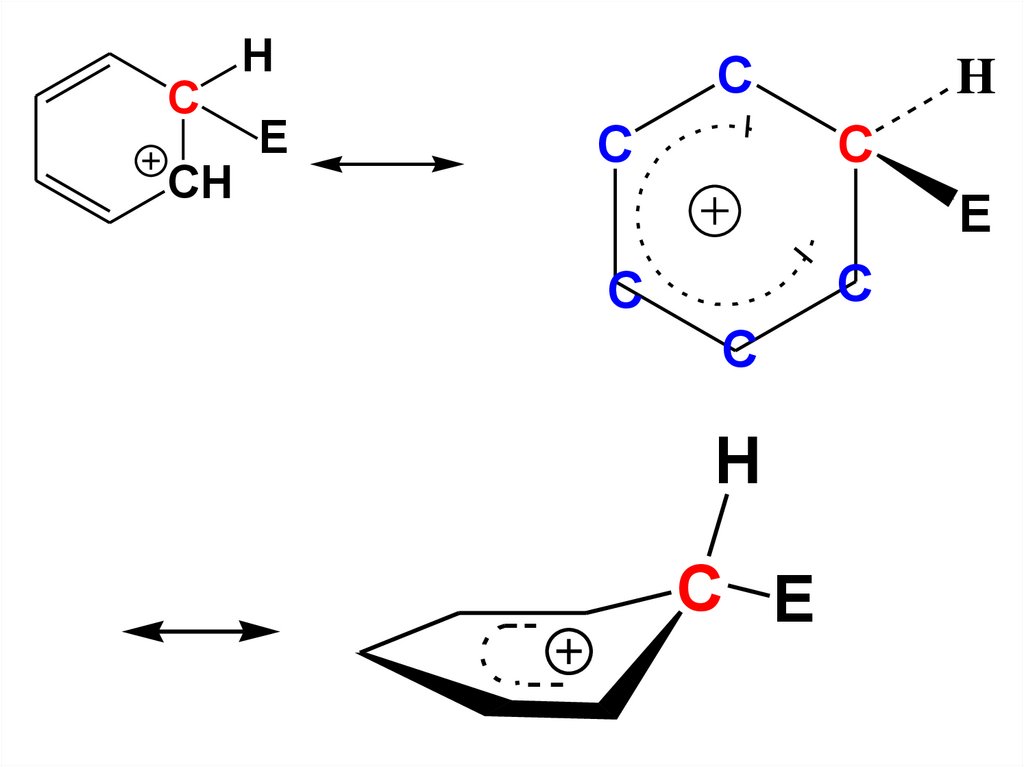
• σ-аддукт является сопряженнымкарбокатионом, в котором
положительный заряд делокализован
в системе пяти атомов С, а шестой
атом С находится в sp3-гибридном
состоянии и в делокализации участия
не принимает
• Распределение электронной
плотности в σ-аддукте можно
изобразить с использованием
резонансных структур
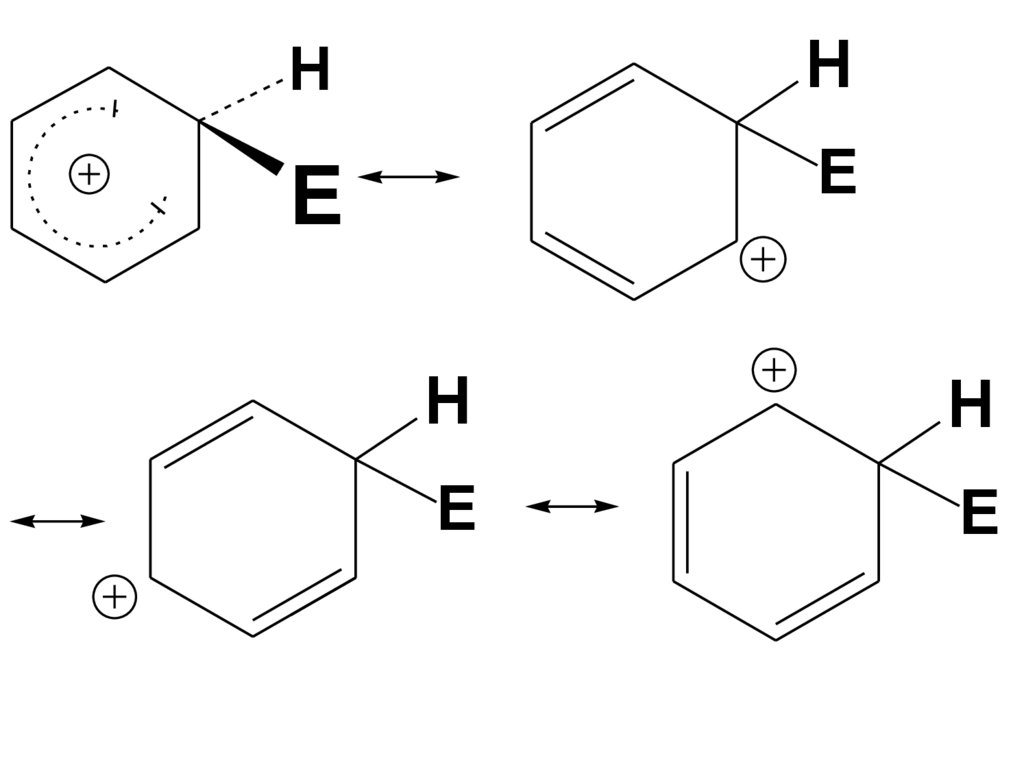
45.
HH
E
E
H
H
E
E
46.
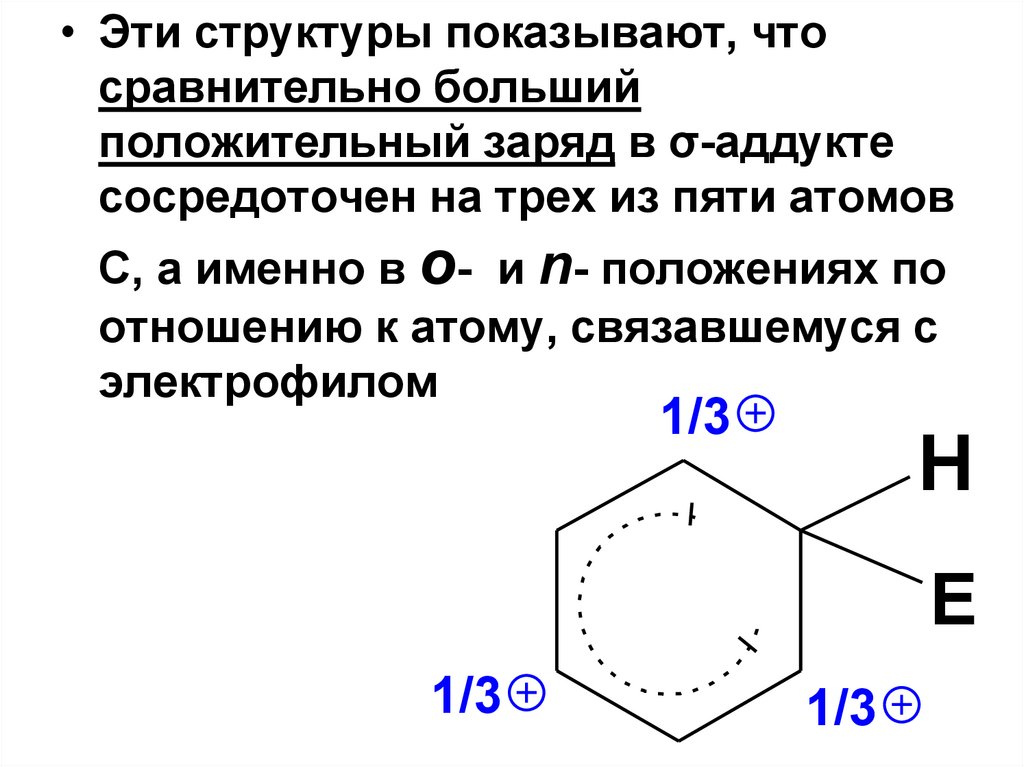
• Эти структуры показывают, чтосравнительно больший
положительный заряд в σ-аддукте
сосредоточен на трех из пяти атомов
С, а именно в о- и n- положениях по
отношению к атому, связавшемуся с
электрофилом
1/3
H
E
1/3
1/3
47.
• 3) σ-аддукт – частица мало стабильная,т.к. его образование вызывает
разрушение 6-π сопряженной системы
ароматического кольца
(ароматического секстета электронов).
• Поэтому σ-аддукт легко превращается
опять в стабильную систему бензола
за счет возвращения в сопряжение
электронной пары связи С-Н и
отщепления протона (Н+). В этом
случае σ-аддукт выступает в роли С-Н
кислоты.
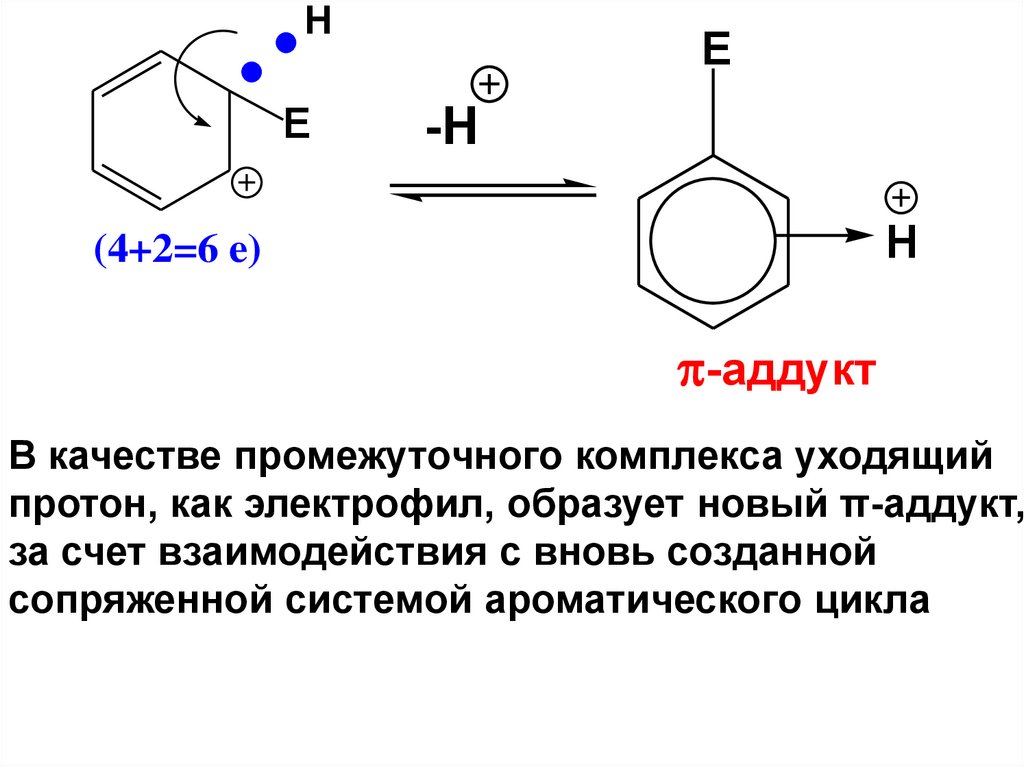
48.
HE
E
-H
H
(4+2=6 e)
-аддукт
В качестве промежуточного комплекса уходящий
протон, как электрофил, образует новый π-аддукт,
за счет взаимодействия с вновь созданной
сопряженной системой ароматического цикла
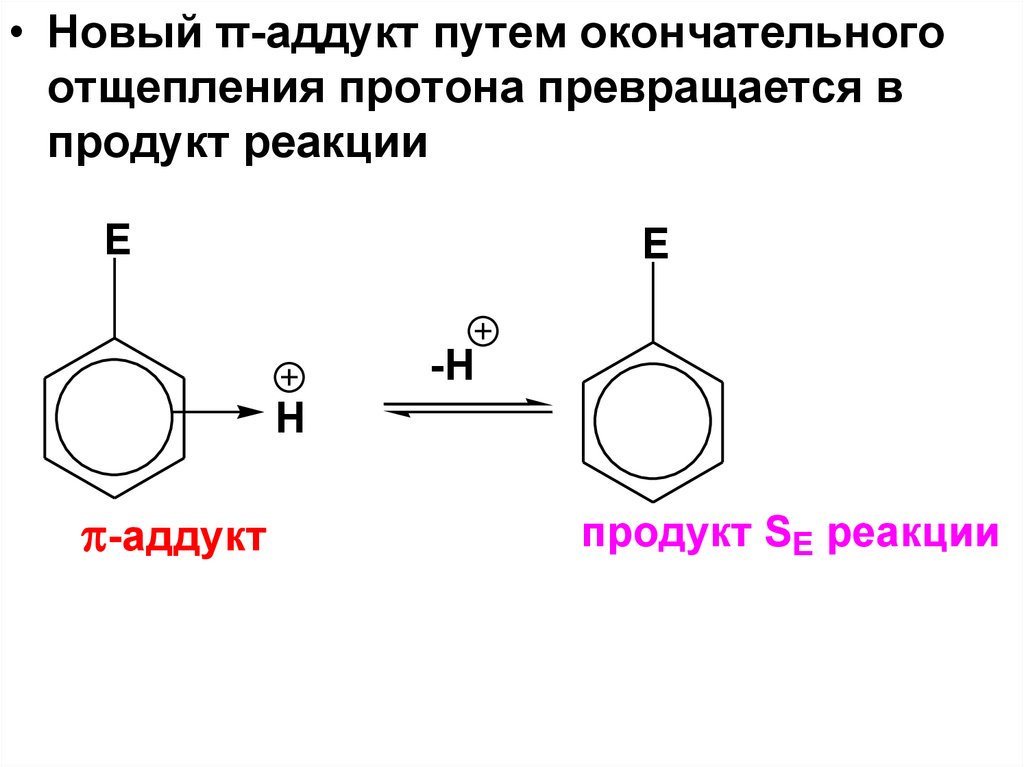
49.
• Новый π-аддукт путем окончательногоотщепления протона превращается в
продукт реакции
E
E
-H
H
-аддукт
продукт SE реакции
50.
• Т.о. весь механизм SE-реакции• 1) Стадия активации активной
кинетической частицы – электрофила Е+
• 2)
51.
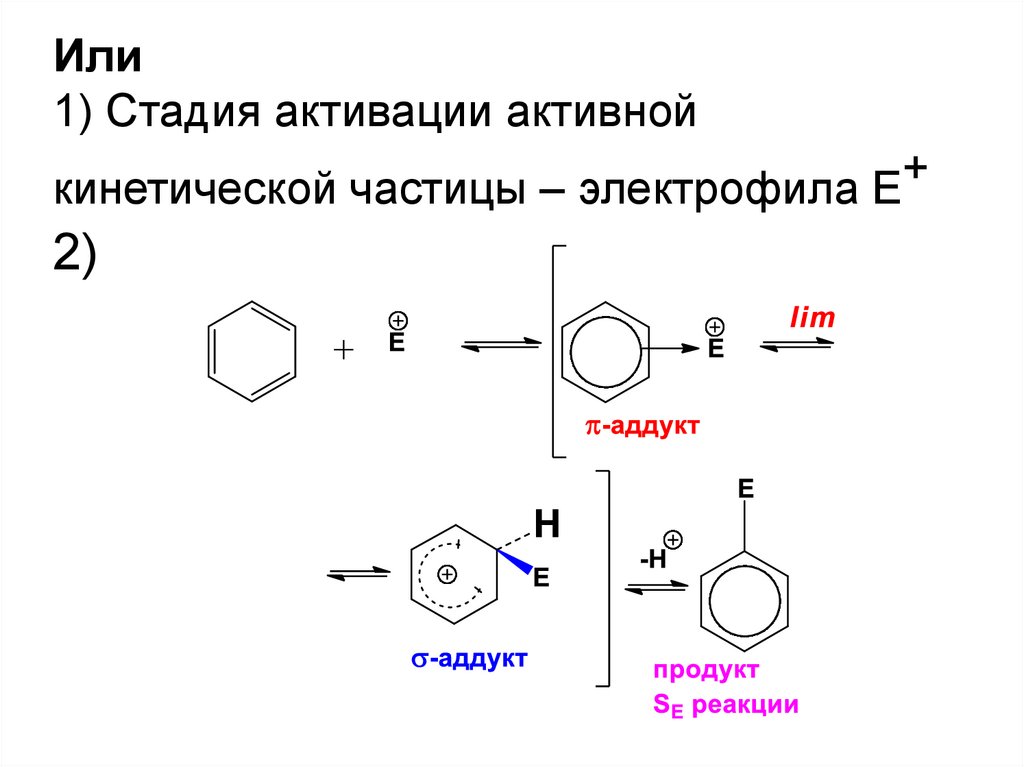
Или1) Стадия активации активной
+
кинетической частицы – электрофила Е
2)
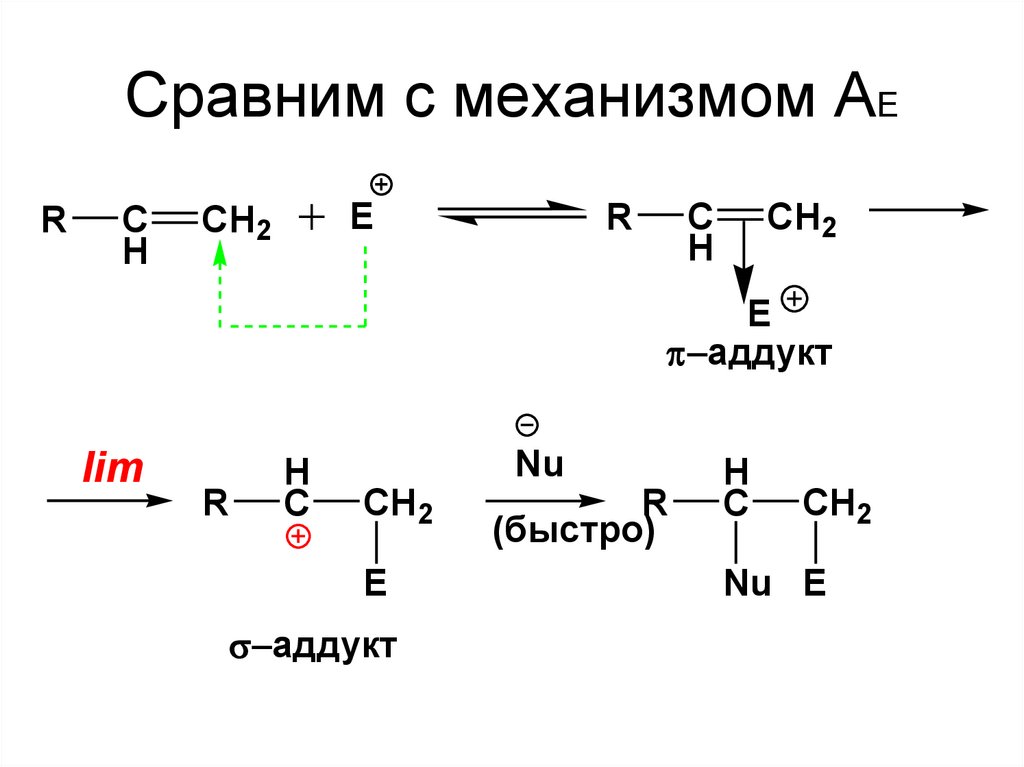
52. Сравним с механизмом АЕ
RC
H
E
CH2
R
C
H
CH2
E
аддукт
lim
R
H
C
Nu
CH2
E
аддукт
R
(быстро)
H
C
CH2
Nu E
53.
• Следует запомнить, что атакующаячастица данной реакции является
электрофилом.
• Уходящая частица ( в данном
случае протон Н+) называется
электрофугом
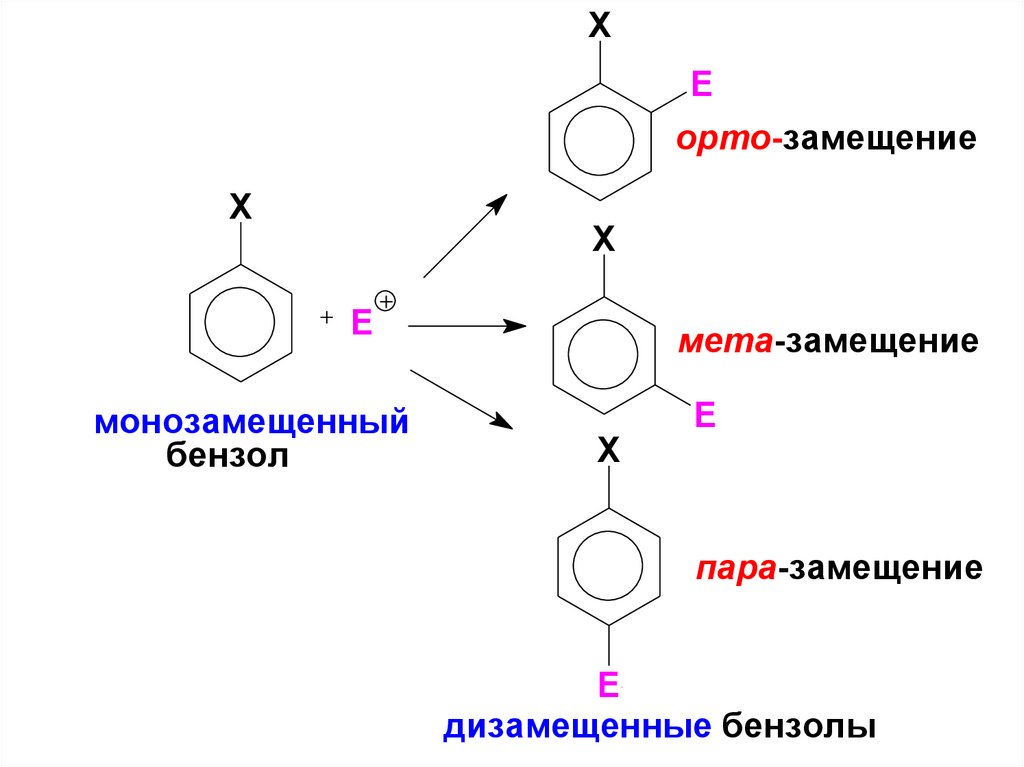
54. ЗАМЕСТИТЕЛИ БЕНЗОЛЬНОГО КОЛЬЦА И ИХ ВЛИЯНИЕ НА СКОРОСТЬ И НАПРАВЛЕНИЕ SE РЕАКЦИЙ ( См. Учебник. С. 199-206).
Заместители в бензольном кольце нарушаютравномерность распределения π-электронного
облака и оказывают влияние на его
реакционную способность.
Если бензольное кольцо содержит какой-либо
заместитель (Х), то положения ароматического
цикла, остающиеся свободными, неравноценны.
В общем случае замещение Н в
монозамещенных бензолах может протекать в
трёх направлениях:
55.
XE
орто-замещение
X
X
E
монозамещенный
бензол
мета-замещение
X
E
пара-замещение
E
дизамещенные бензолы
56.
• При рассмотрении таких реакций надорешать два важных вопроса:
1) Каково ориентирующее влияние
заместителя Х, т.е. какие изомеры (о-, мили п-) преимущественно образуются в
результате замещения?
2) В каком случае выше скорость реакции:
в бензоле С6Н6
или в замещенном
бензоле
С6Н5Х,
то
есть
какова
относительная
реакционная
способность
замещенного
ароматического цикла?
57.
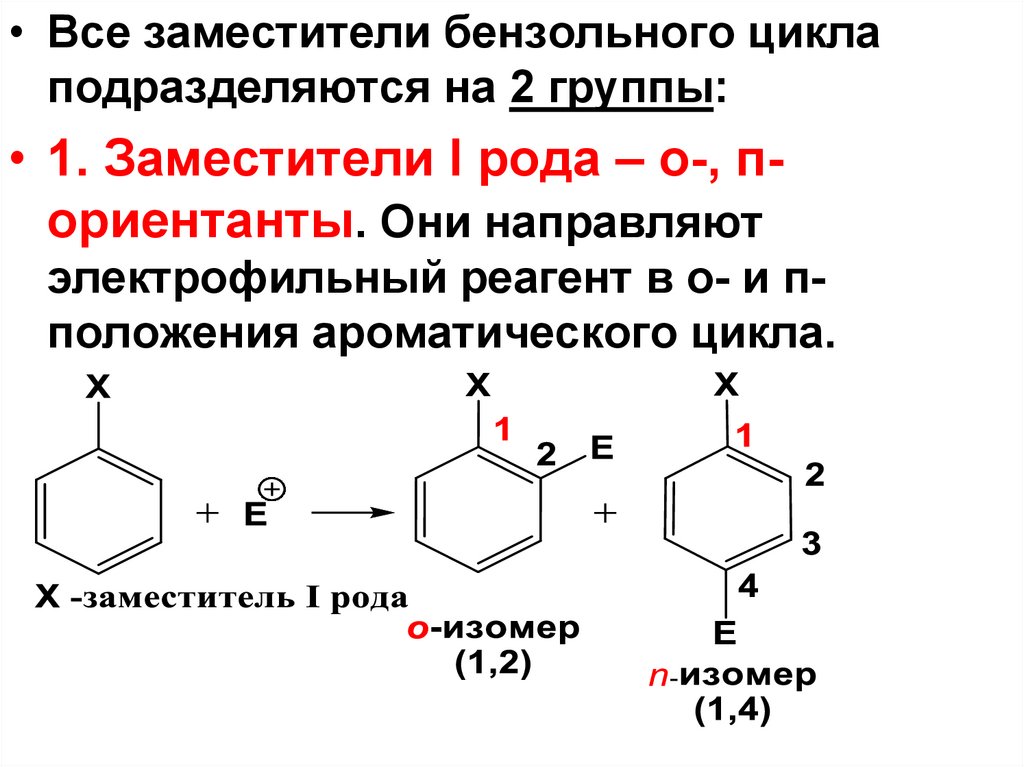
• Все заместители бензольного циклаподразделяются на 2 группы:
• 1. Заместители I рода – о-, пориентанты. Они направляют
электрофильный реагент в о- и пположения ароматического цикла.
58. орто-, пара-Ориентанты (заместители I рода)
• Относятся все электронодонорныезаместители, а также галогениды
• ЭД-заместители стабилизируют πи σ-аддукты и облегчают их
образование
• 1) ЭД-заместители (Д):
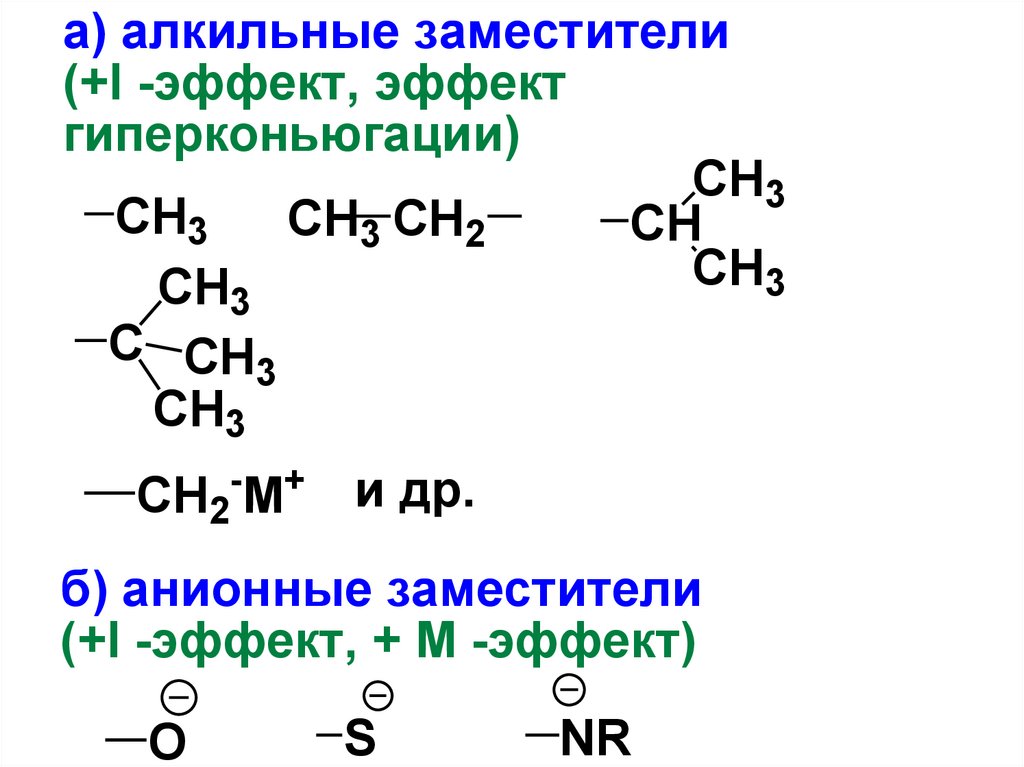
59.
а) алкильные заместители(+I -эффект, эффект
гиперконьюгации)
CH3
CH3
CH3 CH2
CH
CH3
CH3
C CH3
CH3
- +
CH2 M
и др.
б) анионные заместители
(+I -эффект, + М -эффект)
O
S
NR
60.
в) (-I -эффект< + М -эффектa)NH2;
NR2
OH
O
SH
-NH
C
OR
R
•2) Галогениды
(-I -эффект >> + М -эффект)
X
(X = F, Cl, Br, I)
61.
• ЭД-заместители повышают электроннуюплотность в ароматическом цикле, что
способствует атаке электрофильной
частицы (субстрат активируется).
Почему реакция приводит к
образованиюпродуктов замещения о- и пположениях ?
• 1). Электронная плотность под влиянием
ЭД-заместителя повышается
неравномерно в различных положениях
цикла. Более всего в о- и п-положениях
ароматического цикла и менее
значительно в м-положениях.
62.
• 2). ЭД-группы в большей степенистабилизируют σ-аддукты,
соответствующие присоединению
электрофила также в о- и пположениях ароматического цикла
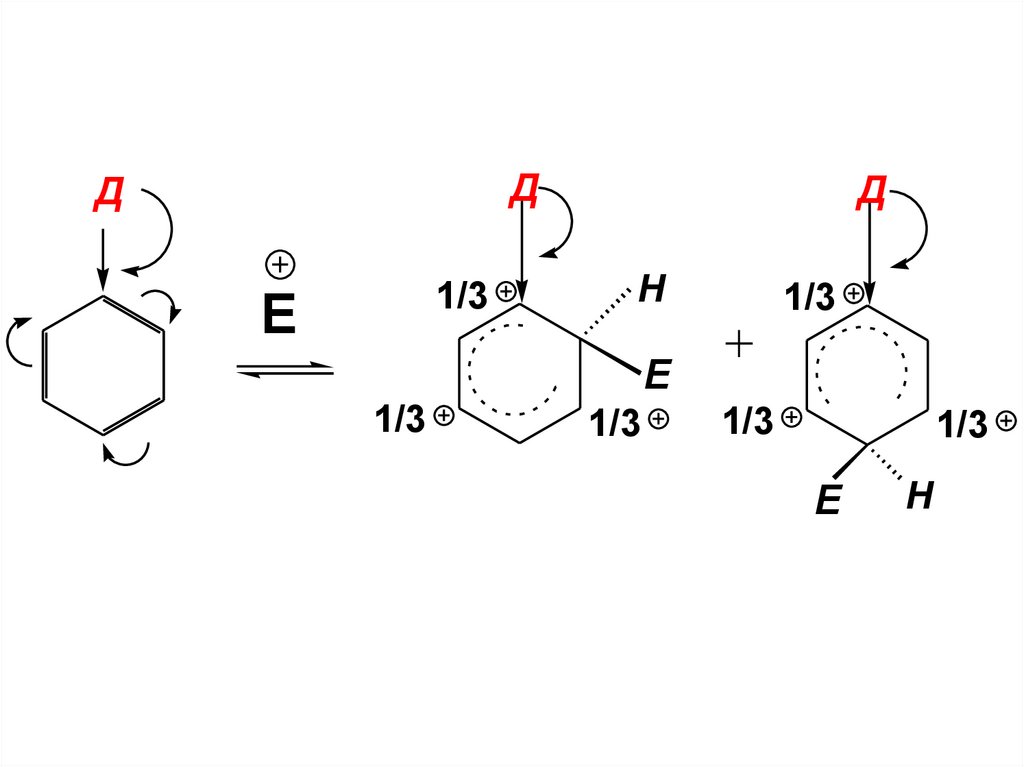
63.
ДД
1/3
E
Д
H
1/3
E
1/3
1/3
1/3
1/3
E
H
64.
Все заместители а), б) и в) являютсяактивирующими субстрат заместителями,
стабилизирующими σ-аддукты.
Рассмотрим некоторые SЕ-реакции для
отдельных ароматических соединений,
содержащих ЭД группы
65.
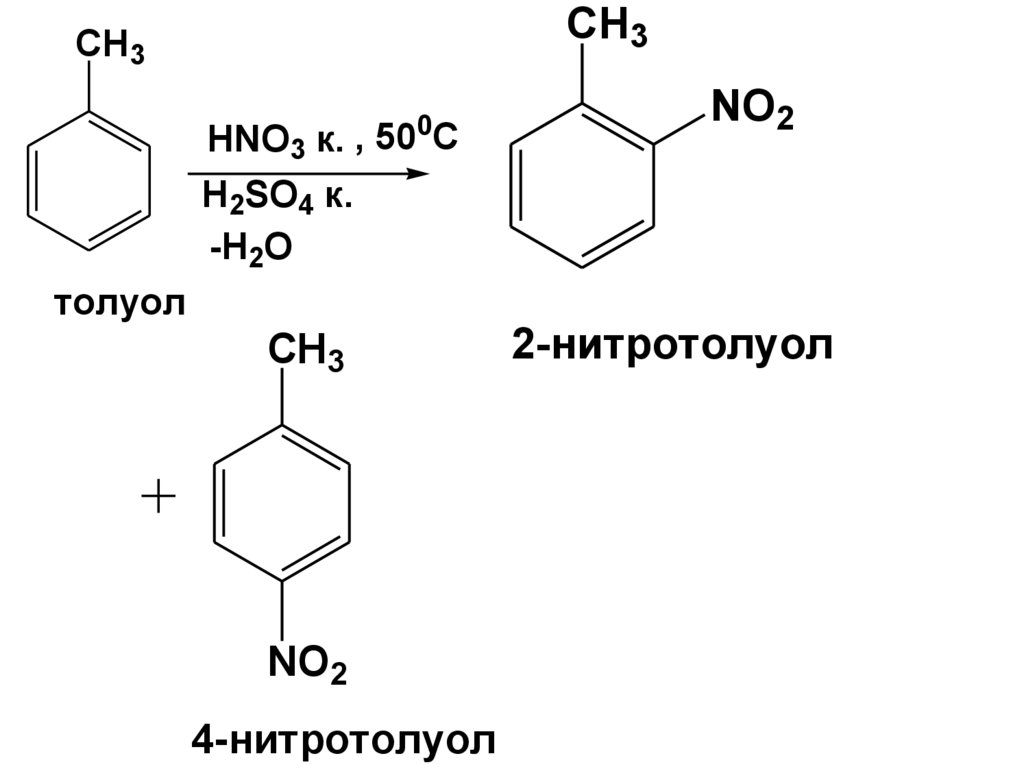
CH3CH3
0
HNO3 к. , 50 C
NO2
H2SO4 к.
-H2O
толуол
CH3
NO2
4-нитротолуол
2-нитротолуол
66.
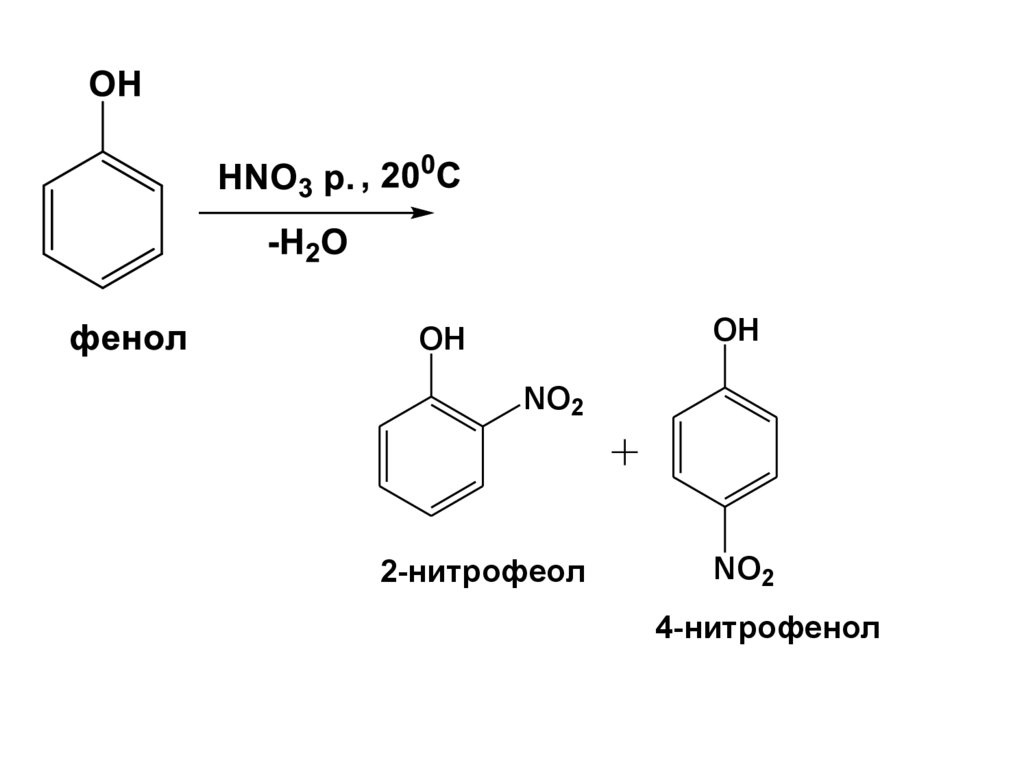
OHOH
NO2
2-нитрофеол
NO2
4-нитрофенол
67.
Следует запомнить, что заместителиI рода являются о- и п-ориентантами.
Они (кроме галогенов) стабилизируют
σ-аддукт, а следовательно активируют
(повышают скорость реакции в
сравнении с бензолом) ароматический
цикл соединения с таким заместителем
по отношению к реакциям SE
68.
• Галогениды, в отличие от всехориентантов I рода, являются ЭА
заместителями. Они не приводят к
повышению электронной плотности в
ароматическом цикле, Это затрудняет
атаку электрофила и не стабилизирует σаддукты. Однако, благодаря +Мэффекту, они направляют SЕ-реакции в ои п-положения ароматического цикла, так
как это показано выше.
69.
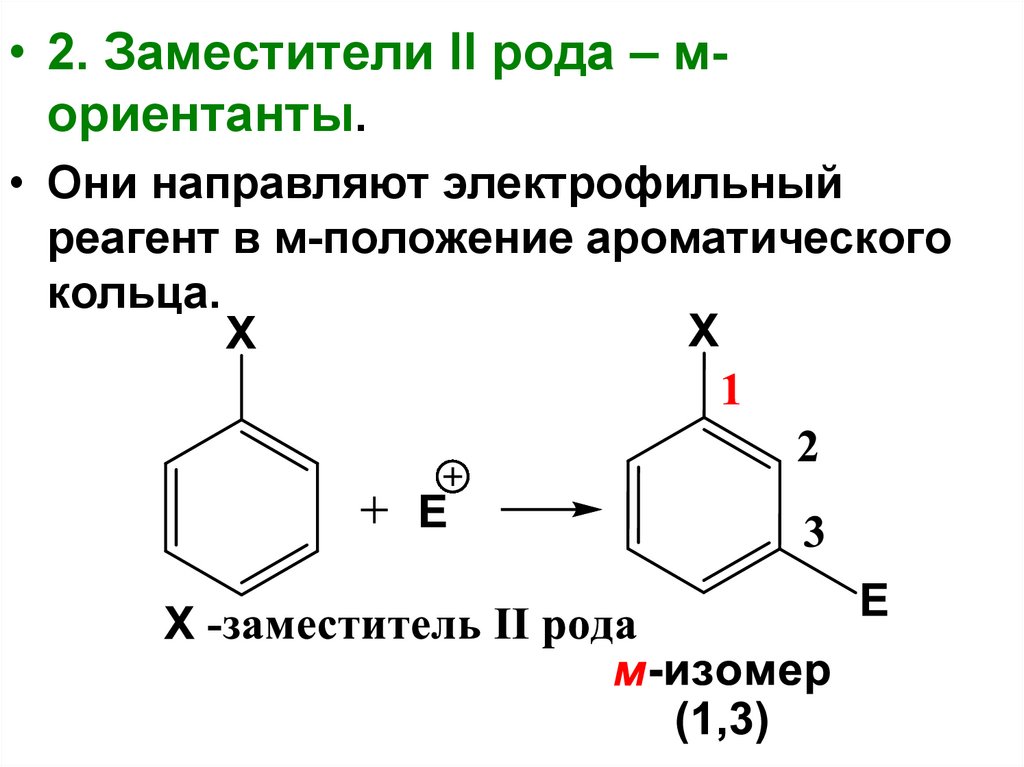
• 2. Заместители II рода – мориентанты.• Они направляют электрофильный
реагент в м-положение ароматического
кольца.
70.
• Относятся всеэлектроноакцепторные заместители
(за исключением галогенов)
• ЭА-заместители дестабилизируют πи σ-аддукты и затрудняют их
образование
• ЭА-заместители (А):
71.
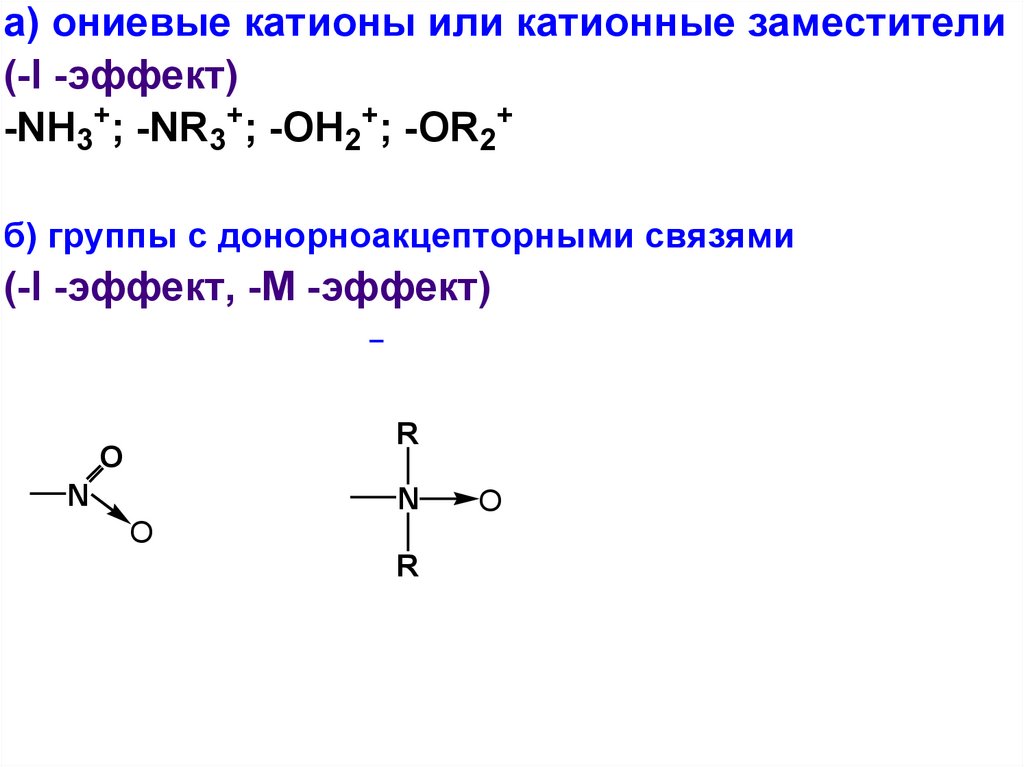
а) ониевые катионы или катионные заместители(-I -эффект)
-NH3+; -NR3+; -OH2+; -OR2+
б) группы с донорноакцепторными связями
(-I -эффект, -М -эффект)
R
O
N
N
O
R
O
72.
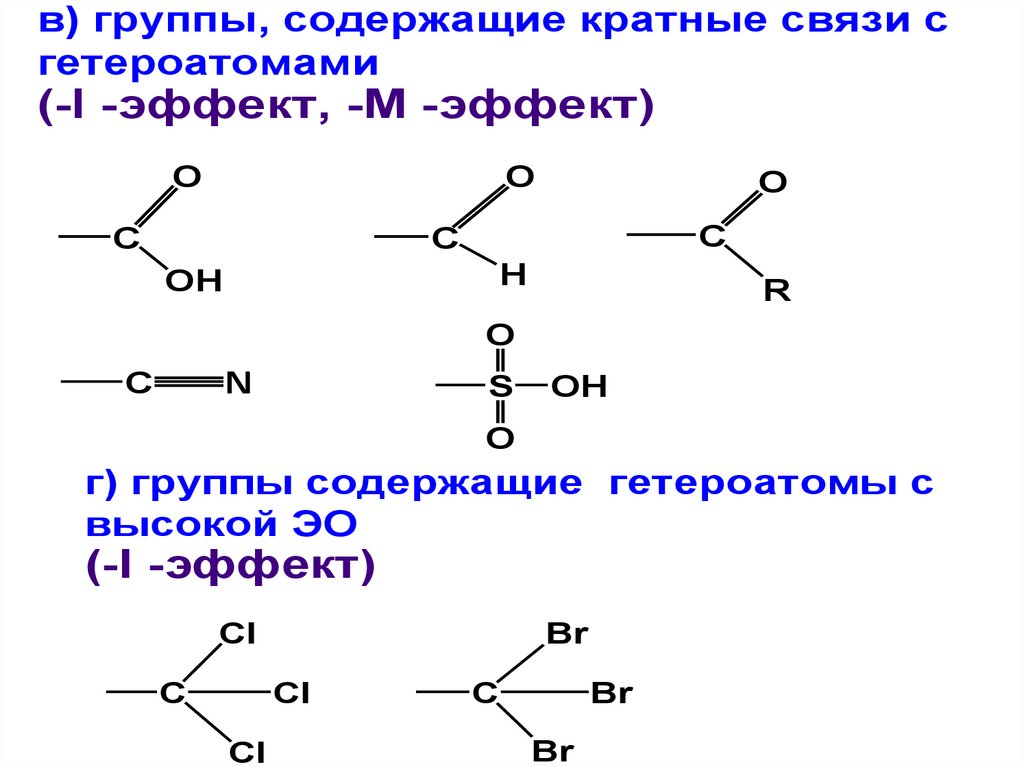
в) группы, содержащие кратные связи сгетероатомами
(-I -эффект, -М -эффект)
O
O
C
O
C
C
H
OH
R
O
C
N
S
OH
O
г) группы содержащие гетероатомы с
высокой ЭО
(-I -эффект)
Cl
C
Br
Cl
Cl
C
Br
Br
73.
• Заместители, принадлежащие к даннойгруппе, обладают сильным
«электронооттягивающим» влиянием
по отношению к π-сопряженной системе
ароматического цикла ( -I и –М-эффекты):
1) электронная плотность в
ароматической системе снижается, что не
способствует взаимодействию с
электрофильными реагентами.
• 2) ЭА группы не стабилизируют σаддукты, которые представляют собой
частицы с электронодефицитными
свойствами
74.
• Снижение электронной плотности вароматическом цикле, также как и
повышение в предыдущем случае,
происходит неравномерно.
• Более всего электронная плотность
снижается в о- и п-положениях цикла.
• Это значит, что атака этих положений
электрофильной частицей невыгодна
энергетически.
75.
• В м-положениях ароматического циклаимеет место область сравнительно
большей
электронной плотности.
Поэтому Е+ предпочтительно атакует
именно м-положения, что приводит к
образованию продуктов м-замещения.
• Кроме того, электорофил, занимающий
м-положение, не вызывает наличия
положительного заряда на том атоме
ароматического цикла, который
непосредственно связан с ЭА группой,
что особенно важно для стабильности
соответствующего сигма-аддукта.
76.
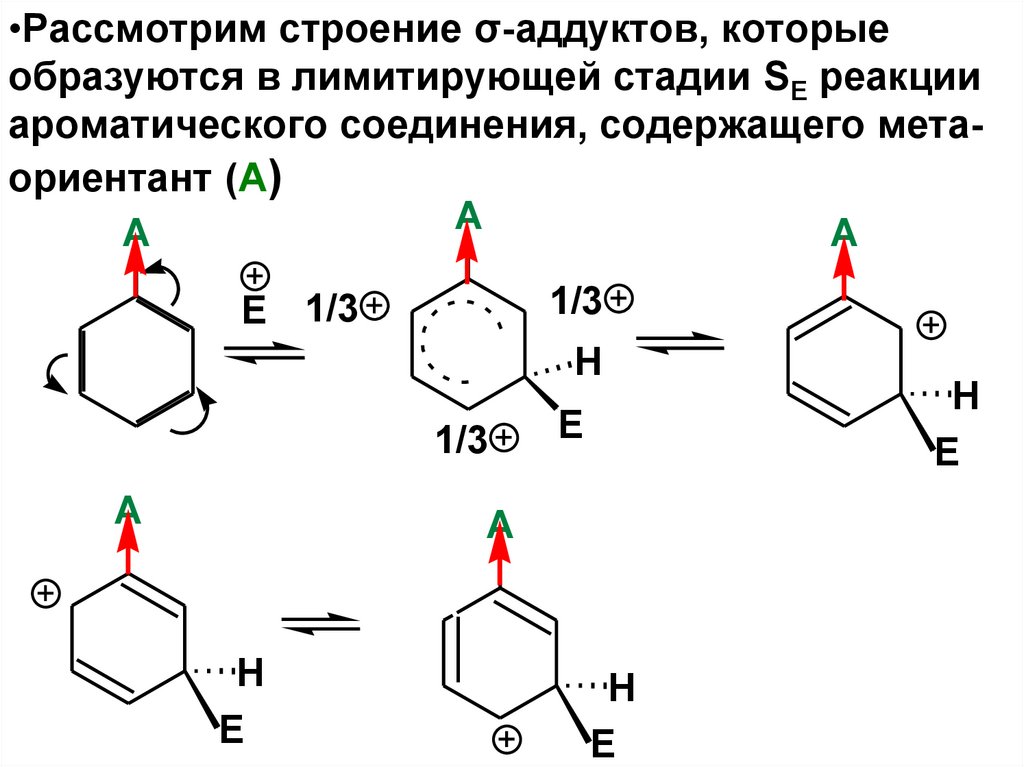
•Рассмотрим строение σ-аддуктов, которыеобразуются в лимитирующей стадии SE реакции
ароматического соединения, содержащего метаориентант (А)
A
A
A
1/3
E 1/3
H
1/3
A
E
A
H
E
H
E
H
E
77.
• Следует запомнить, чтозаместители II рода являются мориентантами.
• Они дестабилизируют σ-аддукт, а,
следовательно, дезактивируют
ароматический цикл соединения с
ЭА заместителем по отношению к
реакциям SE
78.
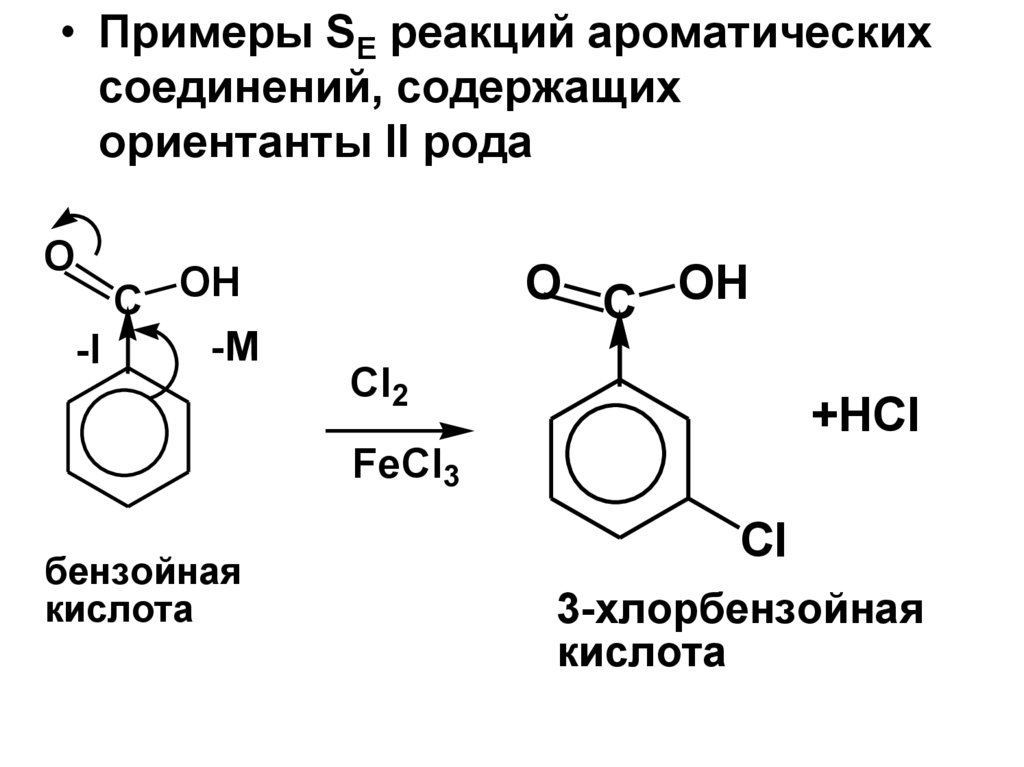
• Примеры SE реакций ароматическихсоединений, содержащих
ориентанты II рода
O
С OH
-M
-I
O С OH
Cl2
+HCl
FeCl3
бензойная
кислота
Cl
3-хлорбензойная
кислота
79.
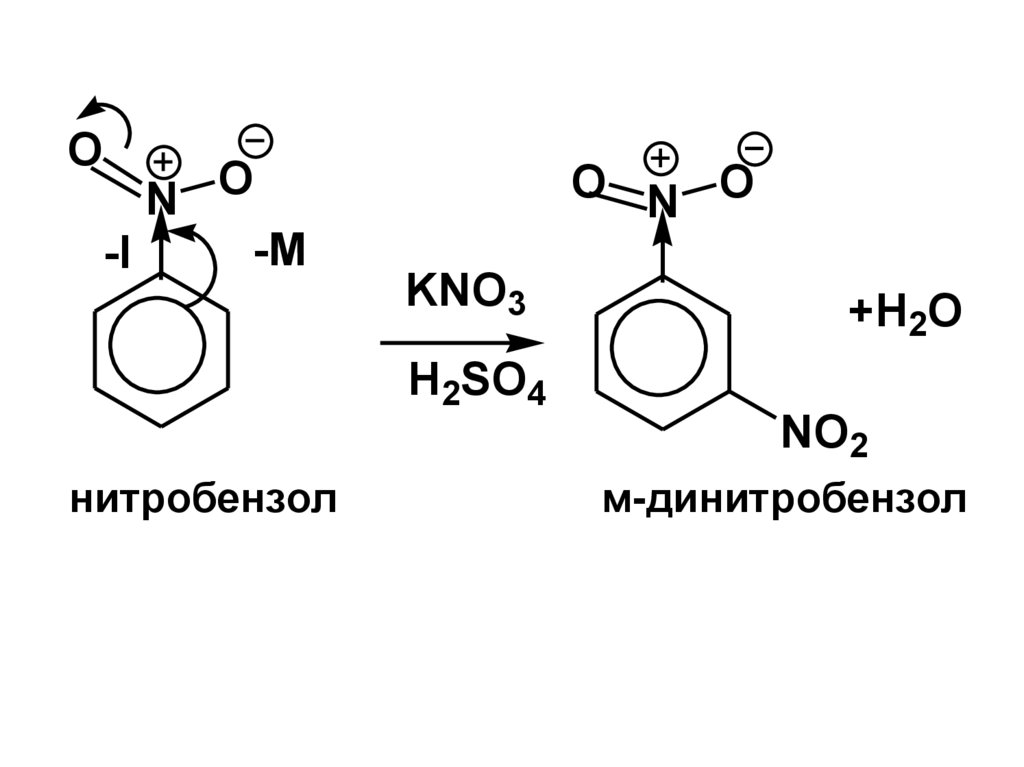
ON O
-M
-I
O N O
KNO3
+H2O
H2SO4
NO2
нитробензол
м-динитробензол
80.
Правила ориентации позволяютпредсказать преимущественное
направление реакции и преобладание того
или иного изомера в продуктах реакции. В
большинстве случаев содержаться все
три. Когда присутствует заместитель I
рода, чаще образуется большее
количество пара-изомера из-за
стерического фактора.
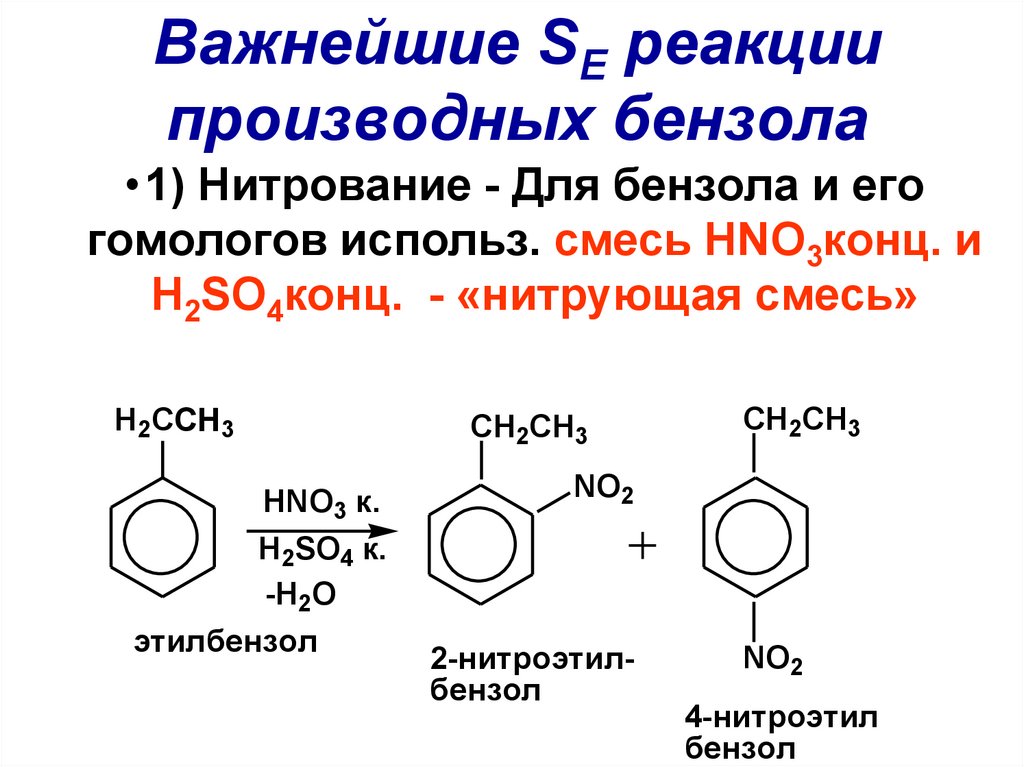
81. Важнейшие SE реакции производных бензола
•1) Нитрование - Для бензола и егогомологов использ. смесь HNO3конц. и
H2SO4конц. - «нитрующая смесь»
H2CCH3
CH2CH3
HNO3 к.
CH2CH3
NO2
H2SO4 к.
-H2O
этилбензол
2-нитроэтилбензол
NO2
4-нитроэтил
бензол
82.
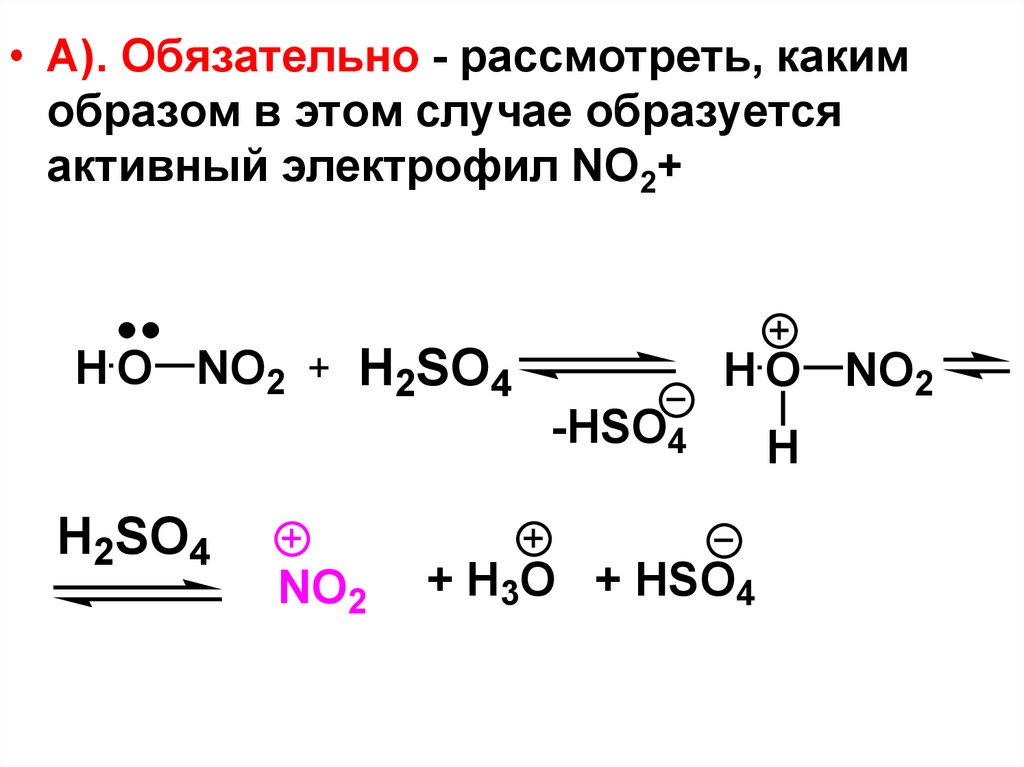
• А). Обязательно - рассмотреть, какимобразом в этом случае образуется
активный электрофил NO2+
H O NO2
H2SO4
H O NO2
-HSO4
H2SO4
NO2
+ H3O + HSO4
H
83. Б)
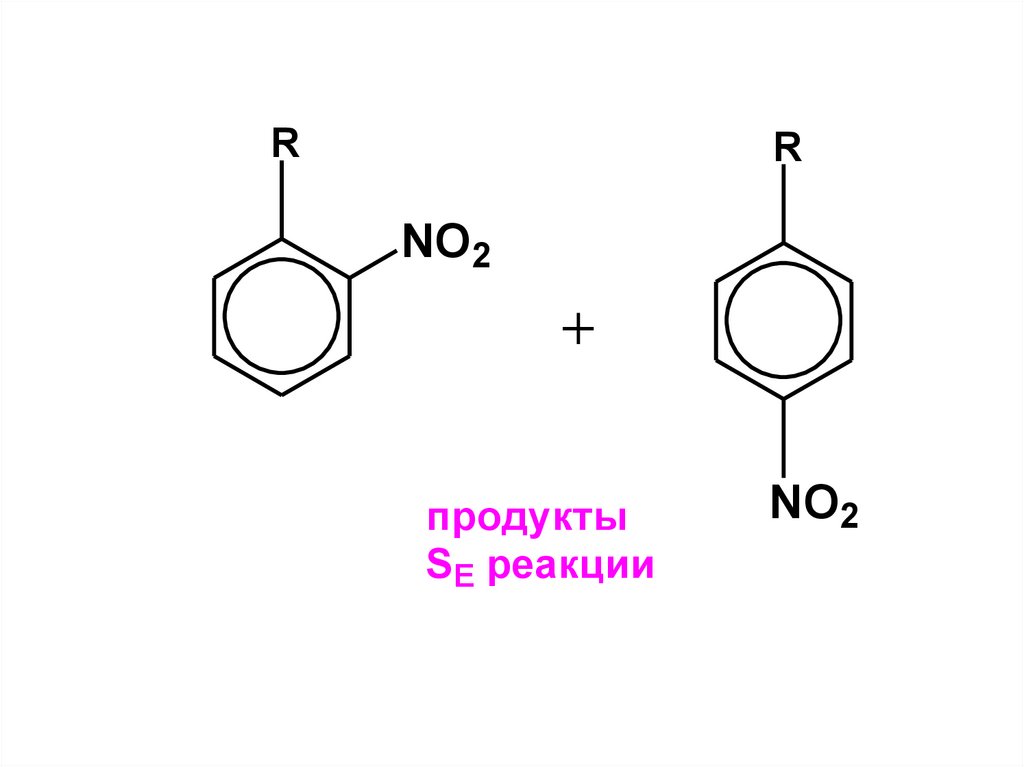
84.
RR
NO2
продукты
SE реакции
NO2
85.
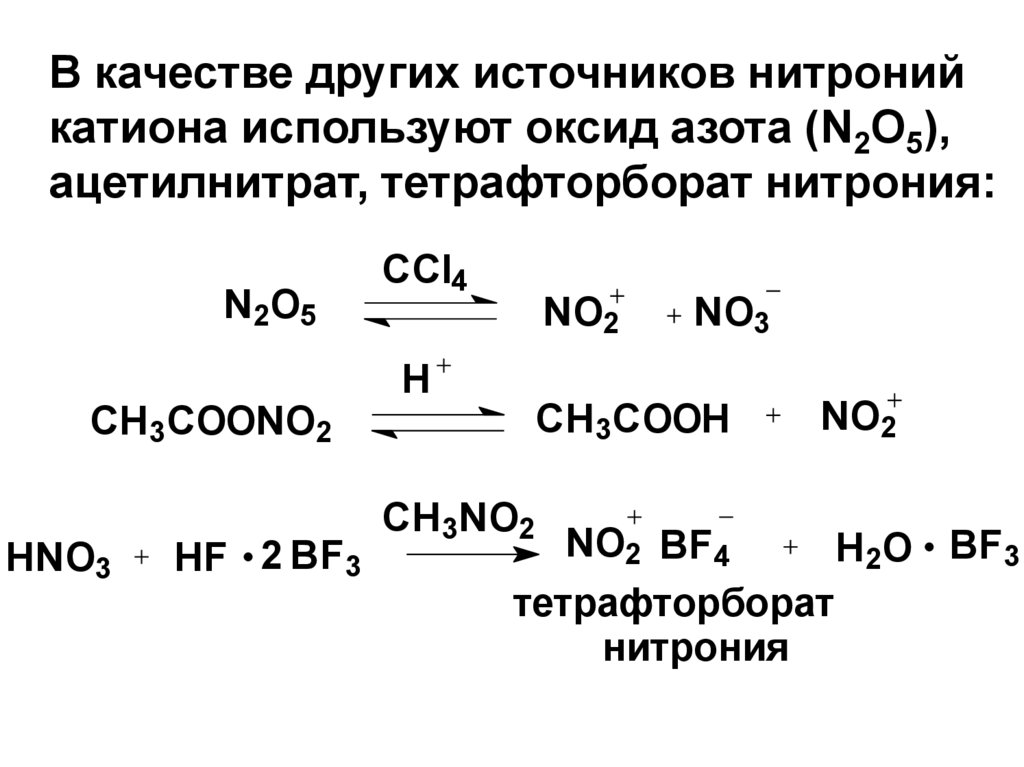
В качестве других источников нитронийкатиона используют оксид азота (N2O5),
ацетилнитрат, тетрафторборат нитрония:
N2O5
CCl4
NO2
NO3
H
CH3COOH
CH3COONO2
HNO3
HF 2 BF3
CH3NO2
NO2
NO2 BF4
H2O BF3
тетрафторборат
нитрония
86.
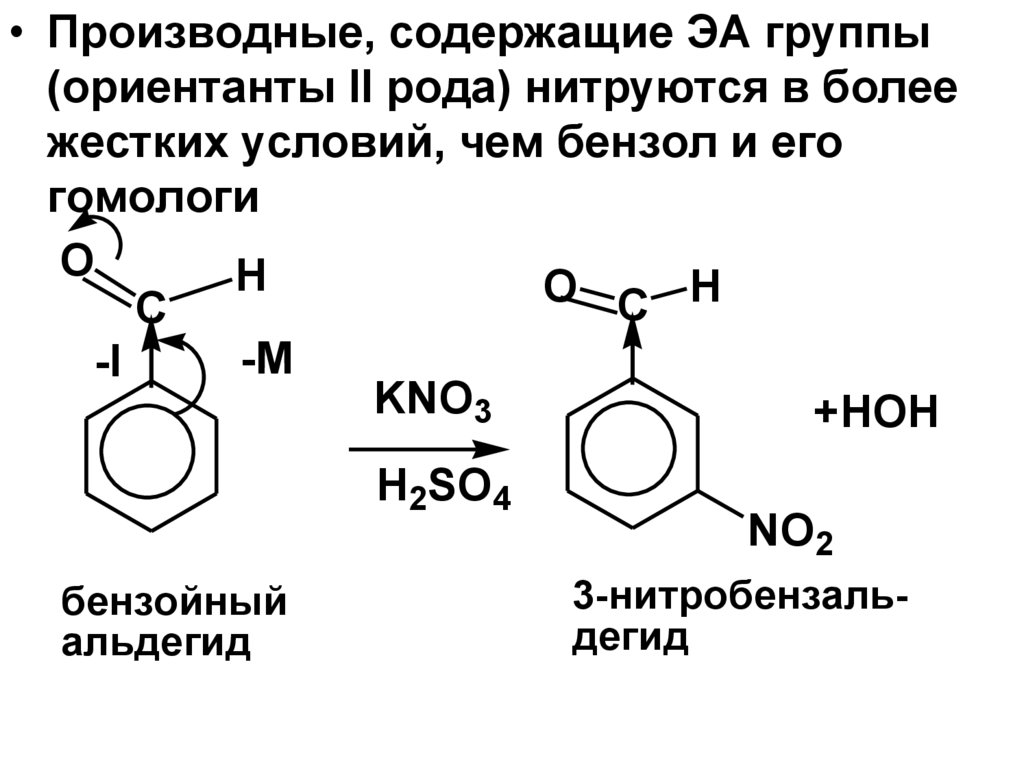
• Производные, содержащие ЭА группы(ориентанты II рода) нитруются в более
жестких условий, чем бензол и его
гомологи
O
H
O
H
С
С
-M
-I
KNO3
+HOH
H2SO4
бензойный
альдегид
NO2
3-нитробензальдегид
87.
K O NO2H2SO4
H O NO2
KHSO4
Введение нитрогруппы в ароматическое
кольцо приводит к его сильной
дезактивации по отношению к реакциям SE,
т.к. нитрогруппа является очень сильной
ЭА-группой. В результате для
нитробензола не идут многие SE реакции
(алкилирование, ацилирование и др.) или
идут в очень жестких условиях с сильными
электрофилами (например, реакция
нитрования).
88.
• Ароматические вещества,содержащие ЭД-группы (-ОН, -ОСН3 , NH2 , и др.) нитруются в более
мягких условиях и часто требуют
специальных преобразований перед
нитрованием, для защиты таких
веществ от окислительного действия
азотной кислоты( см. тему
ароматические амины, фенолы и
т.д.).
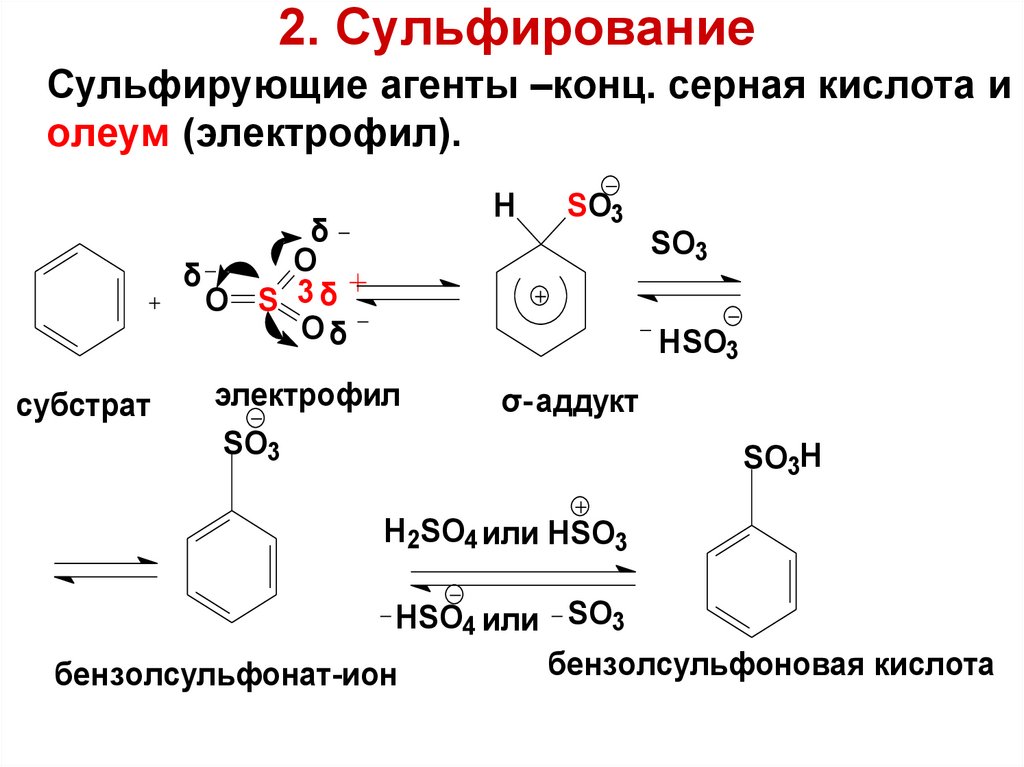
89. 2. Сульфирование
Сульфирующие агенты –конц. серная кислота иолеум (электрофил).
H
δ
O
δ
O S 3δ
Oδ
субстрат
SO3
SO3
HSO3
электрофил
SO3
σ- аддукт
SO3H
H2SO4 или HSO3
HSO4 или SO3
бензолсульфоновая кислота
бензолсульфонат-ион
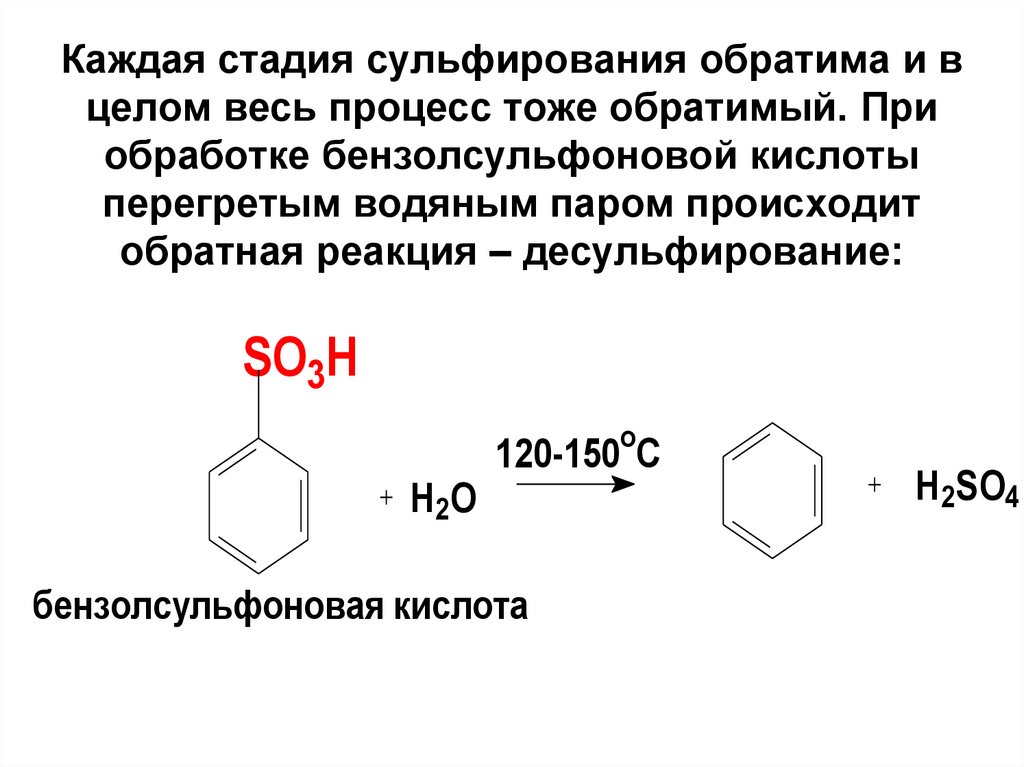
90. Каждая стадия сульфирования обратима и в целом весь процесс тоже обратимый. При обработке бензолсульфоновой кислоты перегретым
водяным паром происходитобратная реакция – десульфирование:
SO3H
o
H 2O
120-150 C
бензолсульфоновая кислота
H2SO4
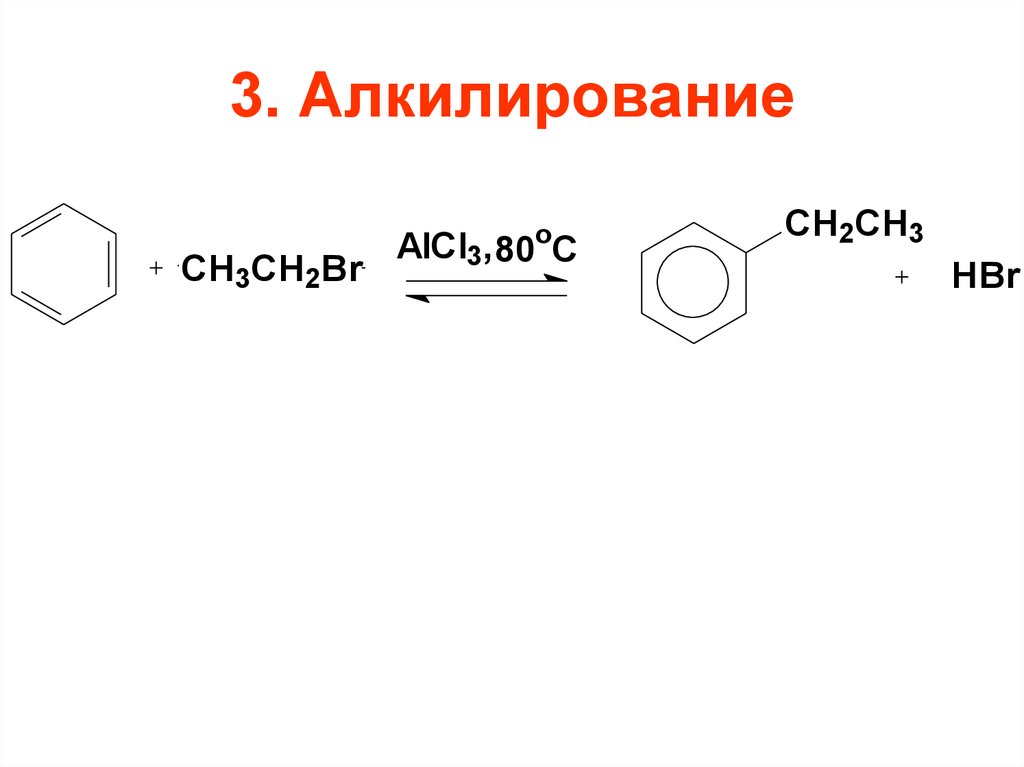
91. 3. Алкилирование
СH3CH2Bro
AlCl3, 80 C
CH2CH3
HBr
92.
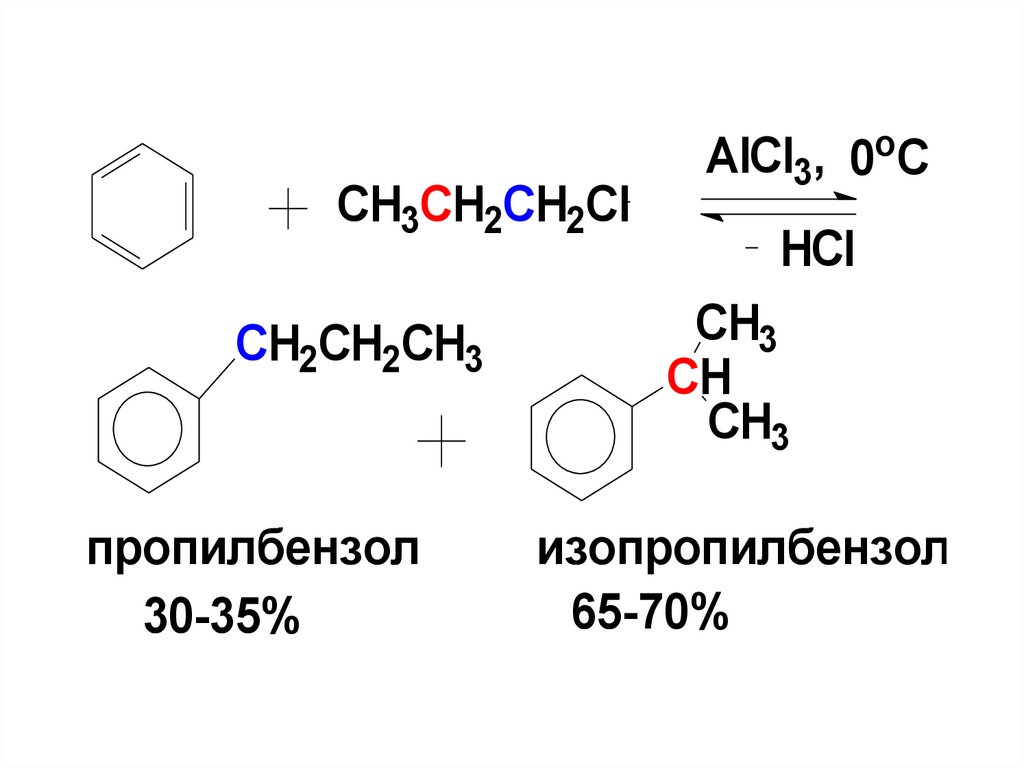
СH3CH2CH2ClCH2CH2CH3
пропилбензол
30-35%
AlCl3, 0oC
HCl
CH3
CH
CH3
изопропилбензол
65-70%
93.
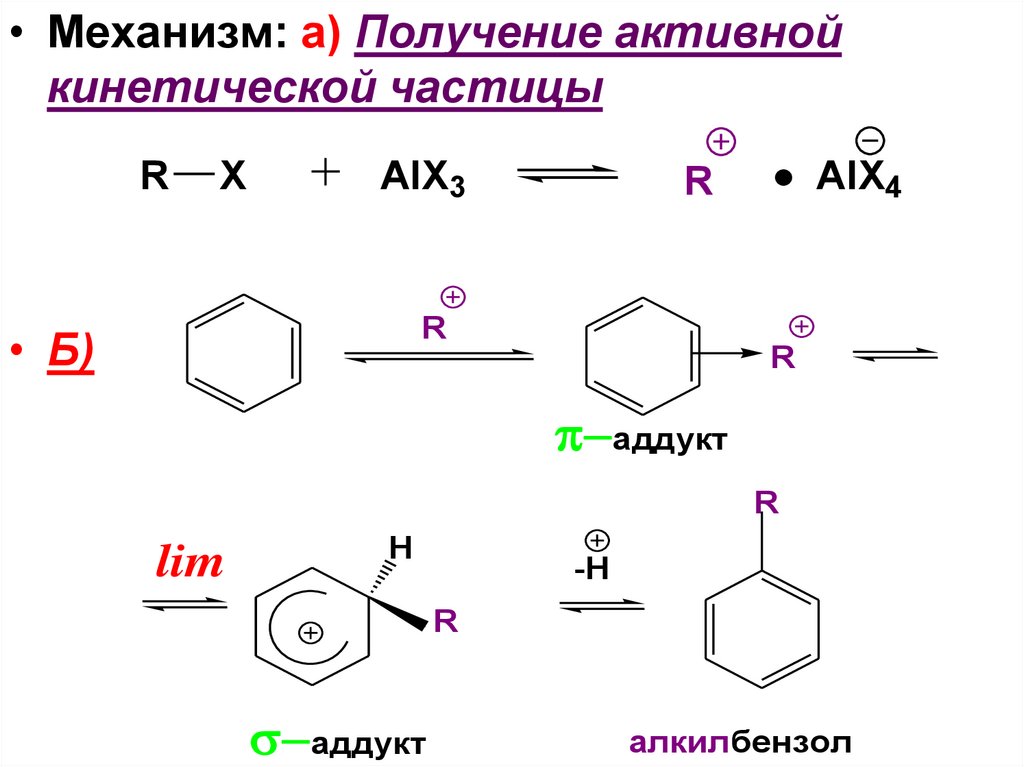
• Механизм: а) Получение активнойкинетической частицы
R
X
AlX3
AlX4
R
R
• Б)
R
аддукт
R
lim
H
-H
R
аддукт
алкилбензол
94.
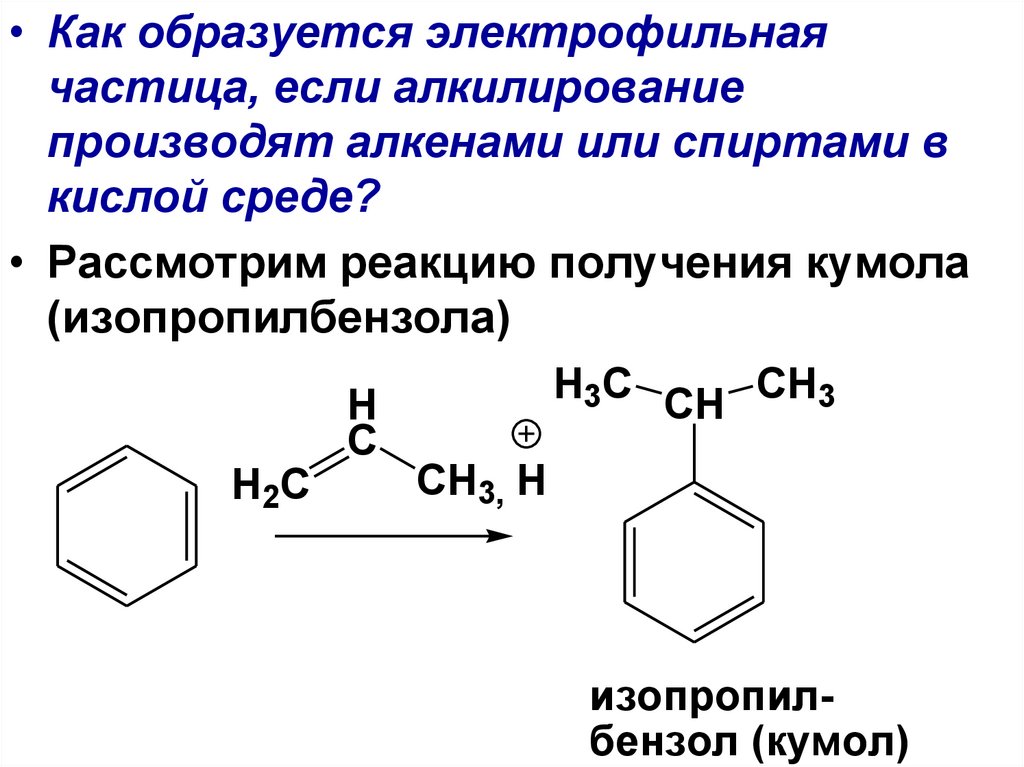
• Как образуется электрофильнаячастица, если алкилирование
производят алкенами или спиртами в
кислой среде?
• Рассмотрим реакцию получения кумола
(изопропилбензола)
H
C
H2C
H3C CH CH3
CH3, H
изопропилбензол (кумол)
95.
HC
H2C
H
CH3
H3C
C
H
CH3
Если реагентом является спирт,
как, например в приведенной ниже реакции
OH
H3C CH CH3
CH
H3C
CH3, H
H2O
изопропилбензол (кумол)
96.
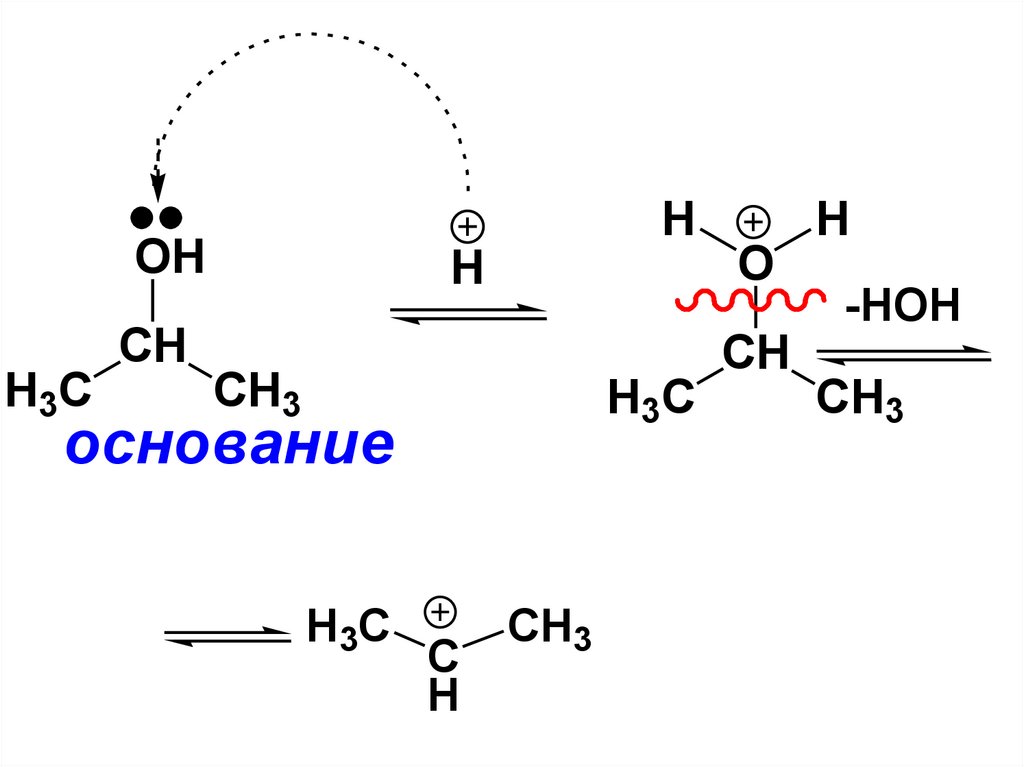
OHO
H
CH
H3C
H
H
-HOH
CH
CH3
H3C
основание
H3C
C
H
CH3
CH3
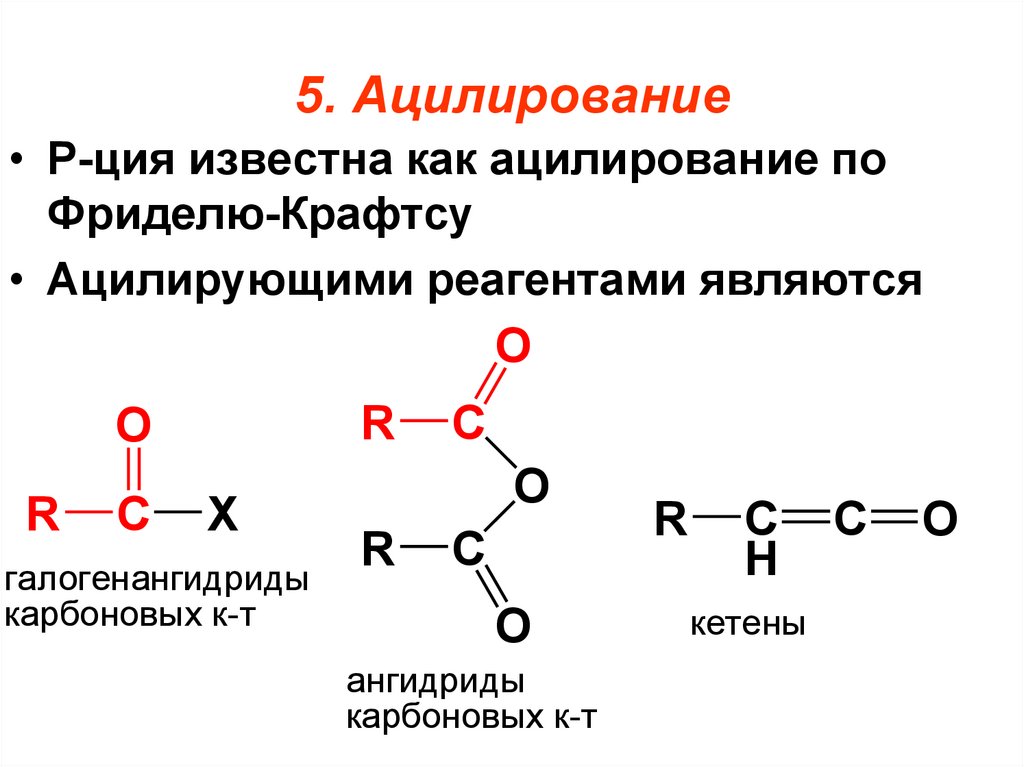
97. 5. Ацилирование
• Р-ция известна как ацилирование поФриделю-Крафтсу
• Ацилирующими реагентами являются
O
R
O
R
C
X
галогенангидриды
карбоновых к-т
C
O
R
C
O
ангидриды
карбоновых к-т
R
C
H
кетены
C
O
98.
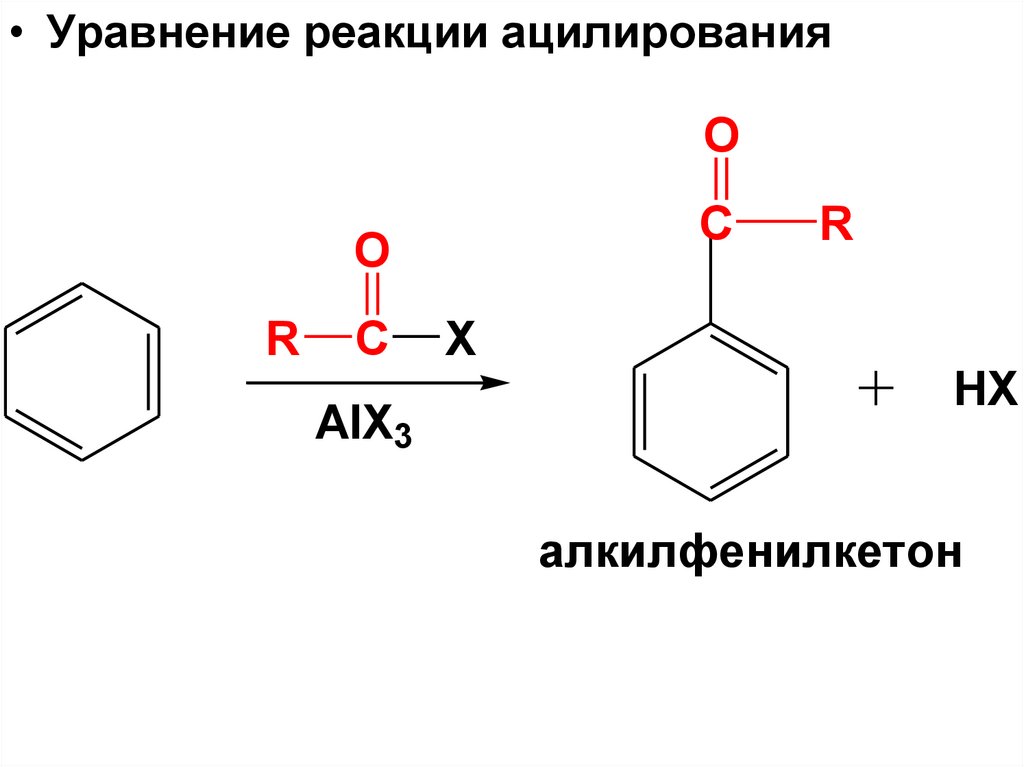
• Уравнение реакции ацилированияO
C
O
R
C
AlX3
R
X
HX
алкилфенилкетон
99.
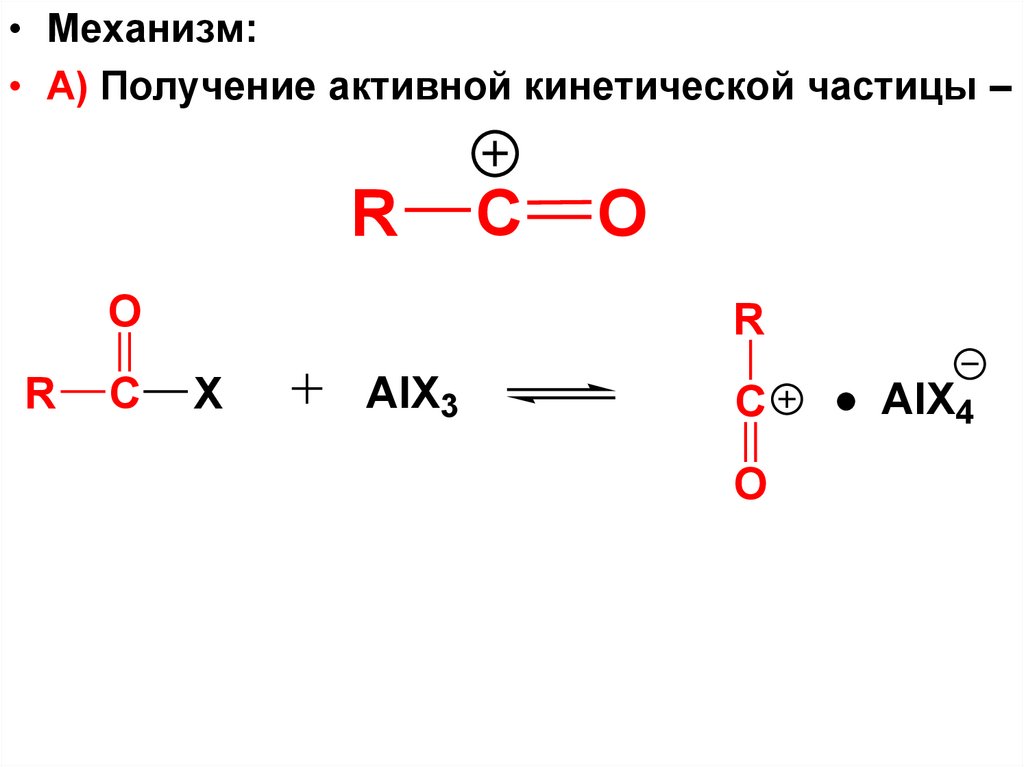
• Механизм:• А) Получение активной кинетической частицы –
R
O
R
C
C
O
R
X
AlX3
C
O
AlX4
100.
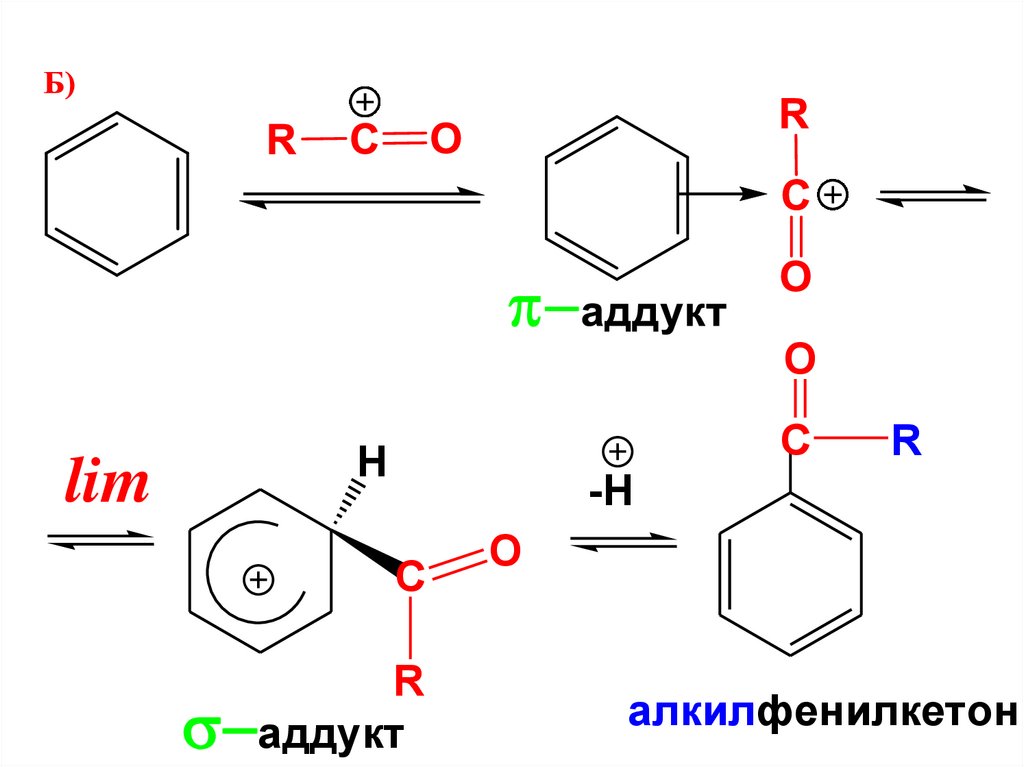
Olim
C
H
R
-H
C
R
аддукт
O
алкилфенилкетон
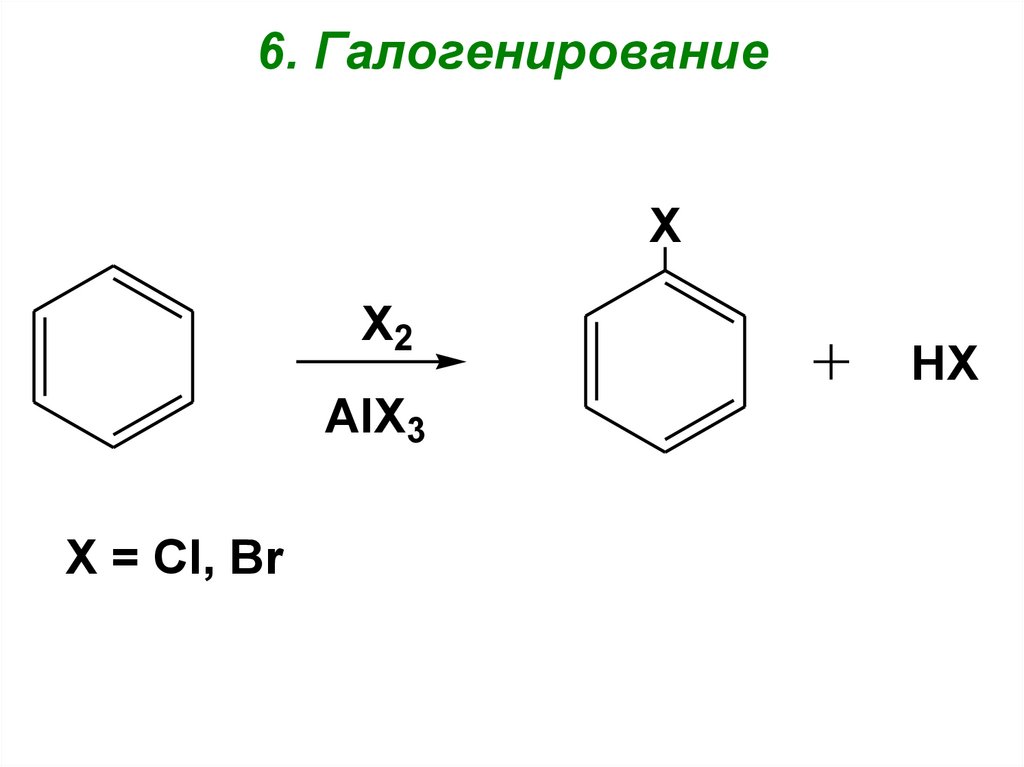
101. 6. Галогенирование
XX2
AlX3
X = Cl, Br
HX
102.
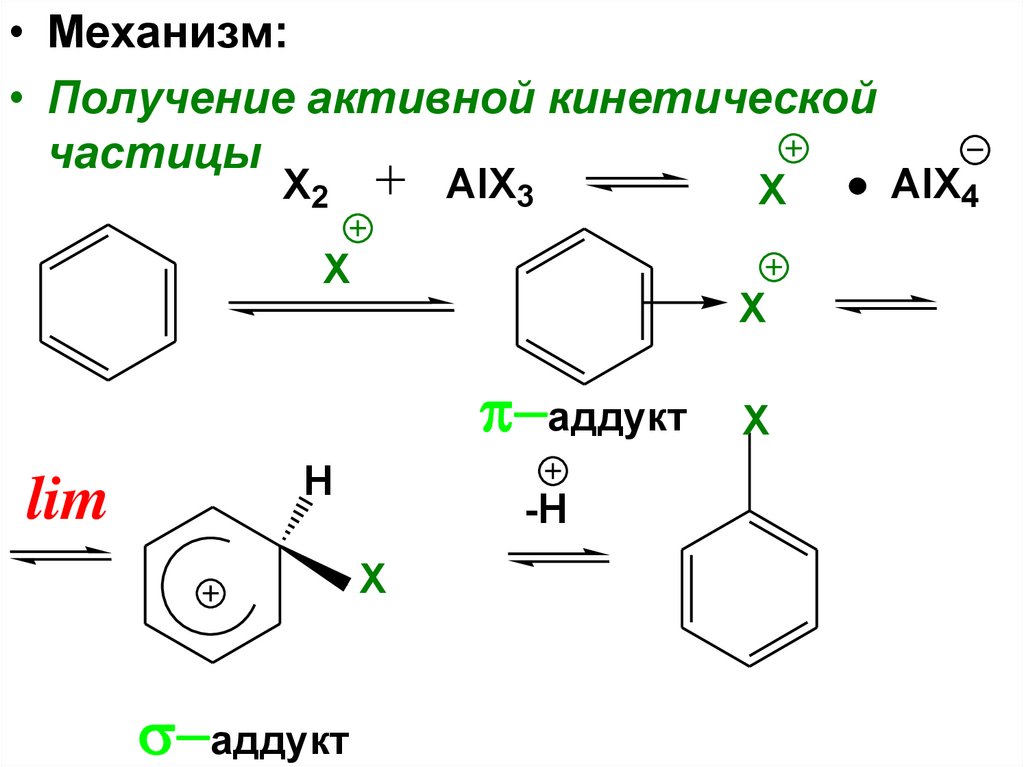
• Механизм:• Получение активной кинетической
частицы
AlX3
X2
X
X
X
аддукт
lim
H
-H
X
аддукт
X
AlX4
103.
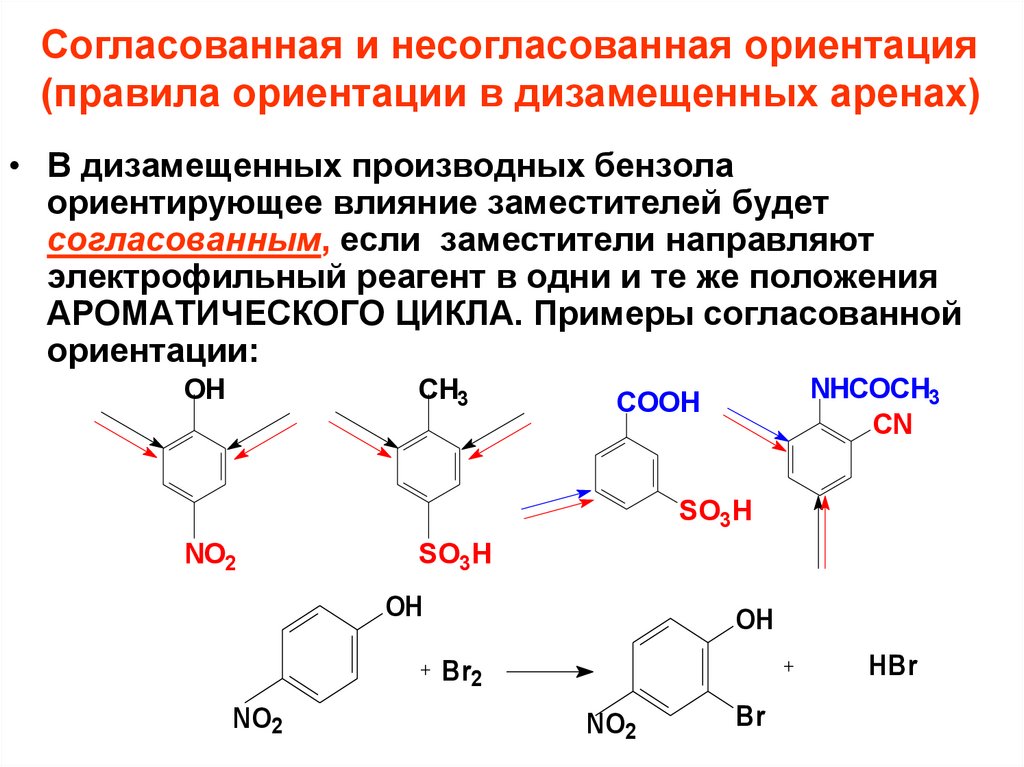
Согласованная и несогласованная ориентация(правила ориентации в дизамещенных аренах)
• В дизамещенных производных бензола
ориентирующее влияние заместителей будет
согласованным, если заместители направляют
электрофильный реагент в одни и те же положения
АРОМАТИЧЕСКОГО ЦИКЛА. Примеры согласованной
ориентации:
OH
CH3
NHCOCH3
CN
COOH
SO3H
NO2
SO3H
OH
OH
HBr
Br2
NO2
NO2
Br
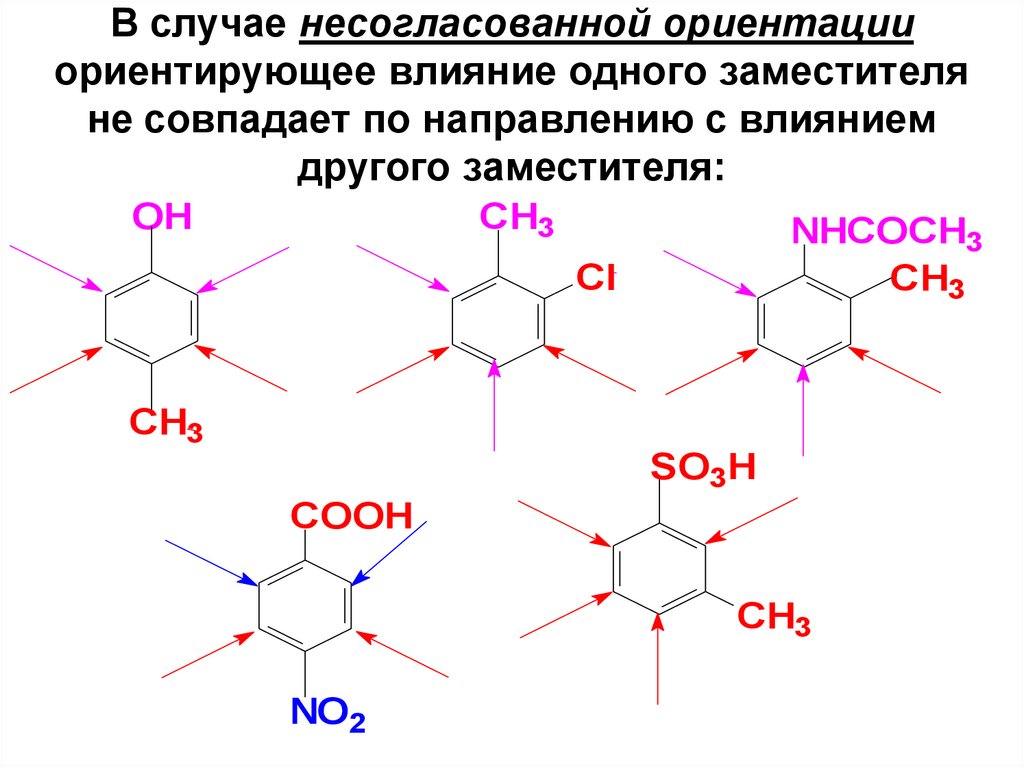
104. В случае несогласованной ориентации ориентирующее влияние одного заместителя не совпадает по направлению с влиянием другого
заместителя:OH
CH3
NHCOCH3
CH3
Cl
CH3
SO3H
COOH
CH3
NO2
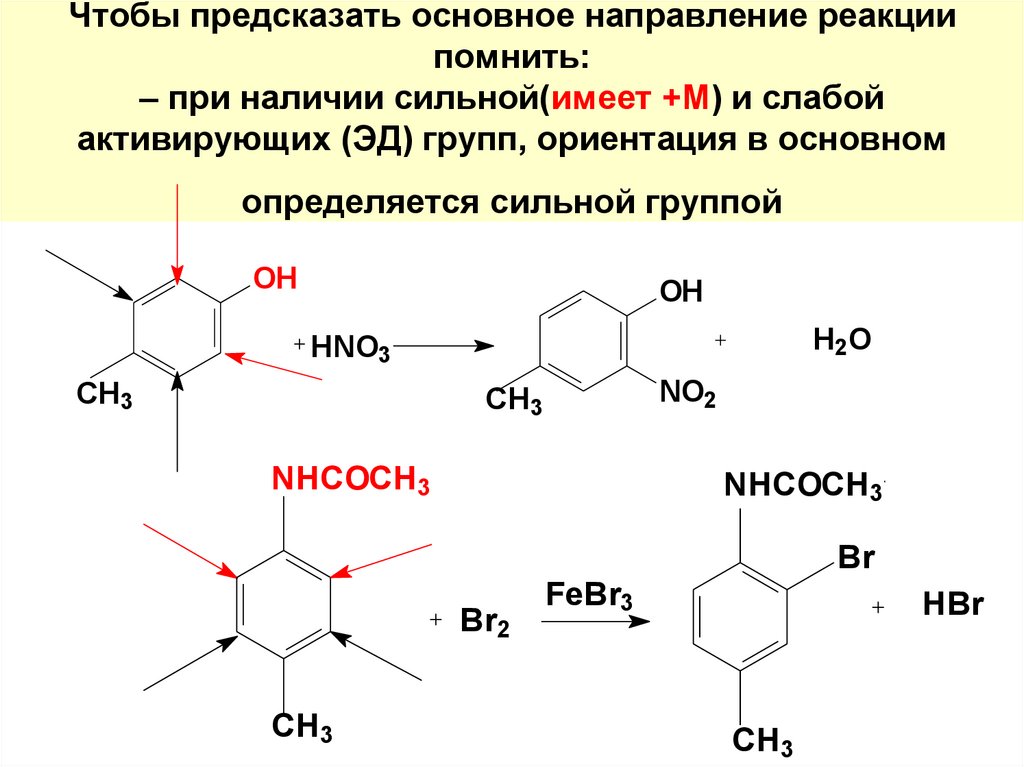
105. Чтобы предсказать основное направление реакции помнить: – при наличии сильной(имеет +М) и слабой активирующих (ЭД) групп,
ориентация в основномопределяется сильной группой
OH
OH
H 2O
HNO3
CH3
NO2
CH3
NHCOCH3
NHCOCH3
Br
Br2
CH3
FeBr3
HBr
CH3
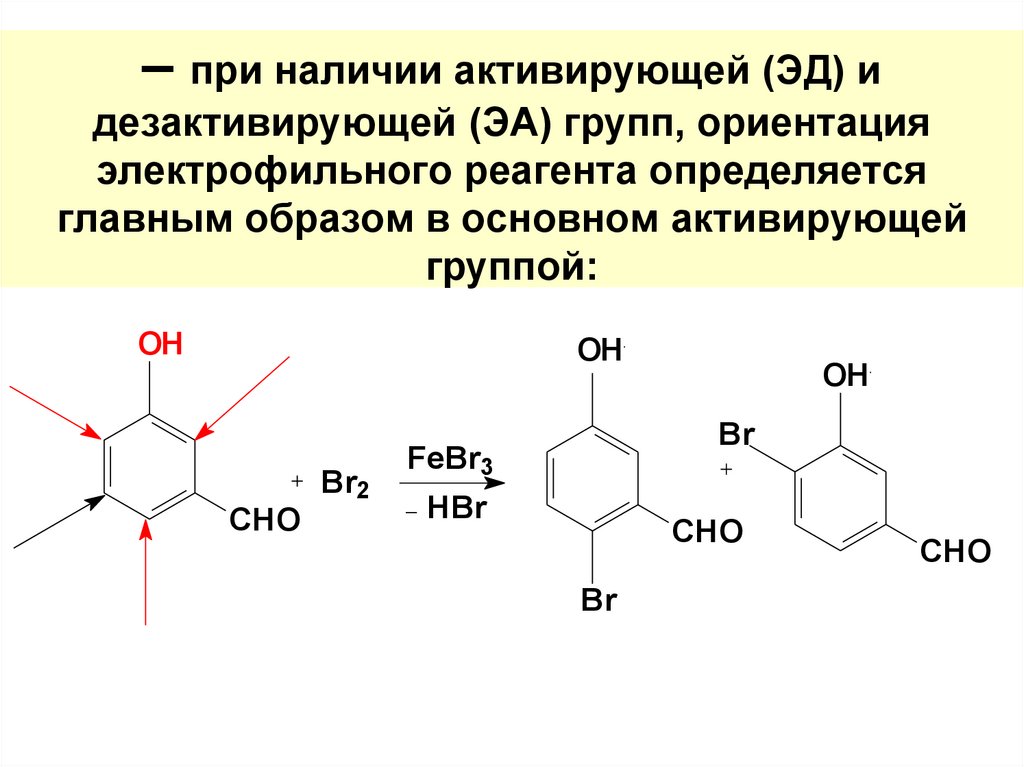
106. – при наличии активирующей (ЭД) и дезактивирующей (ЭА) групп, ориентация электрофильного реагента определяется главным образом
в основном активирующейгруппой:
OH
OH
Br2
CHO
OH
Br
FeBr3
HBr
CHO
Br
CHO
107.
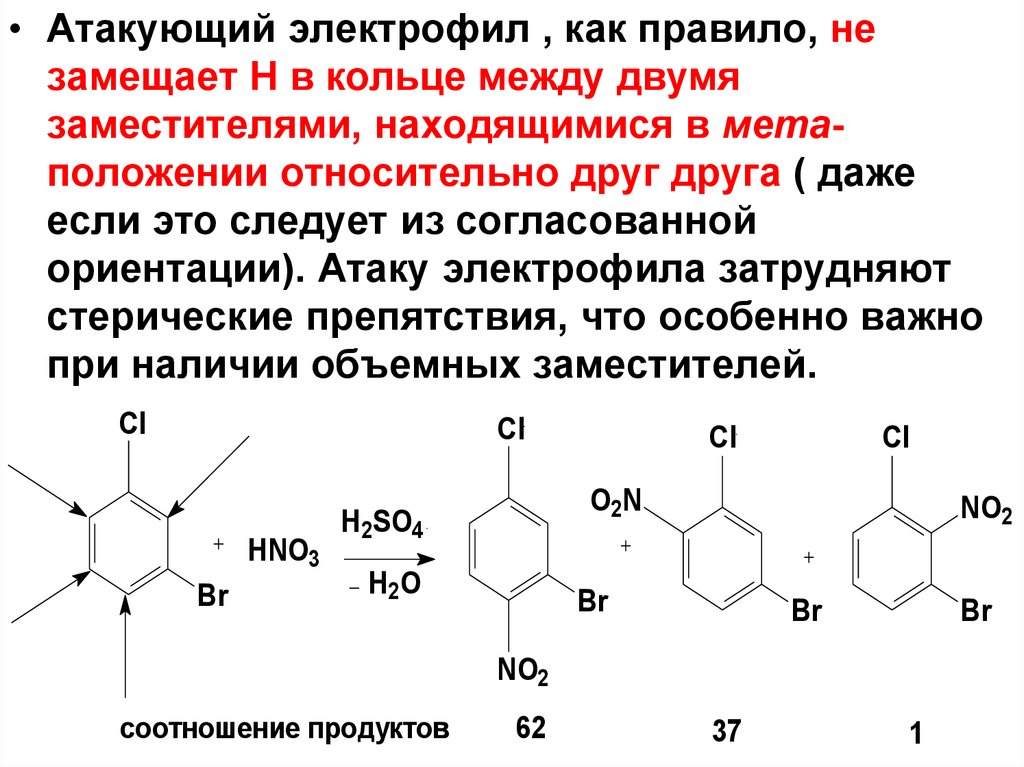
• Атакующий электрофил , как правило, незамещает Н в кольце между двумя
заместителями, находящимися в метаположении относительно друг друга ( даже
если это следует из согласованной
ориентации). Атаку электрофила затрудняют
стерические препятствия, что особенно важно
при наличии объемных заместителей.
Cl
Cl
HNO3
Br
Cl
Cl
O2N
H2SO4
H2O
NO2
Br
Br
Br
NO2
соотношение продуктов
62
37
1
108. Реакции бензола с нарушением ароматической системы
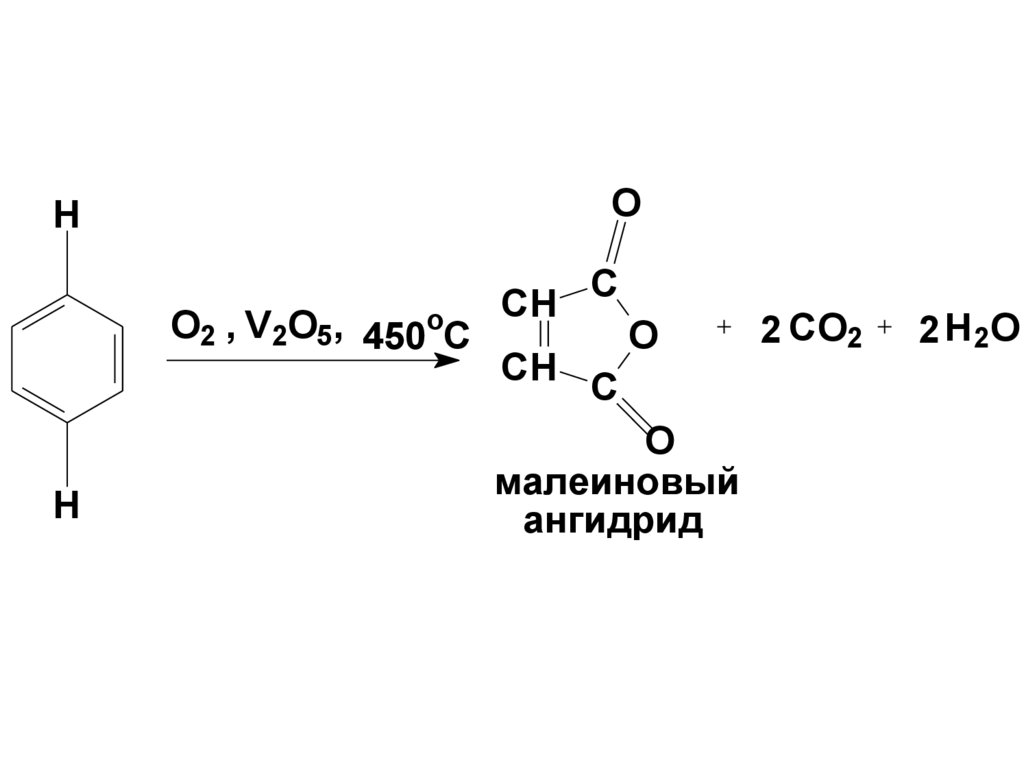
1.ОкислениеПо отношению к действию
окислителей бензол
сходен с алканами. На него не
действуют конц.HNO3,KMnO4, K2Cr2O7
в кислой среде.
Бензол окисляется O2 в присутствии
V2O5 :
109.
OH
O2 , V2O5, 450oC
H
CH
CH
C
O
C
O
малеиновый
ангидрид
2 CO2
2 H 2O
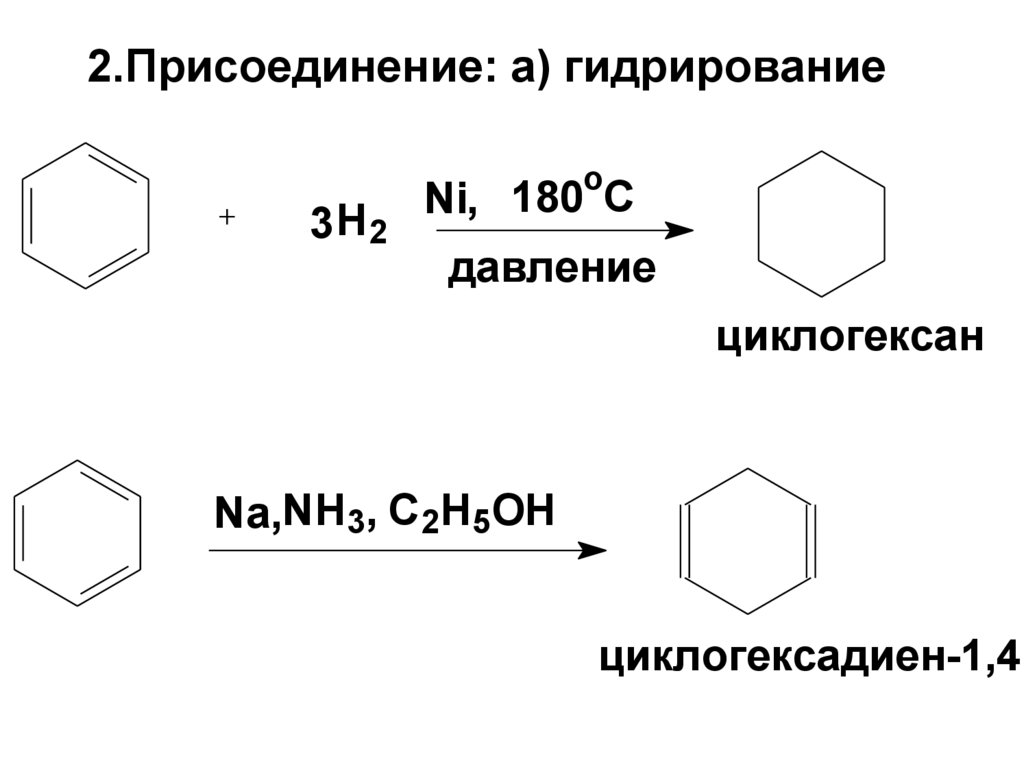
110. 2.Присоединение: а) гидрирование
3 H2o
Ni, 180 C
давление
циклогексан
Nа,NH3, C2H5OH
циклогексадиен-1,4
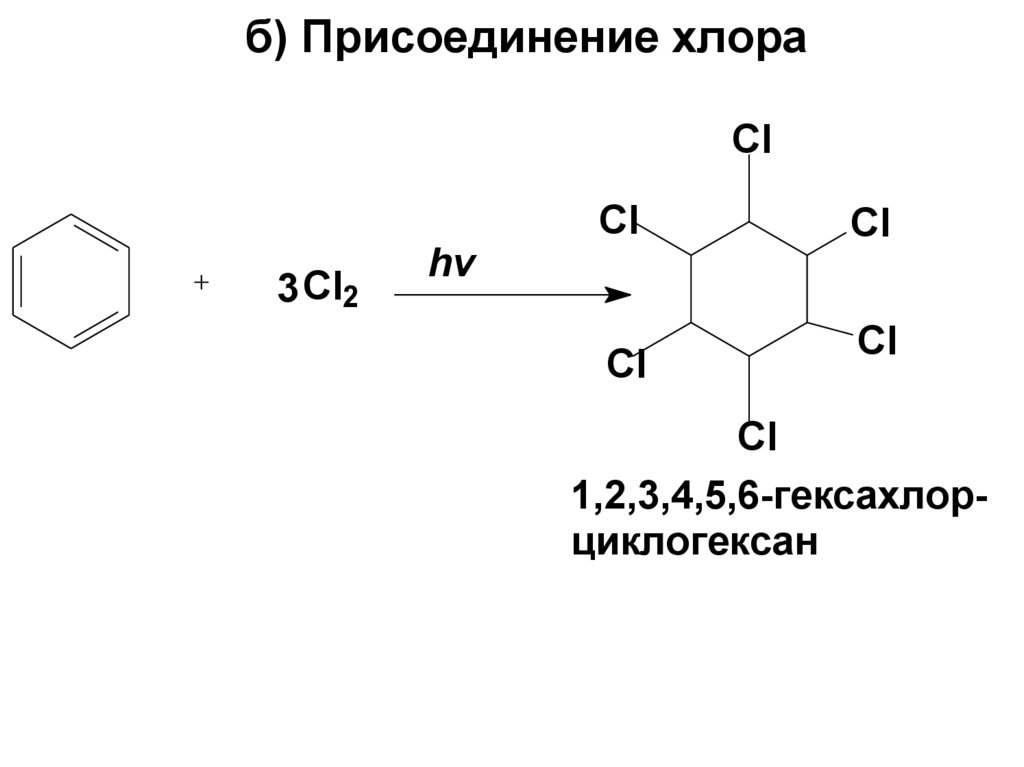
111. б) Присоединение хлора
Cl3 Cl2
hv
Cl
Cl
Cl
Cl
Cl
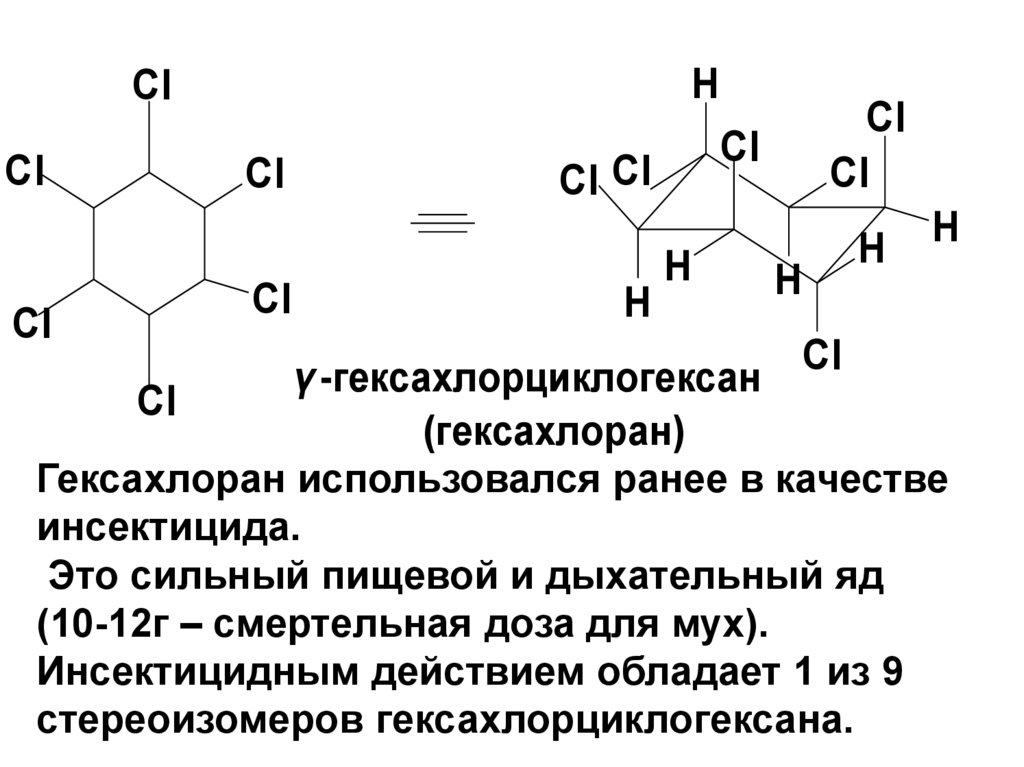
1,2,3,4,5,6-гексахлорциклогексан
112.
HCl
Cl
Cl
Cl
Cl
Cl
Cl
Cl Cl
H
Cl
Cl
H
H
H
H
γ -гексахлорциклогексан Cl
(гексахлоран)
Гексахлоран использовался ранее в качестве
инсектицида.
Это сильный пищевой и дыхательный яд
(10-12г – смертельная доза для мух).
Инсектицидным действием обладает 1 из 9
стереоизомеров гексахлорциклогексана.
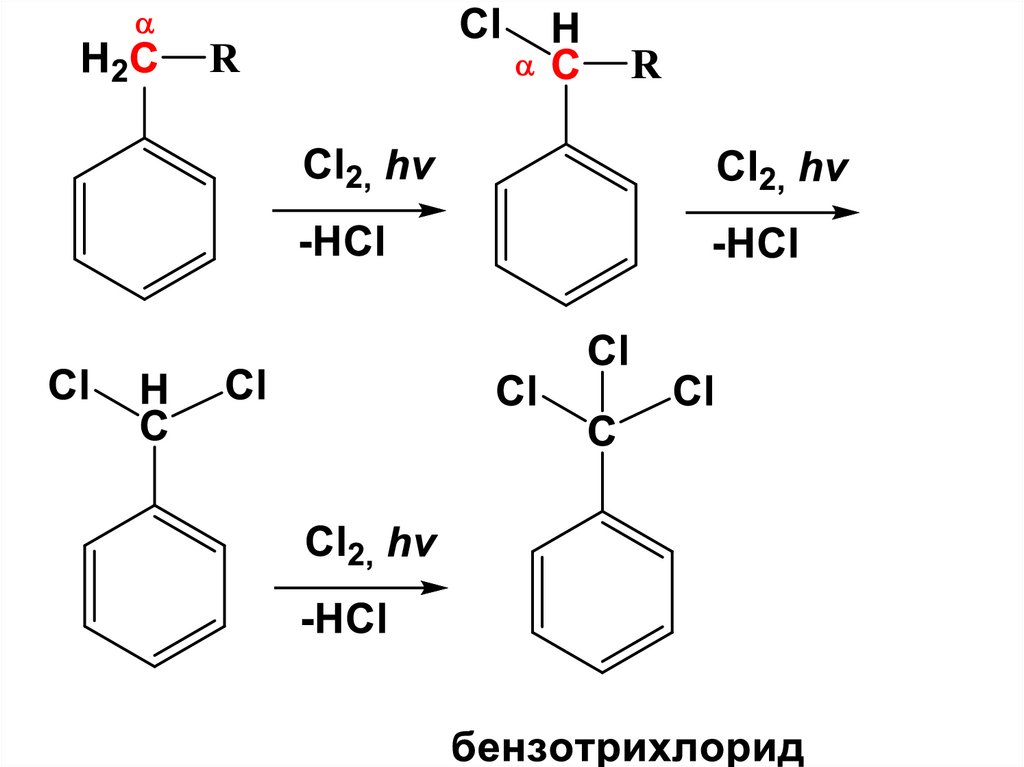
113. Реакции боковых цепей в алкилбензолах
а) Галогенирование (Учебник стр. 214-215).Алкилбензолы вступают в реакции
радикального хлорирования и
бромирования боковой цепи.
• Для инициирования образования
радикальных частиц
• используется освещение
ультрафиолетовым светом (фотолиз)
• или высокие температуры -450-500оС
(термолиз).
114.
115.
В алкилбензолах с более сложнойбоковой цепью бромирование
идет исключительно, а
хлорирование предпочтительно
с замещением атома Н у атома
С, непосредственно связанного
с бензольным кольцом –
«бензильных» водородов (αположение).
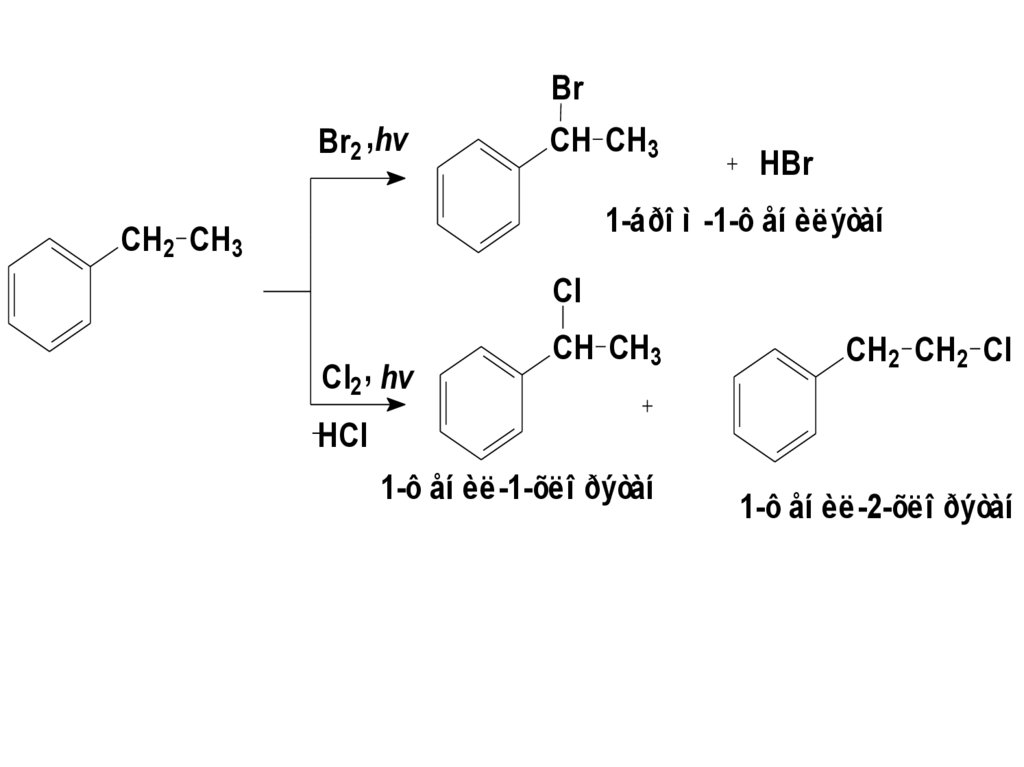
116.
BrBr2 ,hv
CH CH3
HBr
1-áðî ì -1-ô åí èëýòàí
CH2 CH3
Cl
Cl2 , hv
CH CH3
CH2 CH2 Cl
HCl
1-ô åí èë-1-õëî ðýòàí
1-ô åí èë-2-õëî ðýòàí
117.
Скорость замещения бензильного Н в3,3 выше, чем у третичного атома
углерода в алканах из-за более
низкой Есвязи (С-Н бензильной 314
кДж/моль, С-Н третичного 376
кДж/моль), и более высокой
стабильностью бензильного
радикала.
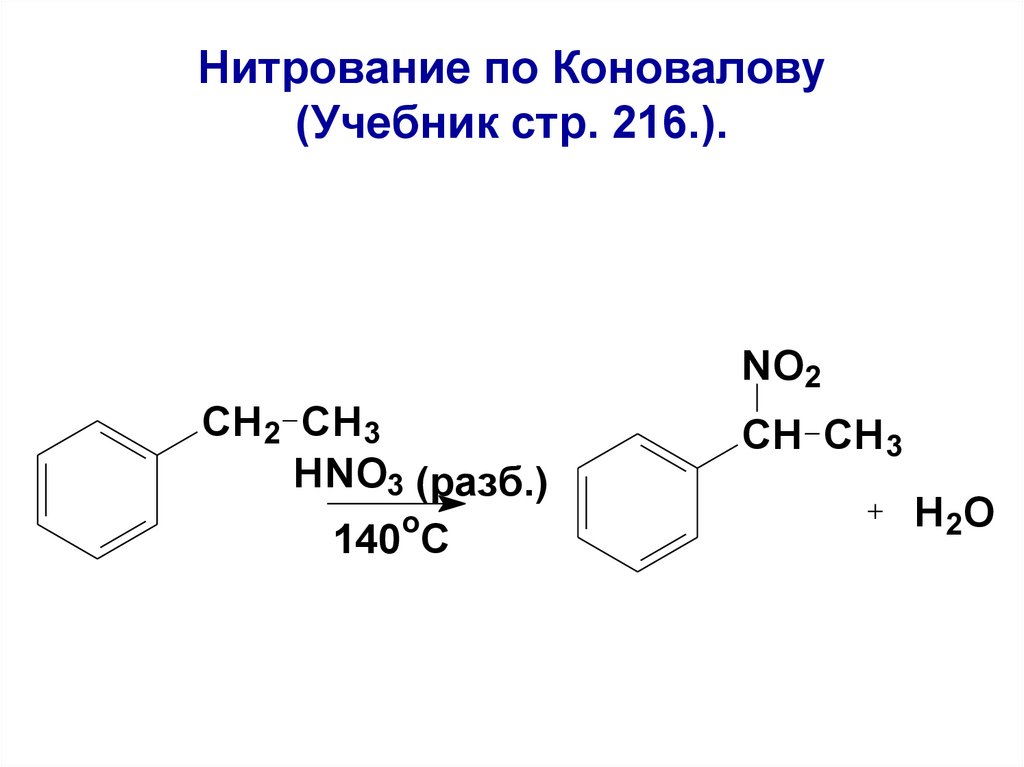
118. Нитрование по Коновалову (Учебник стр. 216.).
NO2CH2 CH3
HNO3 (разб.)
o
140 C
CH CH3
H 2O
119.
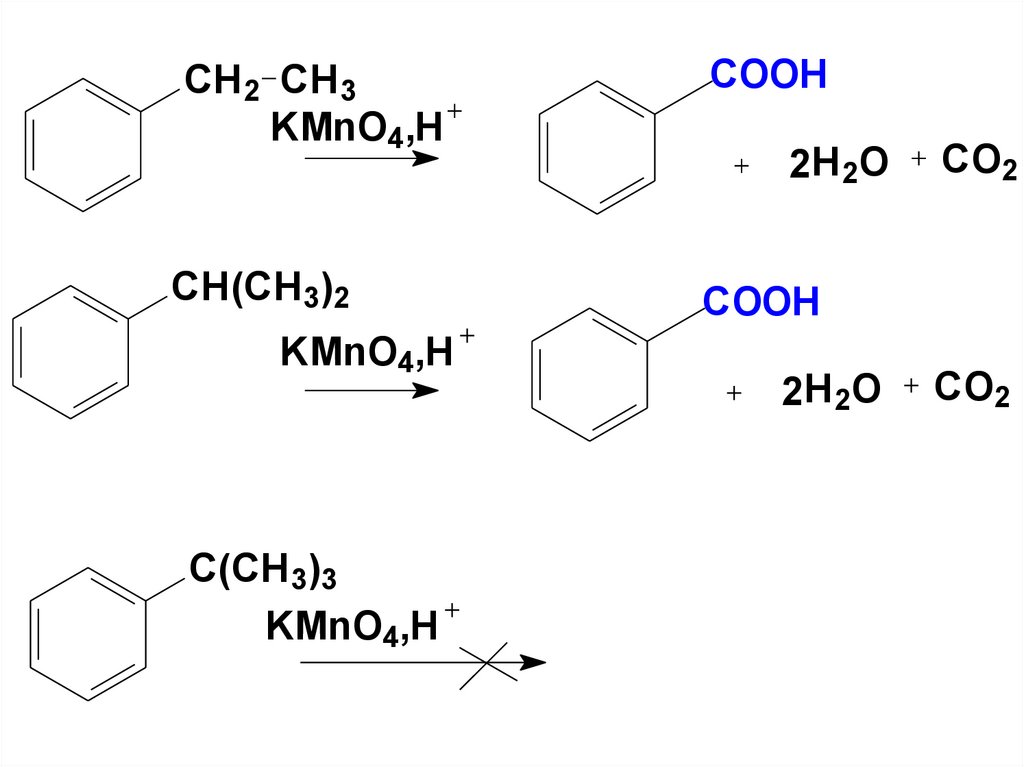
Окисление БОКОВЫХ ЦЕПЕЙАРЕНОВ(Учебник стр. 216.).
Алкилбензолы, в которых с бензольным
кольцом связана перв- или вторалкильная группы окисляются (
КМnO4,K2Cr2O7). Независимо от длины и
разветвленности боковой цепи окислению
всегда подвергается α-углеродный атом.
Третичные алкильные группы, у которых
нет α-Н практически не окисляются в этих
условиях.
120.
CH 2 CH 3KMnO4,H
CH(CH 3)2
KMnO4,H
C(CH 3)3
KMnO4,H
COOH
2H 2 O
CO2
COOH
2H 2 O
CO2
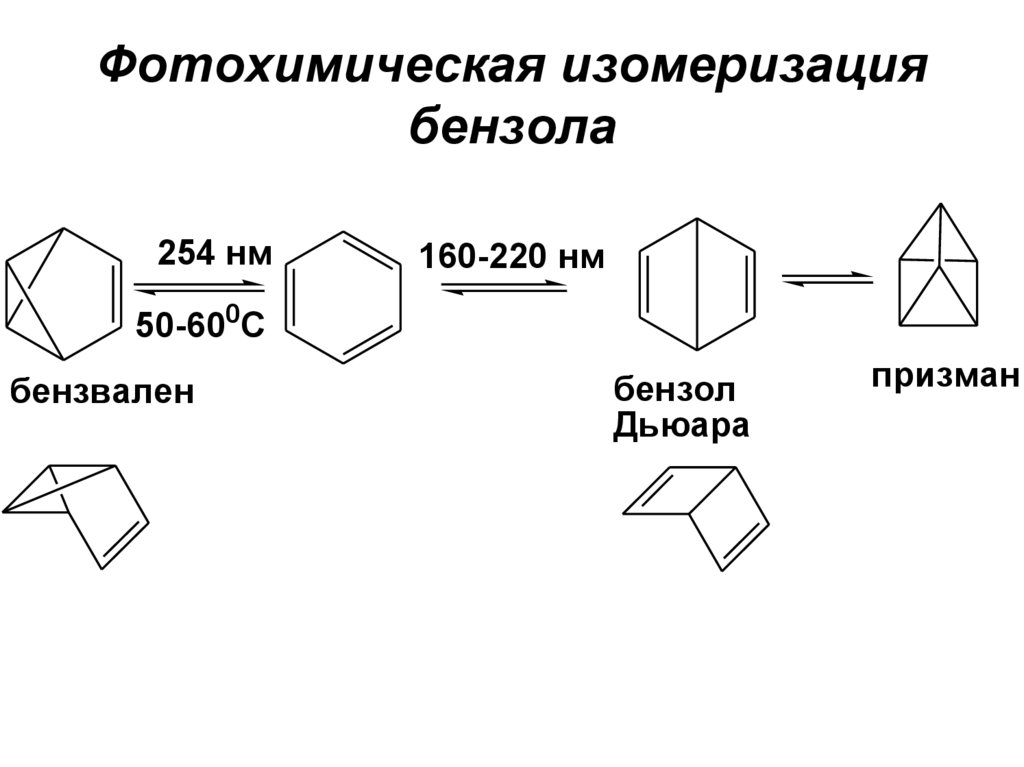
121. Фотохимическая изомеризация бензола
254 нм160-220 нм
50-600С
бензвален
бензол
Дьюара
призман





















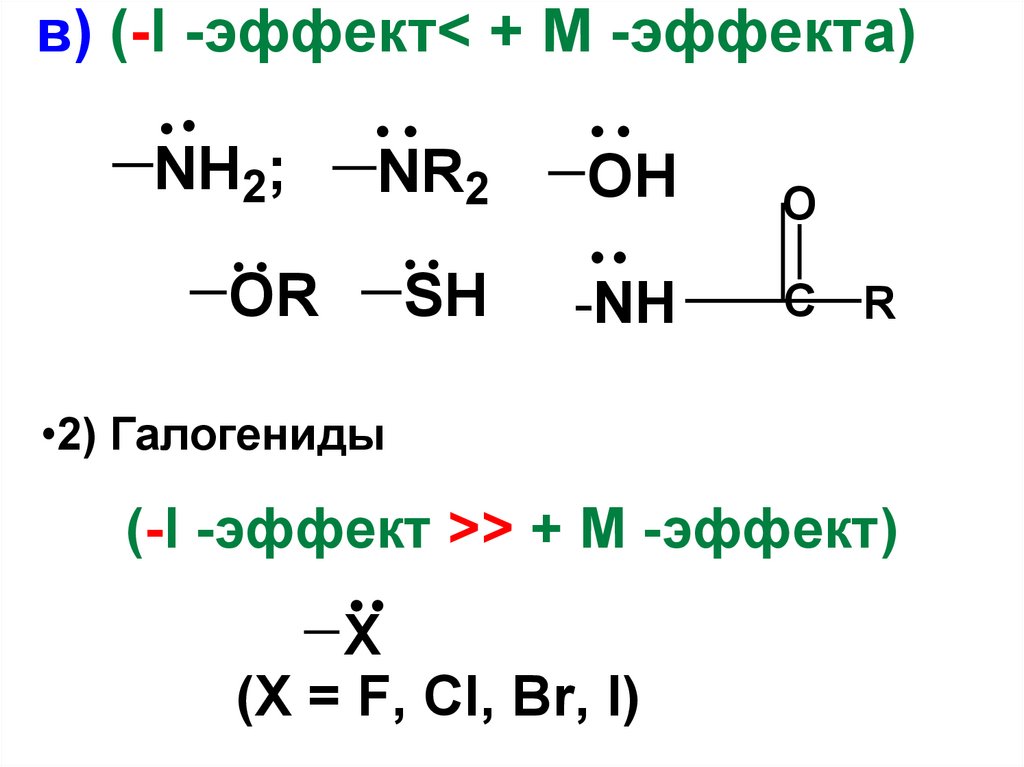


















 chemistry
chemistry








