Similar presentations:
Лекция 7. Электрофильное замещение в ароматических системах
1. На предыдущей лекции…
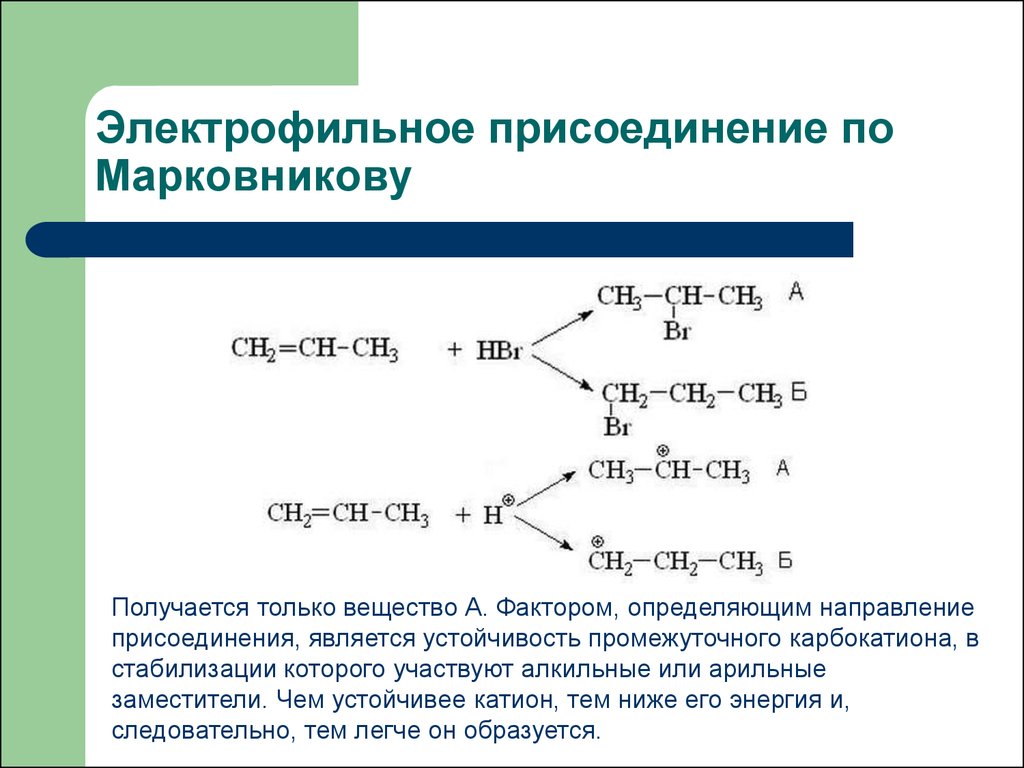
2. Электрофильное присоединение по Марковникову
Получается только вещество А. Фактором, определяющим направлениеприсоединения, является устойчивость промежуточного карбокатиона, в
стабилизации которого участвуют алкильные или арильные
заместители. Чем устойчивее катион, тем ниже его энергия и,
следовательно, тем легче он образуется.
3. Пероксидный эффект Хараша
В присутствии пероксидов присоединение бромистого водорода калкенам идет против правила Марковникова. Из двух радикалов А и Б в
основном образуется первый, как более устойчивый. Аналогично
электрофильному, радикальное присоединение к алкенам протекает
через стадию образования наиболее стабильного радикала.
4. Электрофильное замещение в ароматических системах
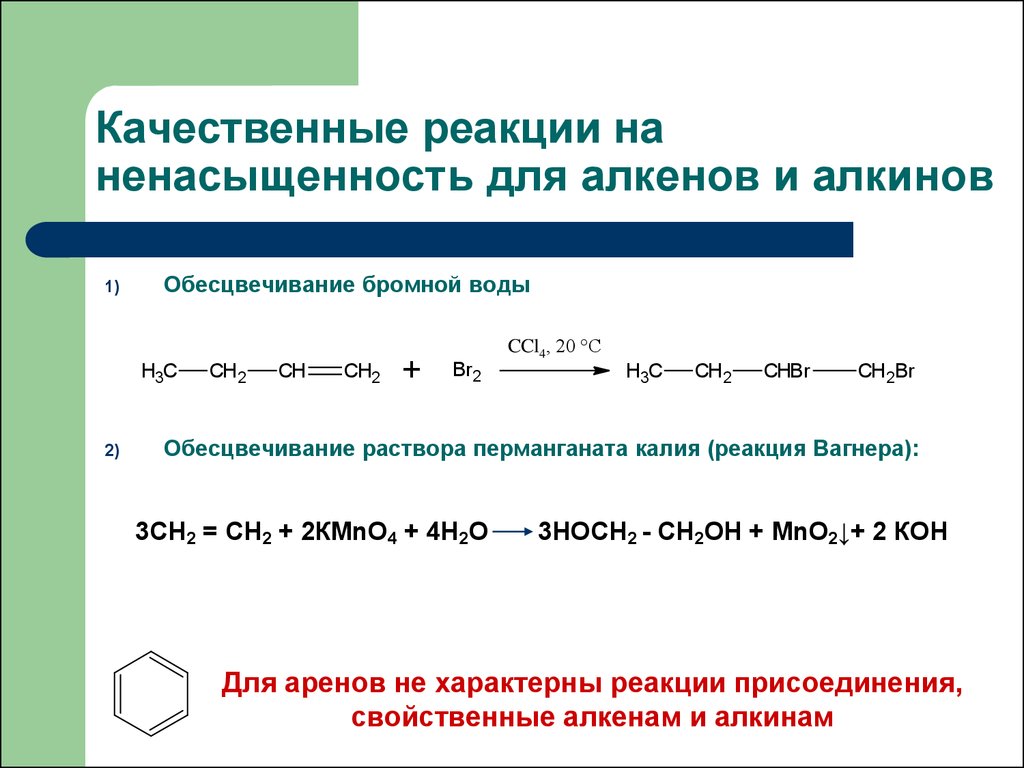
Лекция 75. Качественные реакции на ненасыщенность для алкенов и алкинов
1)Обесцвечивание бромной воды
H3C
2)
CH 2
CH
CH2
+
CCl4, 20 °C
Br2
H3C
CH 2
CHBr
CH 2Br
Обесцвечивание раствора перманганата калия (реакция Вагнера):
3CH2 = CH2 + 2КМnО4 + 4H2О
3НОCH2 - CH2ОН + МnО2↓+ 2 КОН
Для аренов не характерны реакции присоединения,
свойственные алкенам и алкинам
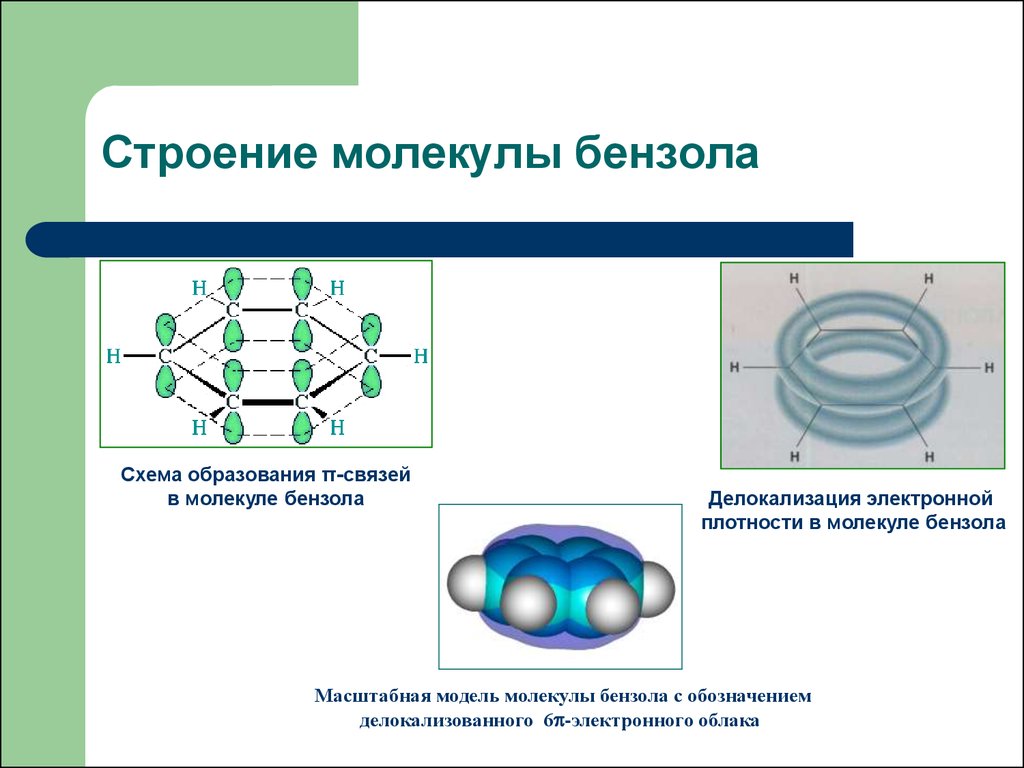
6. Строение молекулы бензола
Схема образования π-связейв молекуле бензола
Делокализация электронной
плотности в молекуле бензола
Масштабная модель молекулы бензола с обозначением
делокализованного 6 -электронного облака
7. Арены и алкены: действие электрофилов
Для ароматических соединенийхарактерные реакции электрофильного
замещения (SE)
Ar
H
+
X
+
Ar
X
+
H
+
8. Электрофилы
Электрофильные реагенты (Е, Е+) – это частицы, образующиеновые ковалентные связи за счет пары электронов
партнера
- положительно заряженные ионы
+
+
H
Hal
протон
NO2
галоген-катионы
+
нитроил-катион
NO
+
нитрозил-катион
C
+
карбокатион
- нейтральные молекулы, имеющие электронодефицитный центр
δ+
C
Х
Х – группа с – I- и/или
– М-эффектом
SO3
Триоксид серы
BF3, BCl3, FeBr3, AlCl3
Кислоты Льюиса
9. Сила электрофилов
1.1. Сильные электрофилыNO2+(Ион нитрония, нитроил-катион); комплексы Cl2 или Br2 с различными
кислотами Льюиса (FeCl3, AlBr3, AlCl3, SbCl5 и т.д.); H2OCl + , H2OBr + , RSO2+ ,
HSO3+ , H2S2O7 .
1.2. Электрофилы средней силы
Комплексы алкилгалогенидов или ацилгалогенидов с кислотами Льюиса
(RCl·AlCl3, RBr·GaBr3, RCOCl·AlCl3 и др.); комплексы спиртов с сильными
кислотами Льюиса и Бренстеда (ROH·BF3, ROH·H3PO4, ROH·HF).
1.3. Слабые электрофилы
Катионы диазония ArNN+, иминия CH2=N+H2, нитрозония NO+ (нитрозоил-катион);
оксид углерода (IV) СО2 (один из самых слабых электрофилов).
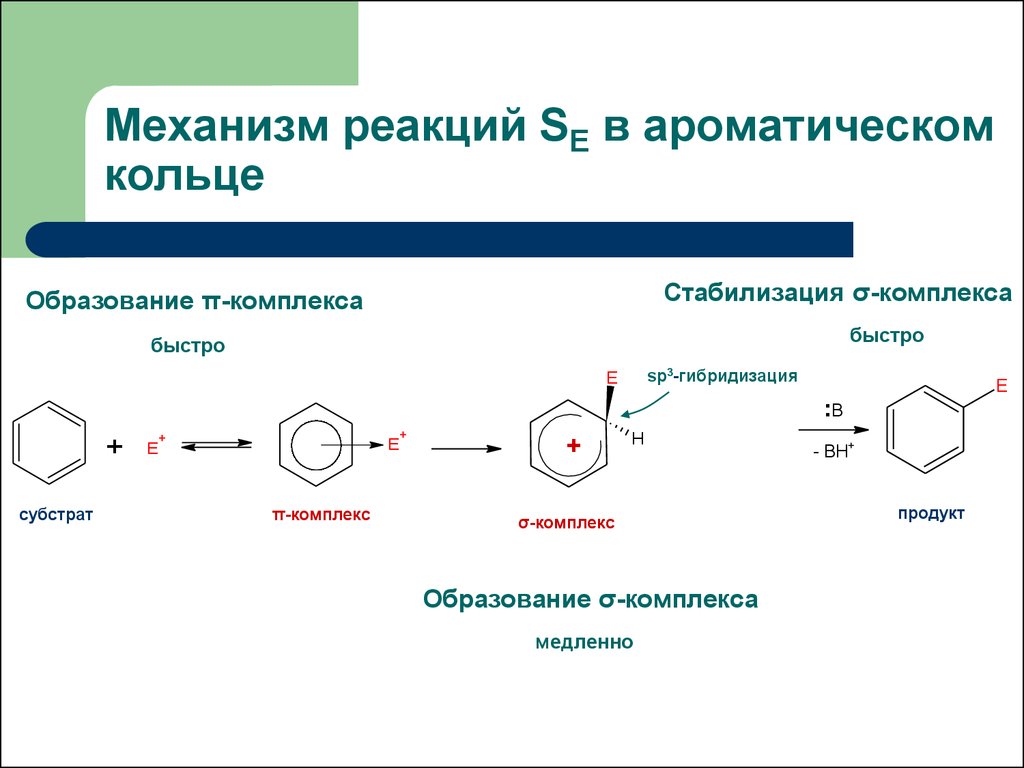
10. Механизм реакций SE в ароматическом кольце
Стабилизация σ-комплексаОбразование π-комплекса
быстро
быстро
sp3-гибридизация
E
E
:B
+
субстрат
E
+
E
π-комплекс
+
+
H
σ-комплекс
Образование σ-комплекса
медленно
- BH+
продукт
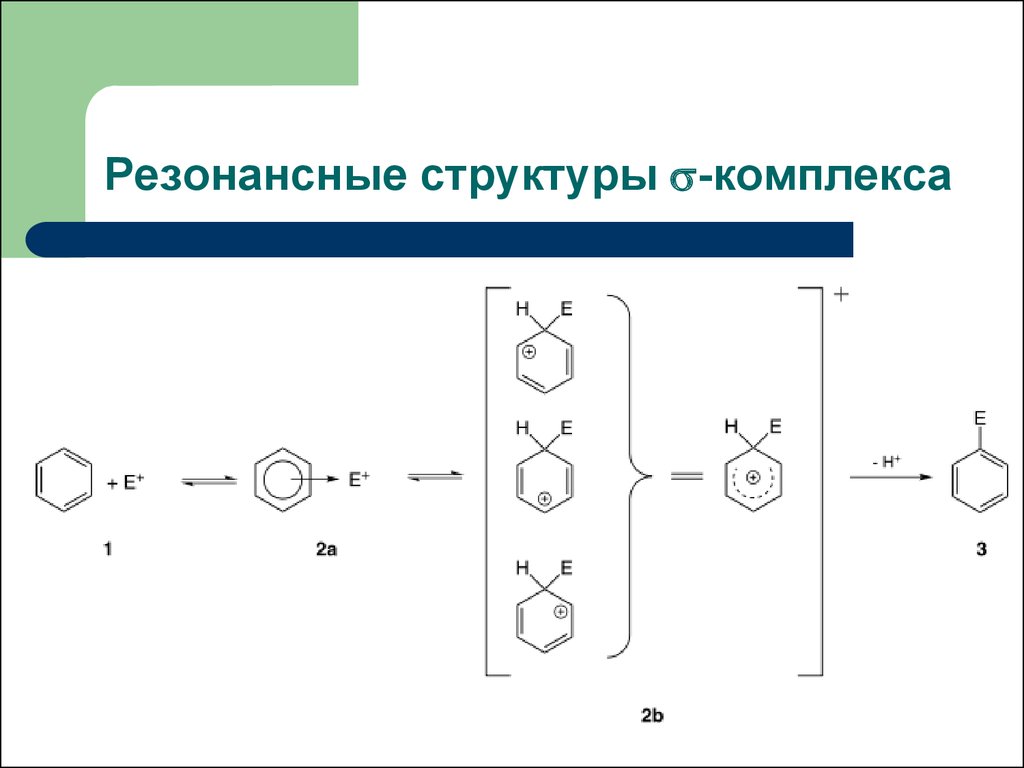
11. Резонансные структуры -комплекса
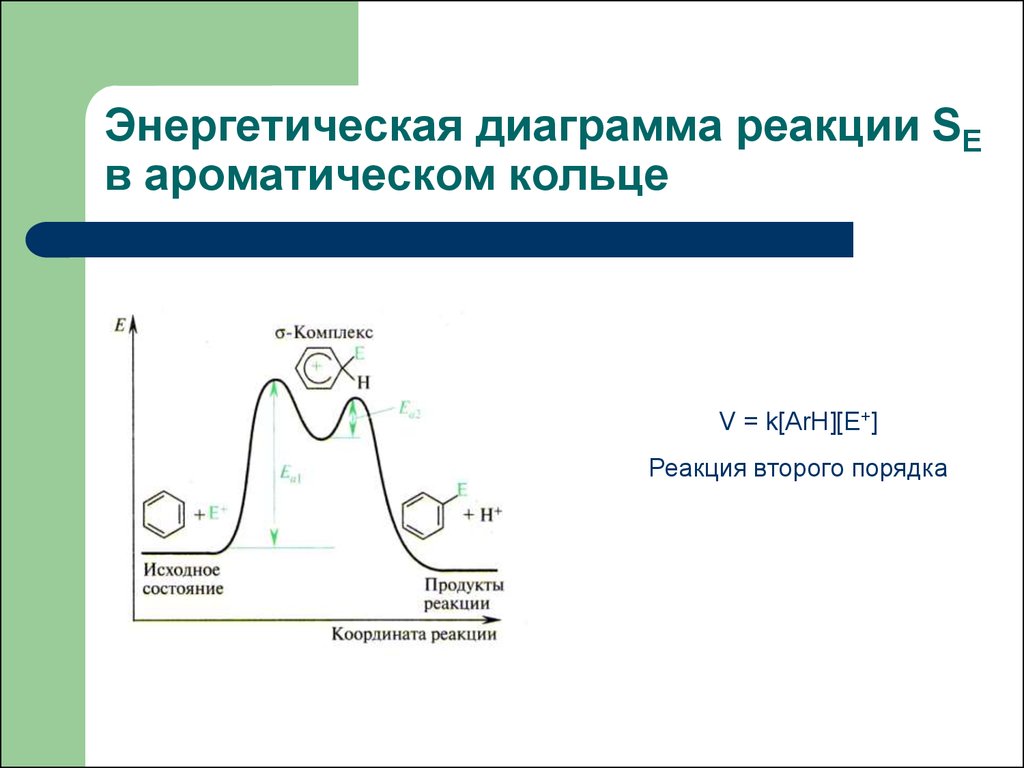
Резонансные структуры -комплекса12. Энергетическая диаграмма реакции SE в ароматическом кольце
V = k[ArH][E+]Реакция второго порядка
13. Устойчивость аренониевых ионов
Устойчивость -комплексов растет при наличии в ароматическом ядреэлектронодонорных заместителей, участвующих в делокализации
положительного заряда, а также при наличии комплексных
противоионов типа BF4- или SbF6- (слабые основания).
Мезитилен образует аренониевый ион при взаимодействии с HF в присутствии
BF3, устойчивый до -30оС. Этот -комплекс имеет желтую окраску и полностью
разлагается на исходные компоненты уже при -15оС.
При использовании в качестве кислоты Льюиса SbF5 образуется соль с
противоионом SbF6-, которая более стабильна и не разлагается даже при +50оС.
14. Стабильные аренониевые ионы
15. Влияние строения субстрата на SE
1)Как заместитель в бензольном кольце влияет на скорость SE в
целом?
2)
Как заместитель в бензольном кольце влияет на направление
атаки электрофильного агента (региоспецифичность реакций
SE)?
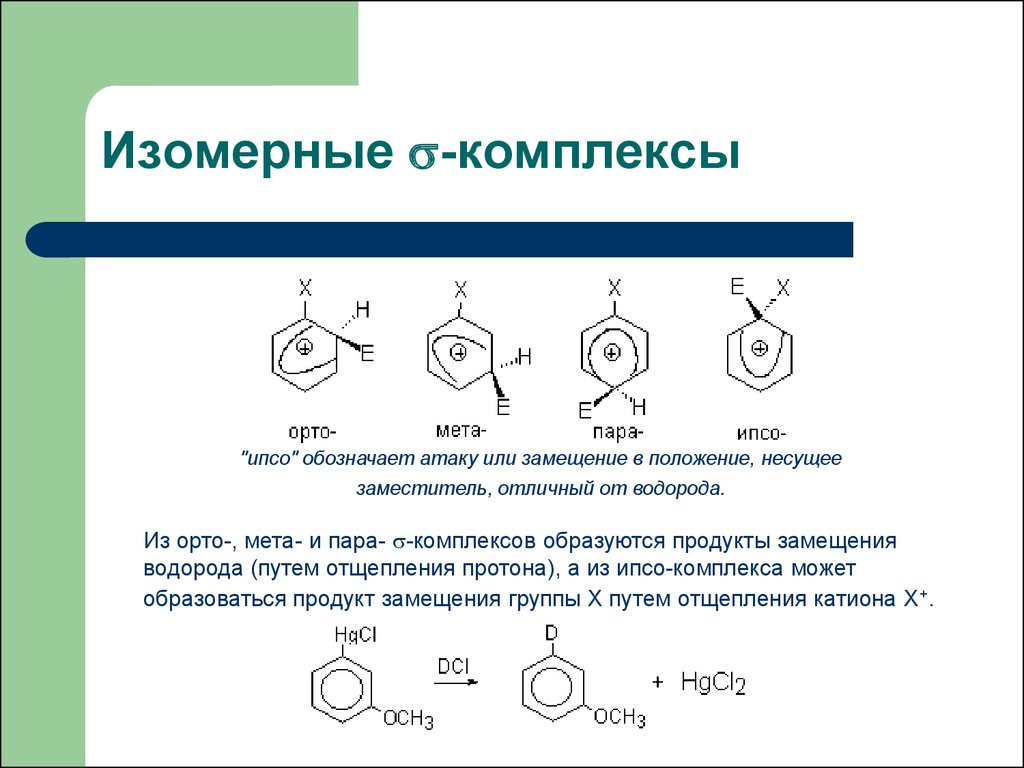
16. Изомерные -комплексы
Изомерные -комплексы"ипсо" обозначает атаку или замещение в положение, несущее
заместитель, отличный от водорода.
Из орто-, мета- и пара- -комплексов образуются продукты замещения
водорода (путем отщепления протона), а из ипсо-комплекса может
образоваться продукт замещения группы Х путем отщепления катиона Х+.
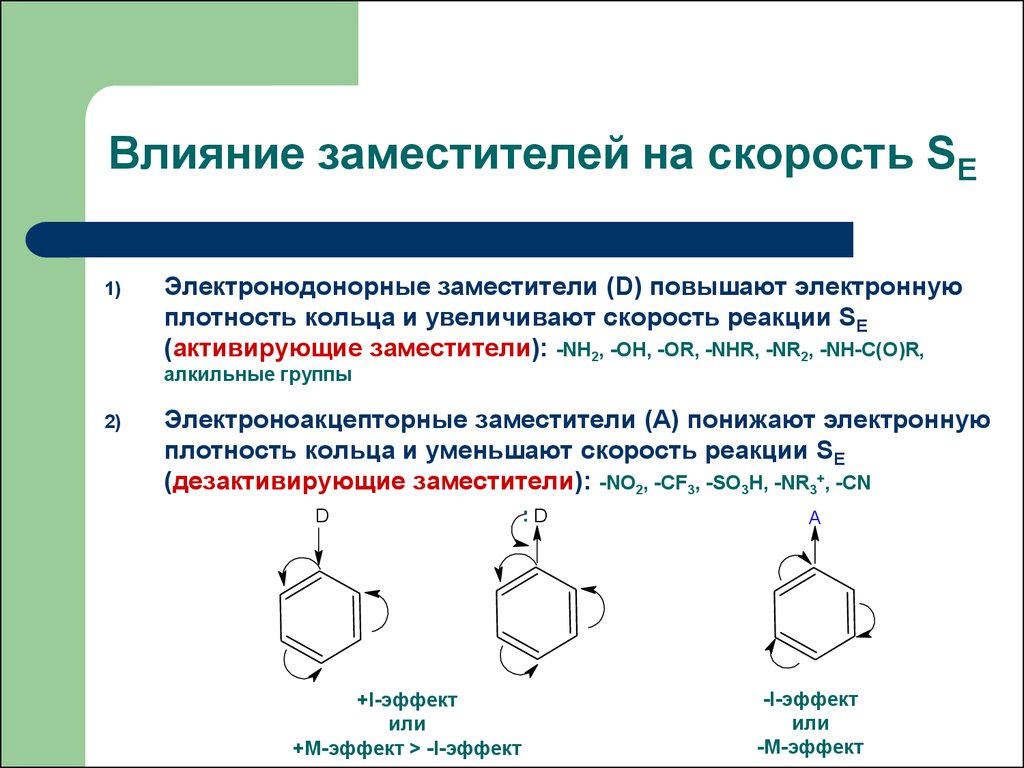
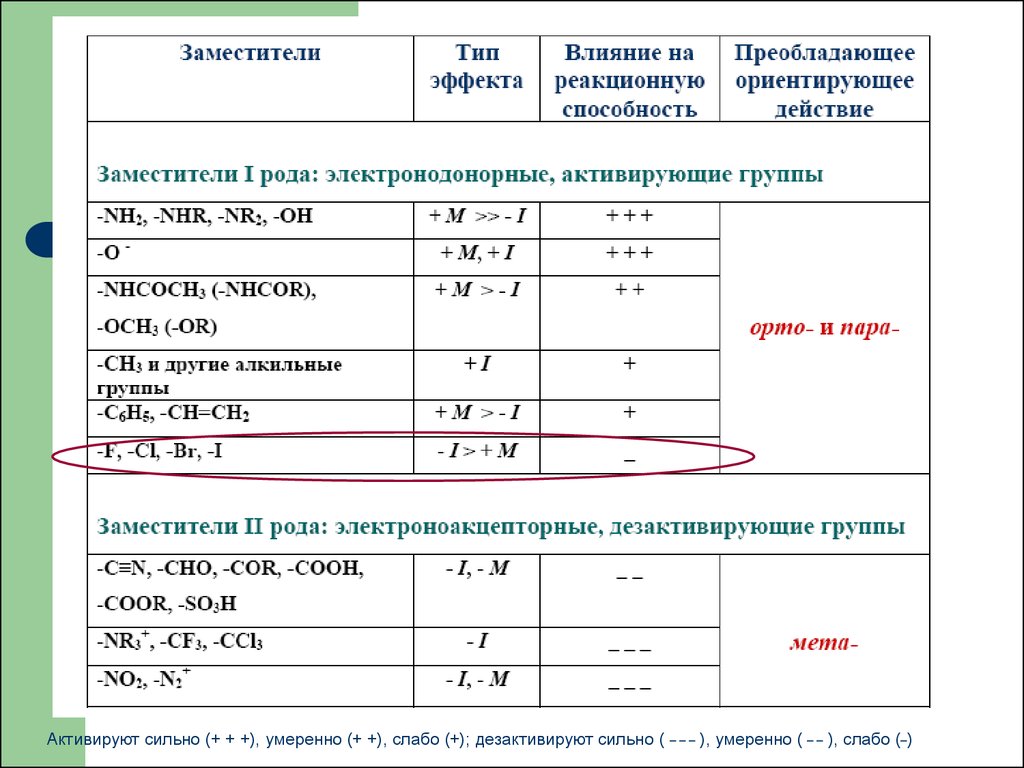
17. Влияние заместителей на скорость SE
1)Электронодонорные заместители (D) повышают электронную
плотность кольца и увеличивают скорость реакции SE
(активирующие заместители): -NH2, -OH, -OR, -NHR, -NR2, -NH-C(O)R,
алкильные группы
2)
Электроноакцепторные заместители (А) понижают электронную
плотность кольца и уменьшают скорость реакции SE
(дезактивирующие заместители): -NO2, -CF3, -SO3H, -NR3+, -CN
D
+I-эффект
или
+М-эффект > -I-эффект
:D
A
-I-эффект
или
-М-эффект
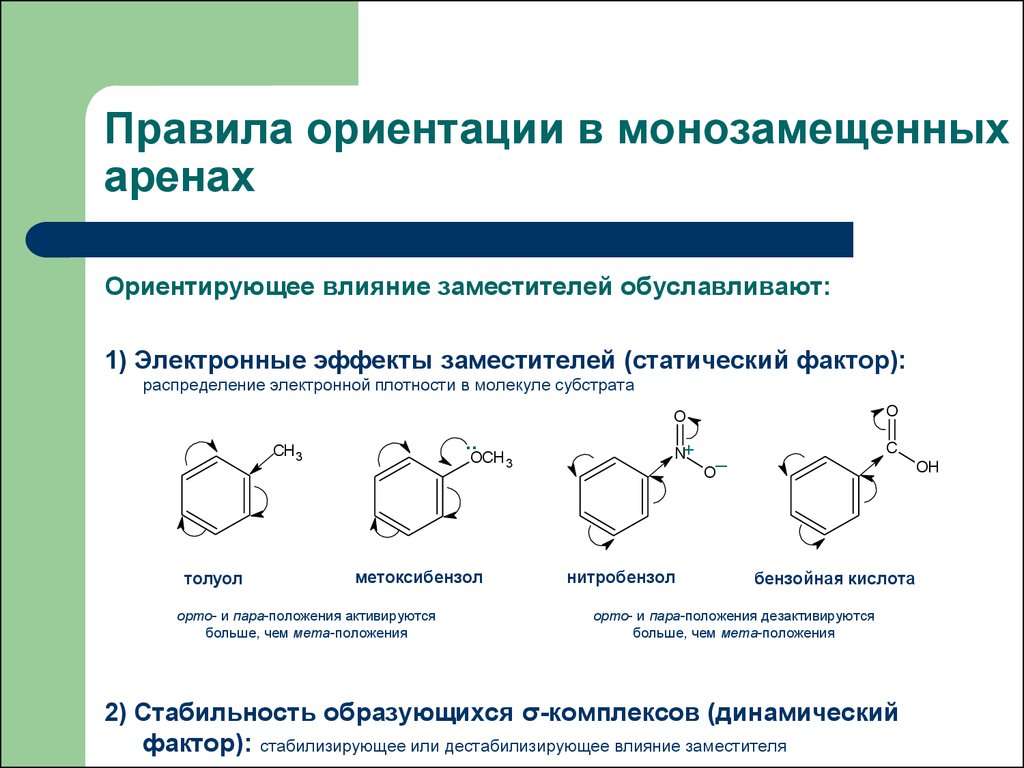
18. Правила ориентации в монозамещенных аренах
Ориентирующее влияние заместителей обуславливают:1) Электронные эффекты заместителей (статический фактор):
распределение электронной плотности в молекуле субстрата
O
O
..
CH 3
толуол
OCH 3
метоксибензол
орто- и пара-положения активируются
больше, чем мета-положения
N+
C
_
OH
O
нитробензол
бензойная кислота
орто- и пара-положения дезактивируются
больше, чем мета-положения
2) Стабильность образующихся σ-комплексов (динамический
фактор): стабилизирующее или дестабилизирующее влияние заместителя
19.
Активируют сильно (+ + +), умеренно (+ +), слабо (+); дезактивируют сильно (___
), умеренно ( _ _ ), слабо (_)
20.
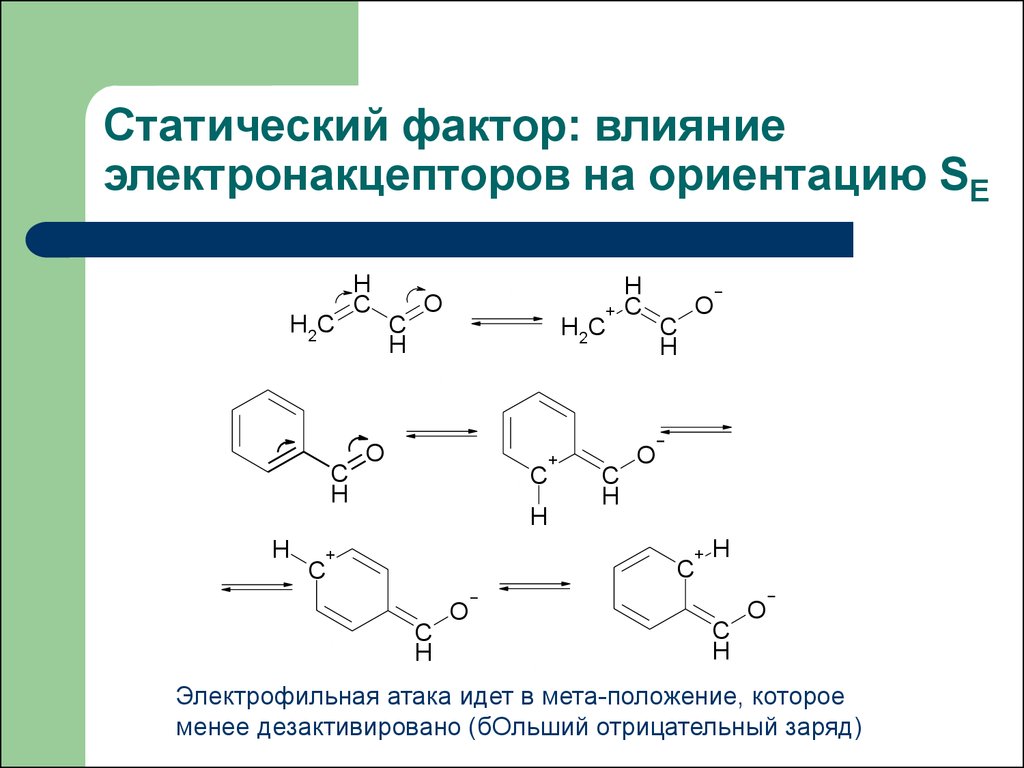
Статический фактор: влияниеэлектронакцепторов на ориентацию SE
H2C
C
H
H
H
C
C
H
O
+
H2C
O
+
C
H
C
H
H
C
C
H
O
O
+
+
C
C
C
H
O
H
C
H
O
Электрофильная атака идет в мета-положение, которое
менее дезактивировано (бОльший отрицательный заряд)
21.
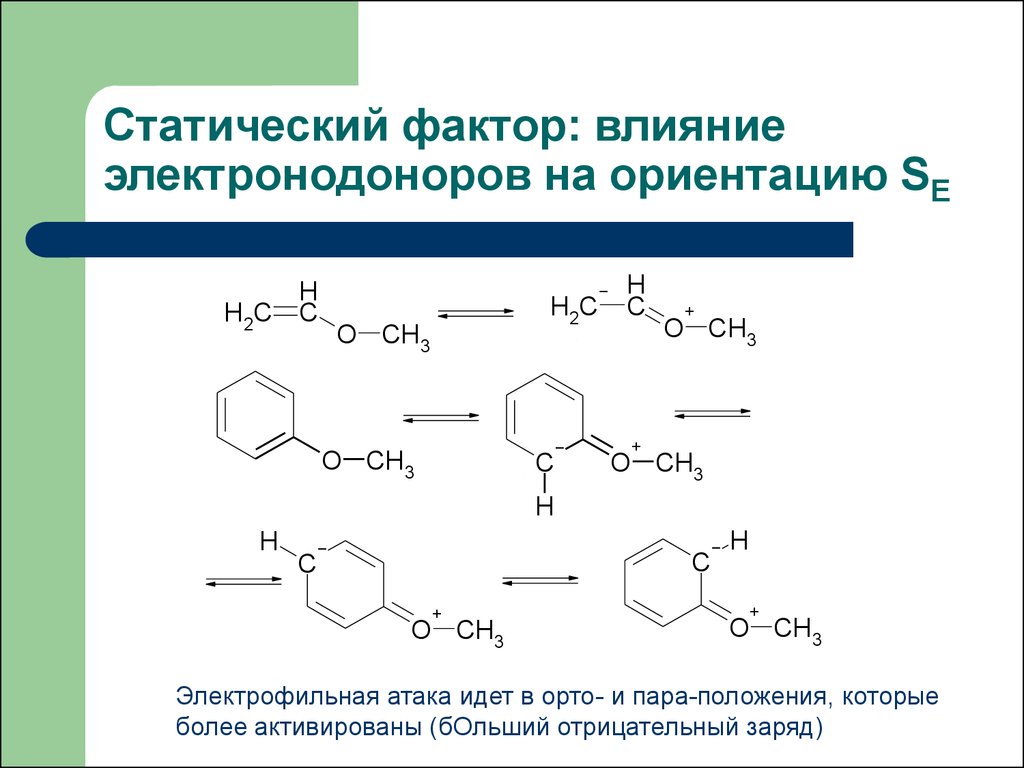
Статический фактор: влияниеэлектронодоноров на ориентацию SE
H2C
H
C
H2C
O CH3
O CH3
C
H
C
+
O CH3
+
O CH3
H
H
C
C
+
O CH3
H
+
O CH3
Электрофильная атака идет в орто- и пара-положения, которые
более активированы (бОльший отрицательный заряд)
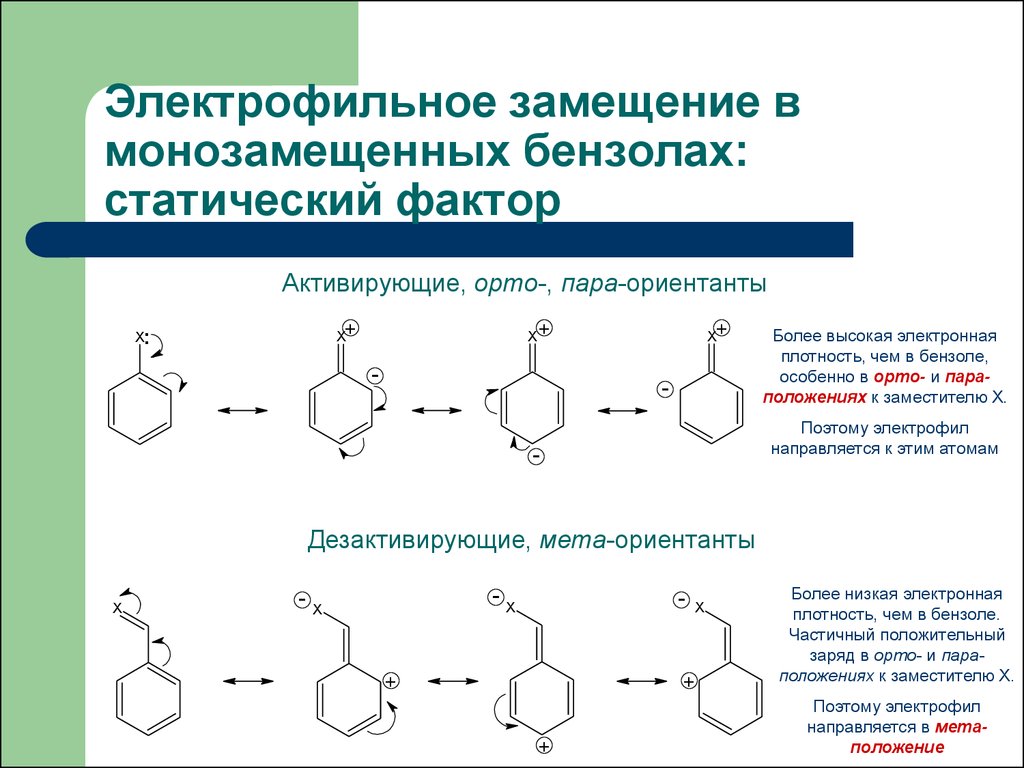
22. Электрофильное замещение в монозамещенных бензолах: статический фактор
Активирующие, орто-, пара-ориентантыX+
X:
X+
-
X+
-
Более высокая электронная
плотность, чем в бензоле,
особенно в орто- и параположениях к заместителю Х.
Поэтому электрофил
направляется к этим атомам
-
Дезактивирующие, мета-ориентанты
X
-X
-X
-
+
X
+
+
Более низкая электронная
плотность, чем в бензоле.
Частичный положительный
заряд в орто- и параположениях к заместителю Х.
Поэтому электрофил
направляется в метаположение
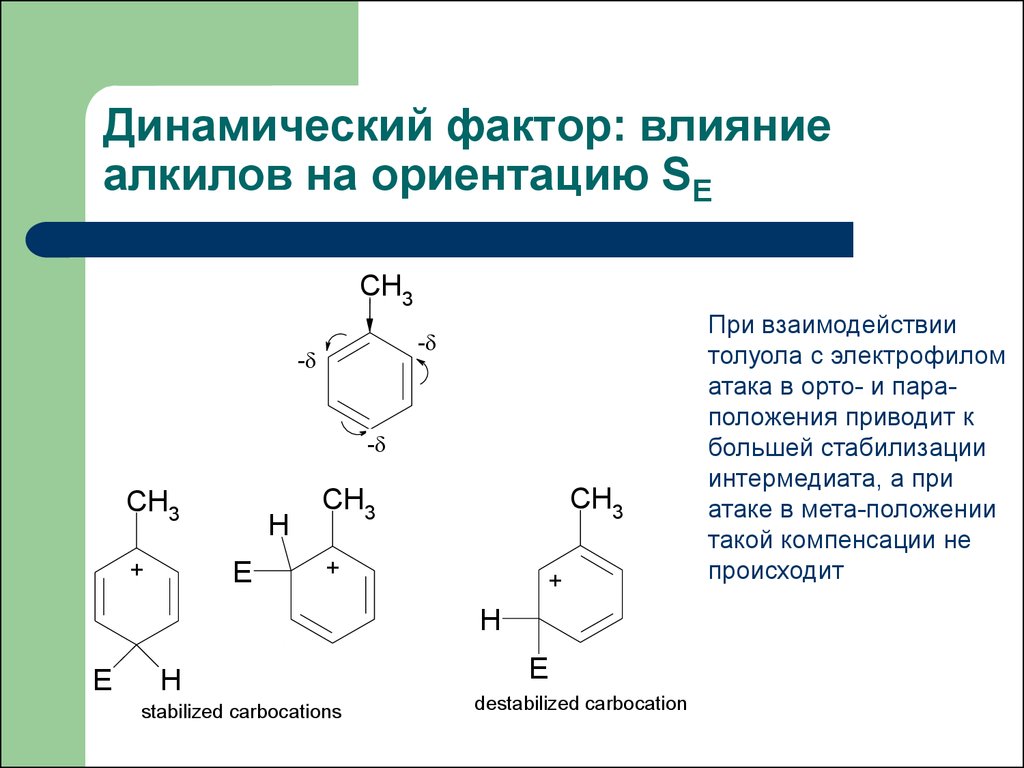
23. Динамический фактор: влияние алкилов на ориентацию SE
CH3-
-
-
CH3
+
H
E
CH3
CH3
+
+
H
E
H
stabilized carbocations
E
destabilized carbocation
При взаимодействии
толуола с электрофилом
атака в орто- и параположения приводит к
большей стабилизации
интермедиата, а при
атаке в мета-положении
такой компенсации не
происходит
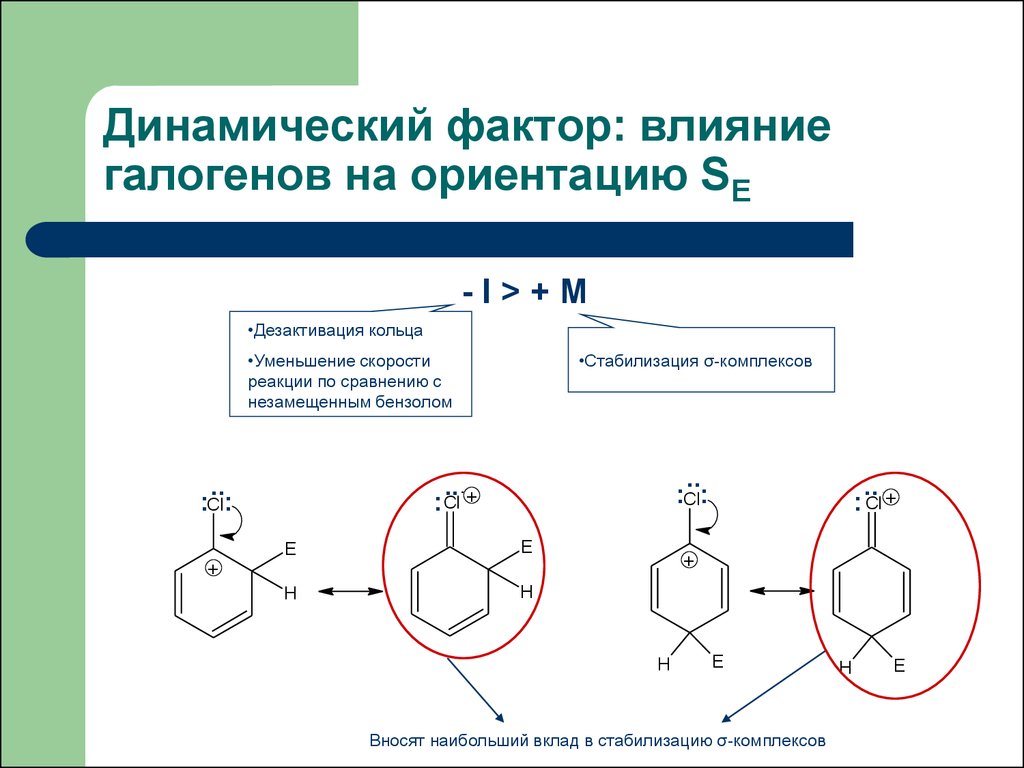
24. Динамический фактор: влияние галогенов на ориентацию SE
-I>+M•Дезактивация кольца
•Уменьшение скорости
реакции по сравнению с
незамещенным бензолом
..
:Cl:
•Стабилизация σ-комплексов
..
:Cl:
.. ++
: Cl
E
E
H
H
.. +
: Cl +
+
+
H
E
Вносят наибольший вклад в стабилизацию σ-комплексов
H
E
25.
Динамический фактор: влияниегалогенов на ориентацию SE
При замещении в мета-положении карбокатионы
дестабилизированы за счет электростатического
взаимодействия карбокатионного центра с положительным
концом диполя связи углерод-галоген.
26.
Динамический фактор: влияниенитрогруппы на ориентацию SE
Во всех граничных формулах происходит
электростатическое отталкивание между
карбокатионным центром и положительным
концом диполя связи С-N. Наиболее сильная
дезактивация должна наблюдаться для ортои пара-замещения, поскольку здесь в одной
из граничных формул положительно
заряжены соседние атомы углерода и азота.
Мета-замещение в нитробензоле
дезактивировано в меньшей степени по
сравнению с орто- и пара-замещением.
Следовательно, при общей дезактивации
преобладает мета-ориентация.
Подобное влияние оказывают и другие (-М)заместители (СНО, СООН и т.п.).
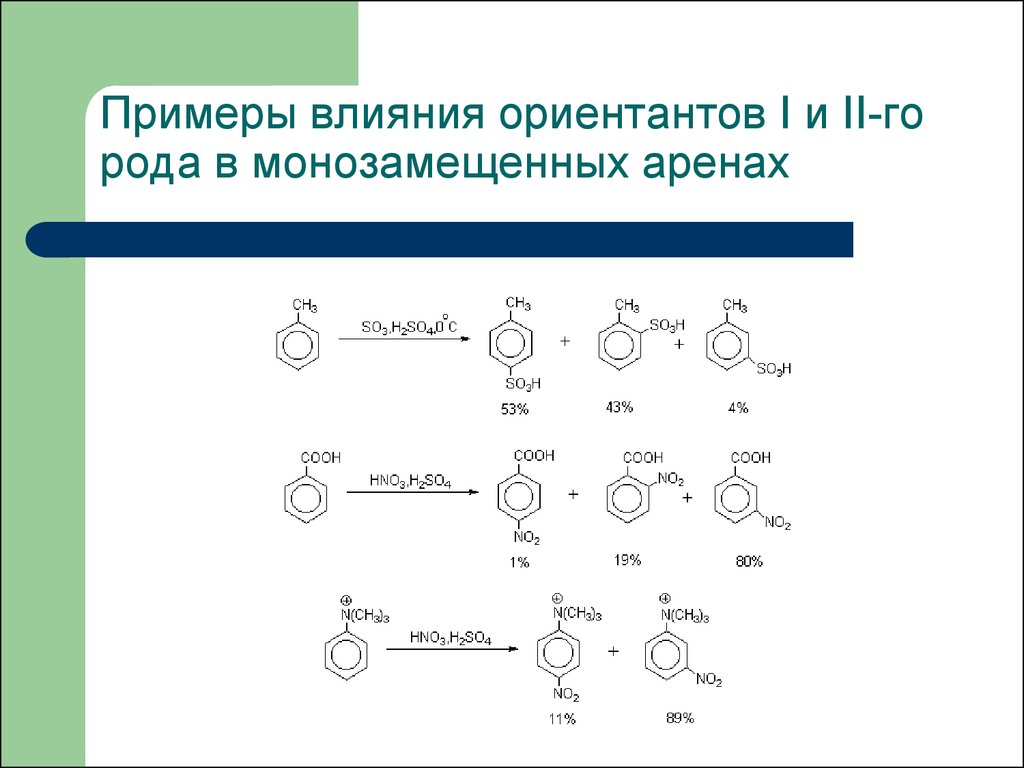
27. Примеры влияния ориентантов I и II-го рода в монозамещенных аренах
28. Примеры влияния ориентантов I и II-го рода в монозамещенных аренах
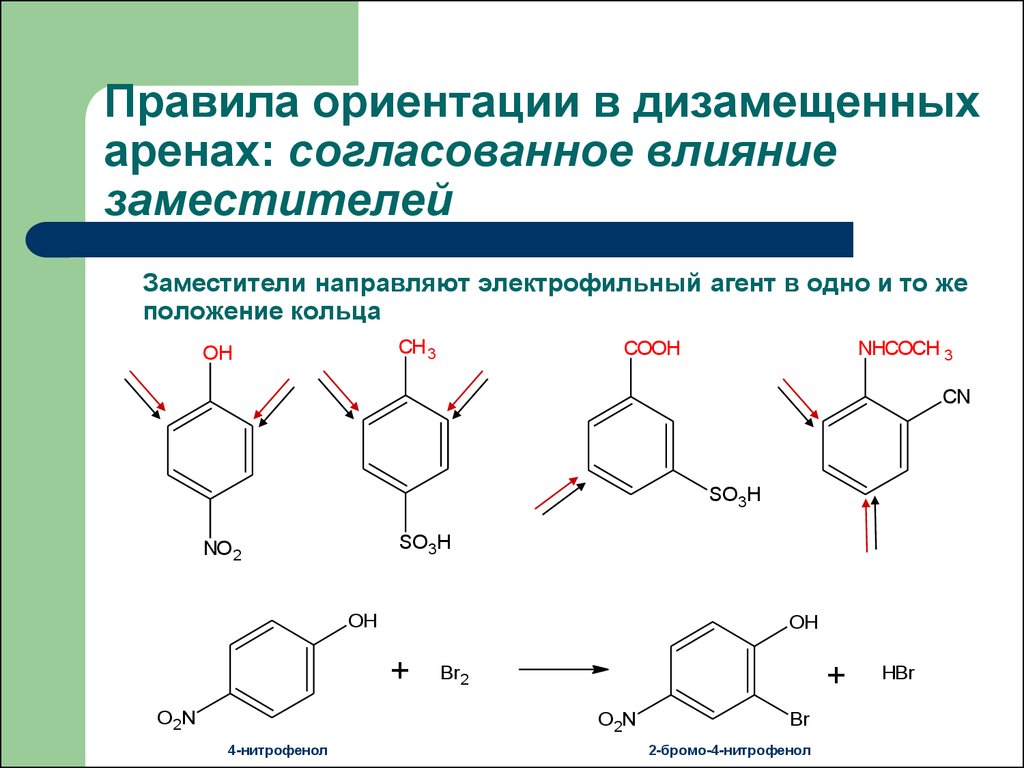
29. Правила ориентации в дизамещенных аренах: согласованное влияние заместителей
Заместители направляют электрофильный агент в одно и то жеположение кольца
CH 3
OH
COOH
NHCOCH 3
CN
SO3H
SO3H
NO 2
OH
OH
+
O 2N
+
Br2
O 2N
4-нитрофенол
Br
2-бромо-4-нитрофенол
HBr
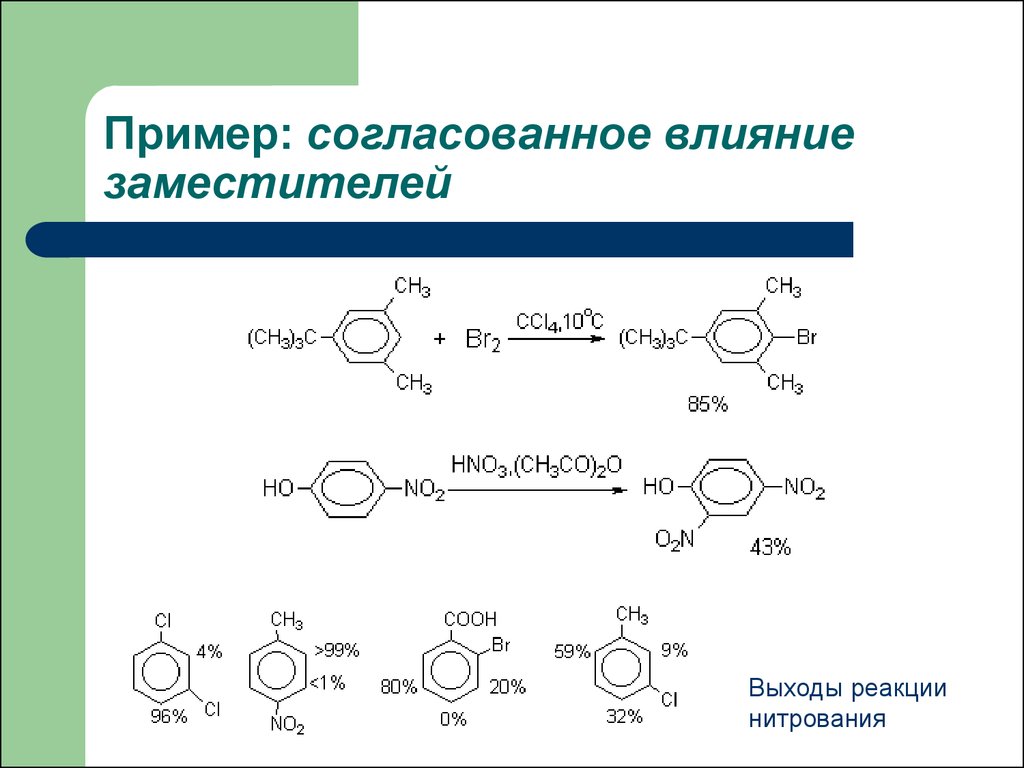
30. Пример: согласованное влияние заместителей
Выходы реакциинитрования
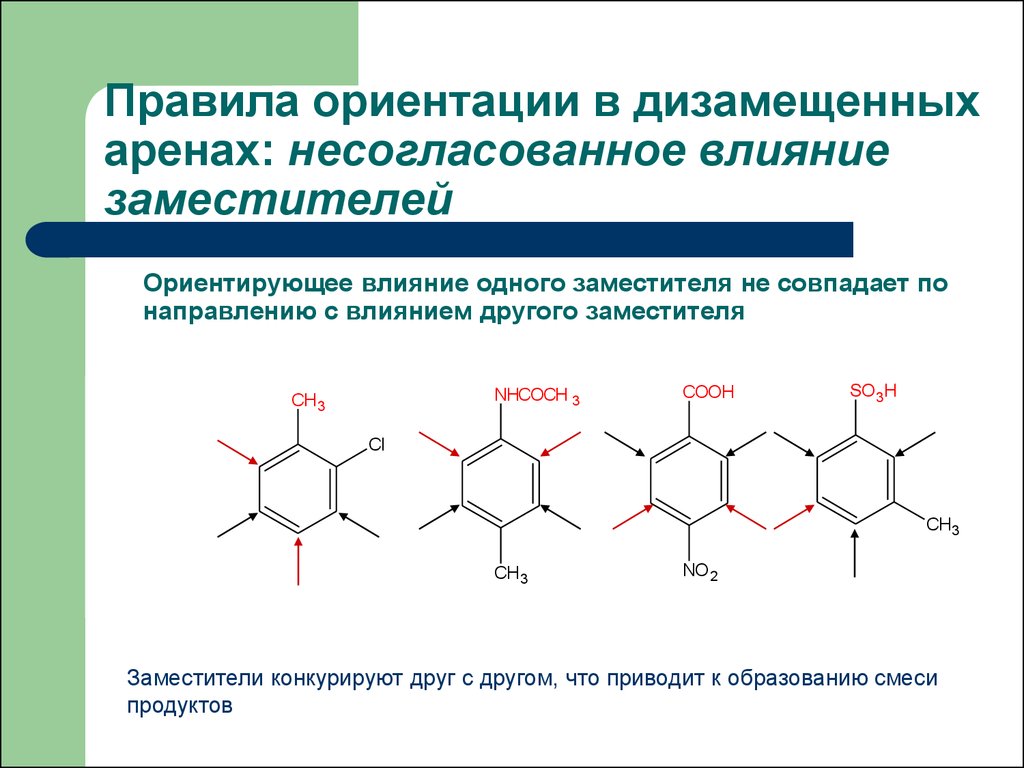
31. Правила ориентации в дизамещенных аренах: несогласованное влияние заместителей
Ориентирующее влияние одного заместителя не совпадает понаправлению с влиянием другого заместителя
NHCOCH 3
CH 3
OH
COOH
SO3H
Cl
CH3
CH 3
CH 3
NO 2
Заместители конкурируют друг с другом, что приводит к образованию смеси
продуктов
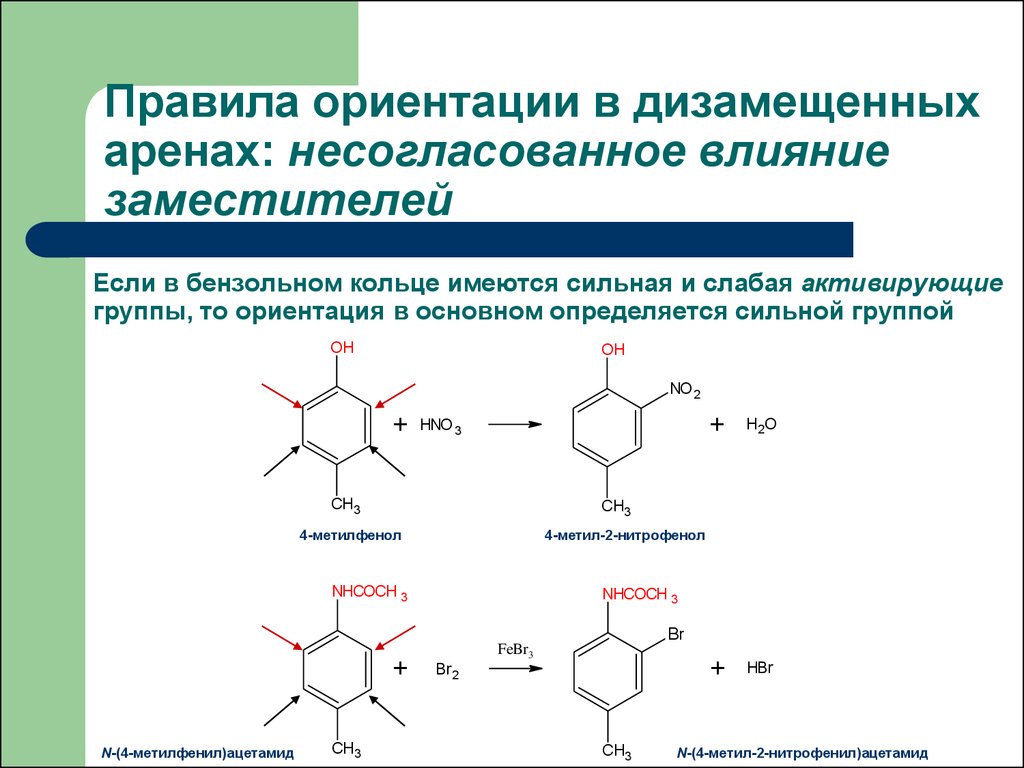
32. Правила ориентации в дизамещенных аренах: несогласованное влияние заместителей
Если в бензольном кольце имеются сильная и слабая активирующиегруппы, то ориентация в основном определяется сильной группой
OH
OH
NO 2
+
HNO 3
CH3
+
HBr
4-метил-2-нитрофенол
NHCOCH 3
+
CH3
H2O
CH3
4-метилфенол
N-(4-метилфенил)ацетамид
+
NHCOCH 3
NO 2
Br
FeBr3
Br2
CH3
N-(4-метил-2-нитрофенил)ацетамид
33. Правила ориентации в дизамещенных аренах: несогласованное влияние заместителей
Если в бензольном кольце имеются активирующая идезактивирующая группы, то ориентация определяется главным
образом активирующей группой
OH
OH
OH
Br
+
FeBr3
Br2
+
- HBr
CHO
CHO
Br
CHO
34. Реакции электрофильного замещения (SE) аренов
1) Галогенирование2) Нитрование
3) Сульфирование
4) Алкилирование
Ar
H
+
кислота Льюиса
X2
Ar
X
-НХ
H2SO4
Ar
Ar
Ar
H
+
HONO 2
Ar
-Н2O
NO 2
H2SO4
H
+
SO3
H
+
R
Ar
X
SO3H
кислота Льюиса
Ar
R
-НХ
O
5) Ацилирование
Ar
H
+
R
O
кислота Льюиса
Cl
-HCl
C
Ar
C
R
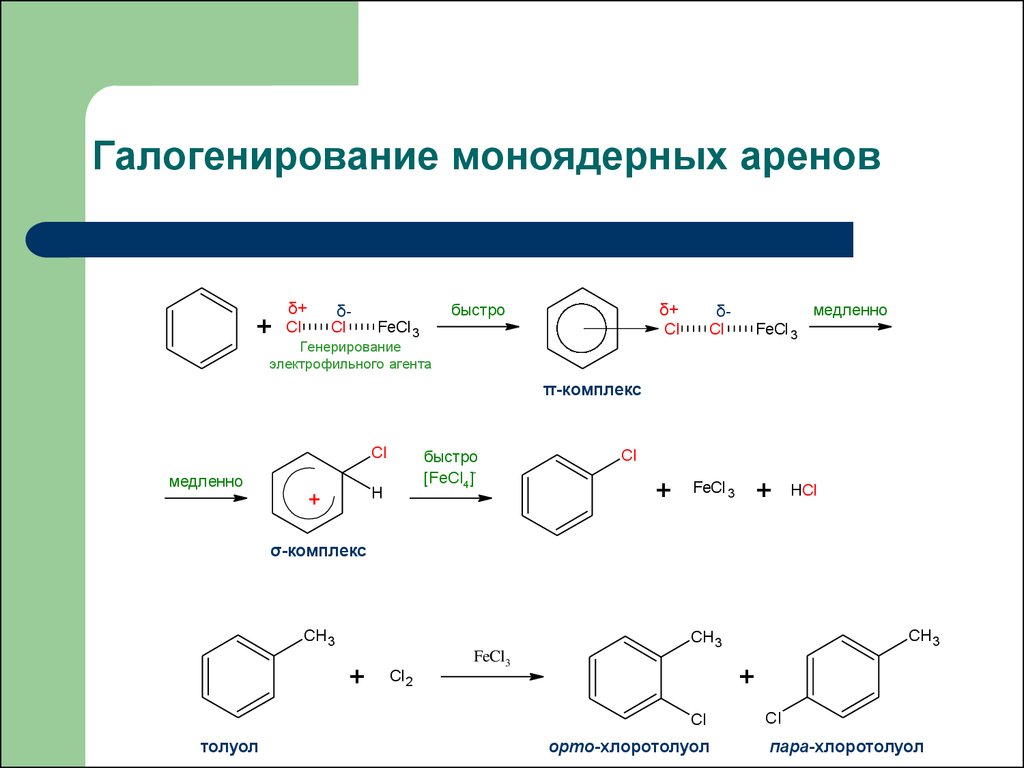
35. Галогенирование моноядерных аренов
+δ+
Cl
δ+
быстро
δCl
FeCl 3
медленно
δ-
Cl
Cl
Генерирование
электрофильного агента
FeCl 3
π-комплекс
Cl
медленно
быстро
[FeCl4]-
H
+
Cl
+
FeCl 3
+
HCl
σ-комплекс
CH3
+
FeCl3
+
Cl 2
Cl
толуол
CH3
CH3
орто-хлоротолуол
Cl
пара-хлоротолуол
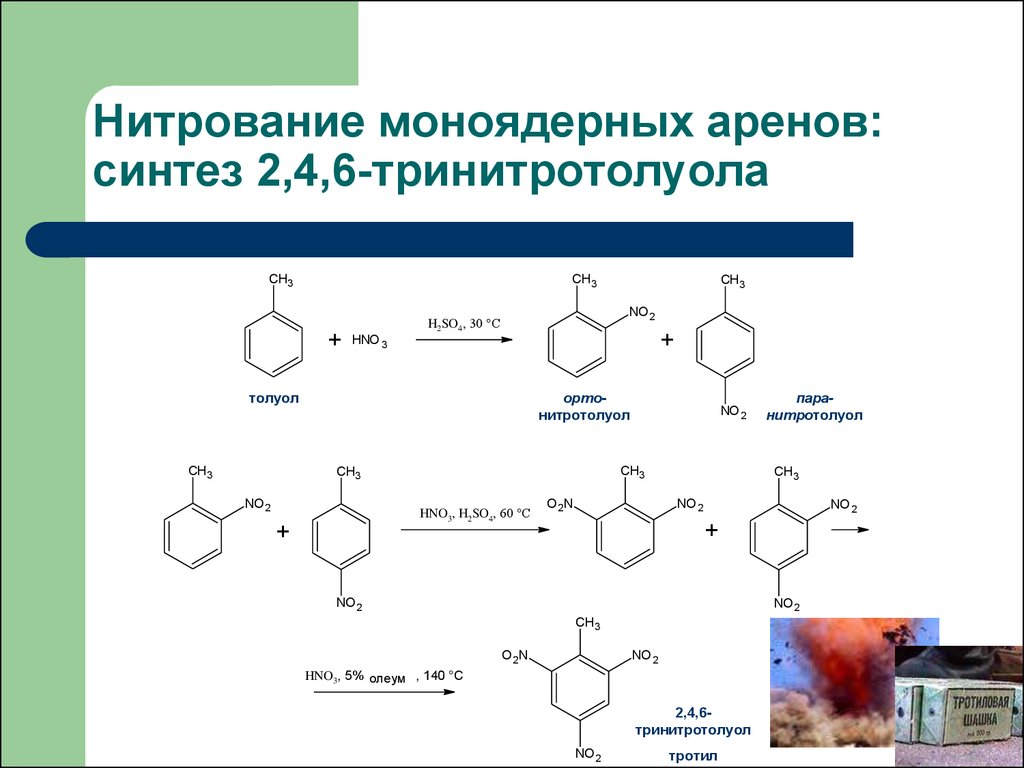
36. Нитрование моноядерных аренов: синтез 2,4,6-тринитротолуола
CH3CH3
+
NO 2
H2SO4, 30 °C
+
HNO 3
толуол
CH3
CH3
ортонитротолуол
CH3
CH3
NO 2
HNO3, H2SO4, 60 °C
+
NO 2
O 2N
паранитротолуол
CH3
NO 2
NO 2
+
NO 2
NO 2
CH3
O 2N
NO 2
HNO3, 5% олеум , 140 °C
2,4,6тринитротолуол
NO 2
тротил
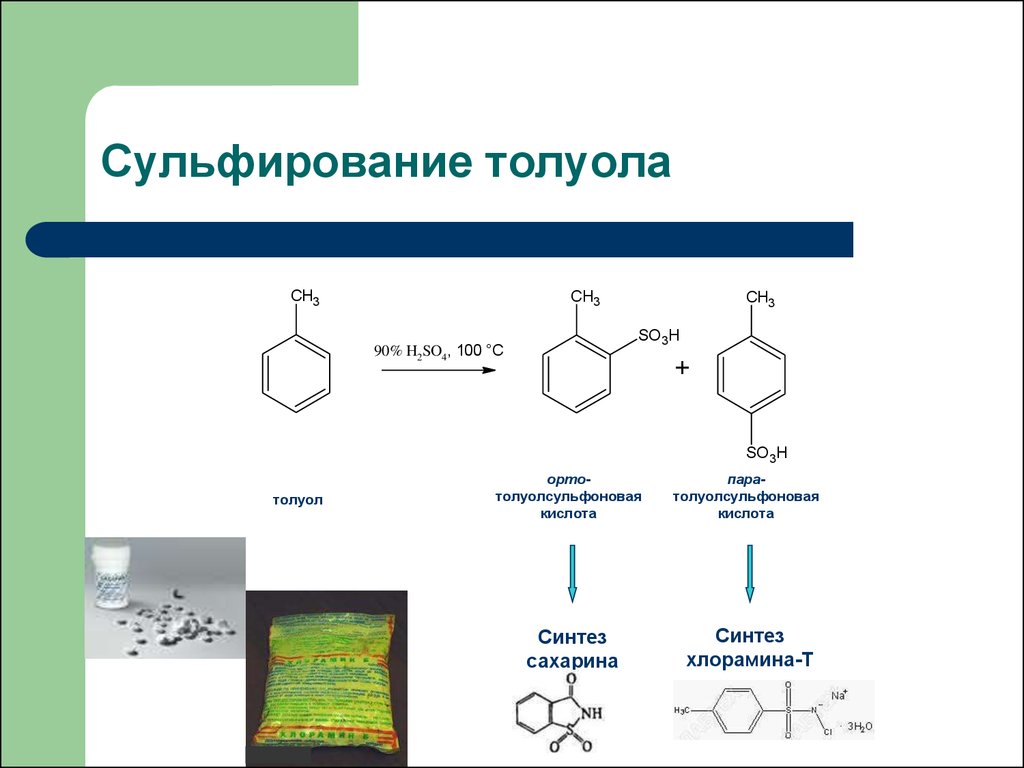
37. Сульфирование толуола
CH3CH3
CH3
SO3H
90% H2SO4, 100 °C
+
SO3H
толуол
ортотолуолсульфоновая
кислота
паратолуолсульфоновая
кислота
Синтез
сахарина
Синтез
хлорамина-Т
38. Реакция Фриделя-Крафтса
Введение в бензольное кольцо алкильных или ацильных группАлкилирующие реагенты: галогеноалканы, алкены, спирты
Ацилирующие реагенты: хлорангидриды и ангидриды кислот
Осуществляется в присутствии кислот Льюиса
Синтез:
Поверхностно-активных веществ
Душистых веществ
Этилбензола
Кумола, тимола
CH3
H3C
CH3
CH2
этилбензол
стирол
O
Ароматических кетонов (промежуточные продукты
в производстве фармацевтических препаратов
H3C
и красителей)
N
кумол
CH3
CH3
N
кетон Михлера
CH3
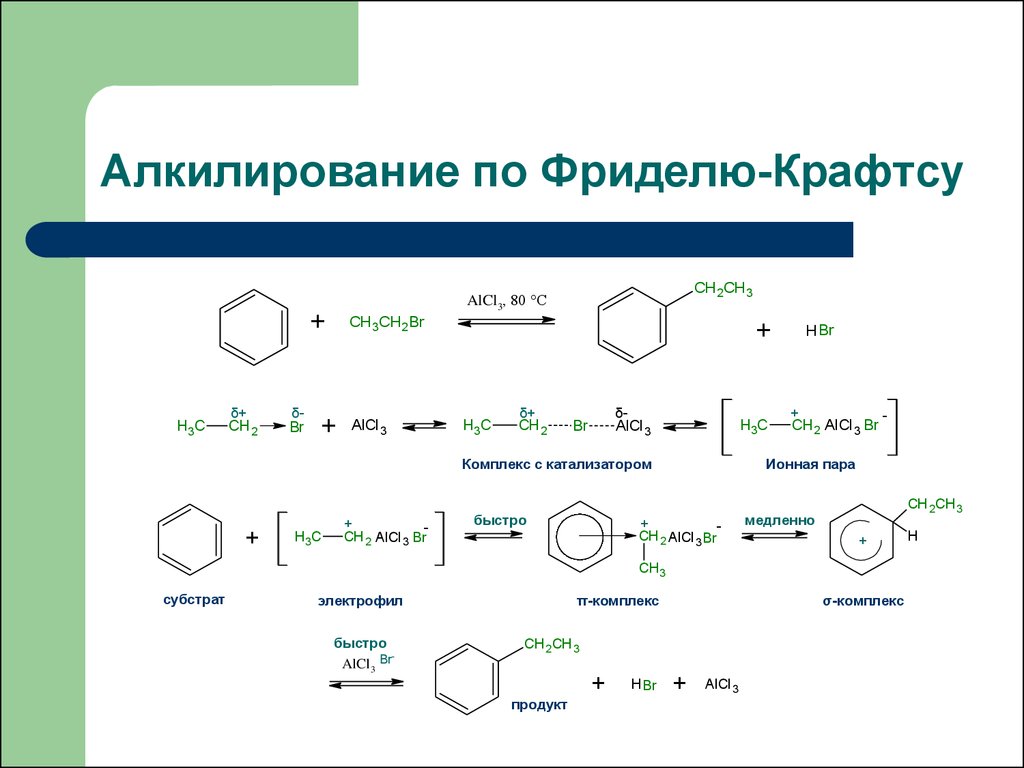
39. Алкилирование по Фриделю-Крафтсу
+H3C
δ+
CH 2
δBr
CH 2CH 3
AlCl3, 80 °C
CH 3CH 2Br
+
AlCl 3
+
H3C
δ+
CH 2
δ-
Br
H3C
AlCl 3
Комплекс с катализатором
+
H3C
+
CH 2 AlCl 3 Br
быстро
H Br
+
CH 2 AlCl 3 Br
-
Ионная пара
+
CH 2 AlCl 3 Br
CH 2CH 3
медленно
+
CH3
субстрат
электрофил
быстро
AlCl3 Br
π-комплекс
σ-комплекс
CH 2CH 3
продукт
+
H Br
+
AlCl 3
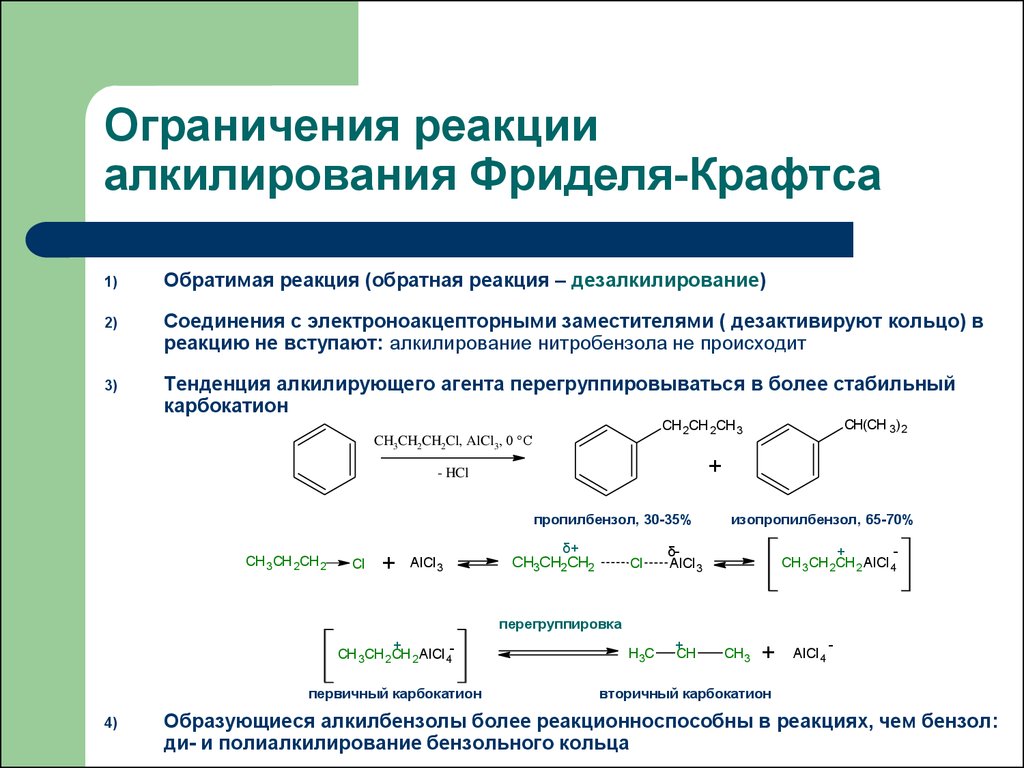
H
40. Ограничения реакции алкилирования Фриделя-Крафтса
1)Обратимая реакция (обратная реакция – дезалкилирование)
2)
Соединения с электроноакцепторными заместителями ( дезактивируют кольцо) в
реакцию не вступают: алкилирование нитробензола не происходит
3)
Тенденция алкилирующего агента перегруппировываться в более стабильный
карбокатион
+
- HCl
пропилбензол, 30-35%
CH 3CH 2CH 2
Cl
+
AlCl 3
CH(CH 3)2
CH 2CH 2CH 3
CH3CH2CH2Cl, AlCl3, 0 °C
δ+
CH
H
3CH
2CH
2CH
2CH
3C2
Cl
изопропилбензол, 65-70%
δAlCl 3
+
CH 3CH 2CH 2 AlCl 4
перегруппировка
+
CH 3CH 2CH 2 AlCl 4-
первичный карбокатион
4)
H3C
+
CH
CH3
+
AlCl 4
-
вторичный карбокатион
Образующиеся алкилбензолы более реакционноспособны в реакциях, чем бензол:
ди- и полиалкилирование бензольного кольца
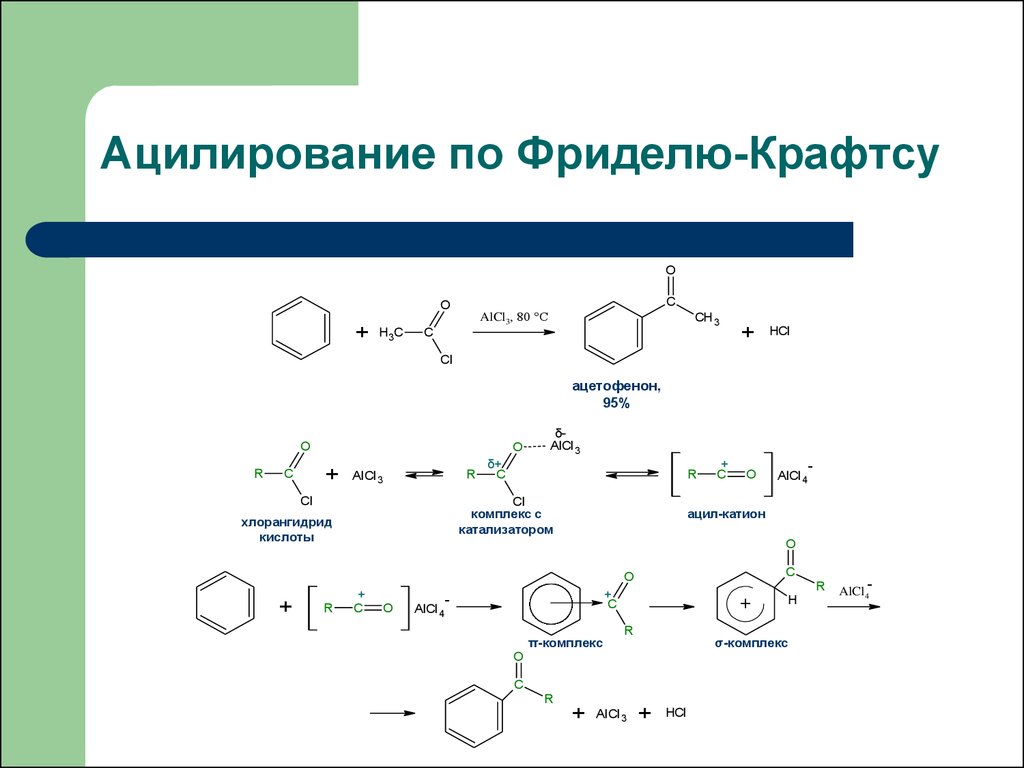
41. Ацилирование по Фриделю-Крафтсу
OC
O
+
H3C
AlCl3, 80 °C
CH 3
C
+
HCl
Cl
ацетофенон,
95%
O
R
O
+
C
R
AlCl 3
Cl
δAlCl 3
δ+
C
R
Cl
комплекс с
катализатором
хлорангидрид
кислоты
+
C
O
R
-
ацил-катион
O
C
O
+
AlCl 4
+
C
O
AlCl 4
R
+
C
π-комплекс
+
R
σ-комплекс
O
C
R
+
AlCl 3
H
+
HCl
AlCl4-
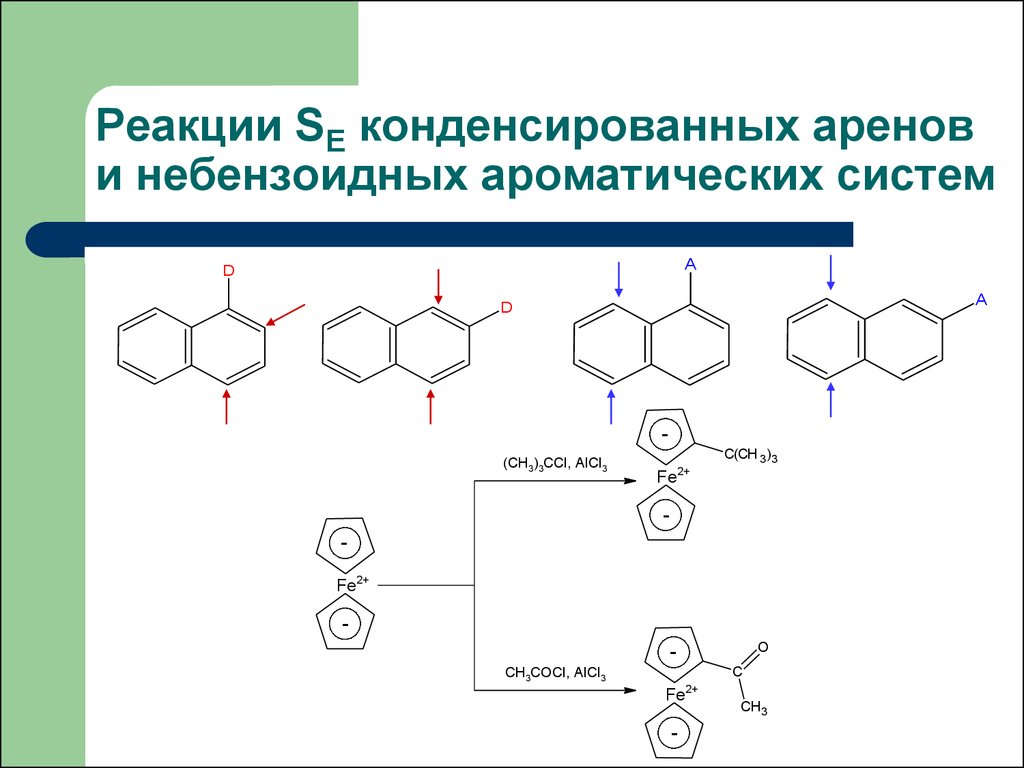
42. Реакции SE конденсированных аренов и небензоидных ароматических систем
1. Электрофильное замещение в соединениях данного типа такжепротекает с частичным нарушением ароматической системы на
стадии образования -комплекса. Потери энергии стабилизации в
этом случае существенно ниже, чем в случае бензола или
соединений с изолированными бензольными ядрами.
2. Нафталин, антрацен и фенантрен легче вступают в реакции
электрофильного замещения, чем бензол и соединения с
изолированными бензольными ядрами.
43. Реакции SE нафталинов
Электрофильное замещение в нафталине приводит к одинаковой потереэнергии стабилизации (на стадии образования -комплекса) при атаке
электрофила как в -, так и в -положение нафталиновой системы. Однако,
для аренониевого иона, образующегося в первом случае, можно изобразить
две энергетически выгодные резонансные структуры, тогда как во втором
случае - только одну.
44. Реакции SE конденсированных аренов и небензоидных ароматических систем
AD
A
D
(CH3)3CCl, AlCl3
C(CH 3)3
Fe
2+
Fe2+
O
C
CH3COCl, AlCl3
Fe
-
2+
CH3
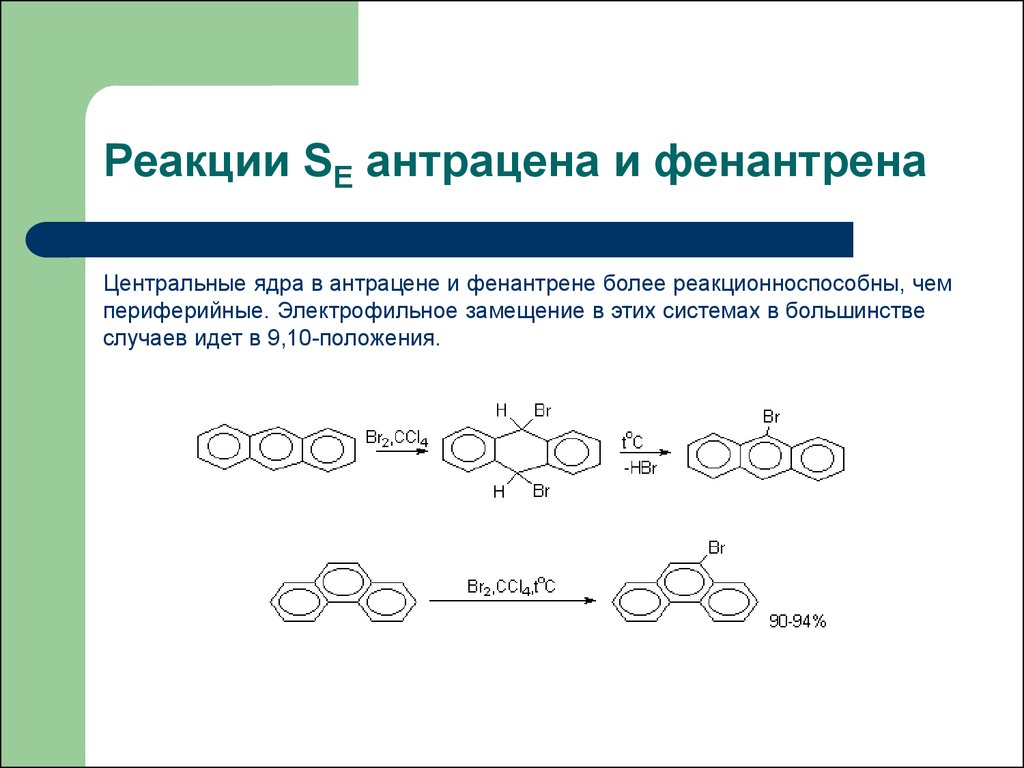
45. Реакции SE антрацена и фенантрена
Центральные ядра в антрацене и фенантрене более реакционноспособны, чемпериферийные. Электрофильное замещение в этих системах в большинстве
случаев идет в 9,10-положения.


















 chemistry
chemistry








