Similar presentations:
Гидроксикислоты. Свойства гидрокислот. Ароматические гидрокислоты. Аминокислоты
1.
1МОДУЛЬ 6
Гидроксикислоты
HO
HO
HO2C
CO2H
CO2H
гликолевая
(свекла, виноград)
HO
CO2H
CO2H
яблочная
(клюква)
OH
молочная
(брожение)
HO
HO2C
CO2H
HO
винная
(виноградная)
CO2H
CO2H
лимонная
(махорка)
2.
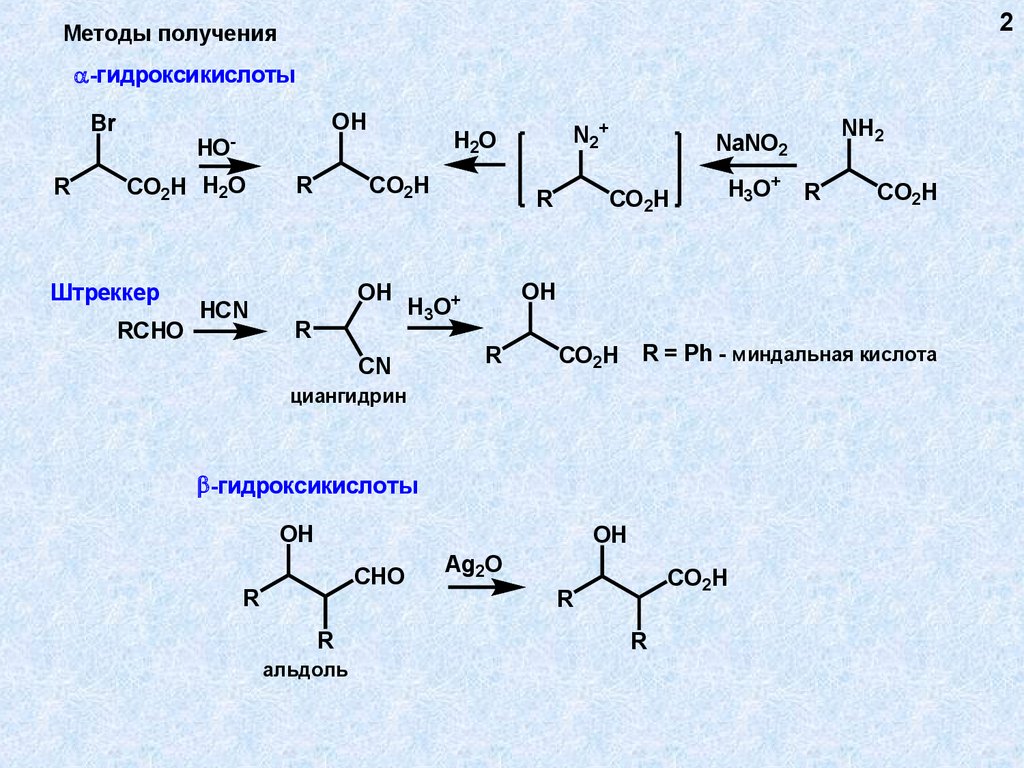
2Методы получения
-гидроксикислоты
Br
R
OH
HOCO2H H2O
Штреккер
RCHO
HCN
R
N2+
H2O
CO2H
OH
R
R
CO2H
H3O+
R
CO2H
-гидроксикислоты
OH
OH
R
R
альдоль
CO2H
R = Ph - миндальная кислота
циангидрин
CHO
R
OH
H3O+
CN
NH2
NaNO2
Ag2O
CO2H
R
R
3.
3HO
CO2H
LiAlH4
HO
H3O+
CO2H
RCO3H
O
CO2H
CO2H
H3O+
OH
HO
CO2H
-гидроксикислоты
Cl
1. Mg/эфир
O
CO2H
H3O+
O
2. CO2
t
-бутиролактон
гидроксикислоты
O
RCO3H
(CH2)n
Реакция Байера-Виллигера
O
O
(CH2)n
лактон
H3O
t
+
HO
(CH2)n+3
HO2C
OH
CO2H
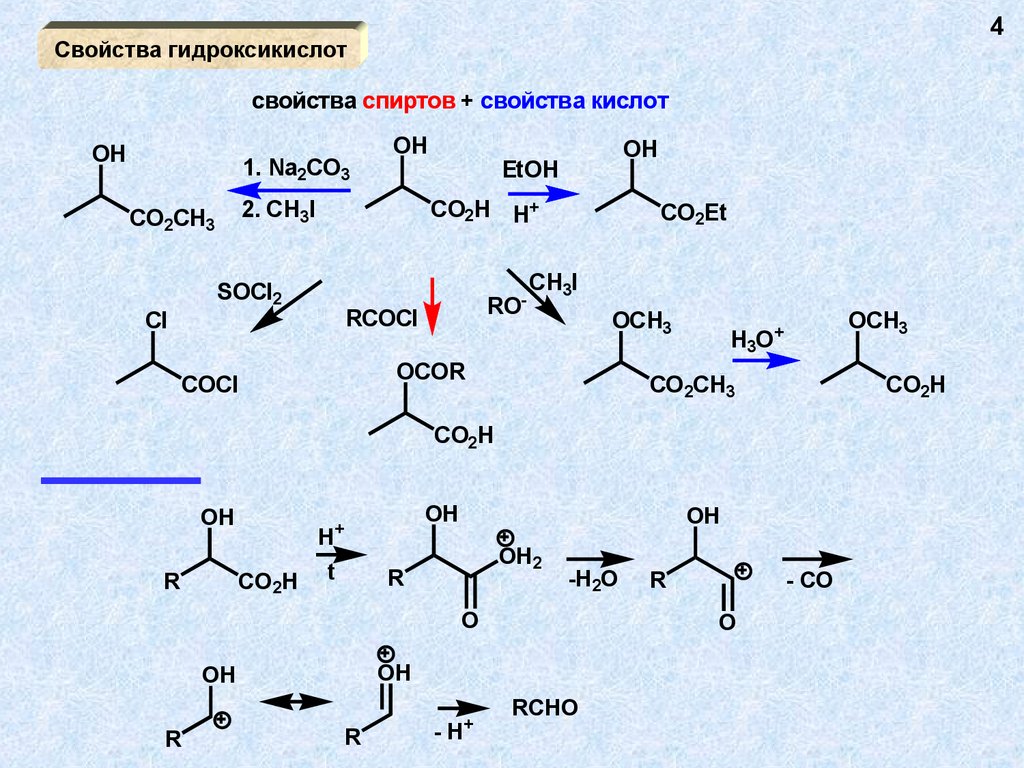
4.
4Свойства гидроксикислот
свойства спиртов + свойства кислот
OH
1. Na2CO3
2. CH3I
CO2CH3
Cl
OH
OH
EtOH
CO2H H+
SOCl2
RO-
RCOCl
CO2Et
CH3I
OCH3
OCOR
COCl
OCH3
H3O+
CO2CH3
CO2H
CO2H
OH
R
H
CO2H
OH
+
t
OH
OH2
R
-H2O
O
R
R
+
-H
- CO
O
OH
OH
R
RCHO
5.
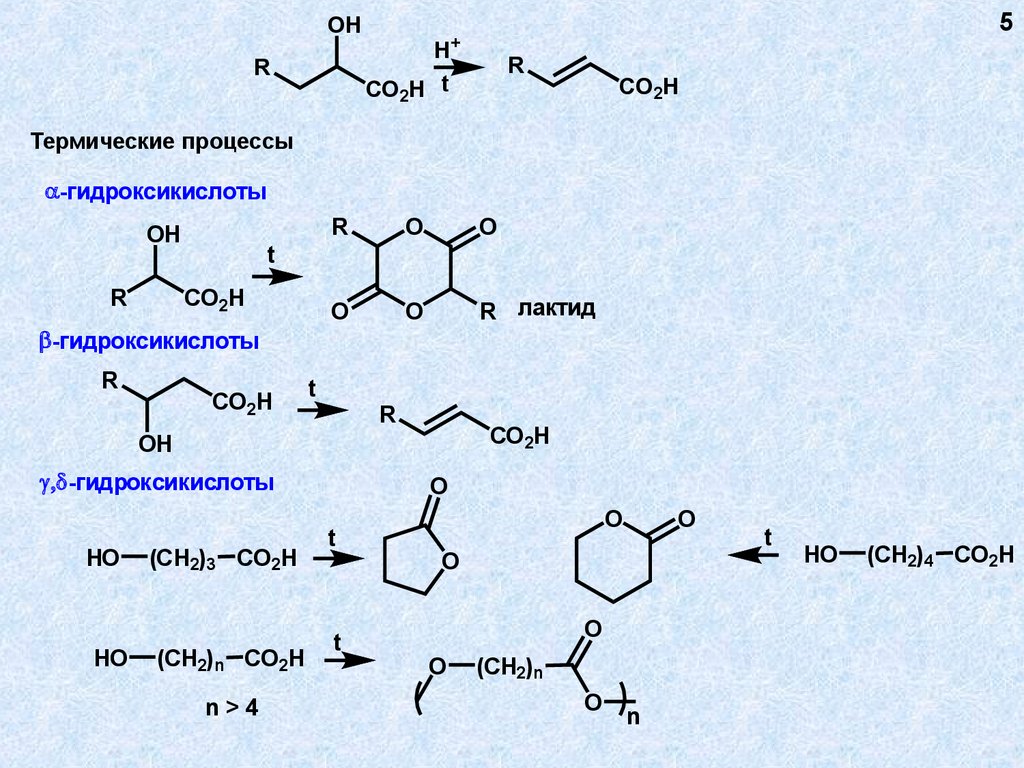
OH5
+
H
CO2H t
R
R
CO2H
Термические процессы
-гидроксикислоты
OH
R
R
O
O
O
O
R лактид
t
CO2H
-гидроксикислоты
R
CO2H
t
R
CO2H
OH
-гидроксикислоты
HO
HO
(CH2)3 CO2H
(CH2)n CO2H
n>4
O
t
t
O
O
O
O
O
(CH2)n
O
n
t
HO
(CH2)4 CO2H
6.
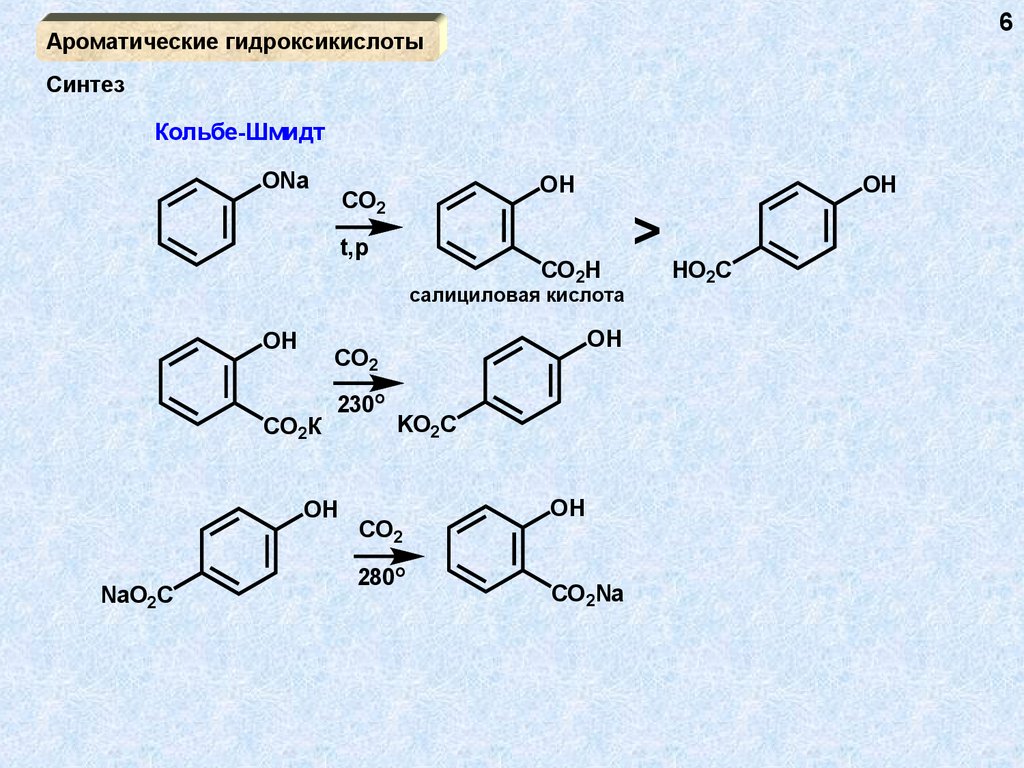
6Ароматические гидроксикислоты
Синтез
Кольбе-Шмидт
ONa
OH
CO2
t,p
OH
CO2H
салициловая кислота
OH
CO2
CO2К
230o
OH
NaO2 C
OH
KO2 C
CO2
280o
OH
CO2Na
>
HO2C
7.
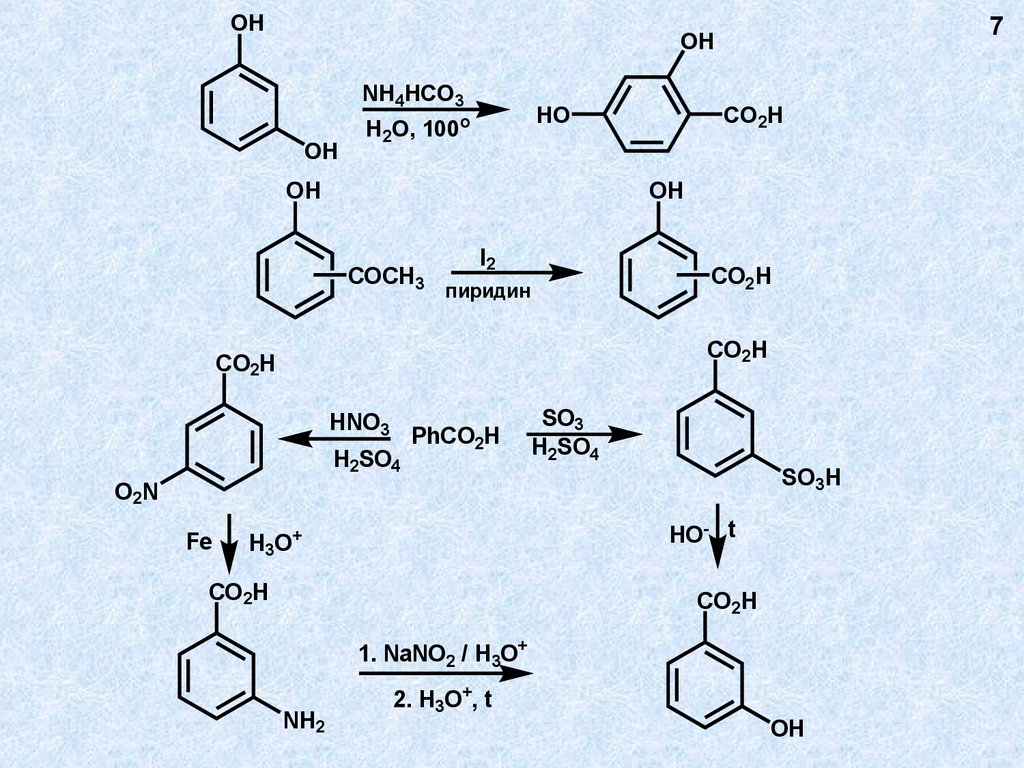
OH7
OH
NH4HCO3
OH
HO
H2O, 100o
OH
CO2H
OH
COCH3
I2
CO2 H
пиридин
CO2H
CO2H
HNO3
H2SO4
PhCO2H
SO3
H2SO4
SO3H
O2N
Fe
HO- t
H3O+
CO2H
CO2H
1. NaNO2 / H3O+
NH2
2. H3O+, t
OH
8.
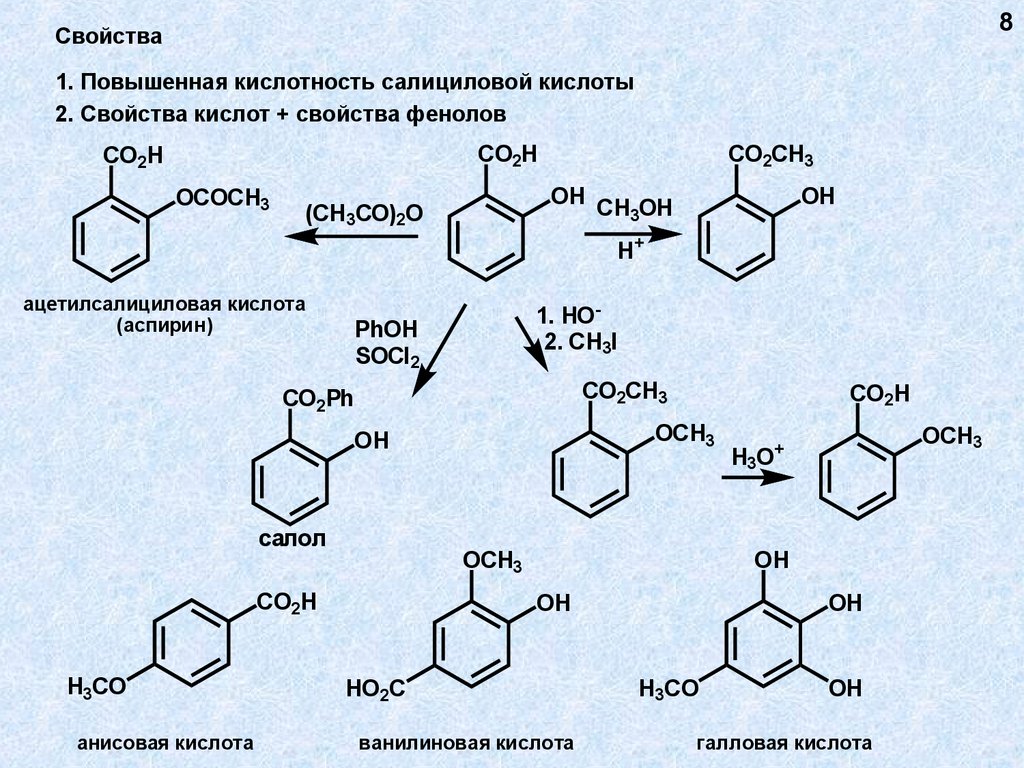
8Свойства
1. Повышенная кислотность салициловой кислоты
2. Свойства кислот + свойства фенолов
CO2H
CO2H
OCOCH3
CO2CH3
OH
(CH3CO)2O
OH
CH3OH
H+
ацетилсалициловая кислота
(аспирин)
1. HO2. CH3I
PhOH
SOCl2
CO2CH3
CO2Ph
OCH3
OH
салол
OCH3
CO2H
H3CO
анисовая кислота
CO2H
OCH3
+
H3O
OH
OH
HO2C
ванилиновая кислота
OH
H3CO
OH
галловая кислота
9.
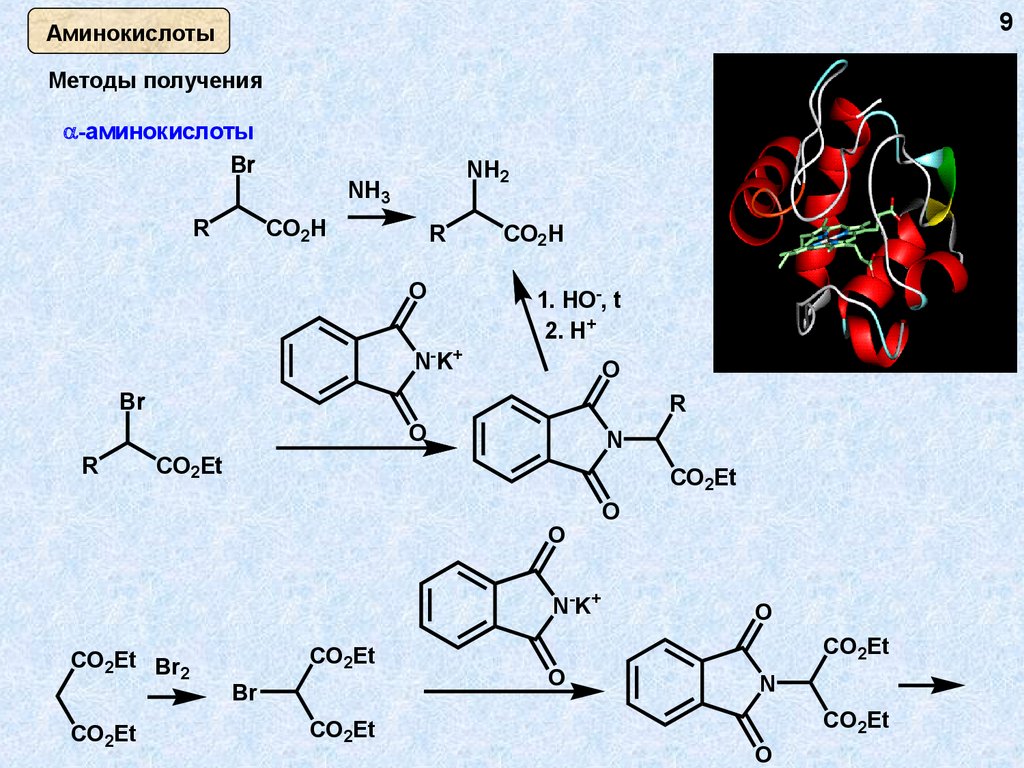
9Аминокислоты
Методы получения
-аминокислоты
Br
R
NH2
NH3
CO2H
R
O
CO2 H
1. HO-, t
2. H+
N-K+
O
Br
R
O
R
N
CO2Et
CO2Et
O
N-K+
CO2Et Br2
CO2Et
CO2Et
Br
CO2Et
O
O
CO2Et
O
N
CO2Et
O
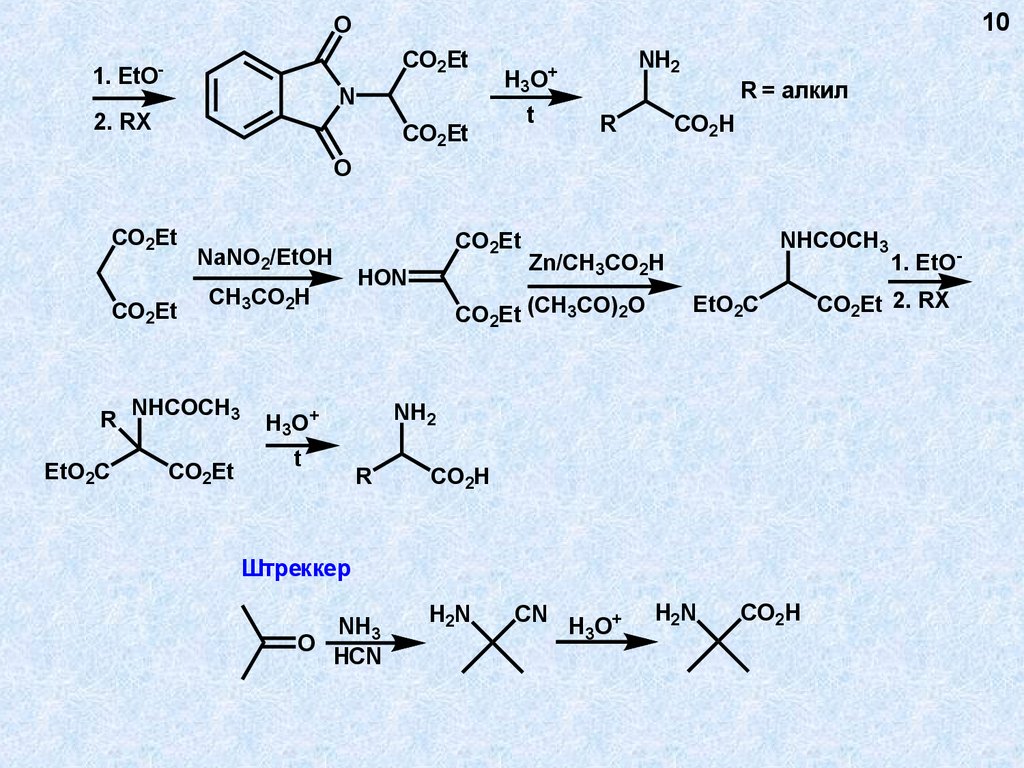
10.
10O
CO2Et
1. EtO-
N
2. RX
H3
t
CO2Et
NH2
O+
R = алкил
R
CO2H
O
CO2Et
CO2Et
NaNO2/EtOH
CH3CO2H
R
NHCOCH3
EtO2C
CO2Et
CO2Et
HON
Zn/CH3CO2H
CO2Et (CH3CO)2O
EtO2C
NH2
H3O+
t
NHCOCH3
R
CO2H
Штреккер
NH3
O
HCN
H2N
CN
H3O+
H2N
CO2H
1. EtO-
CO2Et 2. RX
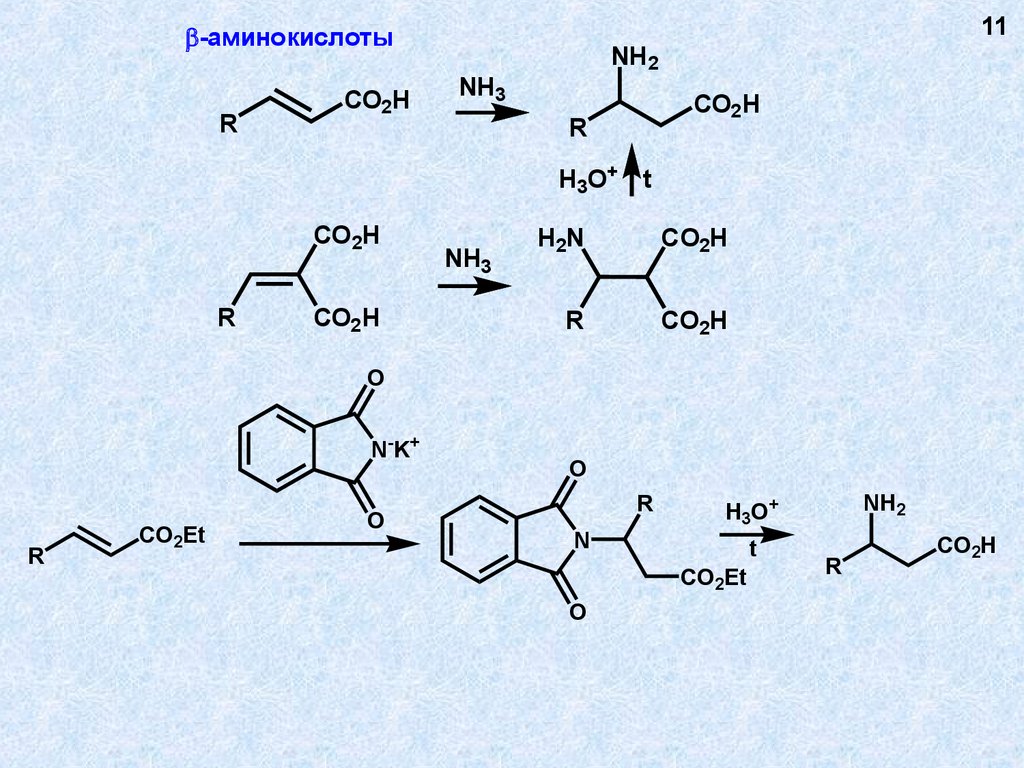
11.
11-аминокислоты
R
CO2 H
NH2
NH3
CO2 H
R
H3O+ t
CO2H
R
CO2 H
NH3
H2N
CO2H
R
CO2H
O
N-K+
R
CO2Et
O
O
R
N
t
CO2Et
O
NH2
H3O+
R
CO2H
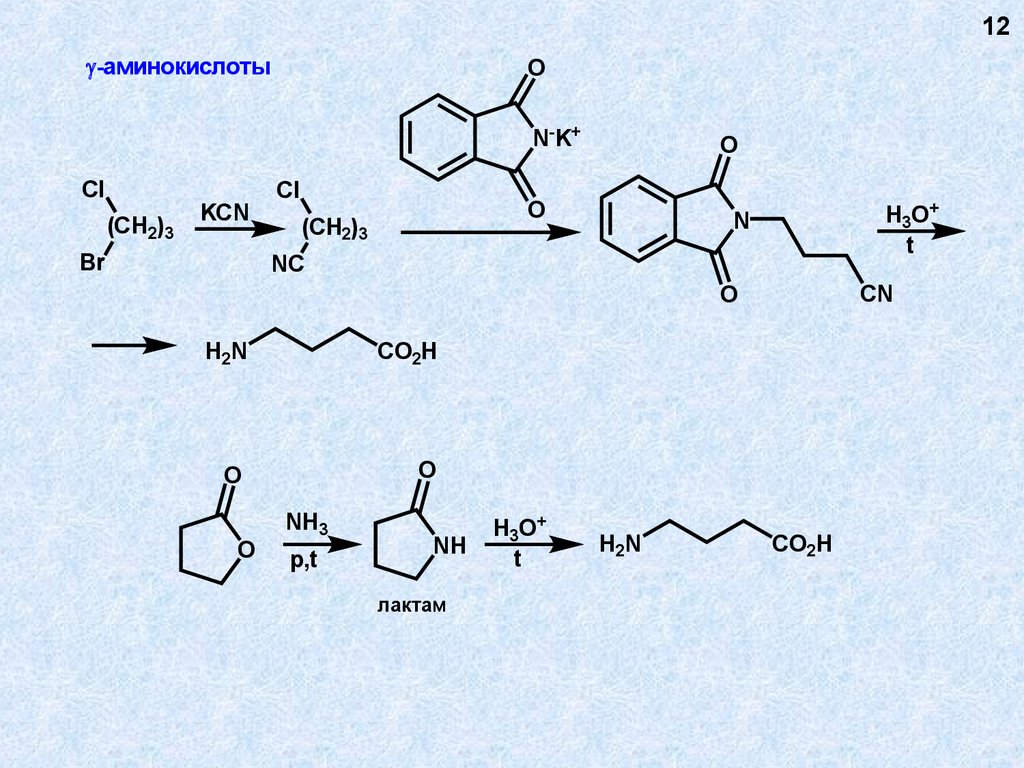
12.
12-аминокислоты
O
N-K+
Cl
(CH2)3
KCN
Br
Cl
O
O
(CH2)3
H3O+
t
N
NC
CN
O
H2N
CO2H
O
O
O
NH3
p,t
NH
лактам
H3O+
t
H2N
CO2H
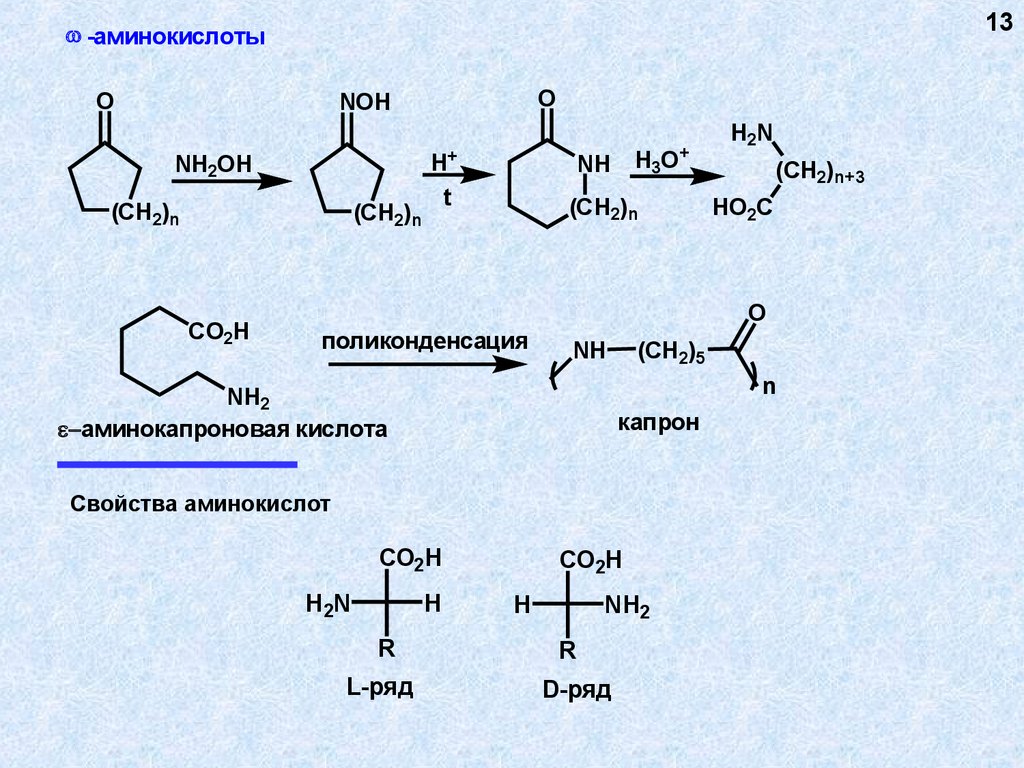
13.
13-аминокислоты
O
O
NOH
NH2OH
(CH2)n
(CH2)n
CO2H
H+
t
H3O
NH
+
(CH2)n
H2N
(CH2)n+3
HO2C
O
поликонденсация
NH
(CH2)5
n
NH2
аминокапроновая кислота
капрон
Свойства аминокислот
CO2 H
H2N
H
R
L-ряд
CO2H
H
NH2
R
D-ряд
14.
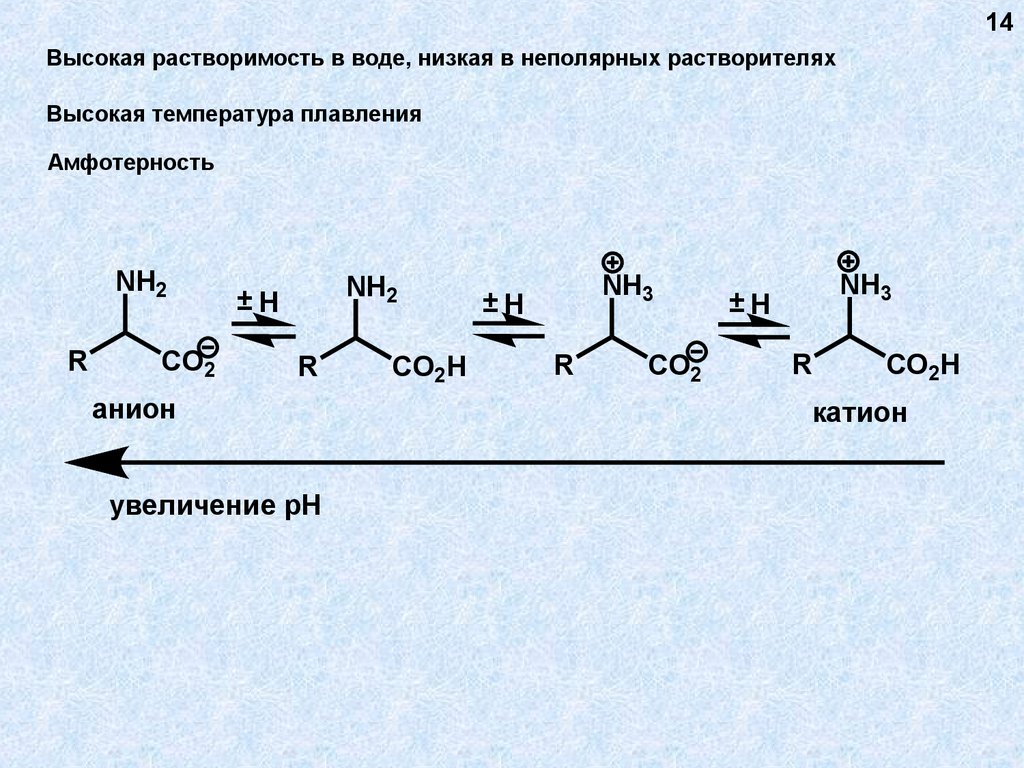
14Высокая растворимость в воде, низкая в неполярных растворителях
Высокая температура плавления
Амфотерность
NH2
R
CO2
NH2
±H
R
анион
увеличение рН
CO2H
NH3
±H
R
CO2
NH3
±H
R
CO2H
катион
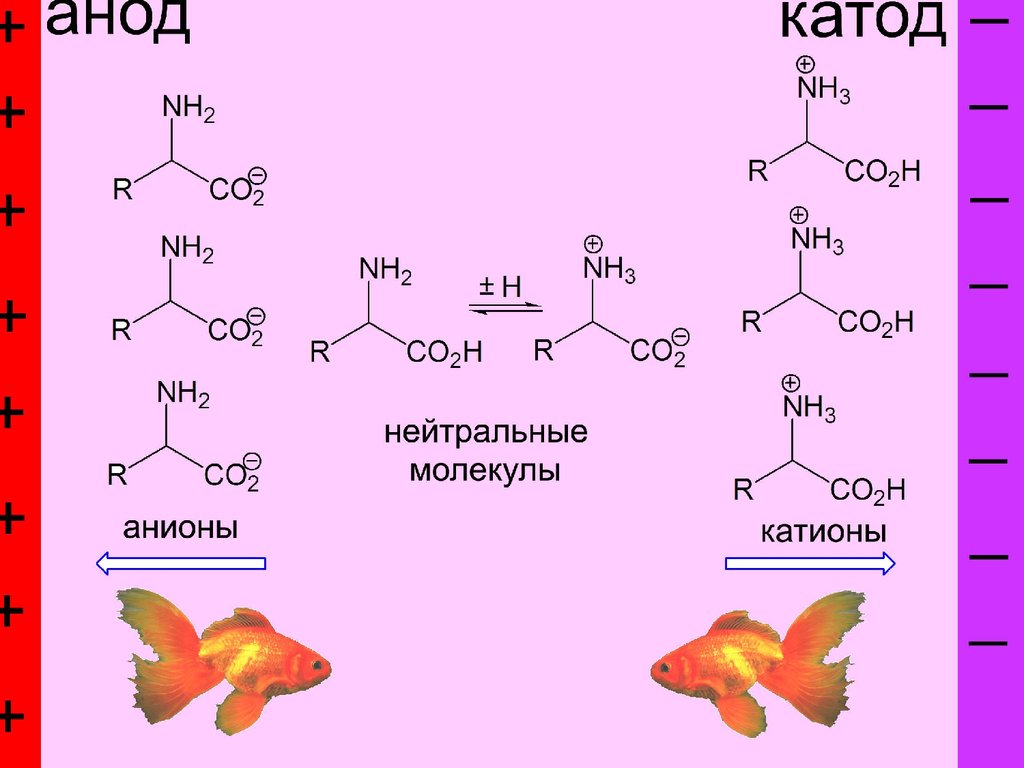
15.
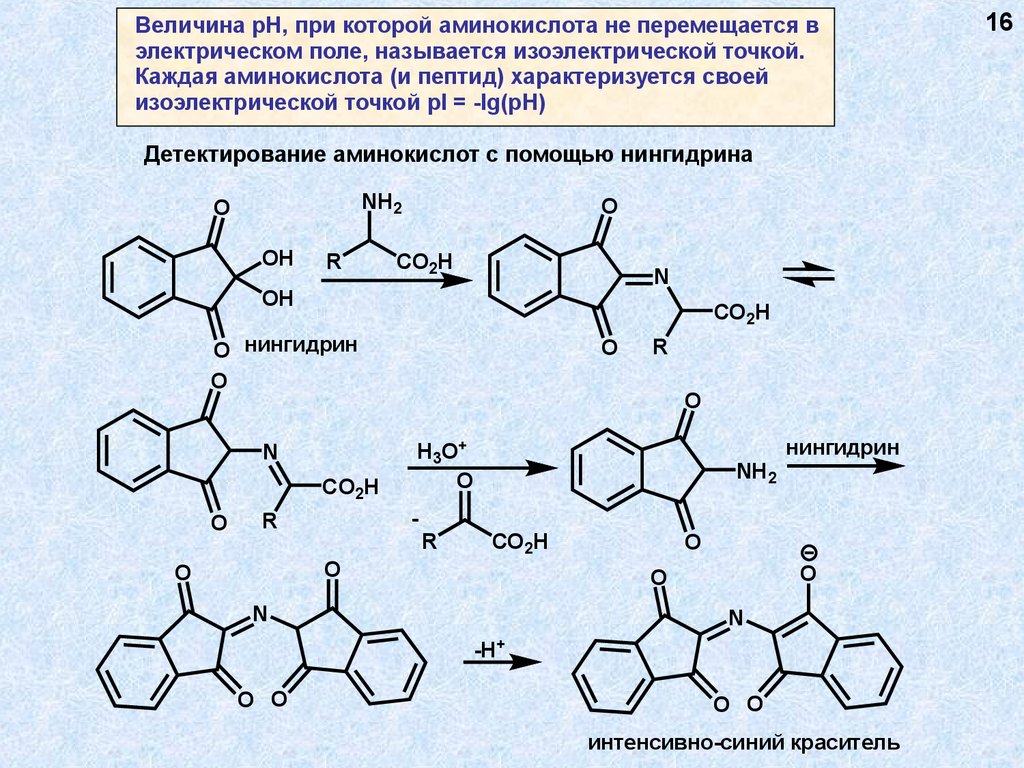
16.
Величина рН, при которой аминокислота не перемещается вэлектрическом поле, называется изоэлектрической точкой.
Каждая аминокислота (и пептид) характеризуется своей
изоэлектрической точкой pI = -lg(pH)
Детектирование аминокислот с помощью нингидрина
NH2
O
OH
R
O
CO2H
N
OH
CO2H
O нингидрин
O
N
CO2H
O
O
O
H3O+
O
-
R
R
NH2
CO2H
O
O
R
O
O
O
N
нингидрин
N
-H+
O O
O O
интенсивно-синий краситель
16
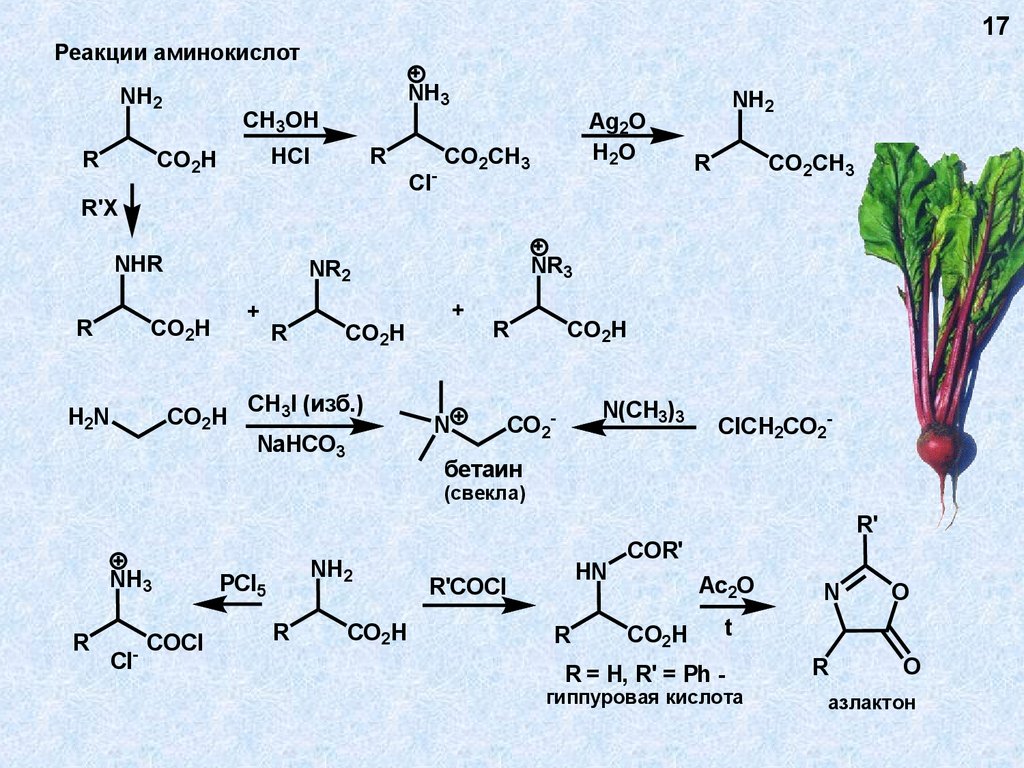
17.
17Реакции аминокислот
NH2
R
NH3
CH3OH
HCl
CO2H
R
Cl
R'X
NHR
R
CO2CH3
+
CO2H
R
+
CO2H
CH3I (изб.)
NaHCO3
R
CO2CH3
NR3
NR2
CO2H
H2N
-
Ag2O
H2O
NH2
R
N
CO2H
N(CH3)3
CO2-
ClCH2CO2-
бетаин
(свекла)
NH3
R
Cl-
COCl
NH2
PCl5
R
CO2H
HN
R'COCl
R
R'
COR'
Ac2O
CO2H
R = H, R' = Ph -
N
O
t
гиппуровая кислота
R
O
азлактон
18.
NH2NaNO2
+
CO2H H3 O
R
NH2
CO2H
R
N
N2
NaNO2
+
CO2R' H3O
R
18
OH
N
CO2R'
R
- H+
R
CO2R' диазоэфир
Термические превращения
NH2
O
O
N
H
R
t
CO2 H - H2O
R
R
H
N
дикетопиперазин
NH2
R
CO2H
t
R
NH2
R
CO2H
CO2H
- NH3
t
- H2O
R
H
N
O
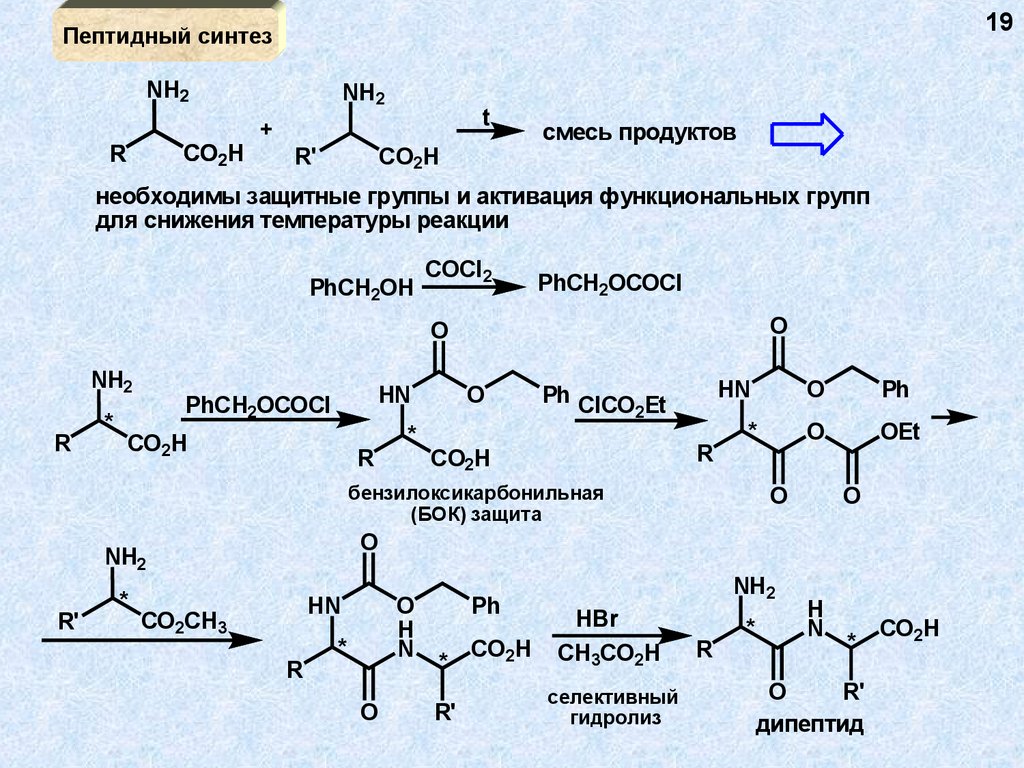
19.
19Пептидный синтез
NH2
CO2H
R
NH2
t
+
R'
CO2H
смесь продуктов
необходимы защитные группы и активация функциональных групп
для снижения температуры реакции
PhCH2OH
COCl2
PhCH2OCOCl
O
O
NH2
R
*
HN
PhCH2OCOCl
CO2H
R
*
O
HN
Ph ClCO Et
2
R
CO2H
*
бензилоксикарбонильная
(БОК) защита
R'
Ph
O
OEt
O
O
O
NH2
*
O
HN
CO2CH3
R
O
H
N
*
O
Ph
*
R'
CO2H
NH2
HBr
CH3CO2H
селективный
гидролиз
R
*
H
N
*
O
R'
дипептид
CO2H
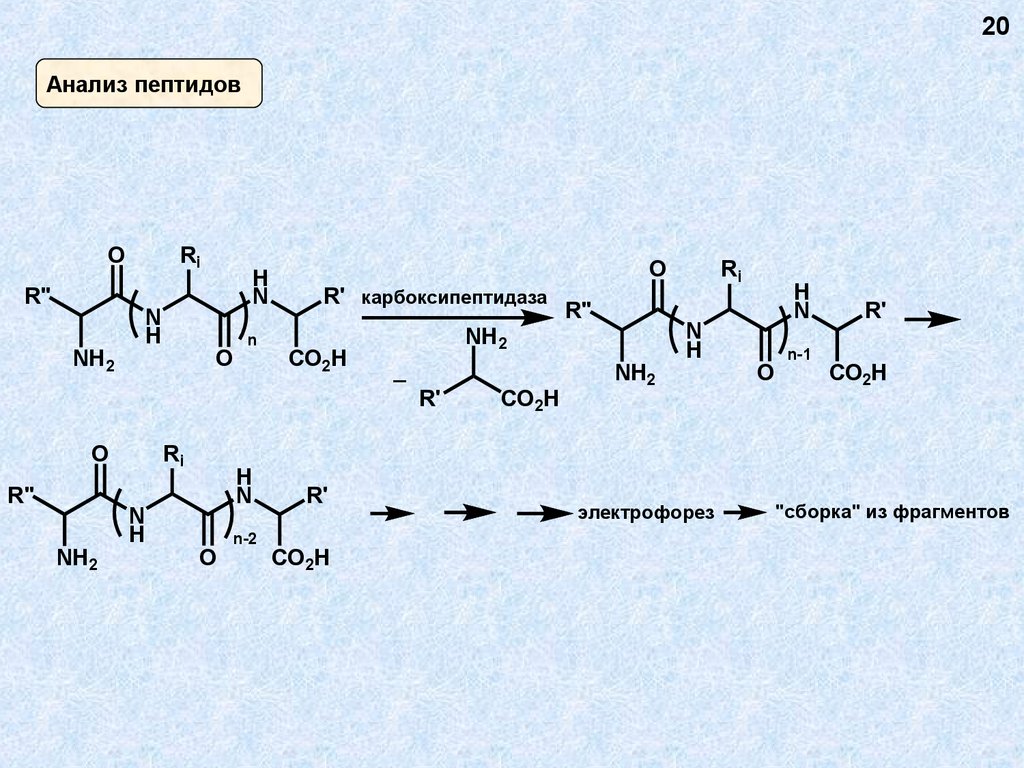
20.
20Анализ пептидов
O
Ri
R"
N
H
NH2
H
N
O
n
O
R' карбоксипептидаза
CO2H
NH2
_
R'
O
R"
NH2
Ri
N
H
H
N
O
n-2
R'
CO2H
R"
CO2H
NH2
Ri
N
H
электрофорез
H
N
O
n-1
R'
CO2H
"сборка" из фрагментов
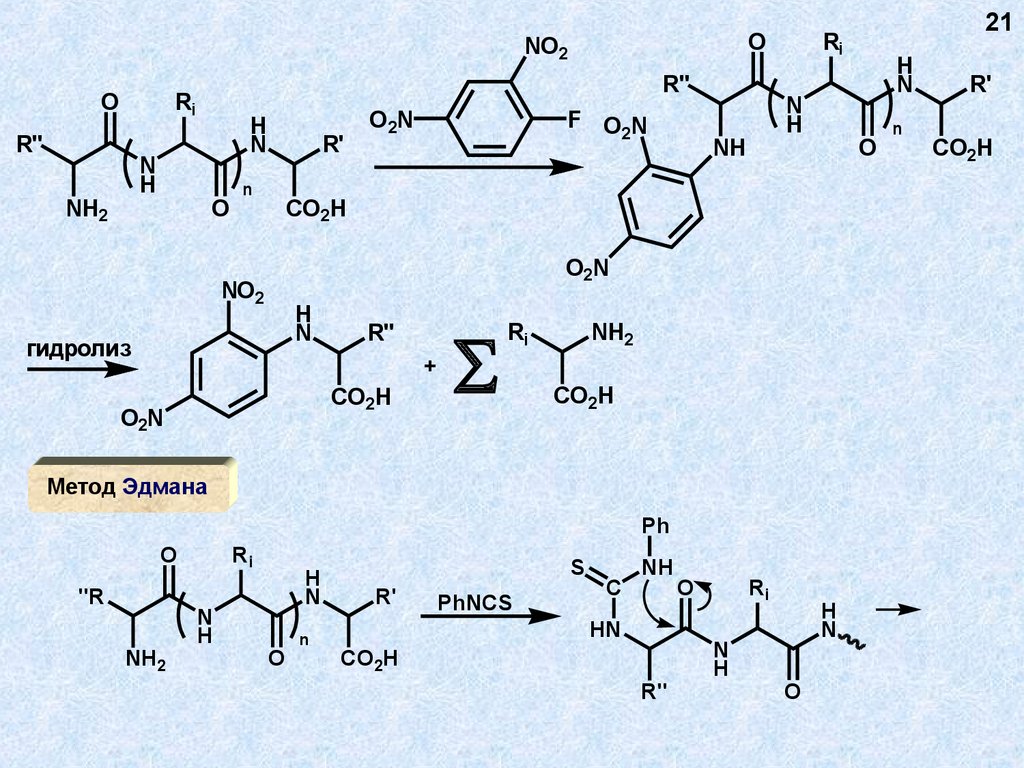
21.
ONO2
O
R"
Ri
R"
H
N
N
H
NH2
O
R'
n
O2N
F O2N
N
H
NH
O2N
H
N
гидролиз
R"
+
CO2H
O2N
Ri
NH2
CO2H
Метод Эдмана
Ph
O
"R
NH2
Ri
N
H
H
N
O
n
S
R'
PhNCS
C
NH
HN
CO2H
R"
O
Ri
N
H
H
N
O
H
N
O
CO2H
NO2
21
Ri
n
R'
CO2H
22.
PhS
C
N
OH Ri
N
H
HN
R"
22
S
H
N
O
H3O+
C
HN
R"
N
Ph
+
O
Ri
H
N
H2N
O
тиогидантоин
Первичная структура инсулина (две субъединицы, 51 аминокислотный остаток
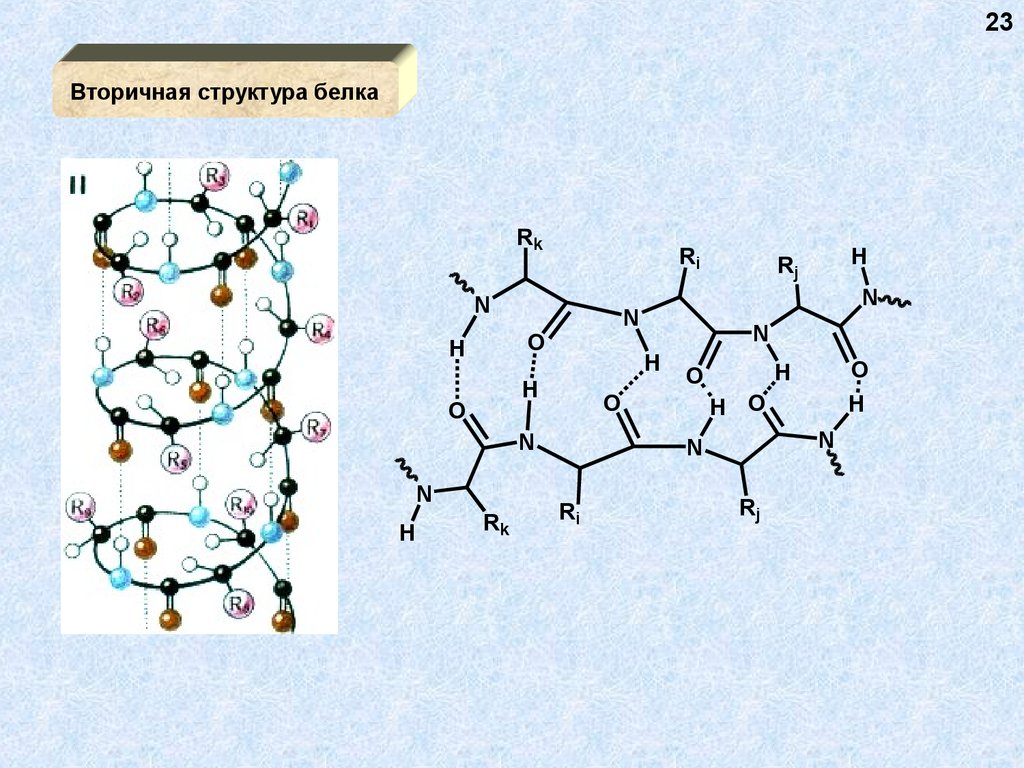
23.
23Вторичная структура белка
Rk
Ri
N
H
Rk
H O
H
N
N
Ri
O
H
O
O
N
N
N
H
H
O
N
N
O
H
H
Rj
Rj
24.
24Третичная структура сывороточного
Типы связей, возникающие между
альбумина, состоящего из 607
аминокислотными остатками при формировании аминокислотных остатков
третичной структуры белка
Четвертичная структура белка
Структура инсулина, Фредерик Сенгер,
нобелевская премия за установление
структуры, 1958 г.
25.
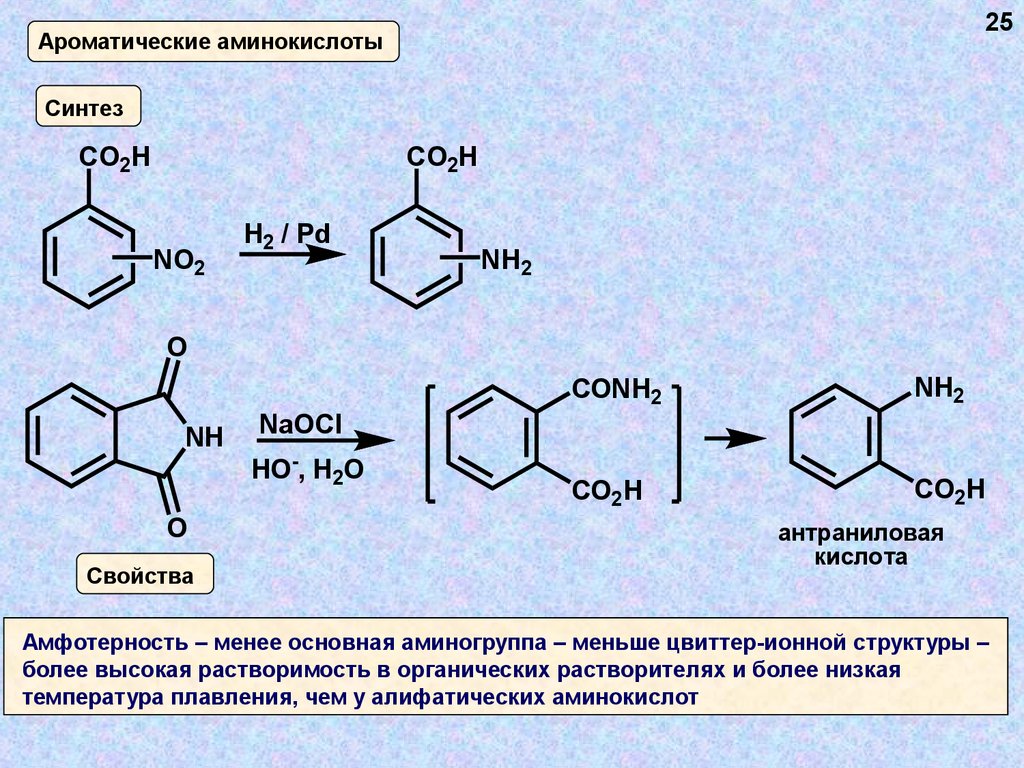
25Ароматические аминокислоты
Синтез
CO2H
CO2H
NO2
H2 / Pd
NH2
O
NH
O
Свойства
CONH2
NH2
CO2 H
CO2 H
NaOCl
HO-, H2O
антраниловая
кислота
Амфотерность – менее основная аминогруппа – меньше цвиттер-ионной структуры –
более высокая растворимость в органических растворителях и более низкая
температура плавления, чем у алифатических аминокислот
26.
26CO2H
CO2H
CO2H
NH2
NaNO2
+
H3O
N2
Cu2X2
X
HX
орто-изомер
NH2
NH2
NH2
O
HO2C
HO3S
витамин H1 -
фактор роста микроорганизмов
сульфаниловая кислота антивитамин
H2N
S
O
белый стрептоцид
27.
27Углеводы
Cn(H2O)n
n = 0 (CH2O) - не углевод
простейшие углеводы при n = 3
CHO
CHO
H
HO
OH
H
O
CH2OH
CH2OH
(+)-D-глицериновый
альдегид
(R)-глицериновый
альдегид
CH2OH
(-)-L-глицериновый
альдегид
(S)-глицериновый
альдегид
CH2OH
дигидроксиацетон
кетоза (кетотриоза)
альдоза (альдотриоза)
CHO
тетрозы D-ряда
CHO
H
OH
H
OH
H
OH
H
OH
CH2OH
D-эритроза
CH2OH
D-треоза
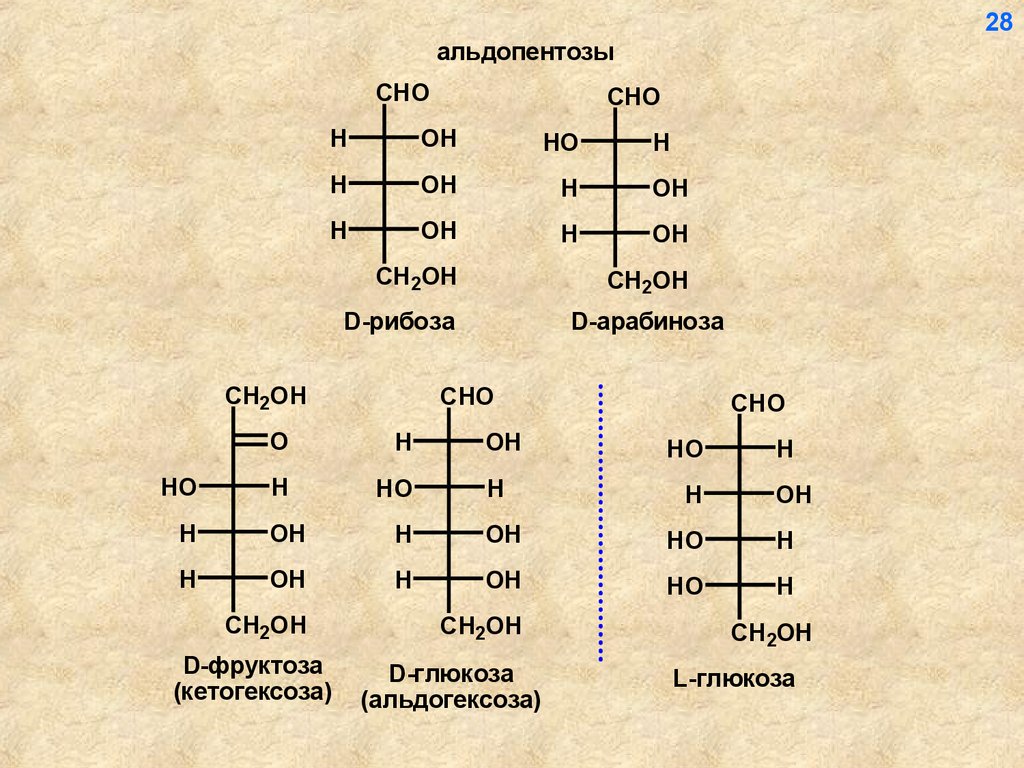
28.
28альдопентозы
CHO
CHO
H
OH
HO
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2OH
D-рибоза
CH2OH
HO
H
D-арабиноза
CHO
O
H
H
HO
OH
H
CHO
HO
H
H
OH
H
OH
H
OH
HO
H
H
OH
H
OH
HO
H
CH2OH
D-фруктоза
(кетогексоза)
CH2OH
D-глюкоза
(альдогексоза)
CH2OH
L-глюкоза
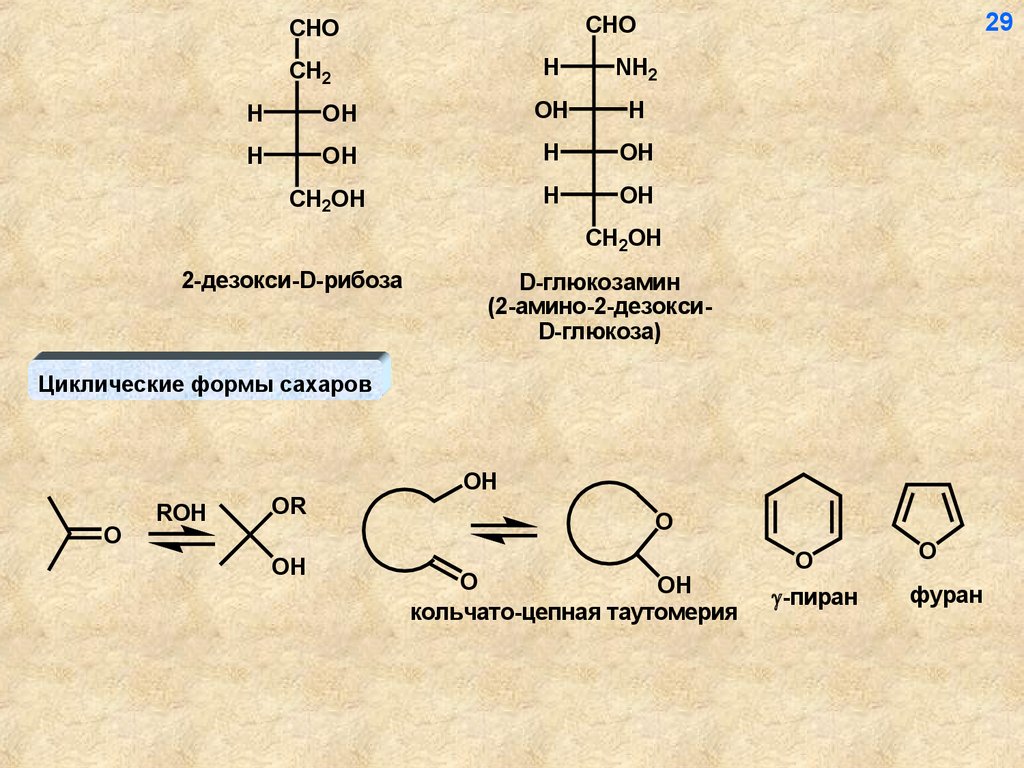
29.
29CHO
CHO
CH2
H
NH2
H
OH
OH
H
H
OH
H
OH
H
OH
CH2OH
CH2OH
2-дезокси-D-рибоза
D-глюкозамин
(2-амино-2-дезоксиD-глюкоза)
Циклические формы сахаров
O
ROH
OR
OH
OH
O
O
OH
кольчато-цепная таутомерия
O
-пиран
O
фуран
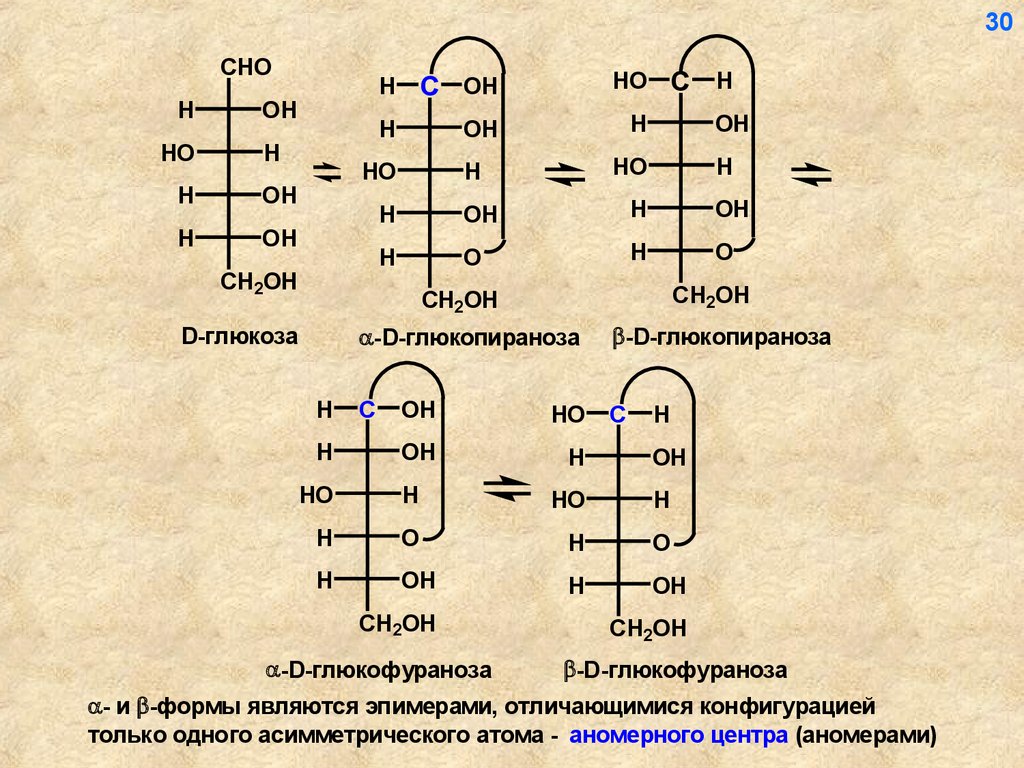
30.
30CHO
H
HO
OH
H
H
OH
H
OH
H
C OH
HO
H
OH
H
HO
CH2OH
C H
OH
HO
H
H
H
OH
H
OH
H
O
H
O
CH2OH
CH2 OH
D-глюкоза
H
H
-D-глюкопираноза
-D-глюкопираноза
C
C
OH
HO
OH
H
H
OH
HO
H
HO
H
H
O
H
O
H
OH
H
OH
CH2OH
-D-глюкофураноза
CH2OH
-D-глюкофураноза
- и -формы являются эпимерами, отличающимися конфигурацией
только одного асимметрического атома - аномерного центра (аномерами)
31.
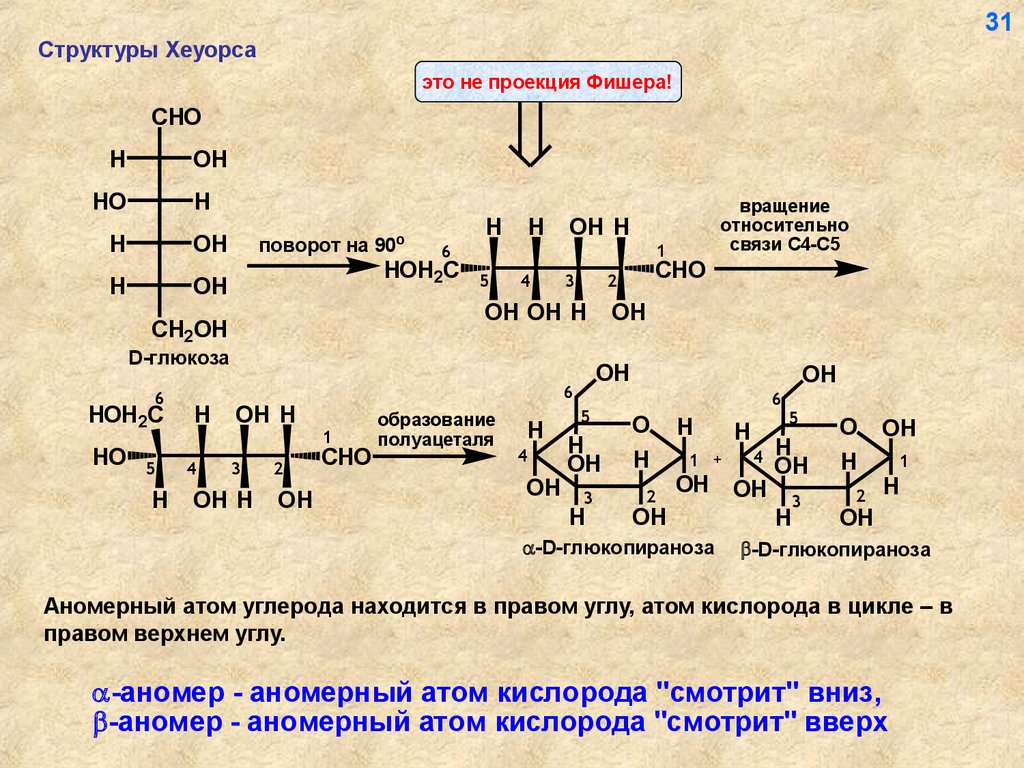
31Структуры Хеуорса
это не проекция Фишера!
CHO
H
OH
HO
H
H
OH
H
OH
поворот на 90о
H
H
OH H
1
6
HOH2C
5
4
3
D-глюкоза
6
HOH2C
HO
5
H
4
OH H
3
OH H
2
OH
1
CHO
образование
полуацеталя
H
4
OH
OH
OH
6
H
CHO
2
OH OH H
CH2 OH
вращение
относительно
связи С4-С5
5
H
OH
3
H
OH
6
O
H
2
H
1 +
OH
OH
-D-глюкопираноза
H
4
OH
5
H
OH
3
H
O
OH
H
1
2
H
OH
-D-глюкопираноза
Аномерный атом углерода находится в правом углу, атом кислорода в цикле – в
правом верхнем углу.
-аномер - аномерный атом кислорода "смотрит" вниз,
-аномер - аномерный атом кислорода "смотрит" вверх
32.
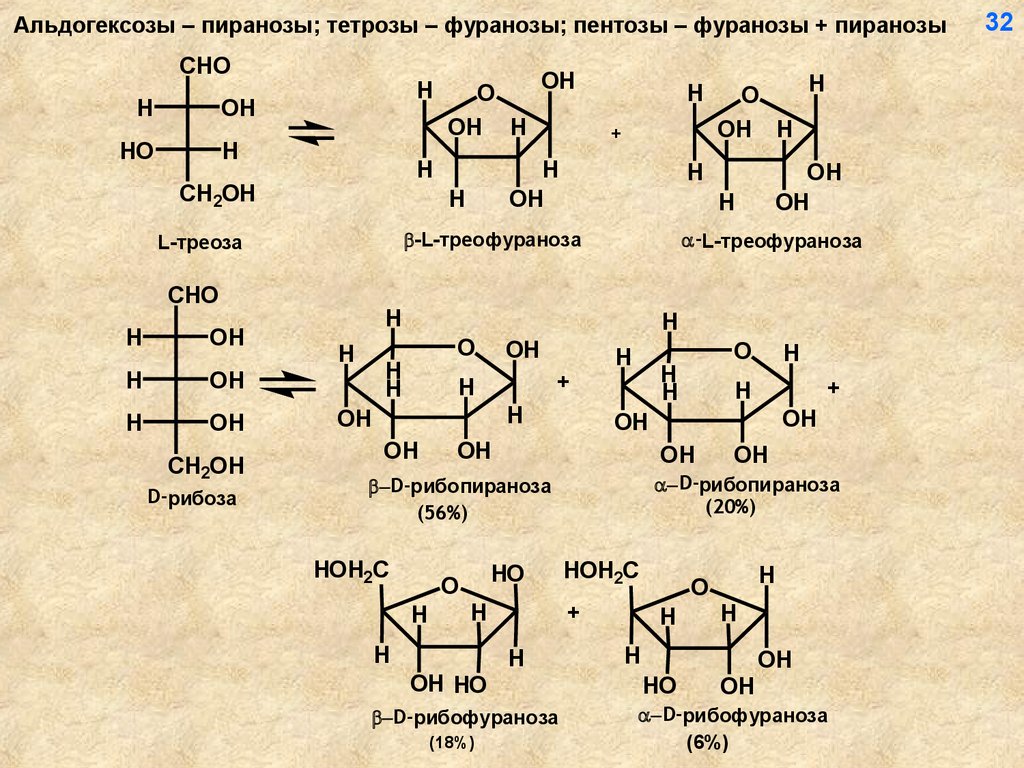
Альдогексозы – пиранозы; тетрозы – фуранозы; пентозы – фуранозы + пиранозыCHO
H
H
OH
HO
H
H
CH2OH
H
OH
H
OH
CH2OH
D-рибоза
H
+
H
OH
OH
H
-L-треофураноза
H
H
O
OH H
H
-L-треофураноза
CHO
OH
OH
H
OH
H
L-треоза
H
O
OH H
H
O
H
H
OH
+
H
H
OH
OH
H
H
H
OH
H
H
H
OH HO
D-рибофураноза
(18%)
OH
OH
D-рибопираноза
(20%)
HOH2C
+
H
+
H
OH
HO
O
H
OH
D-рибопираноза
(56%)
HOH2C
O
O
H
H
H
H
HO
OH
OH
D-рибофураноза
(6%)
32
33.
12
HO
3
H
4
H
5
6
33
CH2OH
O
H
OH
OH
1
6
HOH2C
5
H
O
H HO
OH
2
3
4
H
6
CH2OH HOH2C
OH
CH2OH
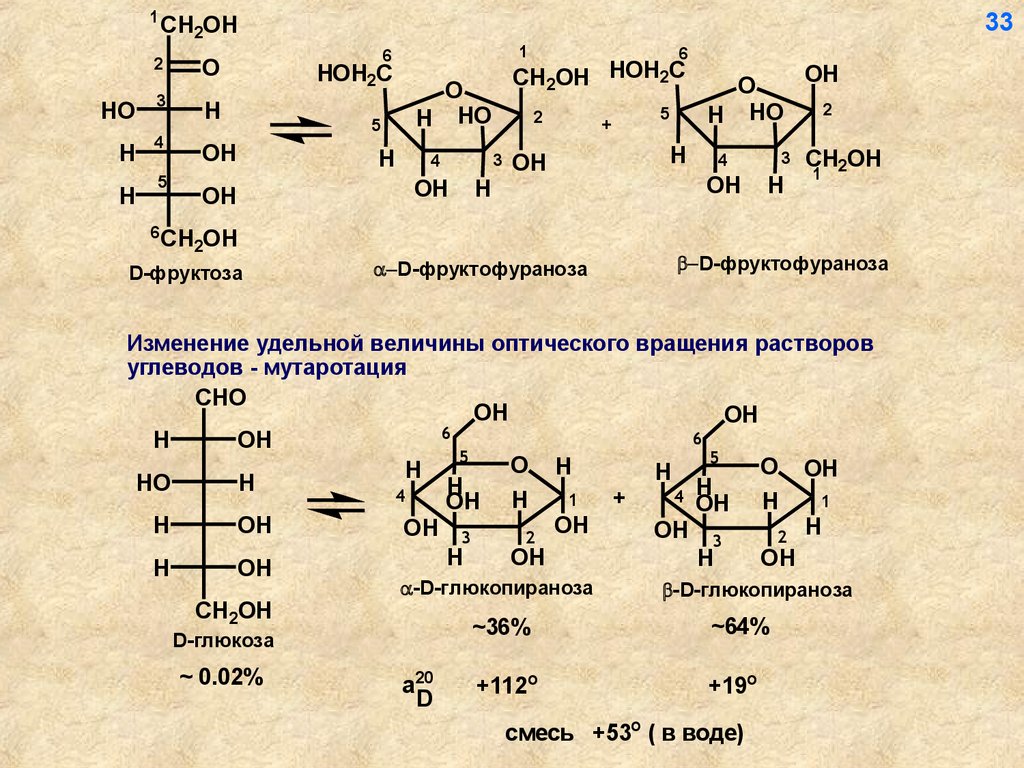
D-фруктоза
D-фруктофураноза
+
5
H
O
H HO
3
4
OH
H
OH
2
CH2OH
1
D-фруктофураноза
Изменение удельной величины оптического вращения растворов
углеводов - мутаротация
CHO
OH
OH
6
6
H
OH
5
5
O H
O OH
H
H
HO
H
H
4
4 H
1
+
1
OH H
OH H
H
OH
OH
OH 3
OH 3
2 H
2
H
OH
H
OH
H
OH
CH2OH
-D-глюкопираноза
D-глюкоза
~ 0.02%
a20
D
-D-глюкопираноза
~36%
~64%
+112o
+19o
смесь +53o ( в воде)
34.
OH6
H
4
OH
6
5
H
OH
3
O
H
H
H
1
2
H
4
OH
OH
OH
5
H
OH
OH
H
1
H
OH
H OH
H O
H
H
O
2
3
H
H OH
HO
HO
34
OH
OH
H O
HO
HO
H
H
H
OH
OH
OH
H
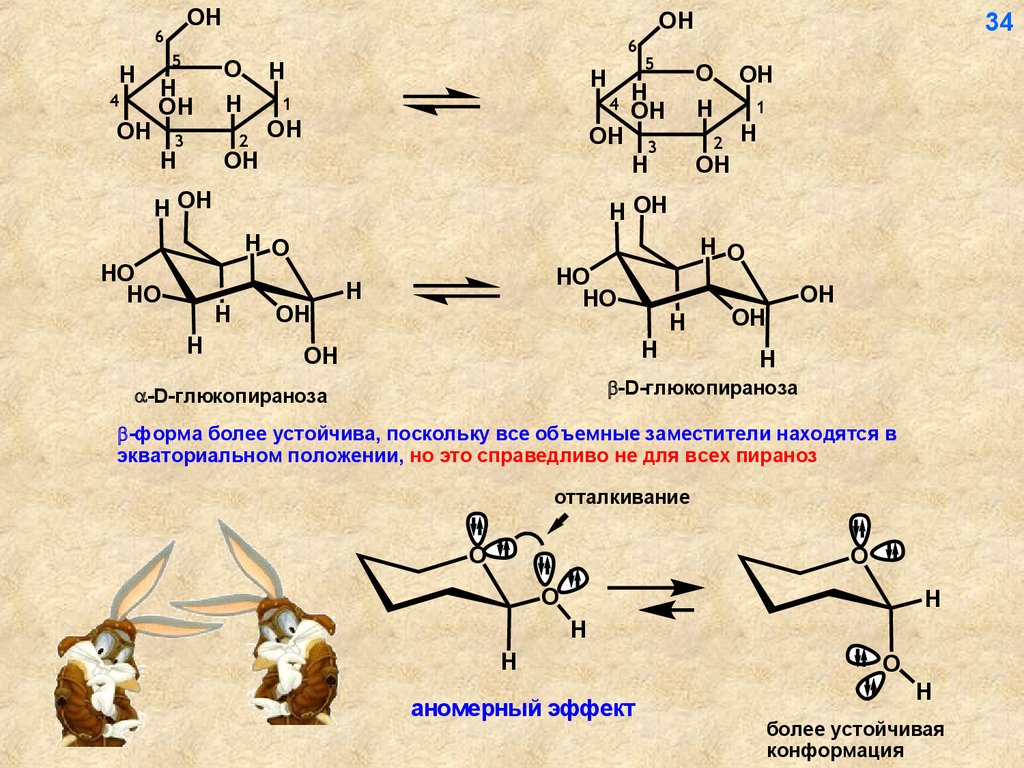
-D-глюкопираноза
-D-глюкопираноза
-форма более устойчива, поскольку все объемные заместители находятся в
экваториальном положении, но это справедливо не для всех пираноз
отталкивание
O
O
O
H
H
H
аномерный эффект
O
H
более устойчивая
конформация
35.
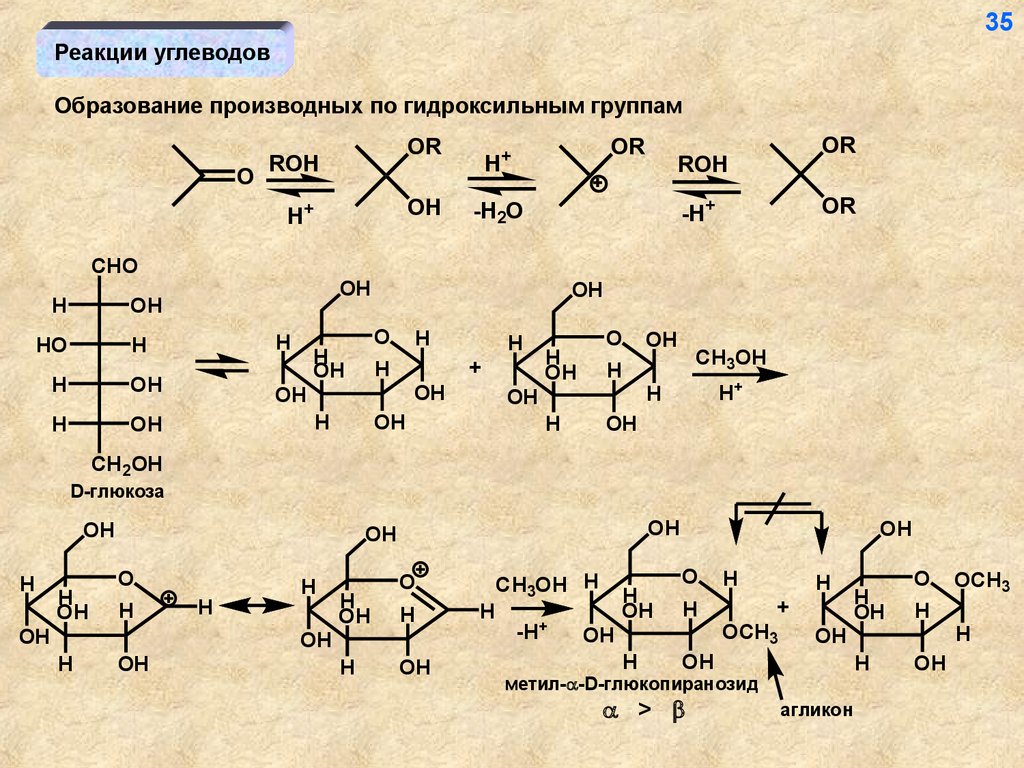
35Реакции углеводов
Образование производных по гидроксильным группам
O
OR
ROH
OH
H+
CHO
H
H
H
H
OH
H
OH
H
H
H
OH
OH
O
H
OH
+
H
H
OR
-H+
OH
O
H
OH
OR
ROH
-H2O
OH
OH
HO
OR
+
H
H
CH3OH
H+
H
OH
OH
OH
OH
CH2 OH
D-глюкоза
OH
H
H
OH
O
H
OH
H
OH
OH
OH
H
H
OH
H
OH
H
O
H
OH
H
CH3OH H
+
-H
H
OH
OH
O
H
OH
H
H
H
+
OCH3
OH
OH
H
метил- -D-глюкопиранозид
>
H
OH
агликон
O
H
OH
OCH3
H
36.
OHH
OH
H
OH
H
NH2
OH
O
H
H
H
OH
OH
OH
H
OH
H
O
H
N
OH
H
OH
HOH2C
H
H3O+
CH3OH / H+
OH
H
OH
H
OH
H
OH
O
H
OH
H
H
+
OCH3
OH
H
OH
H
O
H
OH
OCH3
H
N
H
H
OH
N
N
O
36
H
OH
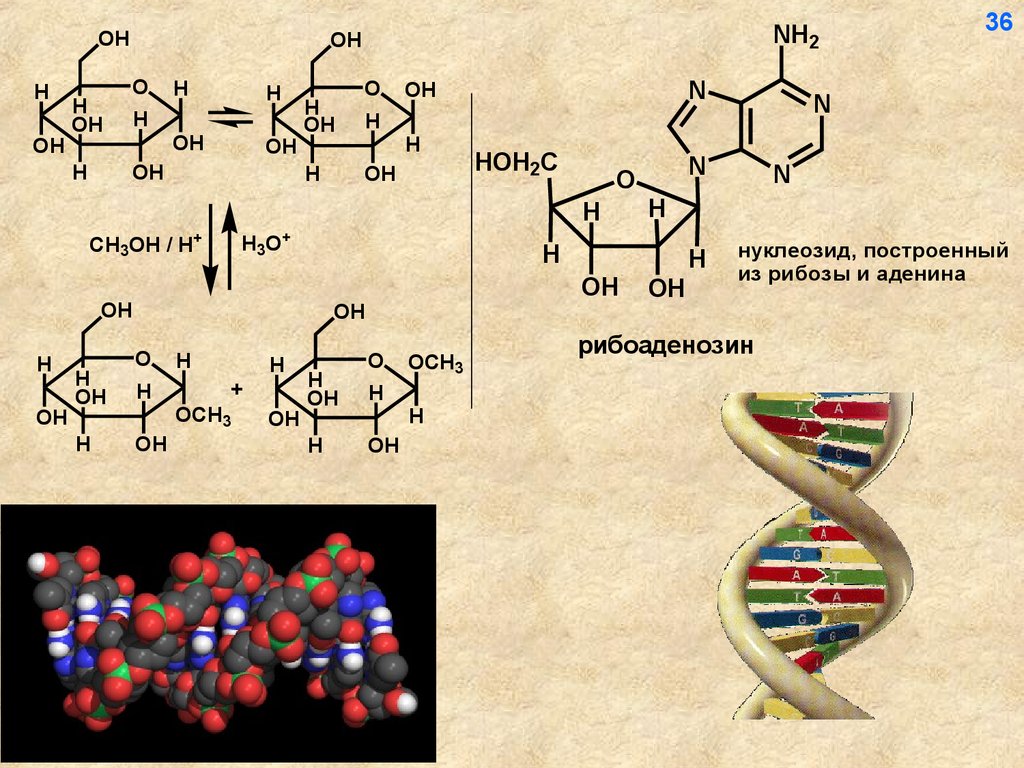
нуклеозид, построенный
из рибозы и аденина
рибоаденозин
37.
37OH
H
OCH3
O
H
OH
H
OH
OCH3
(CH3O)2SO2
H
OH-
H
OH
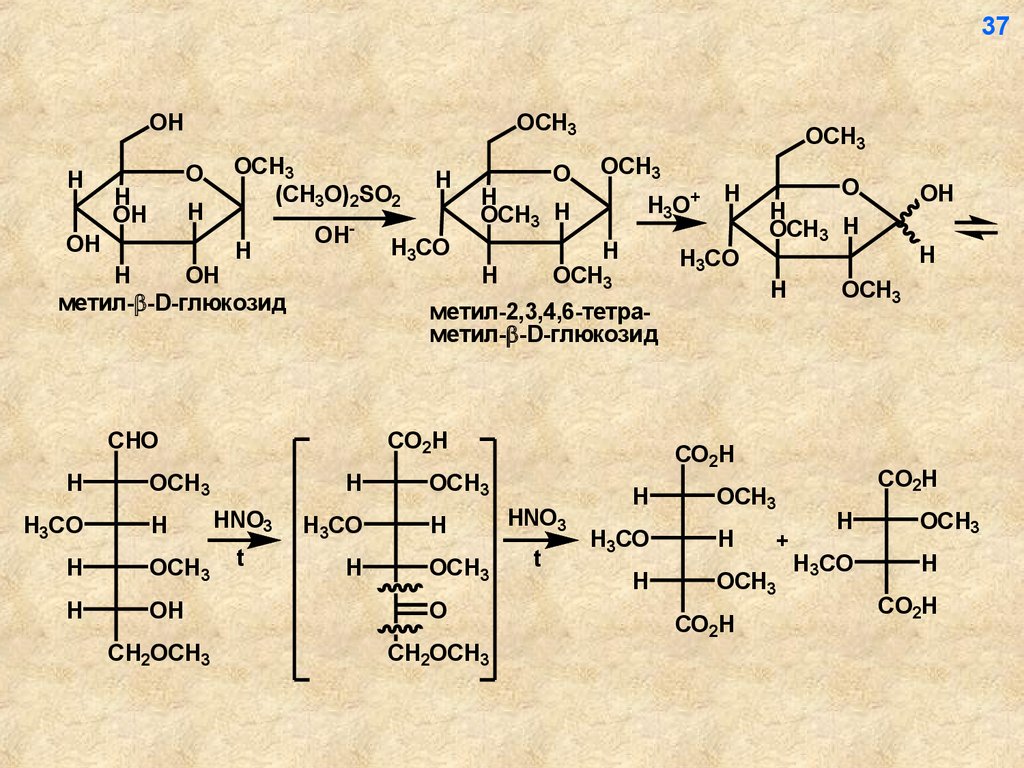
метил- -D-глюкозид
H3CO
H
OCH3
H
OH
CH2OCH3
OCH3
H
OCH3 H
H3O+
H
OCH3
H
H
HNO3
t
H
H3CO
H
OCH3
O
CH2OCH3
HNO3
t
OH
H
OCH3 H
H
H
OCH3
CO2H
OCH3
H
O
H3CO
CO2H
OCH3
H
H3CO
O
метил-2,3,4,6-тетраметил- -D-глюкозид
CHO
H
H
OCH3
H
H3CO
H
OCH3
H
+
OCH3
CO2H
CO2H
H
H3CO
OCH3
H
CO2H
38.
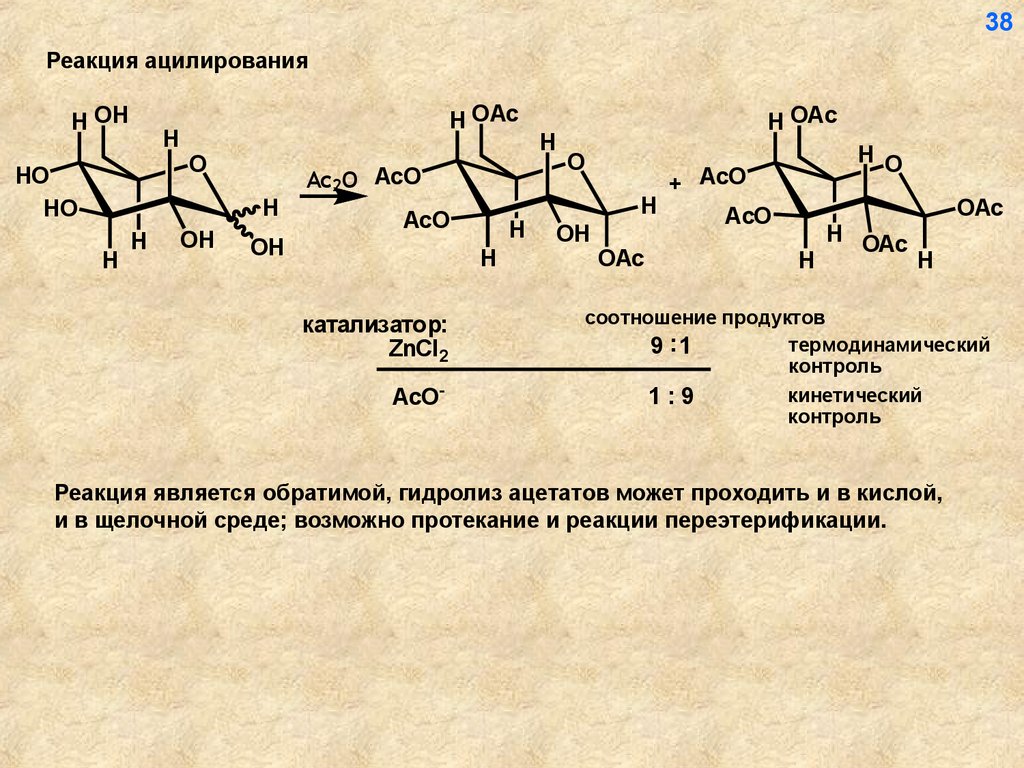
38Реакция ацилирования
H OH
H
HO
HO
H OAc
O
Ac2O AcO
H
H
H
OH
AcO
OH
H
H
катализатор:
ZnCl2
AcO-
H
H OAc
O
OH
H O
+ AcO
H
AcO
OAc
OAc
H
H OAc
H
соотношение продуктов
термодинамический
9 :1
контроль
1:9
кинетический
контроль
Реакция является обратимой, гидролиз ацетатов может проходить и в кислой,
и в щелочной среде; возможно протекание и реакции переэтерификации.
39.
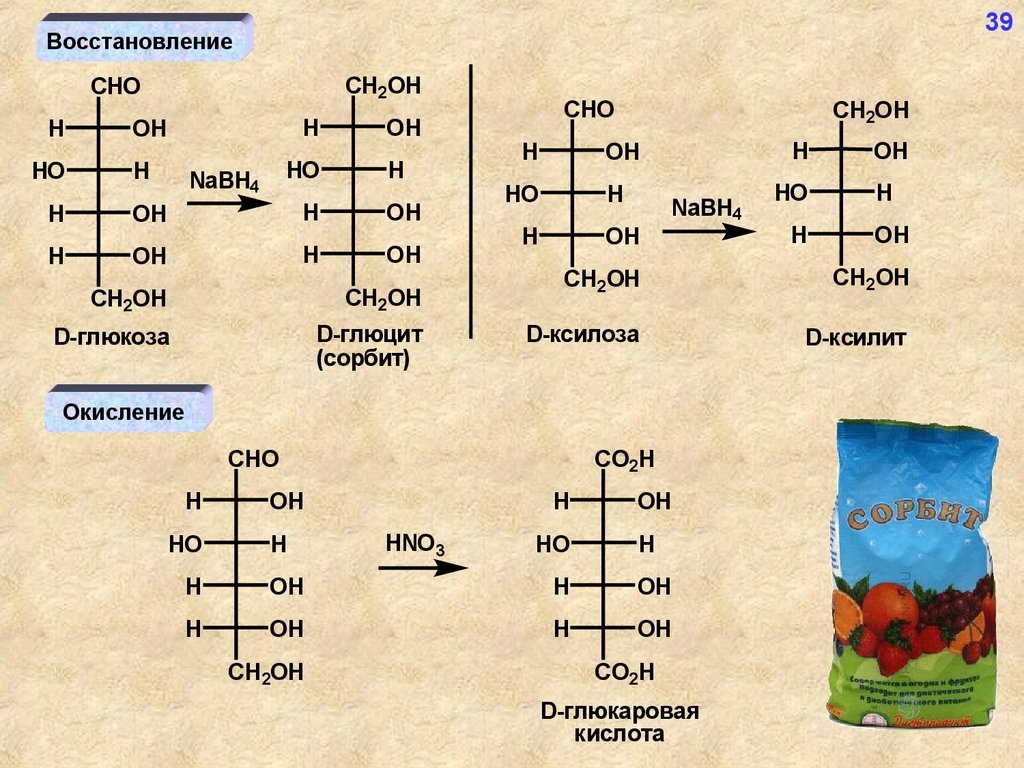
39Восстановление
CH2 OH
CHO
H
HO
H
OH
H
HO
NaBH4
OH
H
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2 OH
D-глюкоза
D-глюцит
(сорбит)
CHO
H
CH2OH
H
OH
HO
H
H
NaBH4
OH
HO
H
D-ксилоза
D-ксилит
CO2H
H
HNO3
HO
OH
H
H
OH
H
OH
H
OH
H
OH
CH2OH
OH
CH2 OH
CHO
OH
H
H
CH2 OH
Окисление
H
HO
OH
CO2H
D-глюкаровая
кислота
40.
CHOH
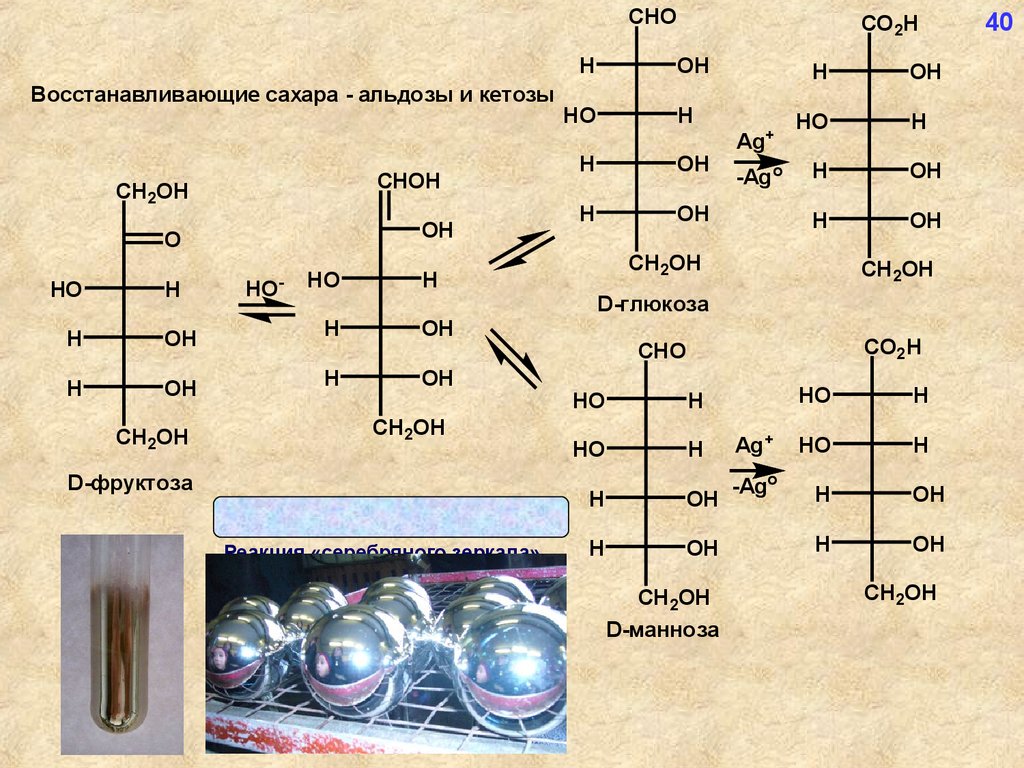
Восстанавливающие сахара - альдозы и кетозы
CHOH
CH2OH
OH
O
HO
H
HO-
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2OH
D-фруктоза
Реакция «серебряного зеркала»
CO2H
OH
HO
H
H
OH
H
OH
H
+
Ag
-Ago
HO
OH
H
H
OH
H
OH
CH2OH
CH2OH
D-глюкоза
CO2 H
CHO
HO
H
HO
H
H
OH
H
OH
CH2OH
D-манноза
HO
H
Ag+
HO
H
-Ago
H
OH
H
OH
CH2OH
40
41.
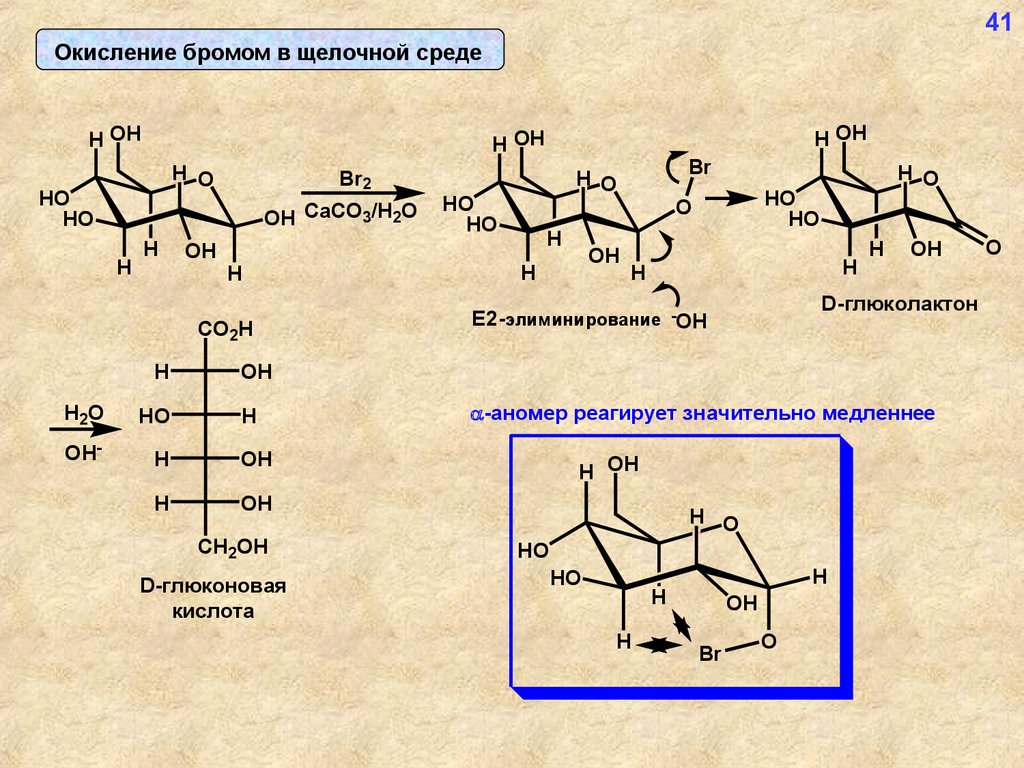
41Окисление бромом в щелочной среде
H OH
H O
HO
HO
Br2
OH CaCO3/H2O
H
H OH
H OH
H
OH
H
CO2H
H
Br
H O
HO
HO
H
OH
H
H O
HO
HO
O
H
H
H
OH
D-глюколактон
E2-элиминирование -OH
OH
H2O
HO
OH-
H
OH
H
OH
H
CH2OH
D-глюконовая
кислота
-аномер реагирует значительно медленнее
H OH
H O
HO
HO
H
H
H
OH
Br
O
O
42.
42O
H
C
OH
HO
H
HO
H
H
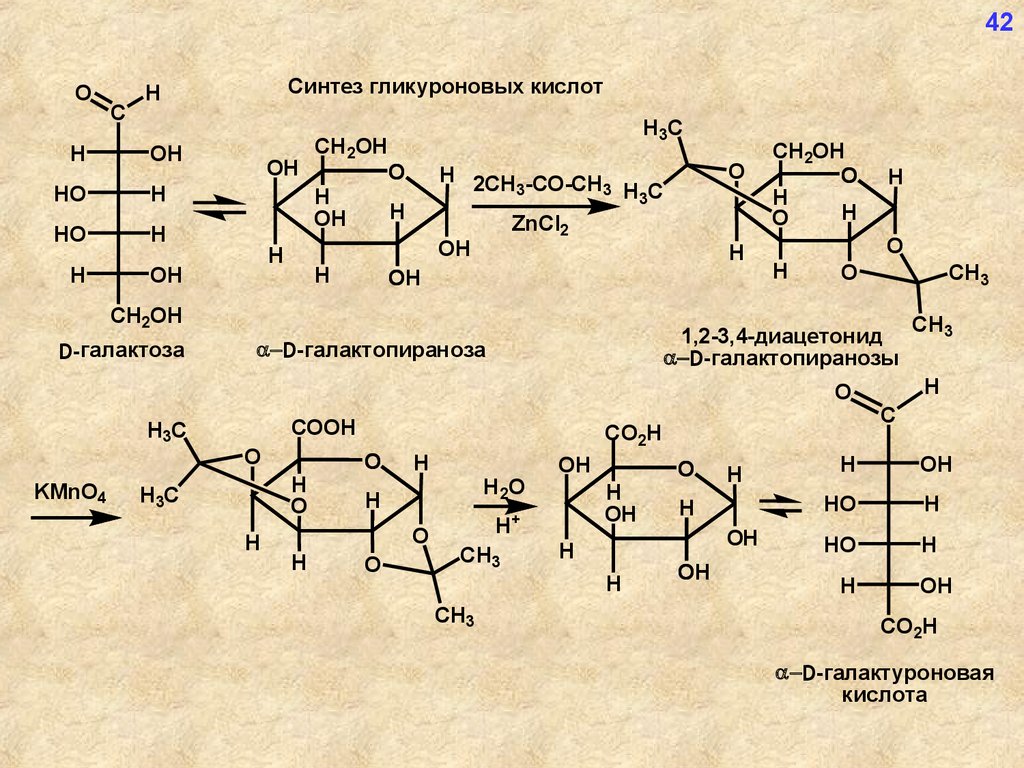
Синтез гликуроновых кислот
H
OH
CH2OH
H
OH
H
OH
H3C
O
H
H
H
OH
CH2OH
D-галактоза
O
H 2CH -CO-CH
3
3 H C
3
ZnCl2
OH
CH2OH
O
H
H
O
O
H
O
D-галактопираноза
KMnO4
COOH
O
H
O
H3C
H
CO2H
O
H
O
H
H2O
H
O
OH
H
OH
+
H
CH3
H
H
CH3
CH3
1,2-3,4-диацетонид
D-галактопиранозы
O
H3C
H
O
H
H
OH
OH
H
CH3
H
C
OH
HO
H
HO
H
H
OH
CO2H
D-галактуроновая
кислота
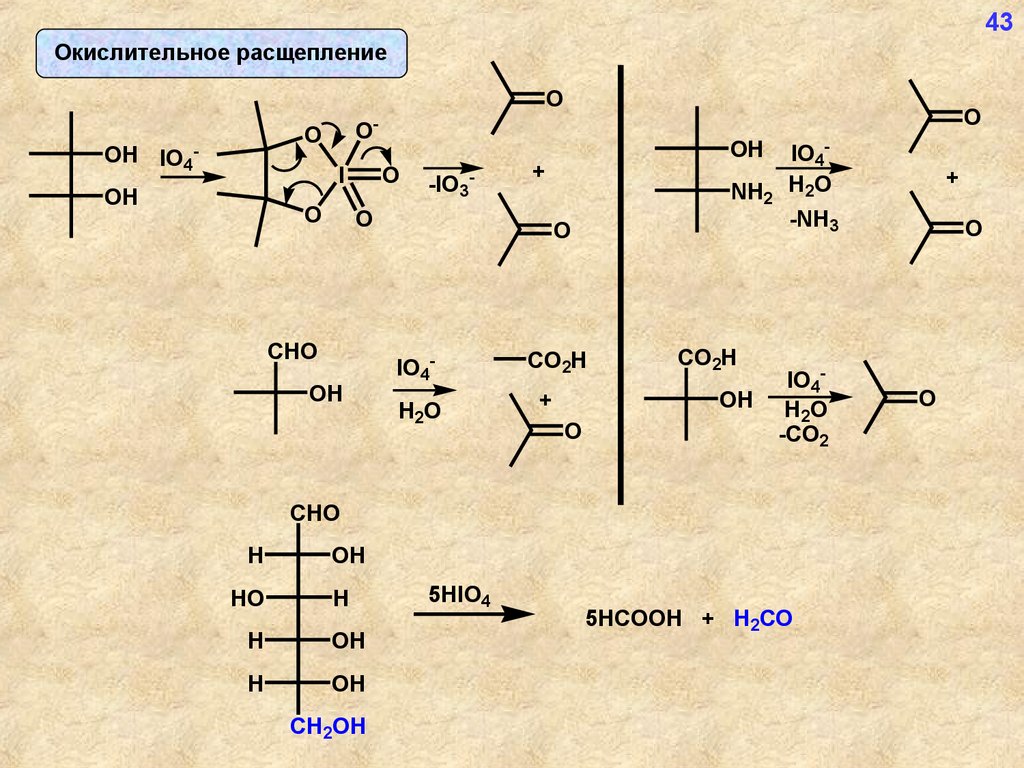
43.
43Окислительное расщепление
O
O
I
OH
O
O
-IO3-
+
O
CHO
OH
OH
NH2
O
IO4H 2O
CO2H
CO2H
OH
+
OH IO4-
O
O-
O
IO4H2O
-NH3
IO4H 2O
-CO2
CHO
H
HO
OH
H
H
OH
H
OH
CH2OH
5HIO4
+
5HCOOH + H2CO
O
O
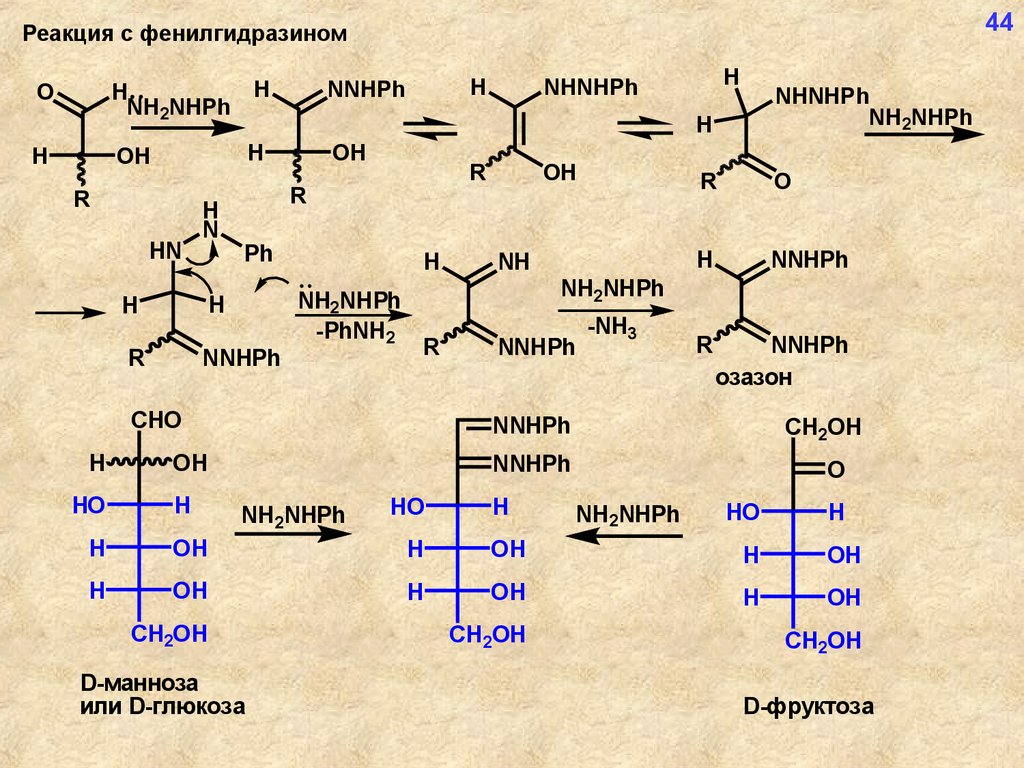
44.
44Реакция с фенилгидразином
O
H
H
NH2NHPh
H
OH
H
R
HN
H
N
H
NNHPh
OH
R
R
Ph
H
H
R
NNHPh
H
NH2NHPh
-PhNH2
HO
R
NH
R
O
H
NNHPh
NNHPh
-NH3
R
NNHPh
озазон
NNHPh
OH
H
OH
H
NHNHPh
NH2NHPh
NH2NHPh
CHO
H
H
NHNHPh
CH2OH
NNHPh
NH2NHPh
HO
H
O
NH2NHPh
HO
H
H
OH
H
OH
H
OH
H
OH
H
OH
H
OH
CH2OH
D-манноза
или D-глюкоза
CH2OH
CH2OH
D-фруктоза
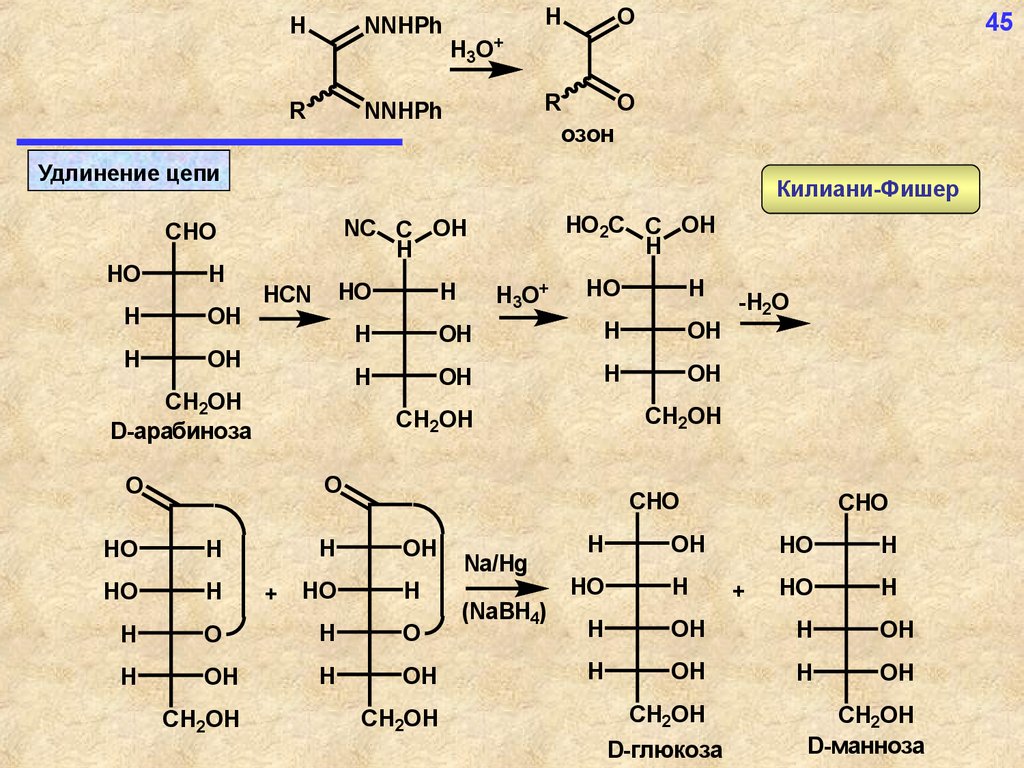
45.
HNNHPh
R
NNHPh
H
O
R
O
45
H3O+
озон
Удлинение цепи
Килиани-Фишер
HO
H
H
OH
H
OH
HO2C C OH
H
NC C OH
H
CHO
HO
HCN
CH2OH
D-арабиноза
H
H3O+
HO
H
OH
H
OH
H
OH
H
OH
O
HO
H
HO
H
H
H
H
CHO
OH
HO
H
O
H
O
OH
H
OH
CH2OH
+
-H2O
CH2OH
CH2OH
O
H
CH2OH
Na/Hg
(NaBH4)
H
HO
CHO
OH
H
+
HO
H
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D-глюкоза
CH2OH
D-манноза
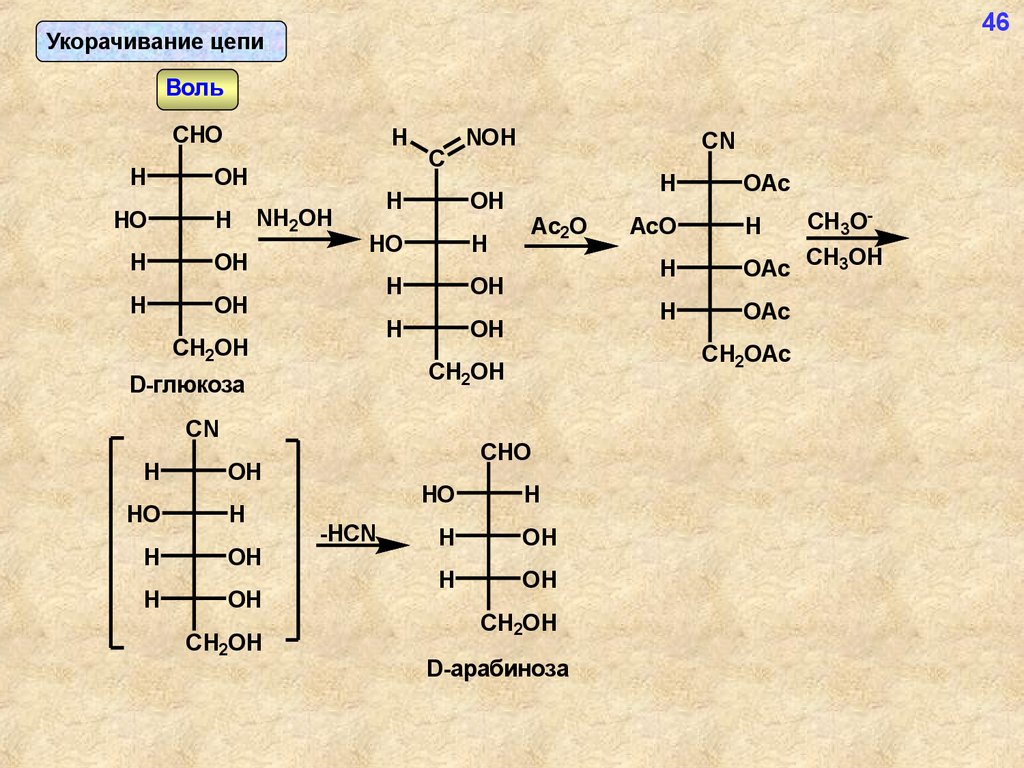
46.
46Укорачивание цепи
Воль
CHO
H
HO
H
OH
H
H
OH
H
OH
NH2OH
C
H
H
OH
H
OH
H
OH
H
OH
CH2OH
HO
-HCN
OAc
H
CH3O-
H
OAc
CH3OH
H
OAc
AcO
CH2OAc
CHO
OH
H
Ac2O
H
CN
HO
H
CH2OH
D-глюкоза
H
CN
OH
HO
CH2OH
NOH
H
H
OH
H
OH
CH2OH
D-арабиноза
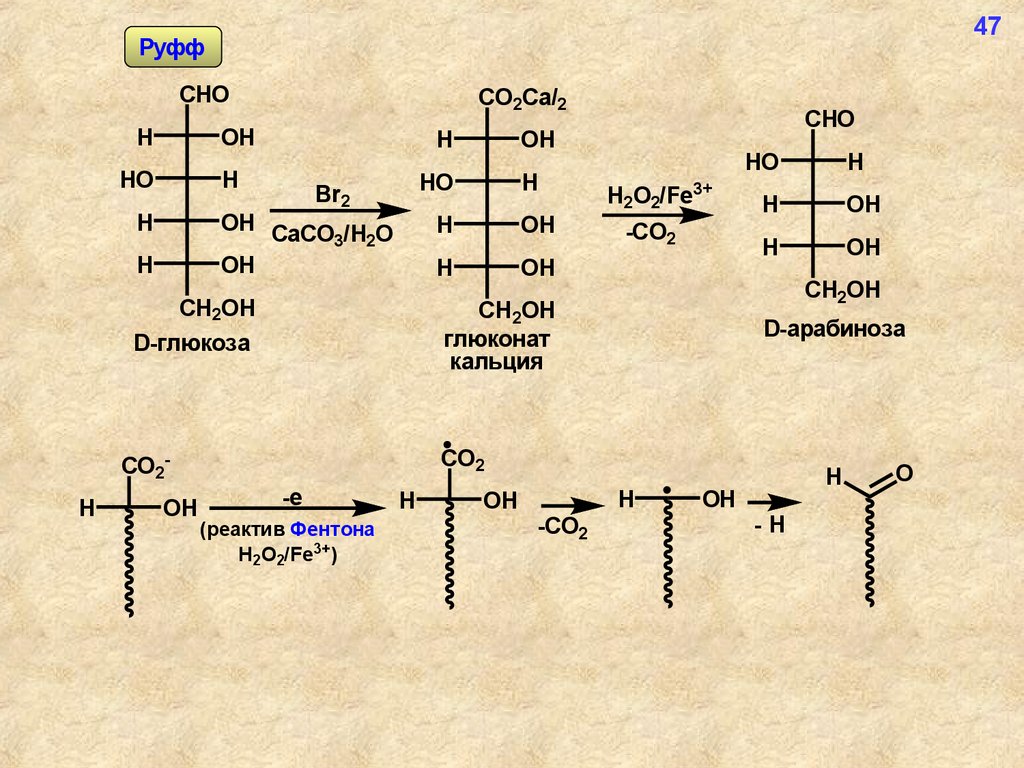
47.
47Руфф
CHO
H
CO2Ca/2
OH
HO
H
H
H
HO
Br2
OH CaCO /H O
3 2
OH
H
CH2OH
H
OH
H
OH
H2 O2/Fe3+
-CO2
-e
(реактив Фентона
H2O2/Fe3+)
H
OH
OH
H
OH
CH2OH
D-арабиноза
H
-CO2
H
H
CO2
CO2OH
H
HO
CH2OH
глюконат
кальция
D-глюкоза
H
CHO
OH
H
OH
-H
O
48.
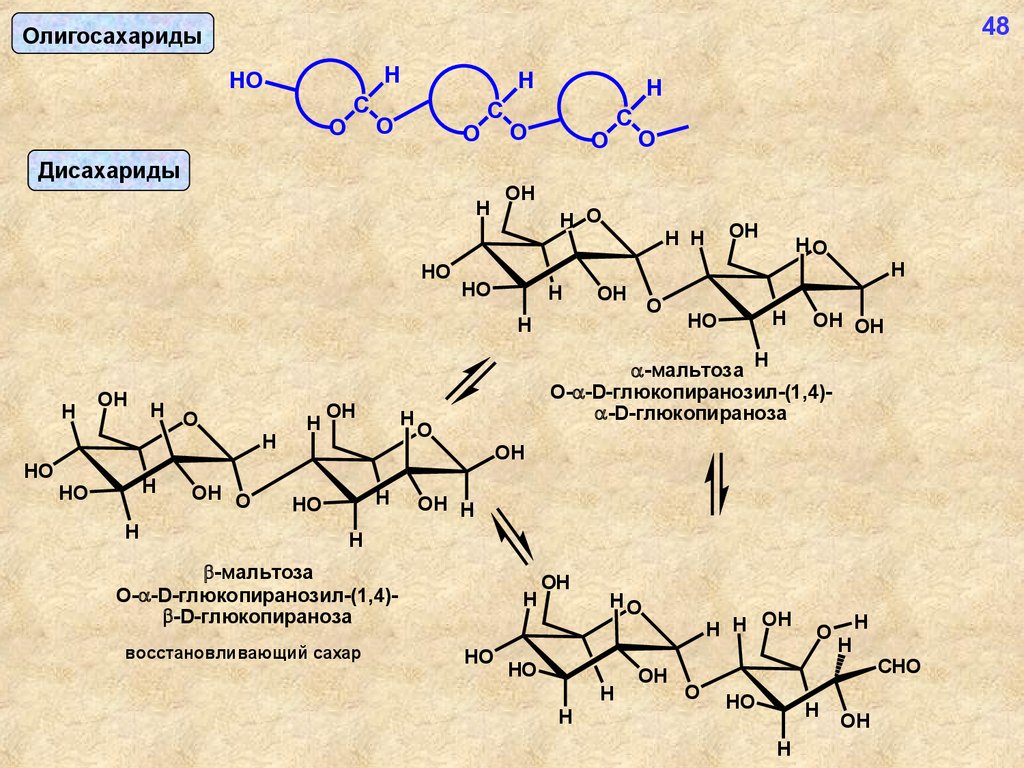
48Олигосахариды
H
HO
O
C
H
O
O
C
Дисахариды
H
HO
H
O
OH
HO
C
O
O
H O
H
OH
O
H
H
HO
OH
H O
H
HO
H
OH O
H
H
OH
H
H
HO
OH
H H
HO
H
HO
H
OH OH
H
-мальтоза
О- -D-глюкопиранозил-(1,4) -D-глюкопираноза
O
OH
OH H
H
-мальтоза
О- -D-глюкопиранозил-(1,4) -D-глюкопираноза
восстановливающий сахар
H
HO
OH
HO
HO
H
H
OH
OH
H H
O
HO
O
H
H
H
H
OH
CHO
49.
OH OHH
H O
H
HO
O
H
H
H O
OH HO
H HO
H
H
H
OH
H
OH OH
OH
H
HO
H
OH H
H
OH H
-целлобиоза
О- -D-глюкопиранозил-(1,4) -D-глюкопираноза
восстанавливающие сахара
H O
H
H
HO
HO
гентиобиоза - О- -D-глюкопиранозил(1,6)
- -D-глюкопираноза
H
O
HO
HO
OH
H
H
HO
HO
49
OH
O
H
OH OH
H O
OH HO
H HO
амигдалин
H
H
OH
H
CN
H3O+
OCHC6H5
-PhCHO
-HCN
H O
H
HO
OH
H
H
OH
H
50.
OH OHH O
H
HO
H
50
H OH
H O
O
HO
OH
H
H
H
OH
H
OH
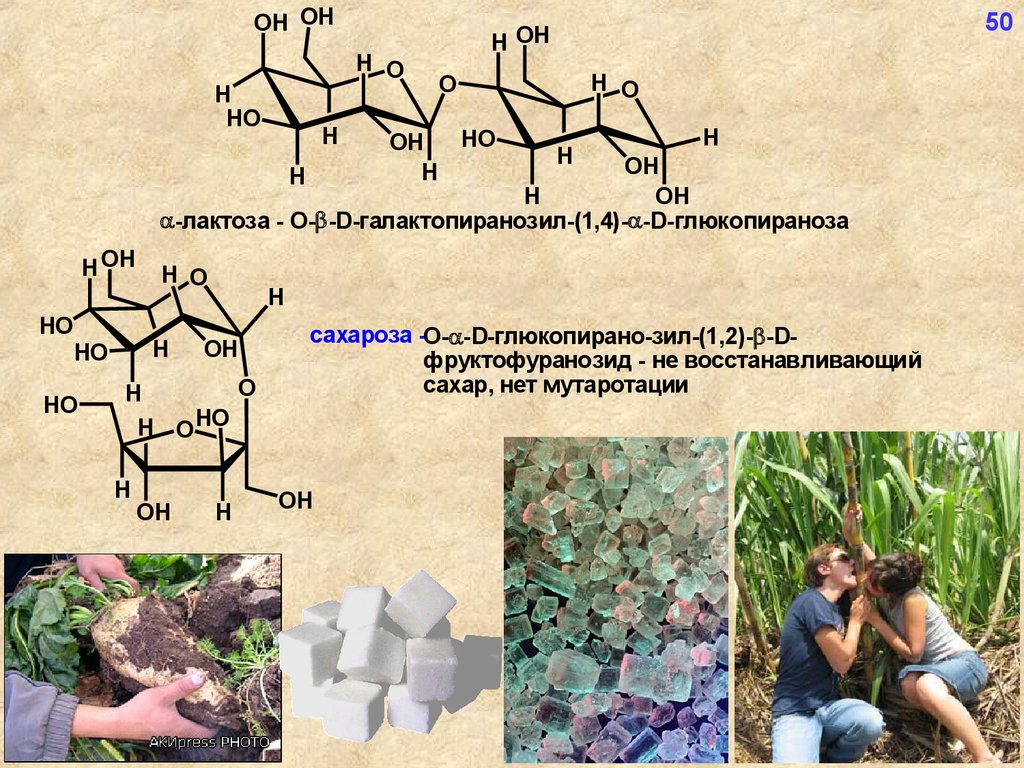
-лактоза - О- -D-галактопиранозил-(1,4)- -D-глюкопираноза
H
H OH
HO
H
HO
HO
H O
H
OH
O
H
H O HO
H
OH
H
сахароза -О- -D-глюкопирано-зил-(1,2)- -Dфруктофуранозид - не восстанавливающий
сахар, нет мутаротации
OH
51.
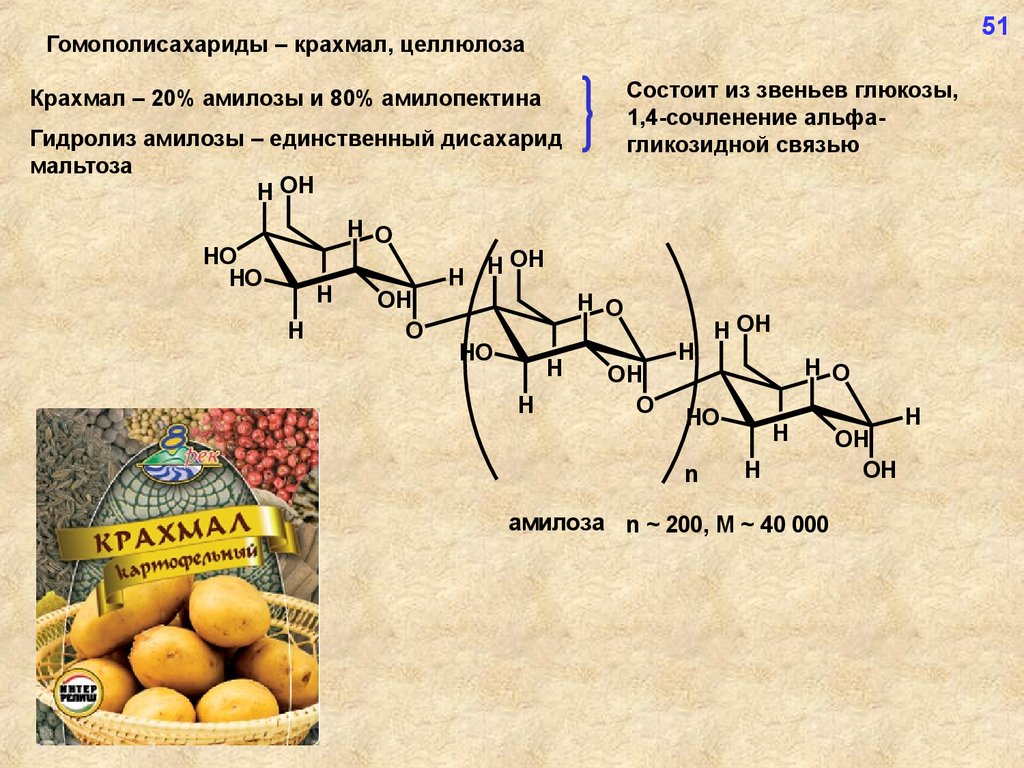
51Гомополисахариды – крахмал, целлюлоза
Состоит из звеньев глюкозы,
1,4-сочленение альфагликозидной связью
Крахмал – 20% амилозы и 80% амилопектина
Гидролиз амилозы – единственный дисахарид
мальтоза
H OH
H O
HO
HO
H
H
OH
O
H
H OH
H O
HO
H
H
OH
O
H
H OH
H O
HO
n
H
H
амилоза n ~ 200, M ~ 40 000
OH
OH
H
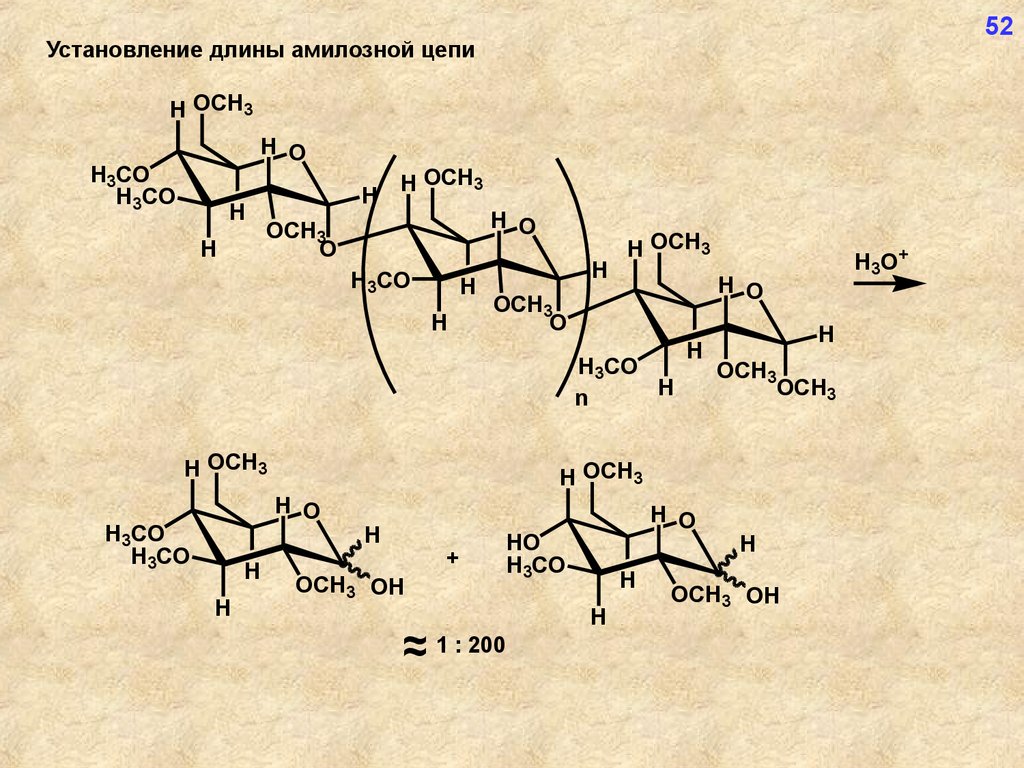
52.
52Установление длины амилозной цепи
H OCH3
H O
H3CO
H3CO
H
H
H
H OCH3
H O
OCH3
O
H3CO
H
H
H
H OCH3
H O
OCH3
O
H3CO
H
n
H OCH3
H3CO
H3CO
H
H
H
H
OCH3
OCH3
H OCH3
H O
H
+
OCH3 OH
~
~ 1 : 200
H O
HO
H3CO
H
H
H3O+
H
OCH3 OH
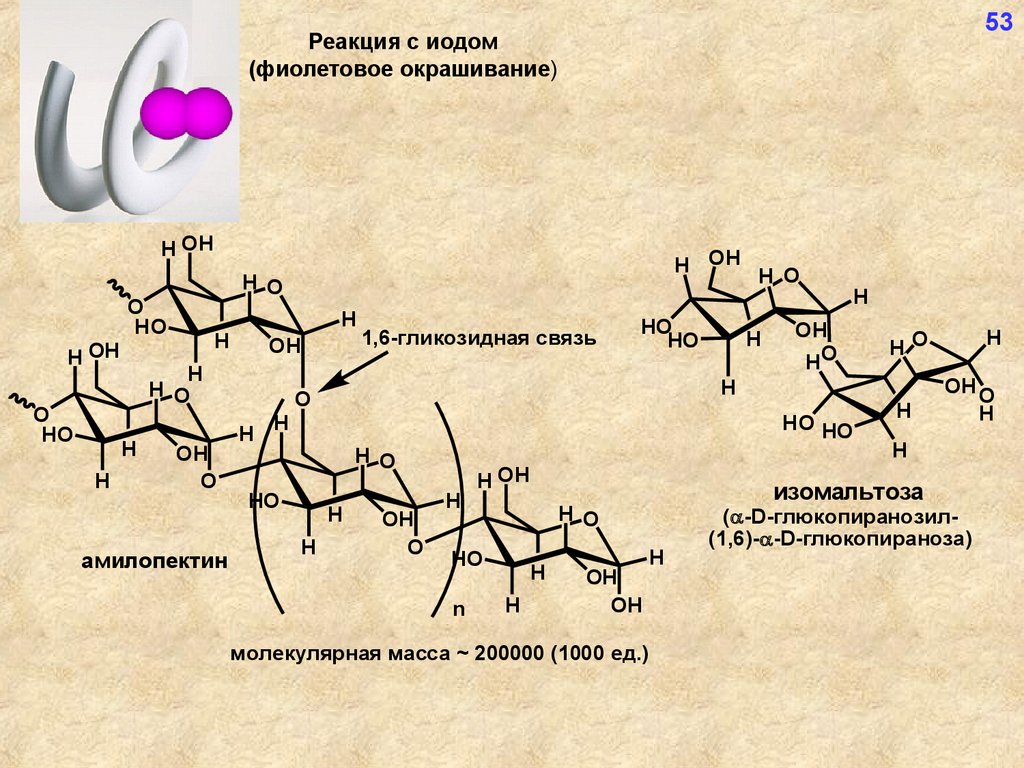
53.
53Реакция с иодом
(фиолетовое окрашивание)
H OH
H OH
O
HO
H
H O
O
HO
H
H
OH
H
H O
H
H OH
OH
O
амилопектин
H H
1,6-гликозидная связь
HO
HO
OH
HO
HO HO
H O
H
H
H
H
H
O
HO
H O
OH
O
H
H OH
HO
n
H
H
OH
OH
молекулярная масса ~ 200000 (1000 ед.)
H
H
OH O
H
H
изомальтоза
H O
H
HO
( -D-глюкопиранозил(1,6)- -D-глюкопираноза)
54.
гидролизамилопектин
54
декстрины (олигосахариды)
гликоген – аналог амилопектина
с более разветвленной цепью
H OH
H OH
H O
HO
HO
H
H
OH
H
H OH
H O
O
HO
H
H
OH
H
öåëëþ ëî çà
O
n
H O
HO
H
H
OH
H
OH
Гомополимер, состоящий из глюкозных субъединиц, соединенных
бета-гликозидной связью
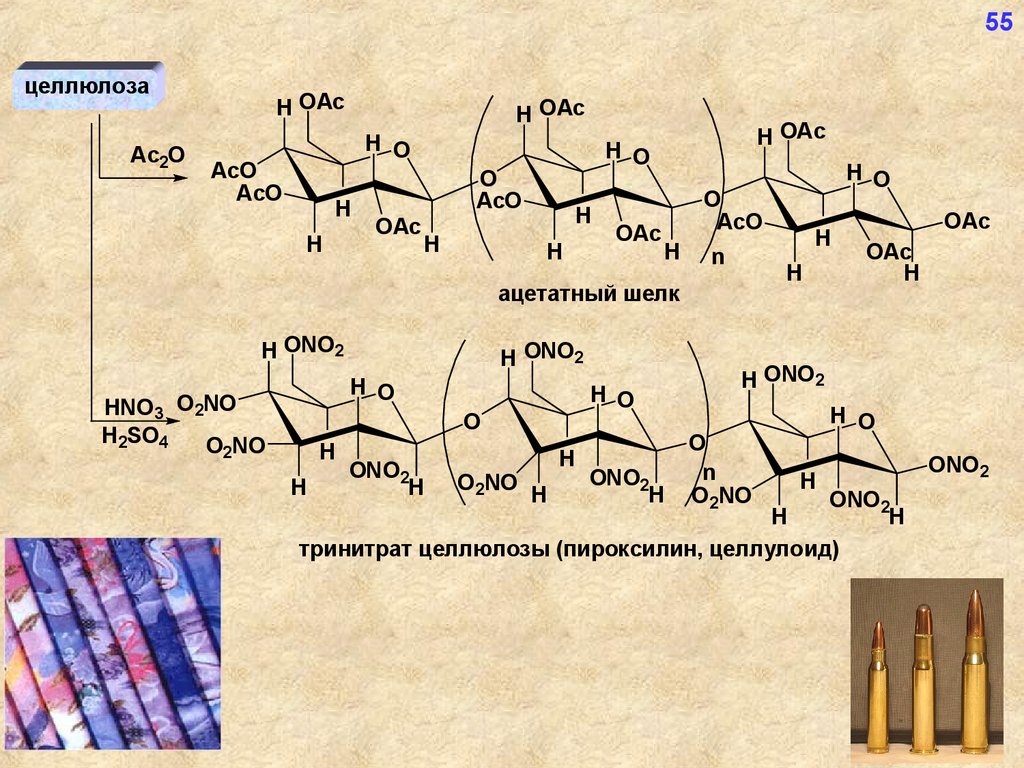
55.
55целлюлоза
Ac2O
H OAc
H OAc
H O
AcO
AcO
H
H
O
AcO
OAc
H
H OAc
H O
H
H
OAc
O
AcO
H
n
H ONO2
H O
HNO3 O2NO
H2SO4
O2NO
H O
O
H
H
ONO2
H
O2NO
H
H
ONO2
H
H
H
ацетатный шелк
H ONO2
H O
OAc
OAc
H
H ONO2
O
n
O2NO
H O
H
ONO2
H
H
тринитрат целлюлозы (пироксилин, целлулоид)
ONO2
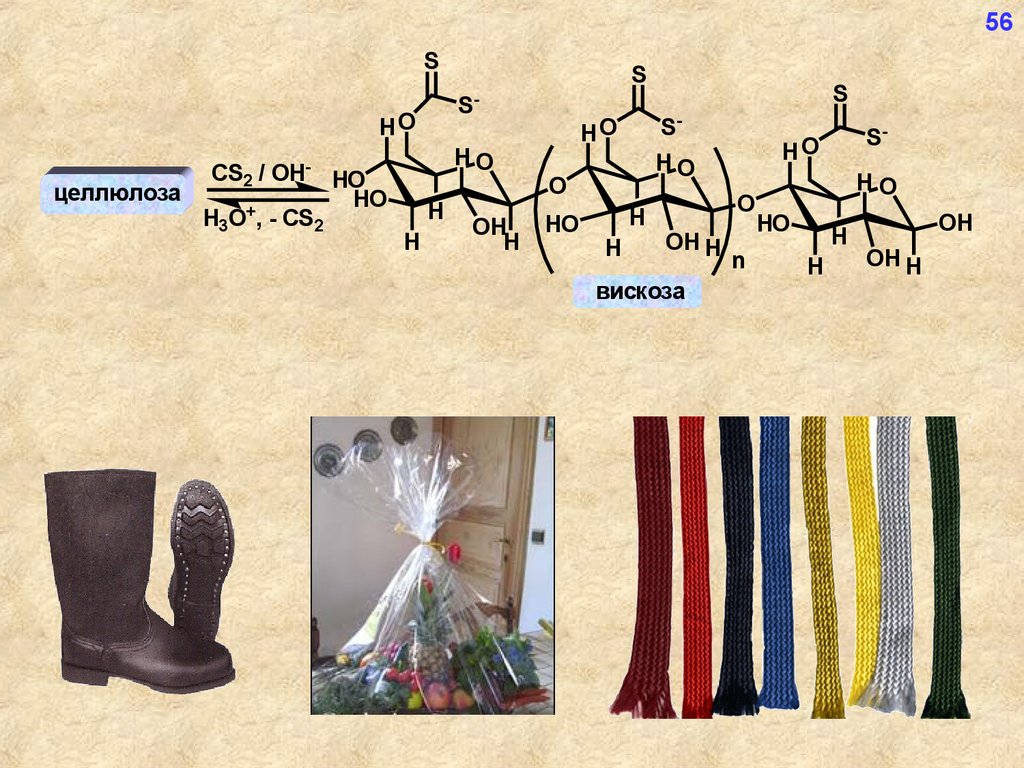
56.
56S
S-
HO
CS2 / OH- HO
целлюлоза
HO
H3 O+, - CS2
S
HO
H
H
OH
H
S-
HO
H
H
O
OH H
вискоза
S-
HO
HO
O
HO
S
n
HO
HO
H
H
OH
OH H
57.
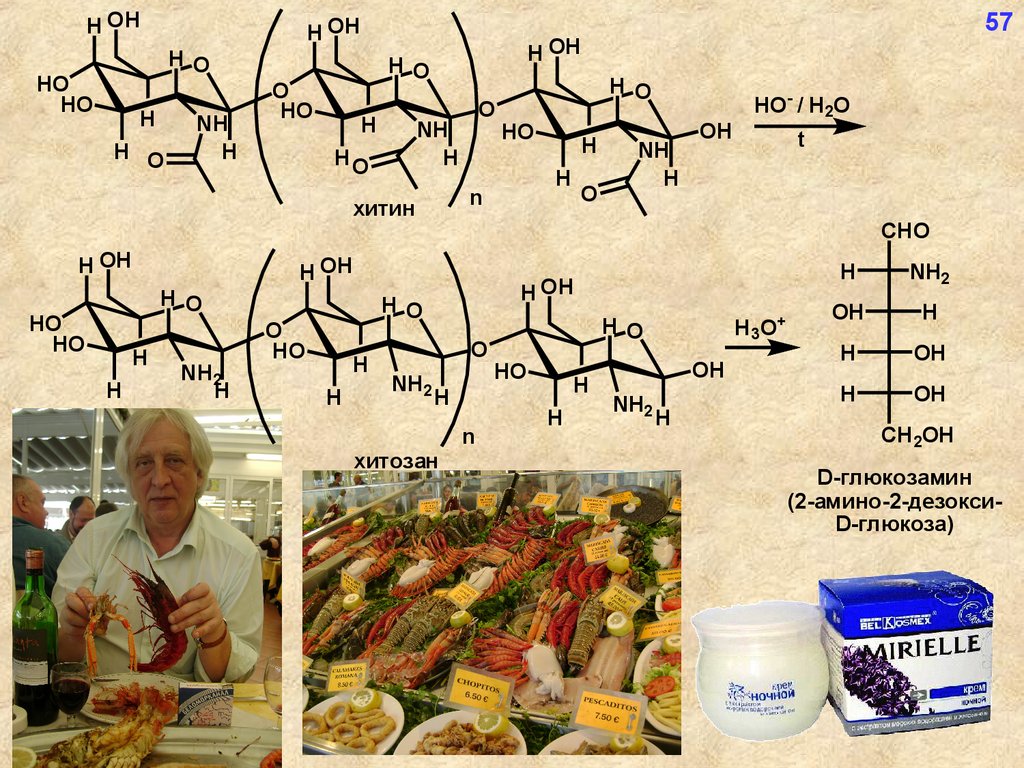
H OHH OH
HO
HO
HO
H
H O
NH
H
H OH
HO
O
HO
H
HO
HO
H
H
NH2
H
H
H
O
NH2
H
H
O
NH
H
OH
t
H OH
HO
O
HO
HO
HO- / H2O
CHO
H OH
H O
H O
n
хитин
H OH
O
NH
H
HO
57
H
хитозан
n
H3O+
HO
HO
H
H
OH
NH2
H
H
NH2
OH
H
H
OH
H
OH
CH2OH
D-глюкозамин
(2-амино-2-дезоксиD-глюкоза)
58.
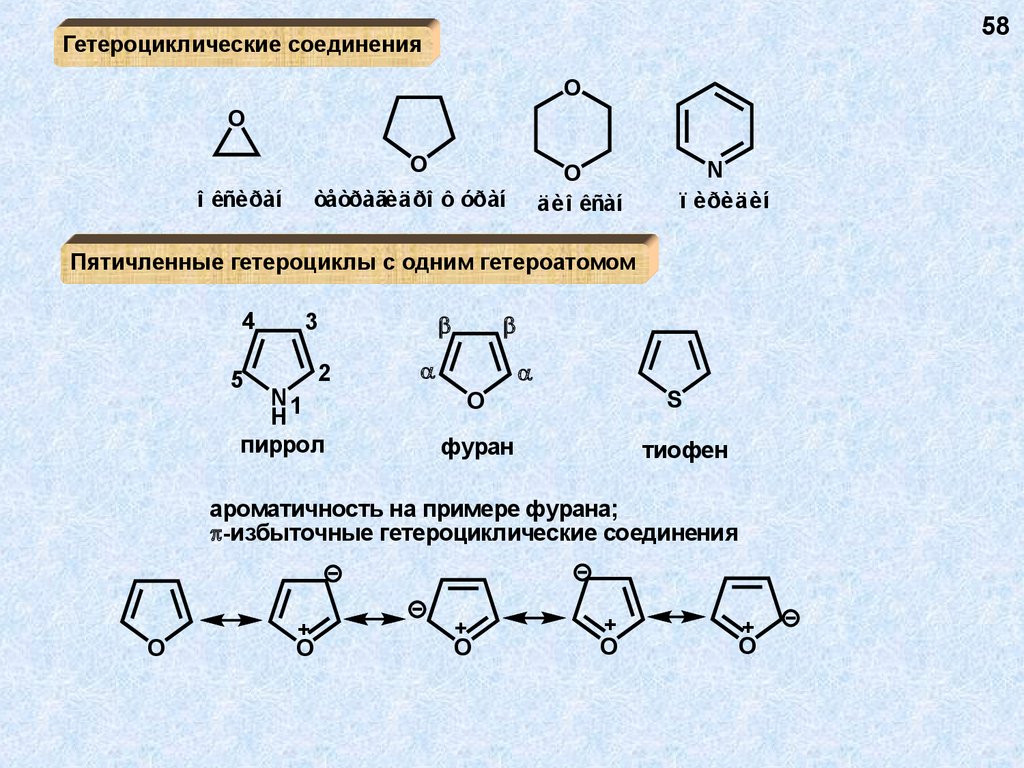
58Гетероциклические соединения
O
O
O
î êñèðàí
O
äèî êñàí
òåòðàãèäðî ô óðàí
N
ï èðèäèí
Пятичленные гетероциклы с одним гетероатомом
4
3
2
5
N1
H
пиррол
S
O
фуран
тиофен
ароматичность на примере фурана;
-избыточные гетероциклические соединения
O
+
O
+
O
+
O
+
O
59.
59Методы синтеза
Пааль-Кнорр
H+
O
R
R
O
H
R
t
O
O
P2S5
R
R
O
N
H
R
R
N
H
R
S
O
R
R
OH
R
R
R
-H2 O
HO
O
t
H+
R
OH
NH2
R
O
150
R
(NH4)2CO3
OH
полифосфорная
кислота
H+
S
± H+
+ OH -H2O
R
R
S
R
R
60.
60Юрьев
O
H2O
NH3
H2S
Al2O3 H2O
400о
H2S
N
H
S
NH3
Те же превращения возможны и для полностью гидрированных производных
OH
NH3
N
H
HO
-CO2, -H2O
HO
CO2H CO2
t
CO2H -H2O
CO2H - CO2
O
Cu, хинолин
OH
слизевая
кислота
O
пирослизевая
кислота
61.
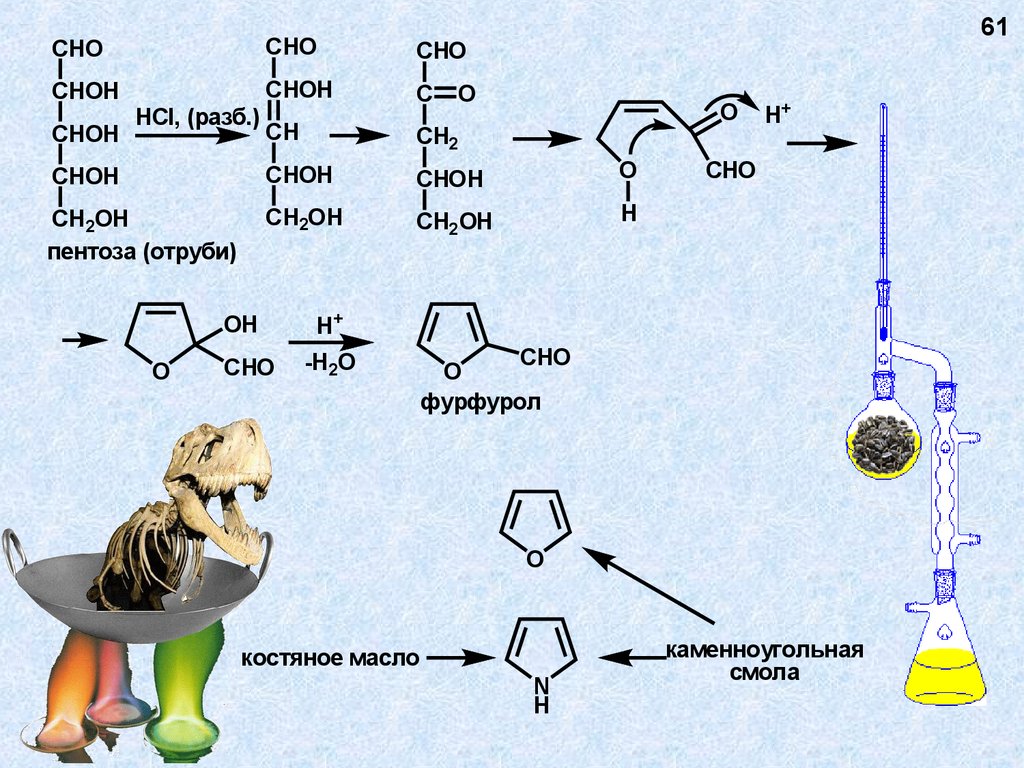
61CHO
CHO
CHO
CHOH
CHOH
C
CH
CH2
CHOH
CHOH
CHOH
O
CH2OH
пентоза (отруби)
CH2OH
CH2 OH
H
CHOH
HCl, (разб.)
OH
O
CHO
O
O
H+
CHO
H+
-H2O
CHO
O
фурфурол
O
костяное масло
N
H
каменноугольная
смола
62.
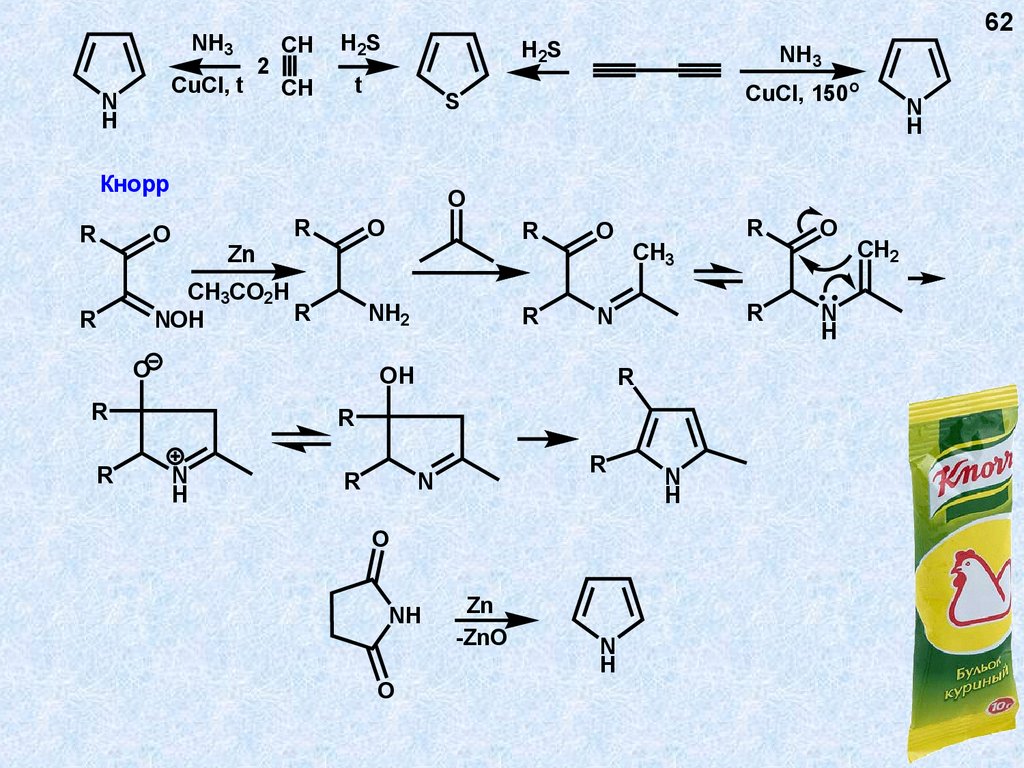
NH3CuCl, t
N
H
2
CH
H2S
CH
t
62
H2S
CuCl, 150o
S
Кнорр
O
R
R
O
R
CH3CO2H
R
NOH
O
R
O
NH2
R
N
Zn
O
OH
R
R
NH3
CH3
R
R
N
H
R
R
N
O
NH
O
Zn
-ZnO
N
H
N
H
R
O
R
N
H
CH2
N
H
63.
63S
S
S
-H2S
-H2S
-H2S
R
S
S
R
CO2Na
R
P2S3
R
CO2Na
S
Свойства
Реакции с электрофильными реагентами
H
+
N
H
H
H+
H
+
N
N
H
H
+
N
H
H
H
H
N
H
H
и т.д.
S
64.
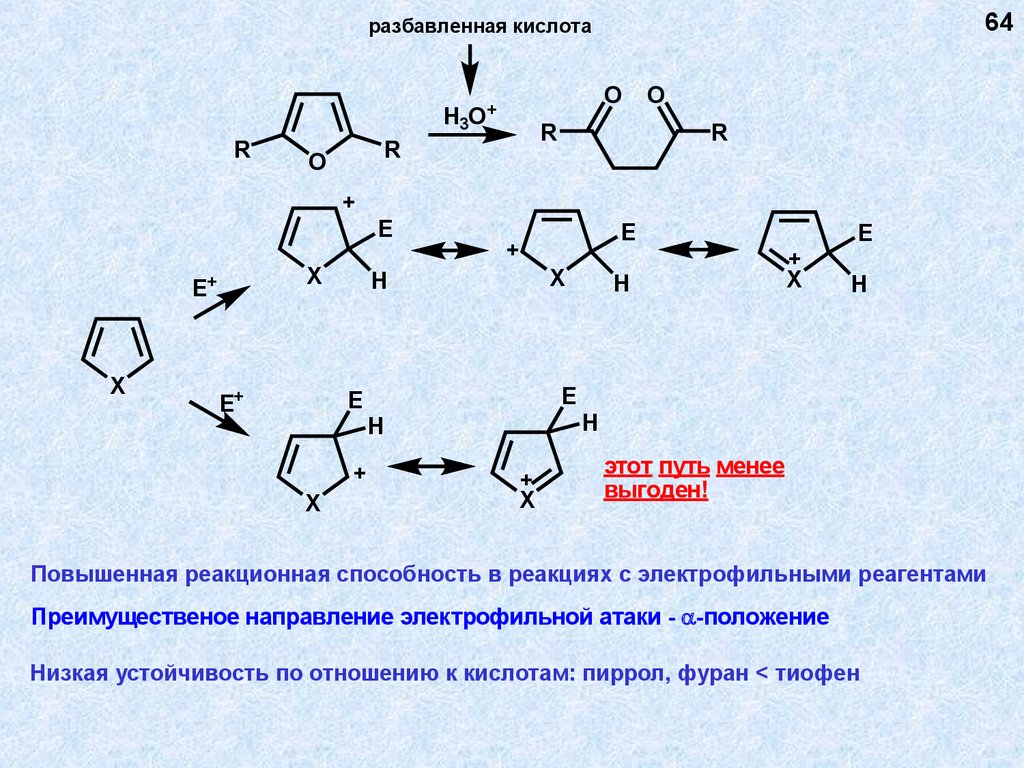
64разбавленная кислота
O
H3O+
R
R
R
O
O
R
+
E
X
E+
X
E+
X
H
H
H
H
X
H
+
X
E
E
E
+
E
+
+
X
этот путь менее
выгоден!
Повышенная реакционная способность в реакциях с электрофильными реагентами
Преимущественое направление электрофильной атаки - -положение
Низкая устойчивость по отношению к кислотам: пиррол, фуран < тиофен
65.
65O
+
N SO3-
ONO2
NO2
X
X
X = S, NH
O
X = O, NH
SO3H
X
ONO2
X=O
AcO-
H
O2N
O
H
H
O2N
O
H
OAc пиридин
t
O
NO2
66.
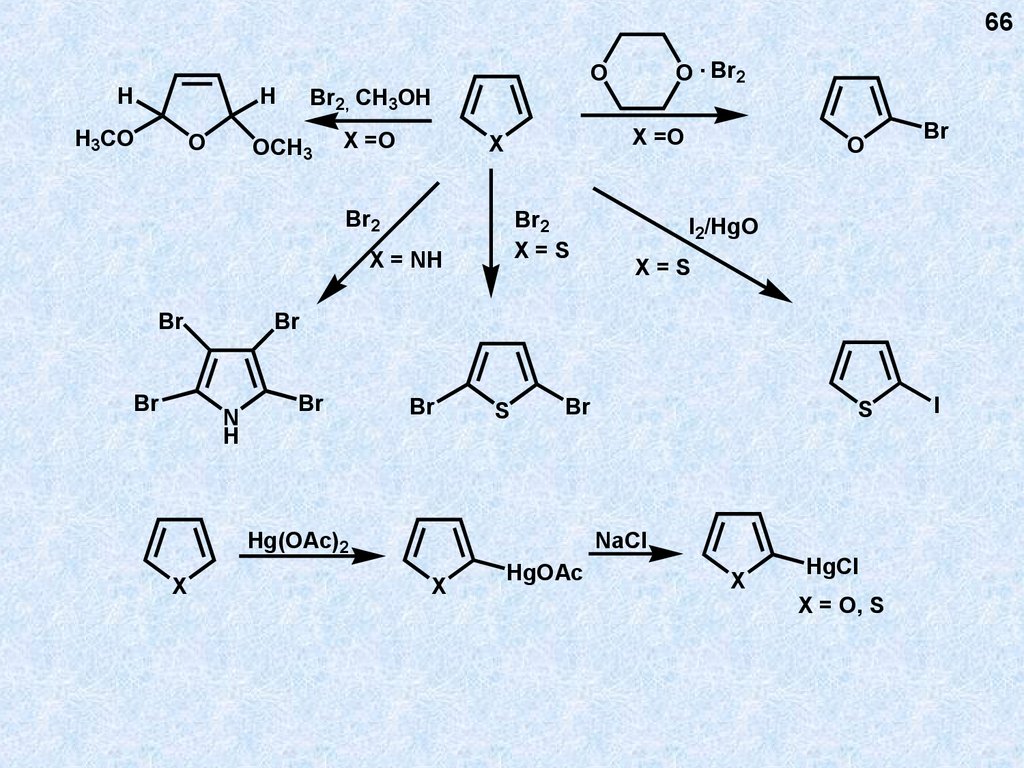
66H
H
H3CO
O
Br2, CH3OH
OCH3
X =O
X =O
X
Br2
Br2
X=S
X = NH
Br
Br
O
Br
I2/HgO
X=S
Br
N
H
Br
Br
S
Br
Hg(OAc)2
X
O . Br2
O
S
NaCl
X
HgOAc
X
HgCl
X = O, S
I
67.
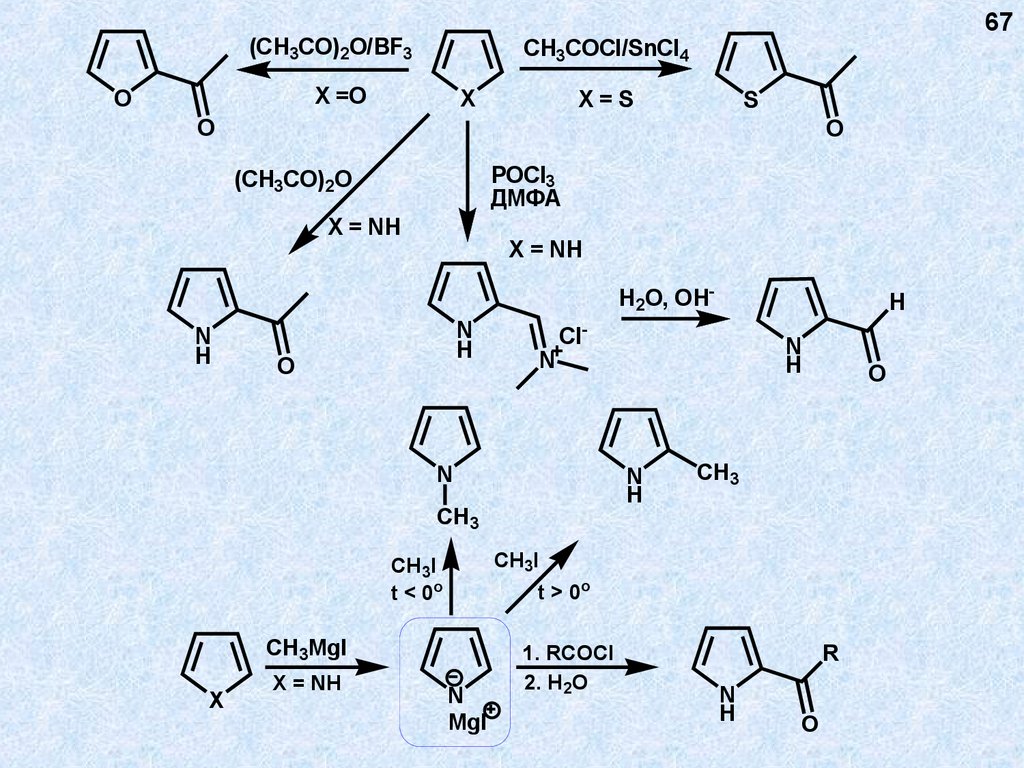
(CH3CO)2O/BF3CH3COCl/SnCl4
X =O
O
67
X
X=S
S
O
O
POCl3
ДМФА
(CH3CO)2O
X = NH
X = NH
H2O, OH-
N
H
N
H
O
ClN+
N
O
CH3
CH3I
CH3I
t < 0o
t > 0o
CH3MgI
X = NH
N
H
N
H
CH3
X
H
N
MgI
1. RCOCl
2. H2O
R
N
H
O
68.
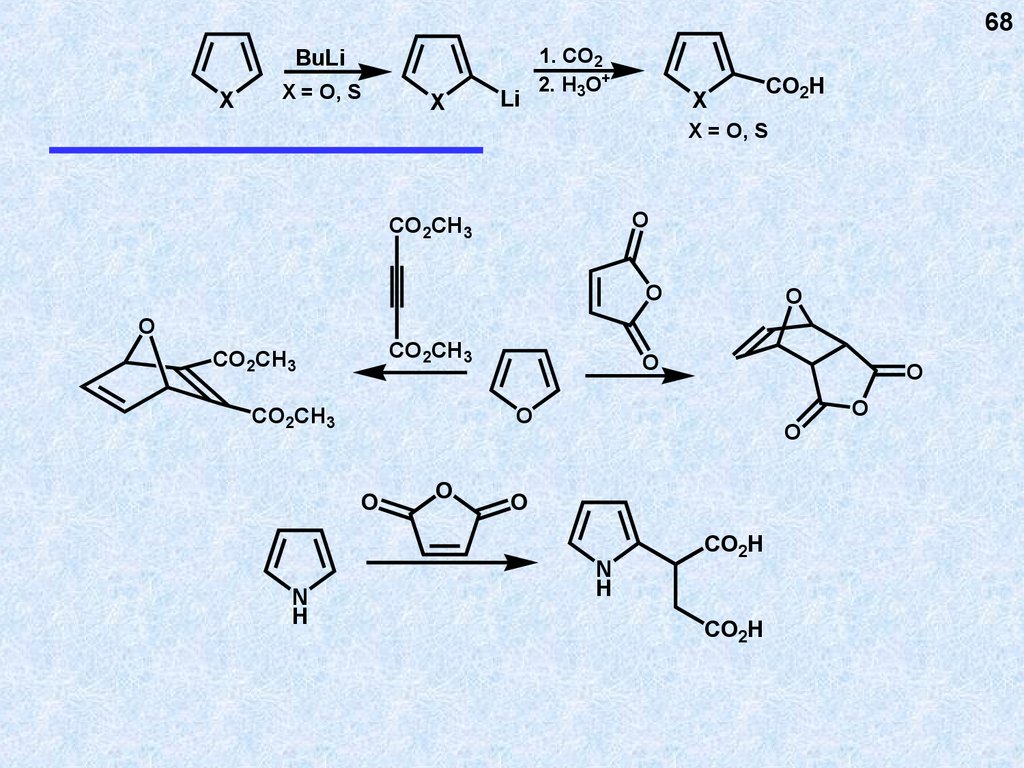
68BuLi
X
X = O, S
X
Li
1. CO2
2. H3O+
X
CO2H
X = O, S
O
CO2CH3
O
O
CO2CH3
CO2CH3
CO2CH3
O
O
O
O
N
H
O
O
O
O
N
H
CO2H
CO2H
O
69.
69CO2H
Ph
CO2H
CO2H
N
N
CH2Ph
CH2Ph
+
N
CO2H
CO2H
CO2H
N
H
CH2O
-
OH
N
H
N
H
H+
N
H
OH
FeCl3
HCO2H
N
H
N
пиррометан
N
H
дипиррилметан
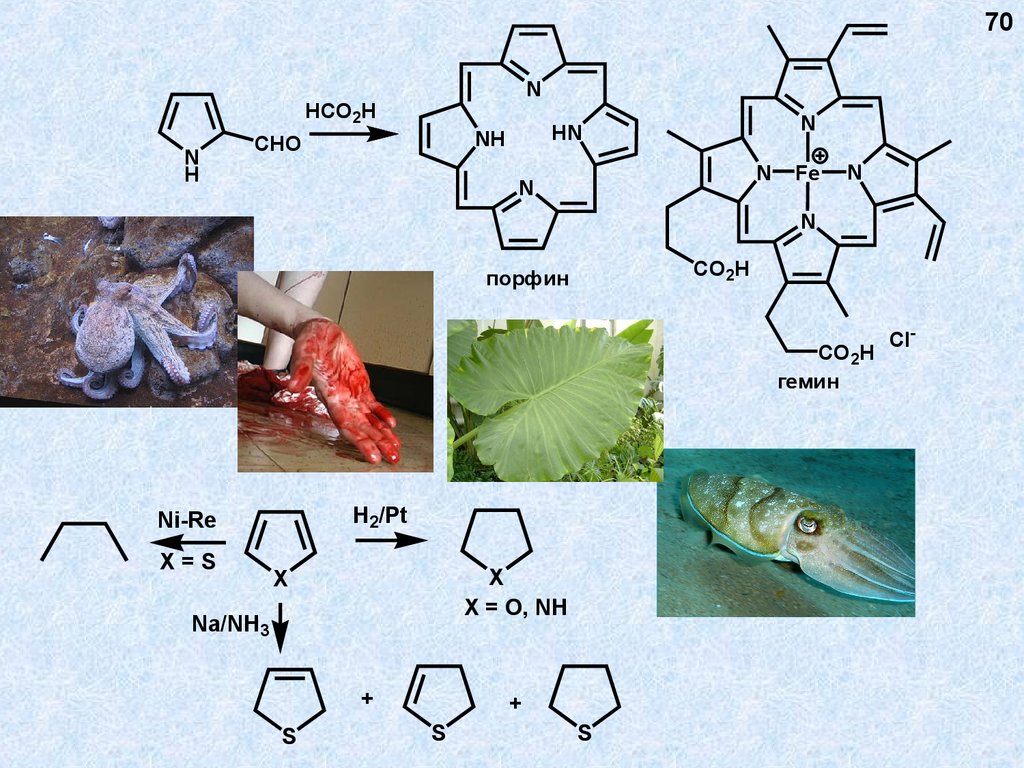
70.
70N
HCO2H
N
H
CHO
N
HN
NH
N
N
Fe
N
N
CO2H
порфин
CO2H
гемин
H2/Pt
Ni-Re
X=S
X
X = O, NH
X
Na/NH3
+
S
+
S
S
Cl-
71.
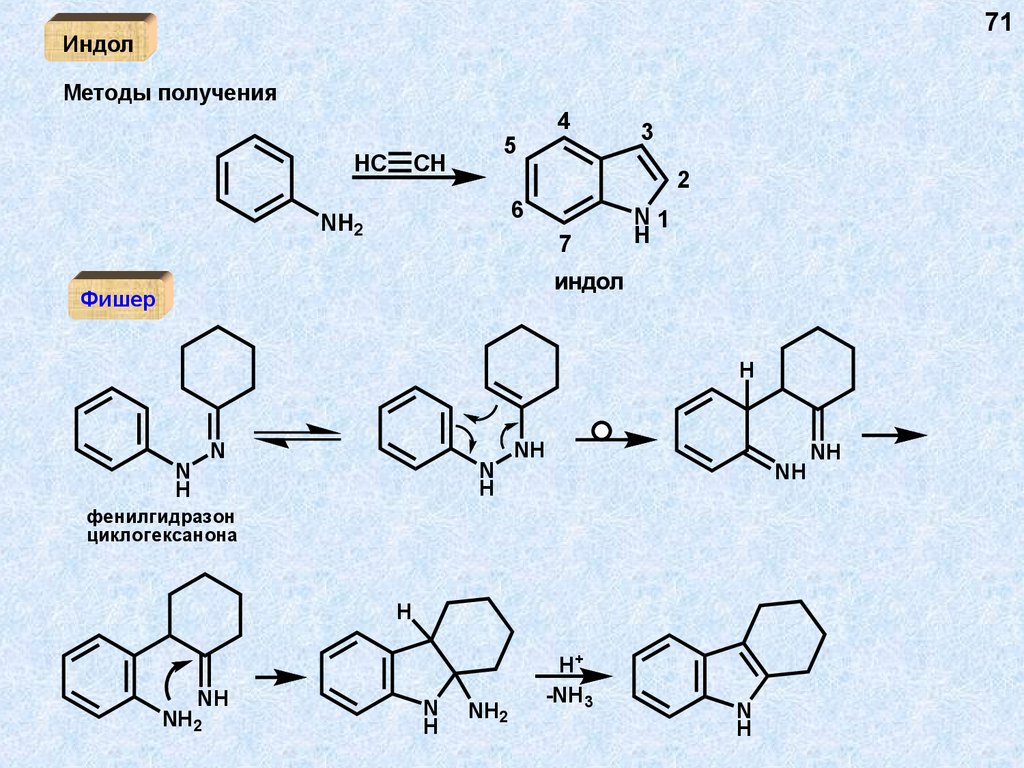
71Индол
Методы получения
HC
4
5
CH
3
2
6
NH2
7
N1
H
индол
Фишер
H
N
H
N
N
H
NH
NH
фенилгидразон
циклогексанона
H
NH
NH2
N
H
NH2
H+
-NH3
N
H
NH
72.
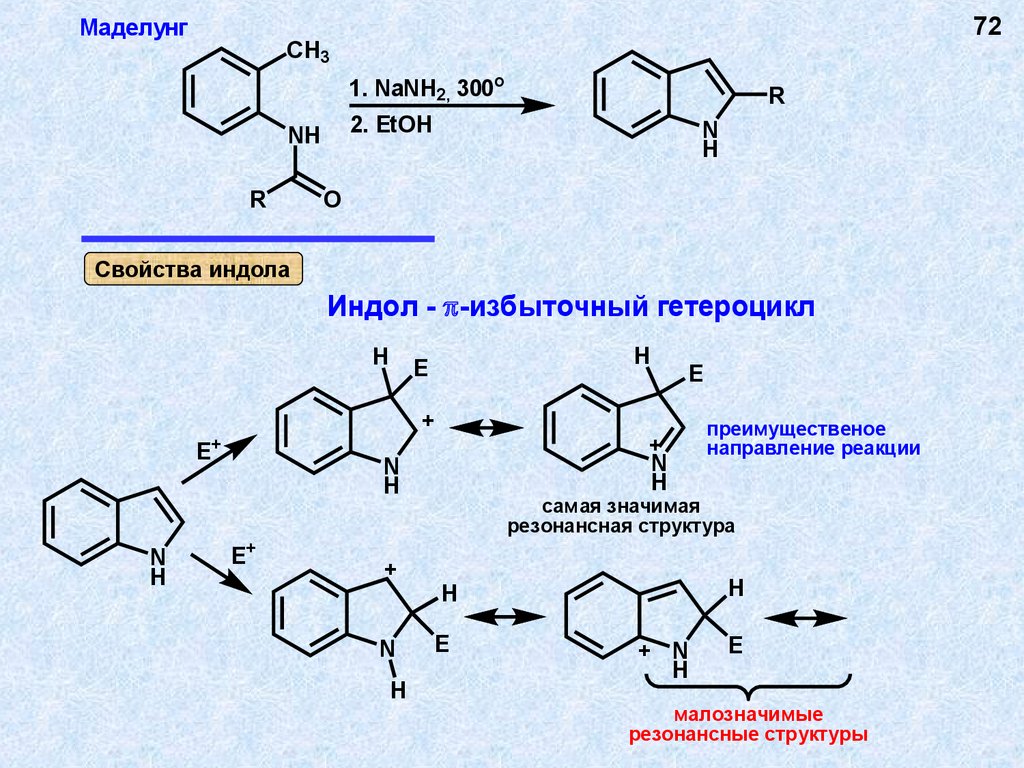
Маделунг72
CH3
1. NaNH2, 300o
2. EtOH
NH
R
R
N
H
O
Свойства индола
Индол - -избыточный гетероцикл
H
H
E
+
E+
N
H
+
N
H
N
H
E+
+
N
H
E
преимущественое
направление реакции
самая значимая
резонансная структура
H
H
E
+ N
H
E
малозначимые
резонансные структуры
73.
73Повышенная реакционная способность в реакциях с электрофильными реагентами
Преимущественое направление электрофильной атаки - положение 3
Низкая устойчивость по отношению к кислотам
CHO
POCl3
ДМФА
N
H
EtO2C
Na+
N
H
N
CH2O
(CH3)2.HCl
N
H
грамин
+
N
RO2C
NH2
NHCOCH3
NHCOCH3
CO2R
EtO2C
N
H
CO2H
H3O+
N
H
триптофан
74.
CO2EtCO2Et
EtO2C
RONO
-
EtO
Na+
NHCOCH3
CO2Et
HON
CO2Et
RX
EtO2C
Zn
AcOH/Ac2O
EtO2C
EtO2C
R
NHCOCH3
H
N
0o
EtO-
NHCOCH3
EtO2C
RX
74
EtO2C
H3O
t
NH2
+
CH2CO2
R
CO2H
H
CH2CO2
ClCH2CO2N
R
N
N
CO2H
CO2
N
H
N
H
гетероауксин
75.
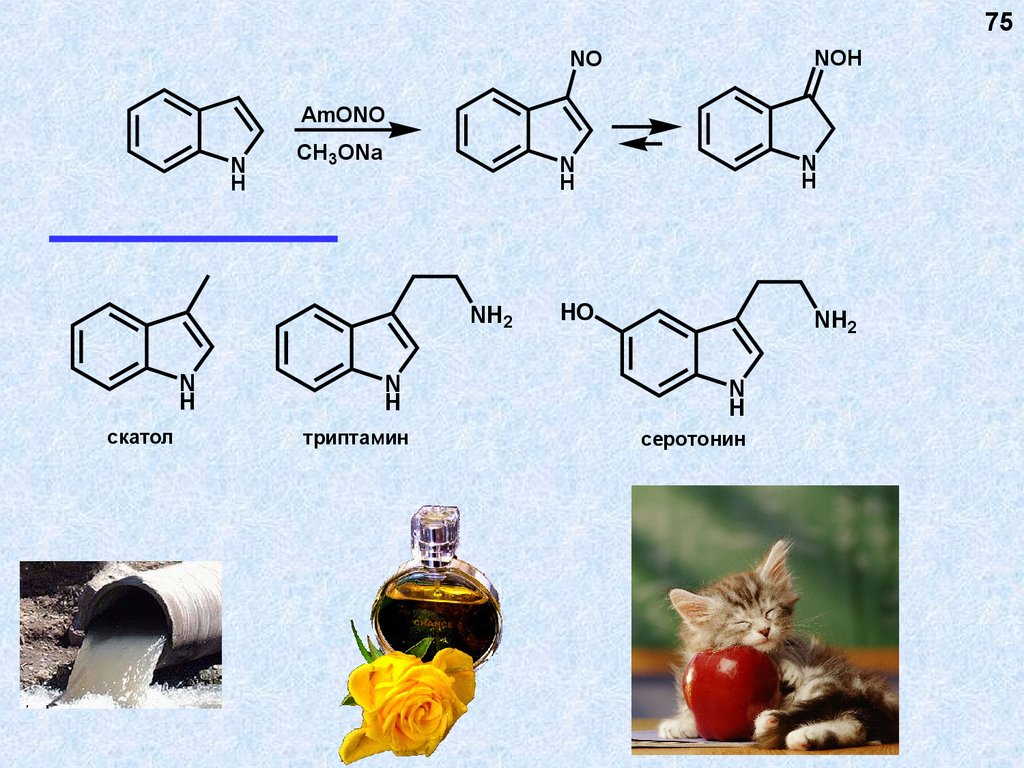
75NOH
NO
AmONO
N
H
CH3ONa
NH2
N
H
скатол
N
H
N
H
N
H
триптамин
HO
NH2
N
H
серотонин
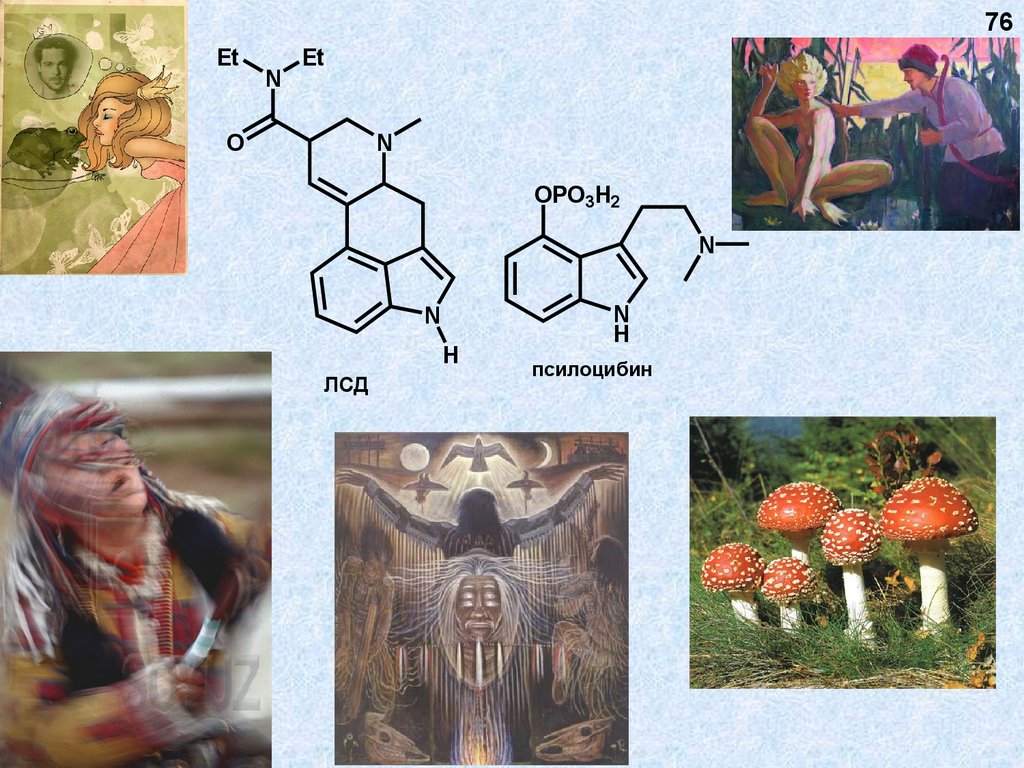
76.
76Et
N
Et
O
N
OPO3H2
N
N
H
ЛСД
N
H
псилоцибин
77.
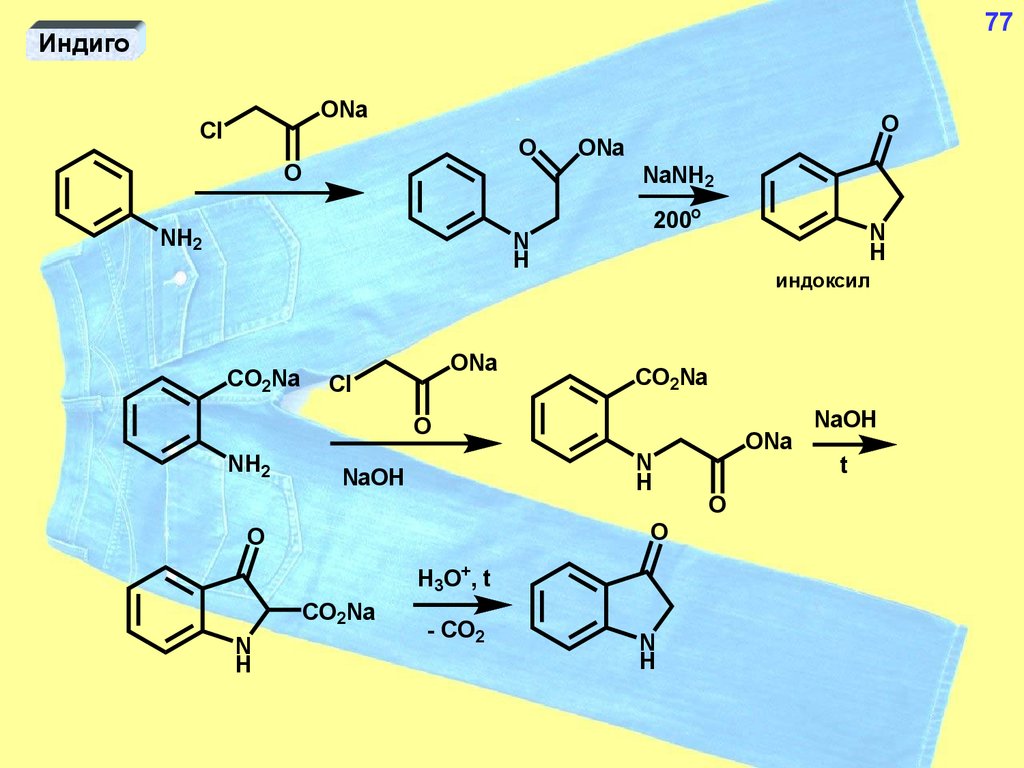
77Индиго
ONa
Cl
O
O
O
ONa
NaNH2
NH2
200o
N
H
CO2Na
ONa
Cl
N
H
индоксил
CO2Na
O
NH2
N
H
NaOH
O
O
H3O+, t
CO2Na
N
H
- CO2
N
H
ONa
O
NaOH
t
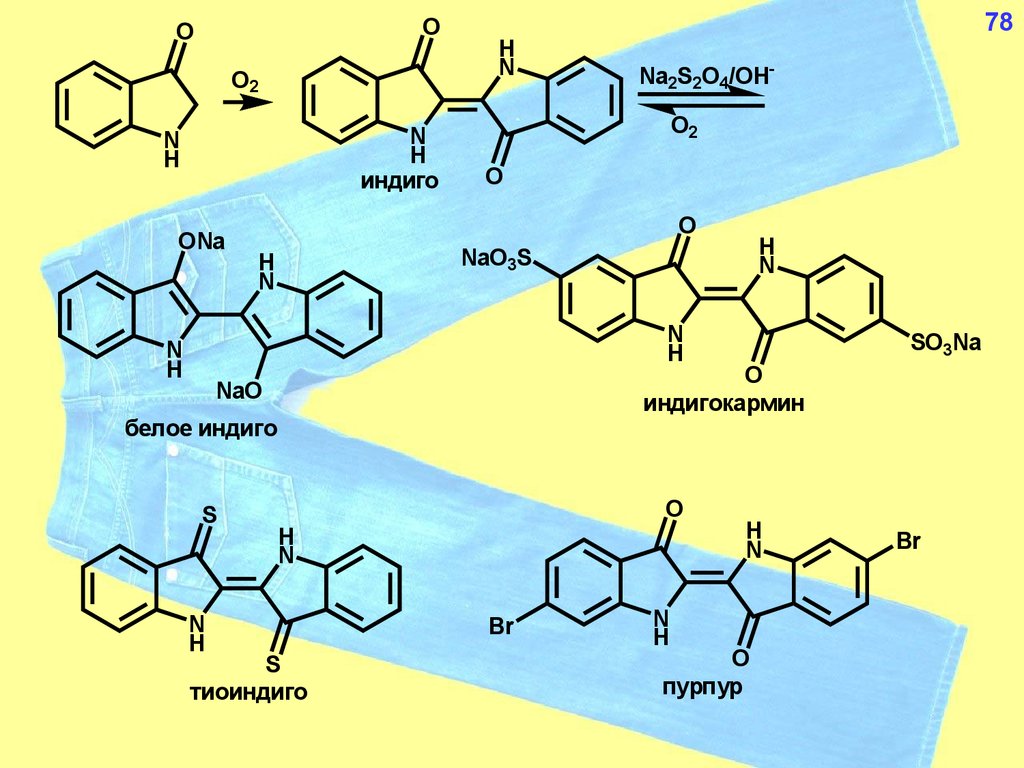
78.
OO
O2
N
H
индиго
N
H
ONa
H
N
78
Na2S2O4/OHO2
O
O
H
N
NaO3S
H
N
N
H
N
H
O
индигокармин
NaO
белое индиго
S
N
H
SO3Na
O
H
N
S
тиоиндиго
Br
N
H
H
N
O
пурпур
Br
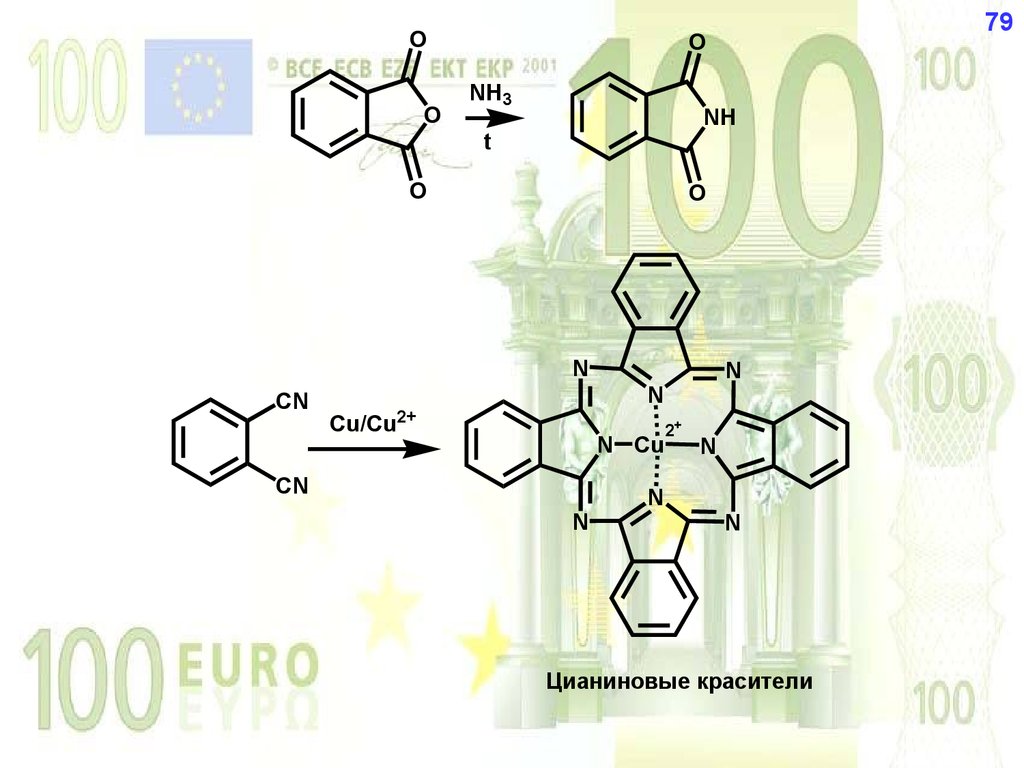
79.
OO
NH3
NH
t
O
O
N
CN
79
O
N
N
Cu/Cu2+
N Cu
CN
N
2+
N
N
N
Цианиновые красители
80.
Азолы – пятичленные -избыточные гетероциклыN
N
N
N
H
N
N
H
пиразол
O
имидазол
изоксазол
3
4
N
O
оксазол
N
N
2
5
N1
H
N
H
N
N
H
N
H
N
N
H
N
N
H
атом N1 - донор электронов, атом N3 - акцептор
80
81.
81Методы получения
1,2-Азолы
NH2
N
N
HO
O
NH
NH2NH2
OH
O
O
NH2OH
O
N
N
O
- H2O
- H2O
N
N
H
OH
N
O
82.
ORNHNH2
82
NHR
HN
HN
NR
O
OH
NH2OH
OH
HN
HN
O
Ph
NOH
H
Ph
Br
Br2
NaOH
-H+
NOH
-Br-
O
HN
OH
Ph
NO
NO
H
H
N
- H2O
O
- H2O
Ph
Ph
HN
O
окись бензонитрила
Br2
-Br-
Ph
Br
NO
H
NR
83.
83Реакция 1,3-диполярного циклоприсоединения
R
R
R
N
N
H
H3C
CH2N2
Ph
N
Ph
O
R
O
R
H3C
O
R
N
H3 C
H3C
CH3I
PhNHNH2
HN
CO2Et
N
O
N
Ph
N
OH
H3C
N
O
N
Ph
антипирин
Ph
CH3
H3C
H3C
NO
CH3I
+
HNO2
Zn/H
H3C
N
N
Ph
O
H3C
NH2
H3C
N
N
Ph
O
H3C
N
N
N
CH3
O
Ph
амидопирин
84.
84H3C
H3C
N
N
H3C
SO3Na
H3C
N
CH3 I
N
H3C
O
H
N
H3C
NH2
HOCH2SO3Na
SO3Na
H3C
O
N
O
N
Ph
анальгин
Ph
Ph
N
1,3-Азолы
Синтез, аналогичный синтезу Пааля-Кнорра
N
R
N
H
CH3CO2NH4
R
CH3CO2H
NH
R
R
O
O
N
H2SO4
R
O
R
85.
85Свойства азолов
высокая температура плавления
высокая растворимость в воде
основность, NH-кислотность
N
H
N
N
H
N
N
N
H
N
N
N
H
N
N
H
NH
N
H
N
4(5)-метилимидазол
N H3C
N
N
I
- I-
N
H
N
-H+
N
H
N
H
E
E
X
N
E+
- H+
N
N
X
N
X
N
E+
- H+
E+ = HNO3/H2SO4; H2SO4; Br2
X
86.
86Другие азолы
4
5
3
N
N1
H
4
N
N2
5
1,2,3-триазол
3
N1
H
N2
1,2,4-триазол
Два атома азота, обладающие акцепторными свойствами:
1. Очень низкая реакционная способность в реакциях ароматического
электрофильного замещения
2. Высокая NH-кислотность
3. Основность
RCOCl
HN
N2H4
N
NH
R
R
O
R NH2
R
O
N
R1
R
R
N
RN3
R
R
N
1
N
R
N
R
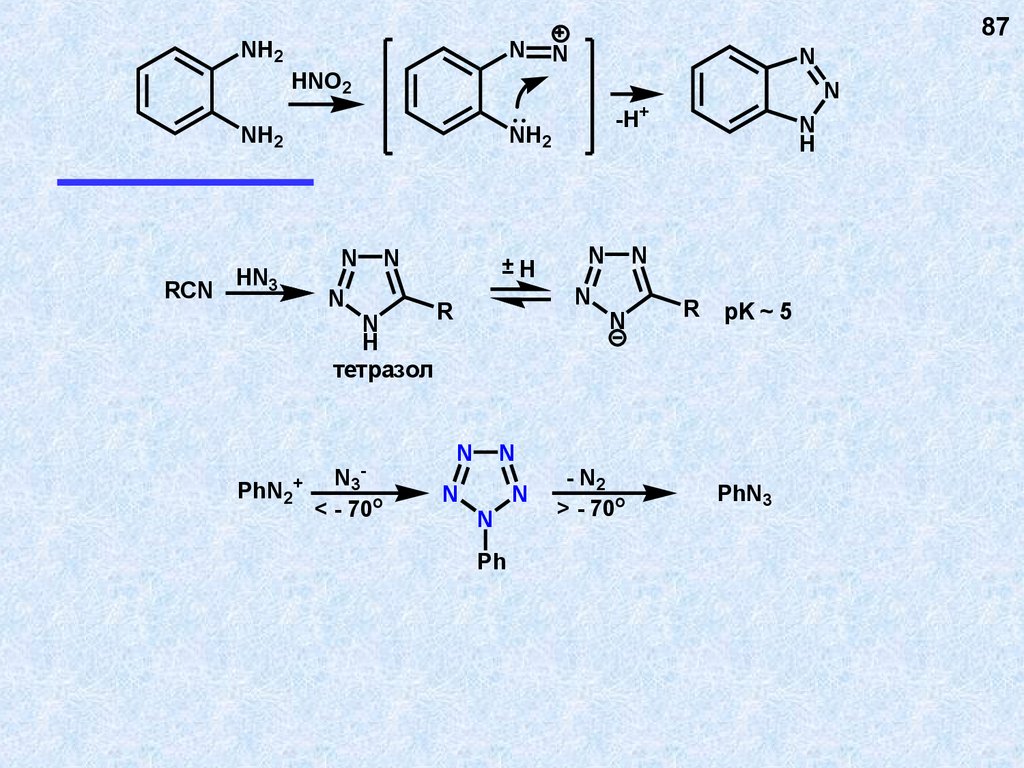
87.
NH2N
87
N
N
HNO2
N
+
NH2
RCN
HN3
N
N
N
N
H
тетразол
PhN2+
-H
NH2
-
N3
< - 70o
±H
N
N
R
N
N
N
N
Ph
N
N
H
N
N
- N2
> - 70o
R
pK ~ 5
PhN3
88.
88Пиридин
Каменноугольная смола
g
4
CH
CH
5
3
b
6
2
a
N1
N
HCN
t
R C N
~ 400o
N
N
R
Промышленные методы синтеза
2 CH3CHO + CH2O
NH3
NH3
CH3CH=CHCHO + CH2O
N
CH3CHO + CH2O
NH3
+
+
N
N
метилпиридины - пиколины
N
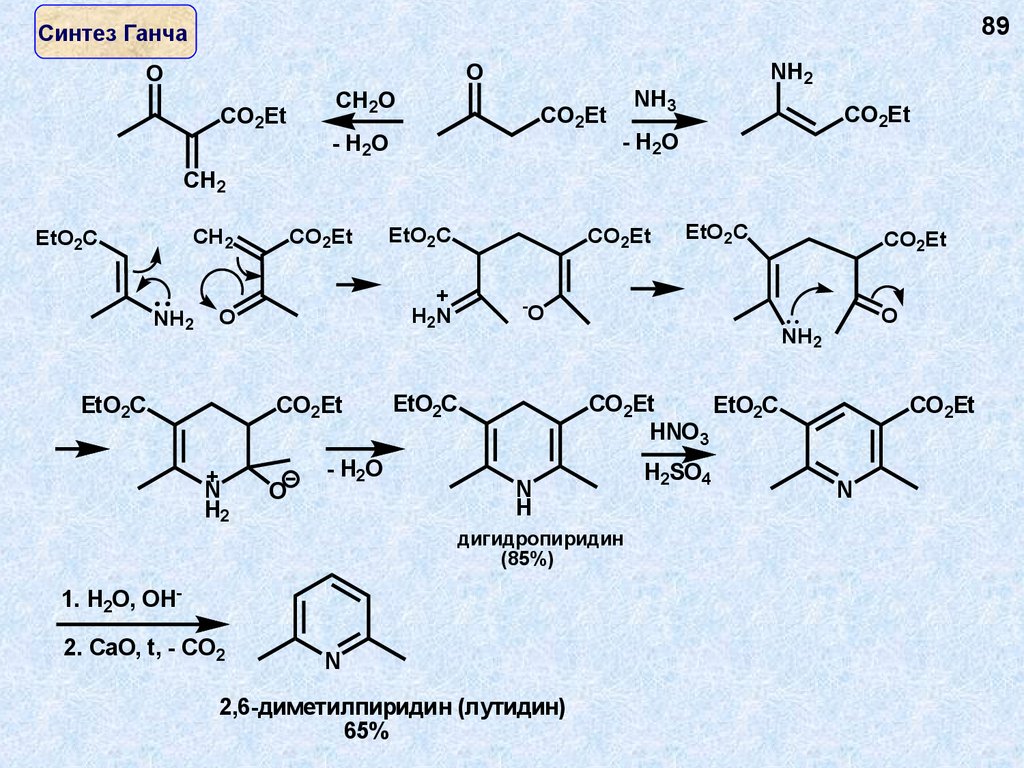
89.
89Синтез Ганча
NH2
O
O
CO2Et
CH2O
CO2Et
- H2O
NH3
CO2Et
- H2O
CH2
CO2Et
CH2
EtO2C
NH2
CO2Et
+
N
H2
CO2Et
+
H2N
O
EtO2C
EtO2C
O
- H2O
-
O
EtO2C
CO2Et
O
NH2
CO2Et
EtO2C
HNO3
N
H
дигидропиридин
(85%)
1. H2O, OH2. CaO, t, - CO2
EtO2C
N
2,6-диметилпиридин (лутидин)
65%
H2SO4
CO2Et
N
90.
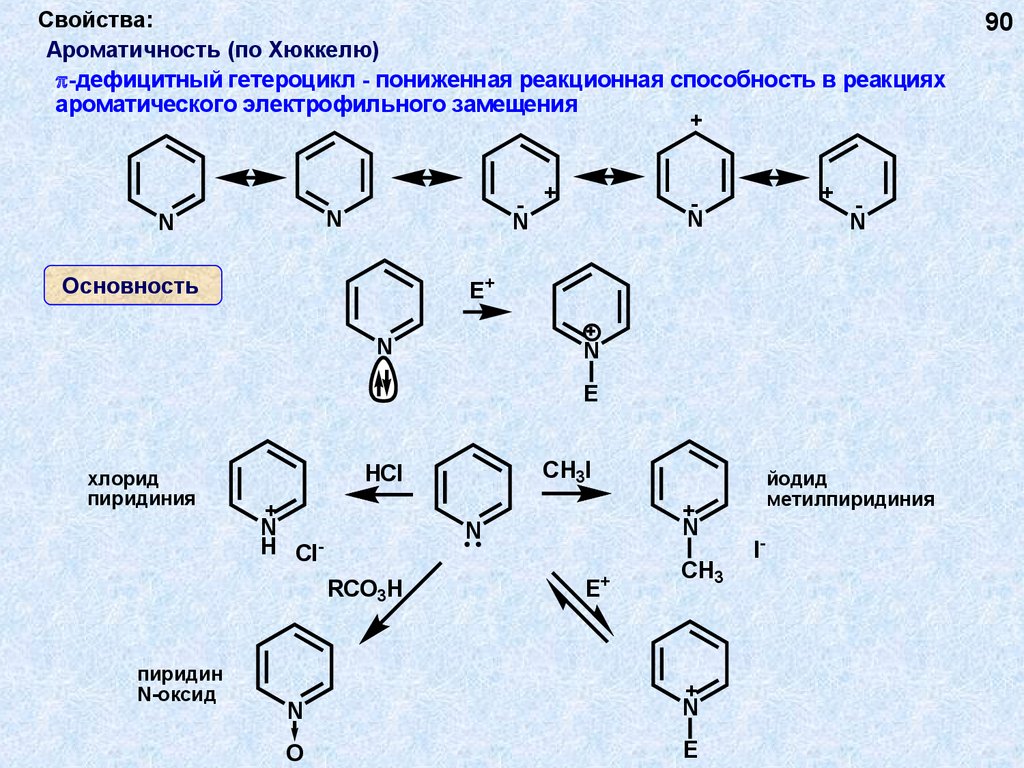
Свойства:Ароматичность (по Хюккелю)
-дефицитный гетероцикл - пониженная реакционная способность в реакциях
ароматического электрофильного замещения
+
N
N
N
Основность
+
+
N
N
E+
N
N
E
хлорид
пиридиния
+
N
H Cl-
+
N
N
RCO3H
пиридин
N-оксид
CH3I
HCl
E+
CH3
N
+
N
O
E
йодид
метилпиридиния
I-
90
91.
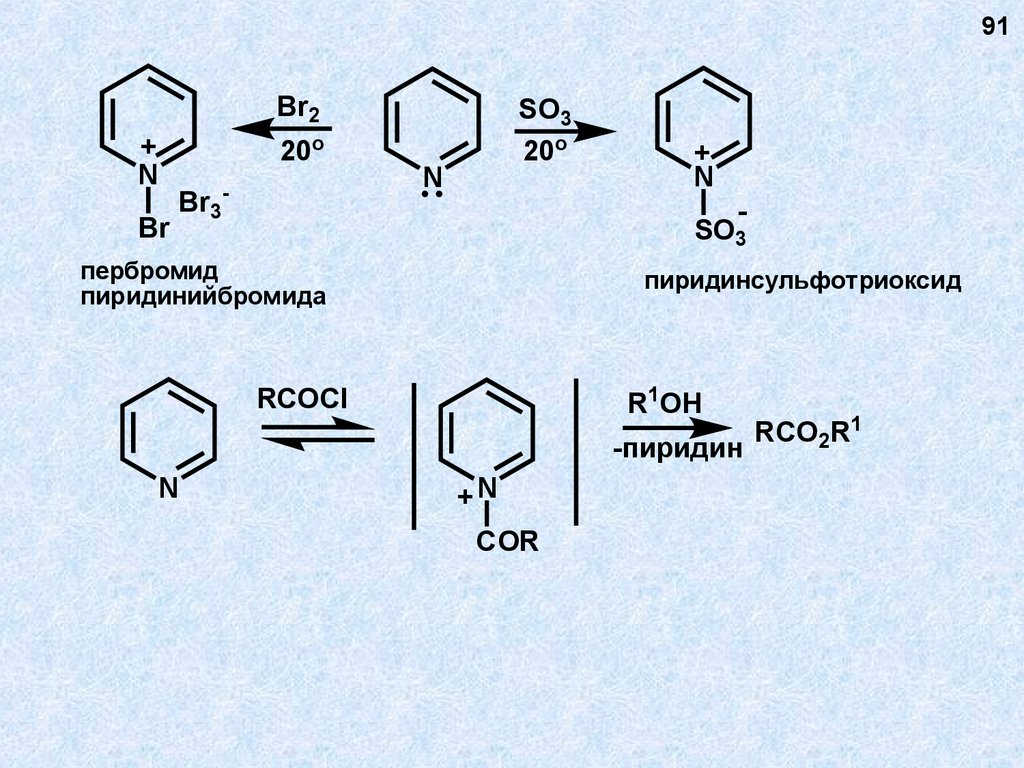
91Br2
+
N
Br
20o
Br3-
SO3
20o
N
+
N
-
SO3
пербромид
пиридинийбромида
пиридинсульфотриоксид
R1OH
RCOCl
-пиридин
N
+N
COR
RCO2R1
92.
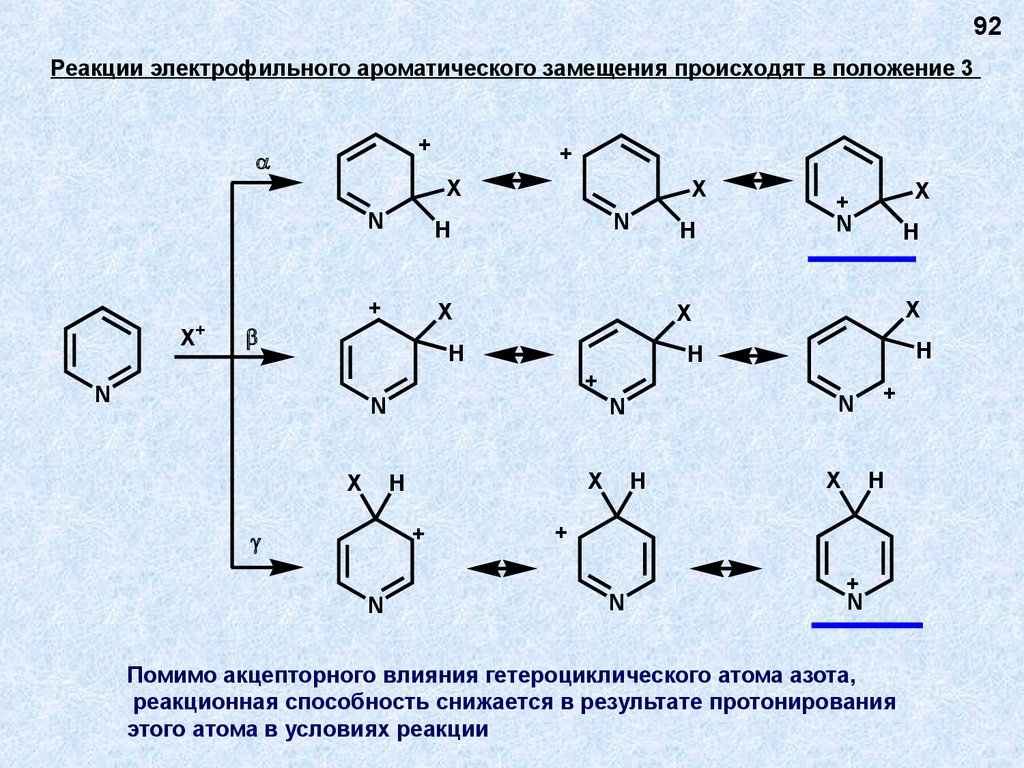
92Реакции электрофильного ароматического замещения происходят в положение 3
+
+
X
X+
N
H
+
X
X
N
H
N
X
+
N
H
N
N
H
X
H
+
X
H
X
H
N
X
+
N
H
X
+
H
+
N
+
N
Помимо акцепторного влияния гетероциклического атома азота,
реакционная способность снижается в результате протонирования
этого атома в условиях реакции
93.
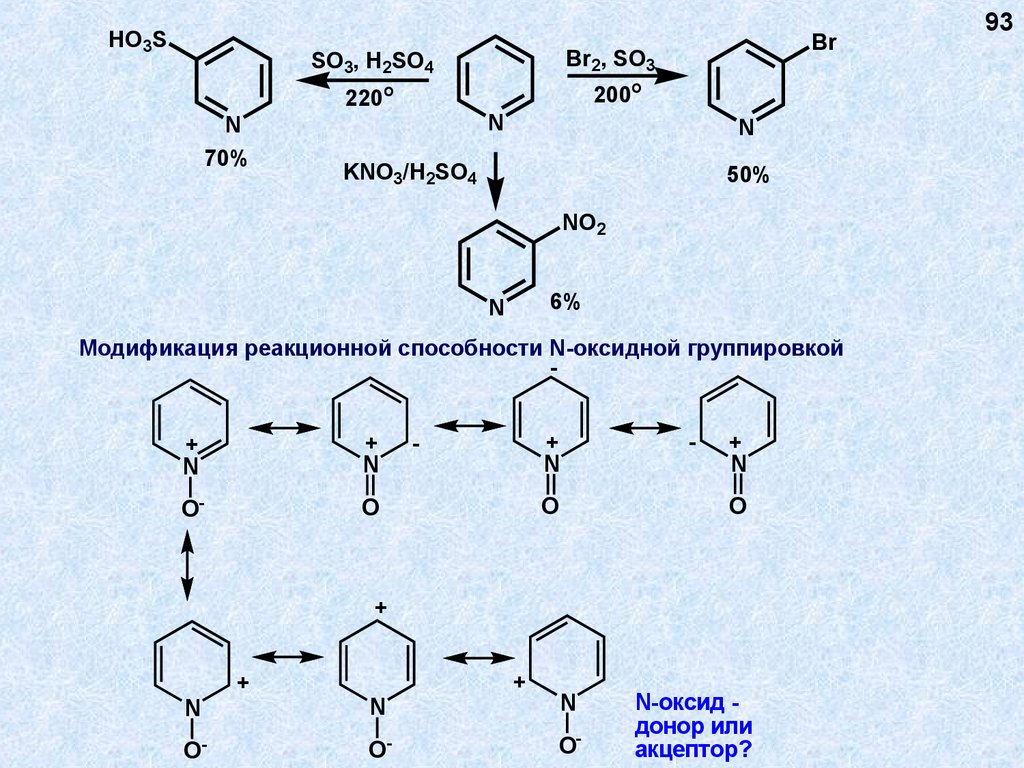
HO3SBr2, SO3
SO3, H2SO4
200o
220o
N
70%
Br
N
N
KNO3/H2SO4
50%
NO2
6%
N
Модификация реакционной способности N-оксидной группировкой
-
+
N
+
N
O-
O
-
+
N
O
-
+
N
O
+
N
O-
+
N
O-
+
N
O-
N-оксид донор или
акцептор?
93
94.
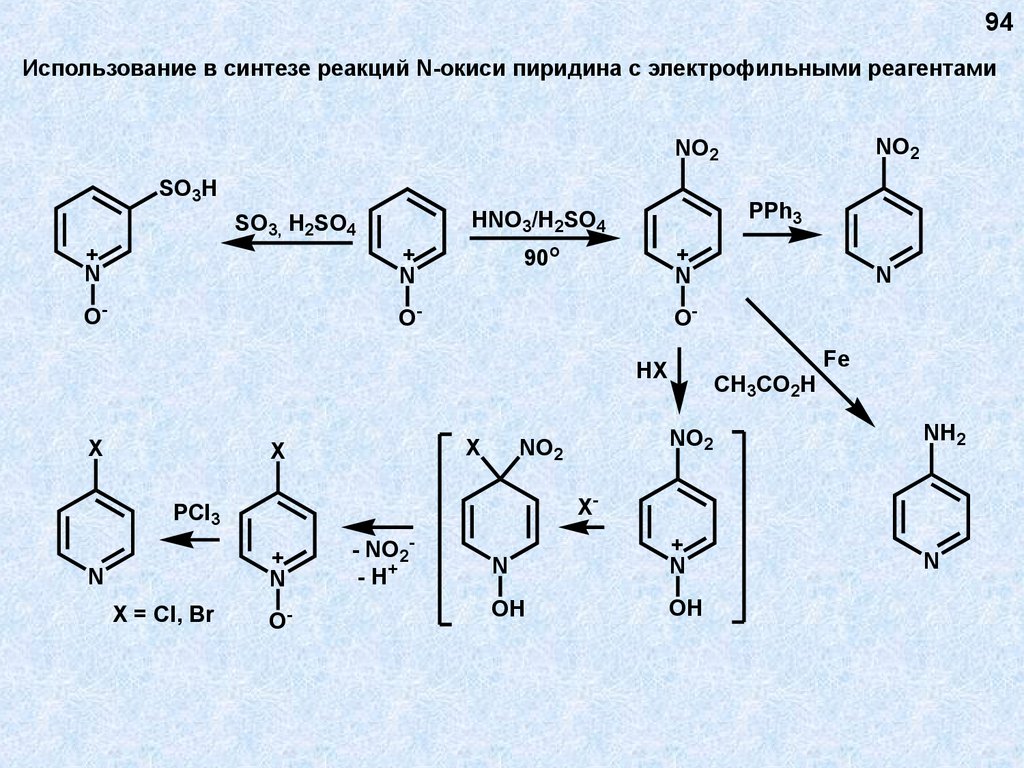
94Использование в синтезе реакций N-окиси пиридина с электрофильными реагентами
NO2
NO2
SO3H
PPh3
HNO3/H2SO4
SO3, H2SO4
+
N
+
N
O-
O-
+
N
90o
OHX
X
NH2
N
+
N
N
OH
OH
NO2
X-
PCl3
+
N
N
X = Cl, Br
CH3CO2H
Fe
NO2
X
X
N
O-
- NO2- H+
95.
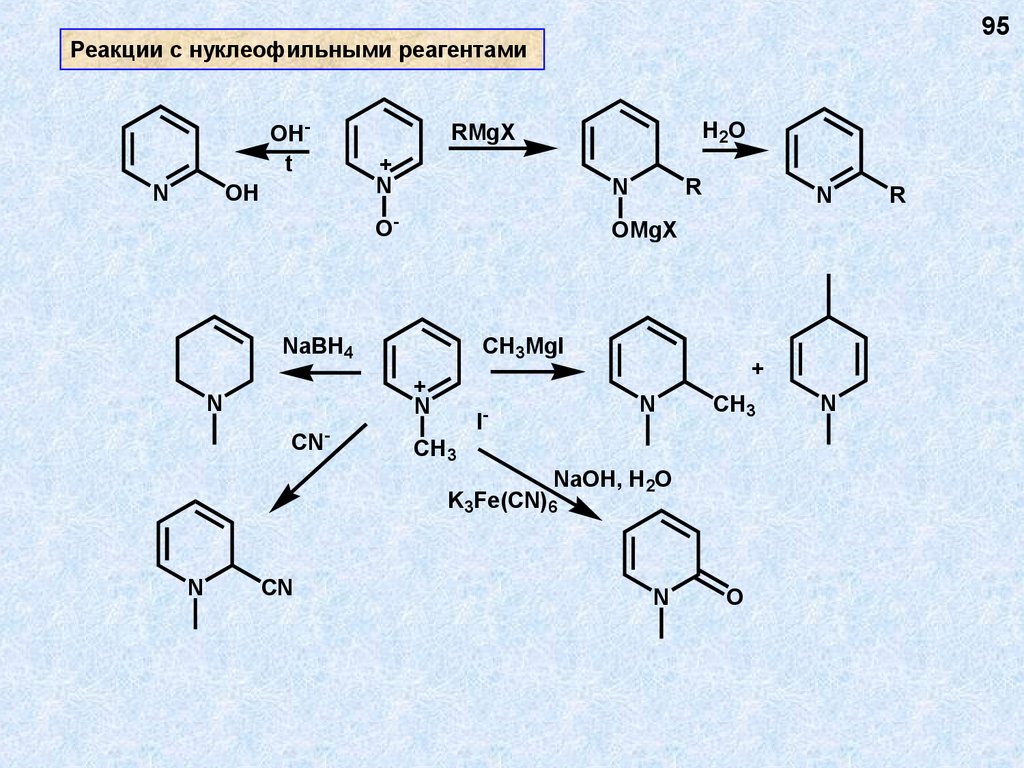
95Реакции с нуклеофильными реагентами
OHt
N
OH
+
N
N
O-
OMgX
NaBH4
CN-
R
N
CH3MgI
+
N
N
H2O
RMgX
+
N
I-
CH3
CH3
NaOH, H2O
K3Fe(CN)6
N
CN
N
O
N
R
96.
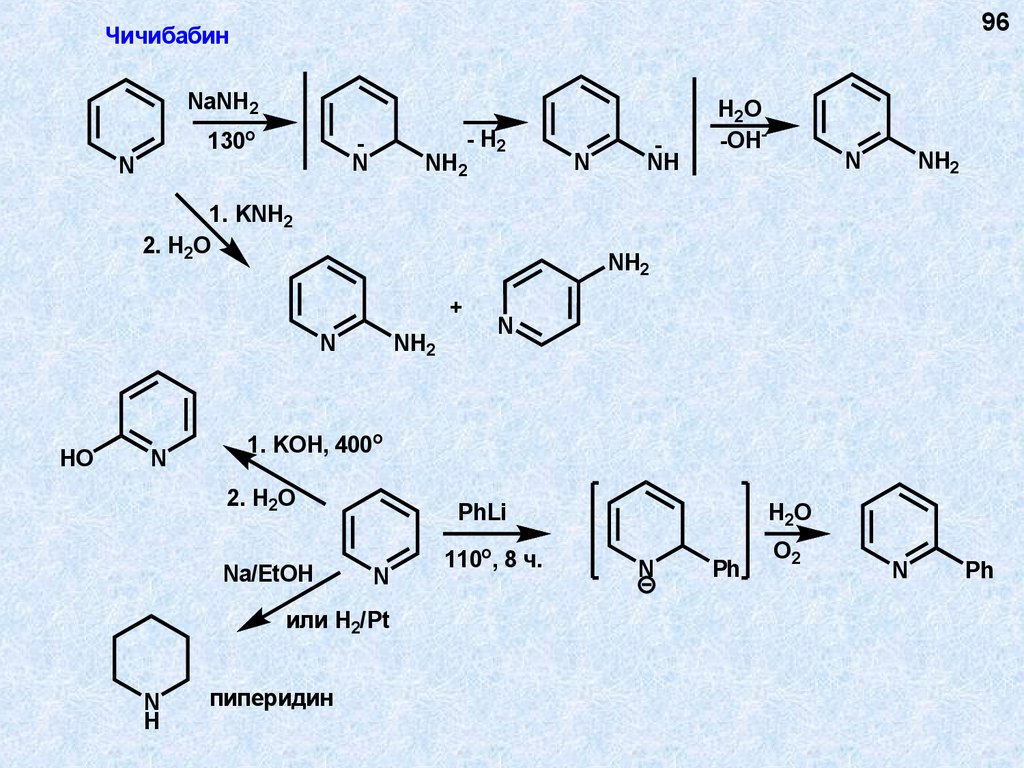
96Чичибабин
NaNH2
130o
N
- H2
N
NH2
1. KNH2
2. H2O
N
N
NH2
N
NH2
N
1. KOH, 400o
2. H2O
Na/EtOH
PhLi
N
или H2/Pt
N
H
NH
NH2
+
HO
N
H2 O
-OH-
пиперидин
110o , 8 ч.
H2O
N
Ph
O2
N
Ph
97.
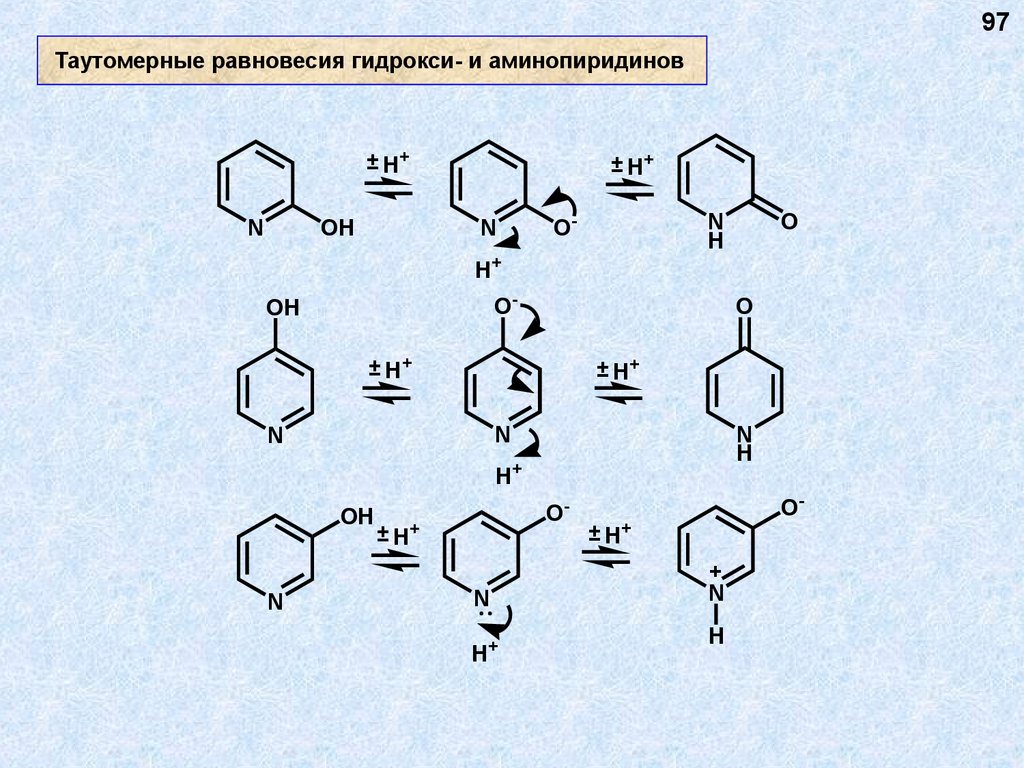
97Таутомерные равновесия гидрокси- и аминопиридинов
± H+
N
OH
± H+
N
N
H
O-
O
H+
O-
OH
O
± H+
± H+
N
N
N
H
H+
OH
N
O-
± H+
N
H+
O-
± H+
+
N
H
98.
NN2
NaNO2
+
N
N
H
NH2
H3O , 0
NH
NH2
o
N
NH2
NH
N
N
H
NaNO2
+
o
H3O , 0
устойчивая
соль диазония
N2
N
H2O
N
- изомеры
Реакции по боковой цепи
KMnO4
CO2H
OHN
пиколин
N
- пиколиновая кислота
- никотиновая кислота
- изоникотиновая кислота
98
OH
99.
Повышенная СН-кислотность протонову -углеродного атома заместителя в - и -положениях пиридинового кольца
_
_
CH2
N
N
RCHO
N
_
N
BuLi
или NaNH2
N
CH2
CHR
CH2
1. RCHO
N
CH2-
2. H2O
AmONO
OH-
_
N
NOH
N
OH
N
R
CH2
99
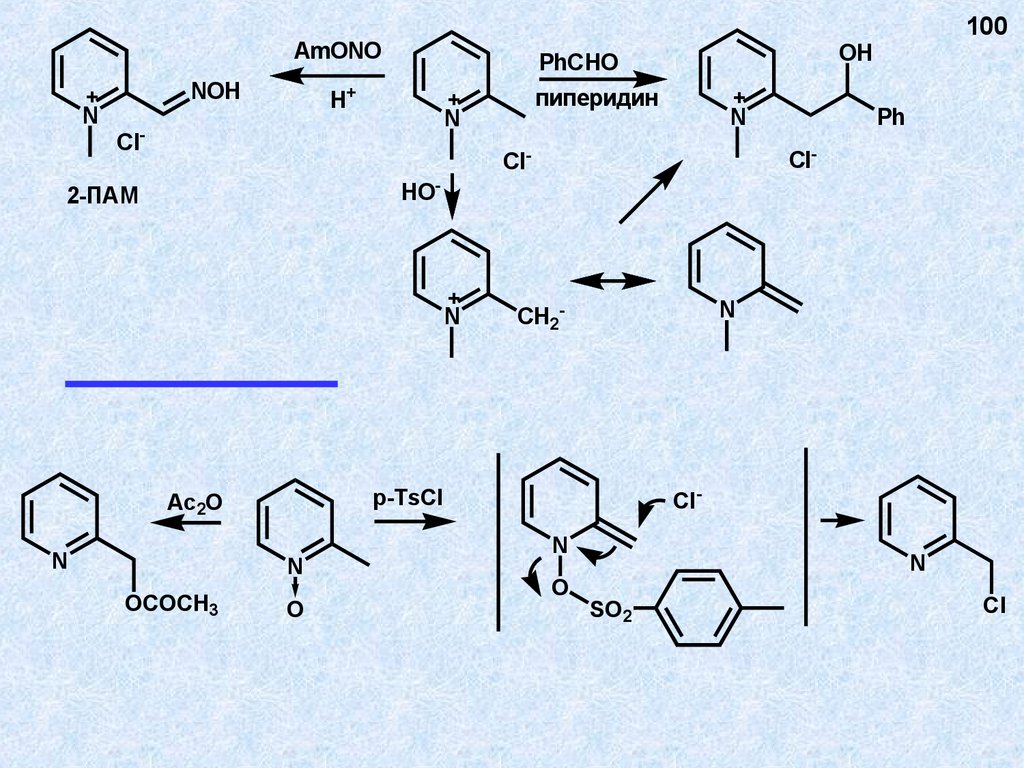
100.
AmONONOH
+
N
OH
PhCHO
H+
пиперидин
+
N
-
Cl
100
+
N
Ph
Cl-
ClHO-
2-ПАМ
+
N
N
OCOCH3
Cl-
p-TsCl
Ac2O
N
N
CH2-
O
N
O
N
SO2
Cl
101.
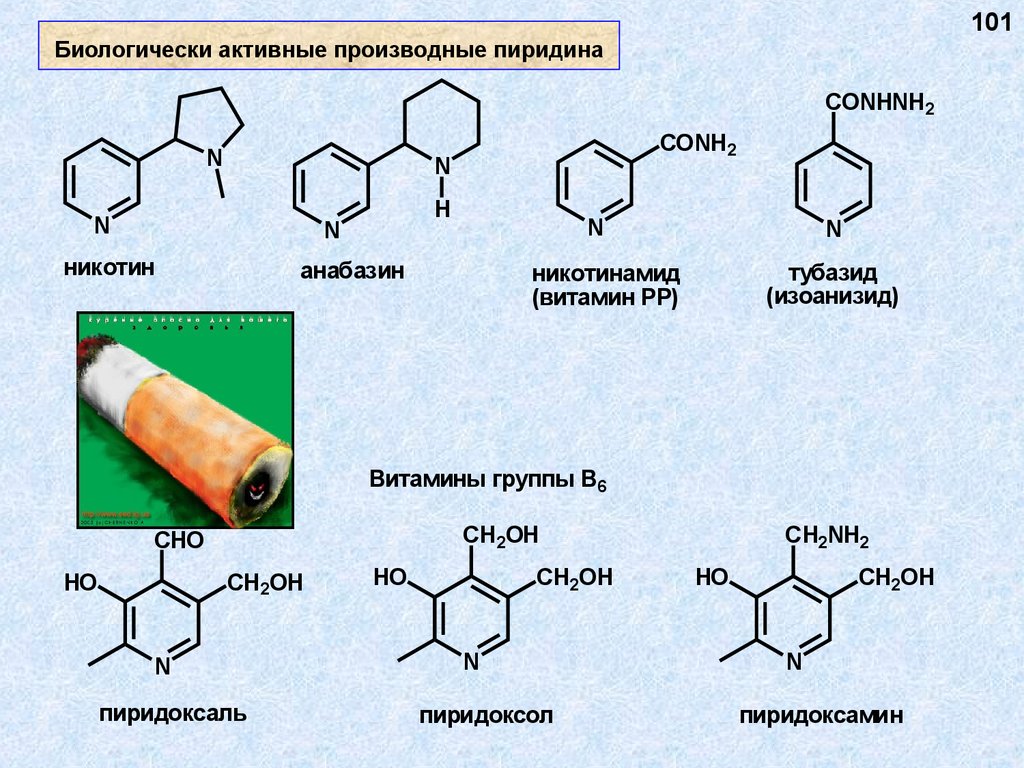
101Биологически активные производные пиридина
CONHNH2
N
CONH2
N
N
H
N
никотин
N
анабазин
N
тубазид
(изоанизид)
никотинамид
(витамин РР)
Витамины группы В6
CH2OH
CHO
HO
CH2OH
N
пиридоксаль
HO
CH2OH
N
пиридоксол
CH2NH2
HO
CH2OH
N
пиридоксамин
102.
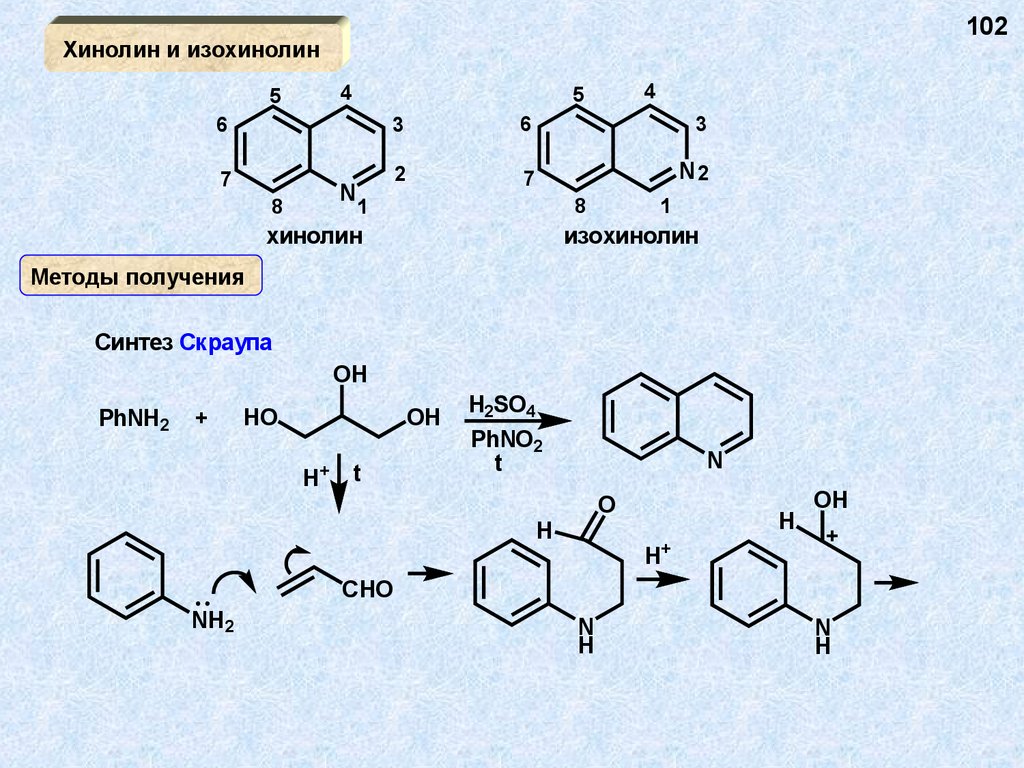
102Хинолин и изохинолин
4
5
4
5
6
3
6
3
7
2
7
N2
N
8
8
1
хинолин
1
изохинолин
Методы получения
Синтез Скраупа
OH
PhNH2
+
HO
OH
H+
t
H2SO4
PhNO2
t
N
O
H
H
+
H
OH
+
CHO
NH2
N
H
N
H
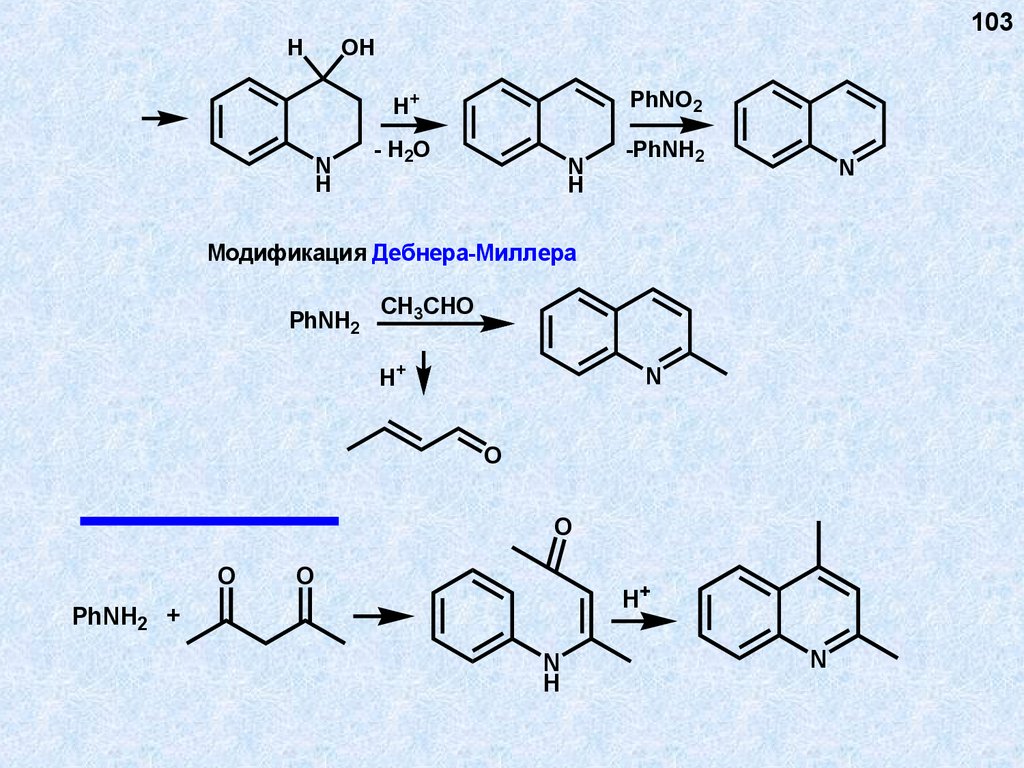
103.
H103
OH
PhNO2
H+
N
H
- H2O
N
H
-PhNH2
N
Модификация Дебнера-Миллера
PhNH2
CH3CHO
H+
N
O
O
O
O
H+
PhNH2 +
N
H
N
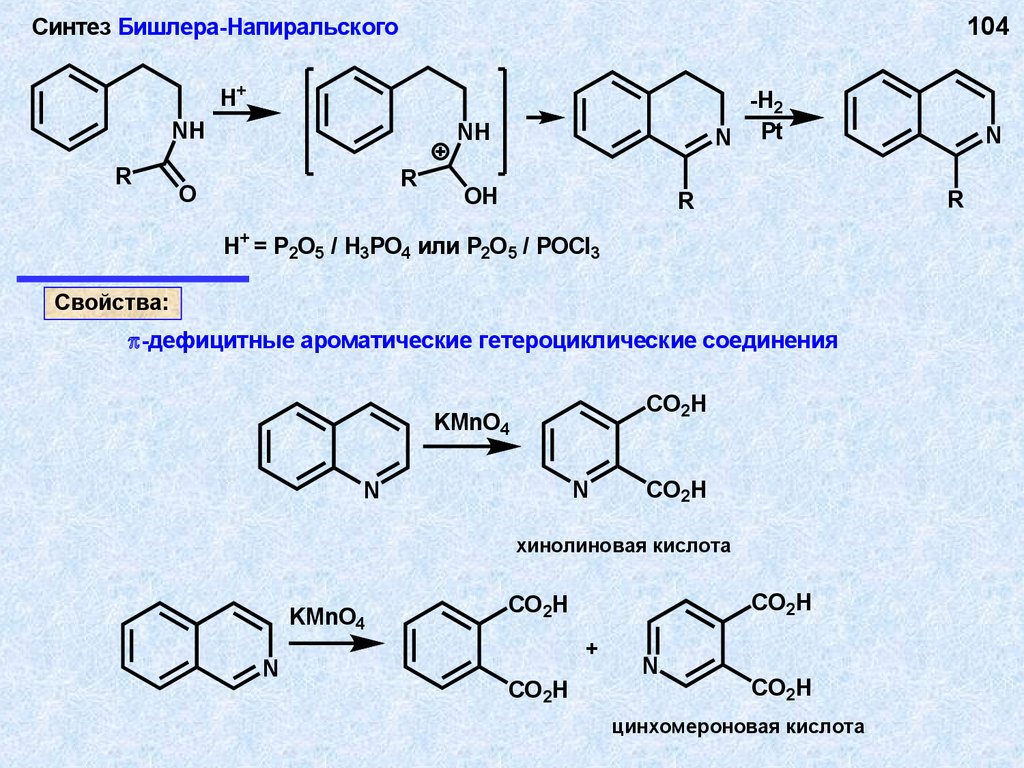
104.
104Синтез Бишлера-Напиральского
H+
NH
R
-H2
N Pt
NH
R
O
OH
R
R
H+ = P2O5 / H3PO4 или P2O5 / POCl3
Свойства:
-дефицитные ароматические гетероциклические соединения
CO2H
KMnO4
N
N
CO2H
хинолиновая кислота
KMnO4
N
CO2H
CO2H
+
CO2H
N
N
CO2H
цинхомероновая кислота
105.
105Реакции по атому азота
CH3I
+
N
RCO3H
N
-
I
N
HCl
O
Cl-
N
H
Реакции электрофильного замещения
Br
Br2
N
+
H2SO4
N
N
51%
H2SO4
Br 49%
NaOH t
N
N
SO3H
OH
8-оксихинолин
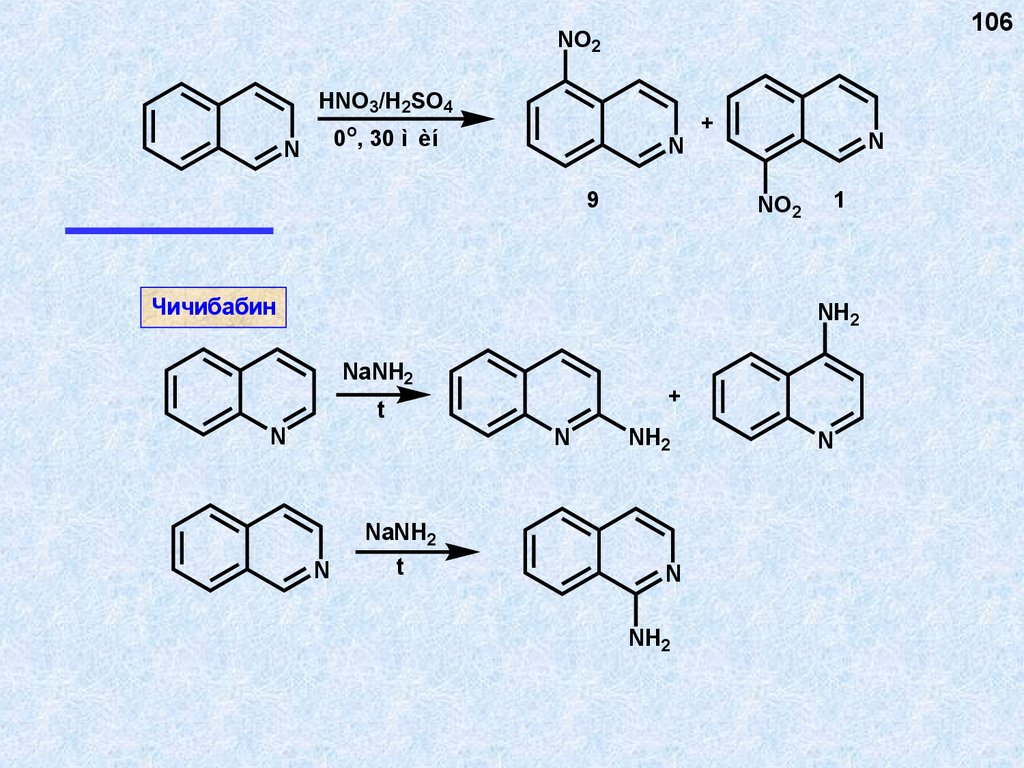
106.
106NO2
HNO3/H2SO4
0o, 30 ì èí
N
N
9
+
N
NO2
Чичибабин
1
NH2
NaNH2
+
t
N
N
NH2
NaNH2
N
t
N
NH2
N
107.
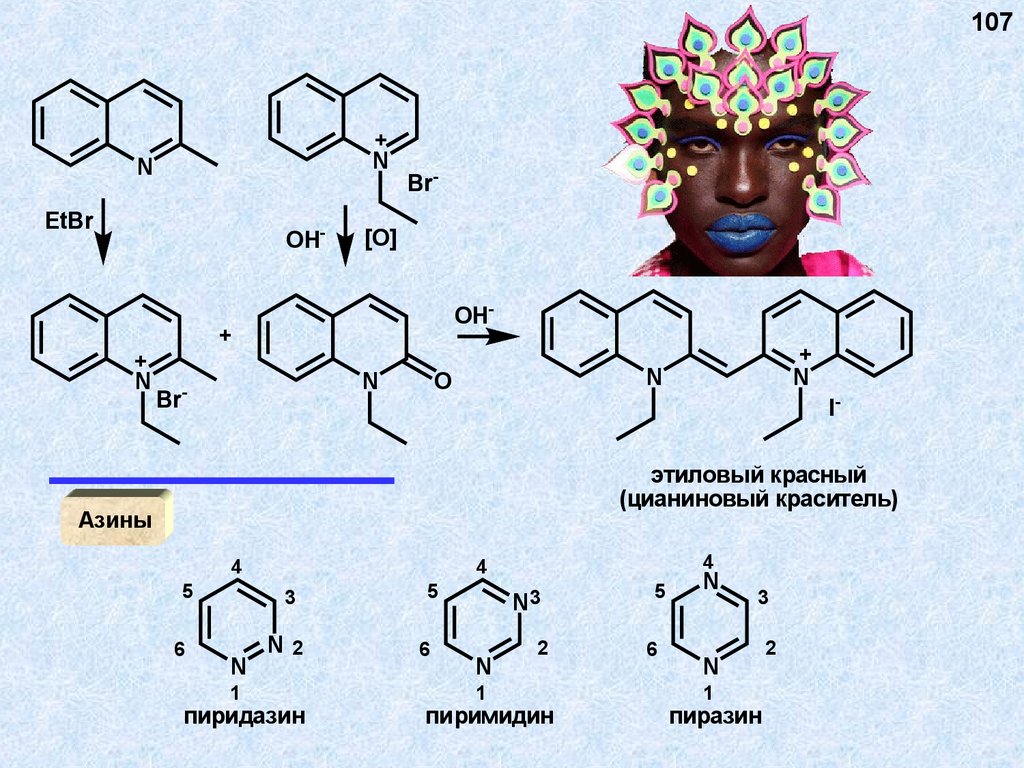
107+
N
N
EtBr
OH-
+
N
Br-
[O]
OH-
+
Br
N
-
+
N
N
O
Iэтиловый красный
(цианиновый краситель)
Азины
4
5
6
3
N
1
4
4
N2
пиридазин
5
6
N3
N
1
2
пиримидин
5
6
N
3
N
1
пиразин
2
108.
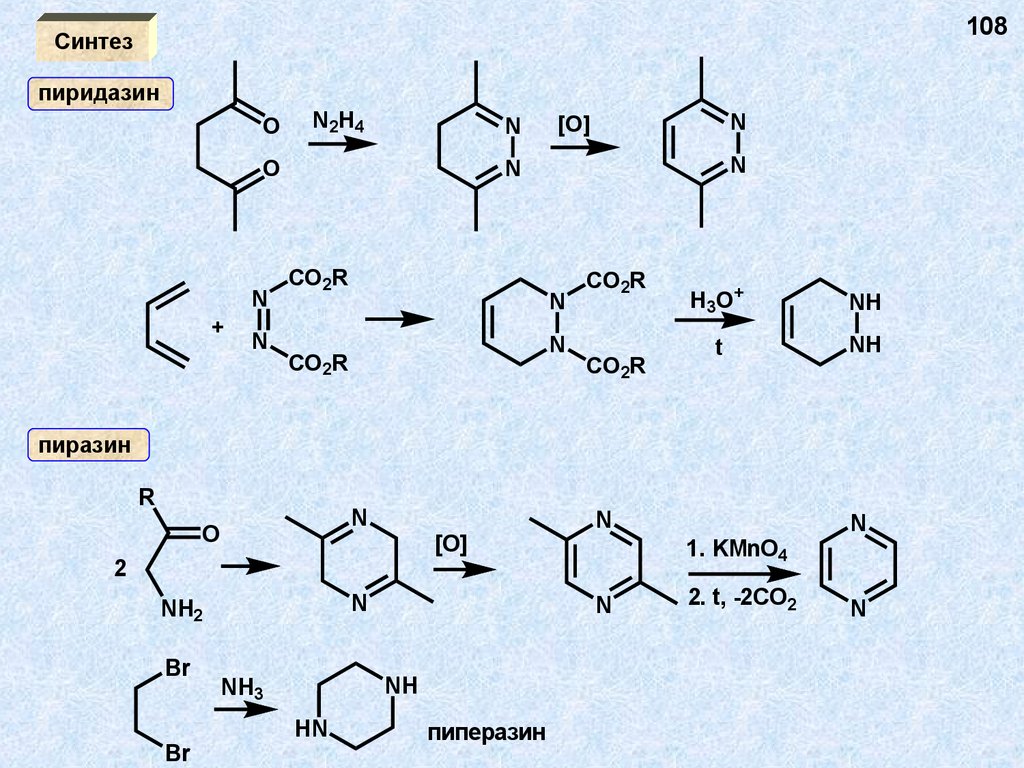
108Синтез
пиридазин
O
N2H4
N
O
N
+
N
N
[O]
N
N
CO2R
N
N
CO2R
CO2R
CO2R
H3O+
NH
t
NH
пиразин
R
N
O
[O]
2
N
NH2
Br
Br
HN
1. KMnO4
N
NH
NH3
N
пиперазин
2. t, -2CO2
N
N
109.
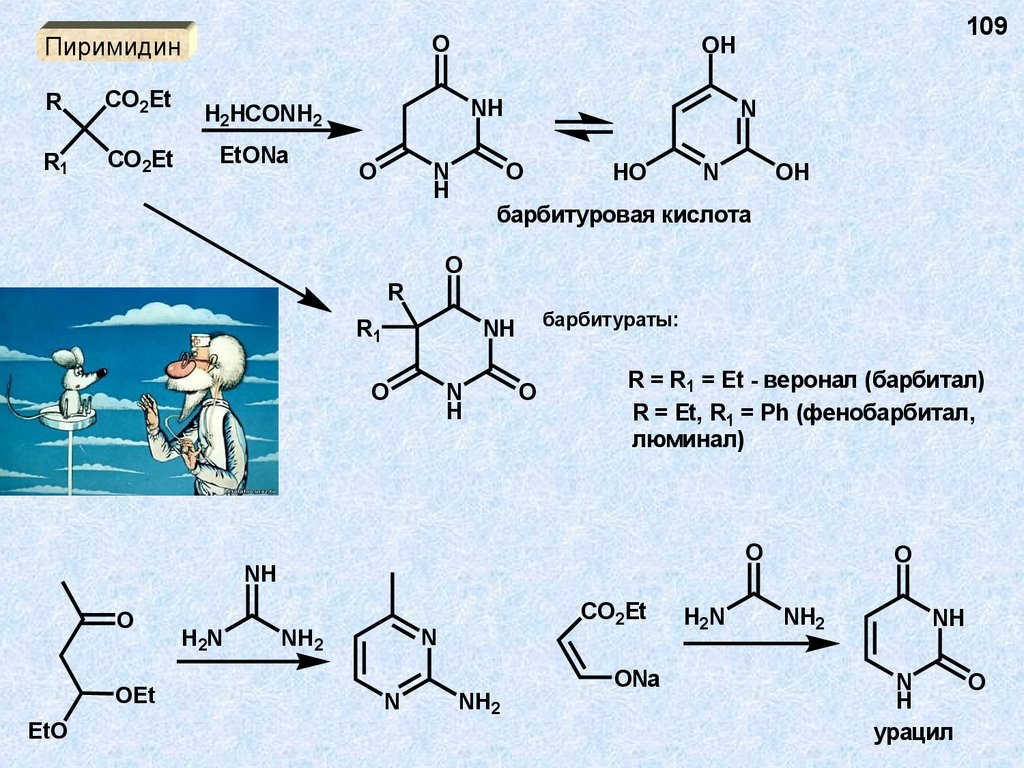
OПиримидин
R
CO2Et
R1
CO2Et
NH
H2HCONH2
EtONa
O
109
OH
N
H
N
O
HO
N
OH
барбитуровая кислота
O
R
R1
барбитураты:
NH
O
N
H
O
R = R1 = Et - веронал (барбитал)
R = Et, R1 = Ph (фенобарбитал,
люминал)
O
NH
O
OEt
EtO
H2N
CO2Et
N
NH2
N
NH2
ONa
H2N
O
NH2
NH
N
O
H
урацил
110.
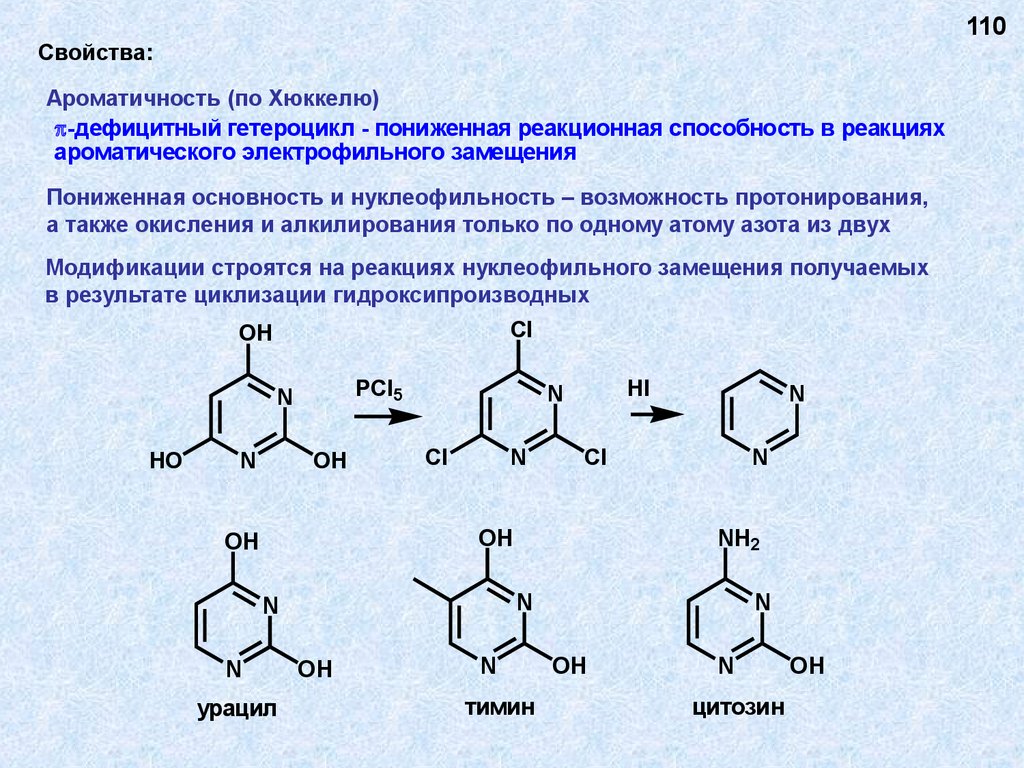
110Свойства:
Ароматичность (по Хюккелю)
-дефицитный гетероцикл - пониженная реакционная способность в реакциях
ароматического электрофильного замещения
Пониженная основность и нуклеофильность – возможность протонирования,
а также окисления и алкилирования только по одному атому азота из двух
Модификации строятся на реакциях нуклеофильного замещения получаемых
в результате циклизации гидроксипроизводных
Cl
OH
PCl5
N
HO
N
OH
HI
N
Cl
N
Cl
OH
OH
урацил
N
NH2
N
N
N
N
OH
N
тимин
N
OH
N
цитозин
OH
111.
HOH
O
111
HO
N
H
H
H
N
O
H
H
OH
HO
-D-рибофуранозид
H
HO
-дезокси- -D-рибофуранозид
O
NH
HO
H
H
HO
P
NH
O
5'
O
H
O
N
H
O
H
O
H
OH
NH
5'
HO
H
P
O
N
O
H
3'
OH O
H
H
HO
O
OH
HO
уридин (нуклеозид)
HO
РНК
O
OH
N
O
H
H
OH
O
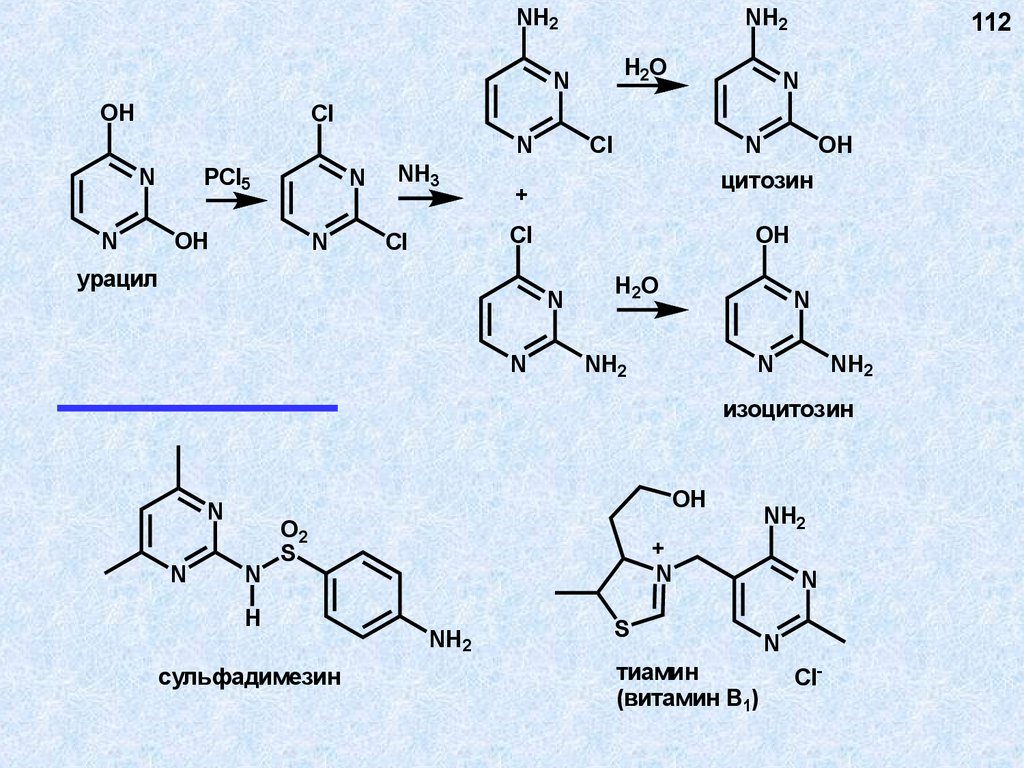
112.
NH2NH2
H2O
N
OH
112
N
Cl
N
N
N
PCl5
N
OH
N
NH3
Cl
N
цитозин
+
Cl
Cl
урацил
OH
N
N
OH
H2O
N
NH2
N
NH2
изоцитозин
OH
N
N
N
O2
S
H
сульфадимезин
NH2
+
N
NH2
S
тиамин
(витамин В1)
N
N
Cl-
113.
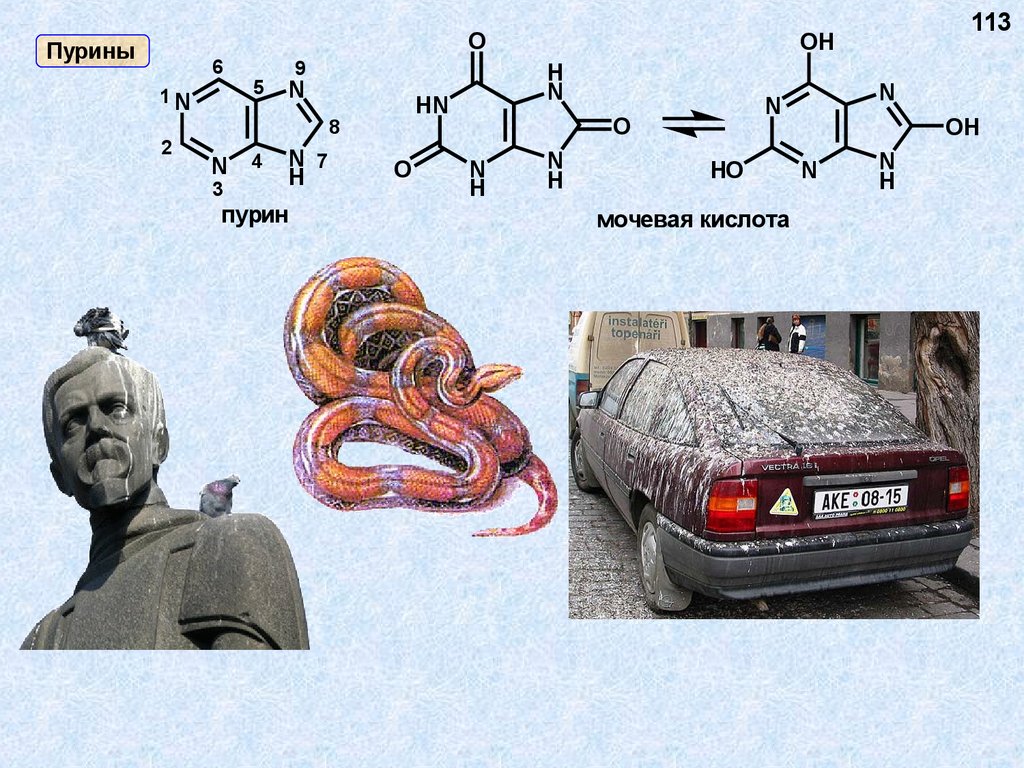
OПурины
6
1N
2
5
9
N
8
N
3
4
N 7
H
пурин
H
N
HN
O
N
H
N
N
O
N
H
113
OH
HO
мочевая кислота
OH
N
N
H
114.
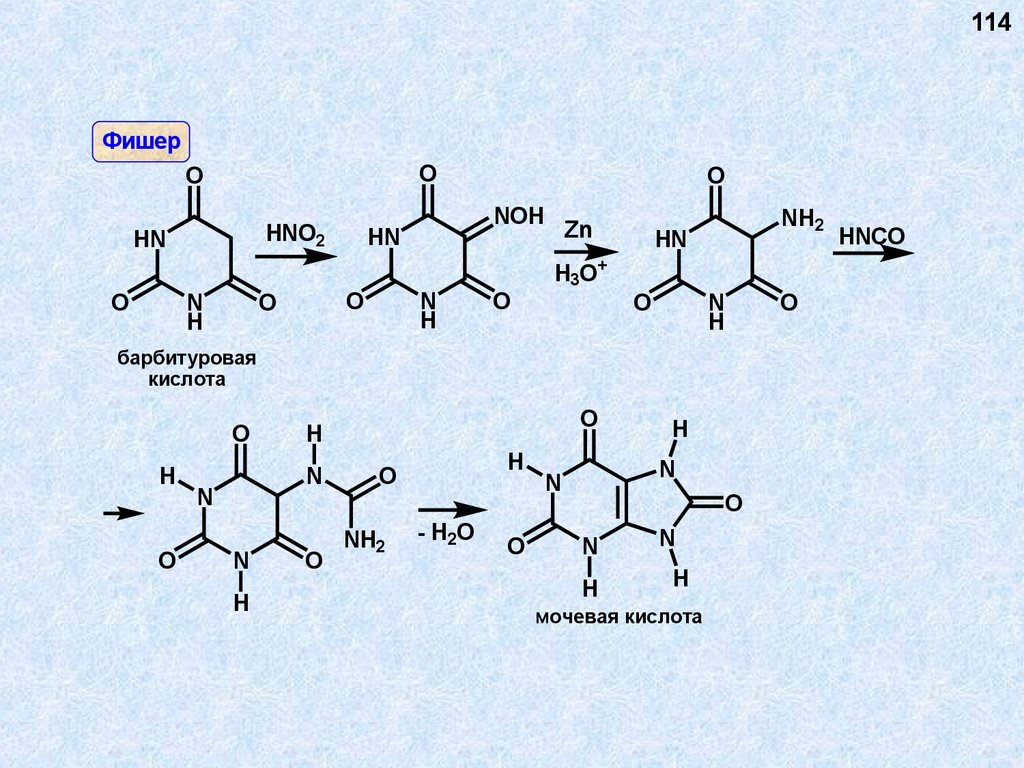
114Фишер
O
O
HNO2
HN
O
N
H
NOH
HN
O
O
O
N
H
O
Zn
NH2
HN
H3O+
O
N
H
O
барбитуровая
кислота
O
H
O
N
N
N
H
O
H
O
H
O
NH2
- H2O
O
H
N
N
O
N
H
N
H
мочевая кислота
HNCO
115.
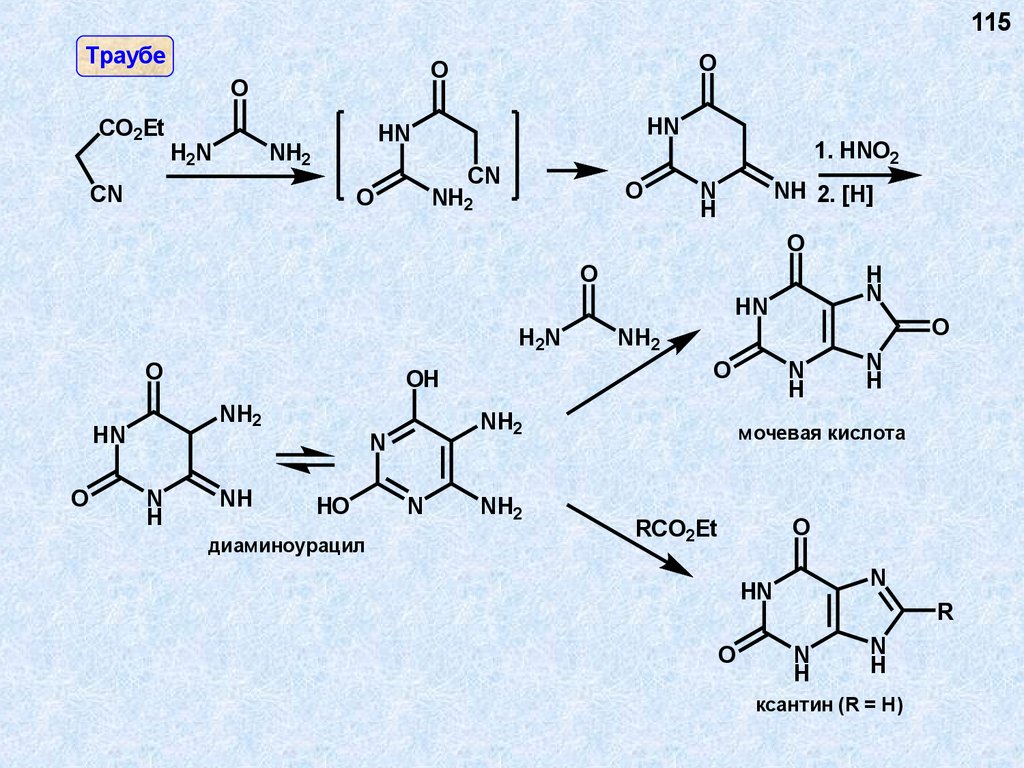
115Траубе
O
CO2Et
H2N
O
O
HN
HN
NH2
CN
CN
O
O
NH2
1. HNO2
N
H
NH 2. [H]
O
O
H
N
HN
H2N
O
NH2
HN
O
NH2
N
N
H
O
OH
NH
HO
диаминоурацил
N
NH2
O
NH2
N
H
N
H
мочевая кислота
O
RCO2Et
N
HN
O
R
N
H
N
H
ксантин (R = H)
116.
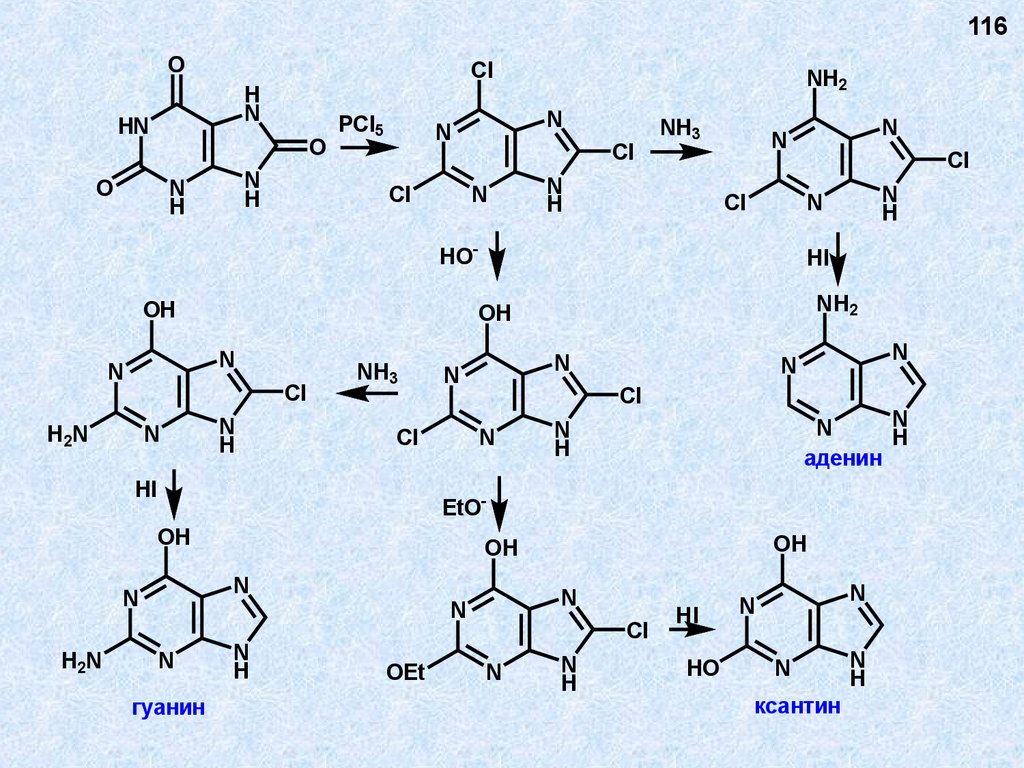
116O
Cl
H
N
HN
O
O
N
H
N
H
PCl5
N
N
Cl
NH2
Cl
N
NH3
N
H
Cl
Cl
H2N
N
N
H
NH3
HI
N
N
Cl
N
N
N
H
аденин
N
H
EtOOH
N
гуанин
OH
OH
N
N
H2N
NH2
N
N
Cl
N
H
HI
OH
N
N
Cl
N
HOOH
N
N
N
H
N
N
OEt
Cl
N
N
H
HI
HO
N
N
N
ксантин
N
H
117.
117Пуриновые алкалоиды – производные ксантина
O
N
N
O
N
N
O
N
H
O
O
N
H
O
теофиллин
(чай)
O
N
HN
(CH3 CO)2O
N
H
N
N
N
H
теобромин
(какао)
O
(CH3O)2SO2
N
H
N
H
O
O
N
N
N
N
N
O
O
N
N
N
кофеин
(чай, кофе)
Синтез кофеина
O
H
N
HN
O
O
N
N
Cl2
O
CCl3
N
N
OH-,
N
N
t
O
N
N
кофеин

























 chemistry
chemistry