Similar presentations:
Основы технической термодинамики
1.
ФБГОУ ВО «Ярославский государственный технический университет»Кафедра двигателей внутреннего сгорания
«Термодинамика и теплотехника»»
Курс лекций
для студентов 3 курса
заочной формы обучения
составлен
кандидатом технических наук,
доцентом
Ивневым
Александром Андреевичем
Часть 1
Основы технической
термодинамики
Ярославль - 2017
1
1
2.
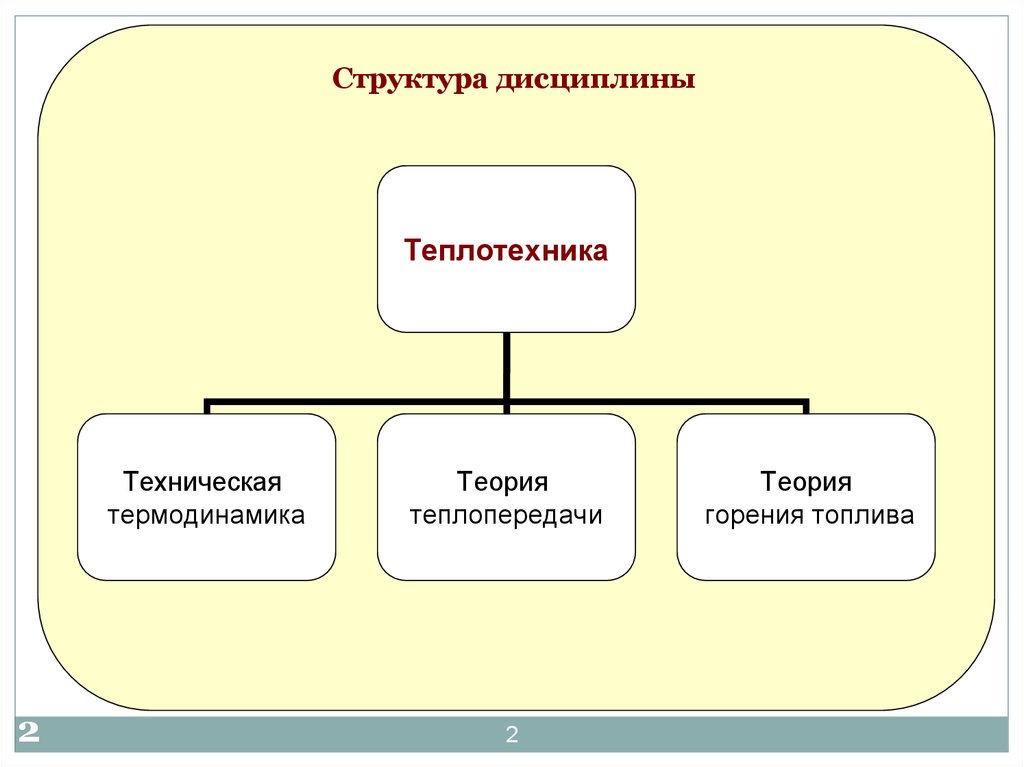
Структура дисциплиныТеплотехника
Техническая
термодинамика
2
Теория
теплопередачи
2
Теория
горения топлива
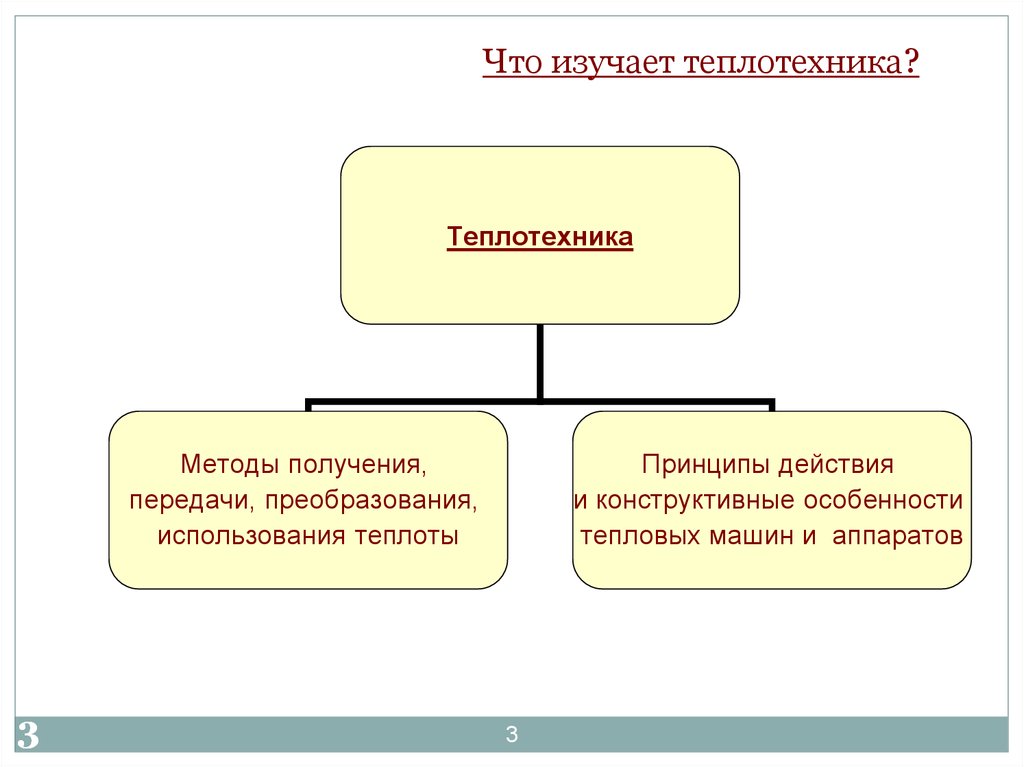
3. Что изучает теплотехника?
ТеплотехникаМетоды получения,
передачи, преобразования,
использования теплоты
3
Принципы действия
и конструктивные особенности
тепловых машин и аппаратов
3
4. Что изучает термодинамика?
THERME + DYNAMIS =ТЕПЛОТА + СИЛА
«Никто не сомневается, что теплота может быть причиной
движения… Паровые машины, ныне столь распространенные, являются
очевидным тому доказательством»
С.Карно «Размышления о движущей силе огня и о машинах,
способных развивать эту силу» 1824 г.
4
4
5.
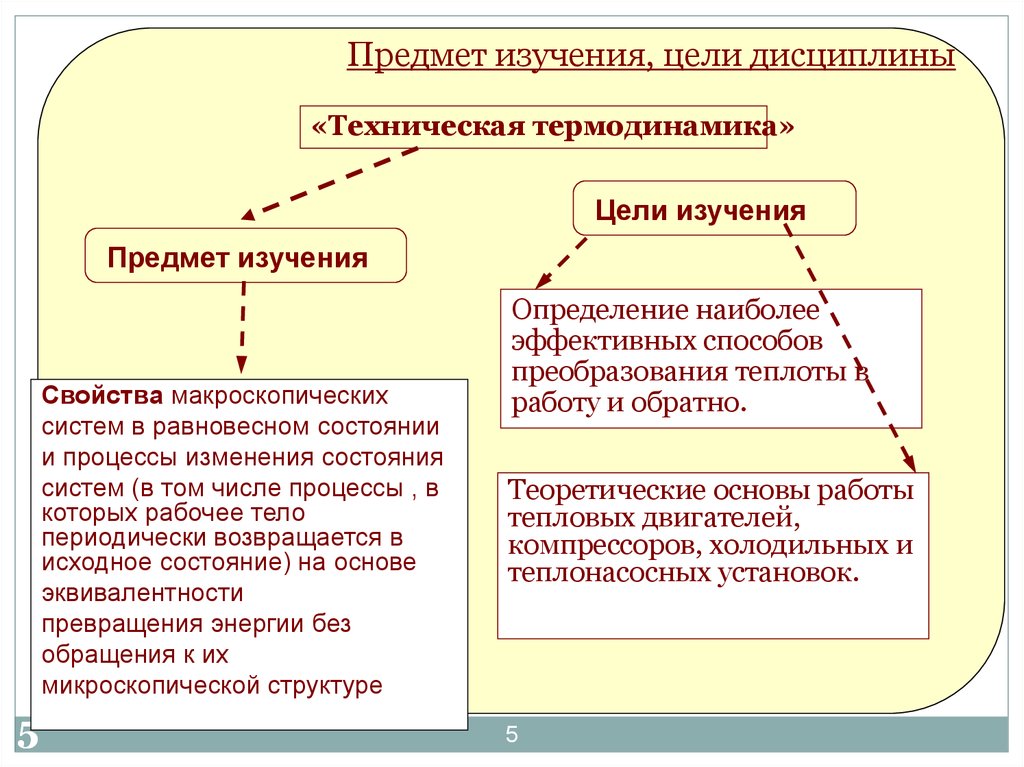
Предмет изучения, цели дисциплины«Техническая термодинамика»
Цели изучения
Предмет изучения
Свойства макроскопических
систем в равновесном состоянии
и процессы изменения состояния
систем (в том числе процессы , в
которых рабочее тело
периодически возвращается в
исходное состояние) на основе
эквивалентности
превращения энергии без
обращения к их
микроскопической структуре
5
Определение наиболее
эффективных способов
преобразования теплоты в
работу и обратно.
Теоретические основы работы
тепловых двигателей,
компрессоров, холодильных и
теплонасосных установок.
5
6.
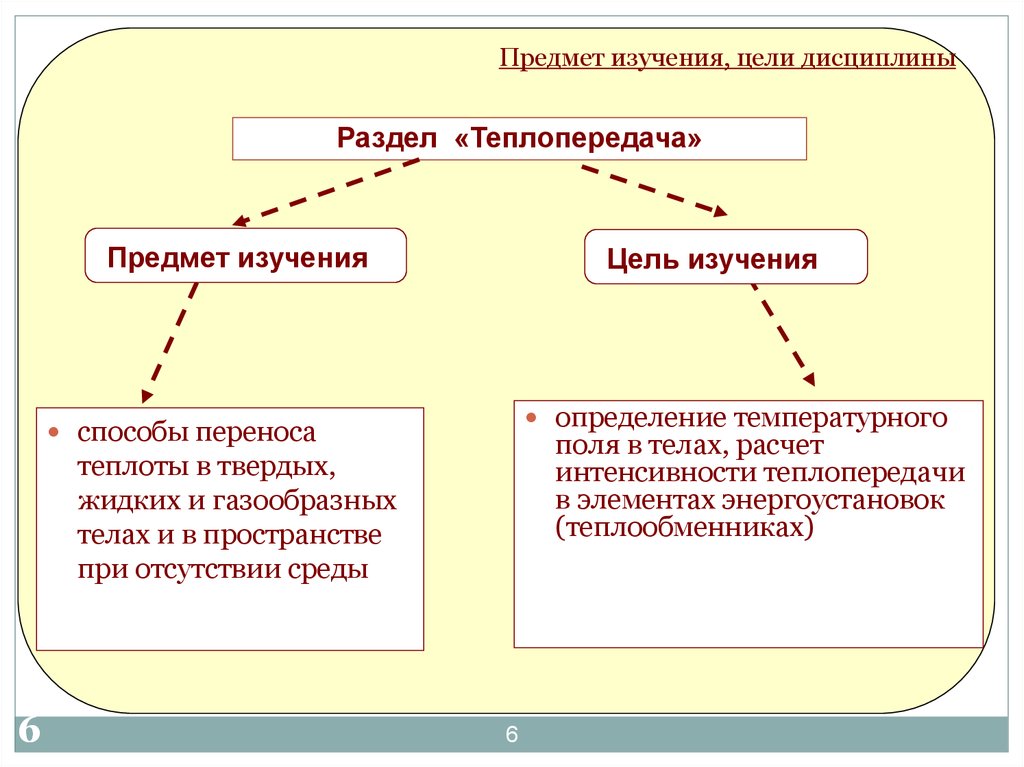
Предмет изучения, цели дисциплиныРаздел «Теплопередача»
Предмет изучения
Цель изучения
определение температурного
способы переноса
поля в телах, расчет
интенсивности теплопередачи
в элементах энергоустановок
(теплообменниках)
теплоты в твердых,
жидких и газообразных
телах и в пространстве
при отсутствии среды
6
6
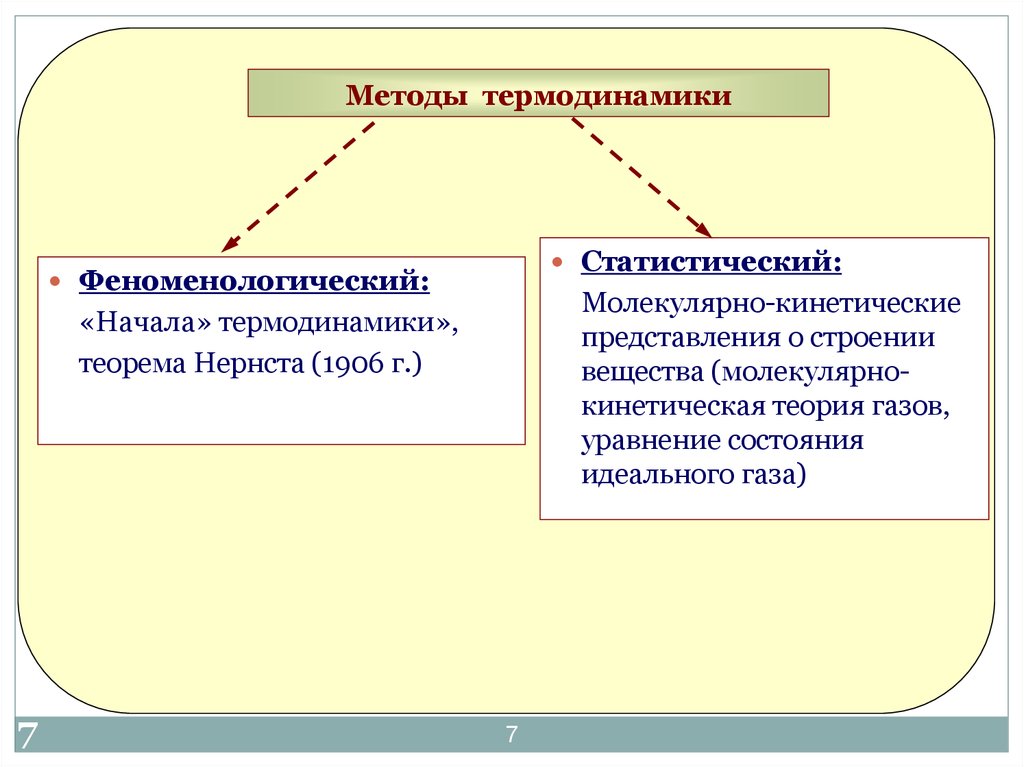
7. Методы термодинамики
Статистический:Феноменологический:
Молекулярно-кинетические
представления о строении
вещества (молекулярнокинетическая теория газов,
уравнение состояния
идеального газа)
«Начала» термодинамики»,
теорема Нернста (1906 г.)
7
7
8. «Начала» термодинамики»
Для закрытой системы:если масса системы неизменна, то
«теплота (Q), полученная системой
извне, используется на изменение ее
внутренней
энергии
(ΔU)
и
совершение работы расширения (L)
над внешними силами (окружающей
средой»
Первое начало: невозможен
процесс возникновения или
исчезновения энергии (общий
закон сохранения энергии)
Q U L
Второе начало: невозможен
циклический процесс,
имеющий единственным своим
результатом превращение
теплоты в работу.
8
в тепловых машинах невозможно
превращение всей теплоты в работу.
8
9. Закон сохранения энергии по М. Ломоносову
Всеперемены,
в
натуре
случающиеся, такого суть состояния,
что сколько чего у одного тела
отнимается,
то
столько
же
присовокупляется к другому: там, где
убудет
несколько
материи,
то
умножится в другом месте
Сей всеобщий естественный
закон простирается в самые правила
движения: ибо тело, движущее своей
силой другое, столько же оныя у себя
теряет, сколько сообщает другому,
которое от него движение получает».
9
М. В. Ломоносов
«Рассуждения о жидкости и твердости тел»,
1760 г.
9
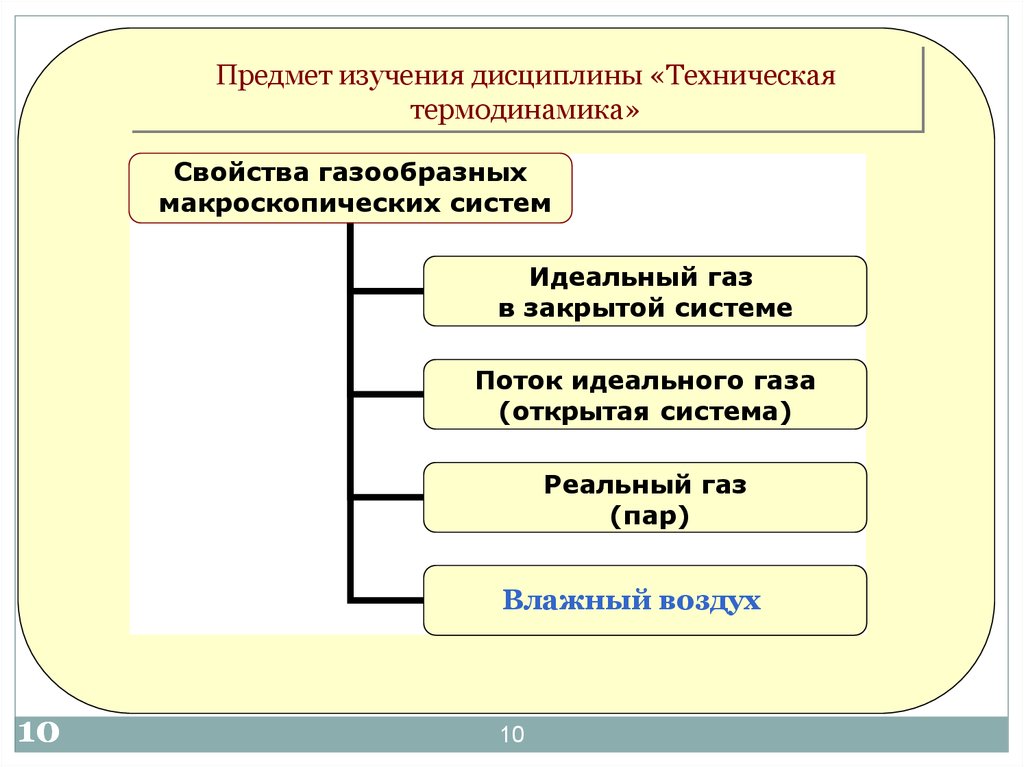
10.
Предмет изучения дисциплины «Техническаятермодинамика»
Свойства газообразных
макроскопических систем
Идеальный газ
в закрытой системе
Поток идеального газа
(открытая система)
Реальный газ
(пар)
Влажный воздух
10
10
11. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1.Теплотехника: Учебник для втузов. Под общ. ред. А.М. Архарова,В.Н. Афанасьева.– М., Изд-во. МГТУ им. Н.Э. Баумана, 2004. – 712с.
2.Рабинович О.М. Сборник задач по технической термодинамике.- М.:
Машиностроение, 1969.- 344 с.
3.Теплотехника. // Под ред. В.Н. Луканина - М.: Высшая школа, 2000.- 671с.
4.Нащокин В.В. Техническая термодинамика и теплопередача. -М.: Высшая
школа, 1980.- 469 с.
5.Теплотехника // Под ред. А.П.Баскакова, М.: Энергоатомиздат, 1991.- 224с.
11
11
12.
Основное содержание раздела «Термодинамика»Равновесные состояния и параметры состояния идеального газа
Процессы идеальных газов в закрытых и открытых системах
Первое начало термодинамики
Термодинамические циклы прямые и обратные
Второе начало термодинамики
Термодинамические основы работы тепловых двигателей,
холодильных установок, «тепловых насосов»
Основы работы компрессоров
Процессы с водяным паром и паротурбинные установки
Парокомпрессионные холодильные установки
12
12
13.
Основные понятия термодинамикиТермодинамическая система
(открытая, закрытая, адиабатная) и окружающая среда
Источники теплоты: «горячий» и «холодный»
Рабочее тело Идеальный газ
Термические параметры состояния Равновесное состояние
Уравнение равновесного состояния идеального газа
Газовая постоянная Универсальная газовая постоянная
Теплоемкость газов
Внутренняя энергия
Теплота
Работа
Первое Начало термодинамики
Энтальпия
Энтропия
Термодинамические процессы и циклы
Второе Начало термодинамики
Показатели эффективности и работоспособности
термодинамических циклов
13
13
14.
Термодинамическая система и источники теплотыОткрытые, закрытые, адиабатные
системы
Источник теплоты – элемент окружающей среды,
взаимодействующий с термодинамической системой и обладающий
бесконечно большой теплоемкостью и температурой, отличающейся от
температуры системы,
14
14
15.
Рабочее тело – идеальный газИдеальный газ – газ, у которого
силами взаимодействия между
молекулами можно пренебречь
Энергетическое состояние
термодинамической системы
(идеального газа) характеризуется
определенными измеряемыми
величинами, называемыми
параметрами состояния.
Параметры состояния термодинамического состояния (параметры
состояния) – макроскопические физические величины, количественно
характеризующие рабочее тело (систему) и не зависящие от размеров
системы
15
15
16.
Параметры термодинамического состоянияАбсолютное давление (p), Па.
Единицы измерения: Н/м2 (Паскаль), м
p= g h
Давление:
абсолютное, р
барометрическое (атмосферное)
В=101325 Па 0,1 МПа
1 мм.рт.ст. = 133,3 Па
избыточное(манометрическое),
избыточное (вакууметрическое)
n
2
p
3
16
i 1
i
V
манометрическое
(избыточное)
p=B+рман
вакууметрическое
p=B-рвак
16
Wê
17. Параметры термодинамического состояния
Абсолютная температура, TЕдиницы измерения:
К,( Кельвин); 1 К = 1 оС
Единицы измерения:
м3/кг
Абсолютная температура:
Удельный объем:
характеризует степень нагретости
тел, является среднестатистическим
результатом хаотичного движения
свободных частиц.
характеризует плотность
рабочего тела
=1/ ).
представляет собой меру
средней
кинетической
энергии молекул
17
Удельный объем ( ),
17
18. Уравнение состояния идеального газа
Если термодинамические параметры одинаковы во всех точках ипри этом неизменны во времени, то такое состояние называется
равновесным
p R T
для 1 моля (кмоля):
где R универсальная газовая постоянная - работа, совершаемая 1 молем
идеального газа при изменении температуры на 1К в изобарном процессе;
является постоянным числом для любого идеального газа,
имеет единицы измерения Дж/(кмоль К) и число: 8314 Дж/(кмоль К).
p R T
для 1 кг:
где R - индивидуальная газовая постоянная- работа единицы массы (1 кг)
идеального газа в изобарном процессе при изменении температуры на 1 К.
Является постоянным числом только для конкретного газа, имеет
единицы измерения Дж/(кг К)
18
18
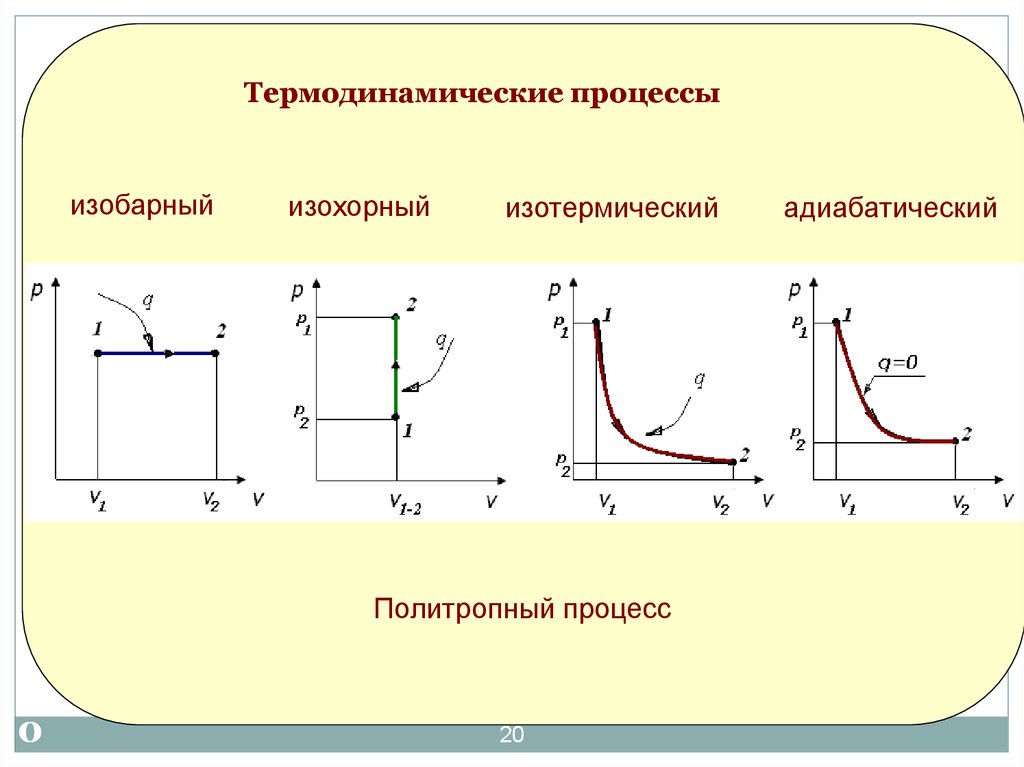
19. Термодинамические процессы и циклы
Термодинамический процесс:всякое изменение хотя бы одного из
параметров состояния.
Термодинамический цикл:
совокупность термодинамических
процессов, в которых рабочее тело,
пройдя ряд состояний, возвращается
в исходное состояние.
Прямые и обратные процессы:
Если в процессе имеет место
увеличение объема (расширение),
то это процесс прямой;
Если объем уменьшается (сжатие),
то это процесс обратный
Прямые и обратные циклы
Если направление процессов по
часовой стрелке, то цикл прямой;
Если направление процессов против
часовой стрелки , цикл обратный.
19
19
20.
Термодинамические процессыизобарный
изохорный
изотермический
Термодинамические процессы
Политропный процесс
2
0
20
адиабатический
21. Первое «Начало» термодинамики»
Первое начало: невозможенпроцесс возникновения или
исчезновения энергии (общий
закон сохранения энергии)
Для закрытой системы
Q U L ,
q u l
Дж
, Дж/кг
Если масса системы неизменна, то
«теплота (Q), полученная системой
извне, используется на изменение ее
внутренней энергии (ΔU) и совершение
работы расширения (L) над внешними
силами (окружающей средой»
dq du dl
21
21
22.
Термодинамические процессыПроцесс
Изобарный,
p const
Изохорный
const
Изотермический
T const; 0
Адиабатический
2
2
q 0
Взаимосвязь параметров
Выражение первого
начала
термодинамики
T2 2
T1 1
q U l
T2 p2
T1
p1
q U
p2 1
p1 2
q l
p2
p1
1
2
22
k
U l
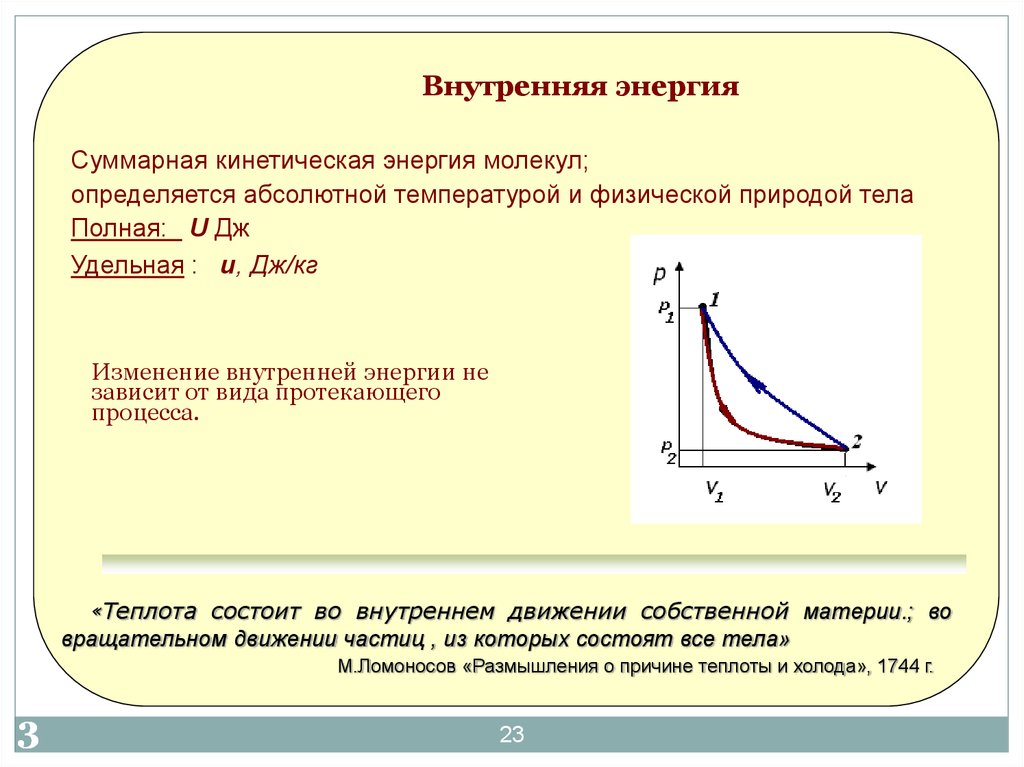
23. Внутренняя энергия
Суммарная кинетическая энергия молекул;определяется абсолютной температурой и физической природой тела
Полная: U Дж
Удельная : u, Дж/кг
Изменение внутренней энергии не
зависит от вида протекающего
процесса.
«Теплота
состоит во внутреннем движении собственной материи.; во
вращательном движении частиц , из которых состоят все тела»
2
3
М.Ломоносов «Размышления о причине теплоты и холода», 1744 г.
23
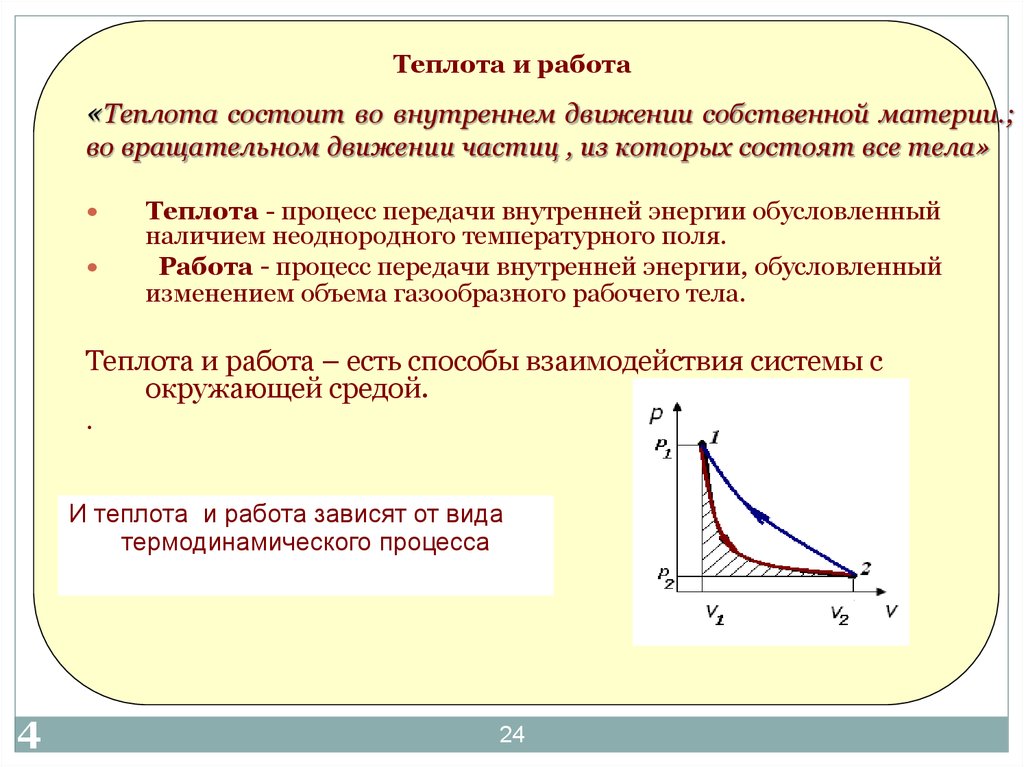
24. Теплота и работа
«Теплота состоит во внутреннем движении собственной материи.;во вращательном движении частиц , из которых состоят все тела»
Теплота - процесс передачи внутренней энергии обусловленный
наличием неоднородного температурного поля.
Работа - процесс передачи внутренней энергии, обусловленный
изменением объема газообразного рабочего тела.
Теплота и работа – есть способы взаимодействия системы с
окружающей средой.
.
И теплота и работа зависят от вида
термодинамического процесса
2
4
24
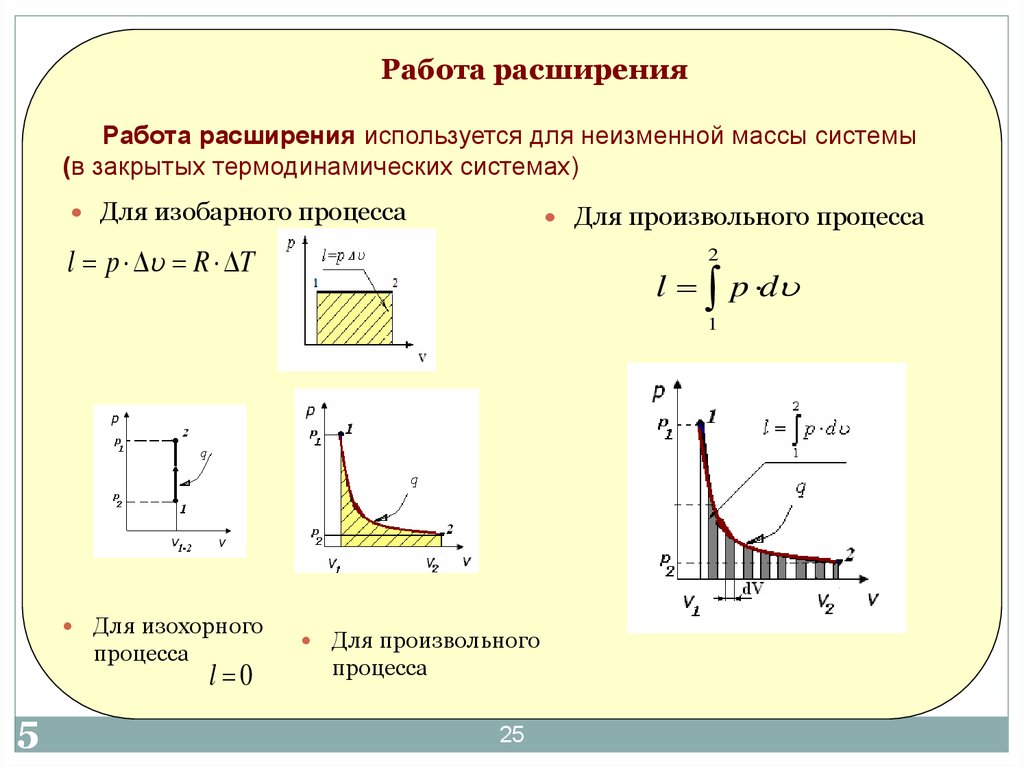
25. Работа расширения
Работа расширения используется для неизменной массы системы(в закрытых термодинамических системах)
Для изобарного процесса
Для произвольного процесса
l p R T
2
l p d
1
2
5
Для изохорного
процесса
l 0
Для произвольного
процесса
25
26.
Работа вытеснения и располагаемая работаРабота располагаемая
используется при перемещении
массы (газового потока) и
определяется как разность работы
расширения и работы вытеснения:
Работа вытеснения
(перемещения) используется при
перемещении массы (газового
потока) из области с давлением р1
в область с давлением р2 :
lвытес p2 2 p1 1
dl0 dl расш dlвытес
2
dl0 p d d ( p )
dlвытес d ( p )
1
2
l0 dp
1
2
6
26
27. Энтальпия (работоспособность)
Энтальпияпараметр
состояния,
характеризующий
работоспособность системы и выражаемый в виде суммы внутренней
энергии и работы перемещения газа объемом V из вакуума в
пространство с давлением р :
Í U p V , Äæ
h u p ,
Дж/кг
dh du d ( p )
Изменение энтальпии не зависит от вида
термодинамического
процесса
и
определяется
только
абсолютной
температурой и физической природой тела
27
27
dh 0
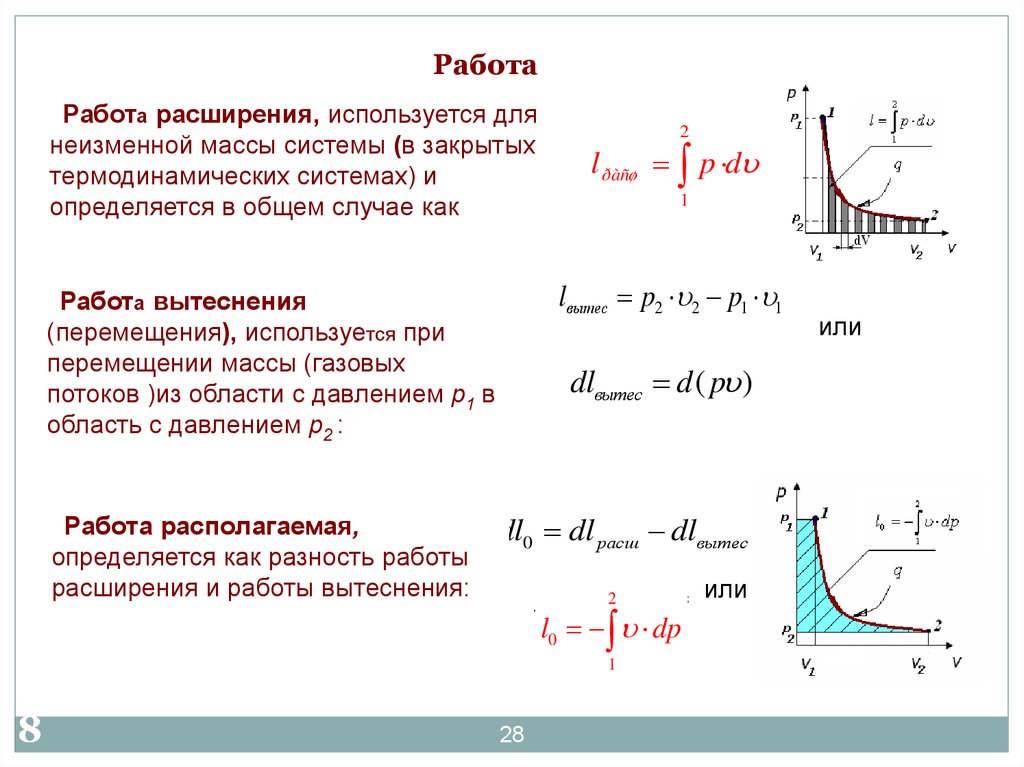
28. Работа
Работа расширения, используется длянеизменной массы системы (в закрытых
термодинамических системах) и
определяется в общем случае как
2
8
l ðàñø p d
1
lвытес p2 2 p1 1
Работа вытеснения
(перемещения), используется при
перемещении массы (газовых
потоков )из области с давлением р1 в
область с давлением р2 :
Работа располагаемая,
определяется как разность работы
расширения и работы вытеснения:
2
dlвытес d ( p )
dl0 dl расш dlвытес
.
2
l0 dp
1
28
;
или
или
29. Энтропия
Энтропия – есть мера неупорядоченности системы:S = k lnW
Важно изменение энтропии, а не её абсолютное значение
Энтропия – параметр состояния, дифференциал которого
равен элементарному количеству теплоты, отнесенному
абсолютной температуре.
dq
dS
T
2
9
29
!
30.
Первое начало термодинамики для открытых системПри составлении уравнения баланса энергии для стационарного течения
несжимаемого газового потока (открытой термодинамической системы) без
совершения технической работы необходимо дополнительно учитывать
кинетическую энергию массы движущегося рабочего тела и работу,
затрачиваемую на перемещение газа (работу вытеснения).
m w2
Q U
Lвытесн
2
где
Lвытесн p V
w2
q u lвытес
2
работа вытеснения (перемещения)
или
30
w2
dq du d dlвытес
2
(1)
30
31.
Первое начало термодинамики для открытых системСравнивая (1)
w2
dq du d dlвытес
2
w2
dl d
dlвытес
2
Учитывая, что
Учитывая, что
то из (1):
dl dlвытес
или
dl dlвытес dl0
dq du dl
с
w2
d
2
w2
dl0 d
2
(2)
dh du d ( p )
w2
dq dh d
или с учетом (2)
2
31
dq dh dl0
31
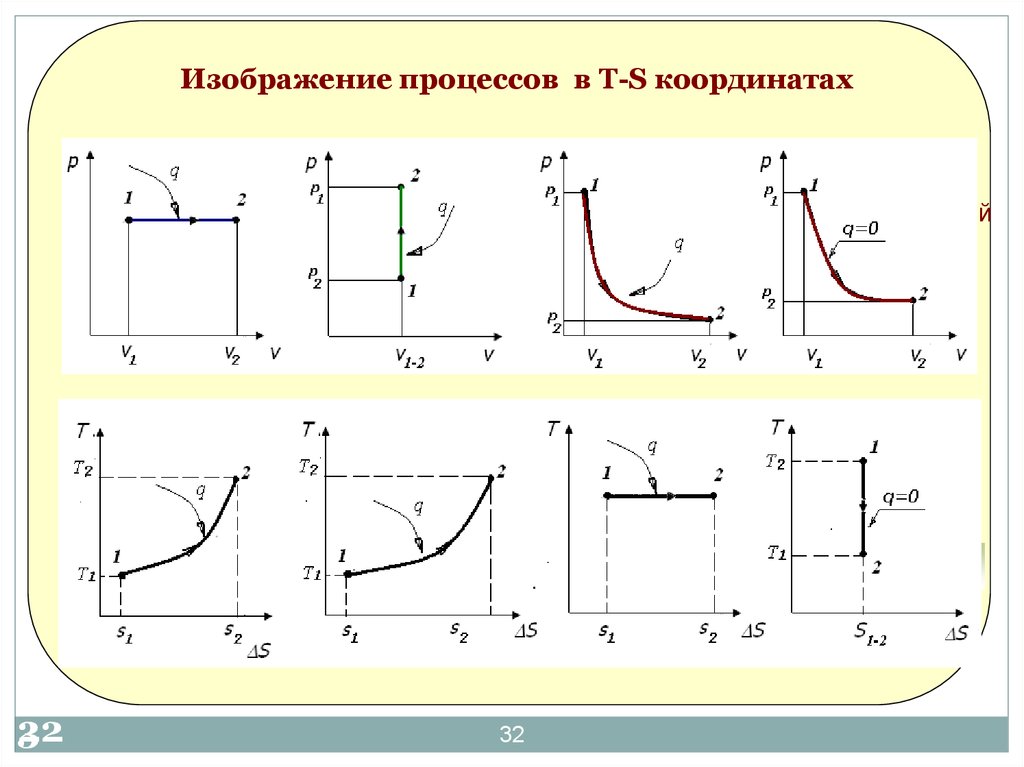
32. Изображение процессов в Т-S координатах
изобарный3
32
2
изохорный
изотермический
32
адиабатический
33. Теплоемкость идеальных газов
Очевидно:При подводе теплоты к рабочему телу увеличивается внутренней
энергии и изменяются параметры состояния (температура).
Одинаковое количество теплоты, подведенное к телам разной
природы, вызывает неодинаковое изменение температуры.
Количество теплоты необходимое для одинакового изменения
температуры разных тел зависит от физической природы тела и
количества вещества. Чем больше вещества в системе, тем больше
требуется теплоты.
C
dQ Äæ
,
dT
Ê
- свойство рабочего тела, характеризующее количество теплоты,
получаемое или отдаваемое телом, отнесенное к изменению
температуры
при
бесконечно
малом
изменении
его
термодинамического состояния.
3
3
33
34. Виды удельной теплоемкости
Джкг К
C
c
m
массовая
Дж
м3 К
C
c'
V
объёмная
мольная
(z – количество молей)
c
C
,
z
Взаимосвязь между массовой и объемной:
c
C
c
c'
m
V
c' c
Взаимосвязь между массовой и мольной:
c
3
4
c
c ñ
34
Äæ
ì î ëü Ê
35.
Виды теплоемкости в зависимости от вида термодинамическогопроцесса
Теплоемкость
Изохорная
Изобарная
dq
c
dt
3
5
cp
35
dq p
dt
36. Важные соотношения
Уравнения МайераДля 1 кг:
Для 1 моля:
cP
k
c
с p c R
R
c
k 1
k- показатель адиабаты
k =5/3 = 1,67 - 1- атомный газ;
k = 7/5 = 1,4 - 2-х атомный;
k= 9/5 = 1,29 - 3-х и более атомный газ.
3
6
с p c R
36
cP
k R
k 1
37. Применение понятия теплоемкости для определения:
Теплоты политропного процессаИзменения внутренней энергии
37
dq c dT
dU c dT
Изменения энтальпии
dh c p dT
Изменения энтропии
Ti 1
s c ln
Ti
37
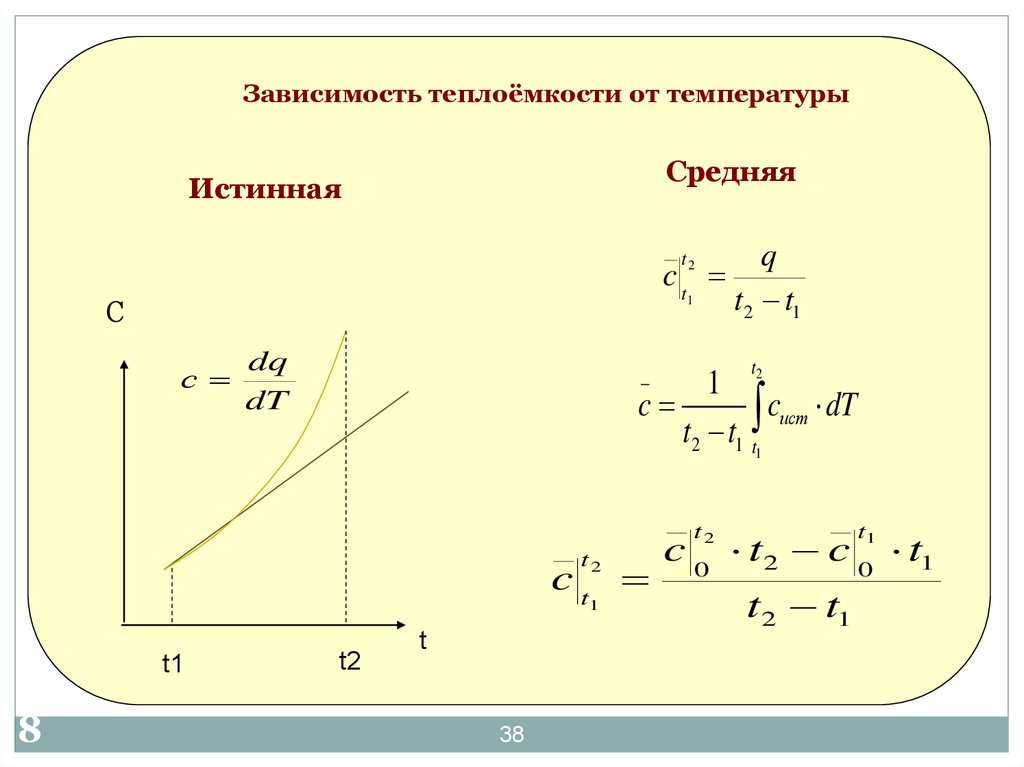
38. Зависимость теплоёмкости от температуры
СредняяИстинная
q
ct
1
t2 t1
t2
С
с
dq
dT
t2
_
1
c
cист dT
t2 t1 t1
t2
t2
ct
1
3
8
t1
t2
t
38
t1
c 0 t2 c 0 t1
t2 t1
39. Смеси идеальных газов (газовые смеси)
Состав смеси обычно задаетсяобъемными,
массовыми
mi
gi
mсм
3
9
Vi
Vсм
ri
мольными долями.
39
zi
i
см
40. Термодинамические параметры смеси, заданной объемными долями
nсм (ri i )
Плотность
i 1
n
см (ri i )
Молярная кажущаяся
масса
4
0
Газовая постоянная
Парциальные давления
i 1
Rсм
1
n
ri
R
i 1
i
pi ri pсм
40
41. Термодинамические параметры смеси, заданной массовыми долями
1n
gi
i 1 i
1
n
gi
i 1 i
см
Плотность
Молярная кажущаяся
масса
см
Газовая постоянная
n
Rсм ( gi Ri )
i 1
Парциальные давления
41
Ri
pi gi
pсм
R см
41
42.
Политропные термодинамическиепроцессы
42
42
43.
Вывод уравнения политропного процесса1-е начало термодинамики в дифференциальном виде
dq du dl
dq dh dl0
c dT c dT p d
(c c ) dT p d
Разделим 2-е на 1-е,
сохраняя равенство:
Обозначим:
c cp
c c
n
c dT c p dT dp
(c c p ) dT dp
(1)
c cp
c c
тогда
43
(2)
dp
p d
n
dp
p d
43
44.
Вывод уравнения политропного процессаn
Разделяя переменные:
Интегрируя:
n
d
n ln ln р ln C
n
Потенциируя:
dp
p d
2
p2
p
1
1
dp
p
или:
1
или:
2
p2
n ln
ln
1
p1
p2 1
p1 2
n
p1 p2 2 p n
n
1
n
p n const
44
44
45.
Удельная теплоемкость политропного процессаРанее было обозначено:
c cp
c c
n
Тогда с учетом:
cp
c
k
n k
c c
n 1
45
45
46.
Политропные процессы в идеальных газахУравнение политропного
процесса
n
d
Соотношения между
параметрами состояния
dp
p
n
2
p1
p2
1
p n const
Показатель политропы
n
2
1
c cp
c c
Теплоемкость процесса
p2
p
1
n k
c c
n 1
4
6
n 1
46
n 1
n
T1
T2
T2
T1
47.
Уравнение адиабатического процессаp n const
dq
c
0
dT
q 0
n
c cp
n
c c
0 cp
0 c
cp
c
k
p k const
p1 1k p2 2 k p k
47
47
48.
Адиабатические процессы в идеальных газахУравнение процесса
Соотношения между
параметрами состояния
p k const
k
2
p1
p2
1
Теплоемкость процесса
c c
n k
k k
c
0
n 1
k 1
2
1
Показатель адиабаты)
n
4
8
c cp
c c
0 cp
0 c
cp
c
p2
p
1
k
48
k 1
k 1
k
T1
T2
T2
T1
49. Термодинамические процессы
Процесс,уравнение
p n const
Изобарный,
p const
Изохорный
const
Изотермический
T const; 0
p const
Взаимосвязь
параметров
4
9
Показатель
политропы
T2 2
T1 1
q U l
n 0
T2 p2
T1
p1
q U
n
p2 1
p1 2
Адиабатический
q 0
p k const
Первое начало
термодинамики
p2
p1
1
2
q l
U l
k
49
n 1
n k
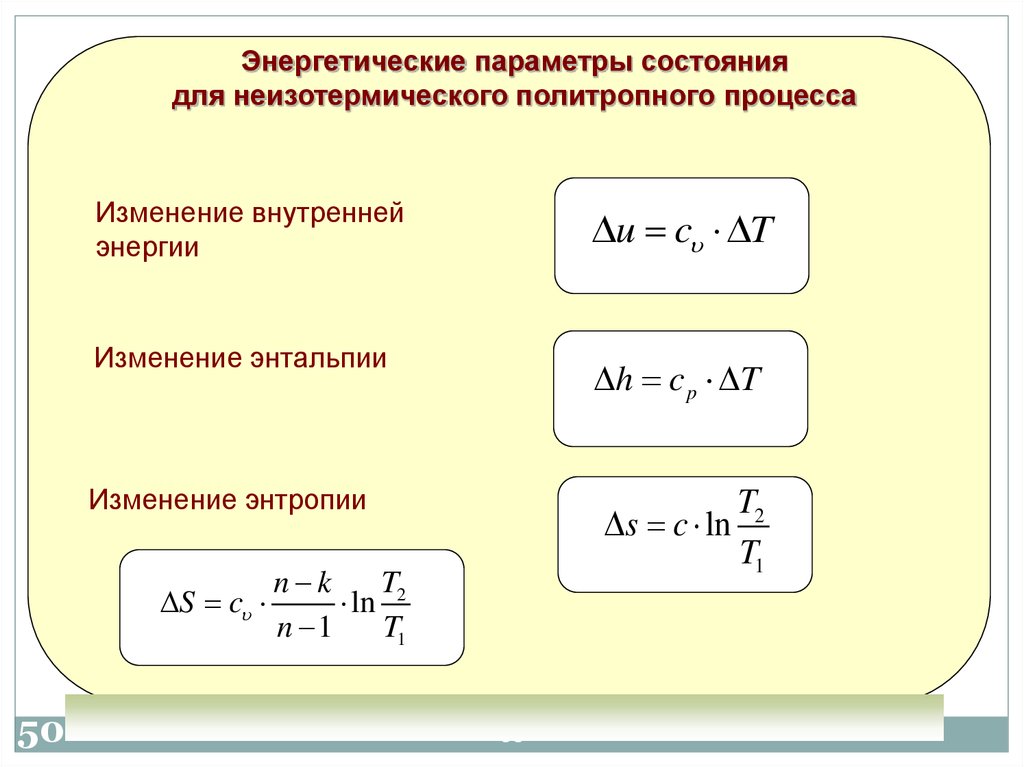
50.
Энергетические параметры состояниядля неизотермического политропного процесса
Изменение внутренней
энергии
u c T
Изменение энтальпии
h c p T
Изменение энтропии
S c
50
T2
s c ln
T1
n k
T
ln 2
n 1
T1
50
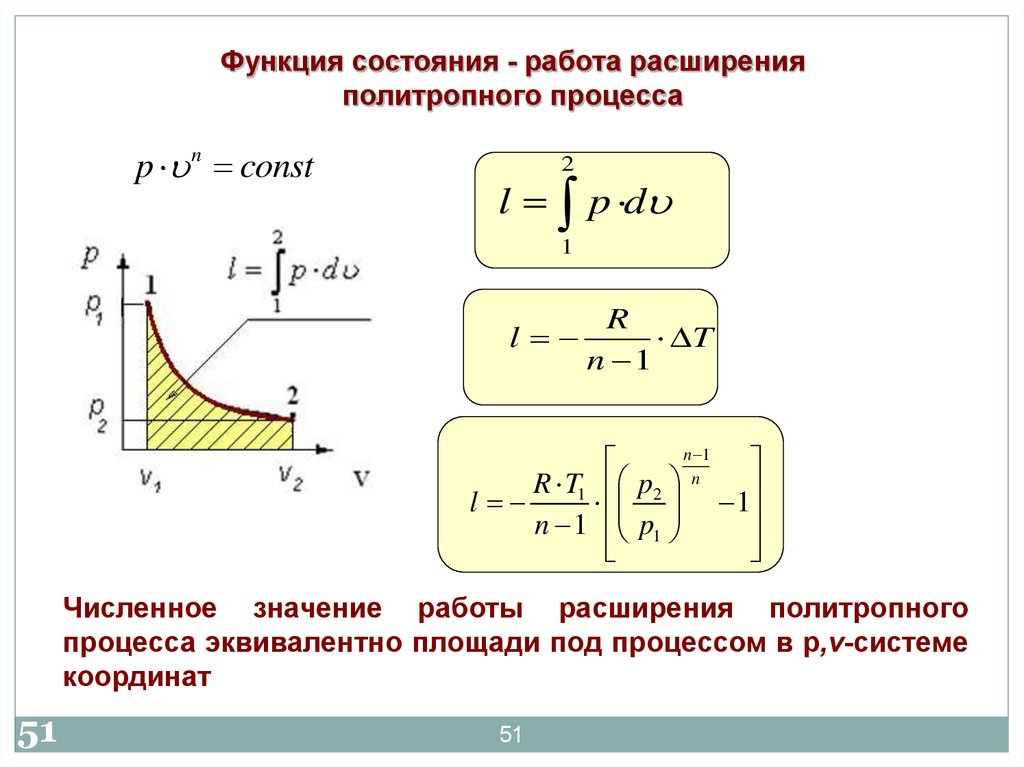
51.
Функция состояния - работа расширенияполитропного процесса
p n const
2
l p d
1
R
l
T
n 1
n 1
R T1 p2 n
l
1
n 1 p1
Численное значение работы расширения политропного
процесса эквивалентно площади под процессом в р,v-системе
координат
51
51
52.
Функция состояния – располагаемая работаполитропного процесса
p n const
n
n
d
dp
p
l
dp
0
p d l расш
l0
5
2
2
l0 dp
1
l0 n l
n 1
n
n R T1 p2
l0
1
n 1 p1
n
R T
n 1
Численное значение располагаемой работы политропного
процесса эквивалентно площади под процессом в р,v-системе
координат
52
53.
Функция состояния - теплота неизотермическогополитропного процесса
ds
dq
T
p n const
dq c dT
c c
dq T ds
n k
n 1
2
q T ds
1
5
3
Численное значение теплоты политропного процесса
эквивалентно площади под процессом в T, s-системе
координат
53
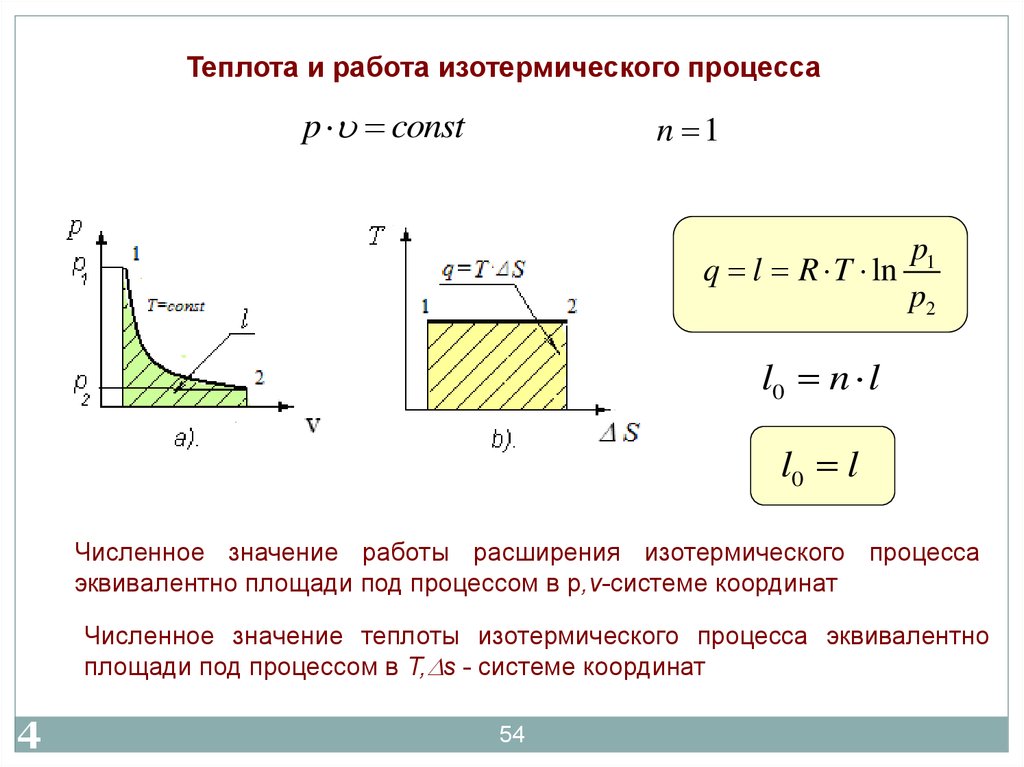
54.
Теплота и работа изотермического процессаp const
n 1
p1
q l R T ln
p2
l0 n l
l0 l
Численное значение работы расширения изотермического процесса
эквивалентно площади под процессом в р,v-системе координат
5
4
Численное значение теплоты изотермического процесса эквивалентно
площади под процессом в T, s - системе координат
54
55.
Все о политропных процессах55
55
56.
56Конец раздела







































 physics
physics








