Similar presentations:
Термодинамика и теплопередача
1. Термодинамика и теплопередача
2.
• Савченко Григорий Борисовичsavtchenco_gb@voenmeh.ru
3. Цель курса
--
ознакомление с основными законами термодинамики и
теплопередачи
ознакомление с общими принципами термодинамического
анализа
ознакомление с принципами термодинамического анализа
тепловых машин
ознакомление с принципами анализа теплообменного
оборудования
- Получение
студентами
навыков
анализа
термодинамических и теплообменных процессов:
- Получение студентами навыков анализа тепловых
машин
4. Литература
• 1. Техническая термодинамика. Под ред. В.И.Крутова, М»,Высшая школа» 1981 .
• 2. В.А.Кирилин, В.В.Сычев, А.Е.Шейндин. Техническая
термодинамика , М., Энергоиздат, 1982.
• 3. В.В.Нащокин, Техническая термодинамика и теплопередача.
М., Высшая школа.
• 4. Исаченко Б,П., Осипова Б.А., Сукашл А,С. Теплопередача М.,
Энергия, 1975 488 с.
• 5. Кутателадзе С.С. Основы теории теплообмена. Новосибирск,
Наука, Сибирское отделение, 1970» 659 с.
• 6. Электронный ресурс: Душин, Юрий Александрович.
Термодинамика и тепло-массопередача [Электронный ресурс] :
графическое сопровождение лекций [для вузов] / Ю. А. Душин ;
БГТУ "ВОЕНМЕХ". - Электрон. текстовые дан. - СПб., 2008. - 1
эл. жестк. диск : цв. : граф., схемы, табл. - Библиогр.: с. 2. Приложения: с. 39. - elr00946.pdf
5. Раздел 1. Введение в термодинамику
6. Разделы термодинамики
• - общая термодинамика (занимаетсявыявлением принципов и закономерностей
различных процессов и явлений обмена
энергией)
• - техническая термодинамика (занимается
практическим приложением
закономерностей, выявленных общей
термодинамикой)
• - химическая термодинамика (занимается
выявлением закономерностей протекания
процессов в сложных т/д системах)
7. Основные понятия общей термодинамики
Энергия
Термодинамическая система
Окружающая среда
Контрольная поверхность
Рабочее тело
Термодинамический процесс
8. Виды преобразования энергии
• 1. Работа (макроуровень)Переданное количество энергии –
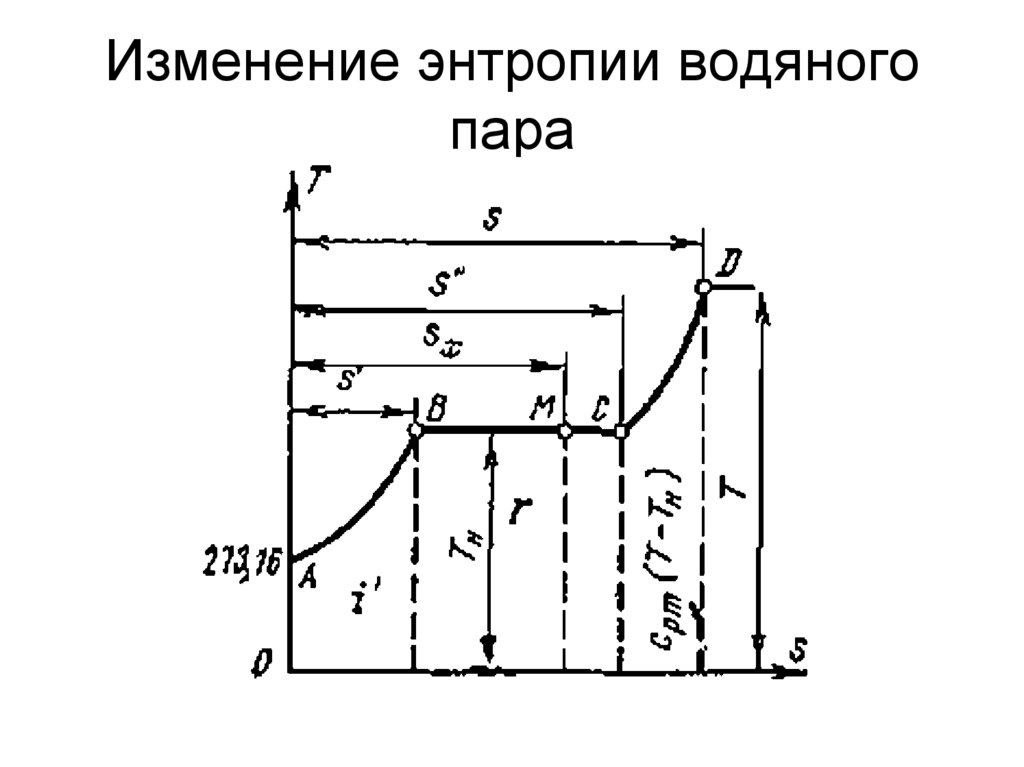
работа процесса.
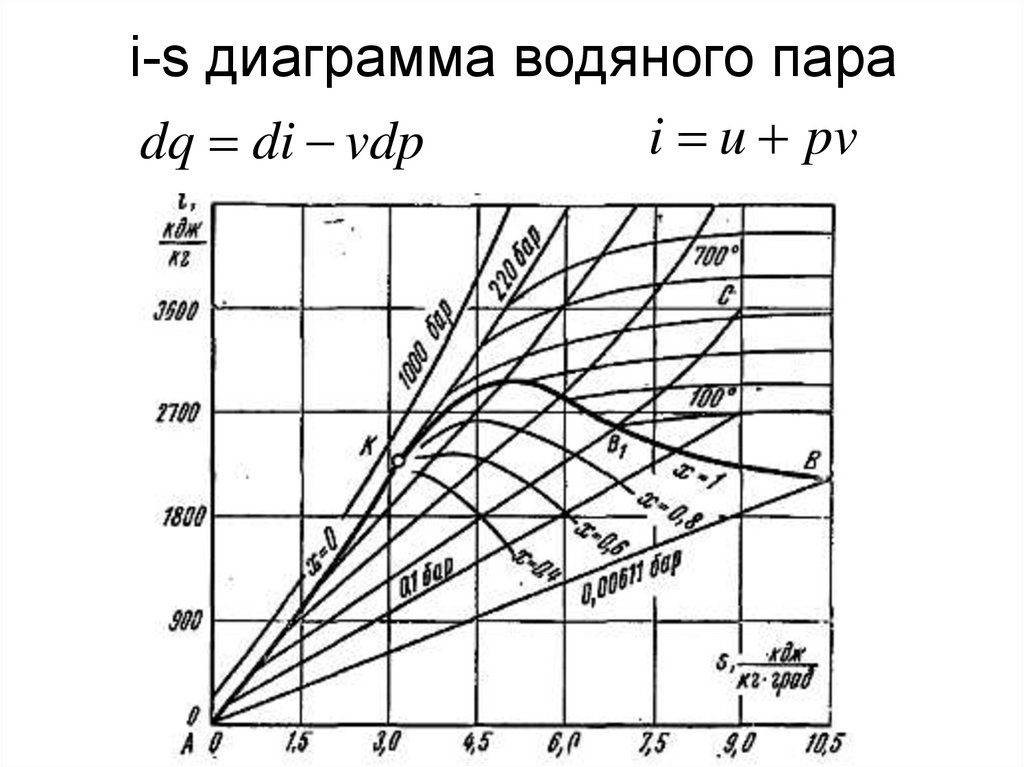
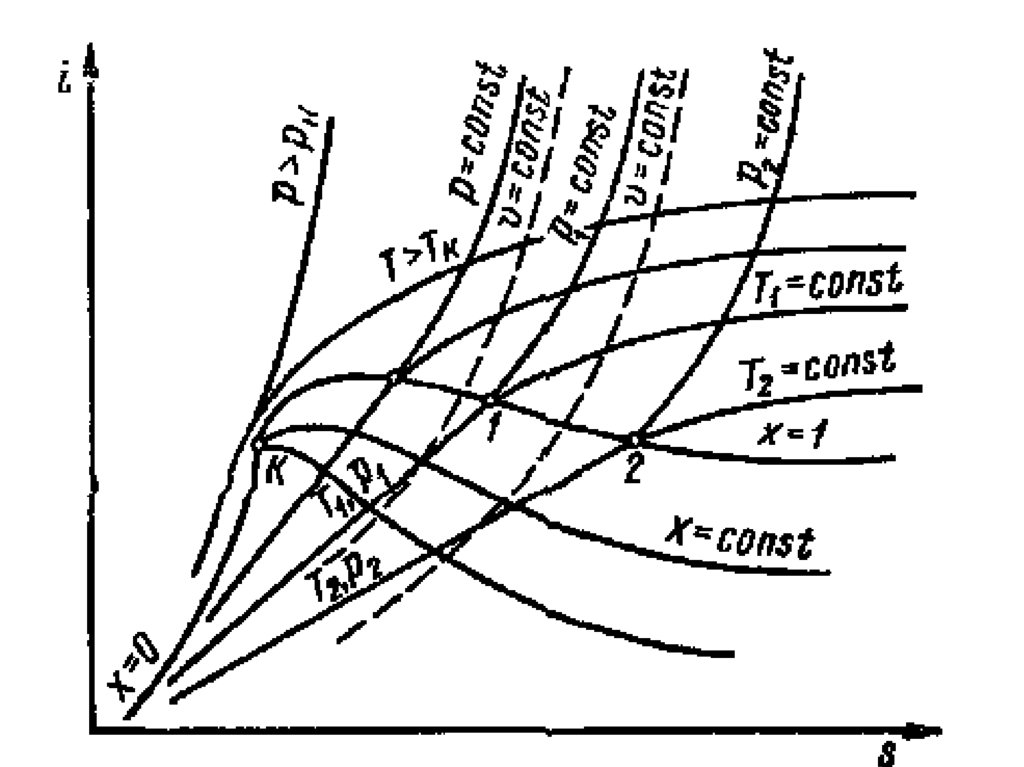
• 2. Теплота (микроуровень)
Переданное количество энергии –
теплота процесса
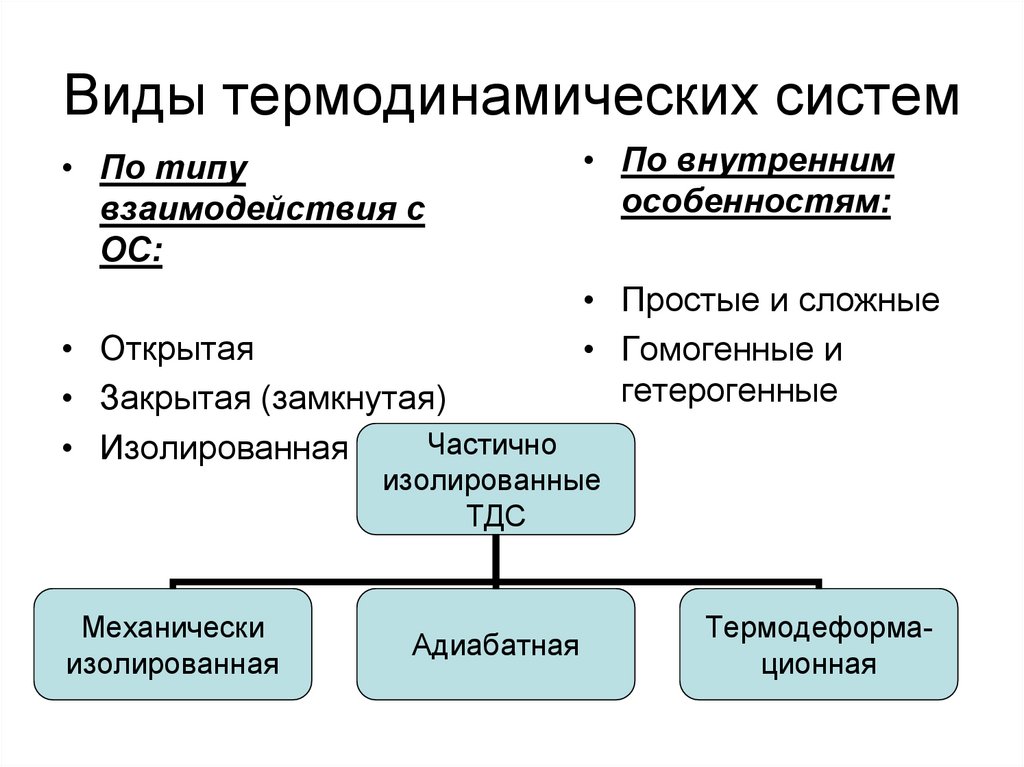
9. Виды термодинамических систем
• По типувзаимодействия с
ОС:
• Открытая
• Закрытая (замкнутая)
Частично
• Изолированная
• По внутренним
особенностям:
• Простые и сложные
• Гомогенные и
гетерогенные
изолированные
ТДС
Механически
изолированная
Адиабатная
Термодеформационная
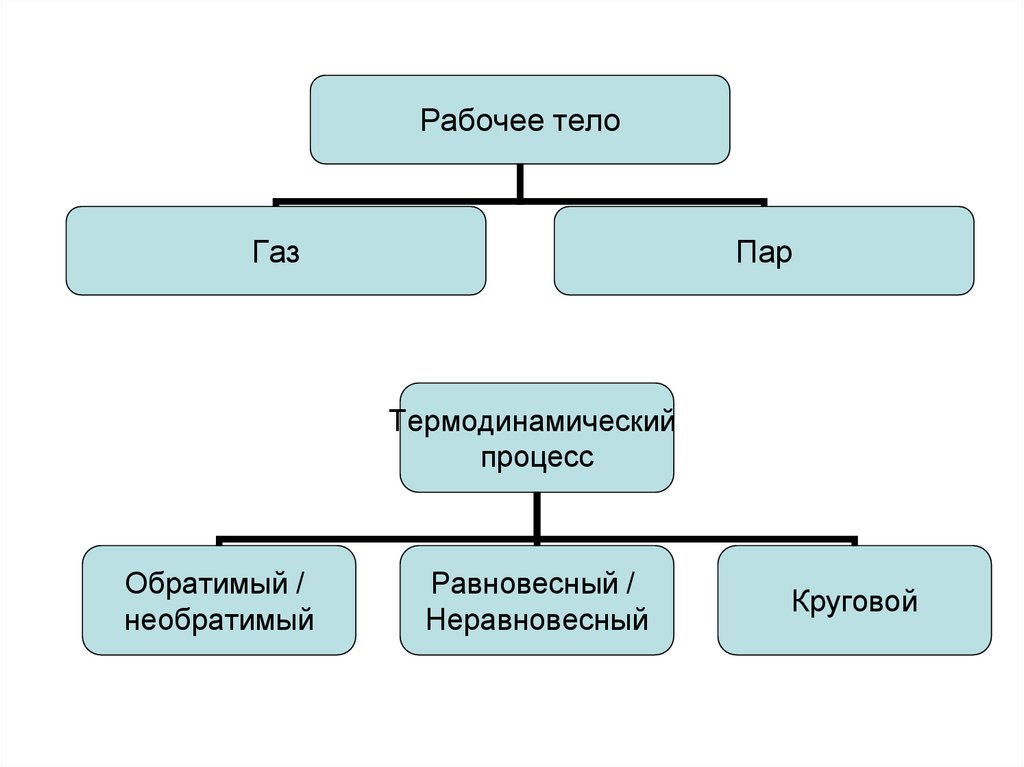
10.
Рабочее телоГаз
Пар
Термодинамический
процесс
Обратимый /
необратимый
Равновесный /
Неравновесный
Круговой
11.
Основные т/дпараметры
Давление
р [Па]
Удельный объем
v [м3/кг]
Температура
Т [К]
Основные т/д
функции
Внутренняя
энергия
Работа
Теплота
12. Законы идеального газа
Уравнение Клайперона:pv
p1v1 p2 v2
... i i R const
T1
T2
Ti
Для произвольной массы газа:
p V M R T
где
p – абсолютное давление [Па];
v – удельный объем [м3/кг];
T – абсолютная температура [К];
R – газовая постоянная;
R – удельный объем одного моля
газа [м3/моль]
v – универсальная газовая
постоянная [Дж/мольК]
µ – масса 1 моля [г/моль]
м3
v 22,4 10
моль
3
Для одного моля газа:
p v R T
1,013 105 22,4 10 3
Дж
R
8,314
288
моль К
R
R
8,314 Дж
кгК
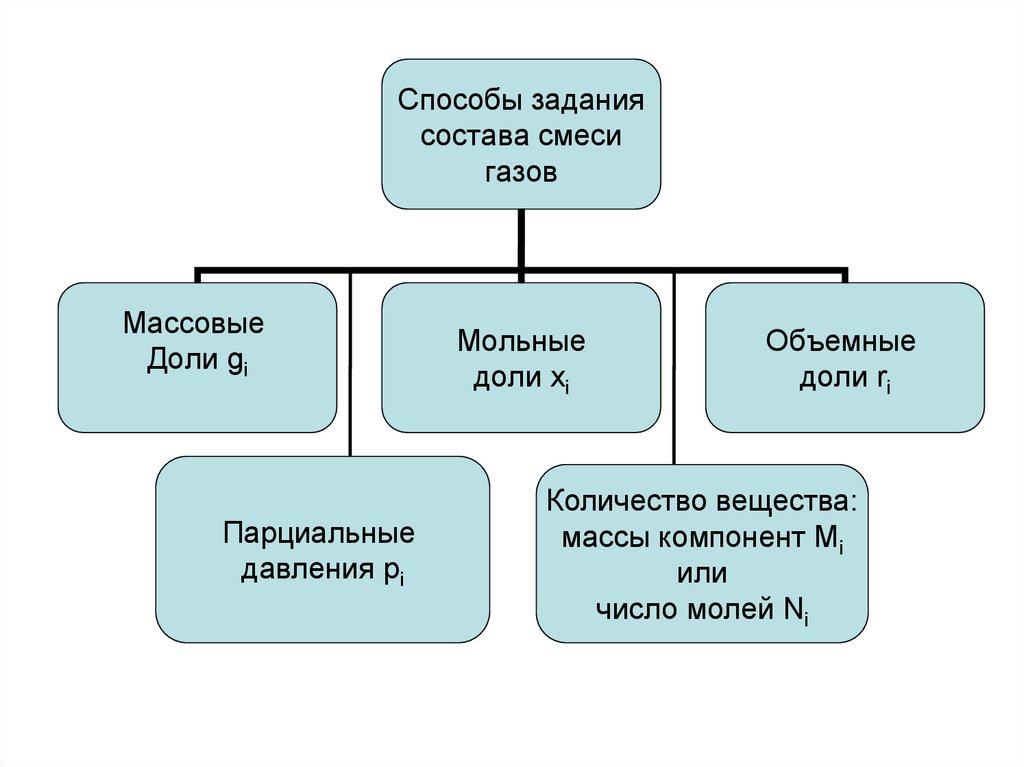
13.
Способы заданиясостава смеси
газов
Массовые
Доли gi
Парциальные
давления pi
Мольные
доли xi
Объемные
доли ri
Количество вещества:
массы компонент Мi
или
число молей Ni
14. Соотношения для расчета состава смеси газов:
Парциальными давлениямиn
pсм pi
i 1
Парциальными объемами
n
V
Vсм
Массами компонент
i
i 1
n
M см М i
i 1
Числом молей компонент
n
N см N i
i 1
Массовыми, объемными
или мольными долями
n
n
n
m r x
i 1
i
i 1
i
i 1
i
1
15. Расчет состава с помощью долей
Массовые долиОбъемные доли
Мольные доли
Парциальные
давления
Газовая
постоянная
Мольная масса
mi
ri
Mi
N
R
i i i xi i ri ri см
M см см N см см
см
Ri
Vi
v Ni
R
p
i
xi mi i mi см i
Vсм vсм N см
Rсм
i
pсм
xi
Vi
v Ni
R
p
i
ri mi i mi см i
Vсм vсм N см
Rсм
i
pсм
i
Rсм
pi ri pсм xi pсм mi pсм
mi pсм
см
Ri
Rсм
8,314
см
n
n
i 1
i 1
mi Ri 8,314
mi
i
8,314
n
ri i
i 1
см
n
n
r
8,314
ri i 8,314 i
Rсм
i 1
i 1 Ri
1
n
ri
i 1 Ri
1
8,314
n
n
mi
mi Ri
i 1
i
i 1
16. Теплоемкость идеального газа
CdQ Дж
dT К
C Дж
c
M кгК
C Дж
c
N мольК
Теплоемкость смеси газов
Дж
cсм ci mi
кг
i 1
n
Дж
cсм ci ri
кг
i 1
n
Показатель адиабаты идеального газа
n
k
cp
cv
cp
cv
kсм
c p см
cv см
c p см
c v см
m c
i 1
n
i pi
m c
i 1
i vi
n
r c
pi
r c
vi
i 1
n
i 1
i
i
17. Термодинамические функции
Работа деформации(объемного
расширения)
Располагаемая
(техническая) работа
Теплота
Внутренняя энергия
Энтальпия
dL Mdl р S dx
p dV M p dv Дж
dL0 Mdl0 Vdp
Mvdp Дж
dQ Mdq MTds Дж
U U1 p,V U 2 p, T U 3 V , T
I U pV , [ Дж ]
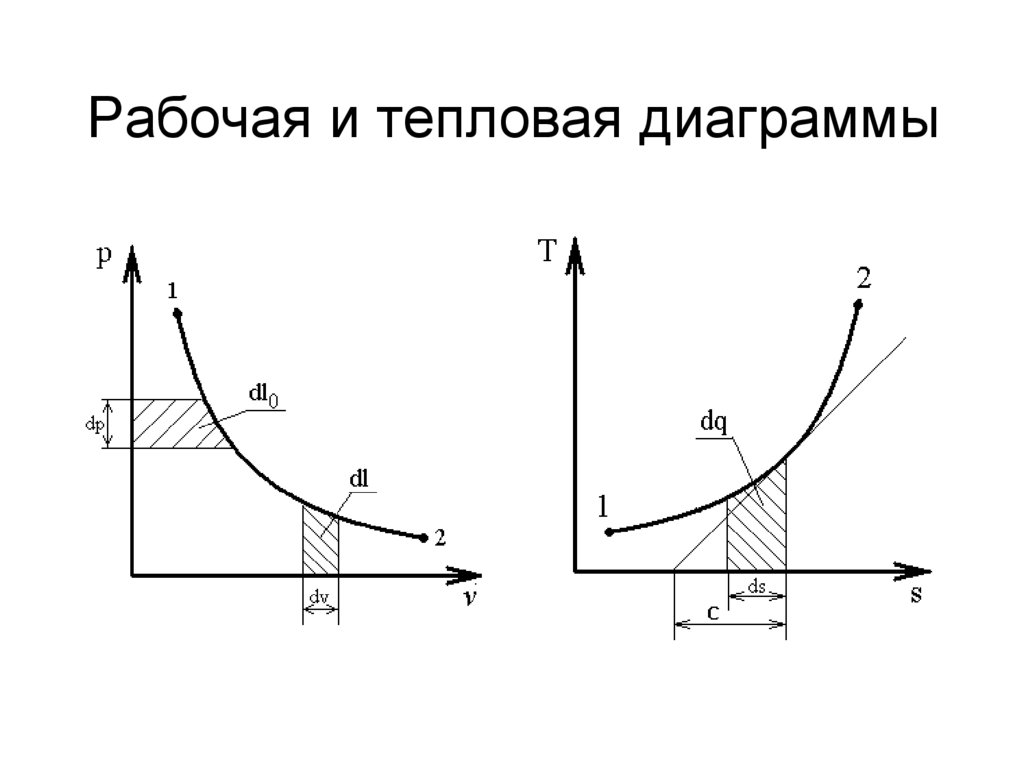
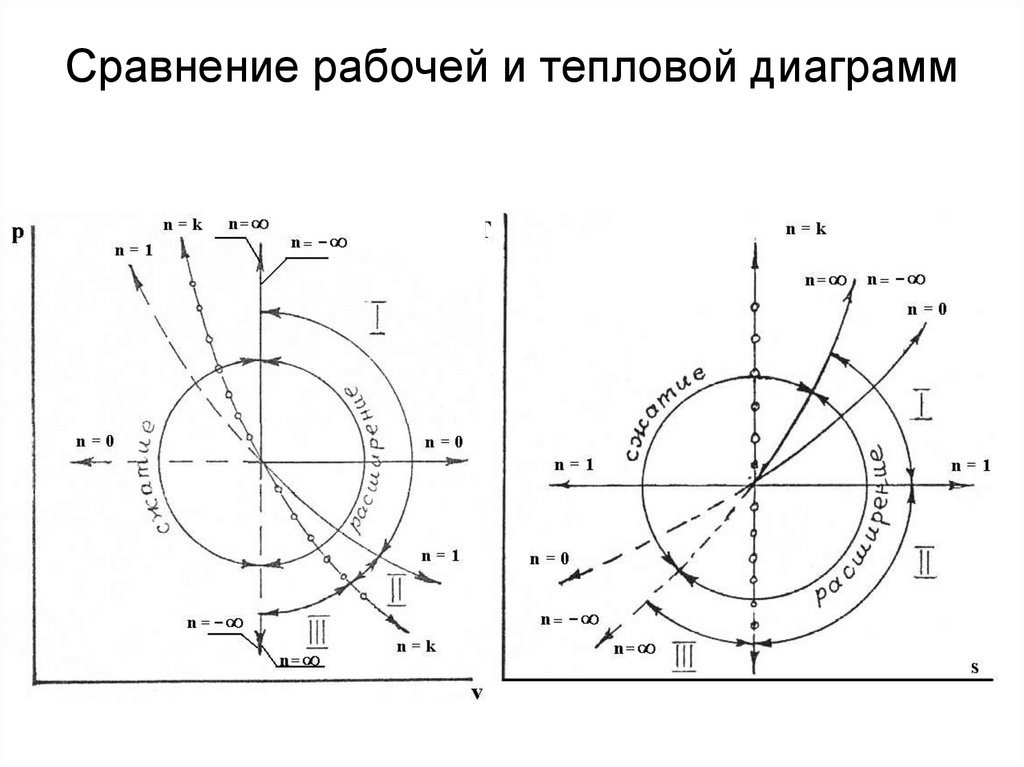
18. Рабочая и тепловая диаграммы
19.
20. Раздел II АНАЛИЗ ТЕРМОДИНАМИЧЕСКИХ ПРОЦЕССОВ ИДЕАЛЬНЫХ ГАЗОВ
21. Необходимые функции
Qq
M
U
u
M
L
l
M
Дж
кг
Q
q
N
U
u
N
L
l
N
Дж
моль
I U pV
dI dU d ( pV )
di du d ( pv)
dl pdv
dl0 vdp
[ Дж ]
Дж
кг
dq cdT Tds
22. I закон термодинамики С использованием параметра «внутренняя энергия»
nQ U L Ai
i 1
или
n
dQ dU dL dAi
i 1
Для простой термодеформационной системы:
dq du dl ;
т.к. dl pdv,
получаем:
dq du pdv;
т.к. dq Tds,
получаем:
du Tds pdv
23. I закон термодинамики
с использованием параметра «энтальпия»dq du pdv vdp vdp du d ( pv) vdp
d (u pv) vdp di vdp di dl0
dq di vdp di dl0
с использованием параметра «свободная энергия»
du Tds pdv sdT sdT откуда du d Ts sdT pdv
d u Ts sdT pdv
df sdT pdv
с использованием параметра «свободная энтальпия»
dq di vdp
di Tds vdp sdT sdT
d i Ts sdT vdp
24. Наиболее важные формы записи I закона термодинамики
dq du pdv;dq di vdp
dq cdT
du cv dT
di c p dT
cp
di
k
c v du
25. Уравнение политропы в p-v координатах
d q c dT cp dT v d pd q c d T cv d T p d v
c c
p
c cv
n
p
c cv
dp
dv
n
0
p
v
pv const
n
n
p1v1 p2 v2
n
c c v d p
pdv
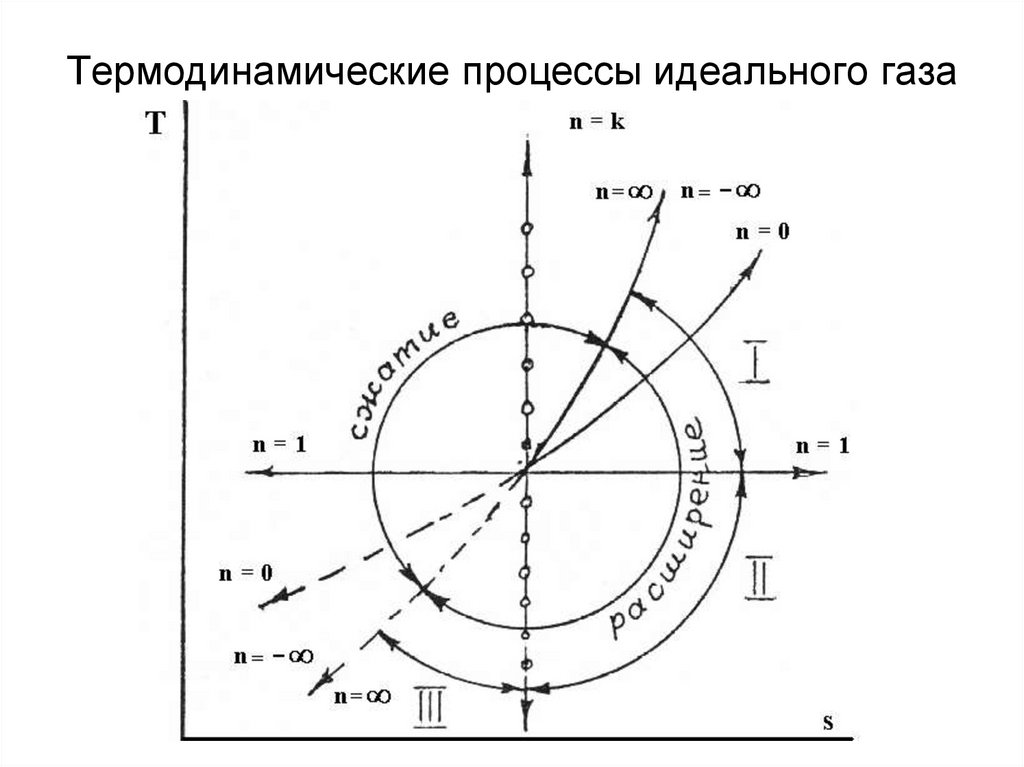
26. Термодинамические процессы идеального газа
27. Уравнение политропы в T-s координатах
d q c dTds
T
T
T2
n k T2
s2 s1 c ln cv
ln
T1
n 1 T1
28. Термодинамические процессы идеального газа
29. Сравнение рабочей и тепловой диаграмм
30. Работа деформации в политропном процессе
dl dq du cdT cv dT (c cv)dTn 1
n 1
RT1 T2 RT1 p2 n p1v1 p2 n
1
l
1
1
n 1 T1 n 1
p1
n 1
p1
pv n pvvn 1 RTv n 1 const
Располагаемая работа в политропном процессе
dl0 dq di (c c p )dT
n 1
n
nRT1
T
np v
p
1 2 1 1 1 2
l0
n 1 T1 n 1 p1
l0 nl
31. Частные случаи политропного процесса
pv constn
c c
T2
s2 s1 c ln
T1
p
c cv
n
Изобарный:
p=const;
n=0;
с=сp
Изохорный:
v=const;
n=±∞;
с=сv
Изотермический: Т=const;
c=±∞
n=1
Адиабатный:
c=0
n=k
dq=Tds=0;
32.
для адиабатного процесса имеем:du cv dT
Т2 - Т1 (p 2 v2 - p1v1 )/R
u cv (T2 Т1 )
R cp - cv
В адиабатном процессе
pv RT
k c p / cv
du dl
c v (p 2 v 2 - p1v1 )
p2 v2 p1v1
u l c v (Т 2 - Т1 )
сp - cv
n 1
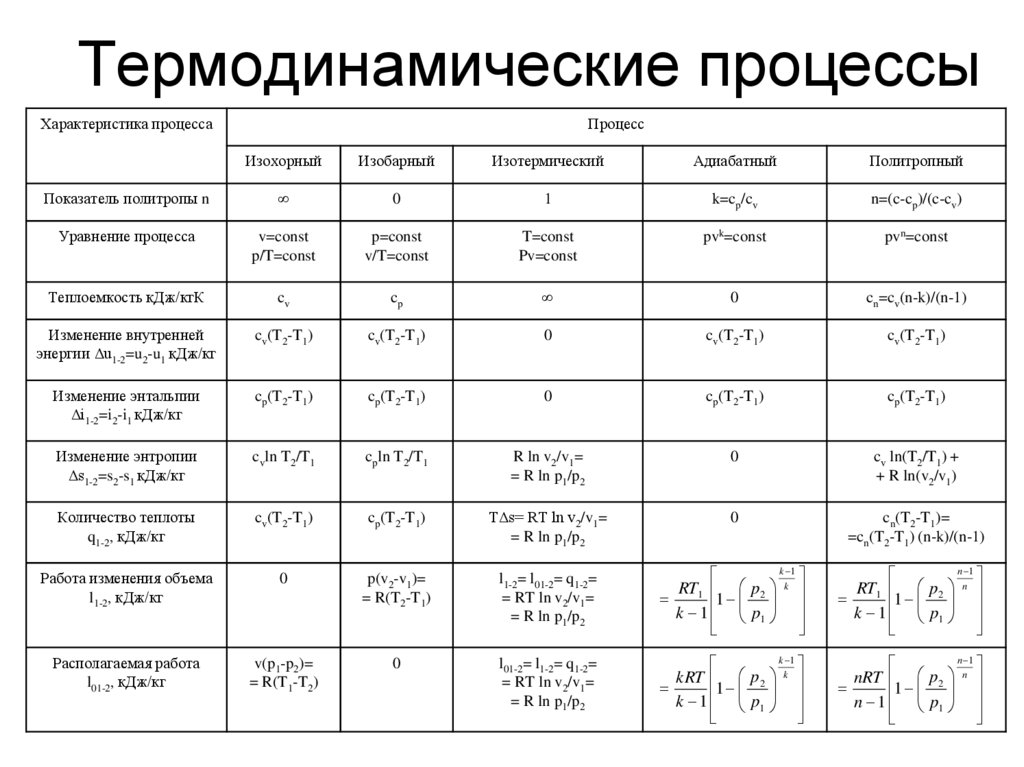
33. Термодинамические процессы
Характеристика процессаПроцесс
Изохорный
Изобарный
Изотермический
Адиабатный
Политропный
Показатель политропы n
∞
0
1
k=cp/cv
n=(c-cp)/(c-cv)
Уравнение процесса
v=const
p/T=const
p=const
v/T=const
T=const
Pv=const
pvk=const
pvn=const
Теплоемкость кДж/кгК
cv
cp
∞
0
cn=cv(n-k)/(n-1)
Изменение внутренней
энергии Δu1-2=u2-u1 кДж/кг
cv(T2-T1)
cv(T2-T1)
0
cv(T2-T1)
cv(T2-T1)
Изменение энтальпии
Δi1-2=i2-i1 кДж/кг
cp(T2-T1)
cp(T2-T1)
0
cp(T2-T1)
cp(T2-T1)
Изменение энтропии
Δs1-2=s2-s1 кДж/кг
cvln T2/T1
cpln T2/T1
R ln v2/v1=
= R ln p1/p2
0
cv ln(T2/T1) +
+ R ln(v2/v1)
Количество теплоты
q1-2, кДж/кг
cv(T2-T1)
cp(T2-T1)
TΔs= RT ln v2/v1=
= R ln p1/p2
0
cn(T2-T1)=
=cn(T2-T1) (n-k)/(n-1)
Работа изменения объема
l1-2, кДж/кг
0
p(v2-v1)=
= R(T2-T1)
l1-2= l01-2= q1-2=
= RT ln v2/v1=
= R ln p1/p2
k 1
RT1 p 2 k
1
k 1 p1
n 1
RT1 p 2 n
1
k 1 p1
Располагаемая работа
l01-2, кДж/кг
v(p1-p2)=
= R(T1-T2)
0
l01-2= l1-2= q1-2=
= RT ln v2/v1=
= R ln p1/p2
k 1
kRT p 2 k
1
k 1 p1
n 1
nRT p 2 n
1
n 1 p1
34.
Раздел IIIТермодинамика потока
35. Уравнение неразрывности
WFWF
M const
v
d F dW d v
F
W
v
36. I закон термодинамики для потока
WE Q LT u pv
gh M
2
2
W 2
g h
q lT i
2
W
d q d i d
2
W 2
g h
l0 lT
2
2
37. Для системы малых размеров, не совершающей технической работы
W 2d q d i v d p d i d l0 d i d
2
W d W v d p
dW 0
→
dp 0
dW 0
→
dp 0
38. Для адиабатной системы
W 2d i
d
2
W22 W12
i1 i2
2
2
W d W d i C p d T
dW 0
→
dW 0 →
di 0
→
dT 0
di 0
→
dT 0
39. Анализ формы канала
d F d v dWF
v
W
dv
dp
v
kp
dp
dv
k
0
p
v
W d W v d p
dW
vd p
2
W
W
d F v d p d p kpv W 2
a2 W 2
dp
dp
2
2
2
F
W
kp
kpW
kpW
a kpv kRT
40.
d F a2 W 2dp
2
F
kpW
• Сопло d p 0
d F 0
• Диффузор d p 0
W1 a1
dF 0
W1 a1
dF 0
d F 0
41. Раздел IV Сложные термодинамические системы Термодинамика реальных газов и паров
42. II закон термодинамики
43. Для обратимого цикла
Tmin1
Tmax
K
t
q2
1
q1
K
t
T2
q2
1 1
T1
q1
q2 q1
T2 T1
q1 q2
q
0
T1 T2
T
dq
ds
T
dq
T 0
44. Для необратимого цикла
qT 0
q1 q2
0
T1 T2
dq
ds
T
q
T 0
dq
ds
T
Tds dq
dq
T 0
dq Tds
dq
T 0
45. II закон термодинамики для адиабатной системы
dq 0dq
ds
T
ds 0
46. Объединенные уравнения Iго и IIго законов термодинамики для простых систем
Tds dqdq du pdv
Tds du pdv
du Tds pdv
di Tds vdp
df pdv sdT
dg vdp sdT
vdp
sdT
47. Сложные термодинамические системы
48. Химический потенциал
dAхим k dM k k dN kДж
k
кг
Дж
k
моль
49. Изменение внутренней энергии сложной ТДС
dU TdS pdV X k dxkk
du k Tds
равн
k
pdvk
внеш
k
dM k
kвнеш k k
du k Tds
равн
k
pdvk k dM k k dM k
50.
nn
n
n
n
k 1
k 1
k 1
k 1
k 1
равн
du
T
ds
k k p dvk k dM k k dM k
n
n
k 1
k 1
dU TdS равн pdV k dM k k dM k
n
неравн
dM
TdS
k k
k 1
TdS TdS
равн
TdS
неравн
T dS
n
равн
dS
dU TdS pdV k dM k
k 1
неравн
51. Объединенные уравнения I и II законов термодинамики для сложных термодинамических систем
ndU TdS pdV k dM k
k 1
dI TdS Vdp k dM k
dF SdT pdV k dM k
dG SdT Vdp k dM k
52. изохорно – изоэнтропная ТДС
dS 0dV 0
n
dU k dM k Aхим 0
k 1
изобарно - изоэнтропная ТДС
dI k dM k 0
dS 0
dp 0
изохорно-изотермическая ТДС
dT 0
dF dM 0
dV 0
изобарно-изотермическая
ТДС
k
dp 0
dT 0
k
dG k dM k 0
53. Термодинамика реальных газов и паров
54. Уравнение состояния реальных газов
Уравнение Ван-дер-Ваальсаa
p 2 a b RT
v
Вириальное уравнение
pv
B (T ) C (T ) D(T )
1
2 3
RT
v
v
v
55.
56.
57. Термодинамические процессы водяного пара
58. Изменение энтропии водяного пара
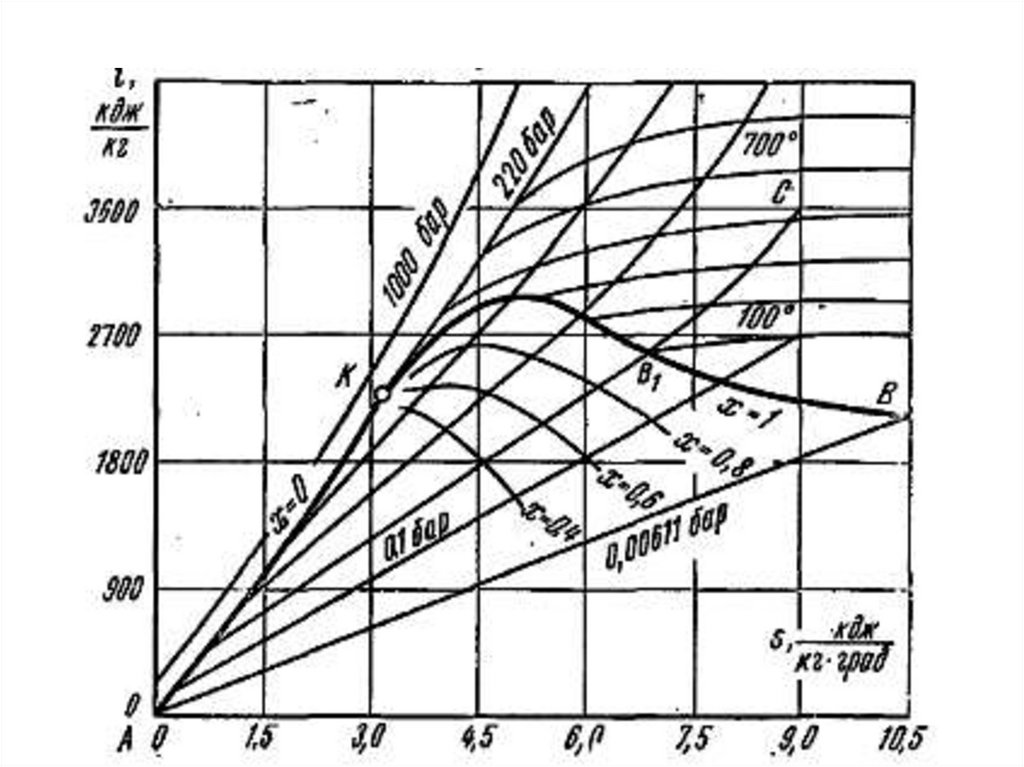
59. i-s диаграмма водяного пара
i u pvdq di vdp
60.
61. Изохорный процесс
u 2 u1 i 2 i1 v( p 2 p1 )v x v'
x
v' ' v'
62. Изобарный процесс
u 2 u1 i 2 i1 p (v 2 v1 )l q u p (v 2 v1 )
63. Изотермический процесс
u 2 u1 (i 2 p 2 v 2 ) (i1 p1v1 )q T ( s 2 s1 )
l q u
64. Адиабатный процесс
l u1 u 2 (i1 p1v1 ) (i1 p1v1 )u2 u1 (i2 p2 v2 ) (i1 p1v1 )
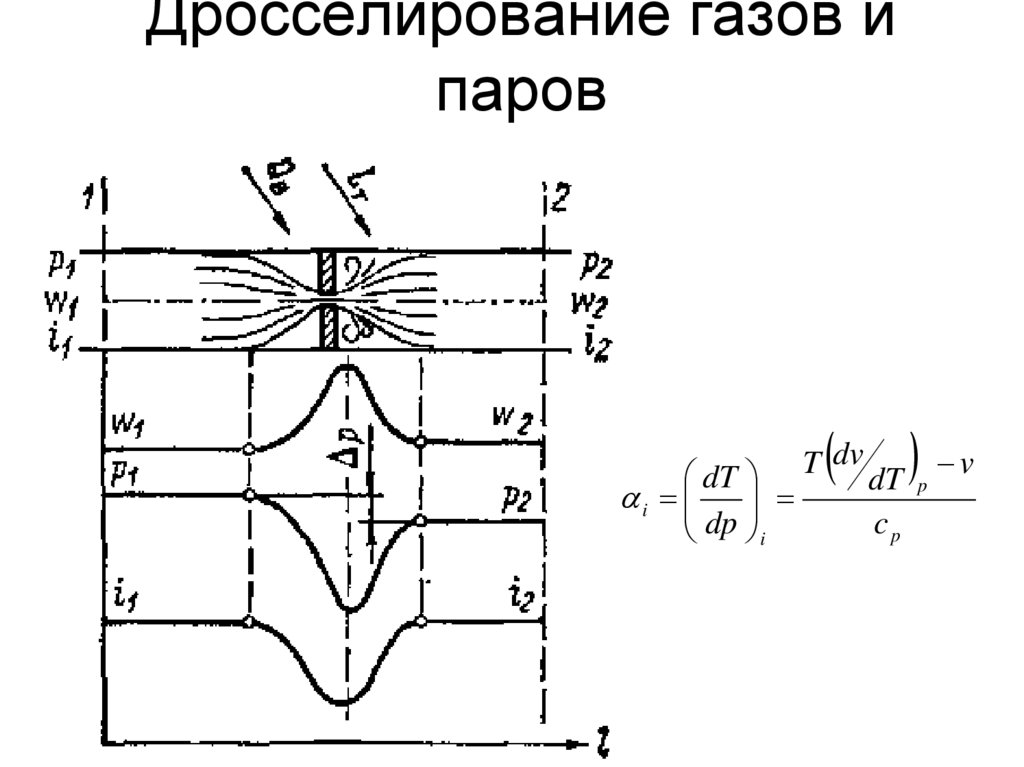
65. Дросселирование газов и паров
dTi
dp i
T dv
dT
cp
v
p




































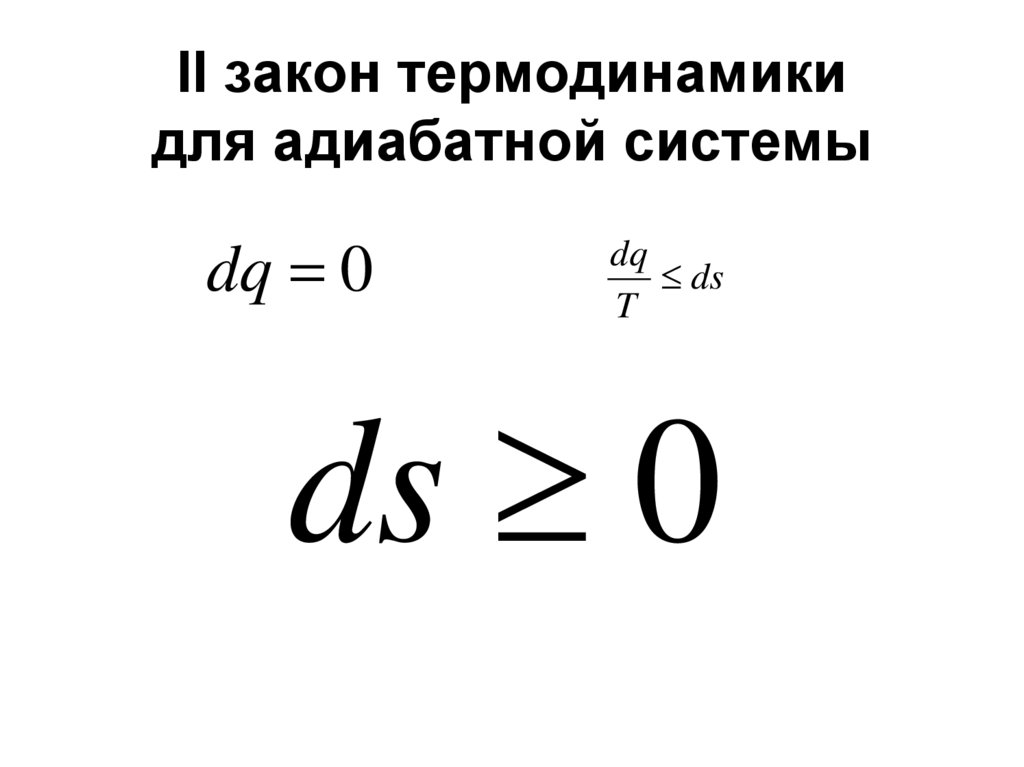




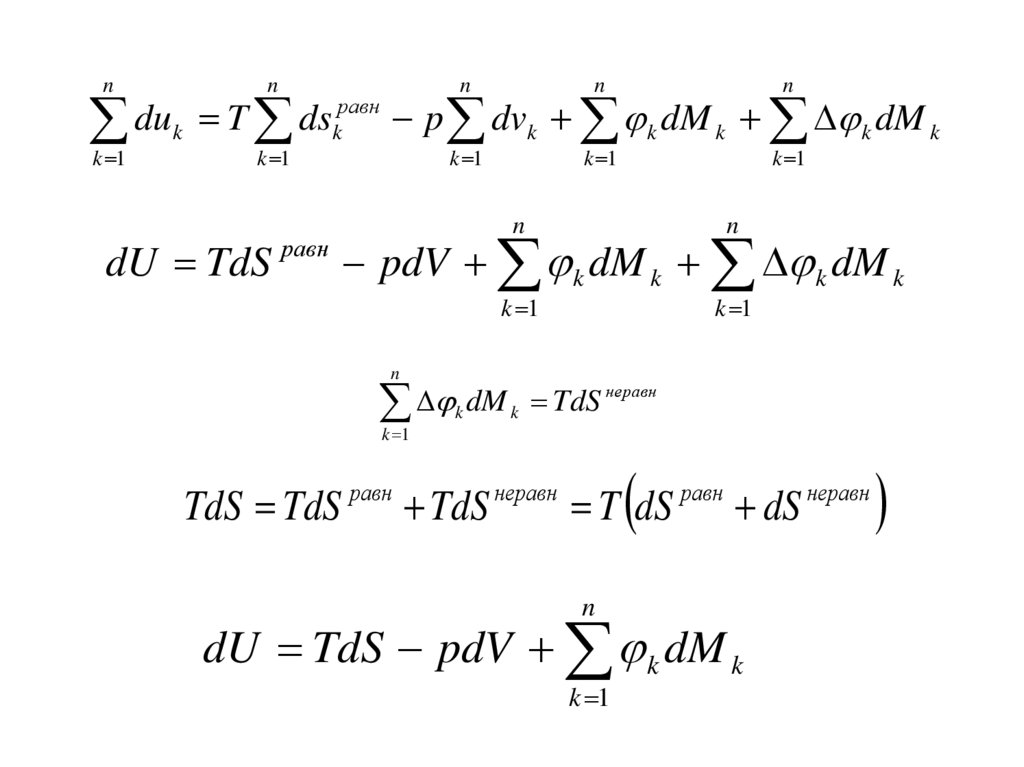











 physics
physics








