Similar presentations:
Термодинамика. Основные понятия и определения. Теплота и работа как форма передачи энергии
1. Термодинамика
Основные понятия и определения.Теплота и работа как форма передачи
энергии. Внутренняя энергия, энтальпия,
энтропия, теплоемкость, смесь рабочих тел.
2.
Литература1. Луканин В.Н., Шатров М.Г. Теплотехника: Учебник для
вузов. − М: Высшая школа, 2011. − 671 с.
2. Михеев М.А., Михеева И.М. Основы теплопередачи. −
Минск: Высшая школа А, 2010. − 320 с.
3. Белоусов Н.А., Задирей В.Н. Термодинамика и
теплопередача (основы теории, типовые задачи, задания и
методические указания): учебное пособие. − Ухта: УГТУ,
2008. − 91 с.
3. Техническая термодинамика
Изучает закономерности взаимного превращениятеплоты и работы, происходящие в
макроскопических системах;
Изучает свойства тел, участвующих в этих
превращениях;
Свойства процессов, протекающих в тепловом
оборудовании;
4. Рабочее тело
Посредник, с помощью которого в тепловых машинах,установках получают работу, теплоту или холод.
Рабочее тело может состоять из одного или нескольких
веществ, быть гомогенным или гетерогенным.
Рабочие тела в термодинамике – газы и пары.
5. Термодинамическая система (ТДС)
Совокупность рабочих тел, обменивающихсяэнергией и веществом между собой и
окружающей средой, – ТДС.
Окружающая среда – все, что не включено в
систему, но может с ней взаимодействовать.
ТДС отделяется от окружающей среды реальной
или мысленной границей
6. Классификация ТДС
Изолированные – отсутствует обмен веществоми энергией с окружающей средой;
Закрытые или замкнутые – отсутствует обмен
веществом;
Открытые – присутствует обмен веществом
(поток пара или газа в турбинах);
Термодинамически изолированные или
адиабатная – отсутствует обмен теплотой.
7. Состояния рабочего тела
Стационарное (равновесное) состояниесистемы – это такое состояние, при
котором свойства системы не изменяются
с течением времени.
Неравновесное состояние – …
8. Макропараметры
При взаимодействии с окружающей средойрабочее тело переходит из одного состояния в
другое.
Макропараметры поддаются прямому
измерению.
Физические величины, свойственные
конкретному состоянию рабочего тела,
подразделяются на интенсивные и
экстенсивные.
9.
Интенсивные – независят от количества
вещества в системе;
Экстенсивные –
изменяются
пропорционально
величине системы;
Удельные –
отнесенные к единице
количества вещества
(относятся к
интенсивным)
T, p
V, энергия, масса
Удельный объем V m
Удельная теплота
Удельная работа
q Q m
l L m
10. Термодинамические параметры
Макроскопические физические величины,характеризующие систему в состоянии
равновесия, − термодинамические параметры
состояния системы.
11. Основные параметры
Абсолютное давление – p , Па;Абсолютная температура – T, K;
Удельный объем – v V m , м3/кг.
12. Термическое уравнение состояния рабочего тела
Характеризует термодинамическоесостояние вещества, находящегося в
состоянии равновесия (во всей массе
устанавливается постоянство
термодинамических параметров), в
равновесном состоянии не происходит
никаких превращений энергии.
f (p , v, T ) 0
13. Идеальный и реальный газ
Идеальный газ – отсутствуют силывзаимодействия между молекулами;
молекулы материальные точки, не
имеющие объема.
Реальный газ – нельзя пренебречь
силами взаимодействия между
молекулами и объемом молекул.
14. Термическое уравнение состояния идеальных газов
pv RTRM
где R
– газовая постоянная, Дж/(кг К);
M
RM 8,314 Дж/(моль К) – универсальна газовая
постоянная.
Для идеальной смеси газов, химически не
взаимодействующих друг с другом,:
pсм vсм RсмTсм
15. Уравнение состояния реальных газов
Межмолекулярные силы отталкивания позволяютмолекулам сближаться до некоторого минимального
расстояния.
Свободный для движения молекул объем − v b ,
где b – наименьший объем, до которого можно сжать газ.
Длина свободного пробега молекул уменьшается и
давление увеличивается:
RT
p
v b
16. Уравнение состояния реальных газов
Сила притяжения по направлению совпадает свнешним давлением и приводит к
возникновению молекулярного (внутреннего)
давления:
p мол
a
2
v
Уравнение Ван-дер-Ваальса
a
RT
p 2
v
v b
17. Уравнение Ван-дер-Ваальса
При больших удельных объемах иневысоких давлениях реального газа
уравнение Ван-дер-Ваальса превращается
в уравнение состояния идеального газа.
Уравнение не учитывает склонность
молекул к ассоциации в отдельные группы.
18. Законы идеальных газов
Закон Дальтона – давление смеси газов равно суммепарциальных давлений компонентов смеси:
p p1 p 2
n
pn pi
i 1
Закон Амаго – объем смеси равен сумме парциальных
объемов компонентов. Парциальный объем – объем,
который занимал бы компонент, если бы он один
находился при параметрах смеси ( T , p ):
V V1 V2
n
Vn Vi
i 1
19. Состав смеси
miМассовая доля: gi
m
n
g1 g2 gn gi 1
i 1
i
ni
Мольная доля:
n
n1 n 2 n n n i 1
i 1
Vi
Объёмная доля: ri
n
V
r1 r2 rn ri 1
i 1
n i ri
20. Соотношения для расчёта смесей идеальных газов
Способ задания смесиОбъёмными
(молярными) долями
V
ri i i
V
Массовыми долями
gi
mi
m
M i ri
M i ri
ri
gi M i
gi M i
Молярная масса смеси
M M i ri
M
RM
Ri gi
Газовая постоянная
смеси
R
Формулы перехода
Плотность и удельный
объём смеси
Парциальное давление
gi
i ri
RM
M i ri
1
v
ri v i
p i pri
R Ri gi
1
gi i
pi p
v vi gi
Ri gi
gi vi
21. Теплоёмкость
Теплоёмкость C − количество теплоты, необходимой дляизменения на 1 градус рабочего тела (вещества):
dQ Q
C
dT dT
Дж/К.
Различают:
Удельную теплоёмкость –
c C m,
Мольную теплоёмкость −
Cm C ,
Объемную теплоёмкость −
Дж/(кг К);
Дж/(моль К);
c C V c ,
Дж/(м3 К).
22. Теплоёмкость
Теплоёмкость газов величина переменная,зависит от температуры:
истинная;
средняя.
Теплоёмкость газов зависит от протекания
процесса:
изохорная;
изобарная.
23. Теплоёмкость
изохорнаяизобарная
cv − удельная изохорная
теплоёмкость
c v − объёмная изохорная
теплоёмкость
cv − мольная (молярная)
изохорная теплоёмкость
cp cv R
i
Cv cv R
2
cp − удельная изобарная
теплоёмкость
c p − объёмная изобарная
теплоёмкость
cp − мольная (молярная)
изобарная теплоёмкость
cp cv R 8,314 Дж/(моль К)
Cp i 2
i 2
k
Cp cp
R
Cv
i
2
24.
ТеплоёмкостьМассовая (удельная) теплоёмкость
с
c
Объёмная теплоёмкость
с
c
22,4
Связь объёмной и массовой теплоёмкостей
c с н
25.
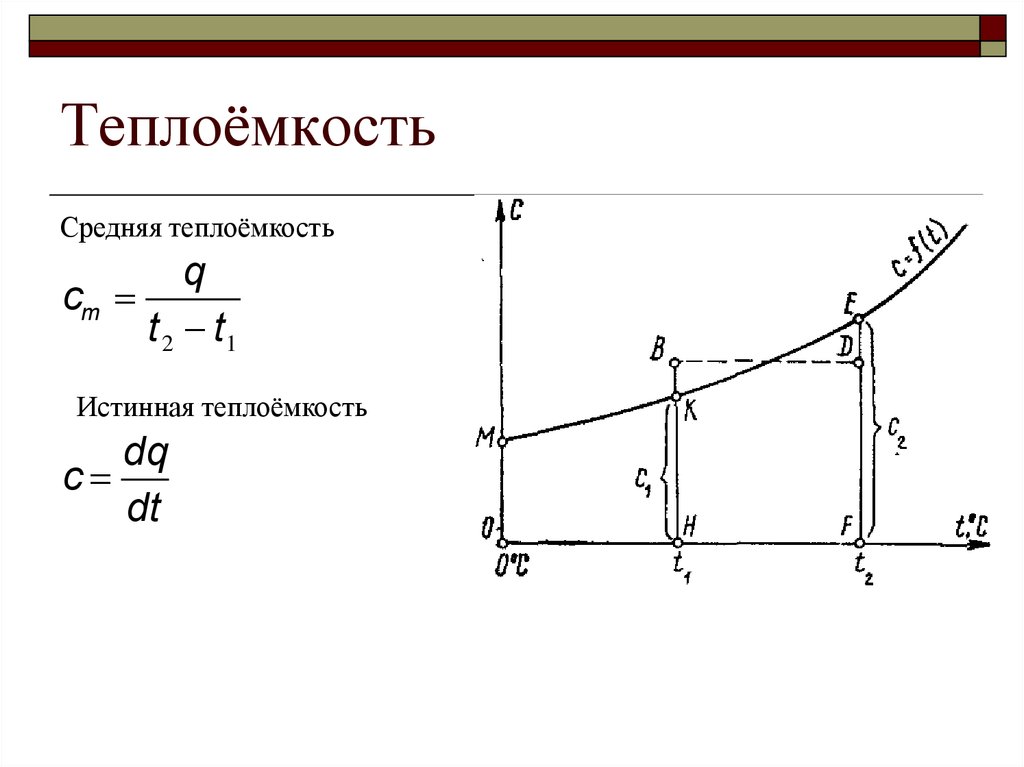
ТеплоёмкостьСредняя теплоёмкость
q
cm
t 2 t1
Истинная теплоёмкость
dq
c
dt
26.
Теплоёмкость27.
ТеплоёмкостьТеплоёмкость газов изменяется с изменением температуры, причём эта
зависимость имеет криволинейный характер. В таблицах приведены
теплоёмкости для наиболее часто встречающихся в теплотехнических расчётах
двух- и трёхатомных газов.
При пользовании таблицами значения истинных теплоёмкостей, а также средних
теплоёмкостей в пределах от 0°С до t берут непосредственно из этих таблиц,
причём в необходимых случаях производится интерполирование.
28.
Нелинейную зависимость истинной теплоёмкости от температуры представляютобычно уравнением вида
c a bt dt 2
Средняя теплоёмкость при нелинейной зависимости
(c )
t2
m t1
cm 2 t 2 cm1 t1
t 2 t1
Линейная зависимость истинной теплоёмкости от температуры имеет вида
c a bt
Средняя теплоёмкость при изменении температуры от t1 до t2
b
cm a (t1 t 2 )
2
Средняя теплоёмкость при изменении температуры от 0°С до t
b
cm a t
2
29.
30.
31. Теплоёмкость газовой смеси
Массовая теплоёмкостьn
cсм g i ci
i 1
Объёмная теплоёмкость
n
c см ri c i
i 1
Мольная теплоёмкость
n
n
i 1
i 1
cсм ri i ci ri ( c)i
32. Теплота и работа
Теплота и работа представляют две формы передачиэнергии от одного тела к другому. Общее:
Необходимо два тела;
Пополняется запас энергии.
Мерой энергии, передаваемой этими двумя формами
передачи энергии от одного тела к другому, является
количество теплоты и работы.
33. Различия
РаботаМакроскопический
процесс;
Пополняет запас любого
вида энергии;
dl pdv
Теплота
Совокупность
микроскопических
процессов;
Пополняет только
внутреннюю энергию;
dq Tds
34. T-S диаграмма
q и S имеютодинаковые знаки:
при подводе теплоты
энтропия возрастает и
наоборот
35. Эквивалентность теплоты и работы
Эквивалентность теплоты и работы численноустановлена Ю.Майером и У.Томсоном:
1 ккал=4,18 кДж
36. Внутренняя энергия
Совокупность всех видов энергии тела илисистемы в данном состоянии, не связанных
с движением системы как единого целого
или с наличием внешнего силового поля.
Включает энергию теплового движения
молекул и потенциальную энергию их
взаимодействия.
37. Внутренняя энергия
Идеальные газы – энергия взаимодействияравна нулю, энергия их теплового
движения зависит от температуры:
du cv dT
n
u M ri u M i
i 1
u cv (T2 T1 )
n
u gi u i
i 1
38. Энтальпия
Тепловая функция: H U pVУдельная энтальпия: h u pv
h u pv u RT
dh du pdv cv dT RdT cp dT
При постоянном давлении изменение энтальпии равно
количеству теплоты, подведенной к системе. Поэтому
энтальпию называется теплосодержанием.
Изменение энтальпии определяется только начальным
и конечным состоянием газа и не зависит от характера
процесса.
n
hM rk hMk
k 1
n
h gk hk
k 1
39. Энтропия
Удельная энтропия:dq
ds
T
Энтропия – параметр, изменяющийся от количества
переданной теплоты.
dT
ds c
T
T2
s c ln
T1
Энтропию нельзя измерить, только рассчитать.






































 physics
physics








