Similar presentations:
Карбоновые кислоты
1.
КАРБОНОВЫЕ КИСЛОТЫCnH2nO2
O
R C
НОМЕНКЛАТУРА
OH
Формула
Тривиальная
ИЮПАК
Карбоновая
HCOOH
Муравьиная
Метановая
-
CH3COOH
Уксусная
Этановая
Метанкарбоновая
CH3CH2COOH
Пропионовая
Пропановая
Этанкарбоновая
CH3CH2CH2COO
H
Масляная
Бутановая
Пропанкарбоновая
Изомасляная
2-метилпропановая
2-пропан-
H3C
CH COOH
H3C
CH3(CH2)3COOH
карбоновая
Валериановая
Пентановая
1-бутанкарбоновая
2.
Способы получения1. Окисление органических соединений:
а) Алканов (с разрывом цепи); алкенов (KMnO4, OH-,
озонолиз); алкинов.
б) Альдегидов (по ионному и радикальному механизмам);
кетонов (по Попову).
в) спиртов.
2. Гидролиз соединений типа:
Z
R C Y
X
O
R C
X
а) Гидролиз тригалогенметилпроизводных:
R CCl3 + H2O
H+ или OH-
O
R C
OH
+ 3HCl
3.
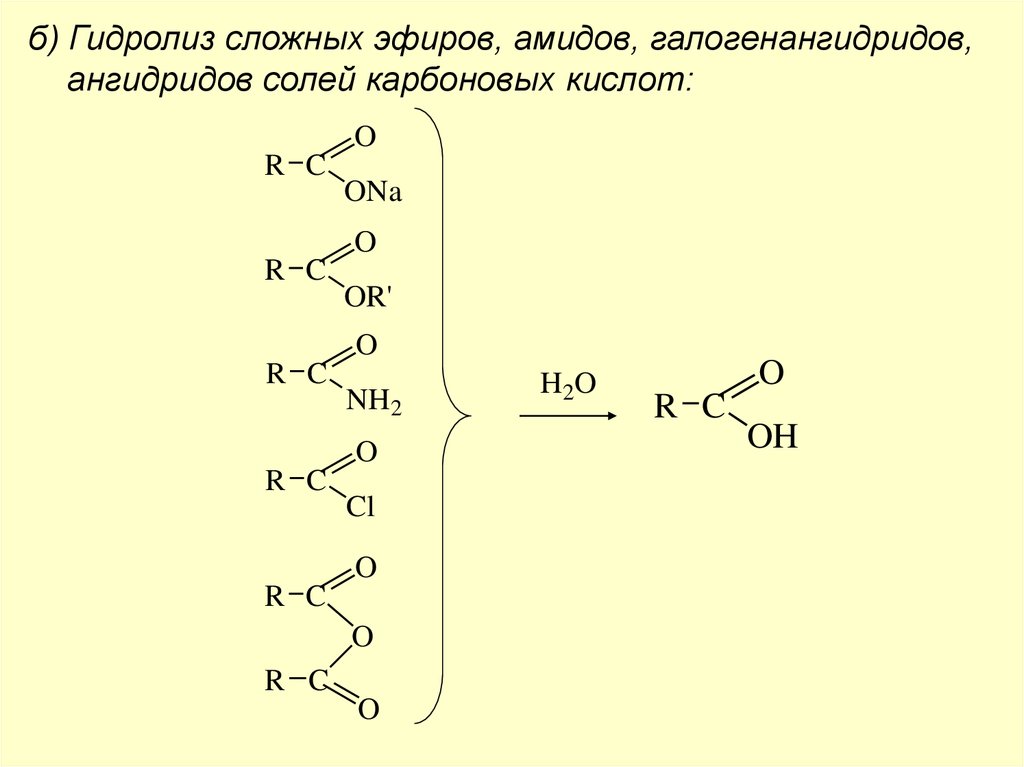
б) Гидролиз сложных эфиров, амидов, галогенангидридов,ангидридов солей карбоновых кислот:
O
R C
ONa
O
R C
OR'
O
R C
NH2
O
R C
Cl
O
R C
O
R C
O
H 2O
O
R C
OH
4.
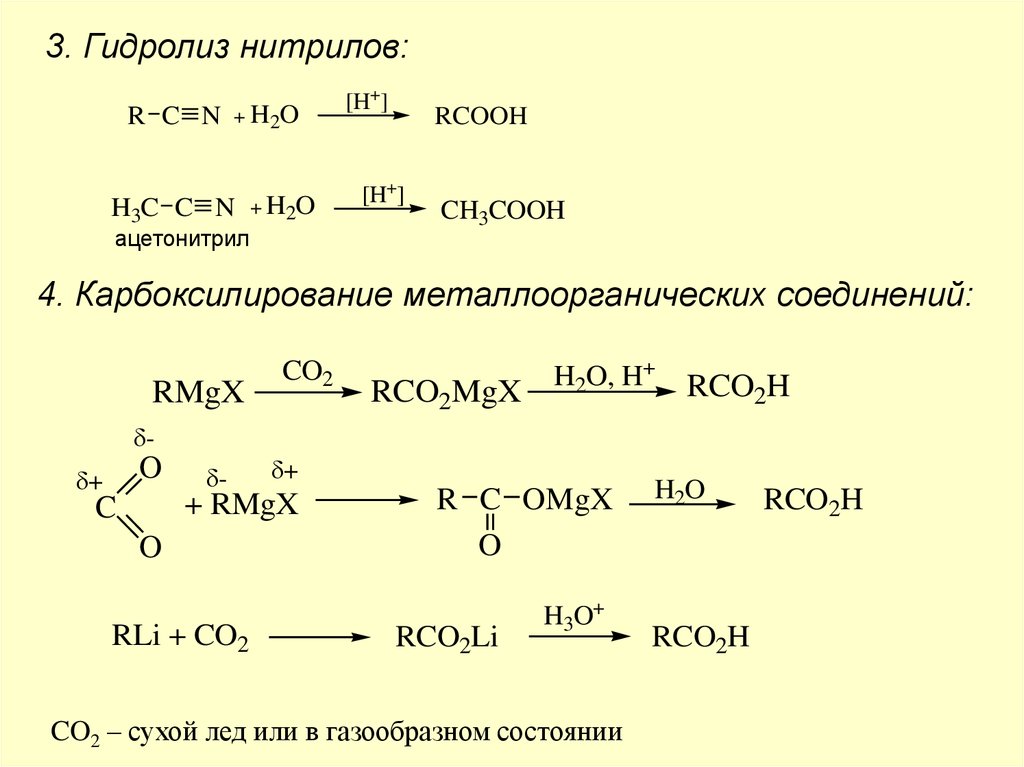
3. Гидролиз нитрилов:R C N
+ H2 O
H3C C N
+ H2O
ацетонитрил
[H+]
RCOOH
[H+]
CH3COOH
4. Карбоксилирование металлоорганических соединений:
RMgX
CO2
RCO2MgX
H2O, H+
RCO2H
δ-
O
δ+
δ-
δ+
+ RMgX
C
O
RLi + CO2
R C OMgX
O
RCO2Li
H3O+
CO2 – сухой лед или в газообразном состоянии
H2O
RCO2H
RCO2H
5.
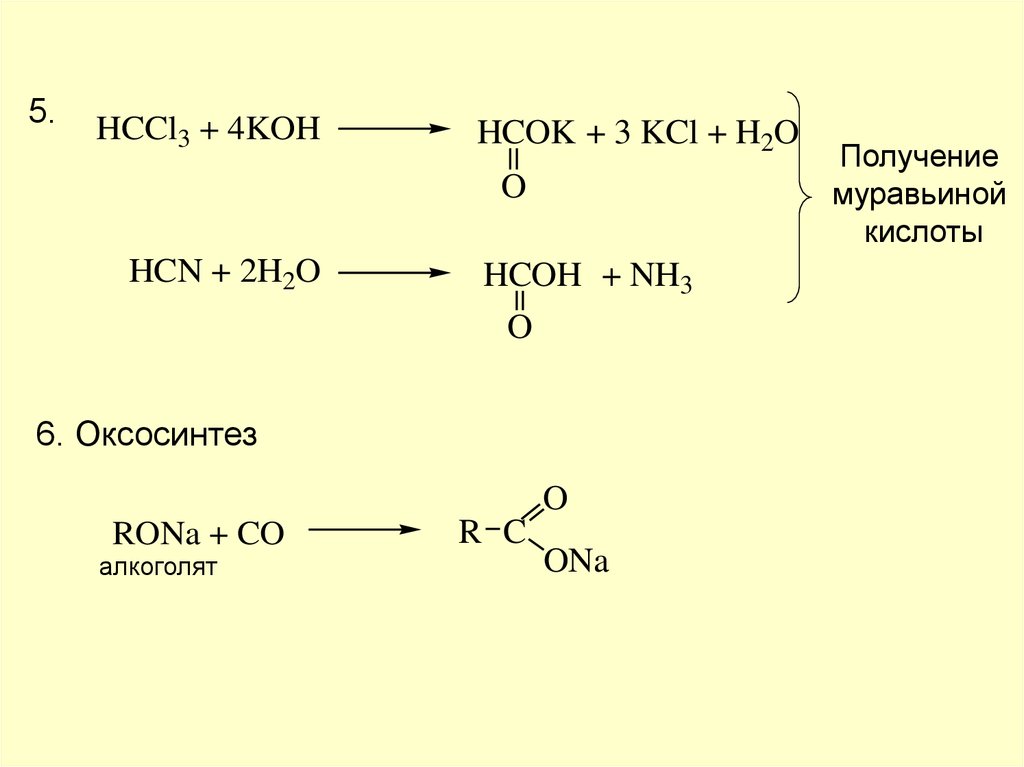
5.HCCl3 + 4KOH
HCOK + 3 KCl + H2O
O
HCN + 2H2O
HCOH + NH3
O
6. Оксосинтез
O
RONa + CO
алкоголят
R C
ONa
Получение
муравьиной
кислоты
6.
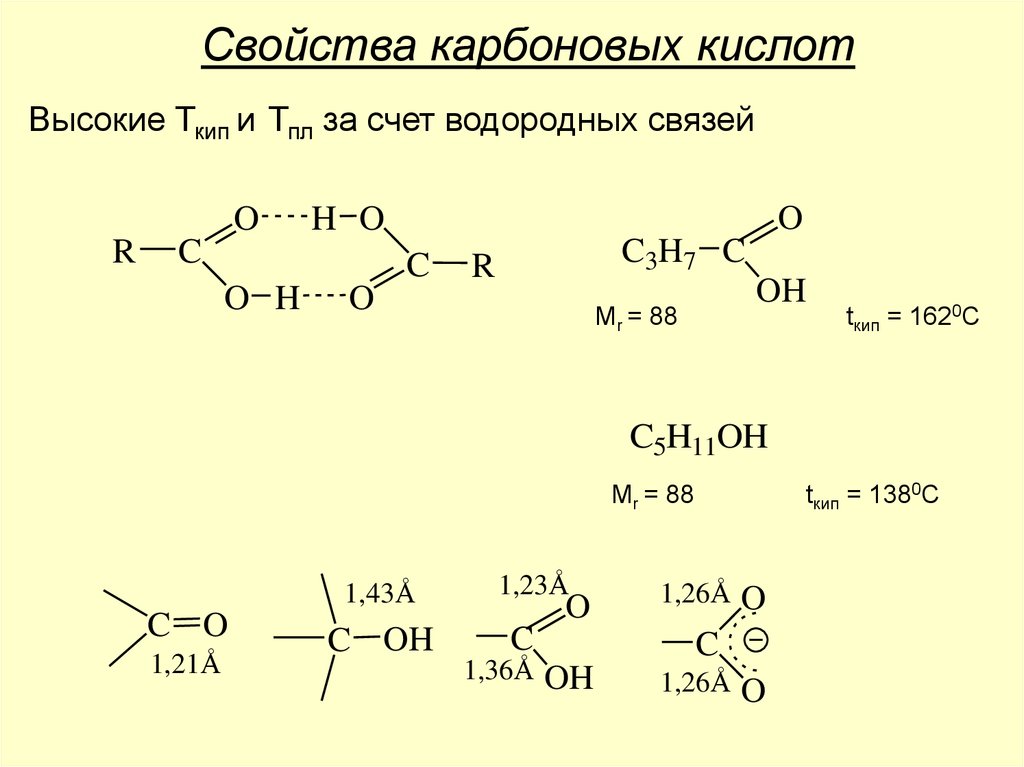
Свойства карбоновых кислотВысокие Ткип и Тпл за счет водородных связей
O
R
O
H O
C
C
O H
C3H7 C
R
O
OH
Mr = 88
tкип = 1620С
C5H11OH
tкип = 1380С
Mr = 88
1,43Å
C O
1,21Å
C OH
1,23Å
O
C
1,36Å
1,26Å
O
C
OH
1,26Å
O
7.
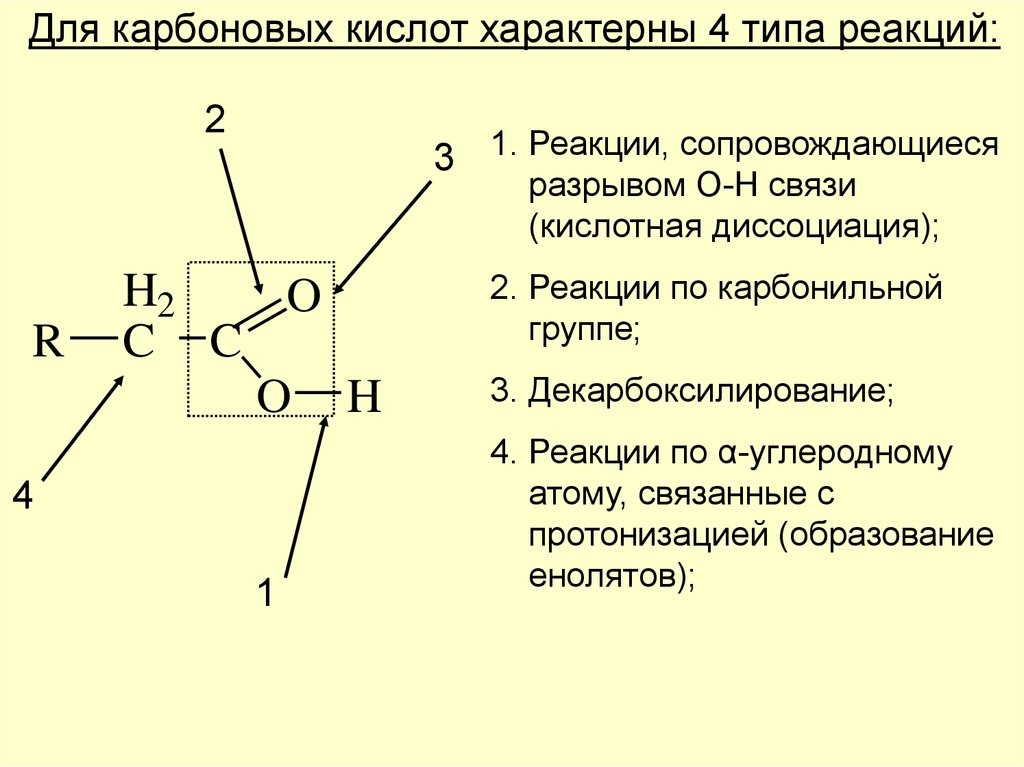
Для карбоновых кислот характерны 4 типа реакций:2
3 1. Реакции, сопровождающиеся
разрывом О-Н связи
(кислотная диссоциация);
R
H2
O
C C
O H
4
1
2. Реакции по карбонильной
группе;
3. Декарбоксилирование;
4. Реакции по α-углеродному
атому, связанные с
протонизацией (образование
енолятов);
8.
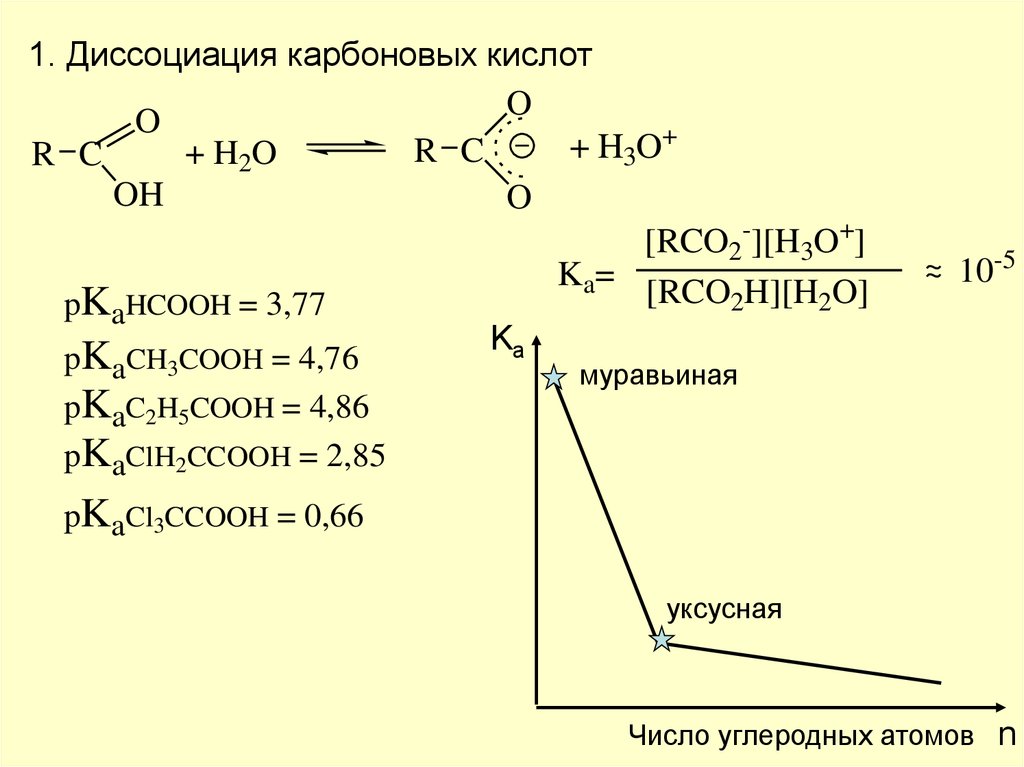
1. Диссоциация карбоновых кислотO
O
+
+
H
O
R
C
+ H2O
R C
3
OH
O
[RCO2-][H3O+]
Ka=
[RCO2H][H2O]
pKaHCOOH = 3,77
Ka
pKaCH3COOH = 4,76
муравьиная
pKaC2H5COOH = 4,86
pKaClH2CCOOH = 2,85
~
~ 10-5
pKaCl3CCOOH = 0,66
уксусная
Число углеродных атомов n
9.
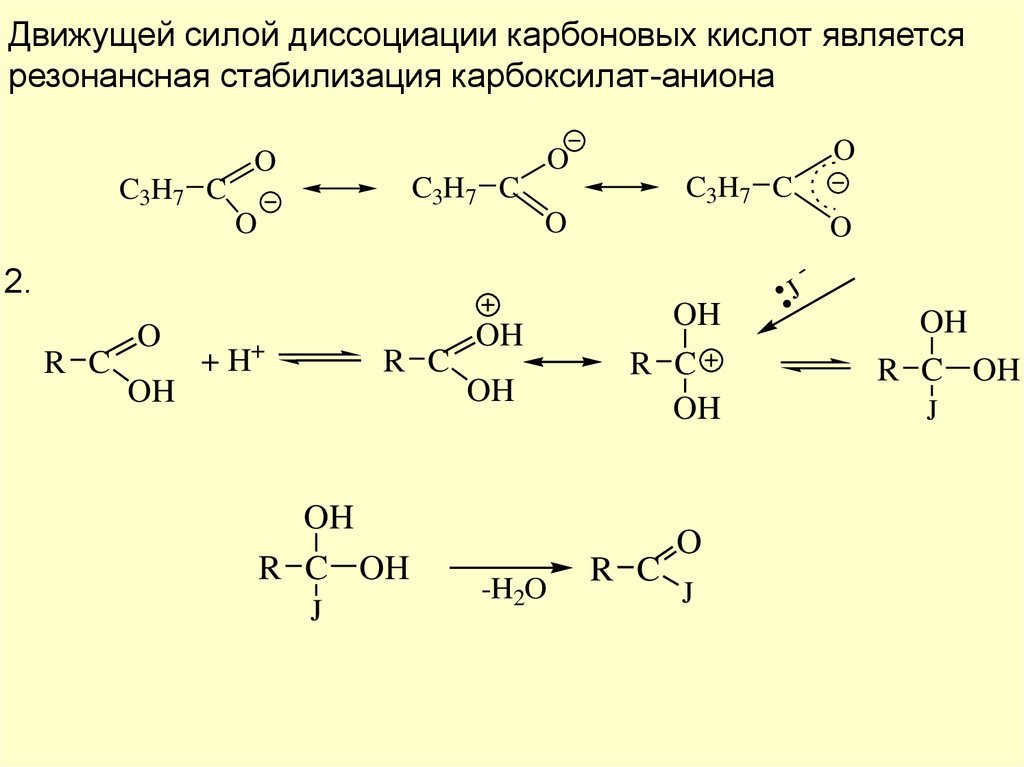
Движущей силой диссоциации карбоновых кислот являетсярезонансная стабилизация карбоксилат-аниона
O
O
O
C3H7 C
C3H7 C
C3H7 C
O
O
O
2.
R C
O
+ H+
R C
OH
OH
R C OH
J
OH
OH
-H2O
OH
R C
OH
R C
O
J
J
OH
R C OH
J
10.
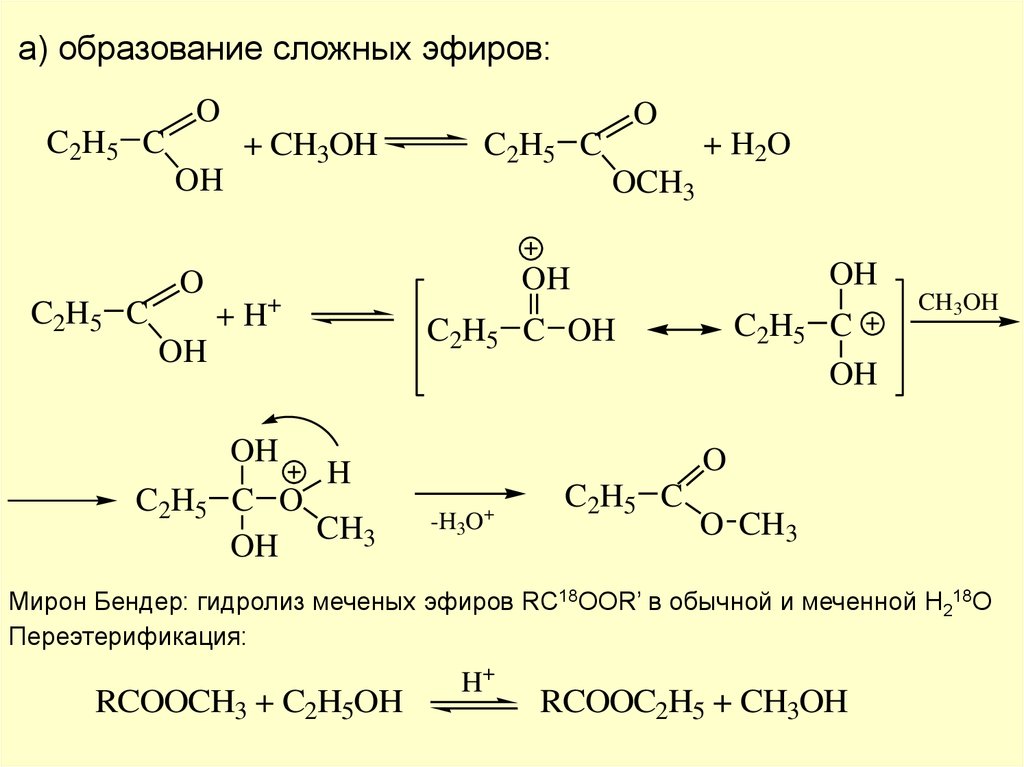
а) образование сложных эфиров:O
C2H5 C
O
+ CH3OH
OH
O
C2H5 C
+ H 2O
C2H5 C
OCH3
+ H+
C2H5 C
OH
C2H5 C OH
OH
OH
OH
OH
O
H
C 2H5 C O
CH3
OH
CH3OH
-H3O+
C 2 H5 C
O CH3
Мирон Бендер: гидролиз меченых эфиров RC18OOR’ в обычной и меченной H218O
Переэтерификация:
RCOOCH3 + C2H5OH
H+
RCOOC2H5 + CH3OH
11.
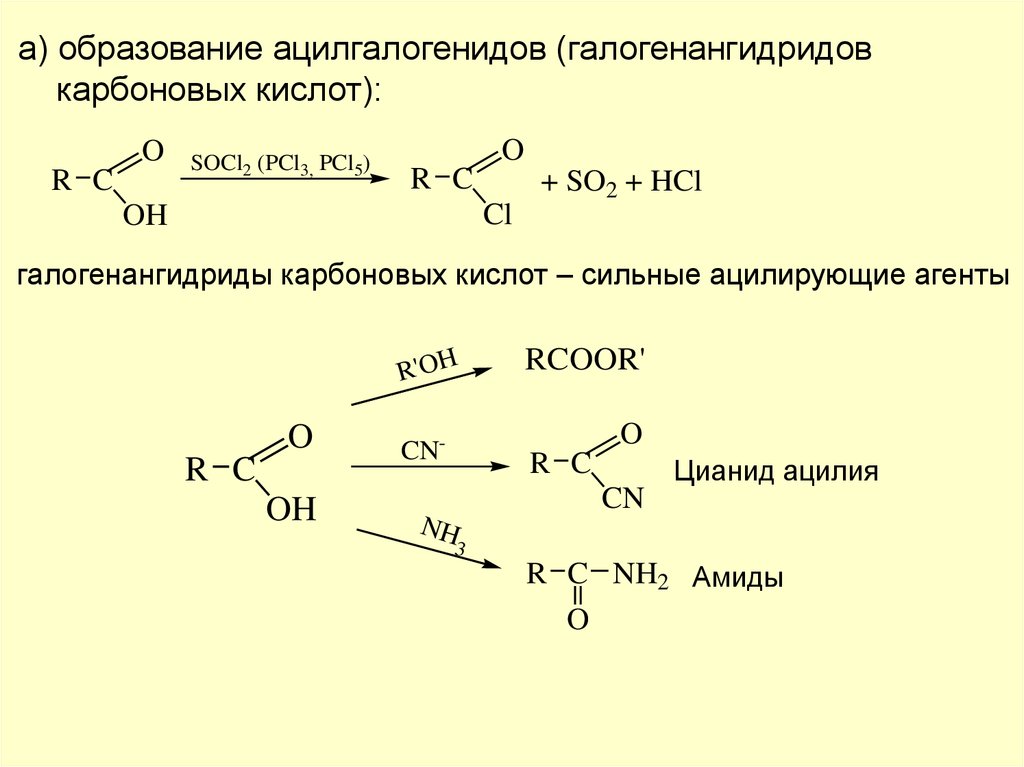
а) образование ацилгалогенидов (галогенангидридовкарбоновых кислот):
O
R C
SOCl2 (PCl3, PCl5)
O
R C
+ SO2 + HCl
Cl
OH
галогенангидриды карбоновых кислот – сильные ацилирующие агенты
R'OH
O
R C
OH
RCOOR'
O
CN-
R C
Цианид ацилия
CN
NH
3
R C NH2 Амиды
O
12.
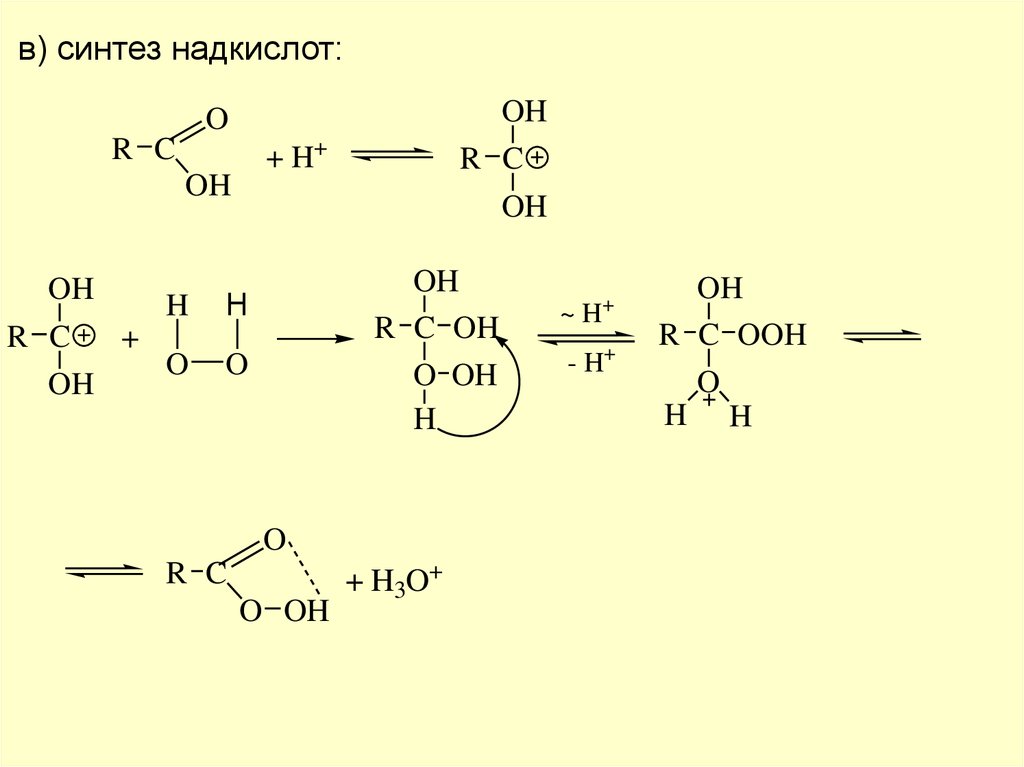
в) синтез надкислот:OH
O
R C
+ H+
OH
OH
R C
OH
+
R C
OH
H
H
O
O
OH
R C OH
O OH
H
O
R C
O OH
+ H3O+
~H
+
- H+
OH
R C OOH
O
H
H
13.
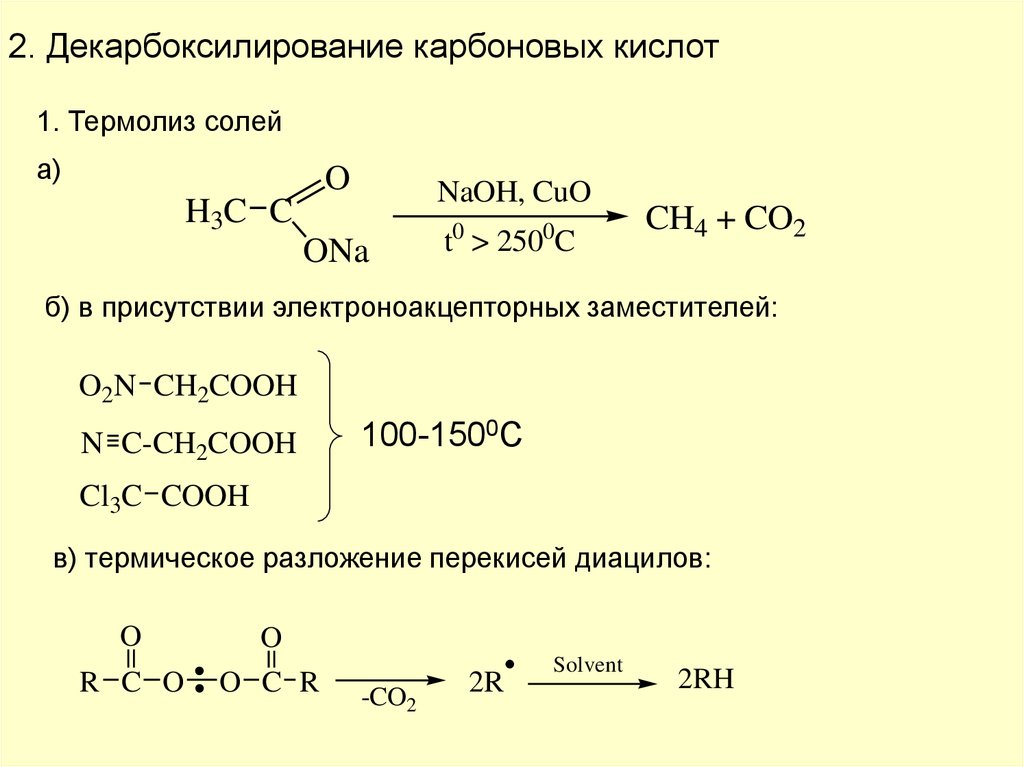
2. Декарбоксилирование карбоновых кислот1. Термолиз солей
а)
O
NaOH, CuO
H3C C
ONa
0
0
t > 250 C
CH4 + CO2
б) в присутствии электроноакцепторных заместителей:
O2N CH2COOH
N C-CH2COOH
100-1500С
Cl3C COOH
в) термическое разложение перекисей диацилов:
O
R C O
O
O C R
-CO2
2R
Solvent
2RH
14.
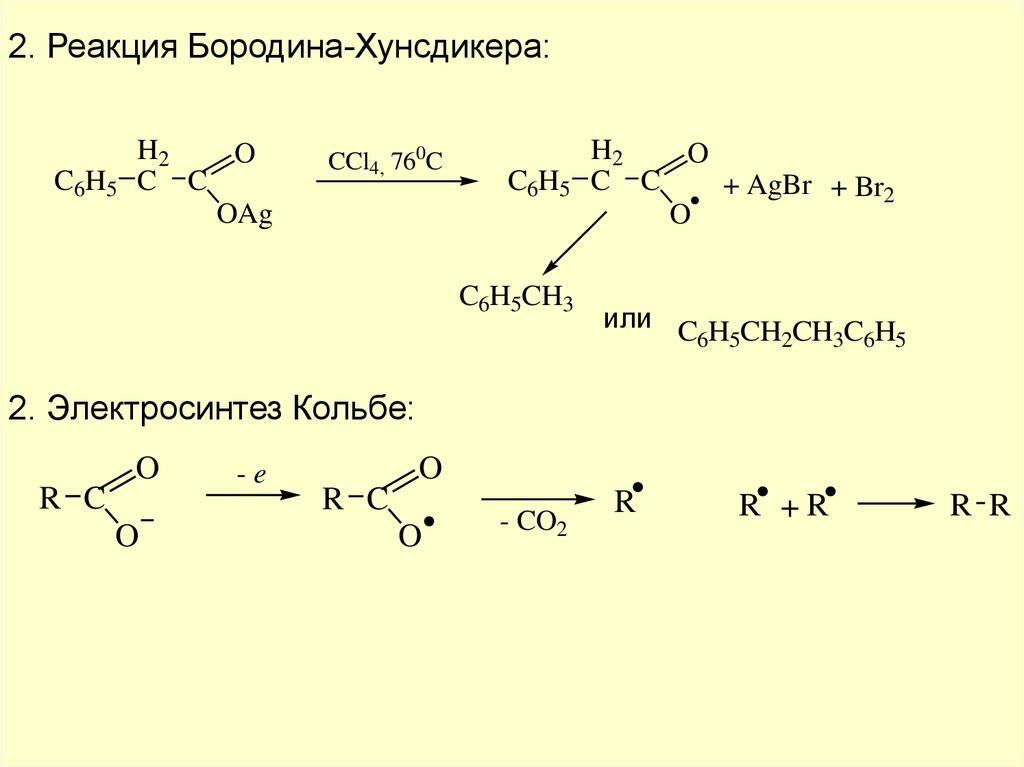
2. Реакция Бородина-Хунсдикера:C6H5
H2
O
C C
OAg
CCl4, 760C
C6H5
C6H5CH3
H2
O
C C
+ AgBr + Br2
O
или C H CH CH C H
6 5
2
3 6 5
2. Электросинтез Кольбе:
O
R C
O
-e
O
R C
O
- CO2
R
R +R
R R
15.
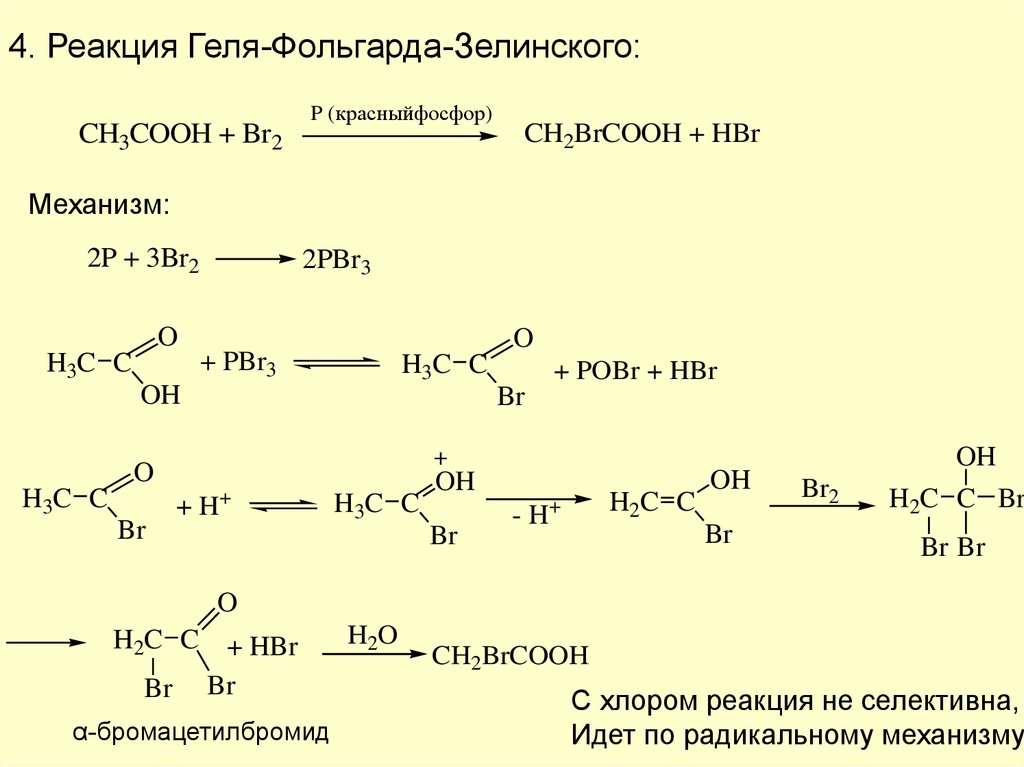
4. Реакция Геля-Фольгарда-Зелинского:CH3COOH + Br2
P (красныйфосфор)
CH2BrCOOH + HBr
Механизм:
2P + 3Br2
O
H3C C
2PBr3
O
+ PBr3
H3C C
OH
Br
O
H3C C
+
Br
+ POBr + HBr
+H
H3C C
OH
H2C C
+
Br
-H
OH
Br
OH
Br2
H2C C Br
Br Br
O
H2C C + HBr
Br Br
α-бромацетилбромид
H2O
CH2BrCOOH
С хлором реакция не селективна,
Идет по радикальному механизму


 chemistry
chemistry








