Similar presentations:
Карбонильные соединения
1.
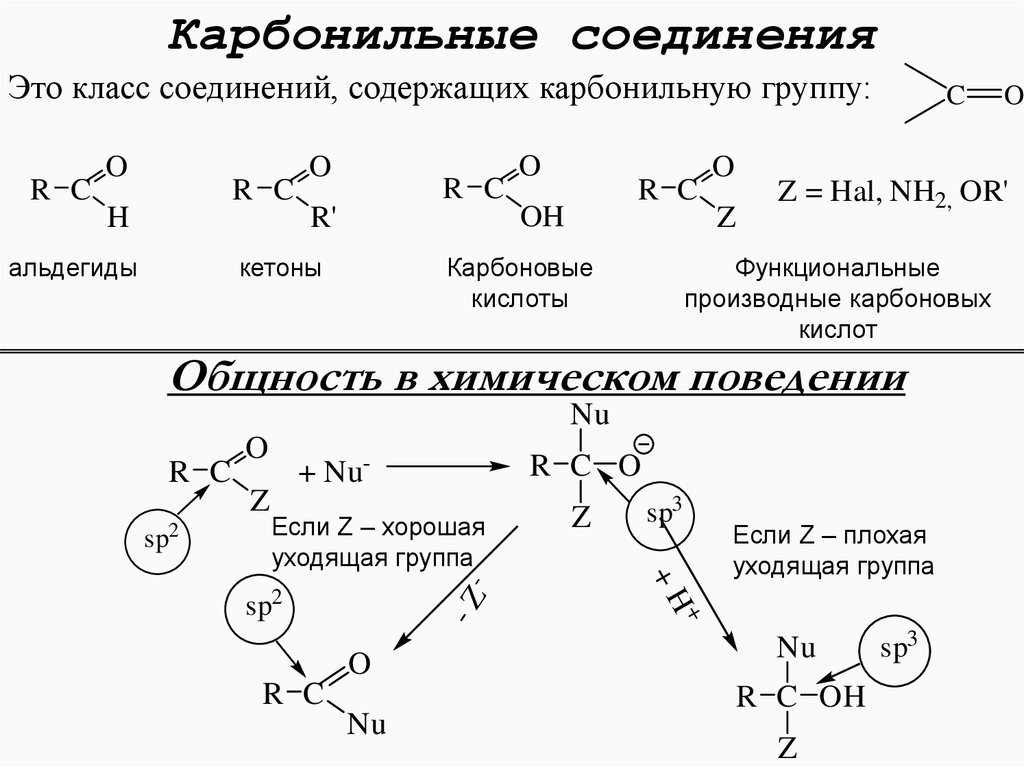
Карбонильные соединенияЭто класс соединений, содержащих карбонильную группу:
R C
H
O
R C
альдегиды
O
R C
OH
R'
кетоны
O
Z
Карбоновые
кислоты
Функциональные
производные карбоновых
кислот
Nu
R C
O
Z
sp2
+ Nu-
R C O
Если Z – хорошая
уходящая группа
R C
Nu
Если Z – плохая
уходящая группа
+
O
sp3
+H
sp2
Z
O
Z = Hal, NH2, OR'
Общность в химическом поведении
-Z-
R C
O
C
Nu
R C OH
Z
sp3
2.
Альдегиды и кетоныМетоды получения изучали ранее:
1. Окисление спиртов;
2. Озонолиз алкенов;
3. Пинаколиновая перегруппировка;
4. Реакция Кучерова (из алкинов).
Специфические методы:
1. Кетонизация солей карбоновых кислот
(М = Ba, Ca, Th, Mn) - пиролиз
R C
O
O
R' C
O
O
Ca
t 0C
O
R C R' + CaCO3
3.
2. Синтезы на основе реактива Гриньяра:R C
O
+ R'MgX
R C
NHMgX
NH2
Амид карбоновой
кислоты
H2O
R'
R
C
R'MgX R'
O
R
C
OMgX
NHMgX
O
OH
-NH3
NH2
R' C R
2. Восстановление хлорангидридов карбоновых кислот (по Розенмунду):
R C
O
H2, Pd / BaSO4
Pb(CH3COO)2
Cl
Cl
O
O
C
C
Cl
LiAlH4
ТГФ, -780С
R C
O
+ HCl
H
H
O
O
C
C
H
4.
Химические свойства карбонильных соединенийС = С связь менее прочная (145,8 ккал/моль), чем две С – С связи.
C
O -связь более прочная (179 ккал/моль).
C
O
C
O
Nu C
O
E+
Атака по кислороду - чаще всего протоном, т.е. альдегиды и кетоны –
слабые основания
R
C
R'
O +
H+
R
C O H
R C OH
R'
R'
R
C O H
R'
5.
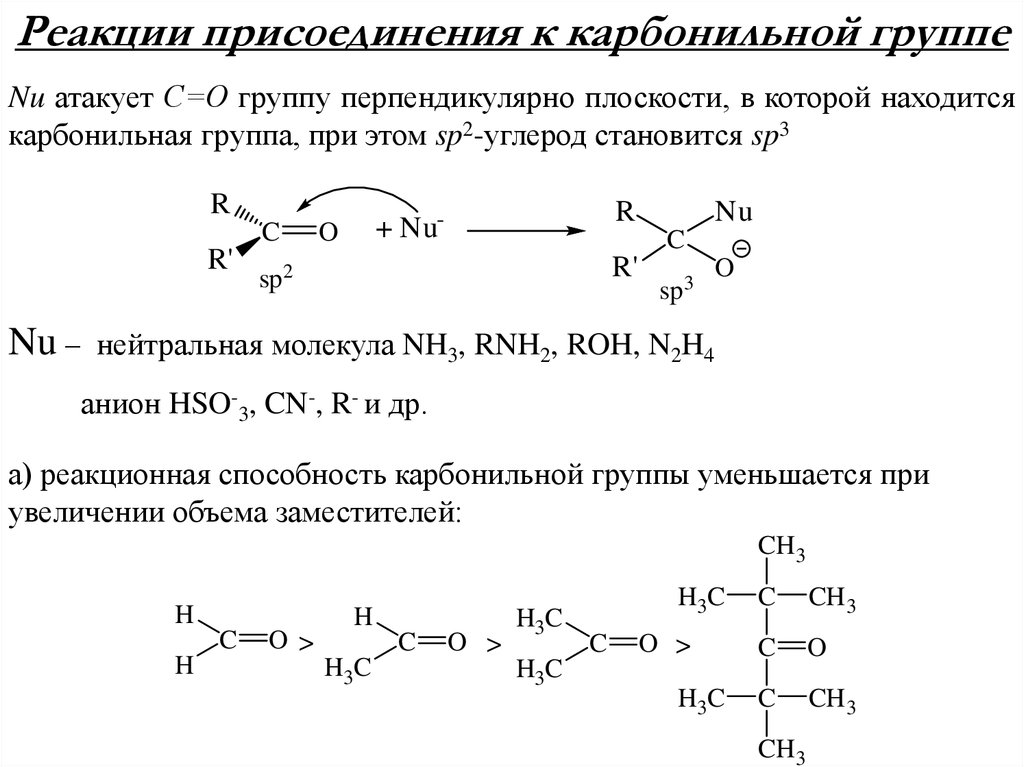
Реакции присоединения к карбонильной группеNu атакует С=О группу перпендикулярно плоскости, в которой находится
карбонильная группа, при этом sp2-углерод становится sp3
R
C
R'
Nu –
R
+ Nu-
O
Nu
C
R'
sp2
sp3
O
нейтральная молекула NH3, RNH2, ROH, N2H4
анион HSO-3, CN-, R- и др.
а) реакционная способность карбонильной группы уменьшается при
увеличении объема заместителей:
CH 3
H
C
H
O >
H
C
H3C
O >
H3C
H3C
H3C
C
O >
H3C
C
CH 3
C
O
C
CH 3
CH 3
6.
Электроноакцепторные заместители облегчают атаку нуклеофила:Cl3C C
O
H
> H 3C C
O
H
1. Образование циангидринов:
C N
H 3C C CH3 + HCN
H 3C C CH3
C N
-H2O
H 3C C CH3
OH
ацетонциангидрин
OH
O
H2O
CH 3
H2C C C
N
α-метилакрилонитрил
CH3
H 3C C C
OH
O
OH 2-гидрокси-2-метил-пропионовая
кислота
7.
Д.З.Провести полимеризацию метакриловой кислоты:
CH 3
O
H2C C C
OH
Ph C
O
H
HCN
KCN
OH
Ph C C N
H
Бензальдегид
H3O+
OH
O
Ph C C
H
OH
Миндальная кислота
Присоединение бисульфита натрия к карбонильным
соединениям:
O
S O- Na+
OH
Нуклеофильный центр
8.
H3CH3C
O - Na+
C O + S OH
H3C
H3C
O
O
HO
C
S
H3C
O
ONa
H3C
C
SO3Na
OH
Бисульфит ацетона
Соль растворима в воде, но не растворима в органических растворителях
Присоединение соединений типа RNH2 к карбонильным соединениям
Азотистые нуклеофилы RNH2:
NH3
Аммиак
NH2OH
Гидроксиламин
H2N NH2
PhNH NH2
Гидразин
Фенилгидразин
H
H2N N C NH2
H
H2N N C NH2
S
Тиосемикарбазид
O
Семикарбазид
C
O + RNH2
C
NR + H2O
Среда слабокислая
RNH 2 + H +
Нежелательный
RNH 3+ процесс
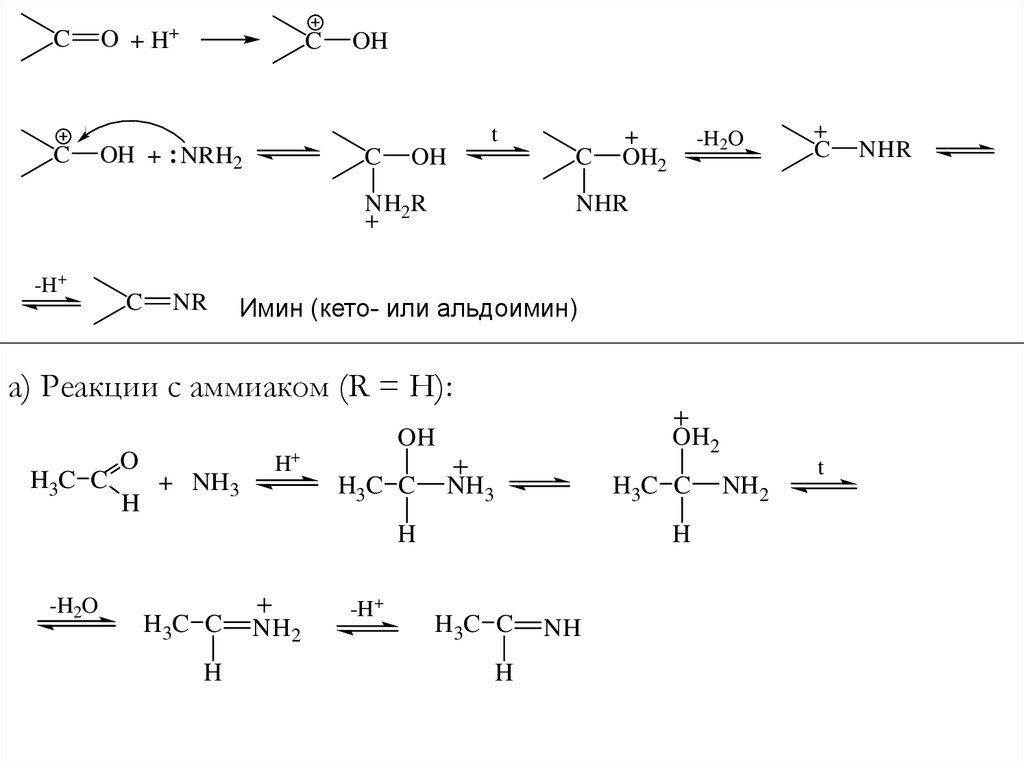
9.
CO + H+
C
OH + NRH2
C
OH
t
C
OH
C
NH2R
-H+
C
NR
-H2O
OH2
C
NHR
Имин (кето- или альдоимин)
а) Реакции с аммиаком (R = H):
H3C C
O
H
+ NH3
OH2
OH
H+
H3C C
H3C C
NH 3
H
H
-H2O
H 3C C
H
NH 2
-H+
H 3C C
H
NH
NH 2
t
NHR
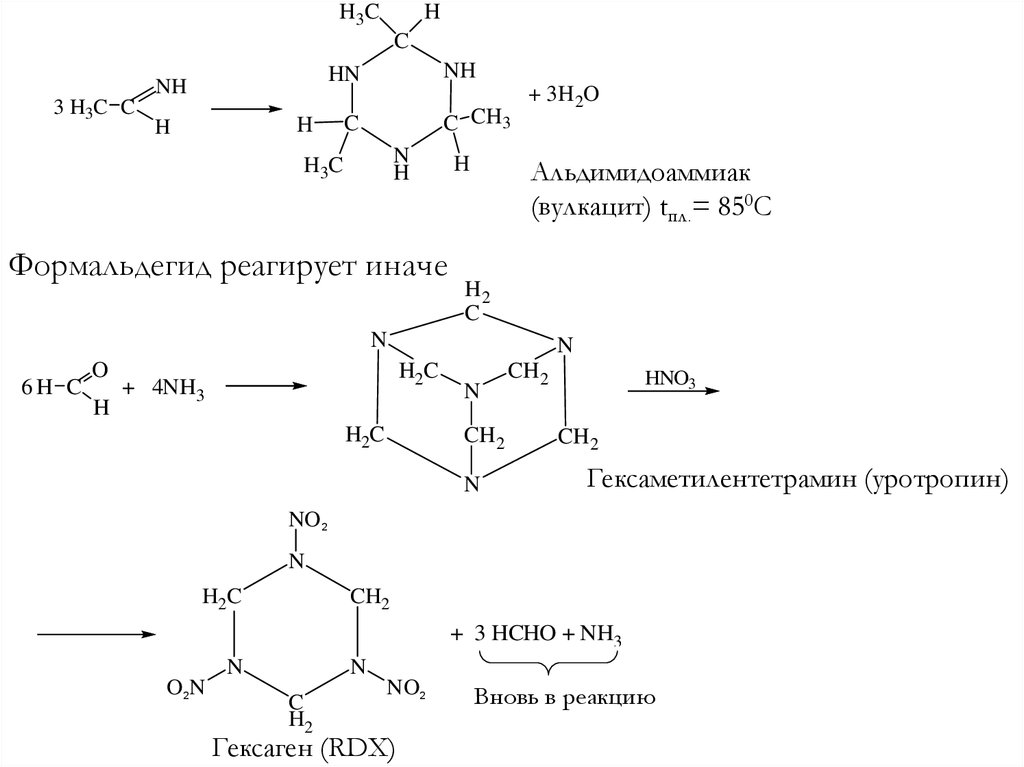
10.
H 3CH
C
3 H3C C
NH
HN
NH
H
H
C CH 3
C
N
H
H3C
Формальдегид реагирует иначе
+ 3H 2O
Альдимидоаммиак
(вулкацит) tпл.= 850C
H
H2
C
N
6H C
O
H
N
H2C
+ 4NH3
H2C
N
CH 2
N
CH 2
HNO3
CH 2
Гексаметилентетрамин (уротропин)
NO 2
N
H2C
CH2
+ 3 HCHO + NH3
N
O2N
N
C
H2
NO2
Гексаген (RDX)
Вновь в реакцию
11.
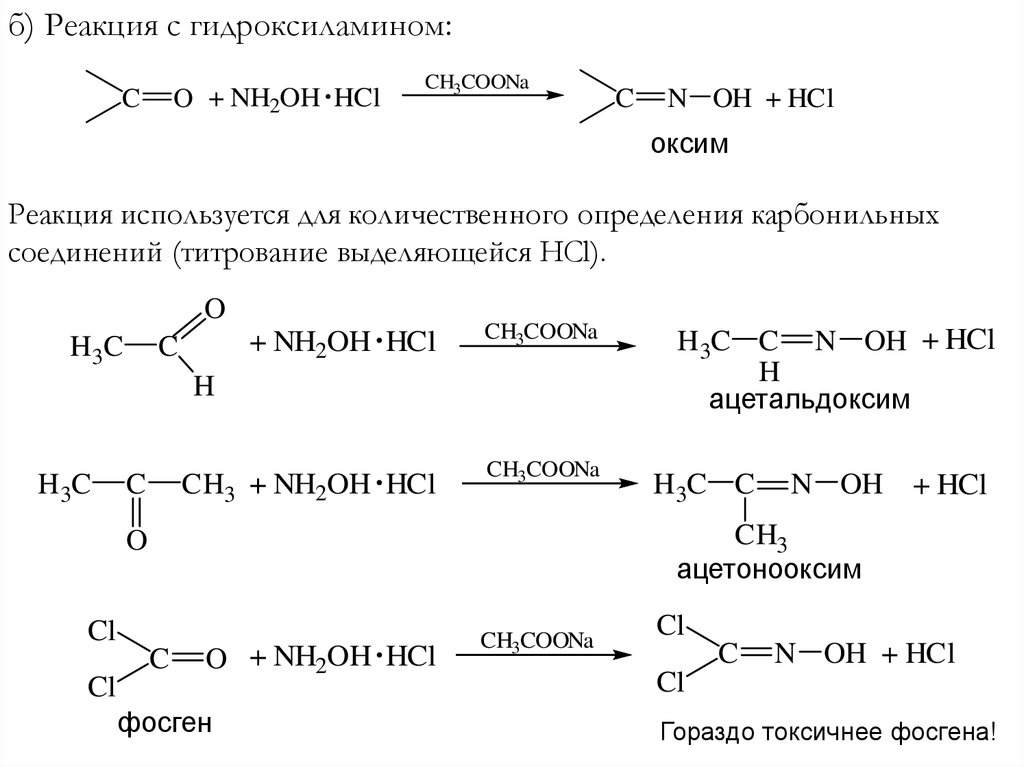
б) Реакция с гидроксиламином:O + NH2OH HCl
C
CH3COONa
C
N OH + HCl
оксим
Реакция используется для количественного определения карбонильных
соединений (титрование выделяющейся HCl).
O
H 3C
+ NH2OH HCl
C
CH3COONa
H
H 3C
CH3 + NH2OH HCl
C
CH3COONa
H3C C
N OH
+ HCl
CH3
ацетонооксим
O
Cl
C
Cl
H 3C C N OH + HCl
H
ацетальдоксим
O + NH2OH HCl
фосген
CH3COONa
Cl
C
N OH + HCl
Cl
Гораздо токсичнее фосгена!
12.
Для оксимов возможна изомерия:H
Ph
H
C
C
N
N
HO
OH
Синtпл = 340С
Антиtпл = 128-1300С
в) Реакция с гидразином:
R'
R
C O
R'
R
R
C
Ph
C
O + H2N NH2
R'
N NH2
гидразон
R
R
C
N N
C
R'
R'
азин
Гидразоны используются для превращения карбонильных соединений
в предельные углеводороды (реакция Кижнера):
H3C C
CH3
N NH 2
t0
CH 3CH2CH3 + N 2
13.
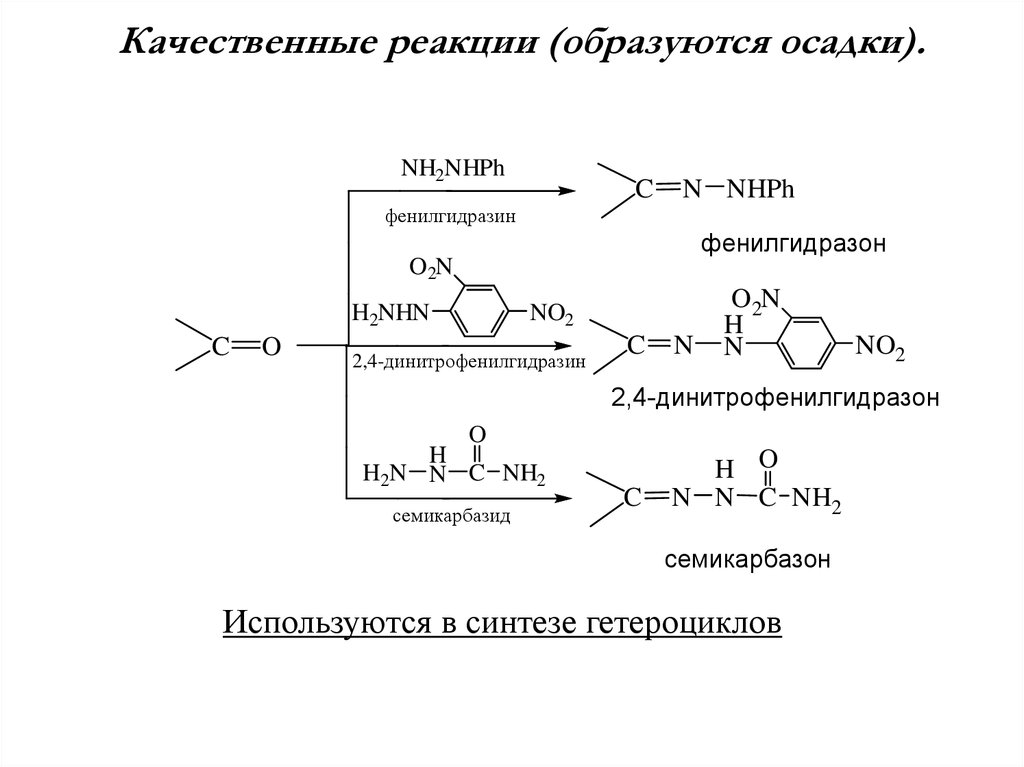
Качественные реакции (образуются осадки).NH2NHPh
C
N NHPh
фенилгидразин
фенилгидразон
O2N
H2NHN
C
O
NO2
2,4-динитрофенилгидразин
C
N
O 2N
H
N
NO2
2,4-динитрофенилгидразон
O
H
H2N N C NH2
семикарбазид
C
H O
N N C NH2
семикарбазон
Используются в синтезе гетероциклов
14.
4. Реакци с реактивом Гриньяра (рассматривали механизм в синтезе спиртов):R
C
O + R"MgX
R'
R
OMgX
C
R'
R
OH
C
R'
R"
H2O
R' = R" = H
R' = H
R
OH
C
R'
R"
Первичные спирты
Вторичные спирты
R = R' = R" = H Третичные спирты
5. Реакции с галогенводородами.
НХ – слабый нуклеофил, равновесие смещено влево:
H3C
H3C
C
C
O + HCl
H
H
OH Хлоргидрин
ΔН ~ 12 ккал/моль
Cl
Для присоединения Cl по карбонильной группе используют PCl3 или PCl5:
C
O + PCl5
C
Cl
Cl
+ POCl3
R"
15.
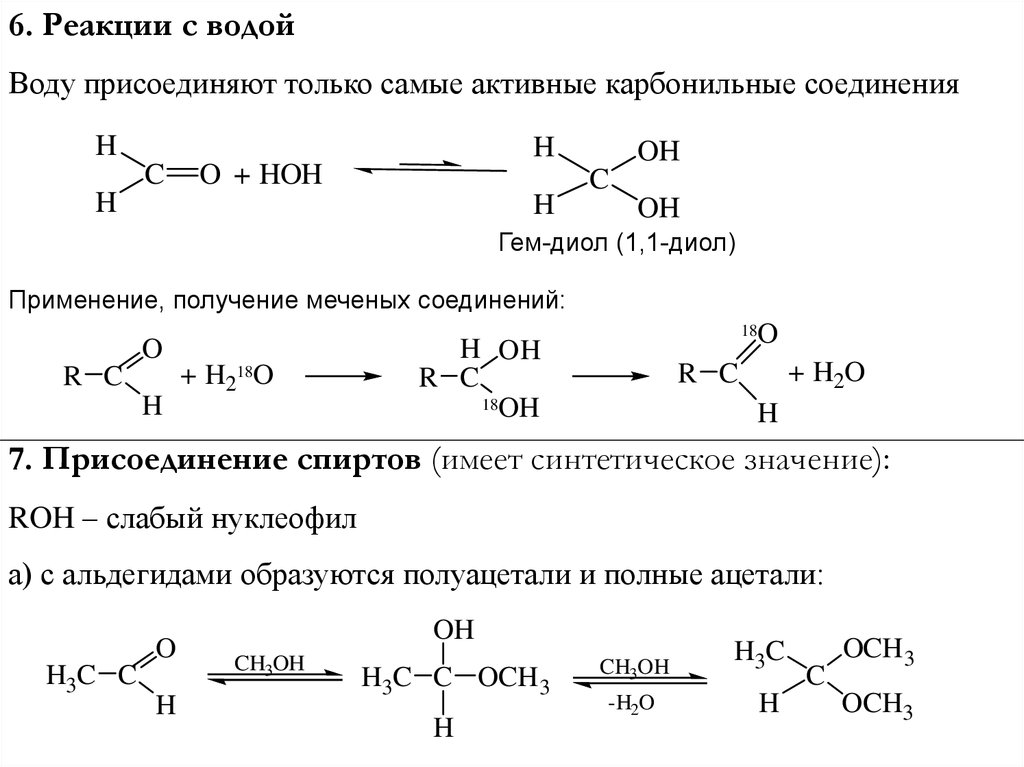
6. Реакции с водойВоду присоединяют только самые активные карбонильные соединения
H
H
C
O + HOH
H
H
OH
C
OH
Гем-диол (1,1-диол)
Применение, получение меченых соединений:
O
+ H218O
R C
H
O
18
H OH
R C
18OH
+ H2O
R C
H
7. Присоединение спиртов (имеет синтетическое значение):
ROH – слабый нуклеофил
а) с альдегидами образуются полуацетали и полные ацетали:
O
H3C C
H
OH
CH3OH
H3C C OCH 3
H
CH3OH
-H2O
H3C
H
C
OCH3
OCH3
16.
Реакция катализируется кислотами и основаниями.Кислотный катализ:
O
R C
OH
O H
+ H+
H
H
H OH
R C
O H
H3C
-H+
CH3OH
R C
R C
H
H OH
R C
O CH3
Основный катализ:
CH3OH + OHO
O
R C
+
H
CH3O- + H2O
CH3O -
R C OCH 3
H
OH
CH3OH
R C OCH 3 + CH 3O
H
17.
Образование полных ацеталей катализируется только кислотами:OH
H 3C C OCH3
H
H+
OH 2
H 3C C OCH3
CH3OH
H 3C
O+
H
-H3
H
C
OCH3
OCH 3
Кетали так не получаются. Частичный положительный заряд на углероде в
кетонах меньше и они стабильнее альдегидов. Общий метод получения кеталей
– реакция с о-муравьиным эфиром:
R
C
R'
OC2H5
H2SO4; H2O
O + HC OC2H 5
OC2H5
Этиловый эфир
орто-ксусной кислоты
R
C2H5O
C
R'
OC 2H5
+
C2H 5O C
H
O
18.
Альдегиды и кетоны реагируют с тиолами:R C
H
O
+ 2R'SH
R C R' + 2R''SH
H
R C
H+
H+
R
C
R''S
O
SR'
SR'
+ H2O
R' + H2O
SR''
Полимеризация альдегидов.
Характерна только для альдегидов – образуются линейные и циклические полимеры.
H C
O
H+, H2O
OH
H C
H
H
H C O
H
H
H2
H2
HO C O C
RO
H
OH
H C O C
OCH2OH
n-2
OR
n H C O
H
H
Параформ
(Фирма «Du pont»)
19.
H2C
3H C
H
O
O
t 0, H2SO4; H2O
O
триоксиметилен
CH 2
H2C
O
CH3
CH
H3C C
O
тримеризация
O
O
HC
CH
H
H3C
CH3
O
O
CH 3
C
H
O
H3C CH
O
паральдегид
HC CH 3
H
C
CH 3
O
снарол
метальдегид
20.
Реакции окисления карбонильных соединений:O
R C
[O]
O
R C
H
OH
[O] – KMnO4; CrO2; H2SO4;
H2O2; RCOOH.
Реакция серебряного зеркала:
AgNO3
O
R C
H
NH4OH
+
AgOH
[Ag(NH3)2]+OH-
NH3
[Ag(NH3)2]+OH-
O
R C
ONH4
+ Ag0 +NH3 + H2O
21.
Окисление альдегидов кислородом воздуха в присутствииактивных радикалов:
O
O
C6H5 C
+R
C6H5 C
(OH)
H
+ RH
(H2O)
O
C6H5 C
O
C 6H5 C
O O
O
+ O
+ C6H 5 C
O OH
Надбензойная
кислота
+ C6H5 C
H
O O
O
O
O
C6H 5 C
C 6H5 C
O
C6H 5 C
+C H C
O OH 6 5
O
O
H
2 C6H5 C
OH
Бензойная
кислота
O
22.
Кетоны окисляются значительно труднее. Нужны сильныеокислители, при этом рвется связь по обе стороны карбонильной
группы, образуется смесь кислот (пр. Попова)
H2 H2 H2
H2
H 3C C C C C C CH3
[O]
O
H2 H2 H2
H3C C C C C
OH
Масляная кислота
O
O
O
O
H2
H2 H2
+ H3C C
+ H3C C C
H3C C C C
OH
OH
OH
Валериановая
кислота
O
Циклогексанон
Пропионовая
кислота
HNO3, V2O5
Уксусная
кислота
O
H2 H2 H2 H2
C C C C C C
HO
OH
O
Адипиновая кислота
+
23.
Реакция Каницарро. Характерна для альдегидов, не содержащихатомов водорода у α-углеродного атома:
O
2 H C
NaOH, H2O
H
O
H C
OH
H
+ H C
ONa
O
H C OH
H
-
H
O
H C OH
CH3OH + H C
O
O
H
H
O +
H C O
H C
OH
H
Метилат-анион
H
H C O
H
O
+ H C
OH
CH3OH
O
+ H 3C C
O
24.
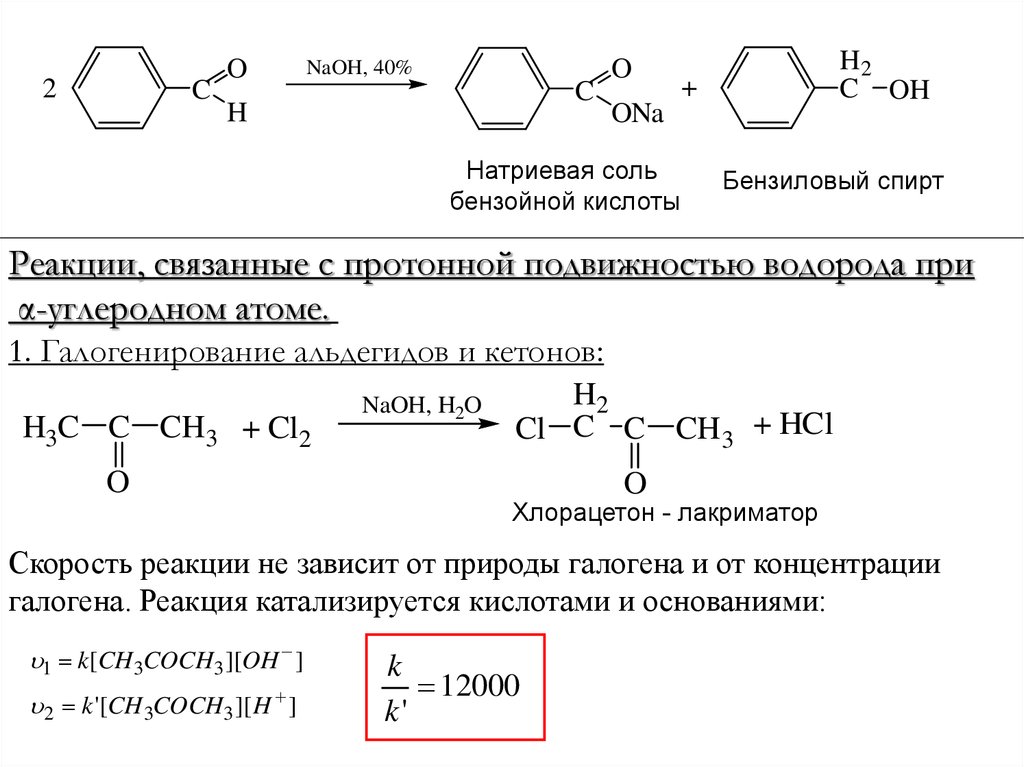
2C
O
NaOH, 40%
C
H
O
H2
C OH
+
ONa
Натриевая соль
бензойной кислоты
Бензиловый спирт
Реакции, связанные с протонной подвижностью водорода при
α-углеродном атоме.
1. Галогенирование альдегидов и кетонов:
H3C C CH 3 + Cl2
O
NaOH, H2O
H2
Cl C C CH 3 + HCl
O
Хлорацетон - лакриматор
Скорость реакции не зависит от природы галогена и от концентрации
галогена. Реакция катализируется кислотами и основаниями:
1 k[CH 3COCH3 ][OH ]
2 k '[CH 3COCH3 ][ H ]
k
12000
k'
25.
В нейтральной среде:H3C C CH3
H2C C CH3
O
Енольная форма ацетона
OH
ацетон
~0,004%
Кето-енольная таутомерия – вид изомерии, где кетонная и енольная формы
различаются положением атома водорода, двойной и простой связей.
Енолизация, катализируемая основаниями:
H2
H 3C C C H
+ OH-
O
H 3C C CH2
H 3C C CH2
O
O
H 2O
Енолят-анионы амбидентны – 2 реакционных центра
H2C C CH3
OH
енол
+ OH-
26.
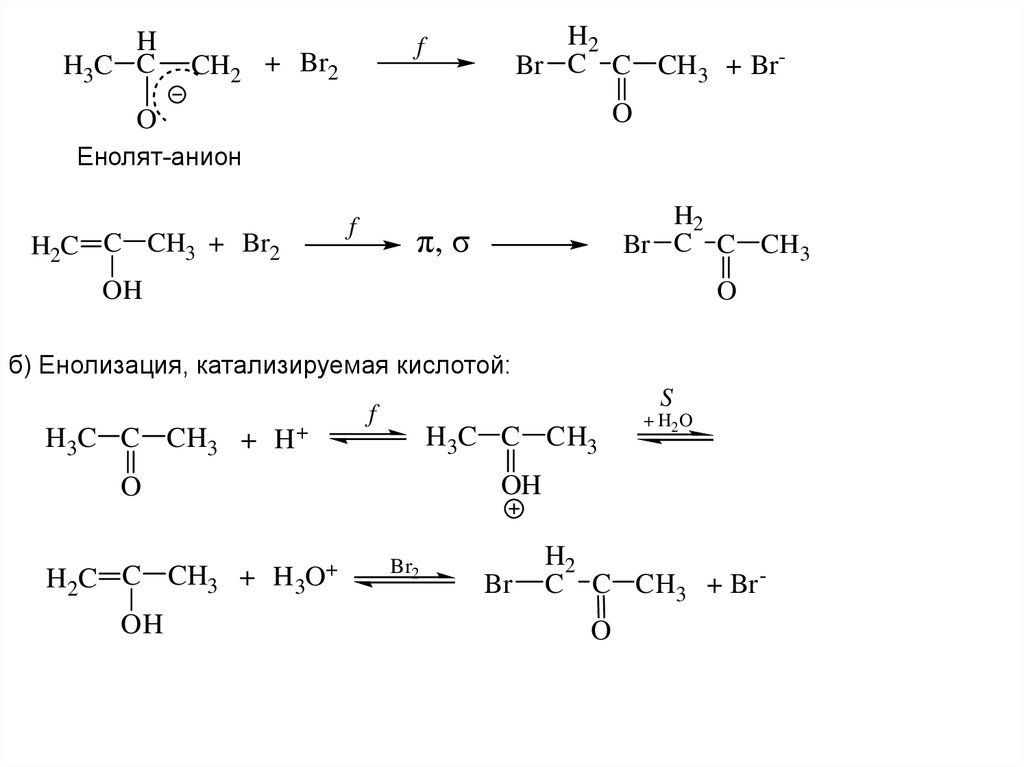
HH3C C
H2
Br C C CH 3 + Br-
f
CH2 + Br2
O
O
Енолят-анион
H2C C CH3 + Br2
f
H2
Br C C CH 3
π, σ
OH
O
б) Енолизация, катализируемая кислотой:
H 3C C CH3 + H+
S
f
H 3C C CH3
OH
O
H2C C CH3 + H3O+
OH
+ H2O
Br2
Br
H2
C C CH3 + Br O
27.
в) Галоформная реакция:NaOH, H2O
H3C C CH3 + Br2
O
Br2
H2
Br C C CH 3
Br2
O
Br
Br C C CH 3
H
O
Br
Br C C CH 3
Br O
В щелочной середе идет исчерпывающее галогенирование – увеличивается
подвижность водородов с появлением С-Hal связи
Br
Br C C CH 3
Br O
-
OH
O
H3C C
O
Br O
Br C C CH 3
Br OH
O
H3C C
OH
+ CBr3
+ CHBr3
Бромоформ – маслянистая жидкость оранж. цвета
CHI3 - йодоформ – осадок, ярко-желтый
28.
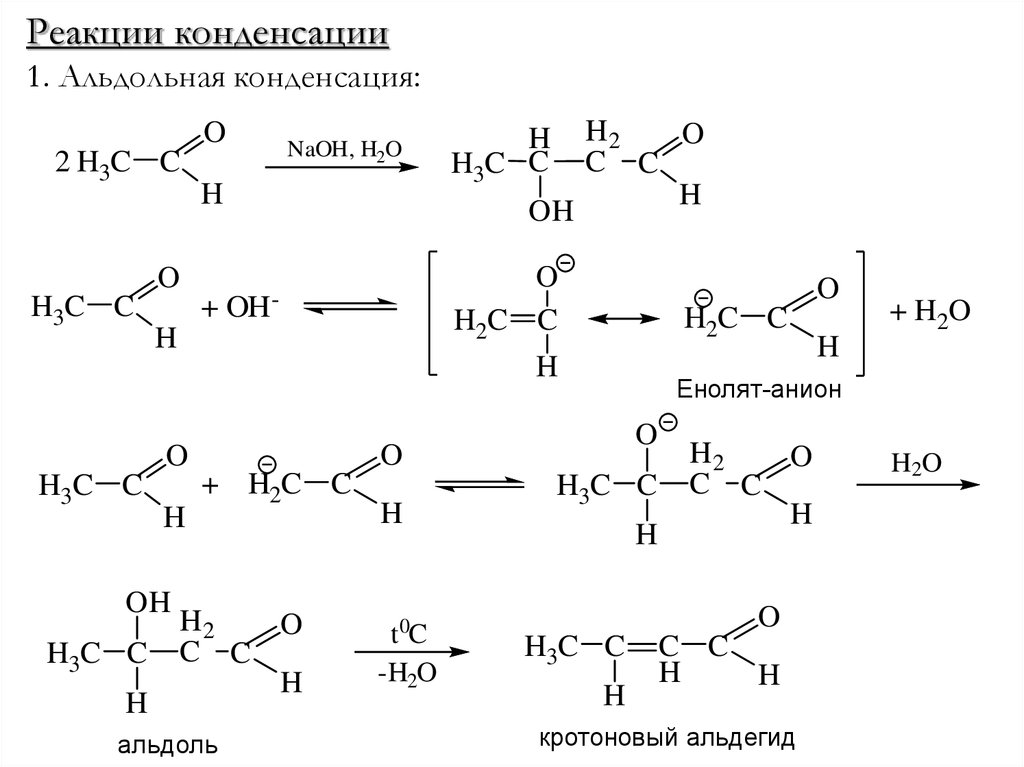
Реакции конденсации1. Альдольная конденсация:
O
2 H3C C
O
H3C C
NaOH, H2O
H
H
H3C C
OH
H2
O
C C
H
O
H2C C
+ OH-
H
O
H2C C
H
H3C C
H
OH
H3C C
H
+ H2C C
H2
O
C C
H
альдоль
H
t 0C
-H2O
H
Енолят-анион
O
O
O
+ H2O
H3C C
H
H2
O
C C
H
O
H3C C
H
C C
H
H
кротоновый альдегид
H2O
29.
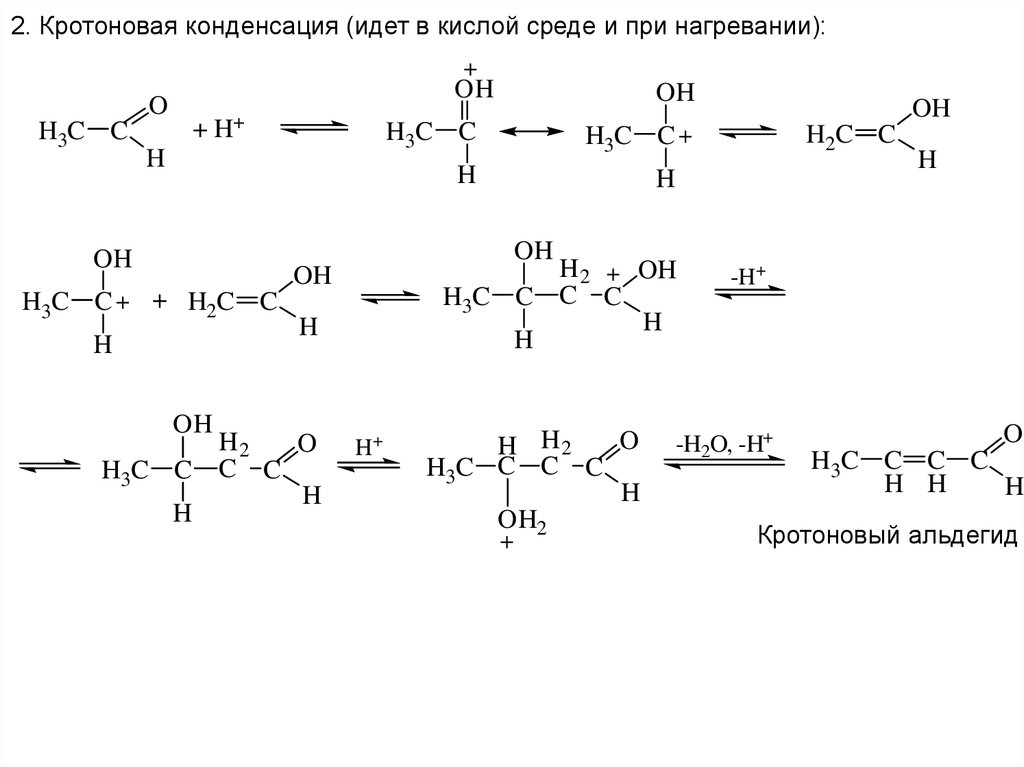
2. Кротоновая конденсация (идет в кислой среде и при нагревании):O
H3C C
OH
+
H+
H
H3C C
H3C C
H
H
OH
OH
H3C C
OH
+ H2C C
H
OH
H
H2
O
H3C C C C
H
H
H2C C
H2
OH
H3C C C C
H
H
OH
H+
O
H H2
H3C C C C
H
OH2
OH
H
-H+
-H2O, -H+
O
H3C C C C
H H
H
Кротоновый альдегид
30.
Для ацетона:2 H3C C CH3
OH
H+
H3C
H2
C C CH3
C
O
CH3
O
Диацетоновый спирт
OH
OH
H3C C
H2
H3C C C C CH 3
+ H2C C CH3
CH 3
CH 3
OH
OH
H2
H3C C C C CH 3
CH 3
H+
O
OH
H 3C
H2
H3C C C C CH3
OH2
-H+
-H2O, -H+
O
Окись мезитила
H3C
C C C CH3
H
H3C
O
CH3COCH3, H+
H3C
C C C C
H
H
H3C
O
CH3
C
CH3
Форон (запах герани)



















 chemistry
chemistry








