Similar presentations:
Карбонильные соединения
1.
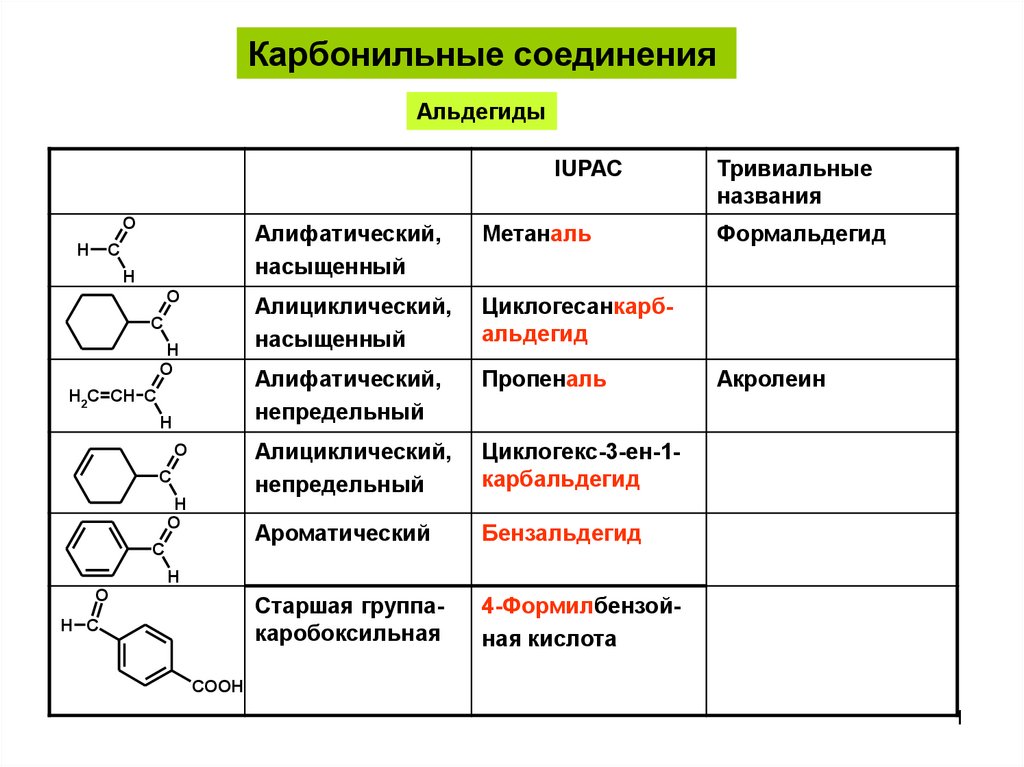
Карбонильные соединенияАльдегиды
IUPAC
O
H
C
H
O
C
H
O
H2C CH C
H
O
C
H
O
C
O
Алифатический,
насыщенный
Метаналь
Алициклический,
насыщенный
Циклогесанкарбальдегид
Алифатический,
непредельный
Пропеналь
Алициклический,
непредельный
Циклогекс-3-ен-1карбальдегид
Ароматический
Бензальдегид
Старшая группакаробоксильная
4-Формилбензойная кислота
Тривиальные
названия
Формальдегид
Акролеин
H
H C
COOH
1
2.
КетоныIUPAC
O
Тривиальные
названия
Симметричный,
предельный
Пропанон
Ацетон
Несимметричный,
непредельный
3-Бутен-2-он
Метилвинилкетон
O
Несимметричный,
предельный
1-Циклогексил-1этанон
Метилциклогексилкетон
O
Несимметричный,
ароматический
Ацетофенон
1-Фенилэтанон
Метилфенилкетон
Старшая группа карбоксильная
3-Оксобутановая
кислота
H3C
C
CH3
O
H3C C
CH CH2
H3C C
H3C C
H3C
O
O
C
C
CH2
OH
2
3.
Способы полученияОтгонка альдегидов позволяет
избежать окисления до карбоновых кислот.
Окисление спиртов
Первичные спирты окисляются до альдегидов, затем до кислот
H3C
O
OH [O]
CH2
с отгонкой
CH3 C
[O]
H
Ацеальдегид
Этанол
O
CH3 C
OH
Уксусная кислота
Вторичные спирты окисляются до кетонов
H3C
O
[O]
CH
OH
H3C
изо-Пропанол
CH3 C
CH3
Ацетон
Третичные спирты окисляются с разрушением скелета
3
4.
Окисление спиртовПервичные спирты - альдегиды
(реактив Саретта-Коллинза)
H3C CH2
5
CH2 OH
CrO3 2С5H5N
CH2Cl2; 25 OC
1-Гептанол
O
H3C CH2 C
5
H
(93%)
Гептаналь
Вторичные спирты - кетоны
(реактив Джонса)
H3C
H3C
C
OH
H3C
СrO3- H2O- H2SO4
ацетон; 25 ОС
4-трет-бутилциклогексанол
H3C
H3C
C
O
(90%)
H3C
4-трет-бутилциклогексанон
Непредельные первичные спирты – непредельные альдегиды
CH3(CH2)4
C C CH2 OH
окт-2-ин-1-ол
(реактив Саретта)
CrO3 * C6H5N * HCl
CH3(CH2)4
C C CH O
2-октиналь
Окисление спиртов до альдегидов и кетонов: см. Реутов, т.2, стр. 266-277
4
5.
Дегидрирование спиртов.R
CH2
OH
Первичный
спирт
Cu; 300
OC
-H2
O
R
HC
R
H
Альдегид
OH
R
Cu; 300 OC
R1
-H2
O
R1
Вторичный
спирт
Кетон
Окисление алкенов
Дизамещенный алкен → два альдегида → две кислоты
Тризамещенный алкен → альдегид и кетон → кислота и кетон
Тетразамещенный алкен → два кетона
+
H
KMnO4,
H3C C CH CH3
H C C O + O C CH3
нагревание 3
CH3
CH3
OH
Ацетон
Уксусная кислота
CH3 CH CH CH2
CH3
KMnO4, H
+
O
CH3 CH C + CO2 + H2O
OH
CH3
изомасляная кислота
5
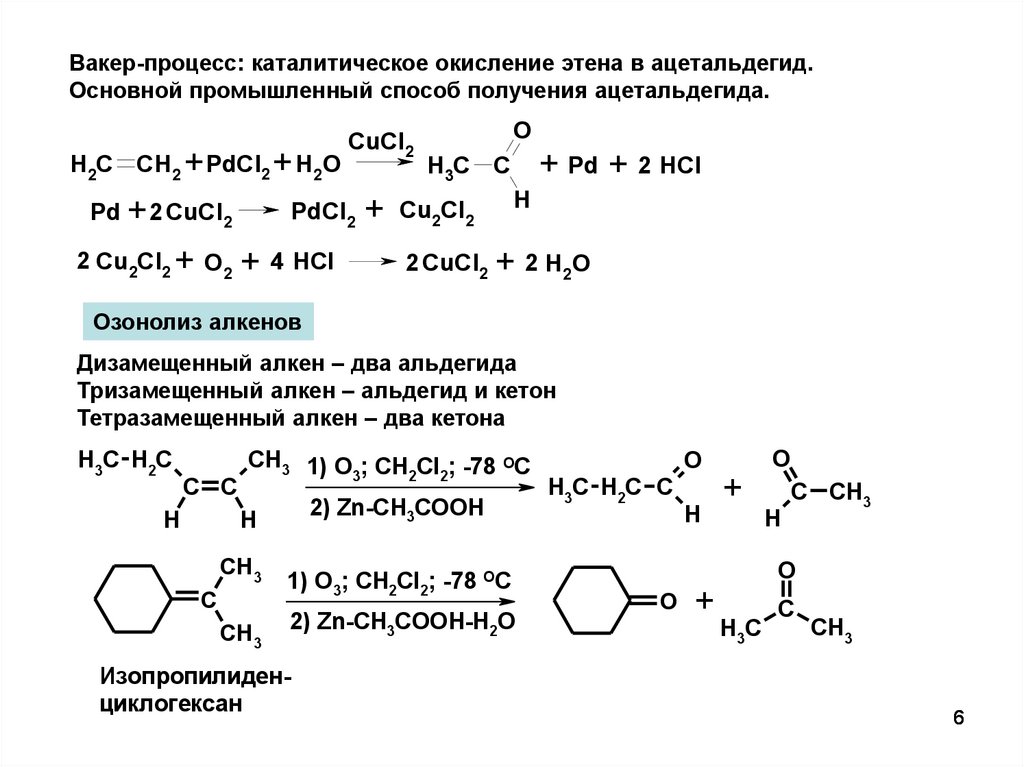
6.
Вакер-процесс: каталитическое окисление этена в ацетальдегид.Основной промышленный способ получения ацетальдегида.
H2C CH2 + PdCl2 + H2O
Pd + 2 CuCl2
2 Cu2Cl2 + O2
CuCl2
PdCl2
+ 4 HCl
+
O
+ Pd + 2 HCl
H3C C
Cu2Cl2
H
2 CuCl2 + 2 H2O
Озонолиз алкенов
Дизамещенный алкен – два альдегида
Тризамещенный алкен – альдегид и кетон
Тетразамещенный алкен – два кетона
H3C H2C
C C
H
CH3 1) O ; CH Cl ; -78 OC
3
2 2
2) Zn-CH3COOH
H
CH3
C
CH3
1) O3; CH2Cl2; -78 OC
2) Zn-CH3COOH-H2O
Изопропилиденциклогексан
O
O
H3C H2C C
H
+
H
C CH3
O
O
+
H3C
C
CH3
6
7.
Гидратация алкинов. Реакция Кучерова.OH
H2O; H+; Hg2+
OH
C
Правило Марковникова
C CH3
CH
1-Этинилциклогексанол
O
1-(Гидроксициклогексил)этанон
Гидроборирование алкинов
Получение альдегидов
3 H3C C CH
H3C
Sia2BH /ТГФ
HC CH OH
Енол
H3C HC CH BSia2
H2O2, NaOH
Пропенилдисиамилбор
O
CH3 CH2 C
H
Sia2BH =
Пропаналь
H3C
HC CH BH
H3C
CH3
2
Дисиамилборан
7
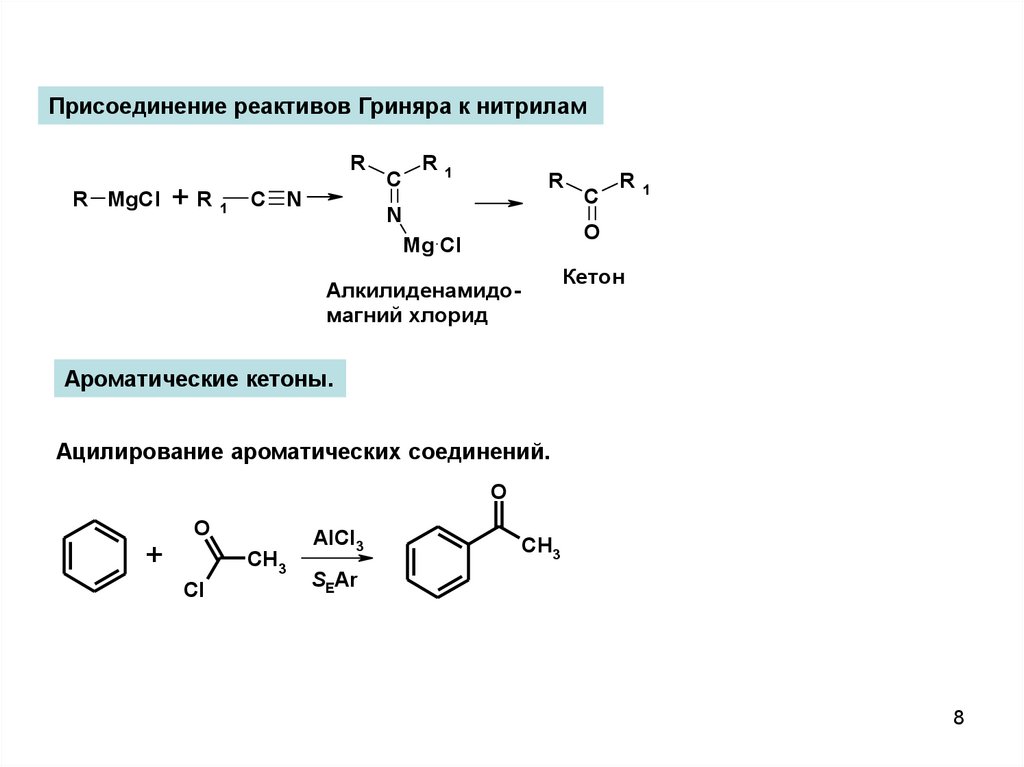
8.
Присоединение реактивов Гриняра к нитриламR
R MgCl
+R1
C N
C
R
1
R
N
C
R1
O
Mg Cl
Кетон
Алкилиденамидомагний хлорид
Ароматические кетоны.
Ацилирование ароматических соединений.
O
O
+
CH3
Cl
AlCl3
CH3
SEAr
8
9.
Гидролиз дигалогенпроизводныхАроматические альдегиды
O
CH3
+
Cl2
CHCl2
h
CH
H2O , Fe
Дихлорметилбензол
Окисление ароматических метилпроизводных
H3C
CH3
CrO3; (CH3CO)2O
(AcO)2HC
H2SO4
CH(OAc)2
Геминальный диацетат устойчив к окислению
H2SO4
H2O-C2H5OH
O
HC
O
CH
(50%)
Бензол-1,4-дикарбальдегид
9
10.
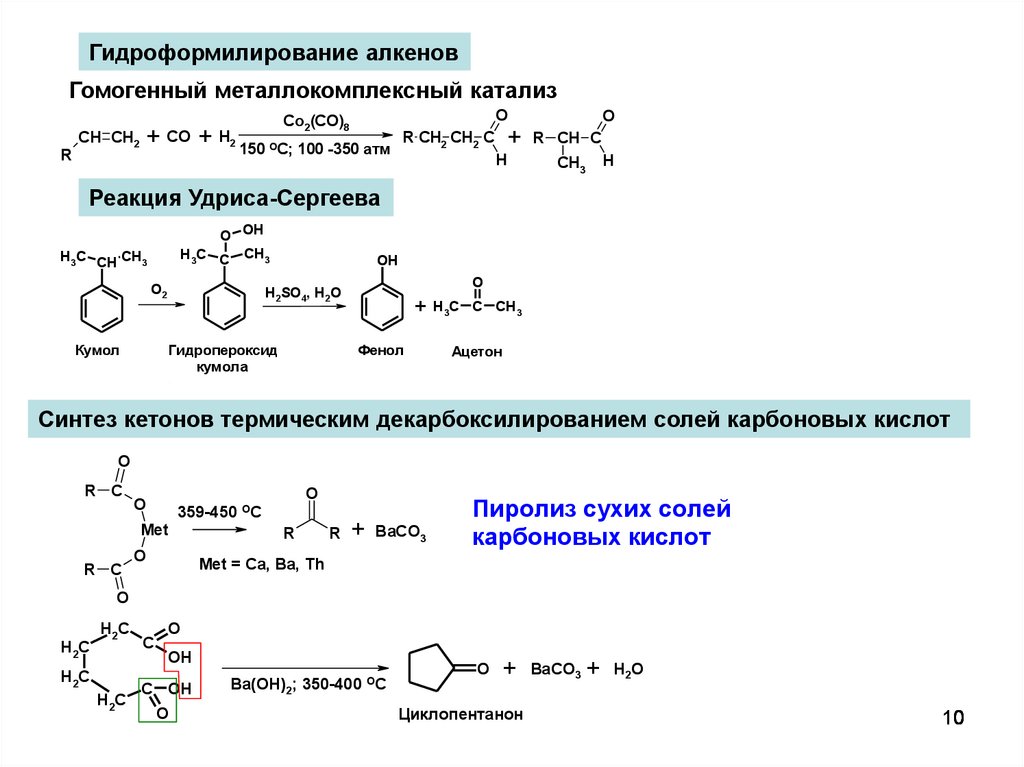
Гидроформилирование алкеновГомогенный металлокомплексный катализ
R
CH CH2
+
CO
O
Co2(CO)8
+ H2 150 OC; 100 -350 атм
+
R CH2 CH2 C
H
O
R CH C
H
CH3
Реакция Удриса-Сергеева
O OH
H3C C CH3
H3C CH CH3
О2
OH
O
Н2SO4, H2O
Гидропероксид
кумола
Кумол
+ H3C
Фенол
C CH3
Ацетон
Синтез кетонов термическим декарбоксилированием солей карбоновых кислот
O
R C
O
O
359-450 OC
Met
R C
O
R
R
+
BaCO3
Пиролиз сухих солей
карбоновых кислот
Met = Ca, Ba, Th
O
H2C
H2C
H2C
H2C
C
O
OH
C OH
O
Ba(OH)2; 350-400 OC
O
+
Циклопентанон
BaCO3
+
H2O
10
11.
Восстановление производных карбоновых кислотCH2
C
O
Cl
O
CH3
2) CH3OH
O
H3C
CH2
3
C
N
(70%)
H
бис-(2-метоксиэтокси)
алюмогидрид лития
1) LiAlH2(OCH2CH2OCH3)2
бензол, 25 ОС
C
CH3
C
O
Циклогексилацетальдегид
CH3 O
C
CH2
этилацетат или
толуол; 25 ОС
Циклогексилацетилхлорид
H3C
H2; Pd/BaSO4
CH3
CH3 O
H3C
C
(81%)
C
CH3
H
триметилуксусный альдегид
O
1) ДИБАЛ-Н; толуол
(92%)
H3C CH2 3 C
2)CH3OH
H
ДИБАЛ-Н: AlH(изо-C4H9)2 Ди-изо-бутилалюминийгидрид
CH3
N,N-Диметилпентанамид
11
12.
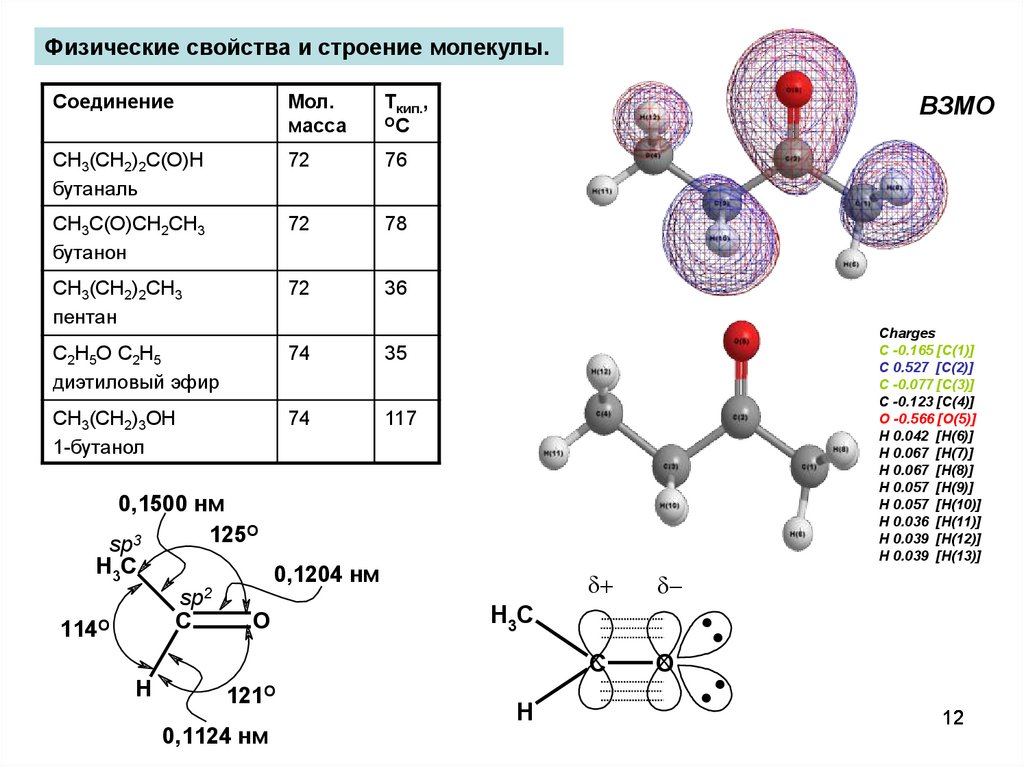
Физические свойства и строение молекулы.Соединение
Мол.
масса
Ткип.,
ОС
CH3(CH2)2C(O)H
бутаналь
72
76
CH3C(O)CH2СH3
бутанон
72
78
CH3(CH2)2CH3
пентан
72
36
С2H5O С2H5
диэтиловый эфир
74
35
CH3(CH2)3OH
1-бутанол
74
117
0,1500 нм
125O
sp3
H3C
0,1204 нм
2
sp
C
O
114O
H
121O
0,1124 нм
ВЗМО
C
O
H3C
H
..
..
Charges
C -0.165 [C(1)]
C 0.527 [C(2)]
C -0.077 [C(3)]
C -0.123 [C(4)]
O -0.566 [O(5)]
H 0.042 [H(6)]
H 0.067 [H(7)]
H 0.067 [H(8)]
H 0.057 [H(9)]
H 0.057 [H(10)]
H 0.036 [H(11)]
H 0.039 [H(12)]
H 0.039 [H(13)]
12
13.
Кислотность, основность, способность к енолизацииH3C
..
.. O
.. .
.. O
.
C
C
CH3
H3C
+
CH3
..
Nu
H
H
H3C
..
C
H
C
..
CH2
H
B:H+
....
O
H
+
H3C
..
C
H
Nu
+
C
CH3
....
O
H
B
H
H
H3C
C
C
CH3
.
.
..
O
H3C
C
C
CH3
....
O
енолят-анион
13
14.
Химические свойстваНуклеофильное присоединение AdN
Механизм реакции
: Nu
R1
Nu
..
O:
C
R1
R2
R2
I
C
Nu
..O :
C
R1
II
Плоская
молекула
R2
III
..O:
+
H
Nu
C
R1 R OH
2
IV
Переходное состояние близкое к тетраэдрическому
Строение и реакционная способность
CH3
H
C O
H
>
H3C
C O
H
>
H3C
C O
H3C
> > >
>
H3C
H3C
CH
C O
CH
CH3
Уменьшение реакционной способности:
Увеличение положительного индуктивного эффекта акильных групп
Увеличение эффекта сверхсопряжения (гиперконьюгации)
Уменьшение положительного заряда на карбонильном атома С
Увеличение стерических препятствий для атаки нуклеофила
14
15.
Присоединение цианид-иона. Образование циангидринов.KCN, HX
O
H2C
C
H
H3C H2C
H+, H2O
+
OH
OH
C3H7 CH C
O
O
OH -H2O
H3C HC
OH
H2C HC
LiAlH4
CN
H3C H2C
C3H7 CH CH2 NH2
(75%)
1-ГидроксиH C H2C CH CH CN
бутилцианид
-H2O 3
HCN
CH C
OH
Механизм AdN2
KCN
HCN
R
C
H +
+
HX
+
X
O
+
HCN
быстро
-
CN
C
H
+
CN
+ CN-
HX
O
медленно
C
R
H
O
R
+ KX
OH
быстро
HX
R
C
H
CN
v=k[CC=O] [CСN-]
X
+
CN
15
16.
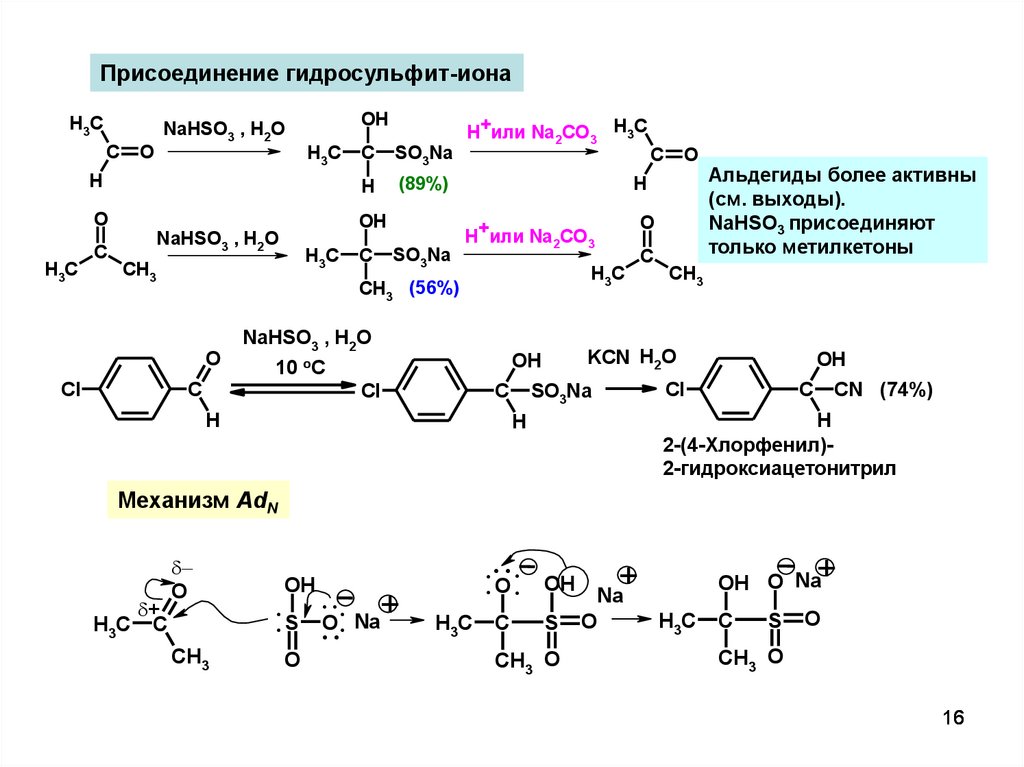
Присоединение гидросульфит-ионаH3C
C
NaHSO3 , H2O
O
OH
H3C
H
O
H3C
C
C
SO3Na
H
(89%)
OH
NaHSO3 , H2O
H3C
CH3
C
SO3Na
H+или Na2CO3 H3C
Cl
O
H+или Na2CO3
H3C
NaHSO3 , H2O
Cl
H
CH3
OH
Cl
SO3Na
C
C
Альдегиды более активны
(см. выходы).
NaHSO3 присоединяют
только метилкетоны
KCN H2O
OH
10 oC
C
O
H
CH3 (56%)
O
C
CN (74%)
C
H
2-(4-Хлорфенил)2-гидроксиацетонитрил
H
Механизм AdN
O
+
H3C C
CH3
.. Na+
O:
:S ..
..
:O:
OH
O
H3C
C
OH
S
CH3 O
+
+
Na
O
OH O Na
H3C
C
S
O
CH3 O
16
17.
Реакции с Mg-органическими соединениямиH2C
O
R'CH
R
O
MgBr
R'R''C
O
R CH2 OMgBr
R CH2 OH
R
H+, H2O R
CH OMgBr
CH OH
R'
R'
-MgOHBr
R
R
R' C OMgBr
R' C OH
R''
R''
Механизм
R
R'
C O
R''
Mg X
+
R MgX
R'
C
R''
O
+R
MgX
X
Mg
R'
R
C
R''
R
R
Mg X
O
-RMgX
R'
C
O MgX
H+, H2O
-HOMgX
R''
алкоксимагний бромид
R
R'
C
OH
R''
17
18.
Реакция с солями алкиновH2C
O
+
HC
Cu2C2; 100 OC; P
CH
Cu2C2; 100 OC; P
HO CH2 C
HO CH2 C
C
CH
+
O
CH2
CH2 OH
2-Бутин-1,4-диол
HC
CH
NH3(жид)
NaNH2
HC
- 38 OC
+
O
C
Na
O C
+
CNa
NH3(жид)-C2H5OC2H5, -38 OC
OH
NH4Cl;H2O; 0 OC
CH
(85%)
C CH
1-(1-этинил)-1-циклогексанол
Механизм AdN
R
C
CH
+ NaNH2
NH3
R
C
+
C Na
R'
+
R''
C
O
R'
R
C
C
C
+
H3O
R''
R
-NaOH
ONa
R'
C
C
C
R''
OH
18
19.
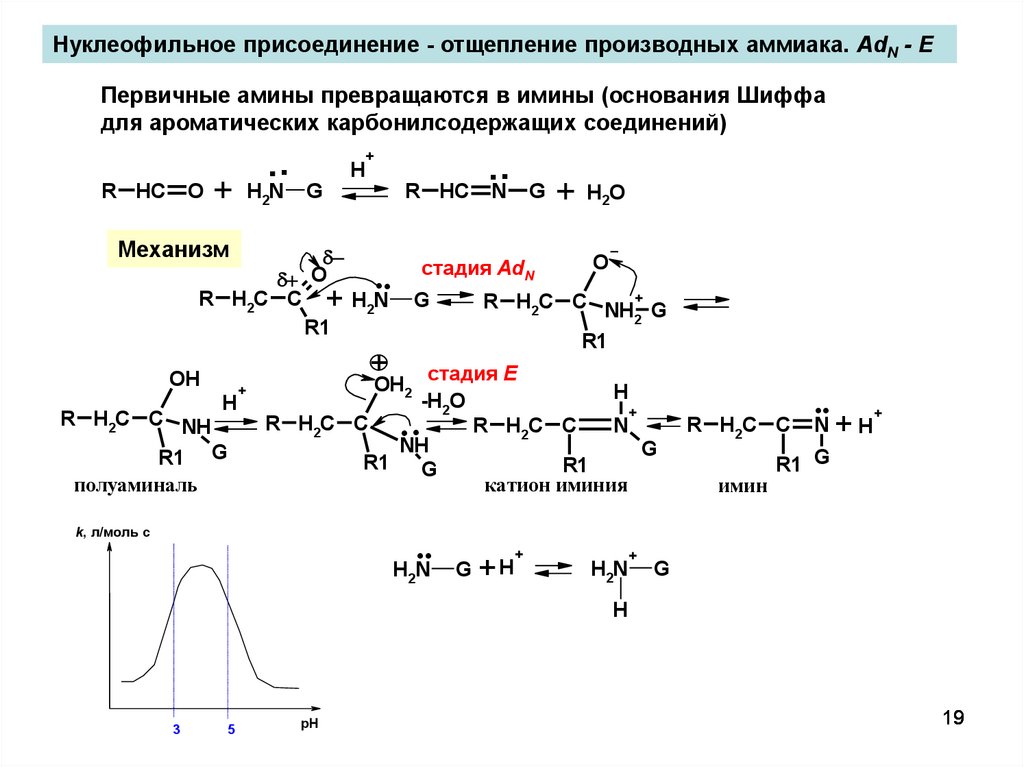
Нуклеофильное присоединение - отщепление производных аммиака. AdN - EПервичные амины превращаются в имины (основания Шиффа
для ароматических карбонилсодержащих соединений)
R HC
O
..
+
H2N
+
H
G
R HC
Механизм
O
..
R H2C C + H2N
R1
G
N
стадия AdN
G
H
R1 G
полуаминаль
+
+
H2O
O
R H2C C NH+ G
2
R1
+
OH
R H2C C NH
..
стадия E
H
-H2O
+
R H2C C
R H2C C
N
..
NH
G
R1
R1
G
катион иминия
OH2
k, л/моль с
..
H2N
G +H
+
H2N
+
R H2C C
имин
..
N
+H
+
R1 G
G
H
3
5
pH
19
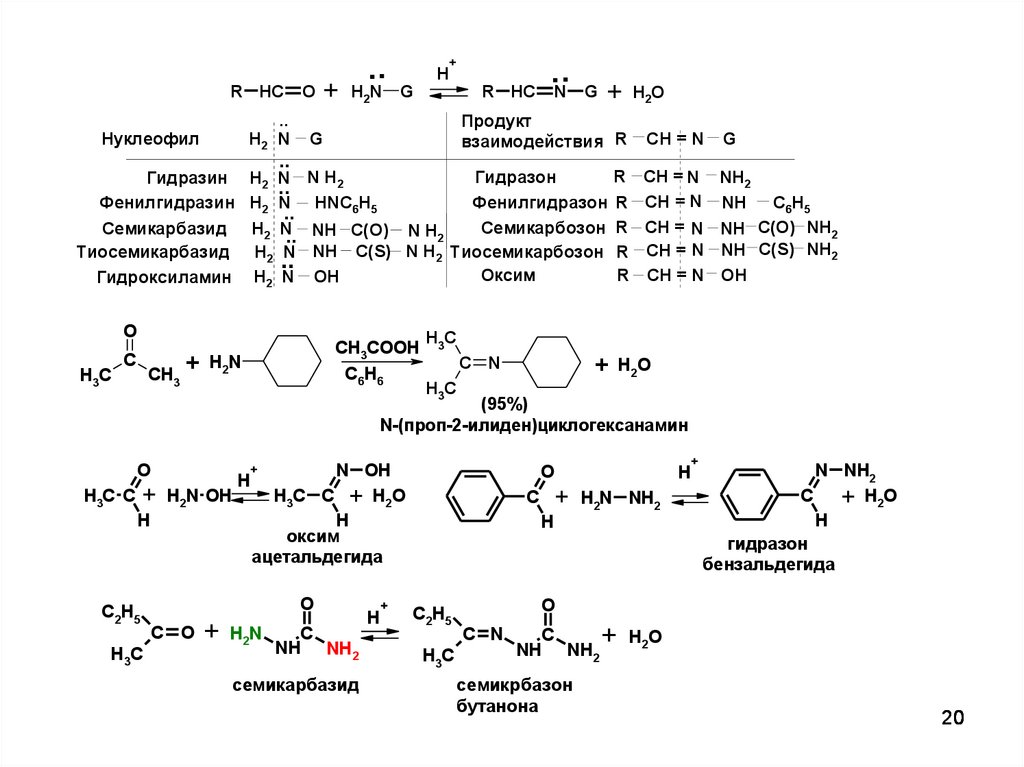
20.
R HC..
H2 N
Нуклеофил
O
+
..
H2N
+
H
G
R HC
..
N
..
Гидразон
Фенилгидразон
..
Семикарбозон
H2 N.. NH C(O) N H2
H2 N NH C(S) N H2 Тиосемикарбозон
..
Оксим
H2 N OH
Семикарбазид
Тиосемикарбазид
Гидроксиламин
O
C
CH3
+
Продукт
взаимодействия R
G
Гидразин H2 N N H2
..
Фенилгидразин H2 N HNС6Н5
H3C
G
CH3COOH
C6H6
+ H2N
R
R
R
R
R
H2O
CH = N
G
CH = N
CH = N
CH = N
CH = N
CH = N
NH2
NH
C6H5
NH C(O) NH2
NH C(S) NH2
OH
H3C
+ H2 O
C N
H3C
(95%)
N-(проп-2-илиден)циклогексанамин
O
N OH
H
H3C C + H2N OH
H3C C + H2O
H
H
оксим
ацетальдегида
C2H5
H3C
O
+
O
C O
+
H2N
C
NH NH2
семикарбазид
H
+
+
C
H
H2N NH2
H
C2H5
H3C
+
N NH2
C
+ H 2O
H
гидразон
бензальдегида
O
C N
C
+ H 2O
NH NH2
семикрбазон
бутанона
20
21.
Перегруппировка БекманаC R
R1
H
+
C NH R1
R
O амид
оксим N OH
Механизм реакции
син R
OH
C
N
анти R1
оксим
H2O
R
C
+
H 2O
..
H
+
..
R
C
N
+
..
OH2 ~ R1
-H2O
R
R1
мигрирует группа из антиположения по отношению
к уходящей группе
R1
R1
R
N
C N
+
-H
HO
..
..
C
R
+
..
R1
N
..
R1
C HN
O
амид
Синтез -капролактама – мономера для получения капрона
O
HO N
O
NH2OH, H
Циклогексанон
+
+
H
Оксим
циклогексанона
NH
Капролактам
21
22.
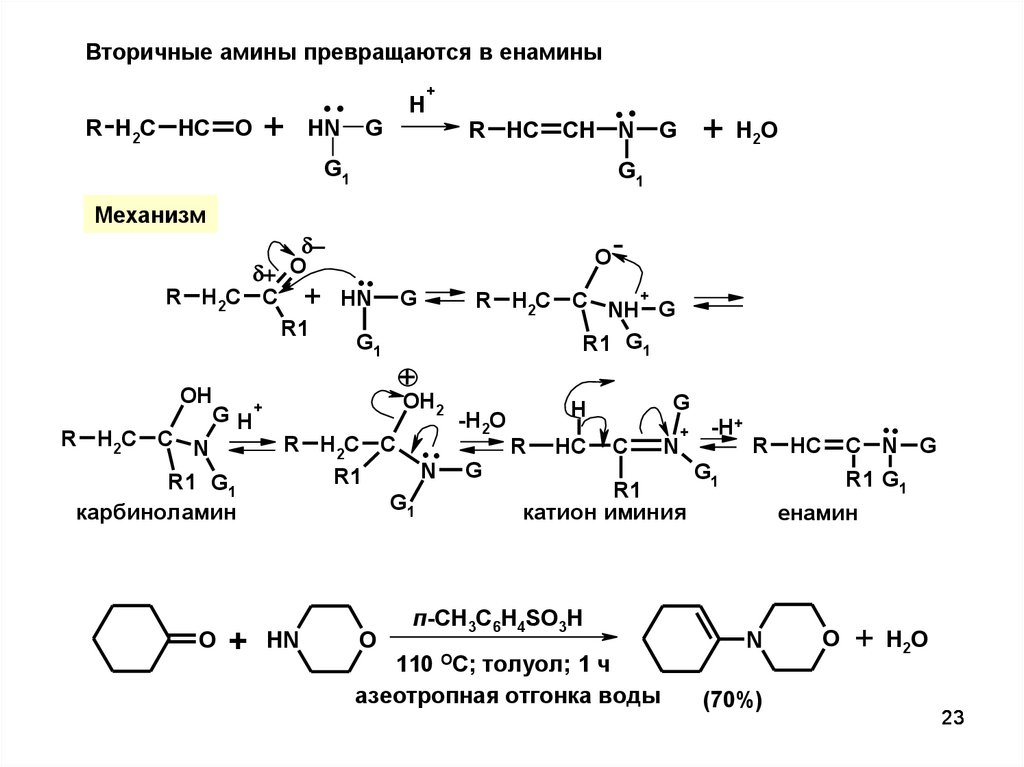
2223.
Вторичные амины превращаются в енаминыR H2C HC
O
+
..
HN
G
H
+
R HC
CH
G1
..
N
G
+
H2O
G1
Механизм
O
..
R H2C C + HN G
R1
G1
O
R H2C C NH+ G
R1 G1
+
OH
OH2
G
H
G H+
-H2O
+
..
+ -H
R H2C C N
R H2C C . .
R HC C N G
R HC C
N
N G
G1
R1
R1 G1
R1 G1
R1
G1
катион иминия
карбиноламин
енамин
O
+
HN
O
п-CH3C6H4SO3H
ОС;
110
толуол; 1 ч
азеотропная отгонка воды
N
(70%)
O
+
H2O
23
24.
Нуклеофильное присоединение воды и спиртовВзаимодействие с водой
O
H
C
+
OH
25 OC
H2O
H
H
C
99,999%
OH
H
Метандиол
(гемдиол)
В.Ф.Травень, Органическая химия
Взаимодействие со спиртами. Катализ кислотой.
..
O + HO
..
R HC
H
R'
R C
H
R
++ ..
..
R
C
HO
R1
+
R
C
R1
OR2
O
OH
+
R1
OH2
HC
-H2O
R
R'
полуацеталь
Механизм
O
OH
+
+
C
R1
OR2
..
+ H.O.
OH
R2
..
+ ..
HO
R
C
H
O
O
R
C
+
R1
R
HC
O
ацеталь
R2
H
O R'
+
R'
-H+
+
R1
R2
H
R2
OR2
OH
R
C
OR2
H
R'
+
R1
полукеталь
OR2
-H+
R C OR2
R1
кеталь
24
25.
Взаимодействие со спиртами. Катализ основанием.При катализе основанием образуются только полуацетали и полукетали!
R HC
..
O + HO
..
OH
R'
OH
R
HC
O
R'
полуацеталь
..
+ H.O.
OH
R'
O R'
R
HC
O
ацеталь
R'
Механизм
CH3OH
+
O
H3C
H
+
_
CH3O + H2O
сильный
нуклеофил
OH
_
O
O CH3
H
O
H3C C O CH3
H
H3C C O CH3
OH
+ H2O
H3C C O CH3
+
OH
H
полуацеталь
ацетальдегида,
2-метоксипроан-2-ол
25
26.
OC
+
OMe
C OMe
HCl
2CH3OH
H
H
O2N
O2N
H3C
O
(76-86%)
H3C
+
C
2C2H5OH
H
O
O
+
HO CH2CH2OH
SO3H
H3C
OC2H5
CH
+ H2O
OC2H5
(60-64%)
O
H3PO4; толуол
+
110 ОС; 4 ч
H2O
(80-85%)
Защита карбонильной группы
H3C C CH2 COOC2H5
3
O
HO CH2CH2OH ; H+
H3C C CH2 COOC2H5
3
O
O
+
1) LiAlH4, эфир H C C CH CH OH
H3O
3
2 3
2
O
O
2) H2O
H3C
C
CH2 CH2OH
3
O
26
27.
Тиоацетали и тиокеталиH2C
C
CH3 HS CH CH SH; BF .OEt
3
2
2
2
(C2H5)2O; 25
O
H2C
S
OC
C
CH3
S
(95%)
H2C
Ni-Ренея; H2
CH3
CH2
C2H5OH
Превращение карбонильной группы в метиленовую
CH3
CH3
HS CH2CH2SH; BF3.OEt2
(C2H5)2O; 25 OC
O
S
S
CH3
Ni-Ренея; H2
20 OC
(60%)
27
28.
Бензоиновая конденсация. Образование α-гидроксикетоновO
C
O KCN, C H OH, H O
2 5
2
C
C6H5
H
+
H
OH
CH бензоин (90%)
C C6H5
O
Механизм.
N
O
(1) Ar
+
C
H
CN
Ar
N
C
(2) Ar
C
CH
O
+
C
Ar
O
C
Ar
OH O
C Ar
O
OH
+
H2O
OH OH
2,3-дифенил-2,3-дигидроксипропаннитрил
H
CN H
C
C
C
Ar C
Ar CH
+ OH
OH
OH
цинагидрин
CN H
CN H
H2 O
C C Ar
Ar C C Ar + OH
H2O
H
OH
бензильный
карбоанион стабилизирован электроноакцепторной СN группой
Ar
N
N
Ar
C
C Ar
O
OH
+
CN
28
29.
Кето-енольная таутомерияОбразование енола под действием кислоты
H
R1
C CH2 R2
+HA
+
R1
C
HO
O
кетон
C
+
A
R2
R1
C
H
CH
R2
+ HA
OH
протонированная
форма кетона
енол
Образование енолят-аниона под действием основания
H
R1
C
H
O
C
+ .. B
R2
..
..
R1
C
H
O
C
O
R1
R2
C
H
C
R2
енолят-анион
Енолят-анион намного более активен, чем енол
29
30.
Рацемизация оптически активных кетоновРацемизация таких оптически активных соединений катализируется кислотами и основаниями.
Основно-каталитическая рацемизация может быть легко обоснована образованием карбаниона при отрыве
протона основанием от хирального углеродного атома.
H3C
O
O
H3C
B:
*
C C
HC C
CH3
H3C C
CH3 BH H3C C
H2
H2
Плоский карбоанион
Оптически
активный
Поскольку карбанион имеет плоское строение последующая атака воды при ее протолитическом
взаимодействии с α-углеродным атомом равновероятна с противоположных сторон и поэтому дает
рацемическую смесь.
H3C
O
H3C
HC C
H3C C
CH3
H2
O
C C
H3C C
H2
CH3
+
H 2O
Атака с двух сторон
равновероятна
Рацемат
Кислотно-каталитическая рацемизация приводит к образованию енольной формы кетона, в которой
хиральность атома углерода утрачивается, поэтому обратная реакция образования кето-формы дает
рацемическую смесь.
R1
R3
* R2 + HA
C CH
O
кетон
H
R1
C
C
+
HO
R3
R2
A
R3
R1
C
C
R2 + HA
OH
енол
30
31.
Реакции с участием енолов и енолят-анионовАльдольная и кротоновая конденсации. Примеры реакций.
O
O
H3C
C
+
H
H3C
NaOH, H2O
C
0-10 OC, 5 ч
H
O
H3C CH2 CH2 C
2
+
H
H3C CH2 CH2 C
2
пентаналь
OH
O
H3C CH2 CH2 C CH C
OH
H3C
C CH2 C
H
NaOH, H2O
0-5 OC
O
H3C CH2 CH2 C C
2
O
O
H3C
C
+
CH3
H3C
O
+
циклопентанон
BaO
C
tкип
CH3
C
H
H CH2 CH3
2
2
2-пропил-3-гидроксигептаналь
Конденсация кетонов.
(50%)
H
H
3-гидроксибутаналь
O
NaOH, H2O
H 100 OC, 3 ч
H CH2 CH3
2
Альдольная конденсация это реакция
образования углерод-углеродной связи
между атомом углерода карбонильной
группы одной молекулы и α-углеродным
атомом другой карбонильной молекулы.
O
2-пропил-2-гептеналь
Кетоны вступают в реакцию хуже, чем альдегиды.
OH
H3C
C CH2 C
O
(80%)
CH3
CH3
4-гидрокси-4-метил-2-пентанон
C2H5ONa, C2H5OH, t
O
(38%)
2-циклопентилиденO 1-циклопентанон
31
32.
Альдольная и кротоновая конденсация.Альдольная конденсация. Катализ основанием. Механизм.
-СН-связи
O
C
R
H
H2C
+
-
OH
O
быстро
+
C
H2 O
CH H
енолят-анион
O
O
O
O
медленно
C
R
C
R
R CH2 C CH C
CH H
H
CH2
H
H R
метиленовая карбонильная
компонента
компонента
R
+
+
быстро
HOH
OH
R CH2 C
O
CH C
+ OH-
H
H R
-гидроксиальдегид
(если R=H,альдоль)
Кротоновая конденсация
OH
R CH2 C
H
O
CH C
H
R
OH
+
OH
OH
R CH2 C
O
C
C
H
R
C
H
+
HOH
H
H R
енолят-анион альдоля
O
R CH2 C
C
O
R CH2 C
C
C
+
-
OH
H
H R
-ненасыщенный альдегид
(если R=H,кротоновй альдегид)
32
33.
Альдольная конденсация. Катализ кислотой. Механизм.В кислой среде реакцию практически
невозможно остановить
на стадии образования альдоля.
-СН-связи
O
C
R
H
H2C
R
H2C
O C +
+ H+
..OH
+R
OH
R
медленно
C
H
CH H
- метиленовая
карбонильная
компонента
компонента
OH
R CH2 C
H
O
CH C
R
H
+
OH
+ -
A
C
CH2 H
R
O
R CH2 C
H
H
H+
+
OH
CH C
H
H
R
+
O H
R CH2 C
HA
OH
+
R CH2 C
H
O
CH C
H
H R
-гидроксиальдегид
(альдоль)
O
CR C
H
+
C
CH H
енол
O
R CH2 C
C
H
R
C
H
+ H+ + H O
2
33
34.
Перекрестная альдольная конденсация-СН-связи
O
H3C C
I H
+
O
H3C CH2 C
II
O
C
+
OH
OH
+
H
пропаналь
карбонильная
компонента
метиленовая
компонента
O
C
H
O
OH
+
OH
O
O
+
H3C CH2 CH CH C
H3C CH CH2C
H3C CH CH C
H3C CH2CH CH2 C
I+I
H
H
H
II+II
H
I+II CH
CH3 H
I+II
3
-СН-связи
O
O
NaOH, H2O, 60 OC
H3C CH2 C
(68%)
HC C C
H
бензальдегид
3 H
OH
O
+HC
3
O
C
CH3 H
2-метил-3-фенилпентеналь
Na2СO3, H2O, 40 OC
H
CH2OH O
HOCH2 C
C
(82%)
CH2OH H
3-гидрокси-2,2-ди(гидроксиметил)пропаналь
Реакция Кляйзена – Шмидта.
O
O
O
C6H5 C
+
NaOH, H2O
O
OH
CH
C6H5 NaOH, 25 OC
CH
10 дней
10 ОС, 5 ч
(100%)
(76%)
H
Бензальдегид
Циклогесанон 2-(гидроксифенил2-(1-фенилметилиден)-1(ароматический (кетон)
метил)-1-циклогексанон
циклогексанон
альдегид)
Синтез –ненасыщенных кетонов и альдегидов, стабилизированных сопряжением с ароматическим ядром.
34
35.
Реакции, родственные альдольной конденсацииКарбонильная
компонента
O
С
Н
O
С
Н
Метиленовая
компонента
O
O
СН3 С О С СН3
Уксусный ангидрид
С
Н
O
CH = СН
С
OH
Коричная кислота
реакция Перкина
O
СH2
O
C
OC2H5
C
OC2H5
O
Диэтилмалоновый эфир
O
Продукт реакции
O
СН3 С OС2Н5
Уксусноэтиловый
эфир
CH = С
С
СH2
Н
O
С
Н
C
C
OC 2H 5
C
OC 2H 5
O
Диэтилбензилиденмалонат
реакция Кневенагеля
O
СН = СН
С
ОС 2Н 5
Этилбензилиденацетат
O
O
C
O
CH3
OC2H5
O
Этиловый эфир
ацетоуксусной кислоты
O
+
СН3 N O
Нитрометан
CH = С
C
CH 3
C
OC 2H 5
O
Этилбензилиденацетоацетат
O
CH = CH
N
+
O
-
1-Нитро-2-фенилэтен
35
36.
Примеры реакций, родственных альдольной конденсации36
37.
Региоселективная перекрестная альдольная конденсацияO
CH3
CH C CH3
CH3
LiN(i-C3H7)2
ТГФ, -78 ОС
O Li
+
O ZnBr ,-78 ОС
CH3
2
CH C CH2 + H3C C
CH3
H
+
O
O Li
O
CH3
CH
O
3
H2O, NH4Cl, 0 C
CH C CH2 CH CH3
CH C CH2 CH CH3
CH3
CH3
OH
5-гидрокси-2-метил-3-гексанон
LiN(i-C3H7)2 - литийдиизопропиламид (ЛДА)
рКа(HN(i-C3H7)2)=40, рКа(альдегида)=17-18, рКа(кетона)=19-20
O
CH3
CH C CH2
CH3
I
O
CH3
C C CH3
CH3
II
В условиях кинетического контроля
(низкая температура), применения
апротонного растворителя и
стерически затрудненного основания
(ЛДА) преимущественно образуется
енолят I.
37
38.
+O
H3C C CH2 CH3
+
O Li
ЛДА, -78 ОС
O
H3C CH CH2 C CH2 CH3
O Li
CH3CHO
H2C C CH2 CH3
енолят лития
OH
H2O
O
H3C CH CH2 C CH2 CH3
5-гидрокси-3-гексанон
O
O
H2C C CH2 CH3
H3C C CH CH3
I
II
O
O
H2C C CH2 CH3
I
H3C C CH CH3
II
В условиях кинетического контроля
два изомерных енолята не превращаются
друг в друга. Соотношение продуктов
определяется сотношением енолятов. Преимущественно образуется енолят I и продукт на его основе.
В условиях термодического контроля
два изомерных енолята находятся в
равновесии, положение которого
определяется их устойчивостью. В продуктах
реакции будет преобладать более
стабильная молекула, образующаяся из
енолята II.
38
39.
Региоселективность образования енолятовнесимметричных кетонов
O
R
B:
O
B:
R
H
термодинамический
енолят:
более замещенный,
более устойчивый.
Преимущественно
образуется при высокой
концентрации кетона,
высокой температуре,
большом времени
реакции.
H
O
R
кинетический
енолят:
менее замещенный,
менее устойчивый.
Преимущественно
образуется при низкой
температуре, в присутствии
стерически затрудненного
сильного основания,
малом времени реакции.
39
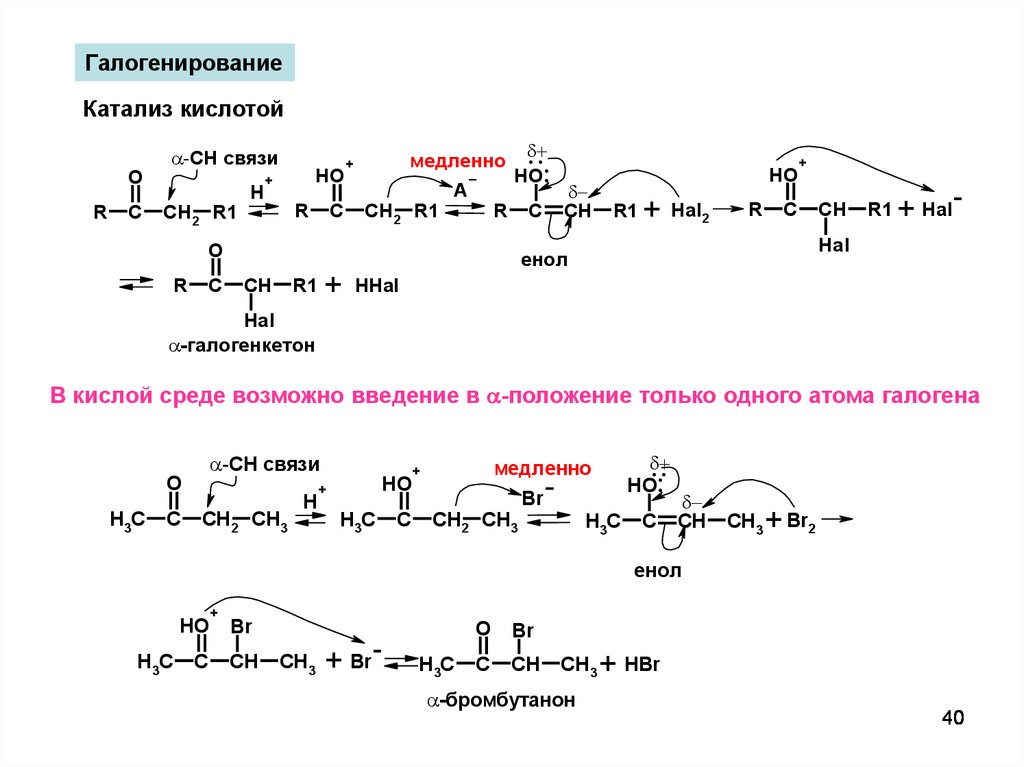
40.
ГалогенированиеКатализ кислотой
O
R
C
-CH связи
CH2 R1
H
HO
+
R
C
медленно
+
CH2 R1
A
..
.
HO.
R
C
O
R
C
CH
+
R1
CH
HO
R1
+
Hal2
R
+
C
CH
R1
+ Hal-
Hal
енол
HHal
Hal
-галогенкетон
В кислой среде возможно введение в -положение только одного атома галогена
-CH связи
O
H3C
C
CH2 CH3
H
медленно
+
HO
+
H3C
C
CH2 CH3
Br
H3C
..
.
HO.
C
CH
CH3
+ Br2
енол
+
HO
H3C
C
Br
CH
CH3
+ Br-
H3C
O
Br
C
CH
CH3
-бромбутанон
+ HBr
40
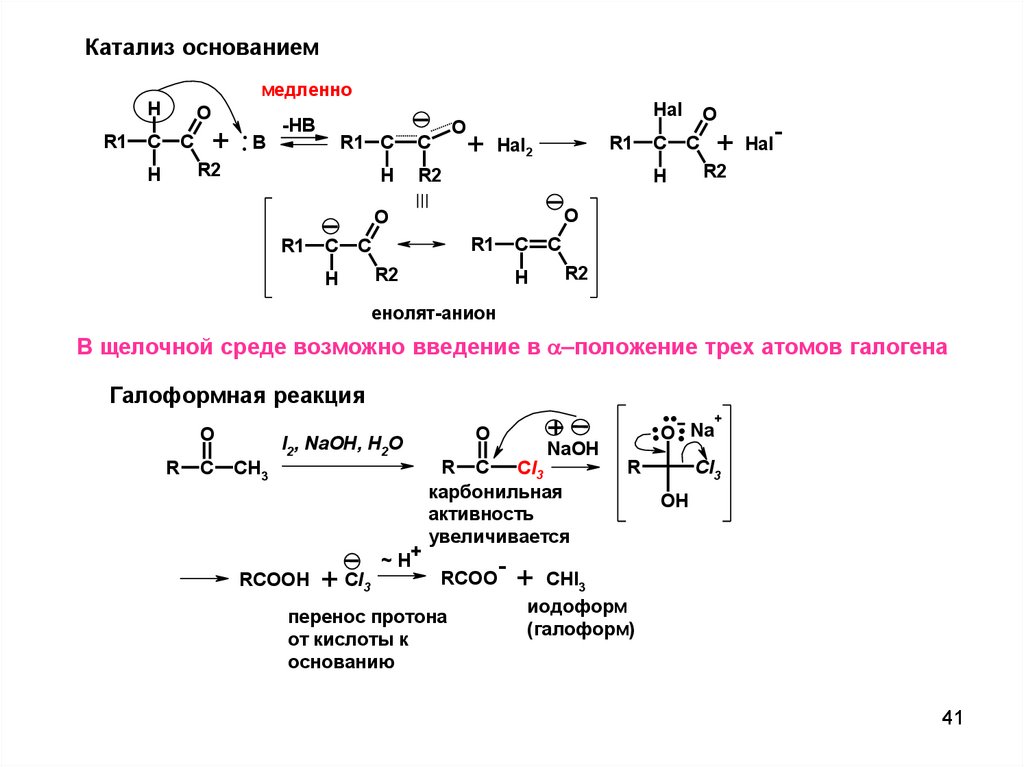
41.
Катализ основаниеммедленно
H
R1
O
C
C
+ .. B
-HB
R1 C
R2
H
H
O
C
Hal
+
R1
Hal2
R2
C
Hal
-
R2
O
R1
C
H
+
C
H
O
R1
C
O
C
R2
H
C
R2
енолят-анион
В щелочной среде возможно введение в положение трех атомов галогена
....
Галоформная реакция
O
R
C
CH3
I2, NaOH, H2O
RCOOH
+ CI3
~ H+
+
O
NaOH
R C
CI3
карбонильная
активность
увеличивается
RCOO
перенос протона
от кислоты к
основанию
-
O Na
R
+
CI3
OH
+
CHI3
иодоформ
(галоформ)
41
42.
Реакция с PCl5 – получение геминальных дихлорпроизводных углеводородов.Cl
O
+ PCl
CH3 CH2 C
O
CH3 CH2 C Cl
5
H
Cl
CH3 CH2 C CH3
+
PCl5
CH3 CH2 C CH3
H
Cl
Окисление альдегидов и кетонов
O
CH3 CH2 C
4
CrO3-H2O-H2SO4
H
ацетон, 0 ОС
Гексаналь
(капроновый
альдегид)
O
CH3 CH2 C (85%)
4
OH
Гексановая
(капроновая)
кислота
CH3 CH2 CH C
O KMnO -H O-KOH
4
2
3
H2C CH3 H
2-Этилгексаналь
0-10 ОС
O
CH3 CH2 CH C (78%)
3
H2C CH3 OK
2-Этилгексановая
кислота
Реакция «серебряного зеркала».
Окисление в присутствии других функциональных групп: С=С, СΞС, СН2ОН и др.
Аммиачный раствор
O оксида серебра (реагент Толленса)
Ag2O, H2O, NH3
20
3-циклогексен1-карбальдегид
OC
O
O
H
OH
(97%)
3-циклогексен1-карбоновая кислота
H3C
C
CH2
C
O
CH Ag O, H O, NH H
2
2
3
CH3
2-метил-2-пентеналь
H3C
C
CH2
C
C
OH
CH3
(98%)
2-метил-2-пентеновая
кислота
42
43.
Реакция «серебряного зеркала».43
44.
OKMnO4, KOH, HO
O
O HO
C
C
H 2O
CH3COOH-C6H6
CH2
(80%)
гексан-1,4-диовая
(адипиновая) кислота
циклогексанон
O
SeO2
CH2
CH2
H2C
tO
O
O
(60%)
1,2-циклогександион
Реакция Байера-Виллигера
Взаимодействие кетонов с перкислотами
O
O
C
CH3
O
C6H5COOOH
CHCl3
1-циклогексил-1-этанон
C
(67%)
циклогексилацетат
O
O
CH3COOOH
O
CH3COOC2H5
CH3
циклогексанон
-капролактон
Механизм: анионотропная миграция алкильной группы
..OH
O
H3C
C
OH
H3C
C
+
CH3
CF3COOOH
O
CH3
C
O
O
C
CF3COO
H3C
C
~CH3
CF3
CH3
O
+
+
H3C
O
O
CH3
+ CF3COOH
44
45.
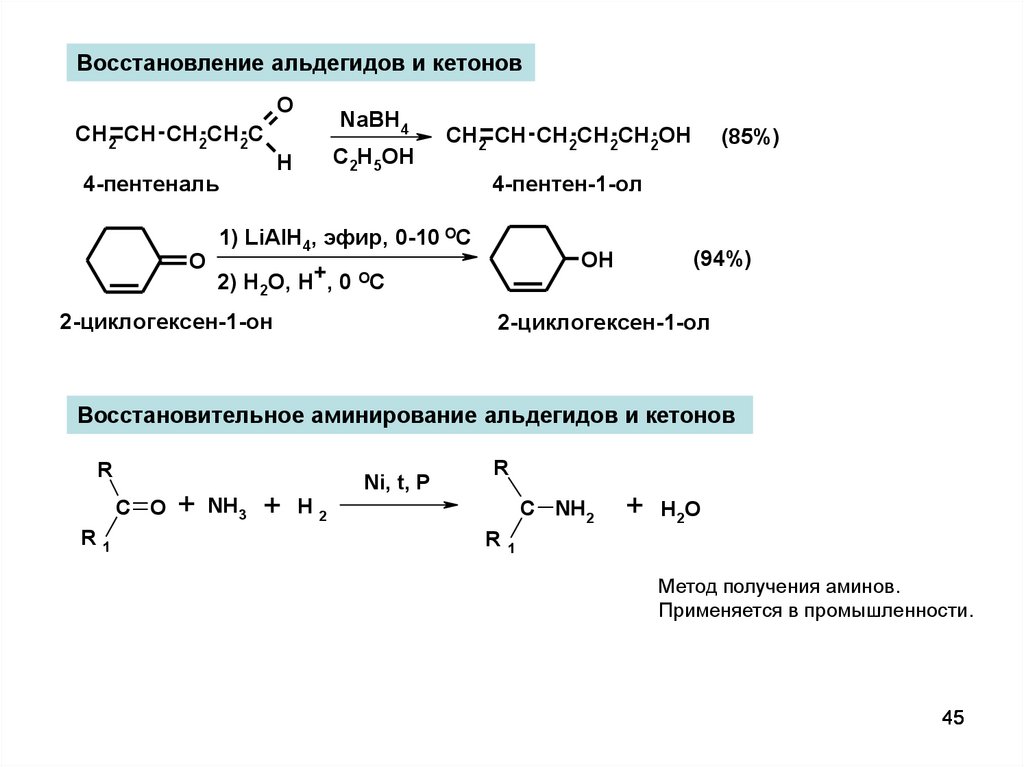
Восстановление альдегидов и кетоновO
NaBH4
CH2 CH CH2CH2C
H
4-пентеналь
O
C2H5OH
CH2 CH CH2CH2CH2OH
4-пентен-1-ол
1) LiAlH4, эфир, 0-10 ОС
(94%)
OH
2) H2O, H+, 0 OC
2-циклогексен-1-он
(85%)
2-циклогексен-1-ол
Восстановительное аминирование альдегидов и кетонов
R
C O
R1
+
NH3
+
Ni, t, P
R
H2
C NH2
+
H2O
R1
Метод получения аминов.
Применяется в промышленности.
45
46.
Реакция С.Канницаро (окисление-восстановление)Альдегиды, не имеющие -C-H-связей, в присутствии щелочи
подвергаются реакции диспропорционирования:
O
2 Ar
C
H
KOH
спирт-вода
O
2 R3C
C
H
KOH
спирт-вода
Ar H2C OH
R3C H2C OH
спирт
O
+ Ar
C
OK
+RC
3
O
C
OK
соль кислоты
Механизм
Ar C
O
H
O
OH-
Ar
H
Ar
. . ..
C
H
H
C
O
O
O
Ar
+
C
Ar H2C OH
O
-
v=k[ArCHO]2.[OH ]
46
47.
OC
2
H
O
50%-ная KOH
CH2 OH
спирт-вода, 100 ОС
HO (94%)
3-Гидроксибензиловый
спирт
2 H3C
C
C
CH3 H
2,2-Диметилпропаналь
HO (94%)
3-Гидроксибензоат калия
CH3 O
50%-ная KOH
спирт-вода, 100 ОС
C
OK
HO
3-Гидроксибензальдегид
CH3 O
+
H3C
C
C
CH3
+
H3C
CH3 OK
2,2-Диметилпропионат
калия
C
CH2 OH
CH3
2,2-Диметилпропанол
При перекрестной реакции Канницаро формальдегид превращается в
формиат анион
O
H3C
O
+
C
H
H
C
H
KOH
С2H5OH
высокая
карбонильная
активность
O
H3C
CH2 OH
+H
C
OK
(90%)
47
48.
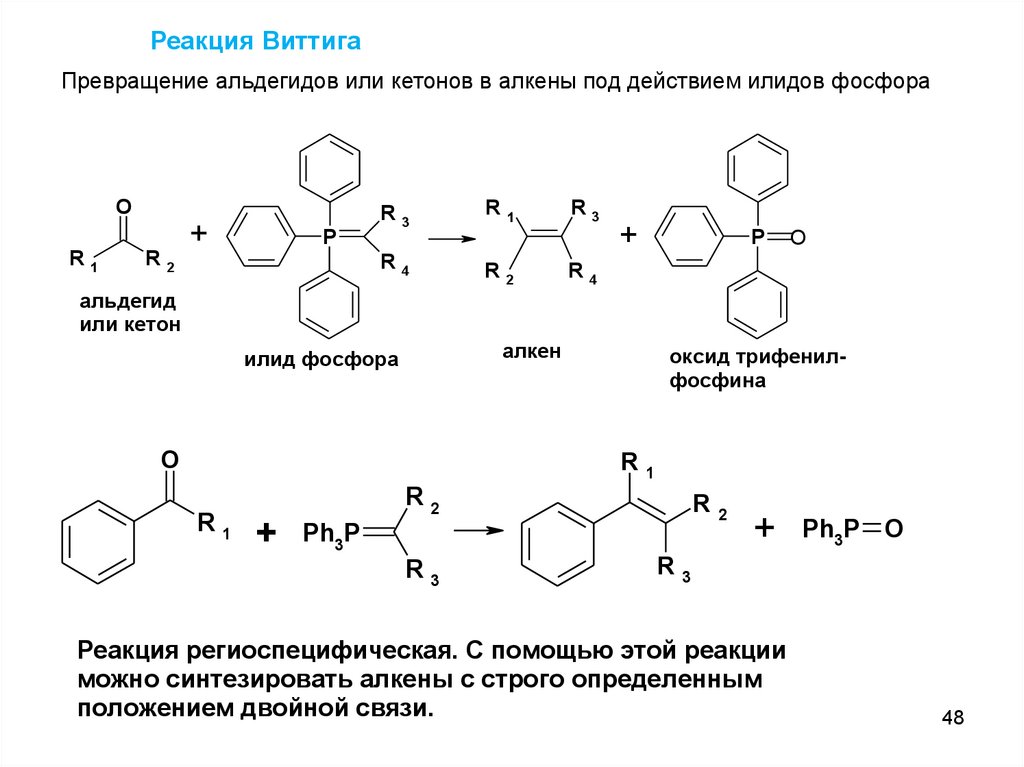
Реакция ВиттигаПревращение альдегидов или кетонов в алкены под действием илидов фосфора
O
R1
R2
+
P
R3
R1
R4
R2
R3
+
P
O
R4
альдегид
или кетон
алкен
илид фосфора
O
оксид трифенилфосфина
R1
R1
R2
+
R
Ph3P
R3
2
+
Ph3P O
R3
Реакция региоспецифическая
. . С помощью этой реакции
можно синтезировать алкены с строго определенным
положением двойной связи.
48
49.
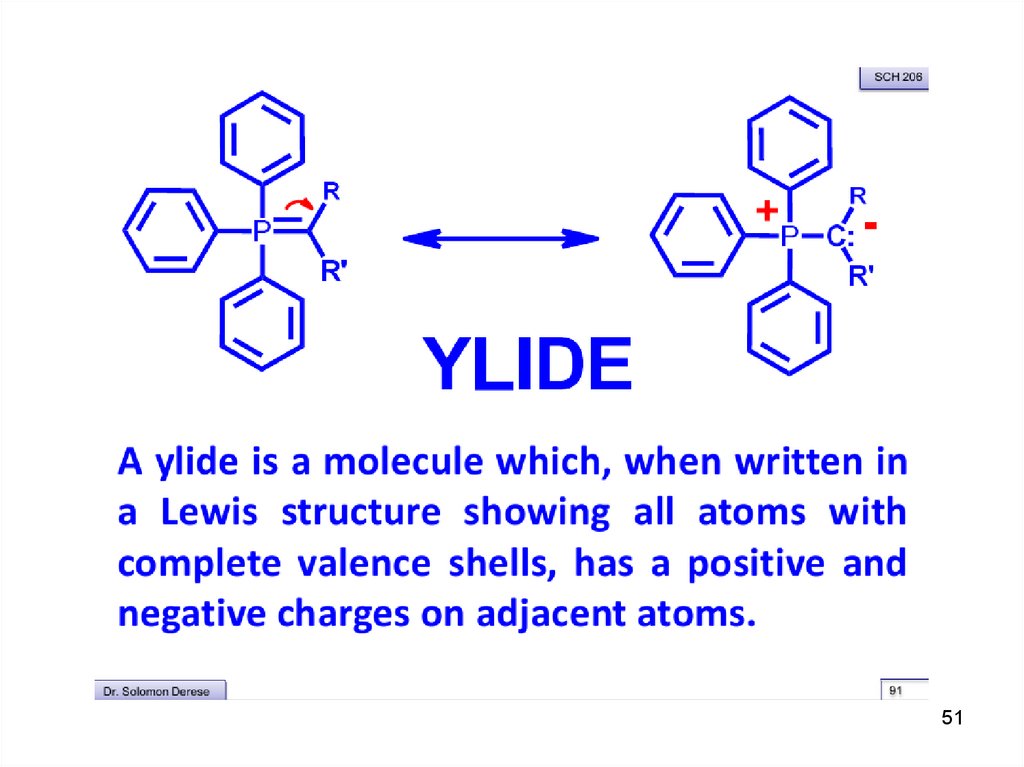
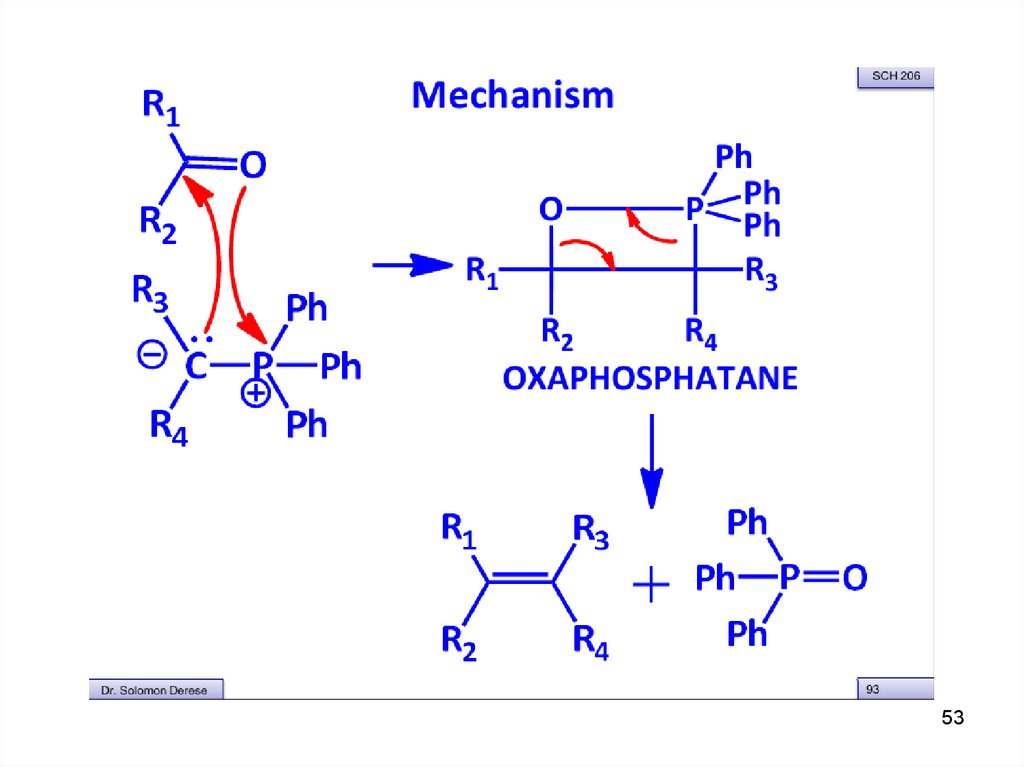
Механизмподвижный
(кислый) протон
Ph +
B:
CH2
Br
Ph P
CH3
- NaBr, -CH3OH
Ph
Ph
Br
Ph P: + H3C
CH2
Ph
трифенилфосфин
H3C
H3C
Ph
Ph P
Ph
CH
CH3
этилтрифенилфосфонийбромид
Ph = C6H5
H3C +
C O
H3C
Ph +
Ph P CH
CH3
Ph
B : = сильное основание:
CH3ONa, NaNH2, C6H5Na, (CH3)3COK
CH3
CH3
CH3
-78 OC
0 OC
-78 OC
H3C C CH CH3
H3C C CH CH3
:O.. : P(C6H5)3
O P(C6H5)3
+P(C6H5)3
_ +
илид
оксафосфетан
бетаин
(фосфоран)
(цвиттерион)
+ :CH
H
C C
_
+
CH3
2-метил-2-бутен
O=P(C6H5)3
+
O-P(C6H5)3
трифенилфосфиноксид
49
50.
В.Ф.Травень, Органическая химия.50
51.
5152.
5253.
5354.
5455.
5556.
Восстановление до пинаконовR1 R1
R1
Mg/Hg, C6H6, t O
R2 C C R2
C O
2
R2
OH OH
Механизм
e
R1
O
C O
R2
R1
e
+
Mg/Hg
2+
C
R1
C O
Mg
O
димеризация
C
R2 R1
R2
анион-радикалы
R2
Mg
O
R2 C
R1
O
C R2
R1
H2O
OH OH
R2 C C R2
пинакон
(виц. диол)
R1 R1
56
57.
PCC-пиридиний хлорхромат57
58.
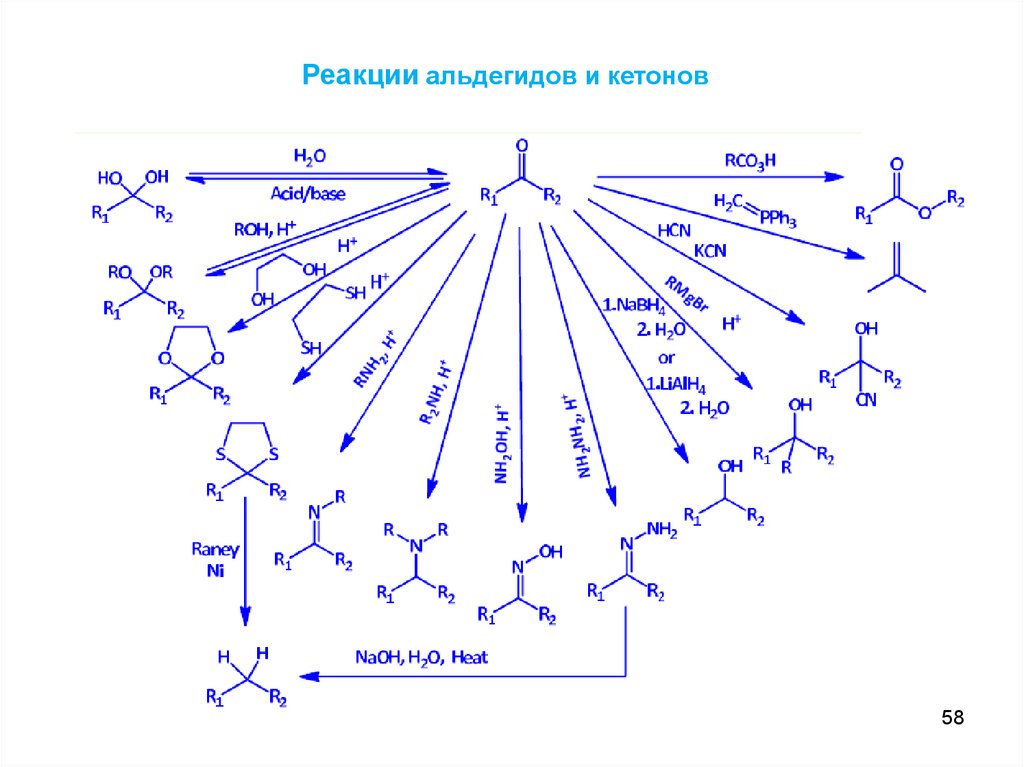
Реакции альдегидов и кетонов58
59.
Непредельные альдегиды и кетоныНепредельные несопряженные альдегиды и кетоны
C
O Проявляют свойства алкенов и
C CH2 C
n
карбонилсодержащих соединений
Непредельные сопряженные (α,β-ненасыщенные) альдегиды и кетоны
O
H2C CH C CH3
H2C CH CH O
C C
C O
пропеналь
3-бутен-2-он
(акролеин)
(метилвинилкетон)
Способы получения
Кротоновая конденсация
O
H3C
+
C
O
H3C
H
H
O
O
C6H5 C
+
H
C
H
H3C
C
C6H5
O
+
H3C
CH CH
2-бутеналь
NaOH, 20 OC
C
H
C6H5 CH
O
CH C
C6H5
(85%)
1,3-дифенил-2-пропен-1-он
59
60.
Окисление ненасыщенных спиртовHC
C CH C
CH2 OH
CH3
2-метил-2-пентен-4-ин-1-ол
C6H5 CH C
CH
CH2Cl2, 25
CrO3-H2O-H2SO4
ацетон, 25 ОС
OH
1-фенил-2-пропин-1-ол
....O
1
Строение молекулы
....O
4
C
2 3
C C
......O
C
+
C
C
OC
HC
C CH C
C
(72%)
H
CH3
2-метил-2-пентен-4-иналь
C6H5 C
C
CH (80%)
O
1-фенил-2-пропин-1-он
4
C
2 3
C C '
1
O
MnO2
......O
1
O
+
C
C
2
C
3
4
C
C
C
60
61.
Следствие сопряжения:• пониженная реакционная способность
в реакциях AdE (смещение электронов
к кислороду),
• 1,2- и 1,4-присоединение.
ВЗМО
НСМО
61
62.
Присоединение по С=С связиПрисоединение по С=О связи
Сопряженное присоединение
Химические свойства
Сопряженное присоединение
1,2-Присоединение к -ненасыщенным енонам
1
O
2
C
1
3
C
4
+
C
4
O
2
C
3
HO
H
C
+
C
H
+
C
C
1O
3+
2C
C
Y C
HO
Y
C C
Присоединение Hδ+
происходит с образованием
более устойчивого
карбокатиона I
4
H
II
C
+
C
+
1
H
O
H C+
2
4
C C3
I
+
1
Y
O
2
C
H
C3
4
Y
1,4-Присоединение к -ненасыщенным енонам
1
O
C
4
2
C
3
C
+
нуклеофильная
атака на активированную двойную связь
C
O
Y
C
C
+
Y
енолят-анион
(неустойчивое
соединение)
C
O
C
C
Y
+
H
O
C
H C
C Y
кето-енольная
таутомерия
H
C
HO
C
C
Y
продукт
1,4-присоединения енол
(неустойчивое
соединение)
62
63.
1,2-Присоединение по С=С связиГалогенирование
O
H2C CH C
Br2
H CCl4
O
H2C CH C
H
Br Br
2,3-дибромпропаналь
Реакция Дильса-Альдера
O
HC
HC
CH2
+
CH2
HC
O
CH
CH2
3-циклогексен1-карбальдегид
63
64.
1,4-Присоединение электрофильных реагентовH3C
HC CH
C O
H3C
3-пентен-2-он
H2C CH
C O
H
акролеин
(пропеналь)
H
H3C
HC CH
C O
HO
H3C
4-гидрокси-2-пентанон
H 2O
H2SO4
H
HBr
H2C CH
C O
Br
H
3-бромпропаналь
+
Механизм
H2C CH C
HBr
H
2.
+
H2C
HC CH OH
карбокатион
аллильного
типа
3.
OH
H2C CH C
...
O.
1.
HCl, HBr, H2O/H+, CH3OH/H+
присоединяются «против»
правила Марковникова
H2C HC CH OH
Br
H
+. .
O H
H2C
Br
+
H2C CH C
H2C CH C
..
OH
..
H
H
..
.. Br ..
резонансный гибрид
+
H2C CH C
..
OH
..
+ Br
H
HC CH OH
енол
O
H2C H2C C
Br
H
64
65.
1,4-Присоединение нуклеофильных реагентовПрисоединение аминов
H3C
C CH CH2
CH2CH3
+ .. NH
20 ОС
C2H5OH
O
CH2CH3
3-бутен-2-он
диэтиламин
CH2CH3
H3C
C CH2 CH2 N
CH2CH3
O
4-N,N-диэтиламино-2-бутанон
Присоединение HCN
Для -ненасыщенных альдегидов преимущественно
протекает 1,2-присоединение по С=О связи.
O
R CH CH C
H
+ HCN
OH
R CH CH C CN
H
циангидрин
Для -ненасыщенных кетонов наблюдается конкуренция
1,2- и 1,4-присоединения (стерические затруднения)
O
R CH CH C
+
R1
HCN
OH
R CH CH C CN
R1
циангидрин
+
O
R CH CH2 C
CN
R1
-кетонитрил
65
66.
Присоединение реактивов ГриньяраДля -ненасыщенных альдегидов преимущественно
протекает 1,2-присоединение по С=О связи
O
1) R2MgBr
H
2) H3O+
R CH CH C
OH
R CH CH C R2
H
+
HOMgBr
Для -ненасыщенных кетонов наблюдается конкуренция
1,2- и 1,4-присоединения
OH
R CH CH C R2
+
2) H3O
R1
1,2-присоединение
кинетический
контроль
O 1) R2MgBr
R CH CH C
R1
H3C CH CH C
3-пентен-2-он
+R
O 1) CH MgBr
3
CH3
2) H3O+
OH
H3C CH CH C CH3
1,2-(72%) CH3
2-метил-3-пентен-2-ол
O
CH CH2 C
R2
+
HOMgBr
R1
1,4-присоединение
термодинамический
контроль
CH3
O
+ H3C
CH CH2 C
1,4-(28%)
+
HOMgBr
CH3
3-метил-2-пентанон
66
67.
Реакция МихаэляO CH
O
3
CH2CH2C
CH3
O
O
CH3
+
Донор
Михаэля
KOH
H2C CH C
O
Акцептор CH3
Михаэля
Метанол
O
2-Метил-2-(3'-оксобутил)1,3-циклогександион
2-Метил-1,3циклогександион
CH3
H
+
CH3
CH3
CH3
O
O
O
OH
O
нуклеофил
O CH
3
CH3
O
енолят-анион
O
CH3
OH
O
- H 2O
промежуточный продукт
внутримолекулярной
альдольной конденсации
O
CH2 CH C
O
H2C CH C
CH3
O
Аннелирование по Робинсону.
O
O
O
O
85%
АННЕЛИРОВАНИЕ (от лат. annellus, anellus - колечко)
(аннулизация), пристраивание карбо- или гетероцикла
к существующей циклической системе.
O CH
O
3
CH2CH2C
CH3
OH
O
продукт реакции
Михаэля
CH3
O
67
68.
Соотношение между 1,2- и 1,4-присоединениемOH
C
OH
Y
C
Y C C
C C
O
C
C C
+
1,2-присоединение
(быстро)
HY
1,4-присоединение
(медленно)
OH
C
Y C C
OH
C
Y
C C
O
C
Y C CH
Кето-енольная
таутомерия
Быстро
Менее стабильный продукт,
быстрее образуется. Продукты
1,2-и 1,4-присоединения не
находятся в равновесии.
Кинетический контроль.
Более стабильный продукт,
медленнее образуется. Продукты
1,2-и 1,4-присоединения
находятся в равновесии.
Термодинамический
контроль.
OH
C
C C
OH
Y
C
Y C C
68
69.
ОкислениеОкисление реактивом Толленса (реакция «серебряного зеркала»)
O
H
H3C
C
CH2
CH O
C
Ag2O, H2O, NH3
CH3
H3C
2-метил-2-пентеналь
C OH
H
C
CH2
C
CH3
2-метил-2-пентеновая
кислота
В жестких условиях окисление проходит с разрушением молекулы.
Восстановление
Каталитическое восстановление
H2, Ru/C
O
H3C CH2 CH2 CH2 OH
H3C CH CH C
H
H2, Pd
+
H3C CH2 CH2 CH3
O
H3C CH2 CH2 C
H
69
70.
Селективное восстановление C=O группы.Восстановители LiAlH4, NaBH4
O
H3C CH CH C
H
1) LiAlH4; эфир; -10 ОС
2) H3O+; 0 OC
H3C CH CH CH2 OH
(82%)
2-бутен-1-ол
Селективное восстановление C=С группы.
Восстановители Li / NH3; Na / Hg, C2H5OH, H2O, H2/PtO2.
O
1) Li; NH3; -33 OC
2) NH4Cl; H2O
CH3
2-метил-2-циклогексен-1-он
O
CH3
2-метил-2-циклогексанон
C6H5 H2(3 атм), PtO2, 25 ОС C H
6 5
C6H5
O
1,3-Дифенилпроп-2-ен-1-он
CH3COOEt
C6H5
O
90%
1,3-Дифенилпропан-1-он
70
71.
КетеныC
C
H2C
O
C
H3C HC
O
кетен
куммулированные
двойные связи
C
O
метилкетен
Способы получения
Пиролиз
O
H3C
C
O
H3C
C
AlPO4, 700 OC
H2C
C
O
+
H2O
H2C
C
O
+
CH4
OH
CH3
700-750 OC
Дегидрогалогенирование галогенангидридов карбоновых кислот
Hal
O (C2H5)3N
R
R
CH2 C
Hal
CH C
O
R
O
CH C
Zn
R
CH C
O
Hal
71
72.
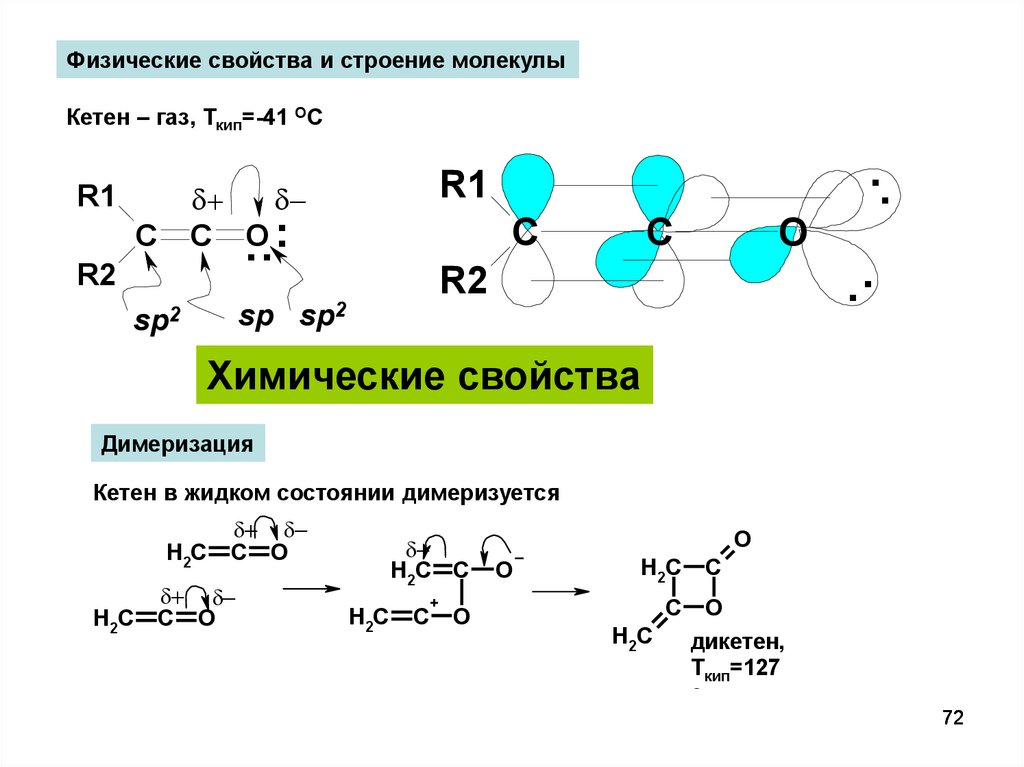
Физические свойства и строение молекулыКетен – газ, Ткип=-41 ОС
R1
.
...
R1
C O
C
R2
C
O
R2
sp sp2
sp2
C
..
..
Химические свойства
Димеризация
Кетен в жидком состоянии димеризуется
H2C
H2C
C O
C O
H2C C
H2C
C
+
O
O
O
H2C
C
C
O
H2C
дикетен,
Ткип=127
ОС
72
73.
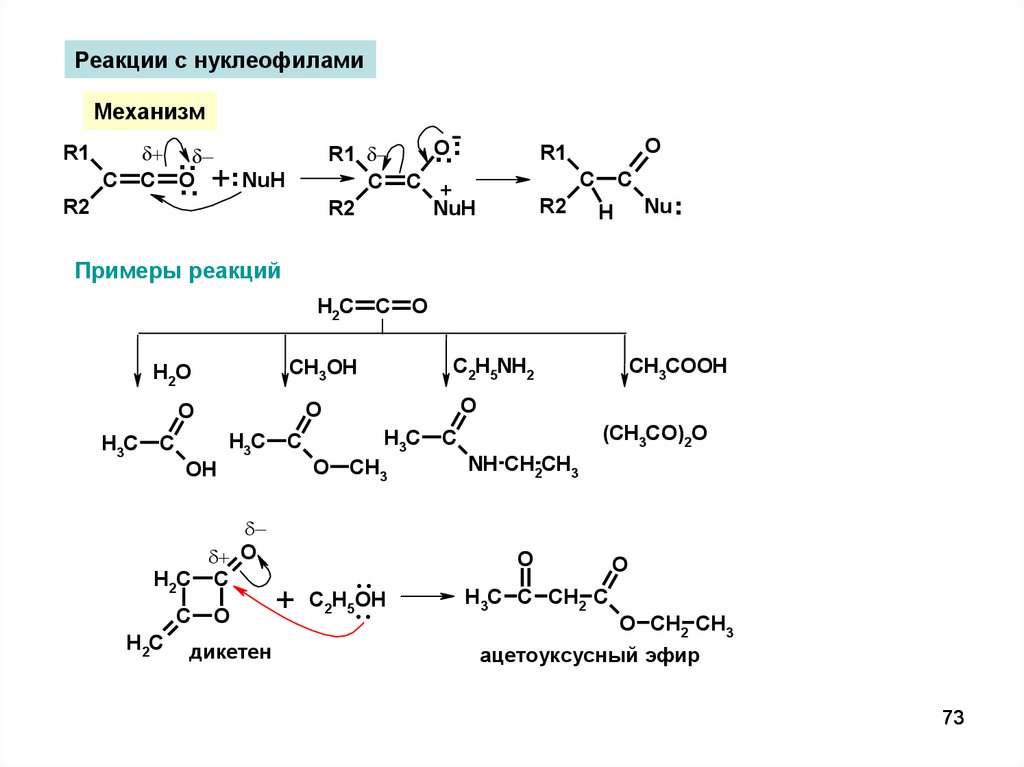
Реакции с нуклеофиламиМеханизм
...
.. +.NuH
..
O
R1
C C +
NuH
R2
C O
R1
C
R2
O
R1
C
R2
C
H
.
Nu
Примеры реакций
H2C
C
OH
H3C
O
H2C C
H2C
C2H5NH2
O
дикетен
H3C
C
O
+
CH3COOH
O
O
O
C
O
CH3OH
H 2O
H3C
C
CH3
..
C H OH
..
2
5
(CH3CO)2O
C
NH CH2CH3
O
O
H3C C CH2 C
O CH2 CH3
ацетоуксусный эфир
73
74.
ХиноныO
O
O
O
O
O
O
O
1,2-бензохинон
1,4-бензохинон
1,4-нафтохинон
9,10-антрахинон
Способы получения
Реакция окисления фенолов и аминов
O
OH
CH3
Na2Cr2O7, 30 OC
H2SO4-H2O
OH
O
NH2
CH3
Na2Cr2O7, 5 OC
H2SO4-H2O
O
(90%)
OH Ag2O
OH
O
(44%)
пирокатехин
эфир
O
O
1,2-бензохинон
74
75.
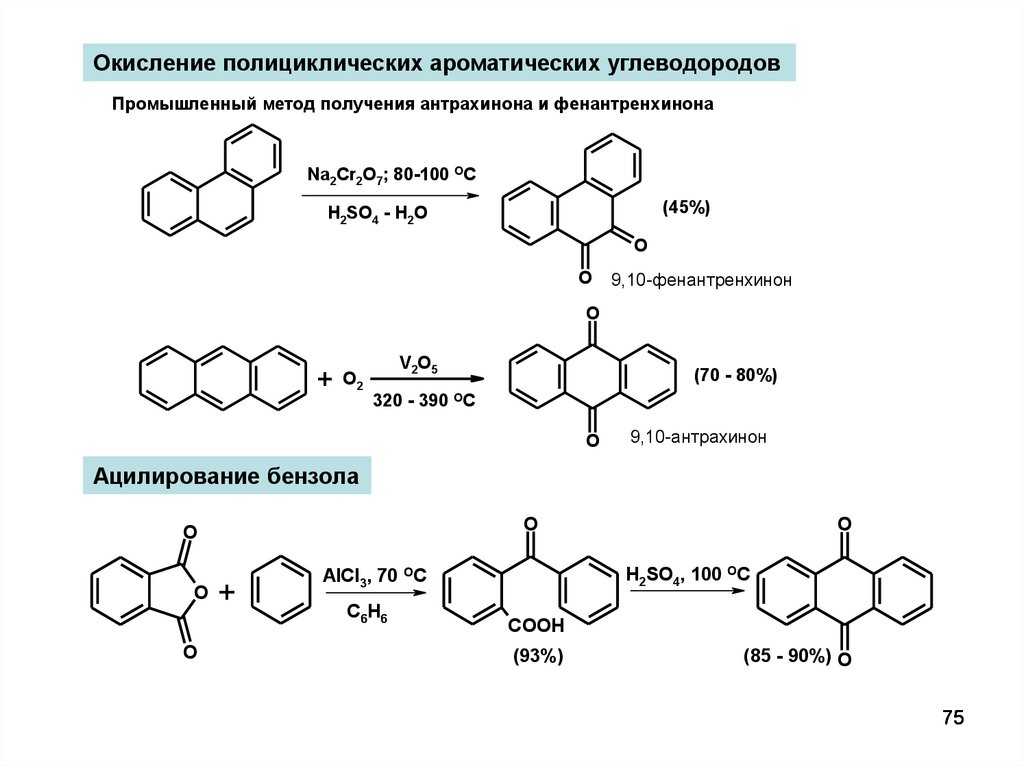
Окисление полициклических ароматических углеводородовПромышленный метод получения антрахинона и фенантренхинона
Na2Cr2O7; 80-100 OC
(45%)
H2SO4 - H2O
O
O
9,10-фенантренхинон
O
+
O2
V2O5
320 - 390
(70 - 80%)
OC
O
9,10-антрахинон
Ацилирование бензола
O
O
O
O
+
H2SO4, 100 OC
AlCl3, 70 OC
C6H6
O
COOH
(93%)
(85 - 90%) O
75
76.
Строение молекулы....O
0,149 нм
Все атомы молекулы хинона в sp2-гибридизации
Хиноны – -непредельные кетоны
0,132 нм
....O
Химические свойства
O
Восстановление хинонов
e
O
OH
O
O
e
O
семихинон
(анион-радикал)
O
+
OH
OH
O
[O]
[H]
O
OH
O
донор
хингидрон акцептор
электронов
донорно- электронов
основание акцепторный -кислота
комплекс
O
OH
OH
76
77.
1,2-ПрисоединениеN
O
+
OH
+
NH2OH
монооксим
O
O
+
O
H
O
OH
диоксим
Cl
Cl
N
O
H
Cl2
OH
NH2OH
O
O
N
O
изб. Cl2, t
- HCl
Cl
O
Cl
Cl
Cl
Cl
O
хлоранил
(сильный
окислитель)
77
78.
1,4-Присоединение..O
+
O
+
H
....OH
H
X
X
C
O
O
OH
OH
X
+
X
H
H
OH
O
O
X = Cl, Br, CH3COO, CH3O, C6H5NH
Реакция Дильса-Альдера
O
O
HCl
CH3COOH
+
O
OH
H
O
H
OH
1,4-дигидрокси-5,8дигидронафталин
78
79.
Восстановление антрахинонаO
Zn + HCl
CH3COOH
O
O
антрон
кето-енольная
таутомерия
OH
Электрофильное замещение
O
O
H2SO4, t
O
SO3H
NaOH, O2
O
OH
плав.
O
O
нуклеофильное
замещение SO3H
OH
O
ализарин
(краситель)
79




























































 chemistry
chemistry