Similar presentations:
Карбонильные соединения
1.
КАРБОНИЛЬНЫЕСОЕДИНЕНИЯ
2.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯК этому классу относятся соединения, в состав
которых входит карбонильная группа
C O ,
Если карбонильный атом углерода связан одним
или двумя атомами водорода, такие соединения
называют альдегидами
O
R
C
H
с двумя углеводородными радикалами – кетонами
O
R
C
O
R 1, Ar
C
R
3.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯИзомерия и номенклатура
Для альдегидов характерна изомерия углеродного скелета, начинается
с С4. Для кетонов – изомерия положения и изомерия углеродного
скелета начинается с С5
Для альдегидов используют 3 вида номенклатуры:
1.Тривиальные названия альдегидов образованы из названий
соответствующих карбоновых кислот, в которые они превращаются при
окислении или они могут иметь свои исторически сложившиеся
названия. Например, пропионоый альдегид, масляный альдегид.
2. По рациональной номенклатуре альдегиды рассматривают как
производные уксусного альдегида, в котором атомы водорода
замещены на углеводородные радикалы. Например, метилуксусный
альдегид, метилэтилуксусный альдегид.
3. Заместительная номенклатура IUPAC. Выбрав за основу самую
длинную цепь углеродных атомов, включающую альдегидную группу,
прибавляют к ее названию суффикс -аль.
4.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯИзомерия и номенклатура
Для кетонов также используют 3 вида номенклатуры:
1.Тривиальные названия
2. Радикально-функциональной номенклатуре кетоны называют по
названию класса – кетон, перед названием перечисляют
углеводородные радикалы в порядке старшинства.
3. Заместительная номенклатура IUPAC. Выбрав за основу самую
длинную цепь углеродных атомов, включающую кетонную группу,
прибавляют к ее названию суффикс –он, с указанием положения
карбонильной группы
5.
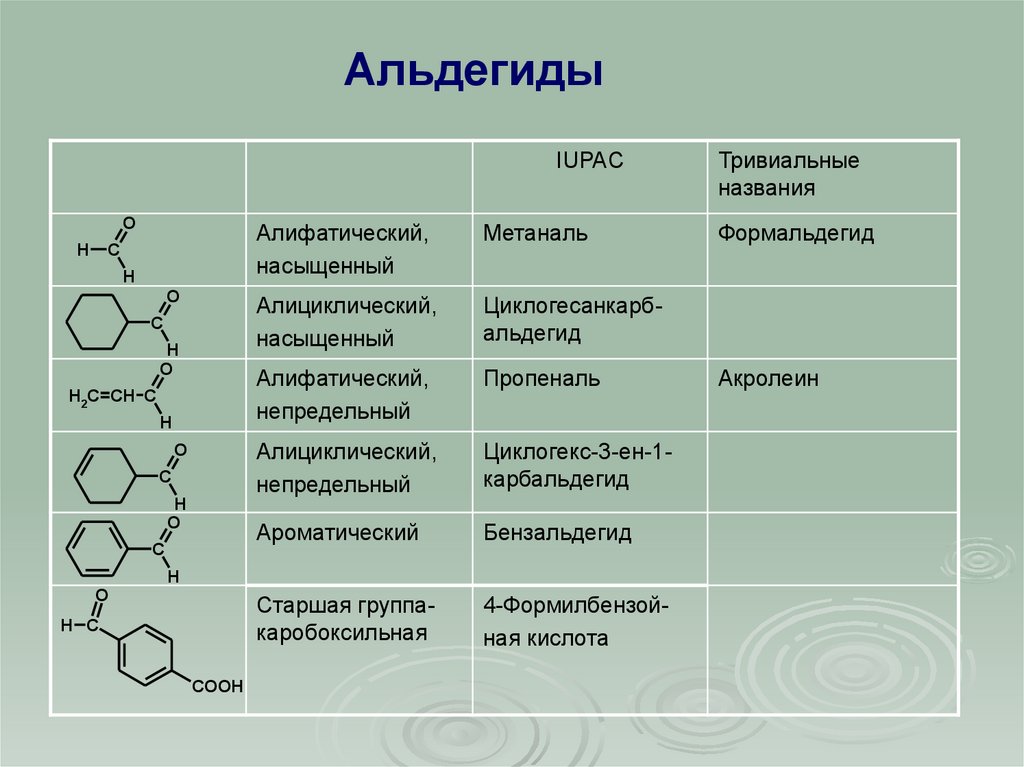
АльдегидыIUPAC
O
H
C
H
O
C
H
O
H2C CH C
H
O
C
H
O
C
O
Алифатический,
насыщенный
Метаналь
Алициклический,
насыщенный
Циклогесанкарбальдегид
Алифатический,
непредельный
Пропеналь
Алициклический,
непредельный
Циклогекс-3-ен-1карбальдегид
Ароматический
Бензальдегид
Старшая группакаробоксильная
4-Формилбензойная кислота
H
H C
COOH
Тривиальные
названия
Формальдегид
Акролеин
6.
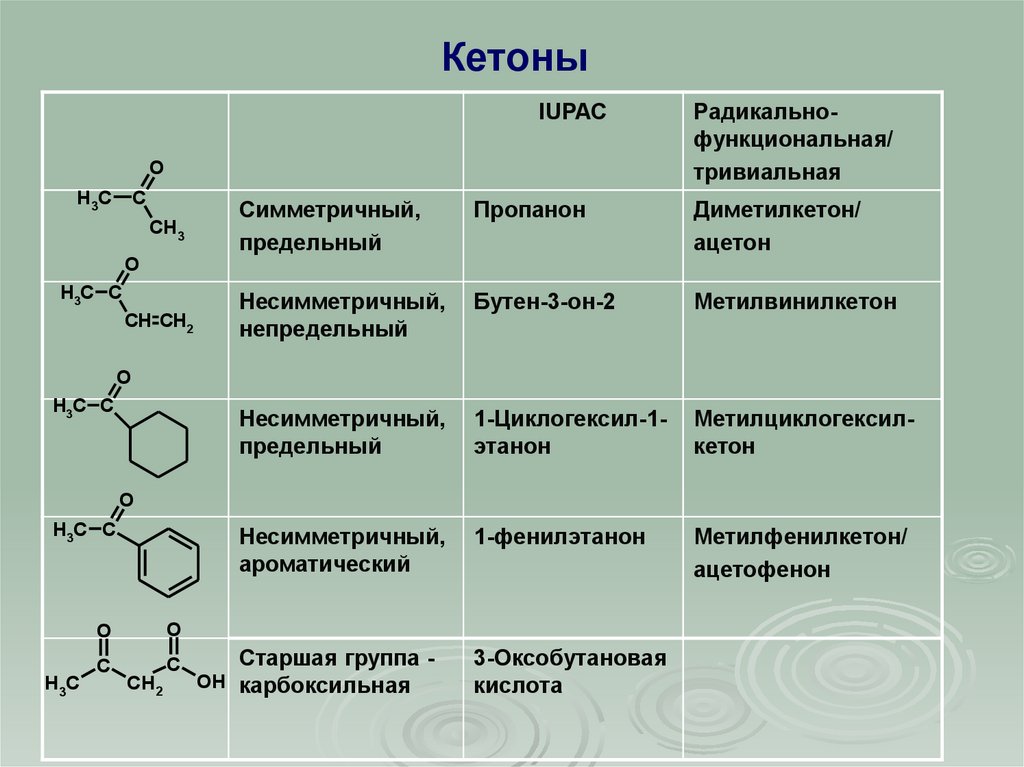
КетоныIUPAC
O
H3C
C
CH3
O
H3C C
CH CH2
Радикальнофункциональная/
тривиальная
Симметричный,
предельный
Пропанон
Диметилкетон/
ацетон
Несимметричный,
непредельный
Бутен-3-он-2
Метилвинилкетон
Несимметричный,
предельный
1-Циклогексил-1этанон
Метилциклогексилкетон
Несимметричный,
ароматический
1-фенилэтанон
Метилфенилкетон/
ацетофенон
O
H3C C
O
H3C C
H3C
O
O
C
C
CH2
Старшая группа OH карбоксильная
3-Оксобутановая
кислота
7.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСпособы получения
1. Окисление и дегидрирование первичных и вторичных спиртов
R
CH 2OH
Первичный
спирт
[O]
O
R
C
H
Альдегид
R
CH
R1
OH
Вторичный
спирт
[O]
O
R
C
R1
Кетон
В качестве окислителей чаще всего используют K2Cr2O7. Окисление
вторичных спиртов не сопряжено с осложнениями. Окисление
первичных спиртов требует осторожности, поскольку образующийся на
первой стадии альдегид способен к быстрому окислению до карбоновой
кислоты. В этом случае одновременно с окислением ведут отгонку
легкокипящих альдегидов
8.
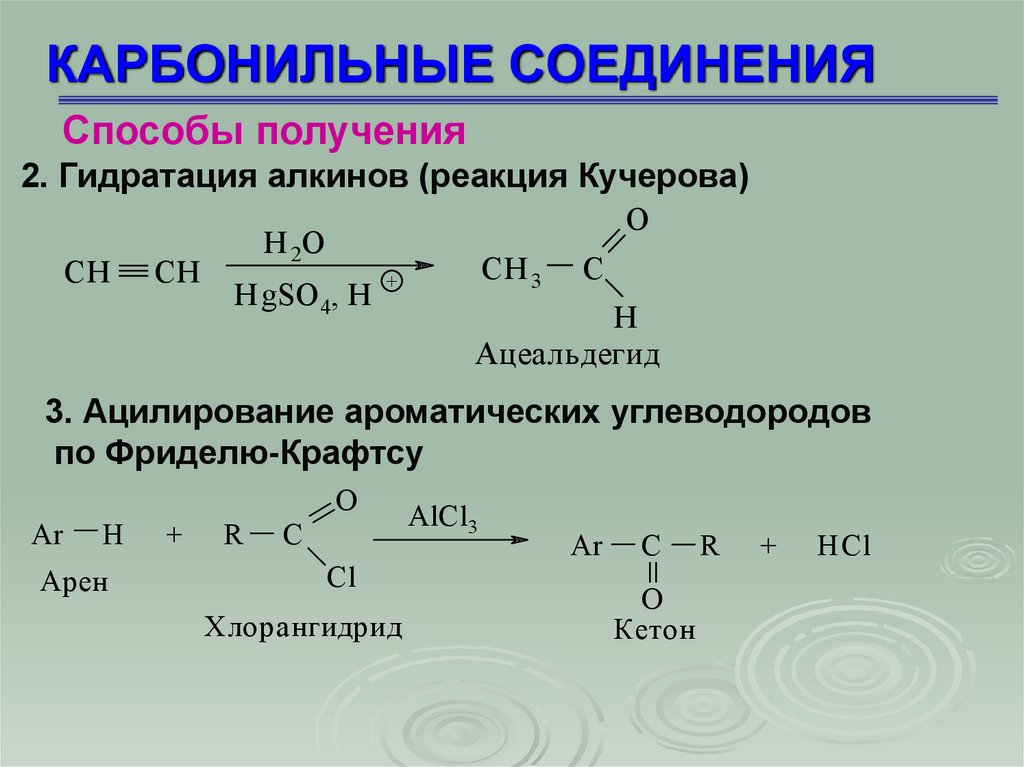
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСпособы получения
2. Гидратация алкинов (реакция Кучерова)
СН
СН
O
Н 2О
HgSO 4, H
CH 3
+
C
H
Ацеальдегид
3. Ацилирование ароматических углеводородов
по Фриделю-Крафтсу
O
Ar
H
Арен
+
R
C
Cl
Хлорангидрид
AlCl3
Ar
C
O
Кетон
R
+
HCl
9.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСпособы получения
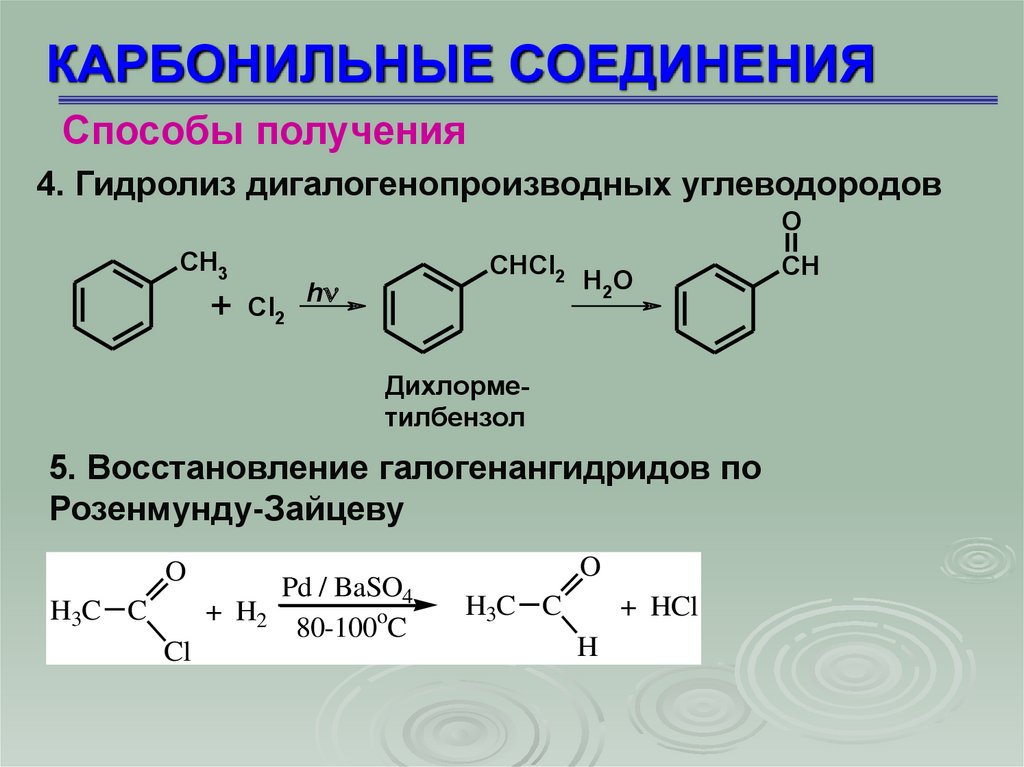
4. Гидролиз дигалогенопроизводных углеводородов
O
CH3
+
Cl2
CHCl2
h
H 2O
Дихлорметилбензол
5. Восстановление галогенангидридов по
Розенмунду-Зайцеву
O
H3C C
Cl
Pd / BaSO4
+ H2
80-100oC
O
H3C C
+ HCl
H
CH
10.
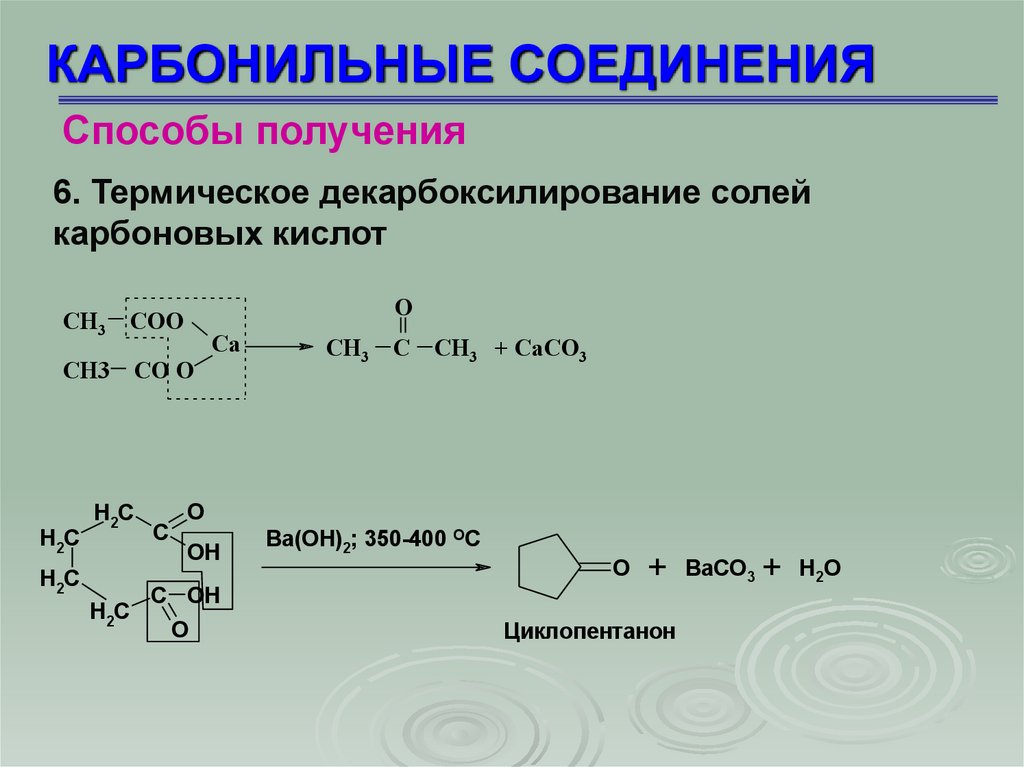
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСпособы получения
6. Термическое декарбоксилирование солей
карбоновых кислот
O
СН3 СОО
Са
СН3 СО О
H2C
H2C
H2C
H2C
C
СН3 С СН3 + СаСО3
O
OH
C OH
O
Ba(OH)2; 350-400 OC
O
+
Циклопентанон
BaCO3
+
H2O
11.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСпособы получения
6. Термическое декарбоксилирование солей
карбоновых кислот
Для получения альдегидов и кетонов используют пиролиз
кислот в виде паров над оксидами некоторых металлов (ThO2,
MnO, CaO, ZnO) при температуре 400-450 oC
O
R
C
OH
R
C
OH
O
O
Соединения Mn, Th
R
C
R + H 2O + CO 2
12.
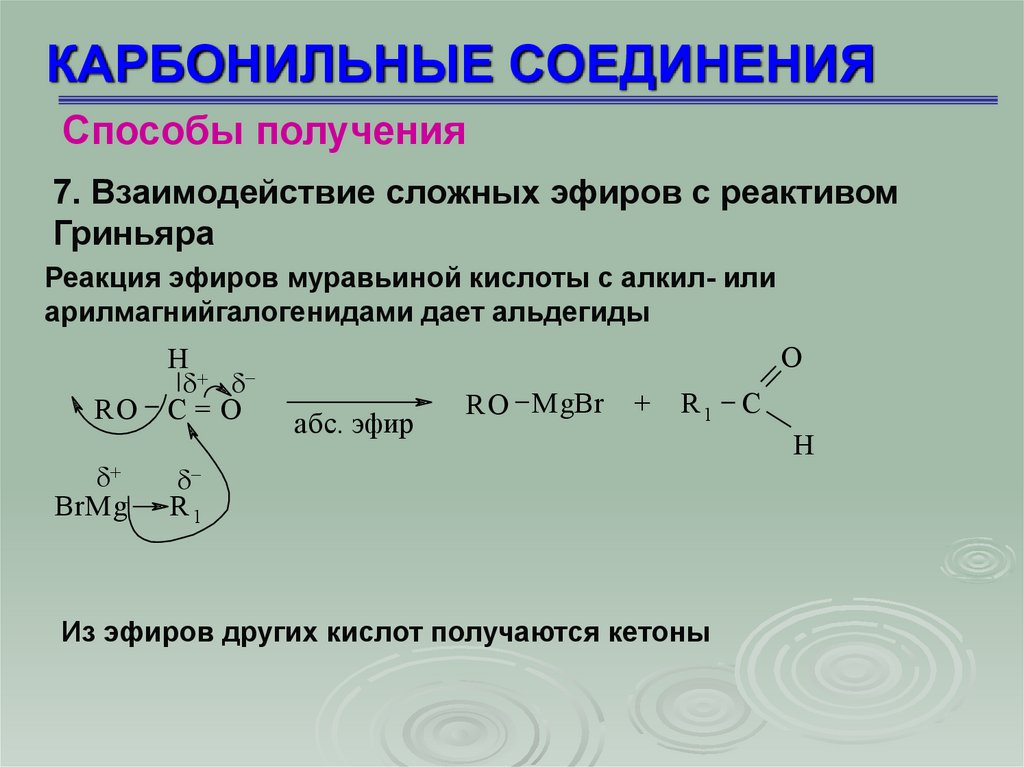
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСпособы получения
7. Взаимодействие сложных эфиров с реактивом
Гриньяра
Реакция эфиров муравьиной кислоты с алкил- или
арилмагнийгалогенидами дает альдегиды
RO
BrMg
H
C=O
O
абс. эфир
RO MgBr
+
R1 C
R1
Из эфиров других кислот получаются кетоны
H
13.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСпособы получения
7. Взаимодействие сложных эфиров с реактивом
Гриньяра
Синильная кислота или нитрилы при взаимодействии с
реактивом Гриньяра также дают альдегиды или соответственно –
кетоны
R C
BrMg
N
R1
где R= H, Alk, Ar
абс. эфир
R С=N
H2O, H+
R1 MgBr
R C
R1
+
+
O + MgBr + NH3 ,
14.
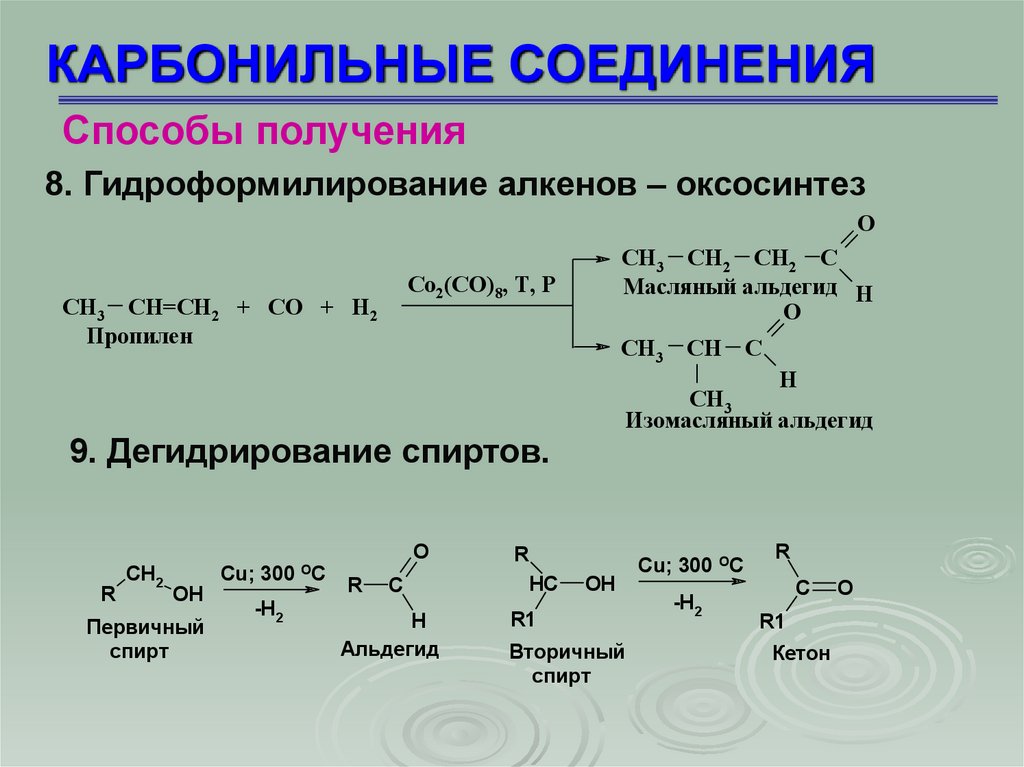
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСпособы получения
8. Гидроформилирование алкенов – оксосинтез
O
СН3 СН2 СН2 С
Масляный альдегид Н
O
Со2(СО)8, Т, Р
СН3 СН=СН2 + СО + Н2
Пропилен
СН3
Н
СН3
Изомасляный альдегид
9. Дегидрирование спиртов.
R
CH2
OH
Первичный
спирт
Cu; 300 OC
-H2
O
R
C
H
Альдегид
R
HC
СН С
OH
R1
Вторичный
спирт
Cu; 300 OC
-H2
R
C
R1
Кетон
O
15.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСпособы получения
10. Окисление алкенов
Дизамещенный алкен → два альдегида → две кислоты
Тризамещенный алкен → альдегид и кетон → кислота и кетон
Тетразамещенный алкен → два кетона
+
KMnO4, H
CH3 C CH CH3 нагревание
H3C C O
O C CH3
CH3
CH3
OH
Ацетон
Уксусная кислота
+
CH3 CH CH CH2
CH3
+
KMnO4, H
O
CH3 CH C + CO2 + H2 O
OH
CH3
изомасляная кислота
16.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСпособы получения
10. Окисление алкенов
Вакер-процесс: каталитическое окисление этена в ацетальдегида.
Основной промышленный способ получения ацетальдегида.
H2C CH2 + PdCl2 + H2O
Pd + 2 CuCl2
2 Cu2Cl2 + O2
CuCl2
PdCl2
+ 4 HCl
+
O
+ Pd + 2 HCl
H3C C
Cu2Cl2
H
2 CuCl2 + 2 H2O
17.
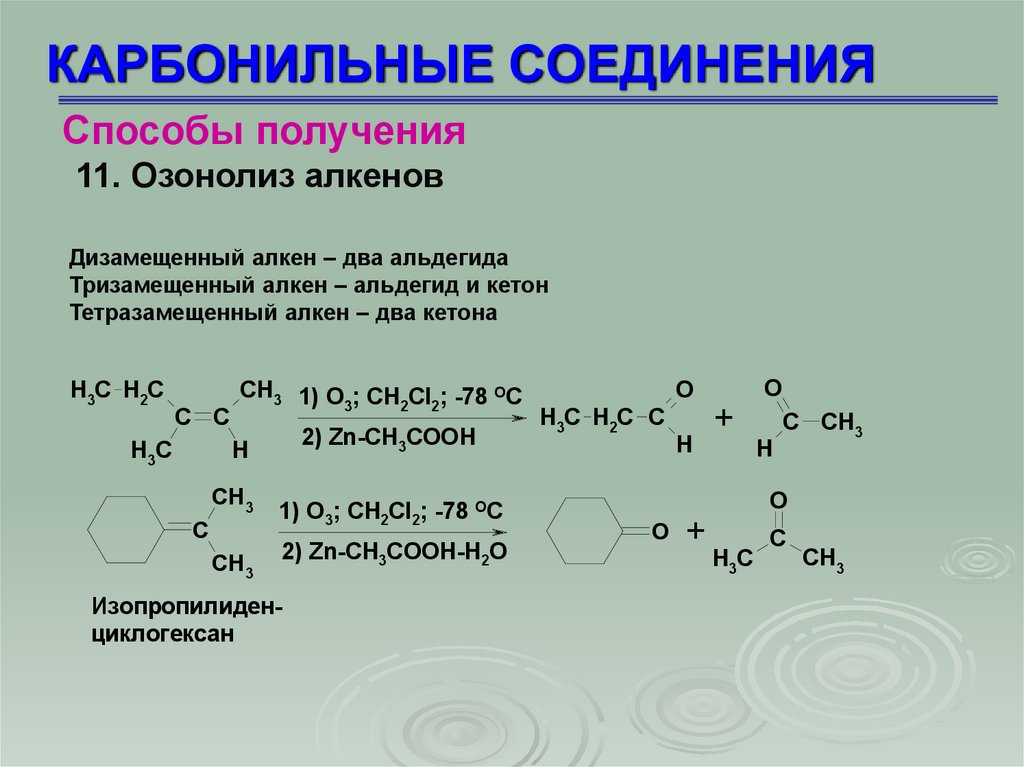
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСпособы получения
11. Озонолиз алкенов
Дизамещенный алкен – два альдегида
Тризамещенный алкен – альдегид и кетон
Тетразамещенный алкен – два кетона
H3C H2C
C C
H3C
CH3 1) O ; CH Cl ; -78 OC
3
2 2
2) Zn-CH3COOH
H
CH3
C
CH3
1) O3; CH2Cl2; -78 OC
2) Zn-CH3COOH-H2O
Изопропилиденциклогексан
O
O
H3C H2C C
H
+
H
C CH3
O
O
+
H3C
C
CH3
18.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯФизические свойства альдегидов и кетонов
Формальдегид – газ с резким запахом, растворим в воде. Водный раствор
формальдегида называют формалином. Другие низшие альдегиды и кетоны
– жидкости, легко растворимые в воде. Растворимость резко уменьшается с
увеличением углеводородного радикала до пяти атомов углерода в молекуле
и более. Низшие альдегиды имеют резкий неприятный запах, который при
сильном разведении становится приятным (напоминает запах плодов).
Высшие гомологи имеют запах цветов и фруктов. Кетоны также обладают
сильным запахом.
Плотность альдегидов и кетонов меньше единицы.
При одном и том же составе и строении углеродной цепи кетоны кипят при
несколько более высоких температурах, чем альдегиды. Температуры
кипения альдегидов и кетонов с нормальным строением углеродной цепи
выше, чем соединений изостроения. Альдегиды и кетоны кипят при гораздо
более низкой температуре, чем спирты того же состава. Это свидетельствует
о слабой диссоциации между молекулами и отсутствии межмолекулярных
водородных связей. В то же время температуры кипения карбонильных
соединений значительно выше температур кипения углеводородов с той же
молекулярной массой, что связано с их высокой полярностью
19.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСтроение карбонильной группы
Атом углерода карбонильной группы находится в cостоянии sp2гибридизации. Его конфигурация плоская: валентные углы между тремя
-связями близки к 120 . -Связь образуется за счет перекрывания рz АО
углерода и рz АО кислорода в плоскости, перпендикулярной плоскости связей
+
C О
На ру АО кислорода находится неподеленная пара электронов (основной
центр).
20.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСтроение карбонильной группы
По электронному строению -связь карбонильной группы имеет аналогию с
двойной связью алкенов, однако электронная плотность более компактна и
поляризована (смещена в сторону более электроотрицательного атома
кислорода).
C
О
l=0,121 нм
E=710 кДж/моль
21.
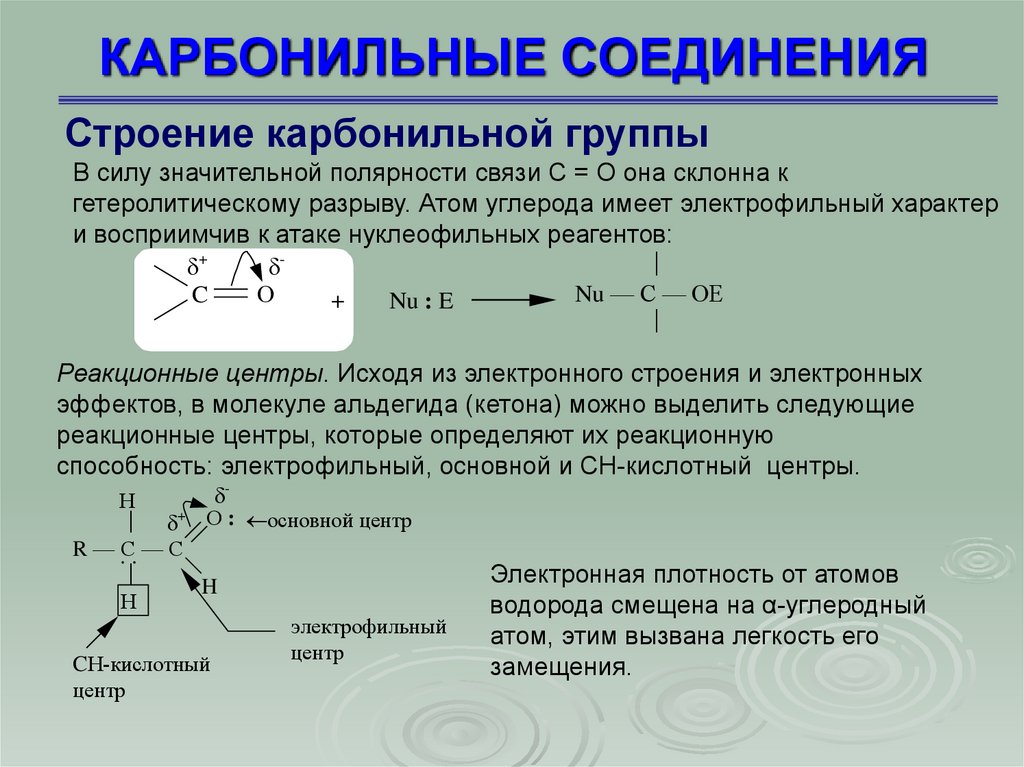
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯСтроение карбонильной группы
В силу значительной полярности связи C = О она склонна к
гетеролитическому разрыву. Атом углерода имеет электрофильный характер
и восприимчив к атаке нуклеофильных реагентов:
+
C
О
+
Nu : E
Nu — С — ОЕ
Реакционные центры. Исходя из электронного строения и электронных
эффектов, в молекуле альдегида (кетона) можно выделить следующие
реакционные центры, которые определяют их реакционную
способность: электрофильный, основной и СН-кислотный центры.
Н
+ О : основной центр
R — .С. — C
H
Н
электрофильный
центр
CН-кислотный
центр
Электронная плотность от атомов
водорода смещена на α-углеродный
атом, этим вызвана легкость его
замещения.
22.
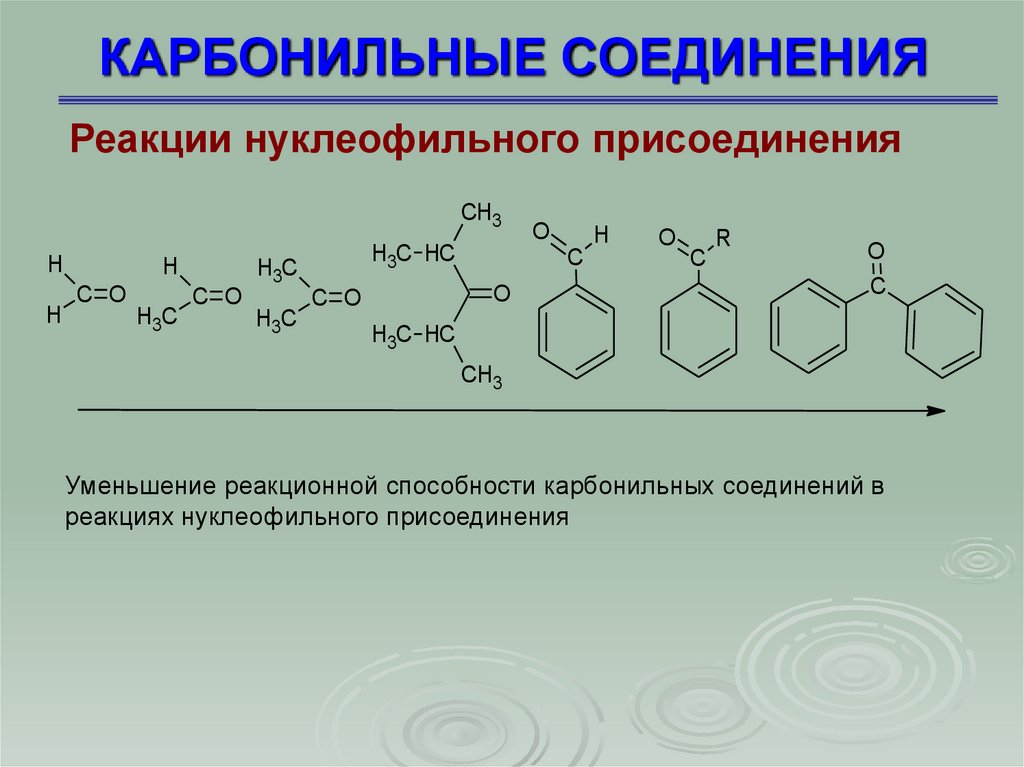
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯРеакции нуклеофильного присоединения
Реакционная способность карбонильных соединений в реакциях
нуклеофильного присоединения определяется
пространственными и электронными факторами. Чем больше
частичный положительный заряд на атоме углерода, тем активнее
карбонильное соединение. Поэтому реакционная способность
будет понижаться с увеличением числа заместителей с
положительным индуктивным и мезомерным эффектом.
Объемные заместители, расположенные у карбонильного атома
углерода, будут препятствовать атаке нуклеофилом,
следовательно реакционная способность также уменьшается
23.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯРеакции нуклеофильного присоединения
CH3
H
H
H
C O
H3C
H3C HC
H3C
C O
H3C
O
C O
O
С
H
O
С
R
O
C
H3C HC
CH3
Уменьшение реакционной способности карбонильных соединений в
реакциях нуклеофильного присоединения
24.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение О-нуклеофилов
1. Гидратация
Многие карбонильные соединения подвергаются в водном
растворе обратимой гидратации
R
C O
R1
+ H2O
OH
R
C
R1
OH
Продуктами гидратации альдегидов и кетонов являются
неустойчивые геминальные диолы
25.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение О-нуклеофилов
1. Гидратация
Гидратация может протекать в условиях как общего кислотного,
так и основного катализа, т.е. скорость лимитирующая стадия
включает или протонирование карбонильного соединения
(кислотный катализ), или превращение Н2О в более сильный
нуклеофил –ОН
26.
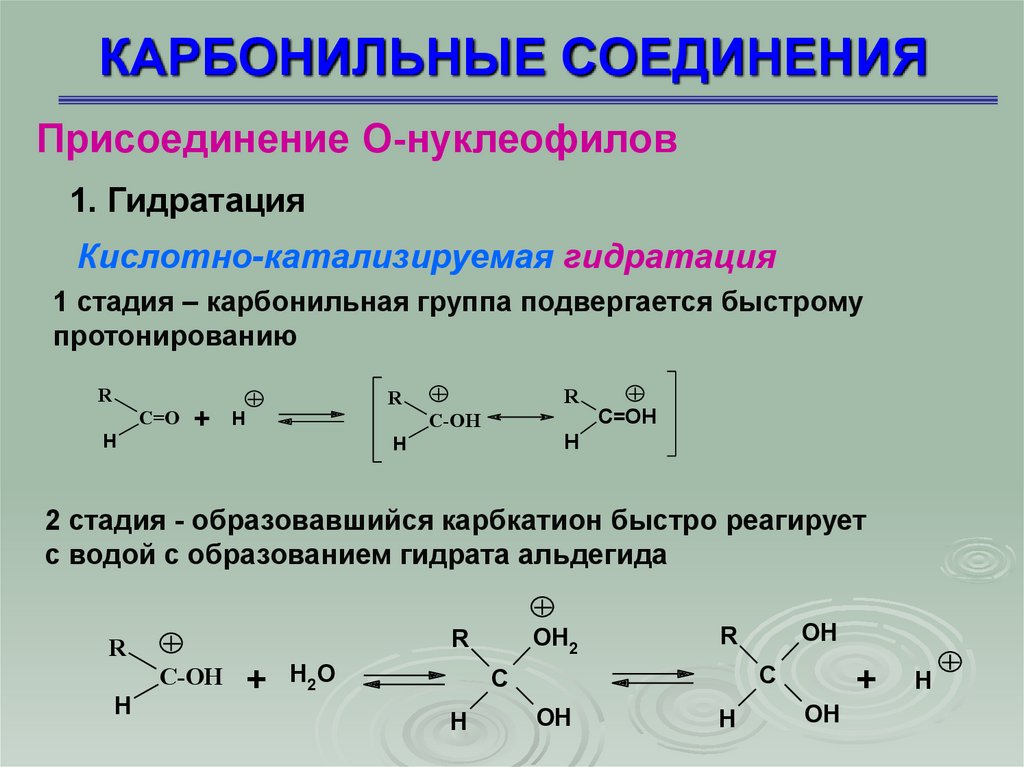
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение О-нуклеофилов
1. Гидратация
Кислотно-катализируемая гидратация
1 стадия – карбонильная группа подвергается быстрому
протонированию
R
C=O
H
+
R
R
C=OH
C-OH
H
H
H
2 стадия - образовавшийся карбкатион быстро реагирует
с водой с образованием гидрата альдегида
C-OH
H
OH2
R
R
+
H2O
+
C
C
H
OH
R
OH
H
OH
H
27.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение О-нуклеофилов
1. Гидратация
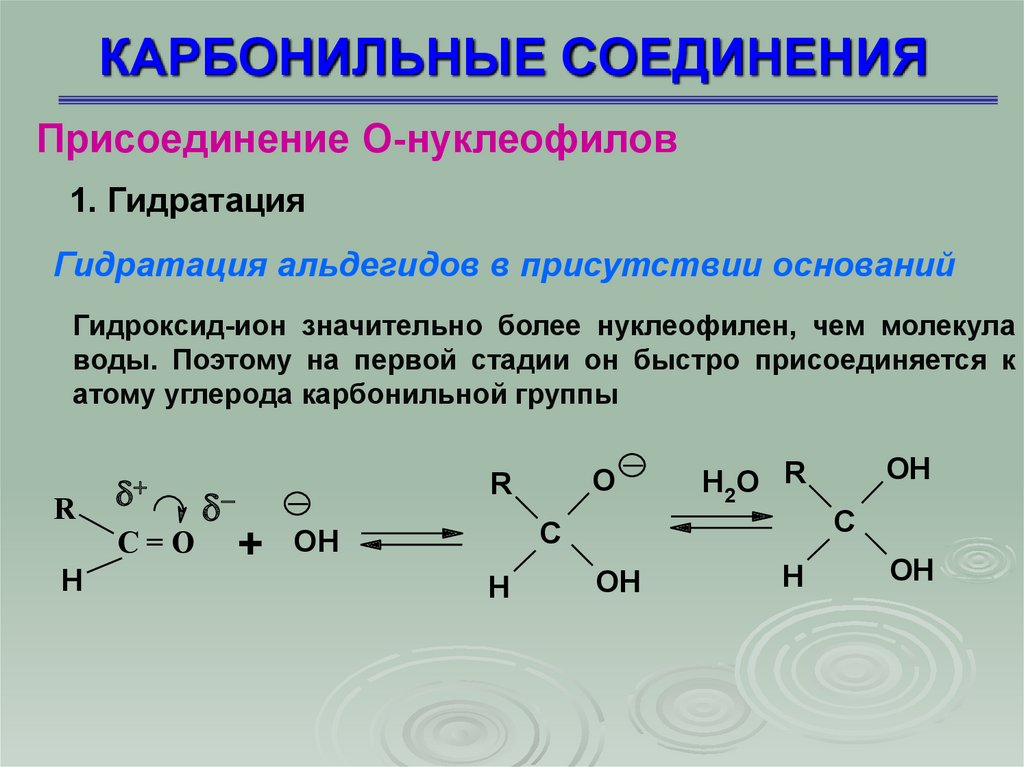
Гидратация альдегидов в присутствии оснований
Гидроксид-ион значительно более нуклеофилен, чем молекула
воды. Поэтому на первой стадии он быстро присоединяется к
атому углерода карбонильной группы
R
C=O
H
O
R
+
C
C
OH
H
OH
H2O R
OH
H
OH
28.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение О-нуклеофилов
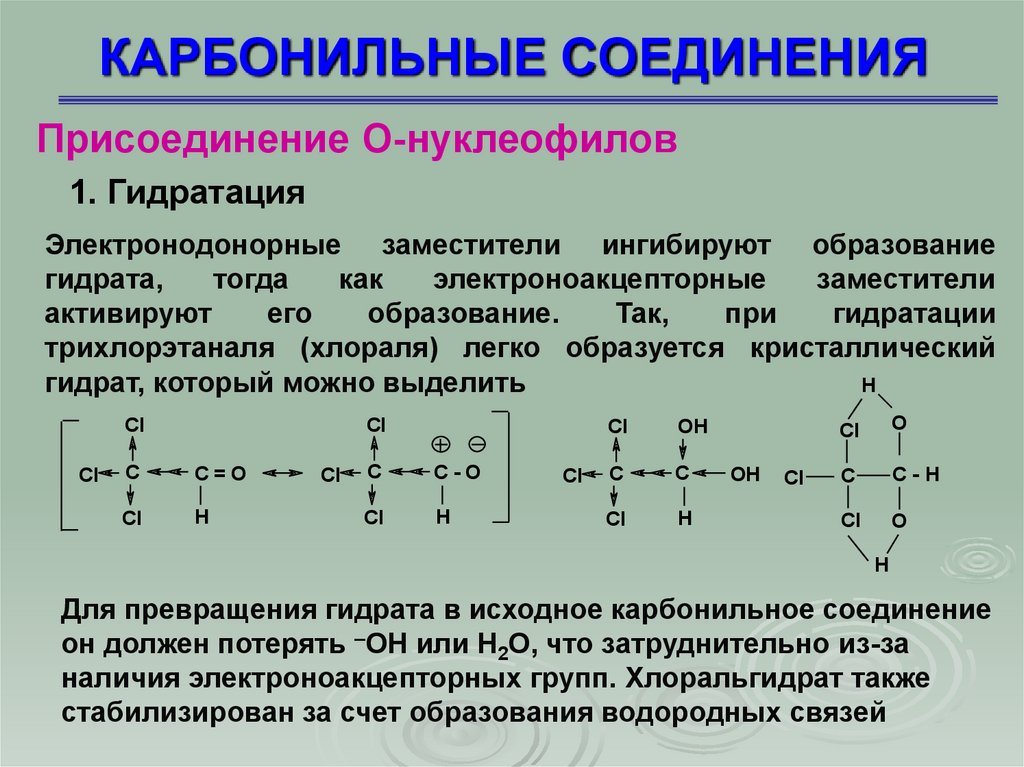
1. Гидратация
Электронодонорные заместители ингибируют образование
гидрата,
тогда
как
электроноакцепторные
заместители
активируют
его
образование.
Так,
при
гидратации
трихлорэтаналя (хлораля) легко образуется кристаллический
гидрат, который можно выделить
H
Cl
Cl
Cl
C
C=O
Cl
H
Cl
C
C-O
Cl
H
Cl
Cl
OH
C
C
Cl
H
OH
Cl
Cl
O
C
C-H
Cl
O
H
Для превращения гидрата в исходное карбонильное соединение
он должен потерять –ОН или Н2О, что затруднительно из-за
наличия электроноакцепторных групп. Хлоральгидрат также
стабилизирован за счет образования водородных связей
29.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение О-нуклеофилов
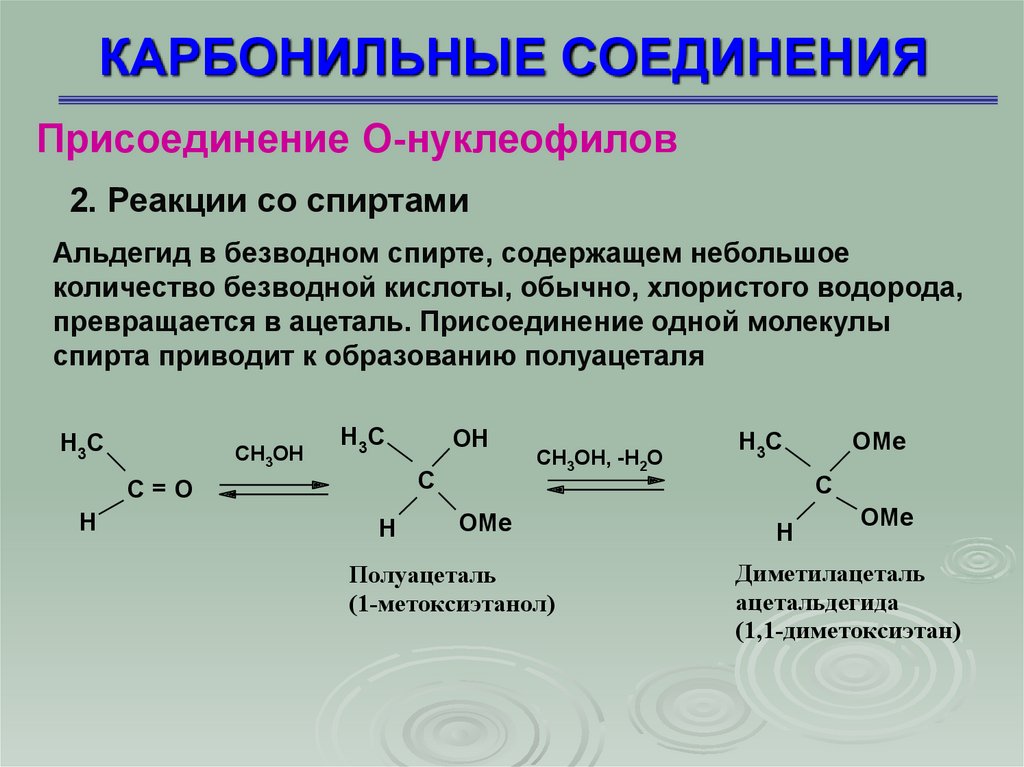
2. Реакции со спиртами
Альдегид в безводном спирте, содержащем небольшое
количество безводной кислоты, обычно, хлористого водорода,
превращается в ацеталь. Присоединение одной молекулы
спирта приводит к образованию полуацеталя
H3C
CH3OH
H3C
C
C=O
H
OH
H
CH3OH, -H2O
H3C
OMe
C
OMe
Полуацеталь
(1-метоксиэтанол)
H
OMe
Диметилацеталь
ацетальдегида
(1,1-диметоксиэтан)
30.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение О-нуклеофилов
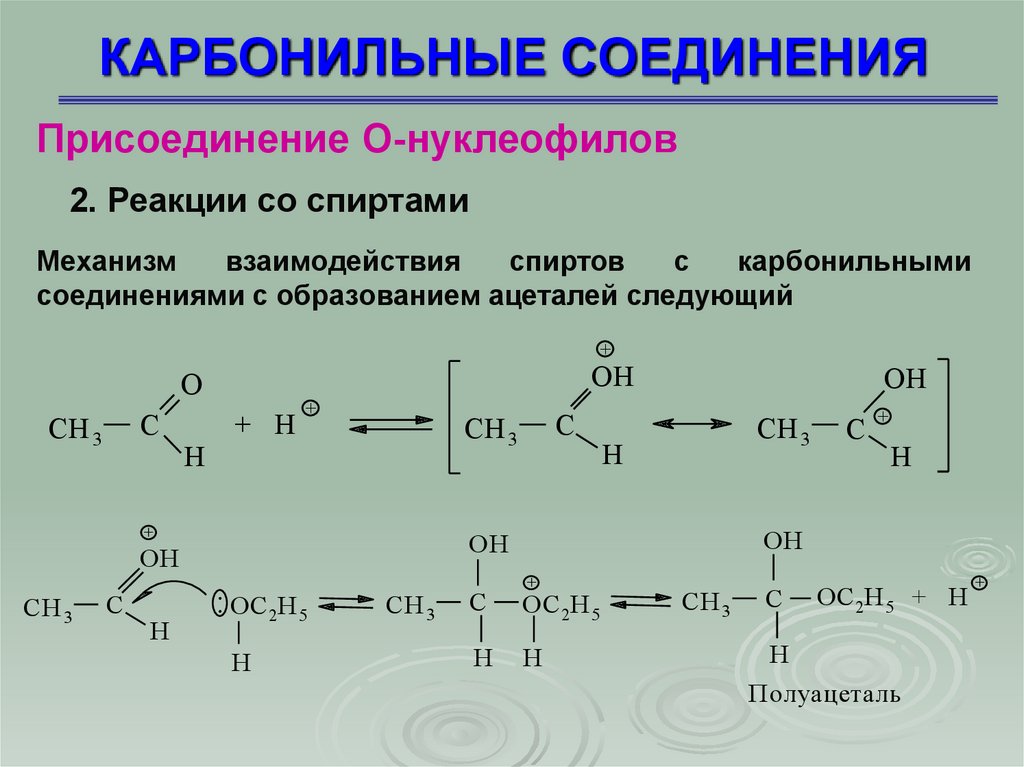
2. Реакции со спиртами
Механизм
взаимодействия
спиртов
с
карбонильными
соединениями с образованием ацеталей следующий
+
OH
O
C
СH 3
+ H
+
H
+
C
H
СH 3
H
: OC 2H 5
H
СH 3
C
+
H
OH
OH
OH
СH 3
C
СH 3
OH
+
C
OC 2H 5
H
H
СH 3
C
OC 2H 5 + H
H
Полуацеталь
+
31.
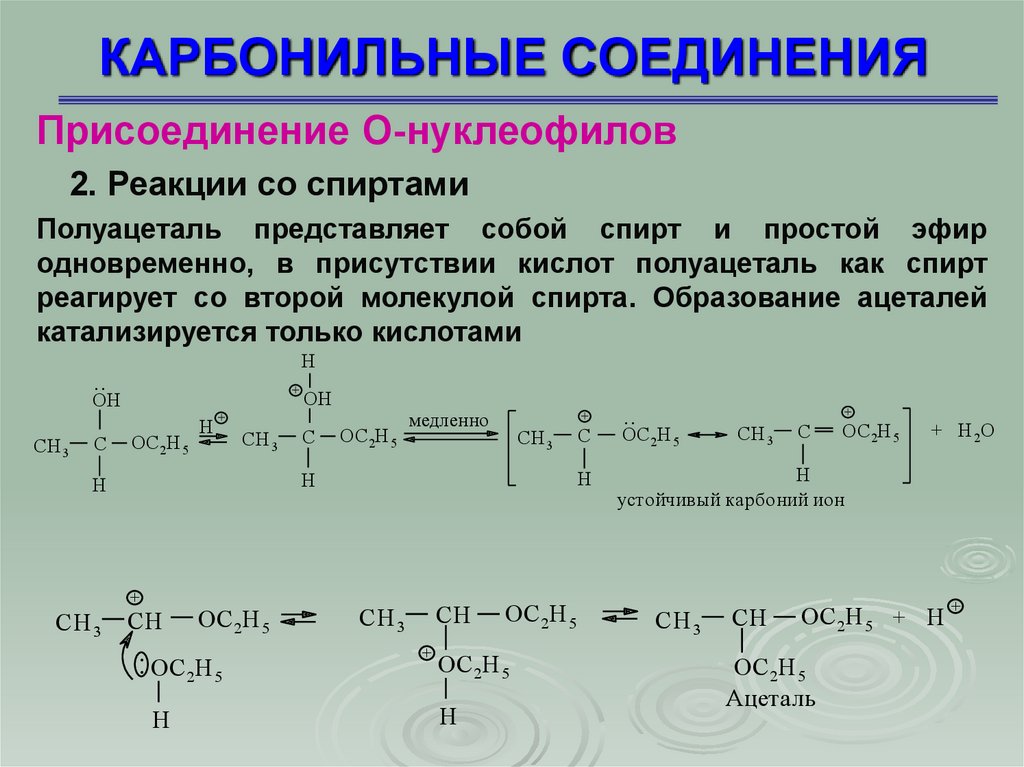
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение О-нуклеофилов
2. Реакции со спиртами
Полуацеталь представляет собой спирт и простой эфир
одновременно, в присутствии кислот полуацеталь как спирт
реагирует со второй молекулой спирта. Образование ацеталей
катализируется только кислотами
H
..
+
OH
СH 3
C
OC 2H 5
H
СH 3
C
OC 2H 5
+
медленно
СH 3
H
H
+
СH 3
OH
+
CН
OC 2H 5
: OC 2H 5
H
CН
СH 3
+
OC 2H 5
OC 2H 5
H
..
+
СH 3
C
OC 2H 5
C
OC 2H 5
H
H
устойчивый карбоний ион
СH 3
CН
+ H 2О
OC 2H 5 + H
OC 2H 5
Ацеталь
+
32.
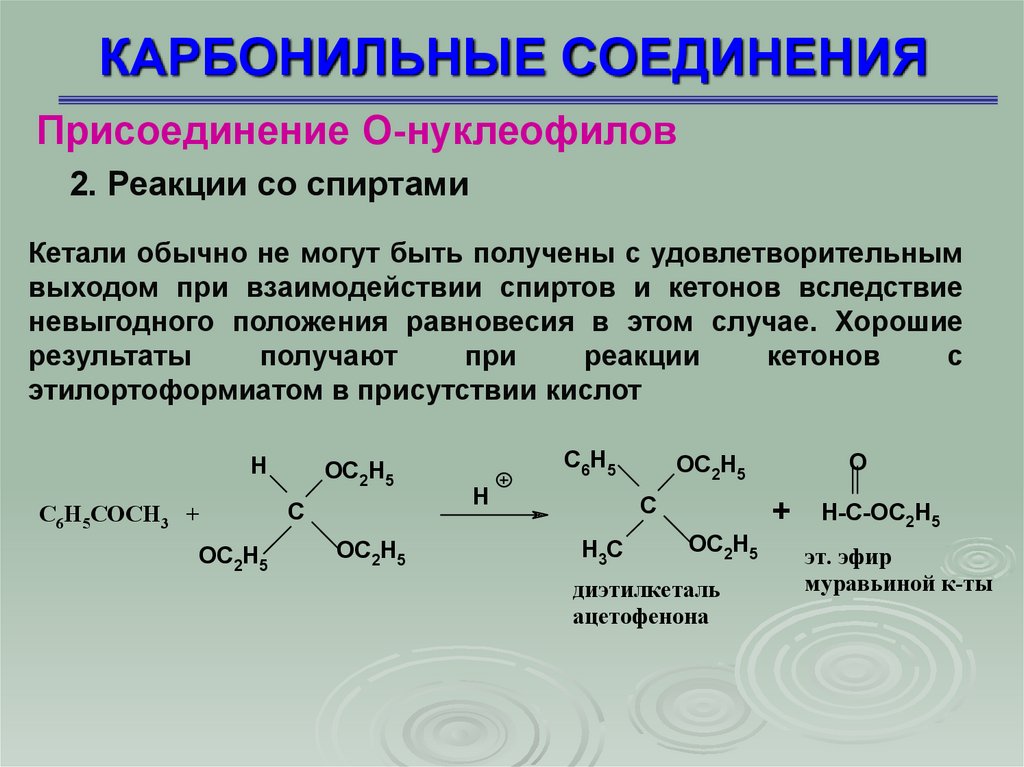
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение О-нуклеофилов
2. Реакции со спиртами
Кетали обычно не могут быть получены с удовлетворительным
выходом при взаимодействии спиртов и кетонов вследствие
невыгодного положения равновесия в этом случае. Хорошие
результаты
получают
при
реакции
кетонов
с
этилортоформиатом в присутствии кислот
H
С6H5COCH3 +
OC2H5
OC2H5
C
OC2H5
C6H5
H
C
H3C
O
OC2H5
+
OC2H5
диэтилкеталь
ацетофенона
H-C-OC2H5
эт. эфир
муравьиной к-ты
33.
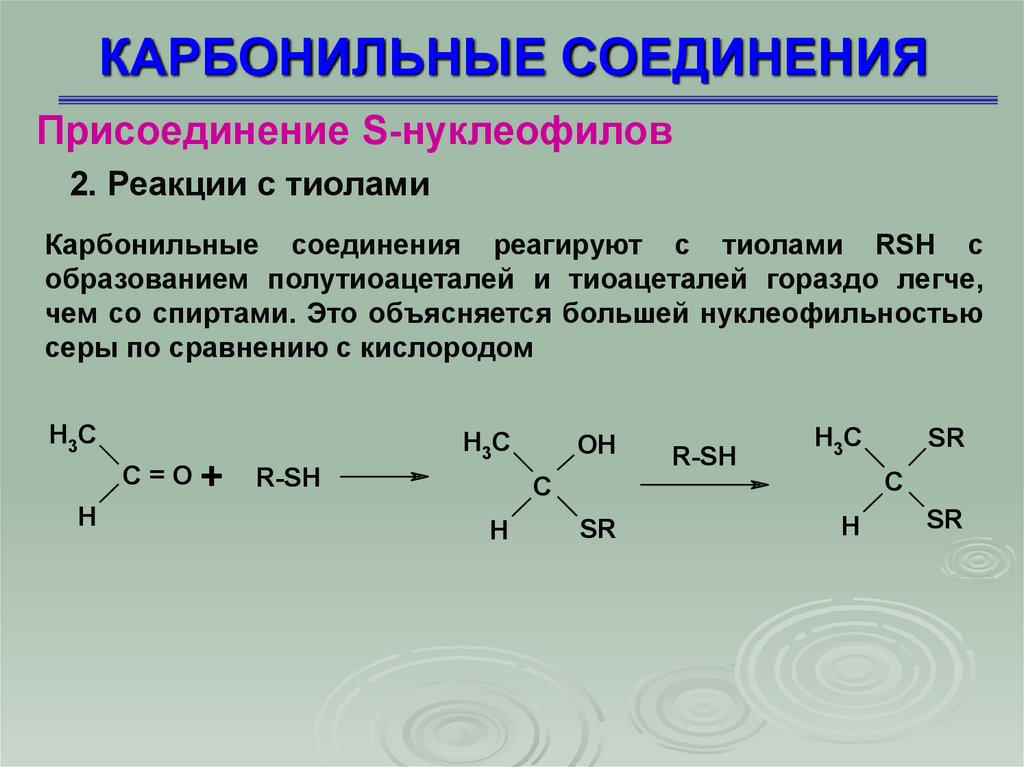
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение S-нуклеофилов
2. Реакции с тиолами
Карбонильные соединения реагируют с тиолами RSH с
образованием полутиоацеталей и тиоацеталей гораздо легче,
чем со спиртами. Это объясняется большей нуклеофильностью
серы по сравнению с кислородом
H3C
C=O+
H
H3C
R-SH
OH
R-SH
H3C
C
C
H
SR
SR
H
SR
34.
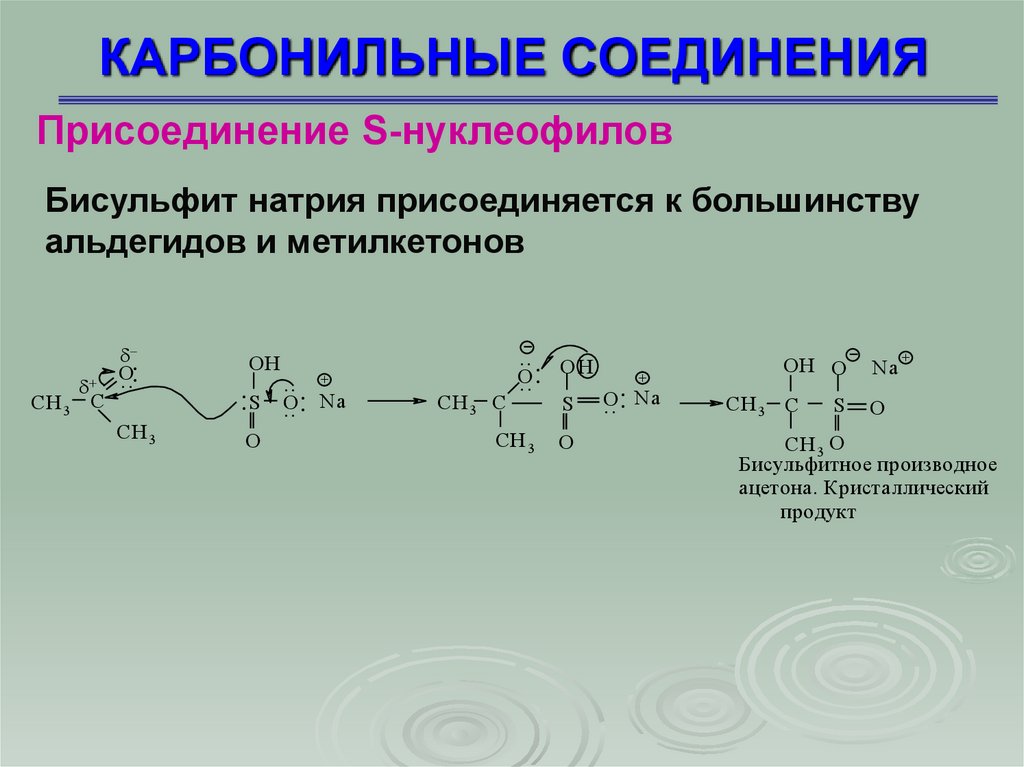
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение S-нуклеофилов
Бисульфит натрия присоединяется к большинству
альдегидов и метилкетонов
CH 3 C
O
..:
CH 3
OН
:S
O
..
O
.. :
+
Na
CH 3 C
..
O
.. :
CH 3
OН
S
O
+
O
.. : Na
OH O
CH 3 C
S
Na
+
O
CH 3 O
Бисульфитное производное
ацетона. Кристаллический
продукт
35.
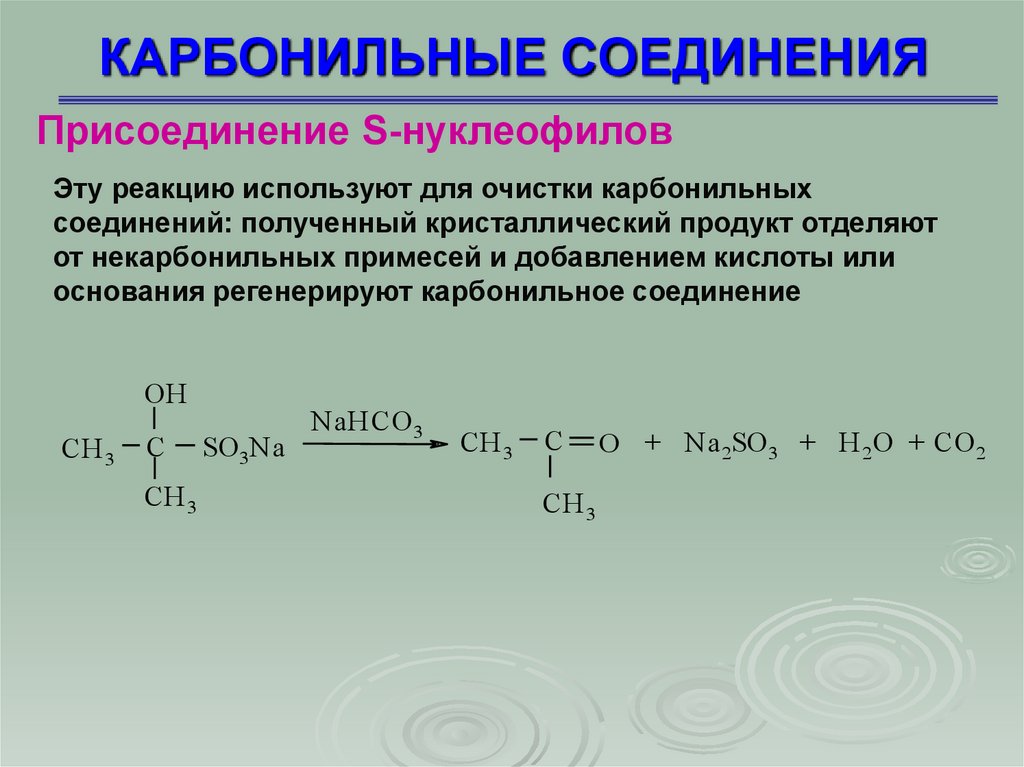
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение S-нуклеофилов
Эту реакцию используют для очистки карбонильных
соединений: полученный кристаллический продукт отделяют
от некарбонильных примесей и добавлением кислоты или
основания регенерируют карбонильное соединение
OH
CH 3
C
CH 3
SО 3Na
NaHCO 3
CH 3
C
CH 3
O + Na 2SO 3 + H 2O + CO 2
36.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение С-нуклеофилов
1. Присоединение синильной кислоты
Цианистый водород присоединяется ко многим альдегидам и
кетонам, образуя циангидрины
OH
O
CH 3 C
H + HCN
CH 3 C
C
N
H
Циангидринацетальдегида,
2-Гидроксипропанонитрил
Это первая органическая реакция, для которой был установлен
механизм (Лэпворт, 1903 г). Особенностью реакции является
необходимость основного катализа. HCN – недостаточно сильный
нуклеофил, чтобы атаковать С = О. Для превращения HCN в более
сильный нуклеофил –СN реакцию проводят в условиях основного
катализа
37.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение С-нуклеофилов
1. Присоединение цианид-иона
Присоединение –CN обратимо и в отсутствие донора протонов
смещается в сторону исходных веществ. В присутствии донора
протонов равновесие смещается вправо, так как равновесие,
включающее циангидрин, более благоприятно, чем равновесие,
включающее промежуточный анион
R
+
C
R1
-
O
CN
O
R
медленно
C
R1
OH
HY
CN
R
быстро
C
CN
+Y
R1
Реакцию проводят, добавляя минеральную кислоту к смеси
карбонильного соединения и цианистого натрия для образования
цианистого водорода, количество добавляемой кислоты должно быть
недостаточно для связывания всех цианид-ионов
38.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение С-нуклеофилов
1. Присоединение синильной кислоты
Эти реакции имеют практическое применение для получения
-оксикислот, цианалкенов и непредельных кислот
OH
CH 3 C
C
N
Н 2О, H
H
-Н 2О
+
OН
CH 3 CН CООН
- Н 2О
Молочная кислота
CH 2 CН C N
Акрилонитрил
CH 2 CН CООН
Акриловая кислота
39.
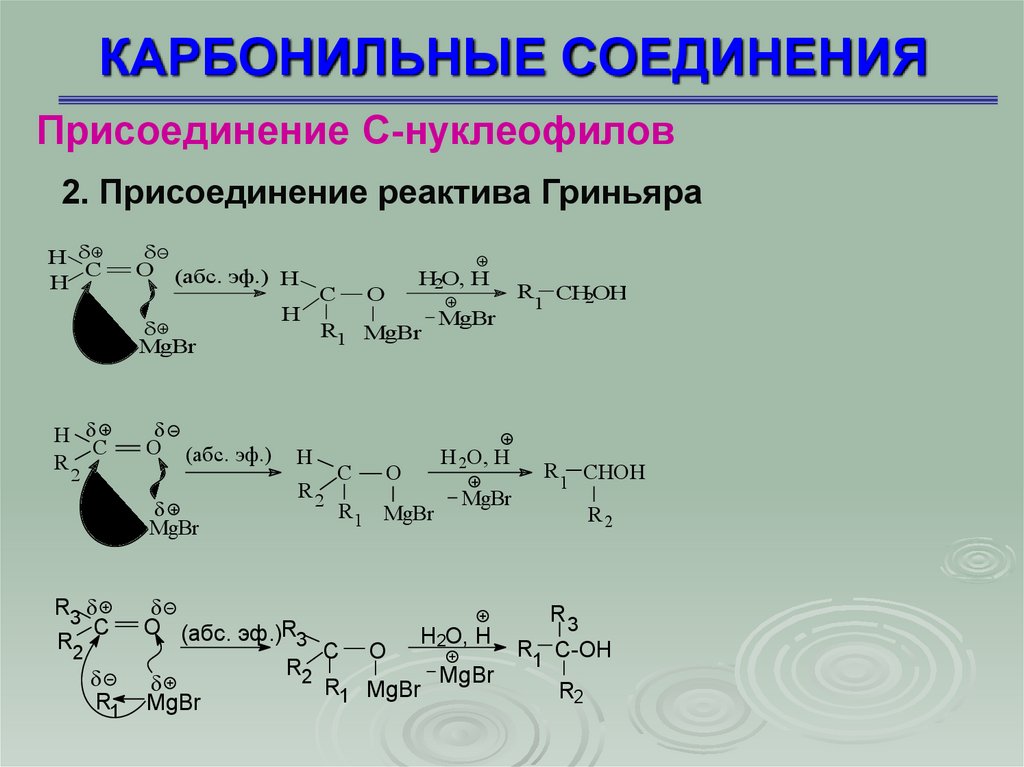
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение С-нуклеофилов
2. Присоединение реактива Гриньяра
H
C
H
R1
H
C
R
2
R1
R3
C
R2
R1
O (абс. эф.) H
MgBr
O (абс. эф.)
MgBr
H
C
H2O, H
O
R1 MgBr
H
R2
C
O
R 1 MgBr
MgBr
H 2O, H
MgBr
O (абс. эф.)R
H2O, H
3
C O
R2
MgBr
R1 MgBr
MgBr
R
1
CH2OH
R
1
CHOH
R2
R3
R1 C-OH
R2
40.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение С-нуклеофилов
3. Присоединение алкинидов
Алкиниды в жидком аммиаке реагируют с альдегидами и кетонами
с образованием алкоксидов, гидролизом которых получают
соответствующие ацетиленовые спирты
R
C=O
H
O Na
R
+
NaC
H
C
C-R'
H
OH
R
C
C C-R'
H2O
H
C C-R'
41.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯНуклеофильное присоединение - отщепление
Известен ряд реакций нуклеофильного присоединения к группе
С = О , в которых присоединяющийся нуклеофил содержит
кислый протон, поэтому становится возможным последующее
отщепление Н2О, т.е. происходит замещение атома кислорода.
Например, с альдегидами и кетонами взаимодействуют
соединения, родственные аммиаку G-NH2. В этом случае
реакция протекает как нуклеофильное присоединение с
последующим отщеплением воды (AdN, E)
42.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯНуклеофильное присоединение - отщепление
Реакция с N-нуклеофилами представляет собой различные
реакции аммиака, первичных и вторичных аминов, гидразина и
его производных, гидроксиламина и семикарбазида
..
Нуклеофил
Амин
H2 N
Продукт взаимодействия
R CH N G
G
H2N - H.. (G = Alk, Ar)
Гидразин
H2 N
..
Фенилгидразин H2 N
N H2
HNС6Н5
Семикарбазид
NH
H2
..
N
..
Гидраксиламин H2 N
CO
OH
H2N-G, H
R2C = O
Азометин (Имин) R-CH = NH (=N-Alk, =N-Ar)
R
CH
N
NH2
Фенилгидразон R
CH
N
NH
Семикарбозон
R
CH
N
NH
Оксим
R
CH
N
OH
Гидразон
N H2
OH
R2C - NH-G
- H2O
C6H5
CO
R2C = N-G
NH2
43.
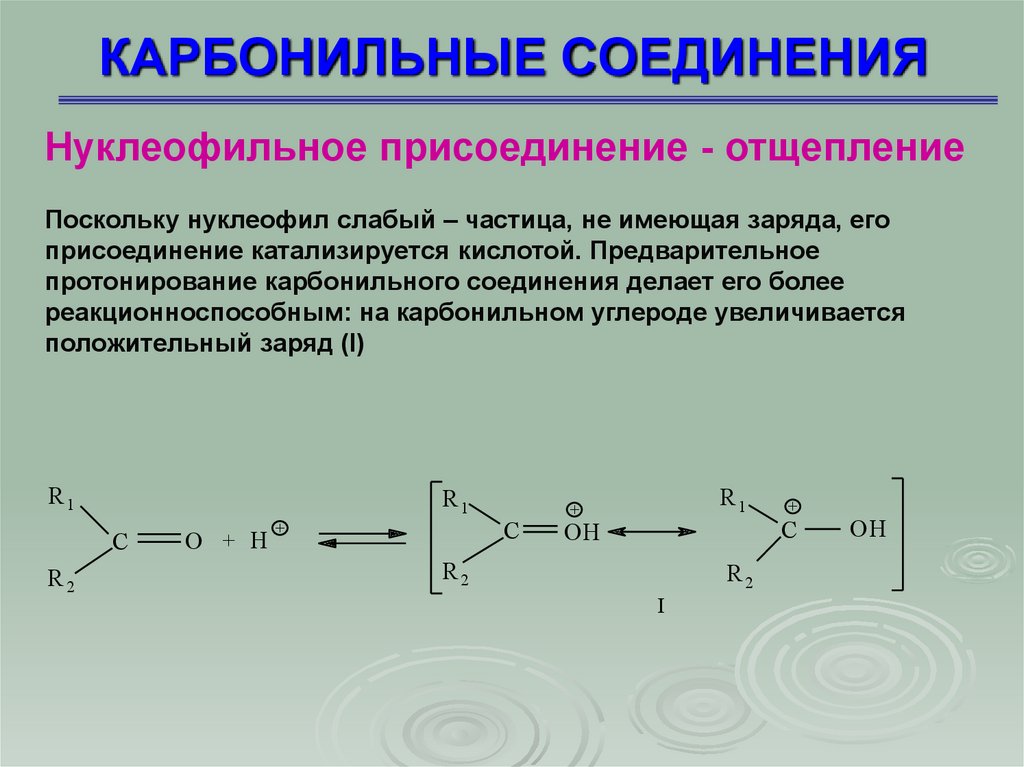
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯНуклеофильное присоединение - отщепление
Поскольку нуклеофил слабый – частица, не имеющая заряда, его
присоединение катализируется кислотой. Предварительное
протонирование карбонильного соединения делает его более
реакционноспособным: на карбонильном углероде увеличивается
положительный заряд (I)
R1
R1
C
R2
O + H
C
+
R1
+
+
C
OH
R2
R2
I
OH
44.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯНуклеофильное присоединение - отщепление
R
2
+
OH
OH
C
R
1
+
NH 2R
R
2
OH
+
C
NH2 G
1
R II
-H
+
R
2
C
R
NH
1
III
G
-H 2O
R
2
C
R
N
1
На второй стадии электрофильный атом углерода, несущий положительный
заряд, подвергается нуклеофильной атаке НЭП атома азота. Далее
образующийся ион II отщепляет протон, образуя нейтральную молекулу –
нестабильный гем-аминоспирт III, который отщепляет молекулу воды.
Наличие стадий присоединения и отщепления воды определило название
приведенного механизма – присоединение-отщепление.
G
45.
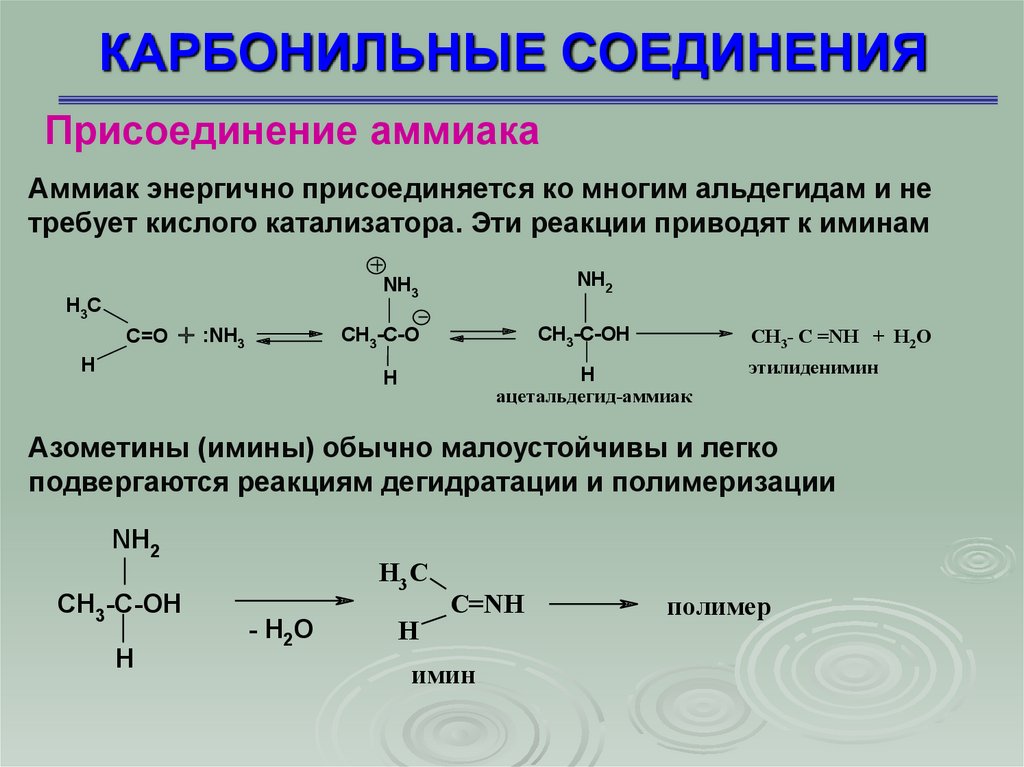
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение аммиака
Аммиак энергично присоединяется ко многим альдегидам и не
требует кислого катализатора. Эти реакции приводят к иминам
NH2
NH3
H3C
C=O
:NH3
H
CH3- C =NH + H2O
CH3-C-OH
CH3-C-O
H
ацетальдегид-аммиак
H
этилиденимин
Азометины (имины) обычно малоустойчивы и легко
подвергаются реакциям дегидратации и полимеризации
NH2
CH3-C-OH
H
H3 C
- H2O
H
C=NH
имин
полимер
46.
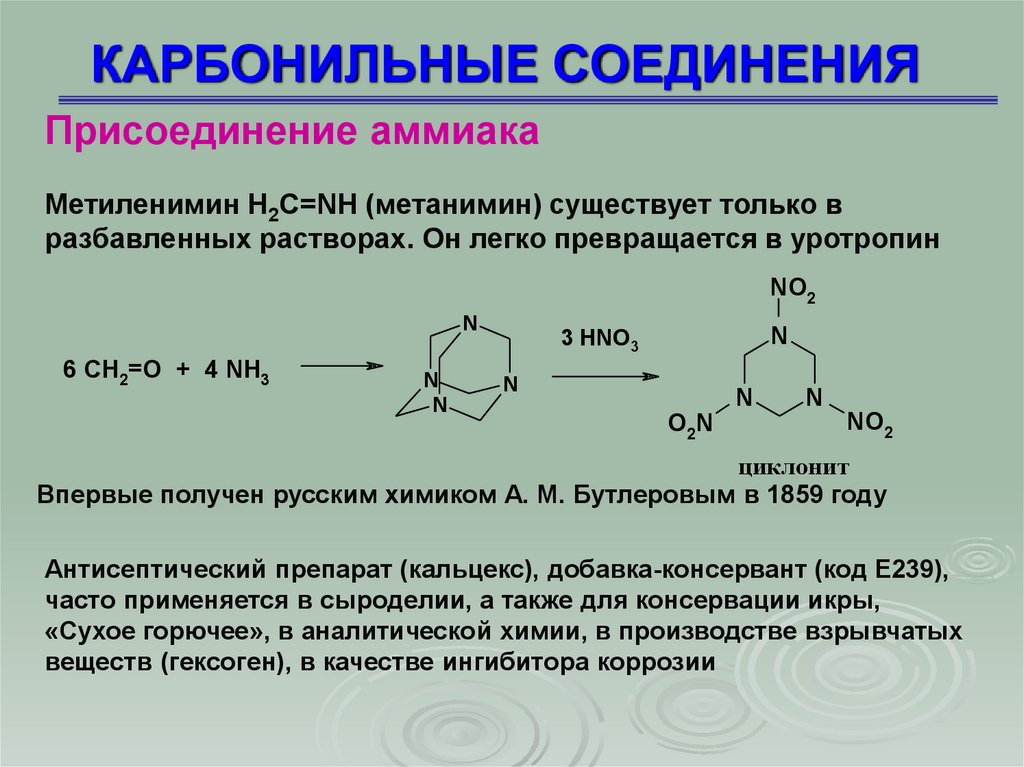
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение аммиака
Метиленимин H2C=NH (метанимин) существует только в
разбавленных растворах. Он легко превращается в уротропин
NO2
N
6 CH2=O + 4 NH3
N
N
N
3 HNO3
N
N
O2N
N
NO2
циклонит
Впервые получен русским химиком А. М. Бутлеровым в 1859 году
Антисептический препарат (кальцекс), добавка-консервант (код E239),
часто применяется в сыроделии, а также для консервации икры,
«Сухое горючее», в аналитической химии, в производстве взрывчатых
веществ (гексоген), в качестве ингибитора коррозии
47.
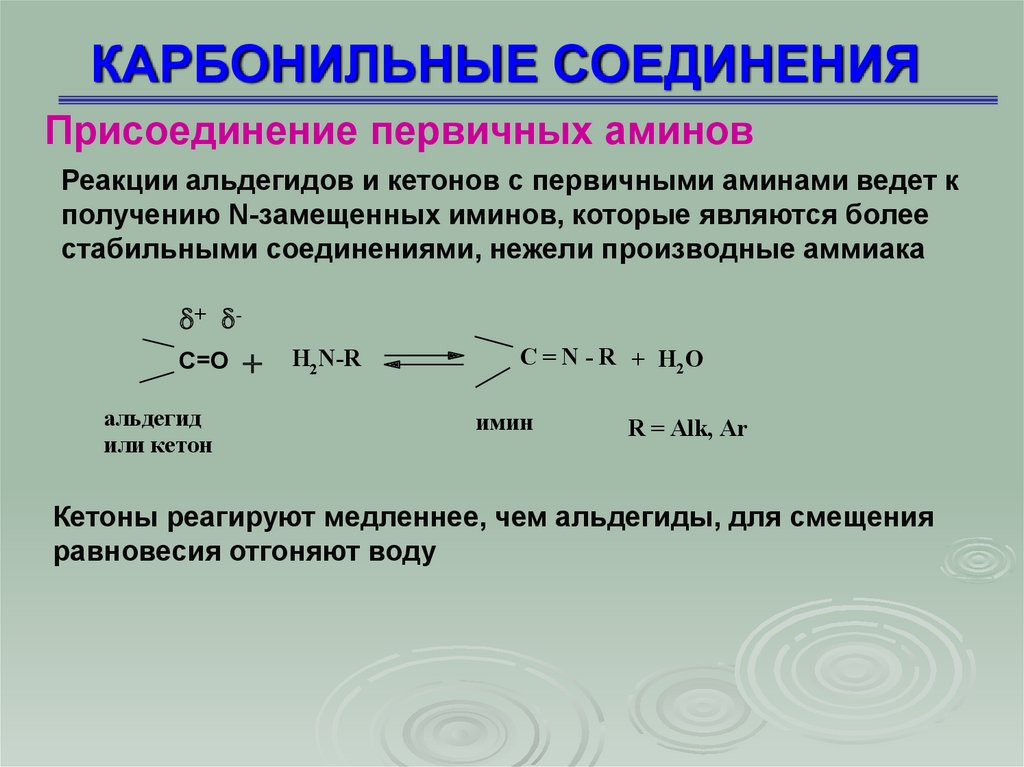
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение первичных аминов
Реакции альдегидов и кетонов с первичными аминами ведет к
получению N-замещенных иминов, которые являются более
стабильными соединениями, нежели производные аммиака
+ C=O
альдегид
или кетон
H2N-R
C = N - R + H2 O
имин
R = Alk, Ar
Кетоны реагируют медленнее, чем альдегиды, для смещения
равновесия отгоняют воду
48.
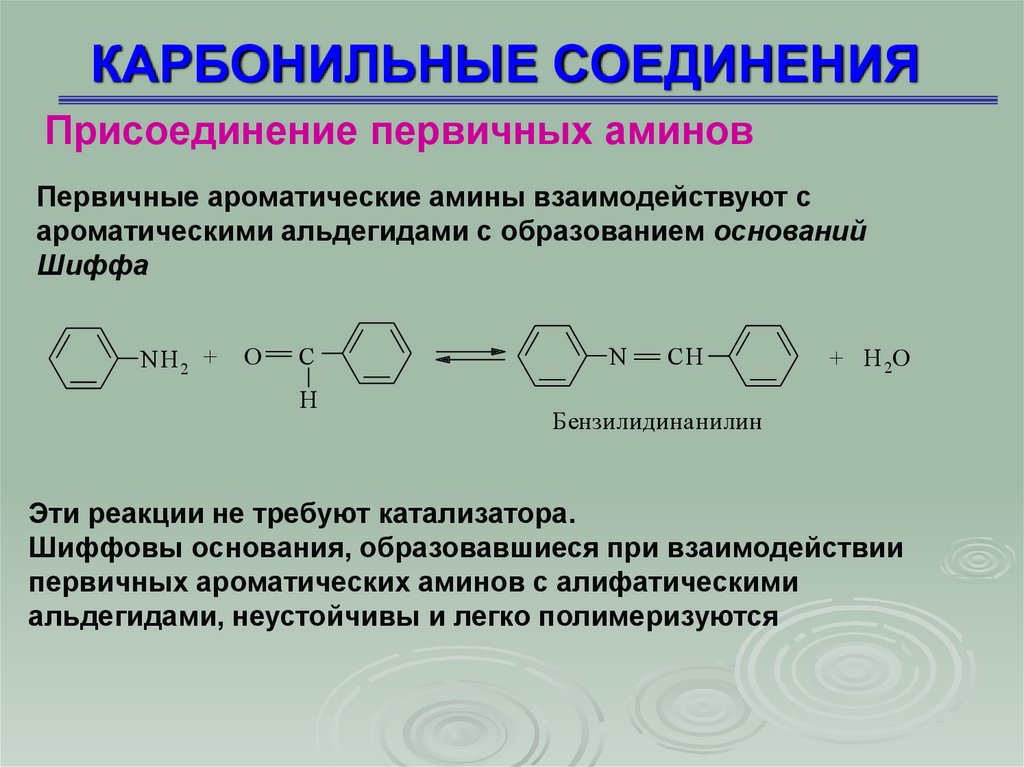
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение первичных аминов
Первичные ароматические амины взаимодействуют с
ароматическими альдегидами с образованием оснований
Шиффа
NH 2 +
O
C
H
N
CH
+ H 2O
Бензилидинанилин
Эти реакции не требуют катализатора.
Шиффовы основания, образовавшиеся при взаимодействии
первичных ароматических аминов с алифатическими
альдегидами, неустойчивы и легко полимеризуются
49.
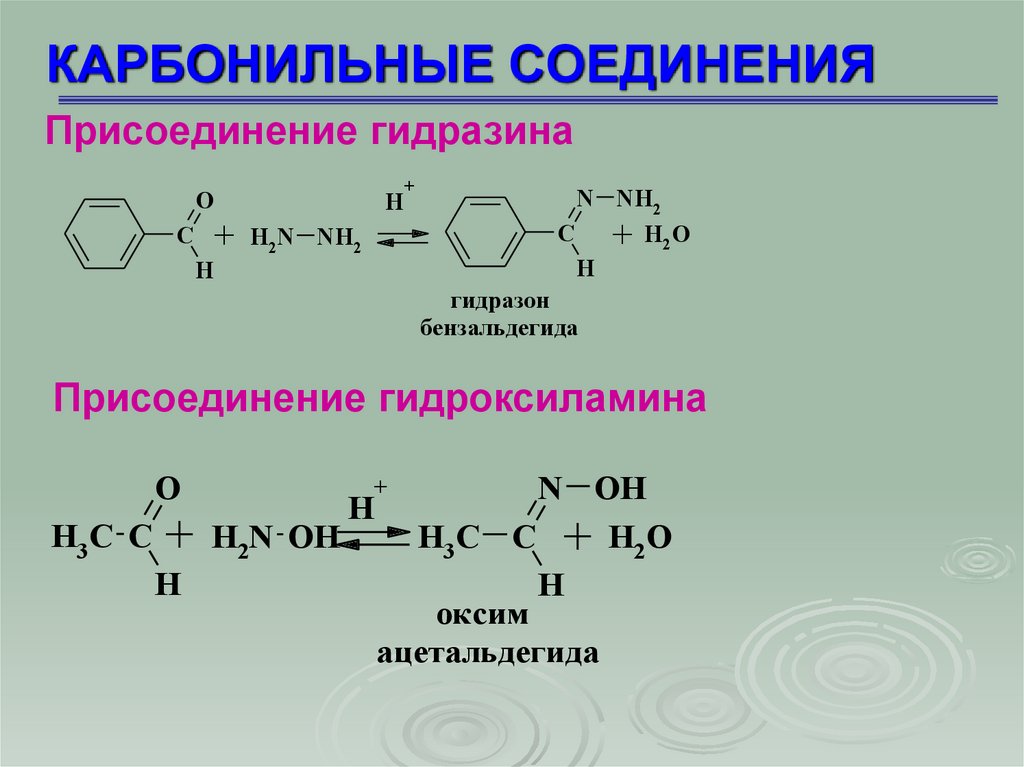
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение гидразина
+
O
C
+
H
H2N NH2
H
N NH2
C
+ H2O
H
гидразон
бензальдегида
Присоединение гидроксиламина
O
N OH
H
H3 C C + H2N OH
H3 C C + H2 O
H
H
оксим
ацетальдегида
+
50.
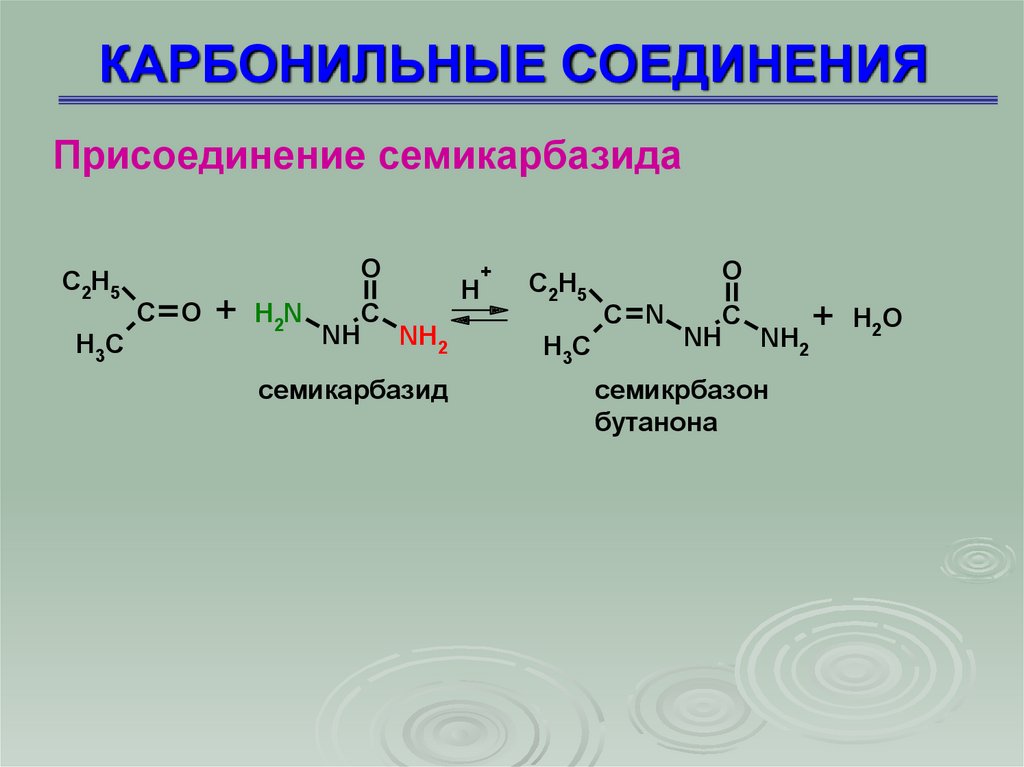
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение семикарбазида
C2H5
H3C
O
C O
+
H2N
C
NH NH2
семикарбазид
H
+
C2H5
H3C
O
C N
C
H 2O
+
NH NH2
семикрбазон
бутанона
51.
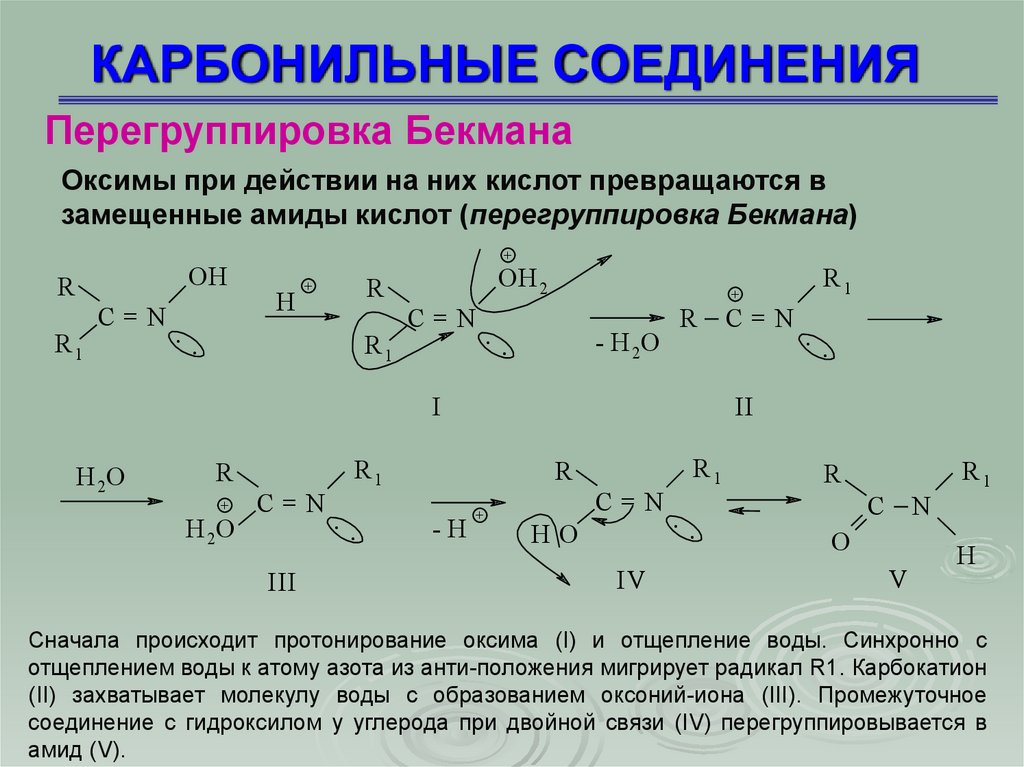
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПерегруппировка Бекмана
Оксимы при действии на них кислот превращаются в
замещенные амиды кислот (перегруппировка Бекмана)
OH
R
R1
С=N
..
+
H
OH 2
R
+
R1
С=N
+
..
- H 2O
R
I
H 2O
R
+
H 2O
С=N
III
R
-H
..
II
R1
..
С=N
R1
+
С=N
HO
IV
R1
..
R1
R
С
N
O
V
H
Сначала происходит протонирование оксима (I) и отщепление воды. Синхронно с
отщеплением воды к атому азота из анти-положения мигрирует радикал R1. Карбокатион
(II) захватывает молекулу воды с образованием оксоний-иона (III). Промежуточное
соединение с гидроксилом у углерода при двойной связи (IV) перегруппировывается в
амид (V).
52.
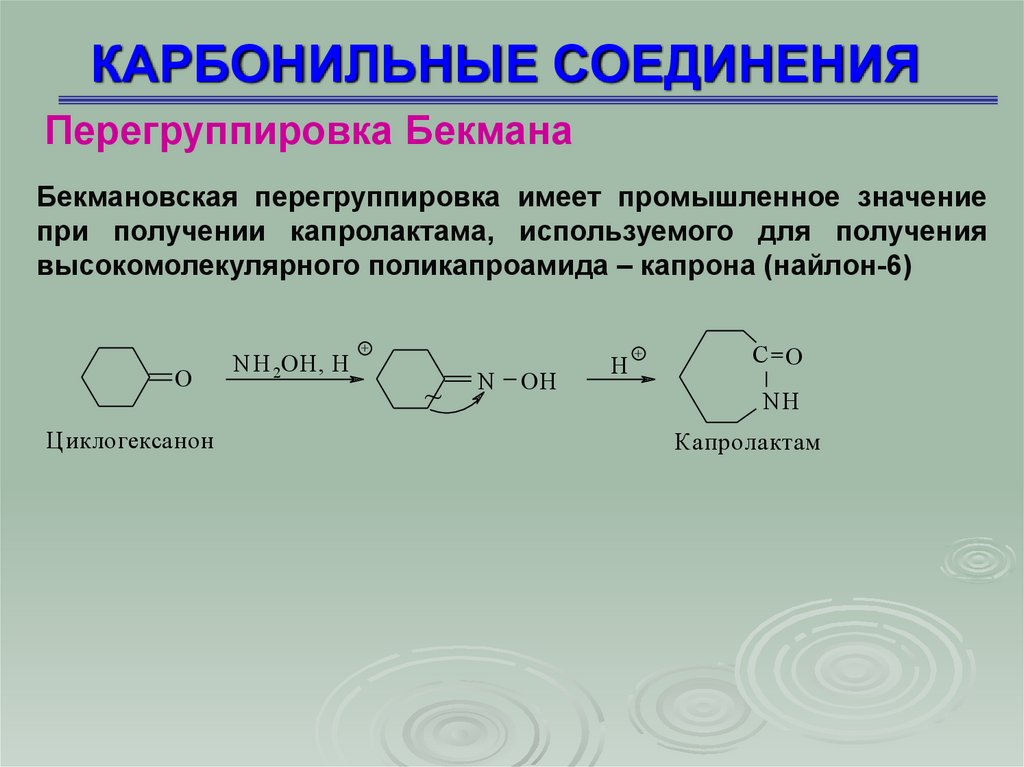
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПерегруппировка Бекмана
Бекмановская перегруппировка имеет промышленное значение
при получении капролактама, используемого для получения
высокомолекулярного поликапроамида – капрона (найлон-6)
O
Ц иклогексанон
N H 2OH , H
+
~
N
OH
H
+
C O
NH
Капролактам
53.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯРеакции енольных форм альдегидов и кетонов
СН-Кислотность и кетоенольная таутомерия
Под влиянием карбонильной группы атомы водорода,
находящиеся в -положении к карбонильной группе, приобретают
кислый характер, т.е. проявляют СН-кислотность. Этот эффект
относится только к -С – Н –связям. Это можно объяснить в
терминах резонансной стабилизации карбаниона, образующегося
при отщеплении протона у -углелеродного атома
O
CH3- C -CH3
O
CH2 - C CH3
O
CH2= C -CH3
+H
54.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯНуклеофильное присоединение, нуклеофил
– карбанион. Альдольная конденсация
Альдольная конденсация - это реакция, в которой карбонильное
соединение является одновременно и субстратом,
подвергающимся атаке нуклеофилом по карбонильной группе группе, и источником карбанионов – нуклеофилов
O
O
СH 3
C
+
H
СH 3
C
H
OH
OH
СH 3
C
H
O
СH 2
C
H
Альдоль
3-Гидроксибутаналь
55.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯКротоновая конденсация
При нагревании реакционной смеси альдоль дегидратируется в
ненасыщенный альдегид
СH 3
CН
OH
СH 2
O
C
H
OH
O
СH 3
CН
СH
C
2-Бутеналь
Кротоновый альдегид
H
+ H 2O
56.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯКротоновая конденсация
Протекание реакции дегидратации можно объяснить тем, что
альдоль содержит -Н-атомы, которые могут легко отщепляться
основанием с образованием карбаниона, имеющего достаточно
хорошо уходящую группу –ОН у соседнего ( ) атома углерода
OH
H
CH3 - C - CH2 - CH-CHO
OH
+ OH
СH3 CH-CH-CHO
- OH
O
CH3 CH CH
C
H
Легкость протекания и направление реакции дегидратации также
обусловлены устойчивостью образующегося алкена: двойная
углерод–углеродная связь сопряжена с двойной углеродкислородной связью карбонила. В тех случаях, когда в
образующихся алкенах в систему сопряжения включено
ароматическое кольцо, альдоль выделить не удается
57.
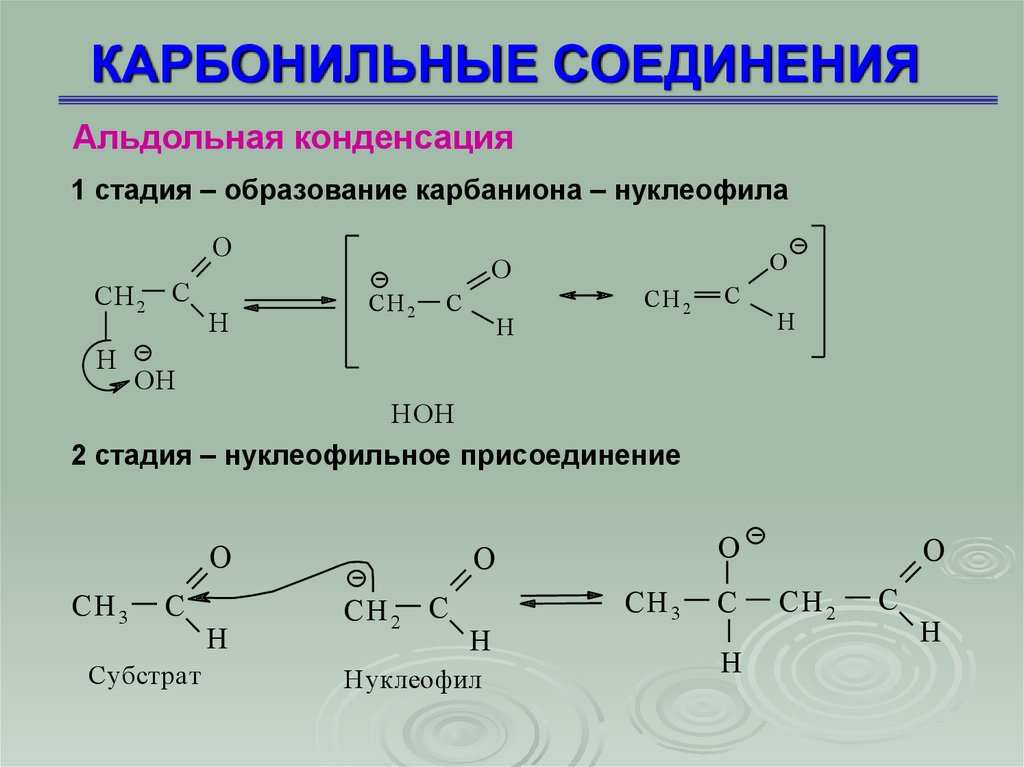
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯАльдольная конденсация
1 стадия – образование карбаниона – нуклеофила
O
СH 2 C
H
H
O
O
CН 2
C
H
CН 2
C
H
OH
H OH
2 стадия – нуклеофильное присоединение
O
СH 3
C
Субстрат
H
O
O
СH 2 C
H
Нуклеофил
СH 3
C
H
O
СH 2
C
H
58.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯАльдольная конденсация
3 стадия – стабилизация алкоголят-иона за счет отрыва
протона от воды
O
СH 3
CH
OH
O
СH 2
Более сильное
основание
C
+ H OH
H
Более сильная
кислота
СH 3
CH
O
СH 2
Более слабая
кислота
C
H
+ OH
Более слабое
основание
59.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯАльдольная конденсация
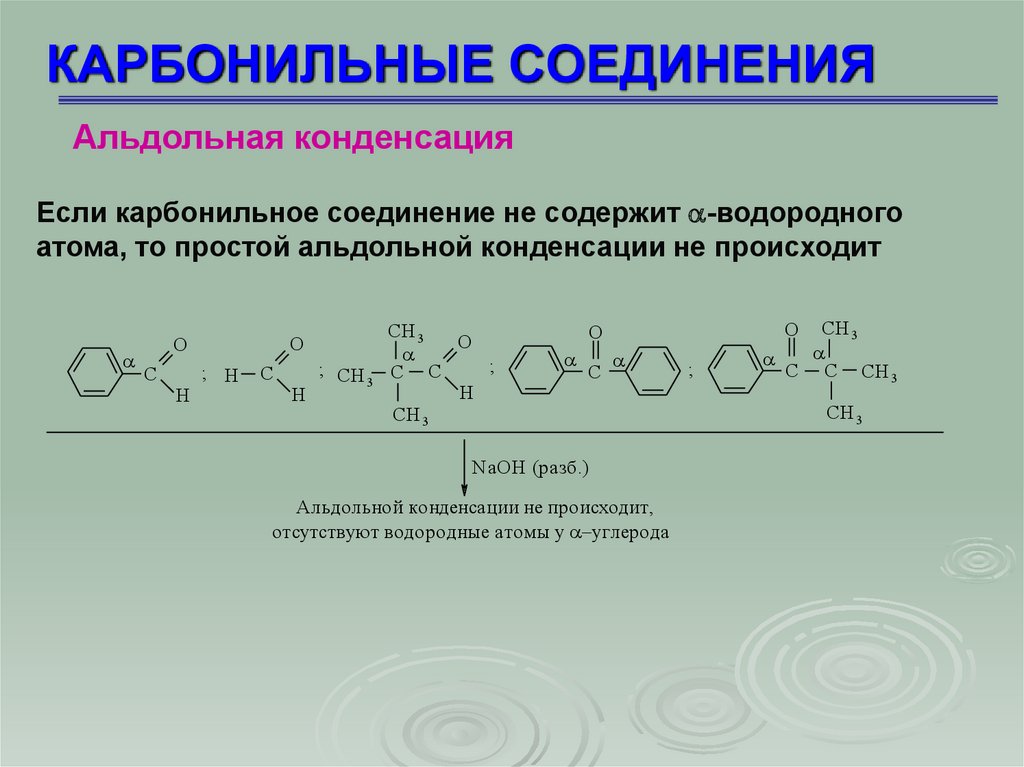
Если карбонильное соединение не содержит -водородного
атома, то простой альдольной конденсации не происходит
O
O
C
H
; H
C
H
; CH
3
CH 3
O
;
C C
H
CH 3
C
CH 3
C C CH 3
O
O
NaOH (разб.)
Aльдольной конденсации не происходит,
отсутствуют водородные атомы у углерода
;
CH 3
60.
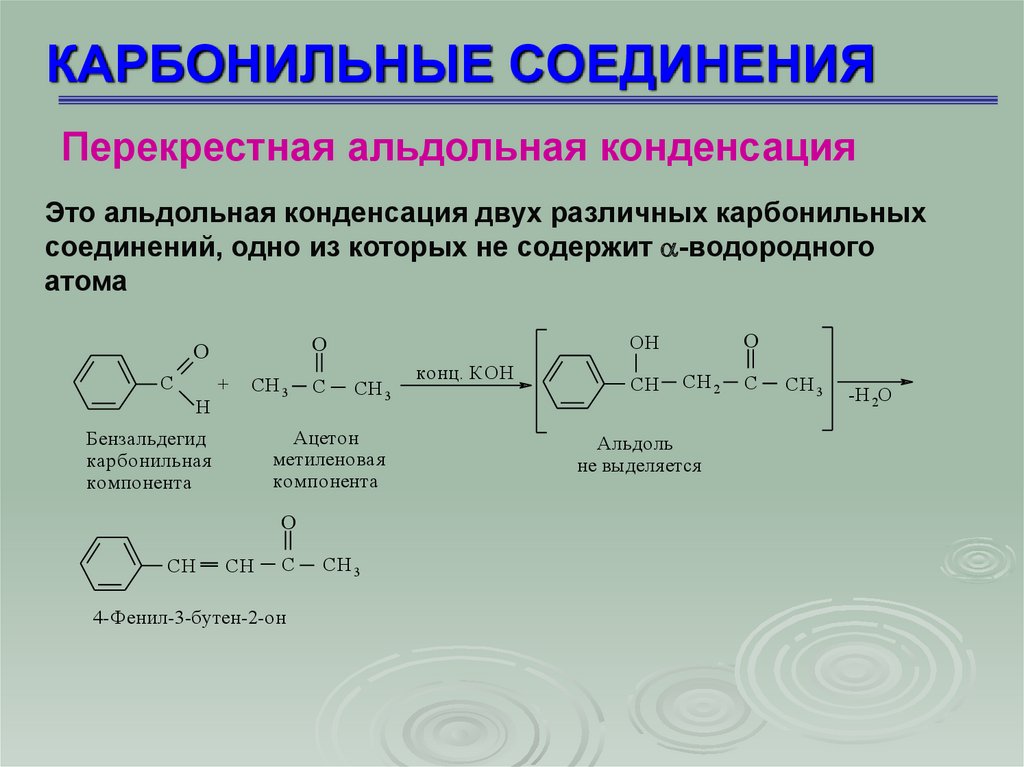
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПерекрестная альдольная конденсация
Это альдольная конденсация двух различных карбонильных
соединений, одно из которых не содержит -водородного
атома
C
+
H
СH 3
C
СH 3
Ацетон
метиленовая
компонента
Бензальдегид
карбонильная
компонента
O
CH
СH
C
4-Фенил-3-бутен-2-он
O
OH
O
O
СH 3
конц. КОН
CH
СH 2
Альдоль
не выделя ется
C
СH 3
-H 2O
61.
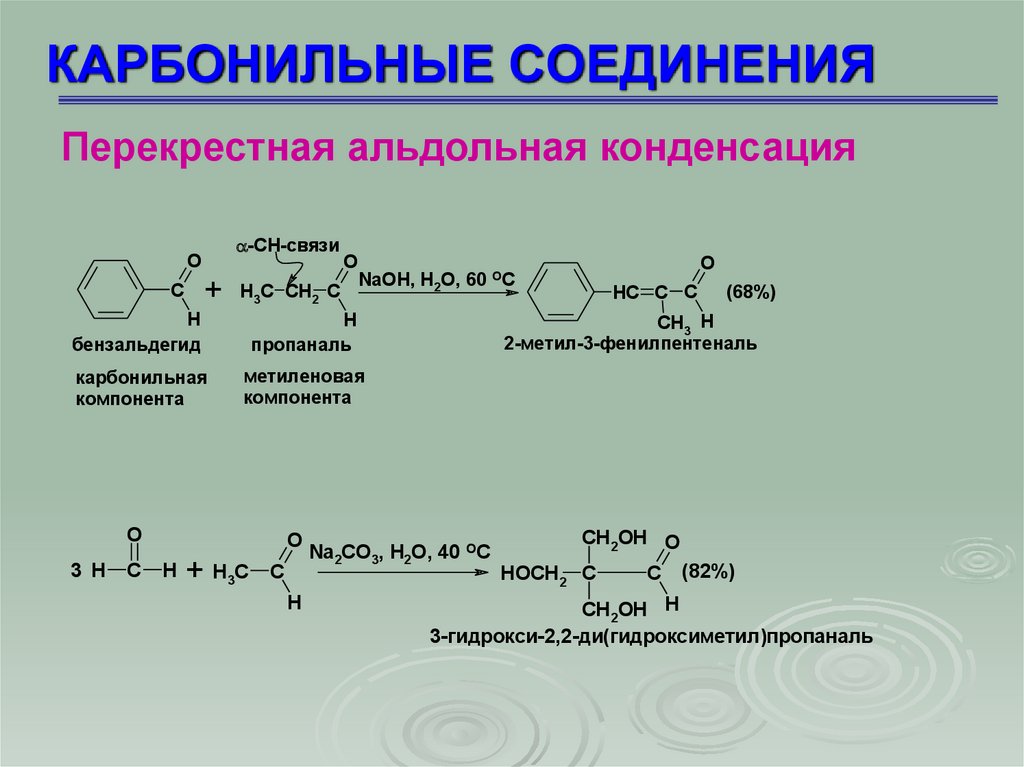
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПерекрестная альдольная конденсация
-СН-связи
O
+
C
H3C CH2 C
O
NaOH, H2O, 60 OC
H
бензальдегид
H
пропаналь
карбонильная
компонента
метиленовая
компонента
O
3 H
C
H
+HC
3
O
C
H
O
HC C C
(68%)
CH3 H
2-метил-3-фенилпентеналь
Na2СO3, H2O, 40 OC
CH2OH O
HOCH2 C
C
(82%)
CH2OH H
3-гидрокси-2,2-ди(гидроксиметил)пропаналь
62.
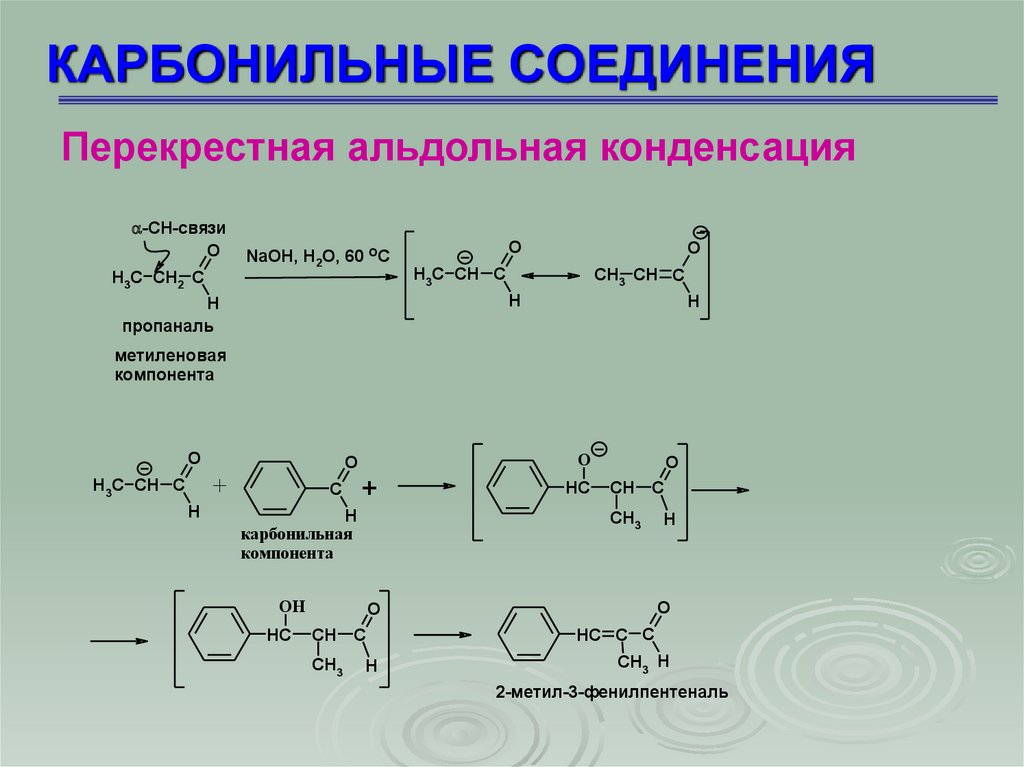
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПерекрестная альдольная конденсация
-СН-связи
O
H3C CH2 C
NaOH, H2O, 60 OC
O
O
H3C CH C
CH3 CH C
H
H
пропаналь
H
метиленовая
компонента
O
+
H3C CH C
H
O
O
+
C
H
карбонильная
компонента
CH
C
CH3
OH
HC
HC
O
O
O
CH
CH3
C
H
H
HC C C
CH3 H
2-метил-3-фенилпентеналь
63.
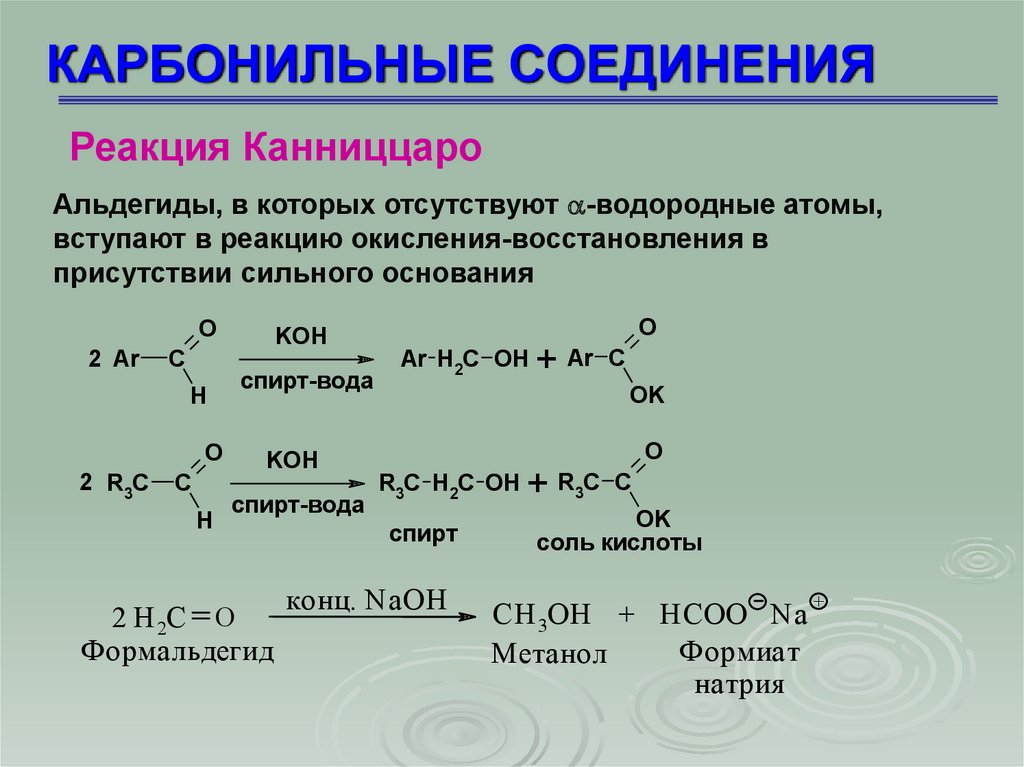
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯРеакция Канниццаро
Альдегиды, в которых отсутствуют -водородные атомы,
вступают в реакцию окисления-восстановления в
присутствии сильного основания
O
2 Ar
C
H
O
2 R3C
C
H
KOH
спирт-вода
KOH
спирт-вода
2 H 2C O
Формальдегид
Ar H2C OH
R3C H2C OH
спирт
конц. NaOH
+ Ar
+RC
3
O
C
OK
O
C
OK
соль кислоты
CH 3OH + HCOO Na
Формиат
Метанол
натрия
+
64.
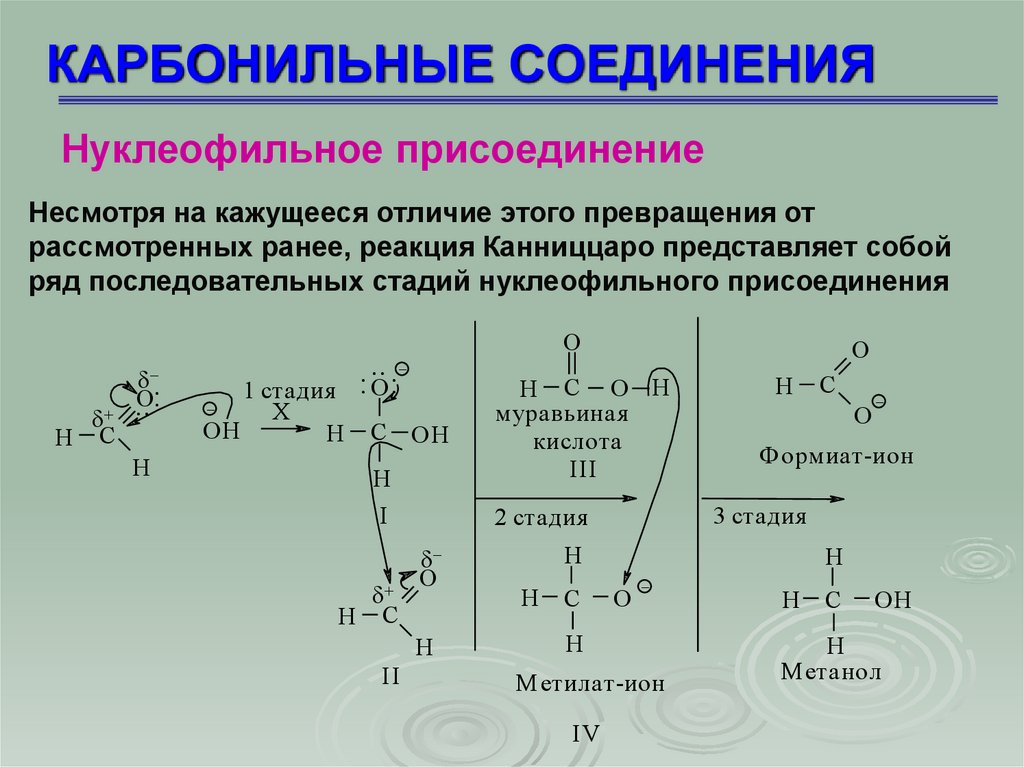
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯНуклеофильное присоединение
Несмотря на кажущееся отличие этого превращения от
рассмотренных ранее, реакция Канниццаро представляет собой
ряд последовательных стадий нуклеофильного присоединения
H
..O:
C
H
..
O
_
1 cтадия : O :
Х
OH
H C OH
_
H
I
H C O H
муравьиная
кислота
III
O
H
II
H
О
С
Н
О
_
Н
М етилат-ион
IV
_
Формиат-ион
Н
Н
C
3 cтадия
2 cтадия
H C
O
Н
С
ОН
Н
М етанол
65.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯНуклеофильное присоединение
1 стадия – нуклеофильное присоединение иона ОН с
образованием промежуточного соединения (I);
2 стадия – превращение иона (I) в молекулу кислоты путем
отщепления от него гидрид-иона Н , который является
нуклеофилом в реакции присоединения ко второй молекуле
альдегида (II), анион (I) превращается в муравьиную кислоту
(III);
3 стадия – перенос протона от более слабого основания
формиат-иона к более сильному метилат-иону (IV)
66.
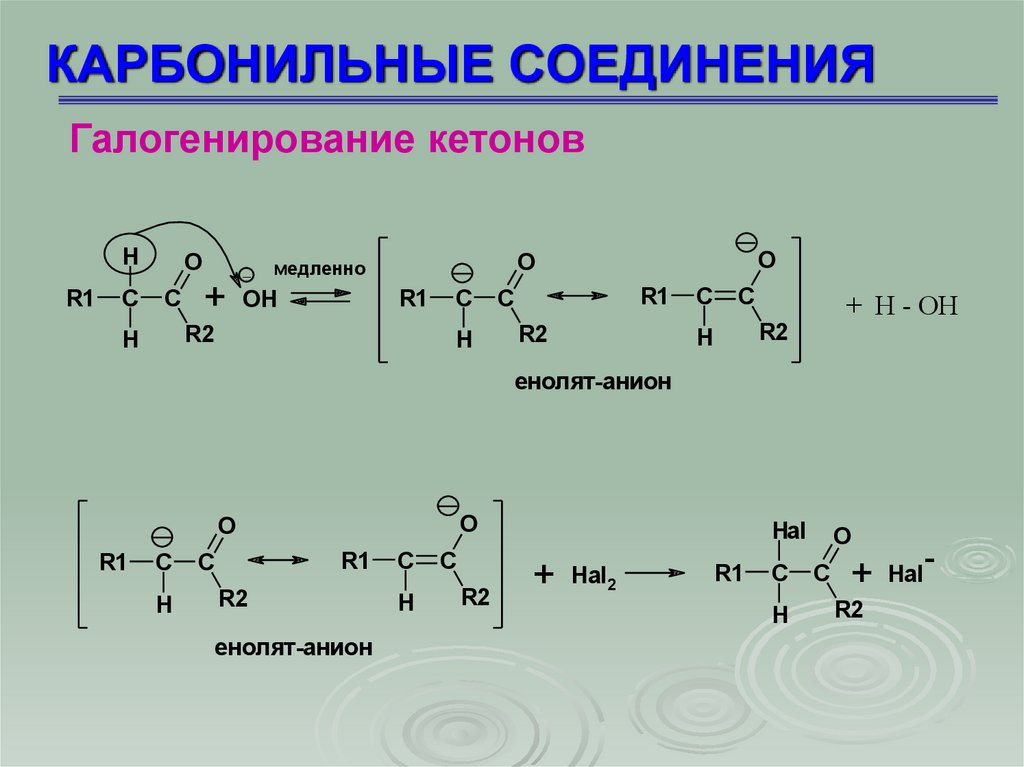
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯГалогенирование кетонов
Галогенирование кетонов происходит путем замещения
исключительно -водородного атома
O
CH 3 C
_
CH 3 + 3Br 2
OH
O
CH 3 C
CBr 3 + 3HBr
67.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯГалогенирование кетонов
1 стадия – медленная: основание отрывает протон от ацетона,
образуя карбанион (I)
_
O
CH3 C
_
CH3 + OH
O
медленно
CH3 C
О
_
CH2
CH3 C
CH2
+ H
OH
I
еноля т-ион
2 стадия – быстрая: анион (I) взаимодействует с молекулой брома,
поляризованной под влиянием отрицательного заряда
карбаниона
O
CH 3 C
O
_
CH 2
Br : Br
быстро
CH 3 C
_
CH 2Br
+ Br
68.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯГалогенирование кетонов
H
R1
C
O
C
+
_
R1
OH
R2
H
O
O
медленно
C
H
R1
C
R2
C
C
+ H - OH
R2
H
енолят-анион
O
O
R1
C
H
R1
C
R2
енолят-анион
C
H
C
R2
Hal
+
Hal2
R1
C
H
O
C
+
R2
-
Hal
69.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯГалогенирование кетонов
Скорость реакции зависит от концентрации ацетона и основания,
но не зависит от концентрации брома; скорость галогенирования
не зависит также от природы галогена, будь то хлор, бром или
иод.
Последующее замещение атомов водорода протекает быстрее
O
CH 3 C
CH 2Br
Br 2, OH
O
CH 3 C
CHBr 2
Br 2, OH
O
CH 3 C
CBr 3
70.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯВзаимодействие альдегидов и кетонов
с пентахлоридом фосфора
Альдегиды и кетоны при взаимодействии с РCl5 обменивают атом
кислорода на два атома хлора, что используется для получения
геминальных дихлоралканов (оба атома хлора присоединяются к
одному и тому же атому углерода
Cl
O
СН 3СН 2
С
+ PCl5
СН 3СН 2
С
Cl
H
H
Пропионовый
альдегид
1,1-Дихлорпропан
O
Cl
СН 3СН 2
С
Бутанон
СН 3 + PCl5
+ POCl3
СН 3СН 2
С
СН 3 + POCl3
Cl
2,2-Дихлорбутан
71.
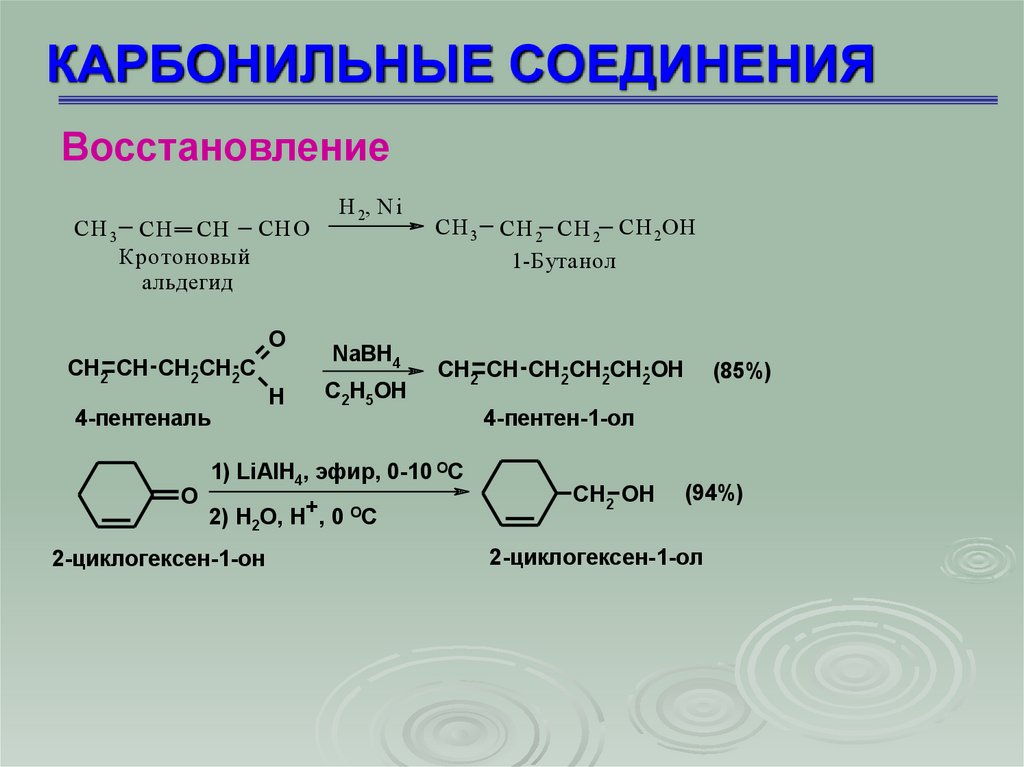
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯВосстановление
CH 3 CН CH СНО
Кротоновый
альдегид
O
CH2 CH CH2CH2C
4-пентеналь
O
H
Н 2, Ni
NaBH4
C2H5OH
CH 3 CН 2 CH 2 СН 2ОH
1-Бутанол
CH2 CH CH2CH2CH2OH
1) LiAlH4, эфир, 0-10 ОС
2) H2O, H+, 0 OC
2-циклогексен-1-он
(85%)
4-пентен-1-ол
CH2 OH
(94%)
2-циклогексен-1-ол
72.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯВосстановление
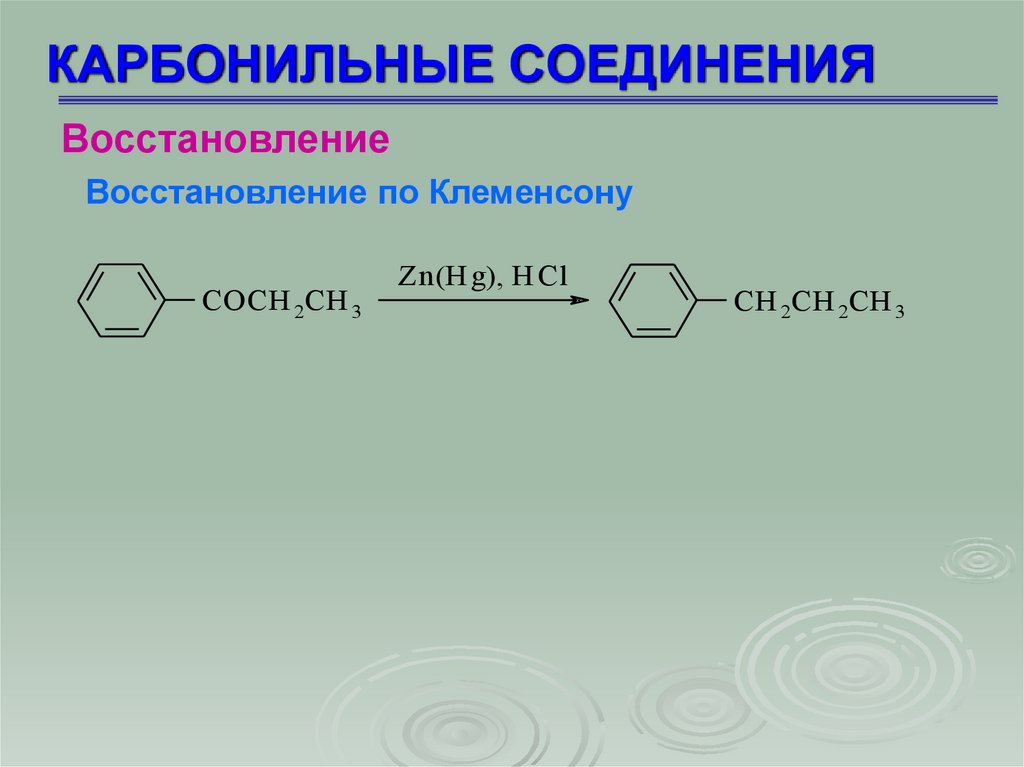
Восстановление по Клеменсону
СOCH 2CH 3
Zn(H g), H Cl
СH 2CH 2CH 3
73.
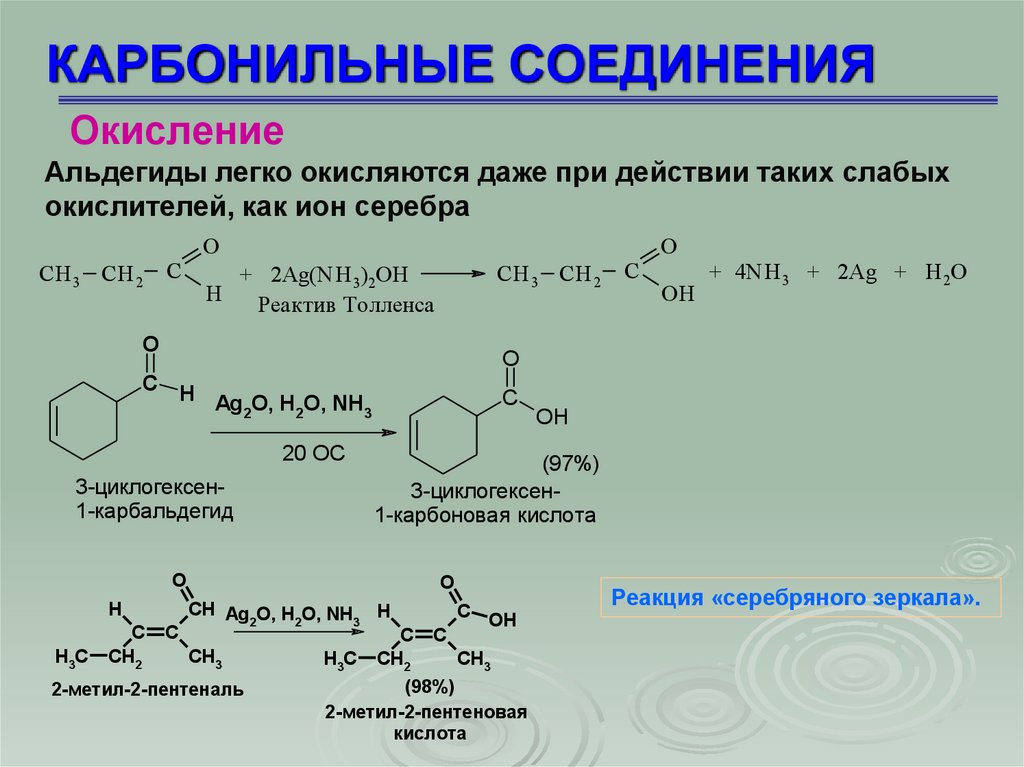
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯОкисление
Альдегиды легко окисляются даже при действии таких слабых
окислителей, как ион серебра
CH 3 CH 2
C
O
CH 3 CH 2
+ 2Ag(NH 3)2OH
H
Реактив Толленса
O
H Ag O, H O, NH
2
2
3
20 OC
3-циклогексен1-карбальдегид
C
H
C
O
CH Ag O, H O, NH H
2
2
3
CH3
2-метил-2-пентеналь
H3C
OH
(97%)
3-циклогексен1-карбоновая кислота
O
H3C
ОH
+ 4NH 3 + 2Ag + Н 2О
O
C
C
CH2
C
O
C
CH2
C
C
OH
CH3
(98%)
2-метил-2-пентеновая
кислота
Реакция «серебряного зеркала».
74.
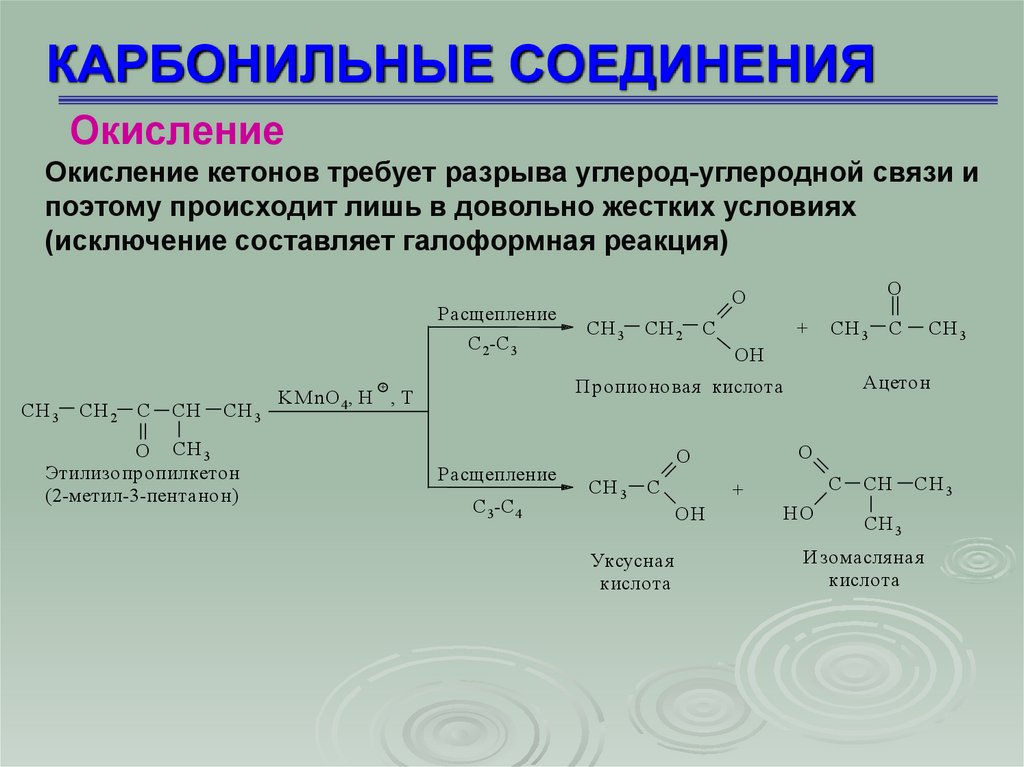
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯОкисление
Окисление кетонов требует разрыва углерод-углеродной связи и
поэтому происходит лишь в довольно жестких условиях
(исключение составляет галоформная реакция)
Расщепление
С 2-С 3
CH 2
C
CH
CH 3
O CH 3
Этилизопропилкетон
(2-метил-3-пентанон)
СН 3
СН 2
С
+
СН 3
KM nO 4, H , T
Расщепление
С 3-С 4
С
СН 3
ОН
Ацетон
Пропионовая кислота
+
СH 3
O
O
O
O
СН 3
С
ОН
Уксусная
кислота
С
+
НО
СН
СН 3
СН 3
Изомасля ная
кислота
75.
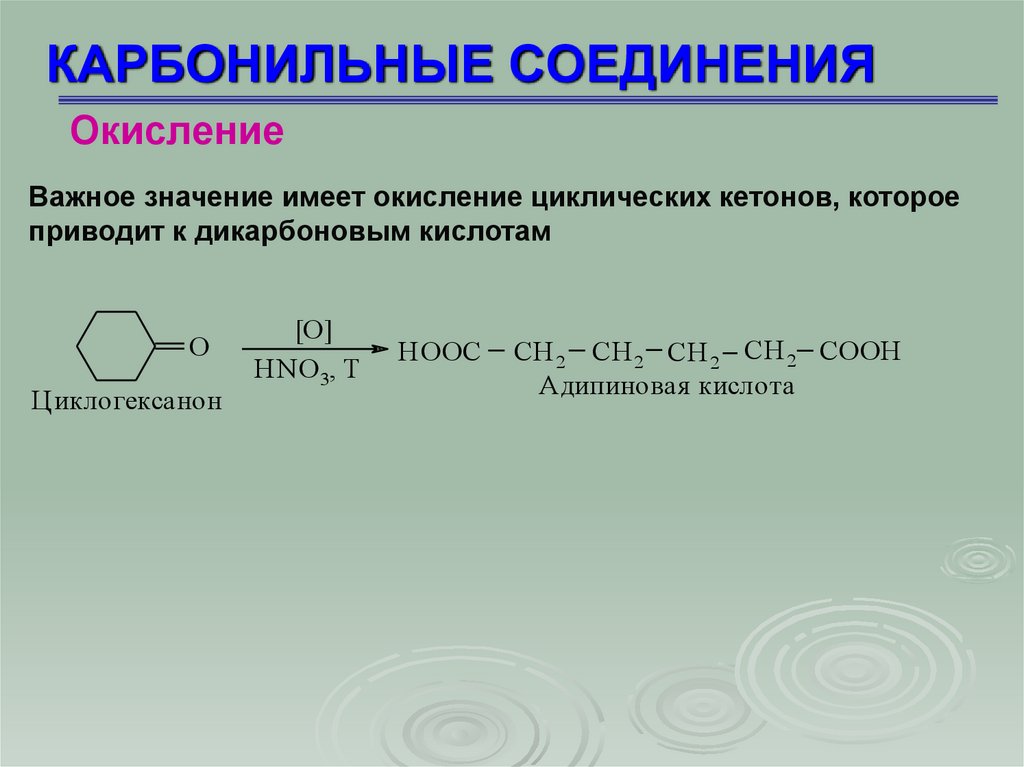
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯОкисление
Важное значение имеет окисление циклических кетонов, которое
приводит к дикарбоновым кислотам
O
Циклогексанон
[O]
HNO 3, T
HOOC
CH 2 CH 2 CH 2 CH 2 COOH
Адипиновая кислота
76.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ3. Полимеризация альдегидов
При пропускании формальдегида над карбонилом железа
(Fe(CO)5) образуется полимер:
n CH2 = O + H2O
HO-CH2-(-O-CH2-)n-2 -O-CH2-OH
Параформ (полиоксиметилен) n=6-100
Это вещество при нагревании регенерирует формальдегид,
поэтому служит удобным источником газообразного
формальдегида
77.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение О-нуклеофилов
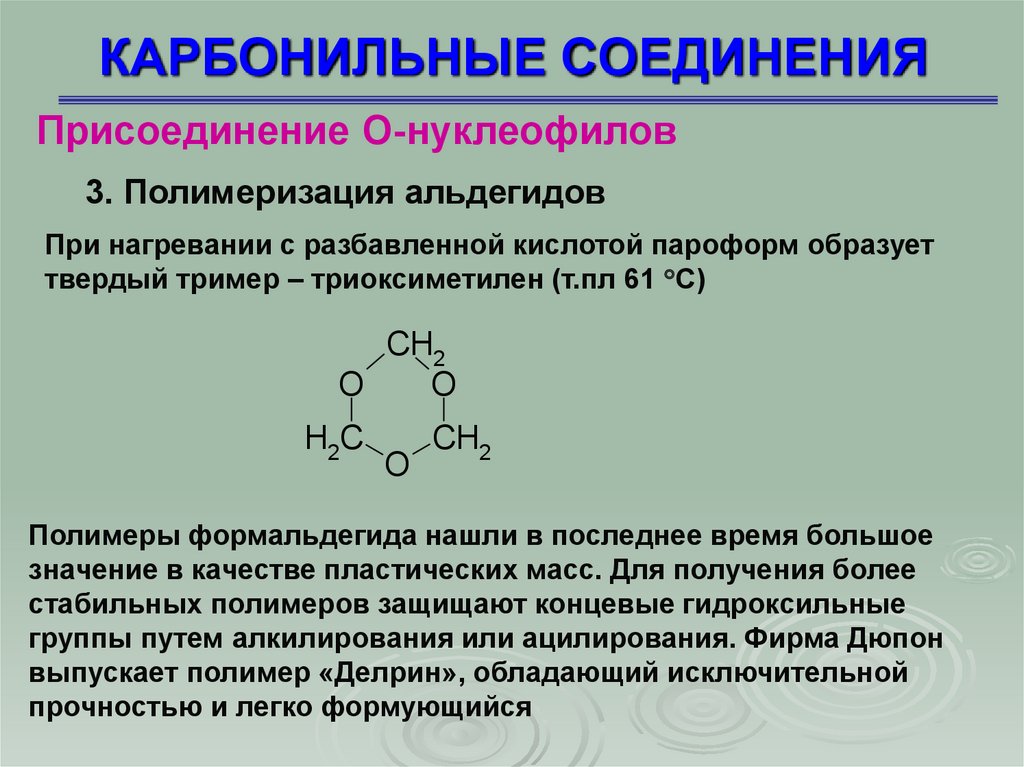
3. Полимеризация альдегидов
При нагревании с разбавленной кислотой пароформ образует
твердый тример – триоксиметилен (т.пл 61 С)
CH2
O
O
H2C
O
CH2
Полимеры формальдегида нашли в последнее время большое
значение в качестве пластических масс. Для получения более
стабильных полимеров защищают концевые гидроксильные
группы путем алкилирования или ацилирования. Фирма Дюпон
выпускает полимер «Делрин», обладающий исключительной
прочностью и легко формующийся
78.
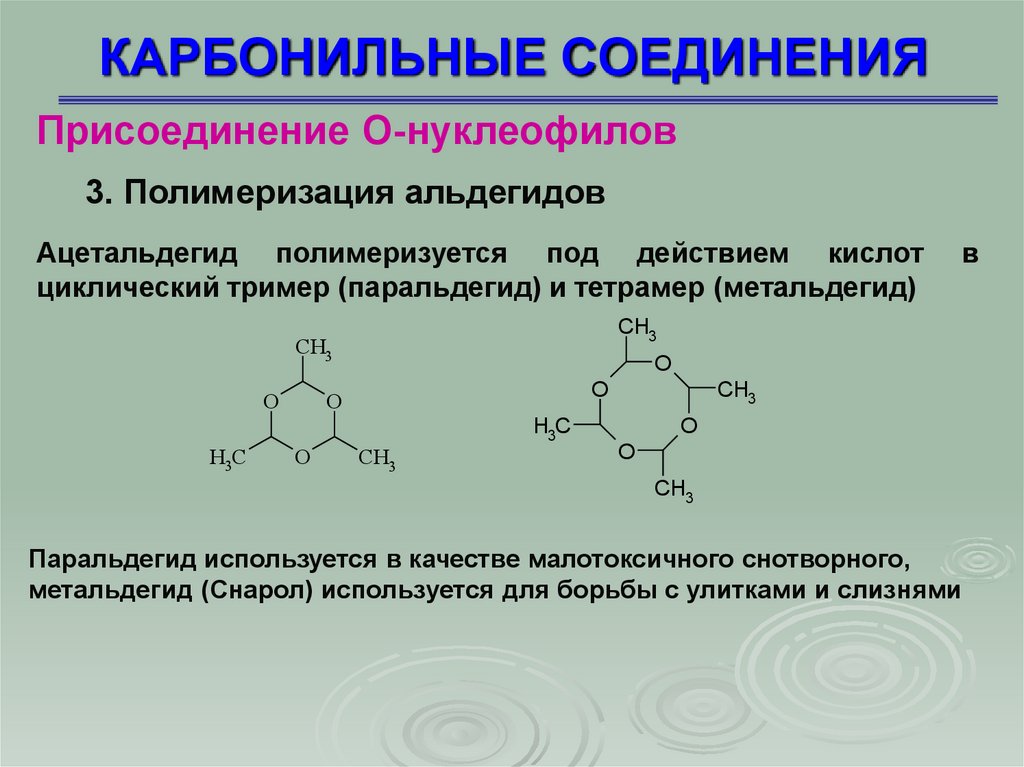
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯПрисоединение О-нуклеофилов
3. Полимеризация альдегидов
Ацетальдегид полимеризуется под действием кислот
циклический тример (паральдегид) и тетрамер (метальдегид)
CH3
CH3
O
O
O
O
H3C
H3C
O
в
CH3
CH3
O
O
CH3
Паральдегид используется в качестве малотоксичного снотворного,
метальдегид (Снарол) используется для борьбы с улитками и слизнями
79.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯОтдельные представители
Муравьиный альдегид
Муравьиный альдегид (формальдегид) – бесцветный газ с резким
запахом, очень ядовит. Хорошо растворим в воде (40 % р-ор
формалин). Получают в промышленности неполным окислением
метана и каталитическим окислением метанола при 650-700 С на
серебряном катализаторе. Используется для получения
фенолформальдегидных смол, уротропина, пентаэритрита
CH2OH
CH3CHO + 3 CH2O
OH
HOCH2 -C- CHO
CH2OH
OH
CH2OH
CH2OH
HOCH2 -C- CH2OH
CH2OH
При нитровании получают пентаэритриттетранитрат – ВВ
80.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯОтдельные представители
Уксусный альдегид
Уксусный альдегид получают гидратацией ацетилена,
дегидрированием этилового спирта, изомеризацией окиси
этилена. Используется для получения уксусной кислоты,
уксусного ангидрида, альдоля, этилового спирта, этилацетата и
других эфиров
Ацетон
Ацетон получаю кислотным разложением гипериза, окислением
или дегидрированием изопропилбензола, ацетон-бутанольным
брожением углеводов, из надсмольной воды при сухой перегонке
древесины. Ацетон широко используется в качестве растворителя,
для получения метилметакрилата



































 chemistry
chemistry