Similar presentations:
Термодинамика. Предмет и задачи термодинамики
1. Термодинамика
ВоГУЛекция 8
Термодинамика
Кузина Л.А.,
к.ф.-м.н., доцент
2015 г.
1
2. План
23.
Предмет и задачи термодинамикиТермодинамика изучает общие свойства макросистем, находящихся в
состоянии термодинамического равновесия, и процессы перехода между
состояниями. Термодинамика позволяет понять, какие процессы
возможны, а какие – нет.
Отвлекаясь от движения тела как целого, термодинамика сосредотачивает
внимание на изменениях внутреннего состояния тела, состояния
термодинамической системы
На основе общих принципов механики пытались установить связь между
молекулярным движением и тепловыми явлениями
Термодинамику пытались свести к механике
Это принципиально невозможно
Законы Ньютона обратимы во времени
Тепловые процессы необратимы: теплота переходит от горячего к холодному,
но не наоборот
Ньютоновская механика принципиально не может объяснить
необратимость процессов
Сведение термодинамики к механике оказывается невозможным
4.
Предмет и задачи термодинамикиПример: греем газ в закрытом сосуде, приведя его в соприкосновение с
нагретым телом. Увеличивается энергия газа; он при расширении может
совершить механическую работу
При теплообмене передача энергии происходит на микроскопическом
уровне, при столкновениях молекул. Результат каждого отдельного
столкновения предсказать невозможно. Но в среднем, с
макроскопической точки зрения, при соударении энергичных молекул
нагретого тела со стенками сосуда с газом энергия переходит от
нагретого тела к газу. В результате тепловая энергия обязательно
перетекает от горячего тела к газу
Теплота представляет собой особую форму движения материи.
Хотя теплота и связана с молекулярным механическим движением, но этим
не исчерпывается ее сущность
В механике переменными являются координаты и импульсы (скорости)
частиц.
В термодинамике такое описание оказалось неприемлемым. В число
переменных (параметров) в термодинамике потребовалось ввести
температуру
Температура определяет направление перехода теплоты, то есть
выступает как мера нагретости тела
5.
ПараметрыДля определения состояния системы в термодинамике
используются параметры (термодинамические переменные):
Экстенсивные
зависят от количества вещества
m
(V, m, )
Интенсивные
не зависят от количества вещества
(T, p)
Параметры измеряются на опыте
Параметры системы не являются независящими друг от
друга, они связаны уравнением состояния
Уравнение состояния – уравнение вида:
f(p,V,T)=0, связывающее параметры системы
6.
В основе термодинамики лежат основанные на опытезаконы (начала) термодинамики
В термодинамике нет моделей, теоретических предположений о строении
вещества или о механизме процессов.
Свойства вещества – теплоёмкость, температурные коэффициенты
объёмного и линейного расширения, и т.д. – определяются из опыта
Закон теплового равновесия
(нулевое начало термодинамики)
Понятие теплового равновесия является одним из главнейших
исходных термодинамических понятий.
Опыт показывает, что если системы 1 и 2 находятся в тепловом
равновесии с системой 3, то то системы 1 и 2 будут также в тепловом
равновесии друг с другом.
Значение этого закона заключается в том, что он приводит к выводу о
существовании температуры как характеристики теплового равновесия
системы.
Температура есть присущая каждому состоянию равновесия
интенсивная величина
7.
Внутренняя энергияОдно из важных понятий – внутренняя энергия системы U.
Внутренняя энергия тела – это полная энергия тела, за исключением
кинетической энергии движения тела как целого (движения центра масс
и вращения тела как целого) и потенциальной энергии тела во внешних
полях
Внутренняя энергия системы – это функция
состояния, то есть однозначно определяется
состоянием системы.
Изменение внутренней энергии системы в какомлибо процессе не зависит от пути перехода, а только
от начального и конечного сотояния; а в замкнутом
процессе, когда система возвращается в исходное
состояние, изменение внутренней энергии равно
нулю
8.
Первое начало термодинамикиВнутреннюю энергию системы можно изменить за счёт:
1) совершения над системой работы;
2) сообщения системе теплоты:
dU Q Aвнешних сил
U Q Aвнешних сил
A Aвнешних сил
Q A dU
Q A U
Количество теплоты, сообщённое системе, идёт на
приращение её внутренней энергии и на работу системы
против внешних сил
9.
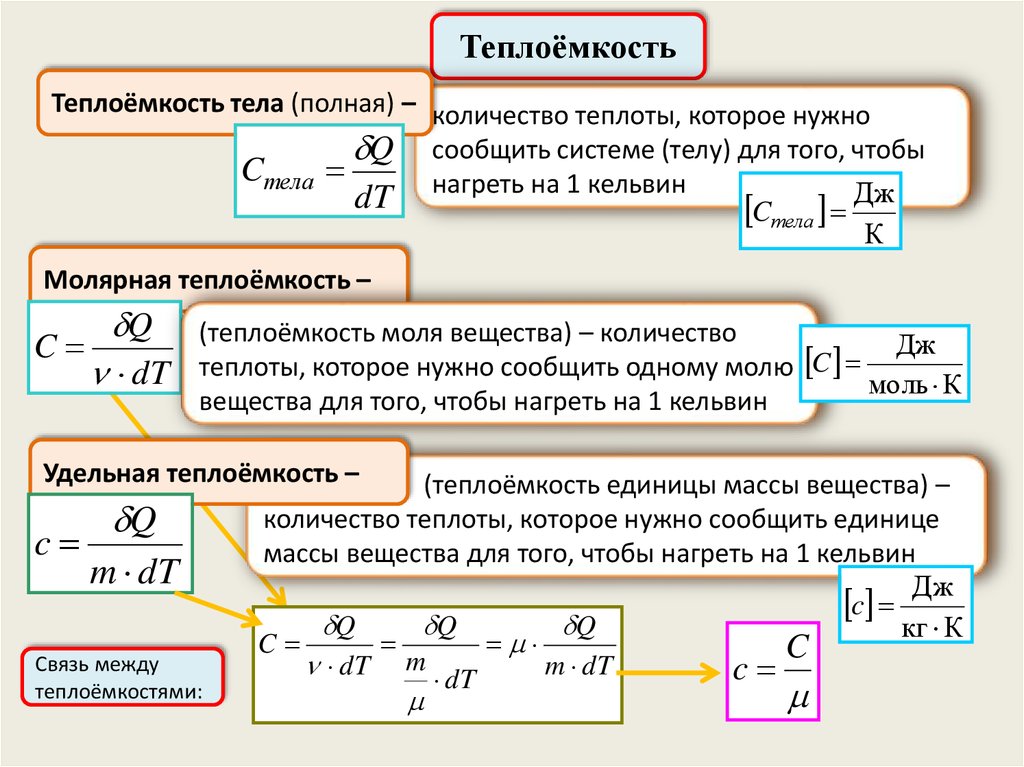
ТеплоёмкостьТеплоёмкость тела (полная) – количество теплоты, которое нужно
Q сообщить системе (телу) для того, чтобы
Cтела
dT нагреть на 1 кельвин
Cтела Дж
К
Молярная теплоёмкость –
C
Q
dT
(теплоёмкость моля вещества) – количество
Дж
C
теплоты, которое нужно сообщить одному молю
моль К
вещества для того, чтобы нагреть на 1 кельвин
Удельная теплоёмкость –
c
Q
m dT
Связь между
теплоёмкостями:
(теплоёмкость единицы массы вещества) –
количество теплоты, которое нужно сообщить единице
массы вещества для того, чтобы нагреть на 1 кельвин
c Дж
Q
Q
Q
кг К
C
C
dT m dT
m dT
c
10.
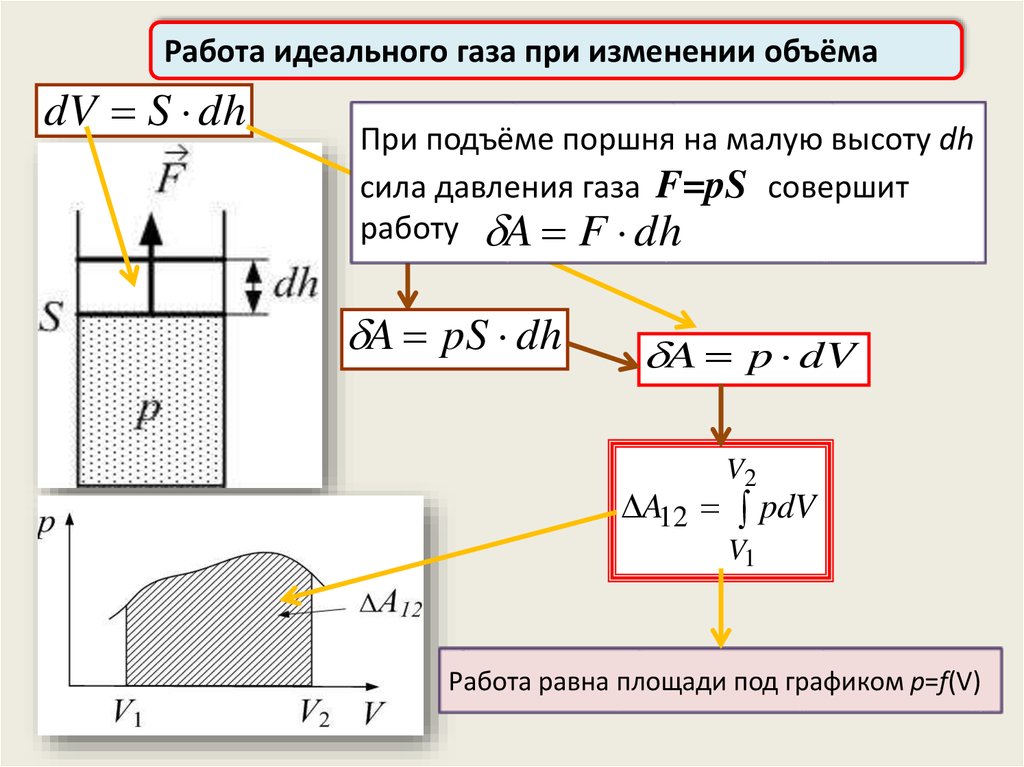
Работа идеального газа при изменении объёмаdV S dh
При подъёме поршня на малую высоту dh
сила давления газа F=pS совершит
работу A
A FF dh
dh
A pS dh
A p dV
V2
A12 pdV
V1
Работа равна площади под графиком p=f(V)
11.
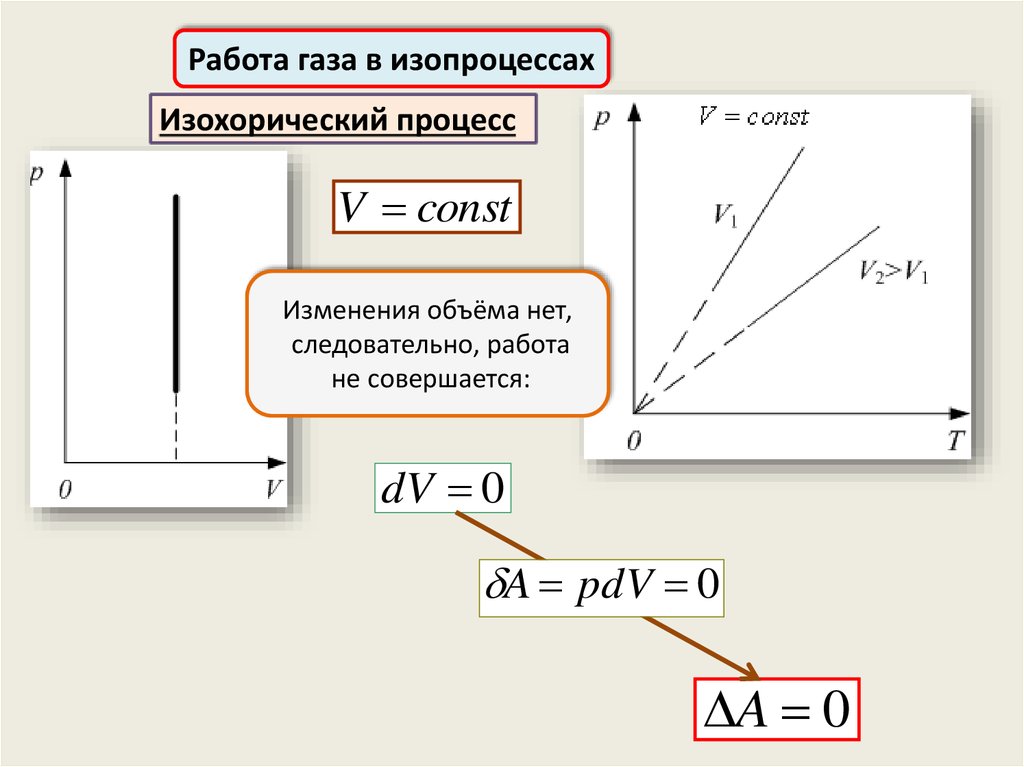
Работа газа в изопроцессахИзохорический процесс
V const
Изменения объёма нет,
следовательно, работа
не совершается:
dV 0
A pdV 0
A 0
12.
Работа газа в изопроцессахИзобарический процесс
V2
V2
V1
V1
A12 pdV p dV p V2 V1
A12 p V
p V1 RT1
p V2 RT2
A12 p V2 V1 pV2 pV1
Универсальная газовая
постоянная R численно A12 RT2 RT1 R T2 T1
равна работе одного моля
A12 R T
идеального газа при
изобарном нагревании на
A12
A
1 кельвин
R
R
T
dT
13.
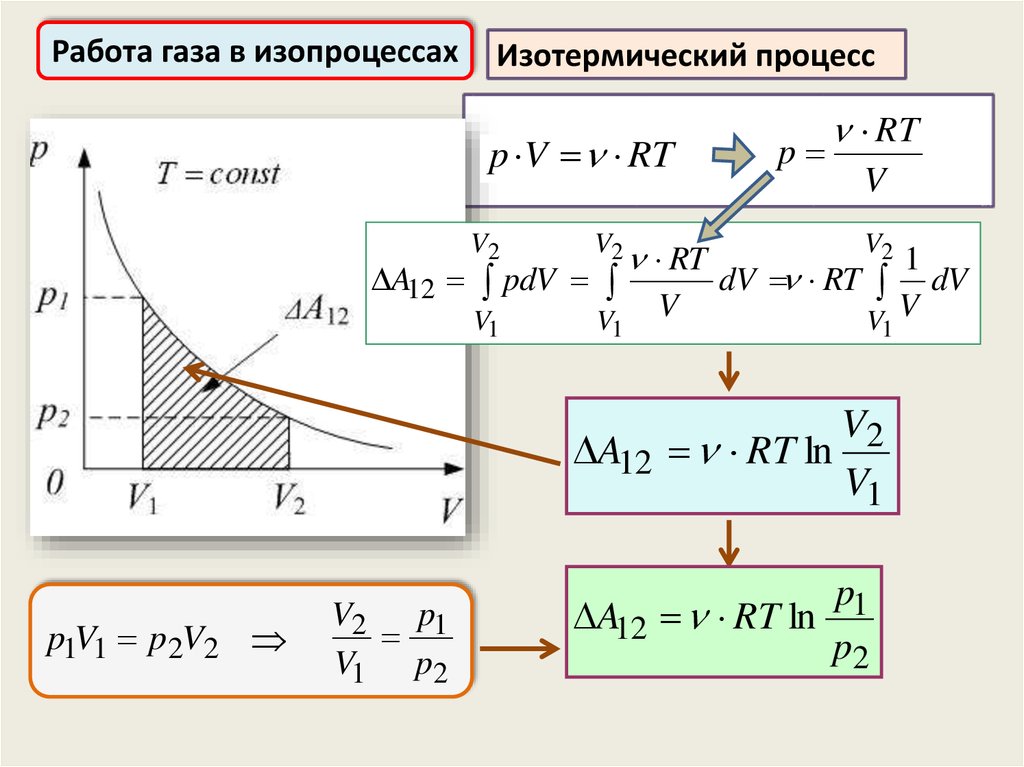
Работа газа в изопроцессахИзотермический процесс
p V RT
V2
V2
V1
V1
A12 pdV
RT
V
p
RT
V
V2
1
dV RT dV
V V
1
V2
A12 RT ln
V1
p1V1 p2V2
V2 p1
V1 p2
p1
A12 RT ln
p2
14.
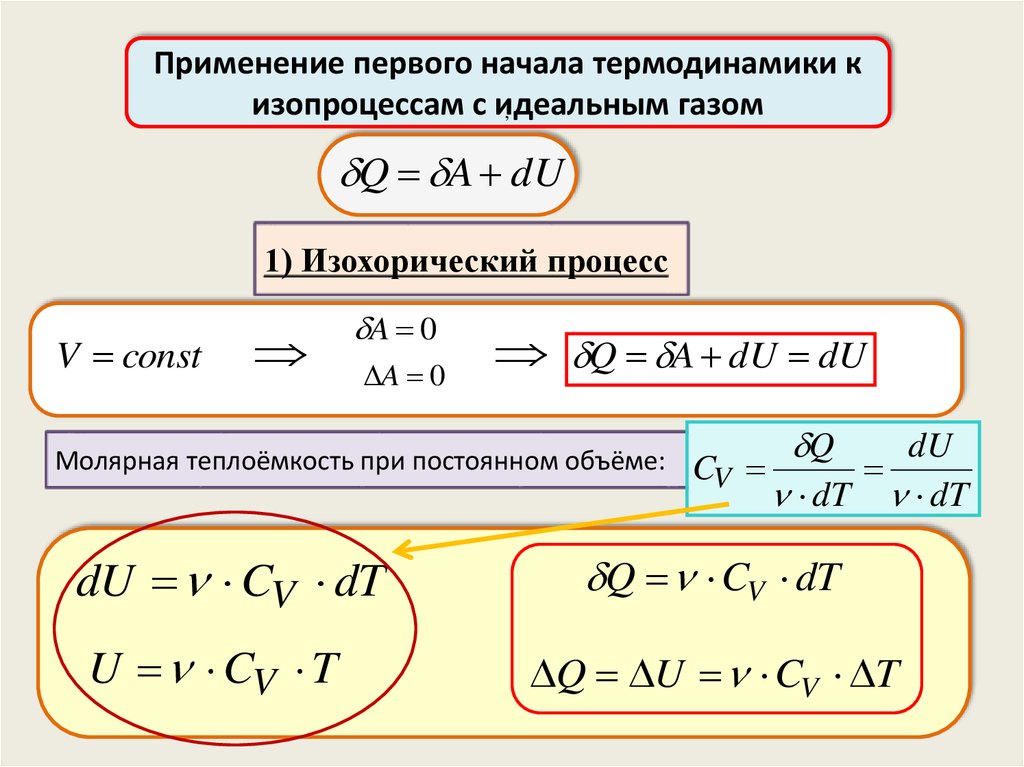
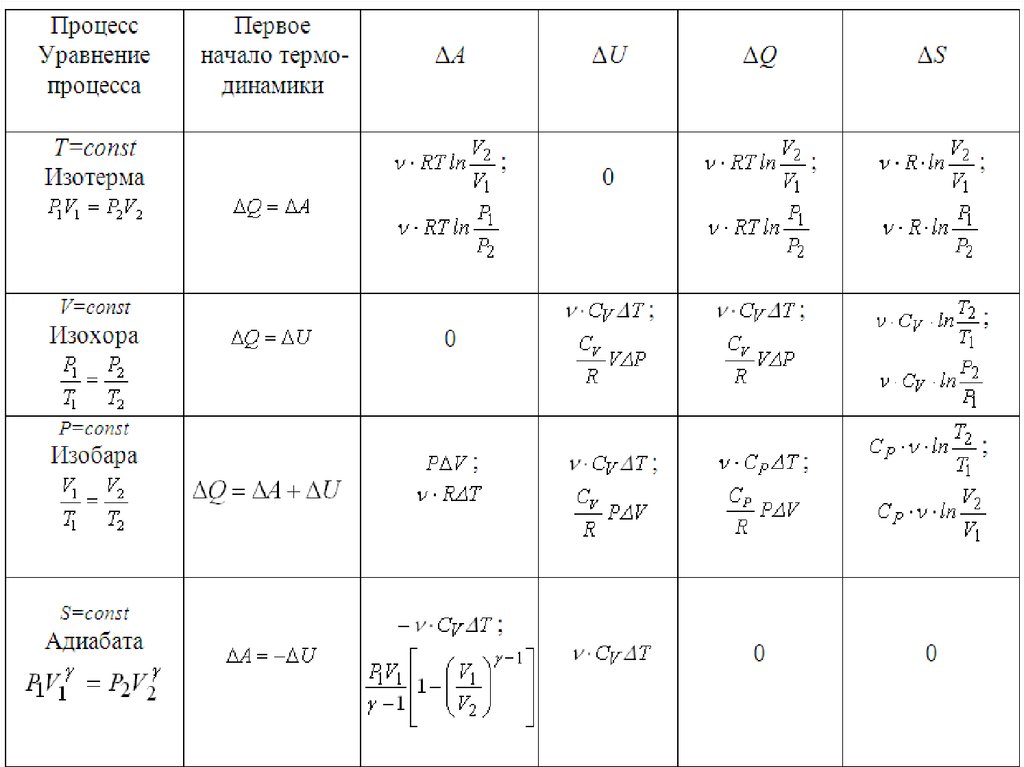
Применение первого начала термодинамики кизопроцессам с идеальным
газом
,
Q A dU
1) Изохорический процесс
V const
A 0
A 0
Q A dU dU
Молярная теплоёмкость при постоянном объёме:
dU CV dT
U CV T
Q
dU
CV
dT dT
Q CV dT
Q U CV T
15.
Применение первого начала термодинамики кизопроцессам с идеальным газом
2) Изобарический процесс
p const
A R dT
Q A dU R dT CV dT
dU CV dT
Q R CV dT C p dT
Молярная теплоёмкость
при постоянном давлении:
Cp
Q
dT
C p R CV
Уравнение Майера
Теплоёмкость при постоянном объёме оказывается меньше, так как газ
не совершает работу, и для нагревания газа на 1 К теплоты
требуется меньше: как раз на величину R, имеющей смысл работы
одного моля газа при постоянном давлении
16.
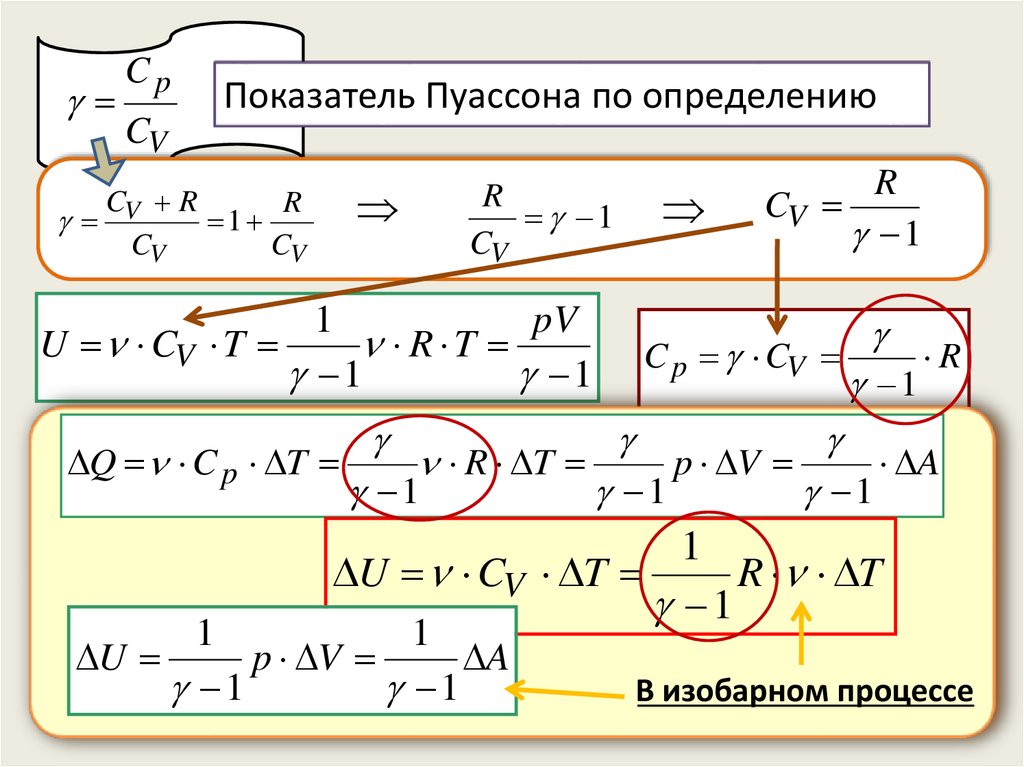
CpCV
Показатель Пуассона по определению
C R
R
V
1
CV
CV
R
1
CV
1
pV
U CV T
R T
1
1
Q C p T
R T
1
R
CV
1
C p CV
1
p V
1
1
R
A
1
U CV T
R T
1
1
1
U
p V
A
1
1
В изобарном процессе
17.
CpCV
Показатель Пуассона
R
CV
1
В изохорическом процессе:
R
Q U CV T
T
1
1
Q U
R T2 T1
1
1
RT2 RT1
Q U
1
1
1
p2V p1V
Q U
V p
1
1
18.
Применение первого начала термодинамики кизопроцессам с идеальным газом
3) Изотермический процесс
dT 0
T const
dU CV dT 0 U 0
Q A dU A p dV
V2
Q A U A 0 RT ln
RT ln
V1
p1
p2
19.
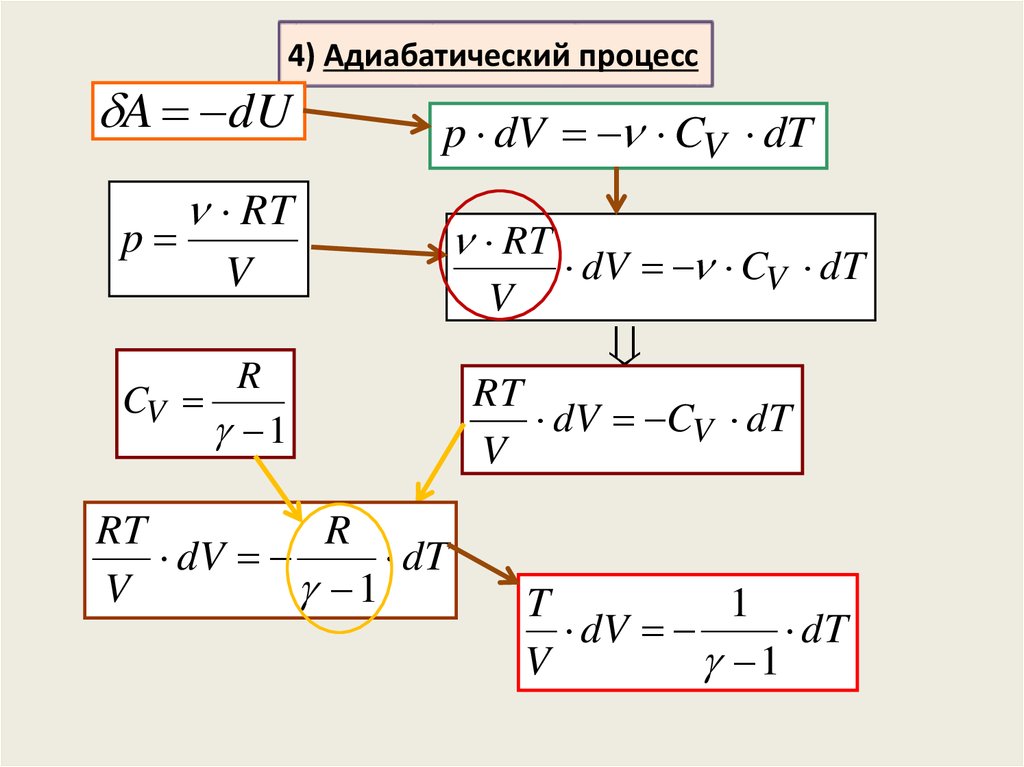
4) Адиабатический процесспротекает без теплообмена с
окружающей средой:
система не получает и не отдаёт теплоты
Q 0
Q 0
Адиабатными процессами будут процессы, протекающие
1) в системе с хорошей теплоизоляцией;
2) очень быстрые процессы, – система не успевает обменяться
теплотой с окружающей средой за время протекания процесса
По первому началу термодинамики:
Q A dU 0
A dU
20.
4) Адиабатический процессA dU
p
p dV CV dT
RT
V
R
CV
1
RT
R
dV
dT
V
1
RT
V
dV CV dT
RT
dV CV dT
V
T
1
dV
dT
V
1
21.
4) Адиабатический процессT
1
dV
dT
V
1
dV
dT
1
V
T
dV
dT
1 const
V
T
ln V 1 ln T const
1 ln V ln T const
ln T V 1 const
1 ln V ln T const
1
T V
const
22.
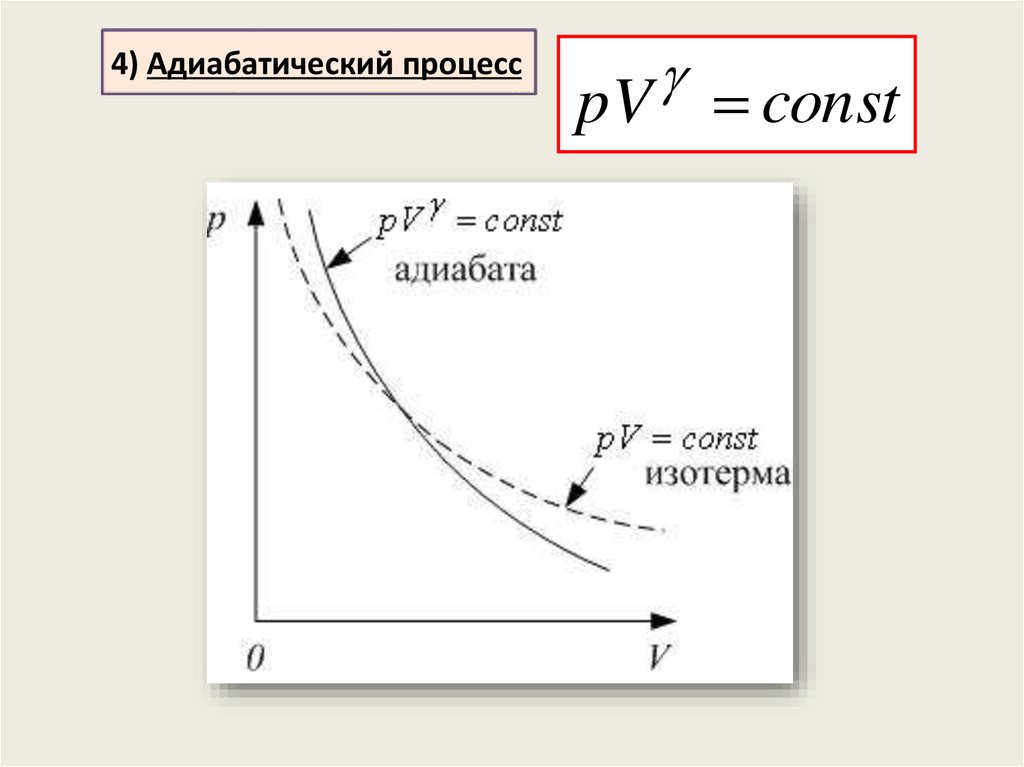
4) Адиабатический процессT V 1 const
p V
const
T
pV const
p V
const
T
1
T V
const
1 p V
T V
const
T
pV const
p V
1
p
p V
T
const
T const
23.
4) Адиабатический процессpV const
24.
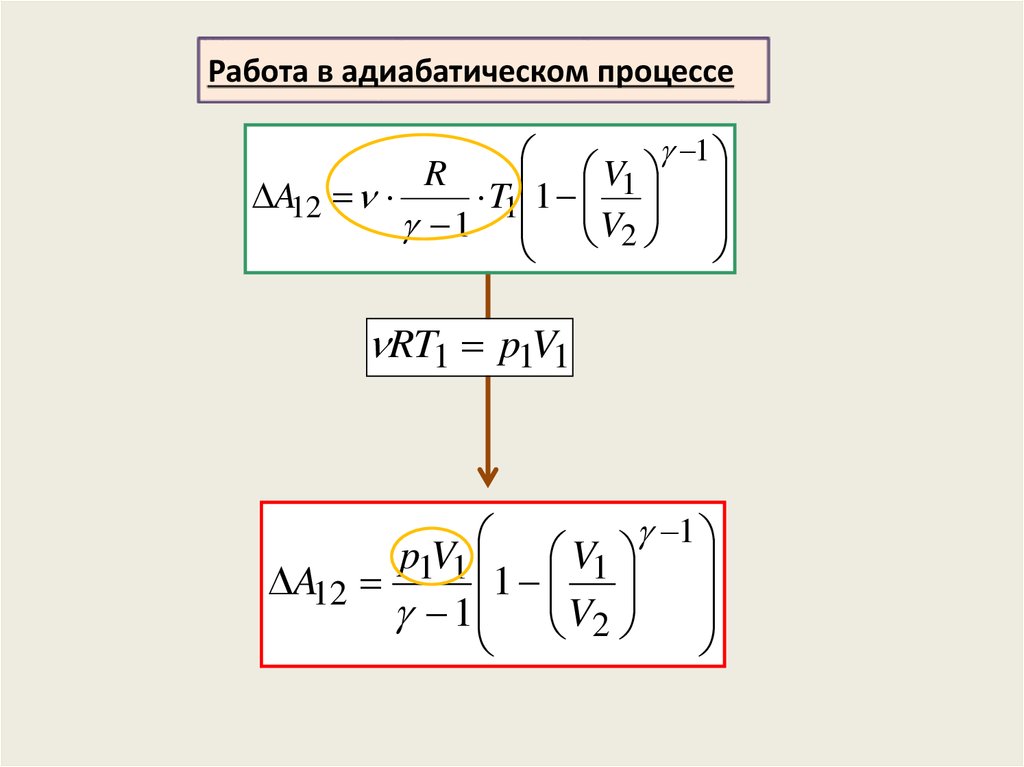
Работа в адиабатическом процессе1
T V
const
По первому началу термодинамики:
A12 U CV T2 T1
V
T2 T1 1
V2
1
T2 V2 1 T1 V1 1
V 1
A12 CV T1 1 T1
V2
1
V 1
V1
R
1
A12 CV T1 1
T1 1
V2
1 V2
25.
Работа в адиабатическом процессе1
V1
R
A12
T1 1
1 V2
RT1 p1V1
1
p1V1 V1
A12
1
1 V2
26.
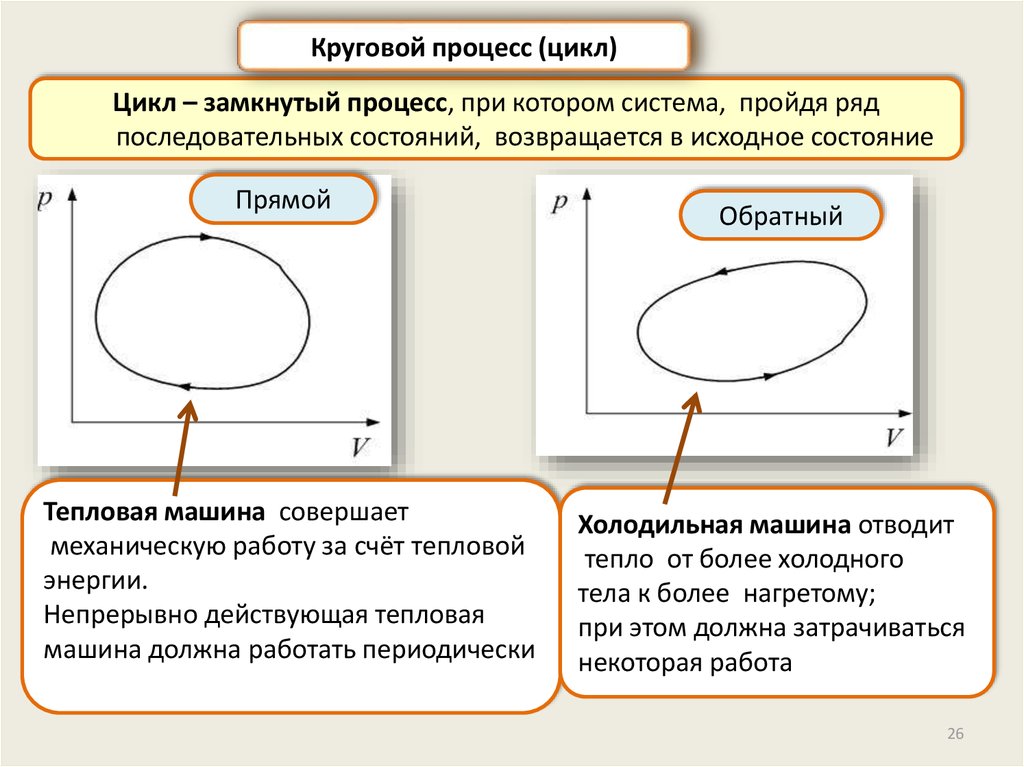
Круговой процесс (цикл)Цикл – замкнутый процесс, при котором система, пройдя ряд
последовательных состояний, возвращается в исходное состояние
Прямой
Тепловая машина совершает
механическую работу за счёт тепловой
энергии.
Непрерывно действующая тепловая
машина должна работать периодически
Обратный
Холодильная машина отводит
тепло от более холодного
тела к более нагретому;
при этом должна затрачиваться
некоторая работа
26
27.
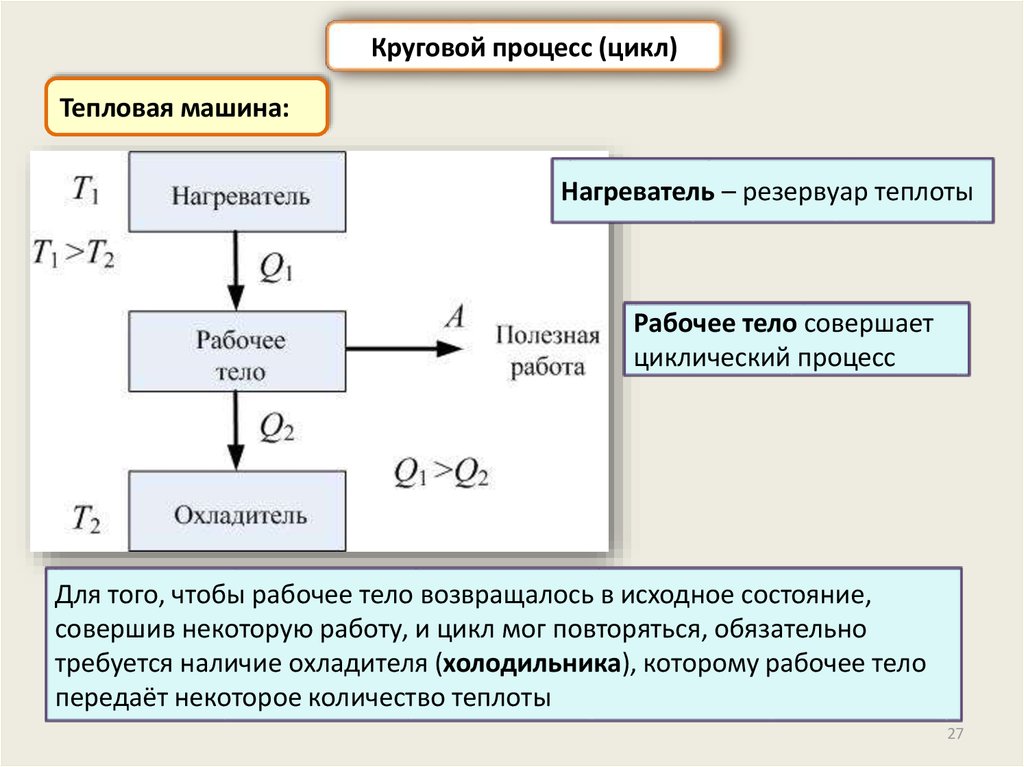
Круговой процесс (цикл)Тепловая машина:
Нагреватель – резервуар теплоты
Рабочее тело совершает
циклический процесс
Для того, чтобы рабочее тело возвращалось в исходное состояние,
совершив некоторую работу, и цикл мог повторяться, обязательно
требуется наличие охладителя (холодильника), которому рабочее тело
передаёт некоторое количество теплоты
27
28.
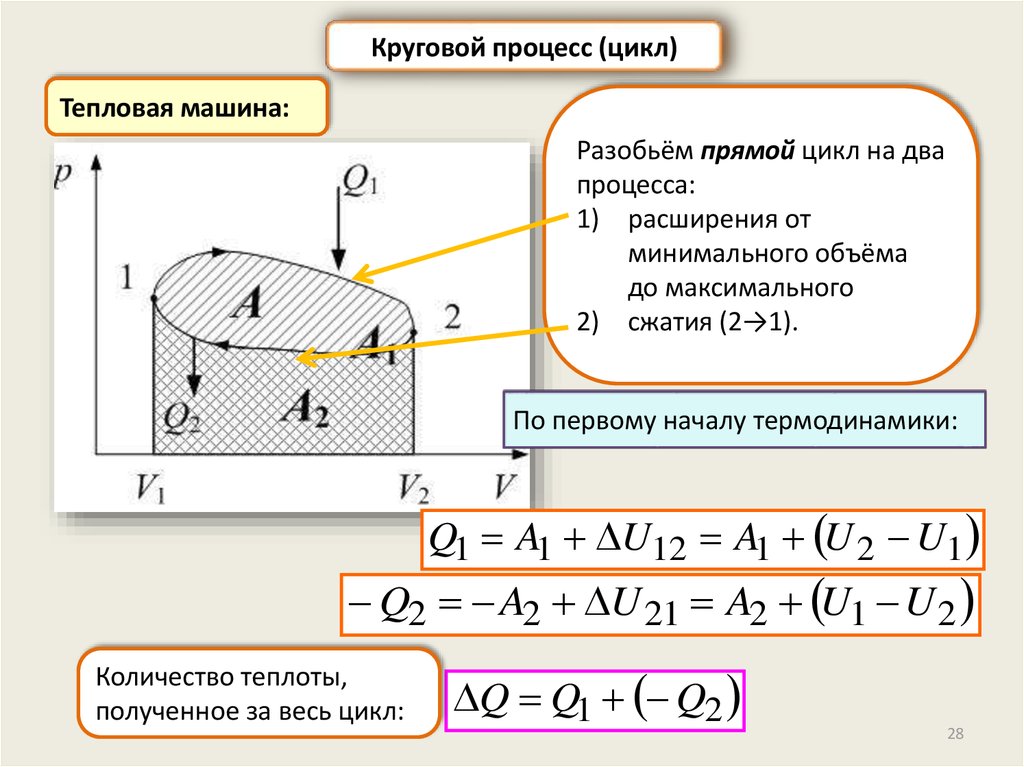
Круговой процесс (цикл)Тепловая машина:
Разобьём прямой цикл на два
процесса:
1) расширения от
минимального объёма
до максимального
2) сжатия (2→1).
По первому началу термодинамики:
Q1 A1 U12 A1 U 2 U1
Q2 A2 U 21 A2 U1 U 2
Количество теплоты,
полученное за весь цикл:
Q Q1 Q2
28
29.
Круговой процесс (цикл). КПД циклаТепловая машина:
1-2
Q1 A1 U12 A1 U 2 U1
2-1
Q2 A2 U 21 A2 U1 U 2
Количество теплоты, полученное за весь
цикл, равно работе за цикл.
Внутренняя энергия не изменилась
Q Q1 Q2 A1 A2 A
A Q1 Q2
Q2
1
1
Q1
Q1
Q1
29
30.
Второе начало термодинамикиОпыт показывает, что нельзя построить тепловую машину, которая ВСЮ
полученную от нагревателя теплоту превращает в работу, то есть
машину с КПД=1 (вечный двигатель второго рода)
Формулировка Томсона:
Невозможен вечный
двигатель II рода
Невозможен процесс, единственным результатом которого
является превращение теплоты, полученной от
нагревателя, в эквивалентную ей работу
Формулировка Клаузиуса:
Невозможен процесс, единственным результатом
которого является передача теплоты от более холодного
тела к более нагретому
Теплота сама собой может переходить
только от нагретого к холодному
30
31.
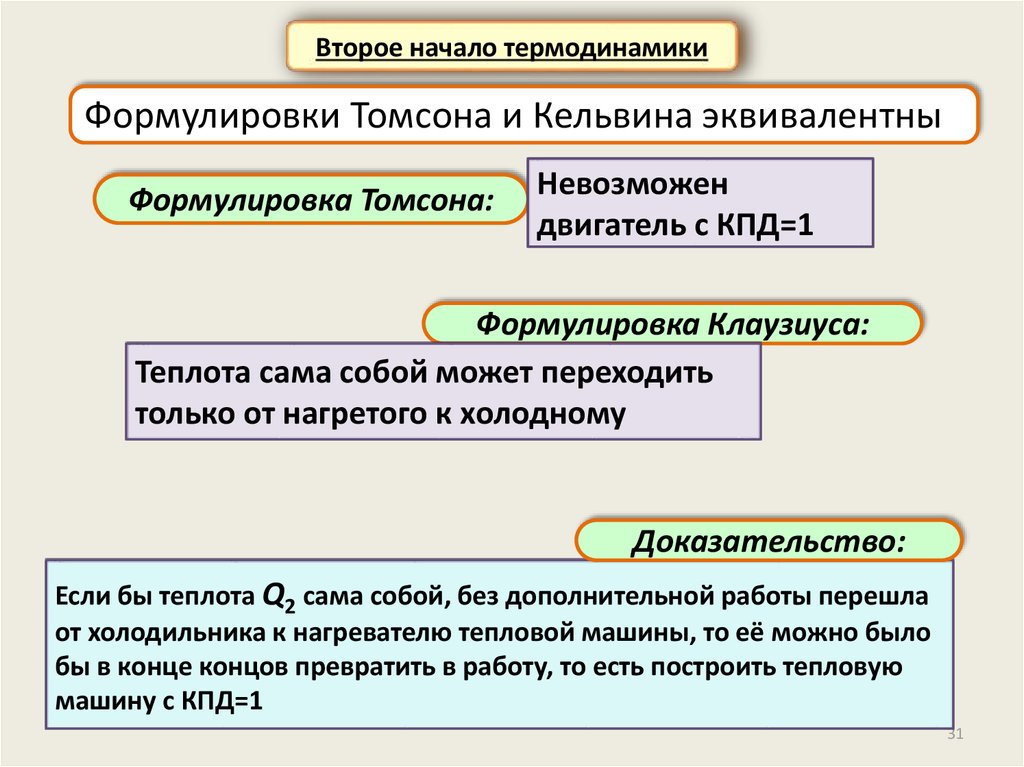
Второе начало термодинамикиФормулировки Томсона и Кельвина эквивалентны
Формулировка Томсона:
Невозможен
двигатель с КПД=1
Формулировка Клаузиуса:
Теплота сама собой может переходить
только от нагретого к холодному
Доказательство:
Если бы теплота Q2 сама собой, без дополнительной работы перешла
от холодильника к нагревателю тепловой машины, то её можно было
бы в конце концов превратить в работу, то есть построить тепловую
машину с КПД=1
31
32.
Обратимые и необратимые процессыТермодинамический процесс называется обратимым, если он может
проходить как в прямом, так и в обратном направлении; при этом после
возвращения системы в исходное состояние в окружающей среде и в
самой системе не происходит никаких изменений
Пример обратимого процесса:
абсолютно упругое соударение
Примеры необратимых процессов: неупругое соударение,
трение, диффузия, теплопроводность
Обратимые процессы – идеализация
Все реальные процессы в той или иной степени необратимы
Равновесный (квазистатический) процесс представляет собой
непрерывную последовательность равновесных состояний.
Любая точка такого процесса – состояние равновесия, из которого
система может идти как в прямом, так и в обратном направлении.
Отсюда следует, что любой равновесный процесс обратим.
Только равновесные процессы можно изображать графически
В обратимых процессах система совершает максимальную работу
КПД максимален
32
33.
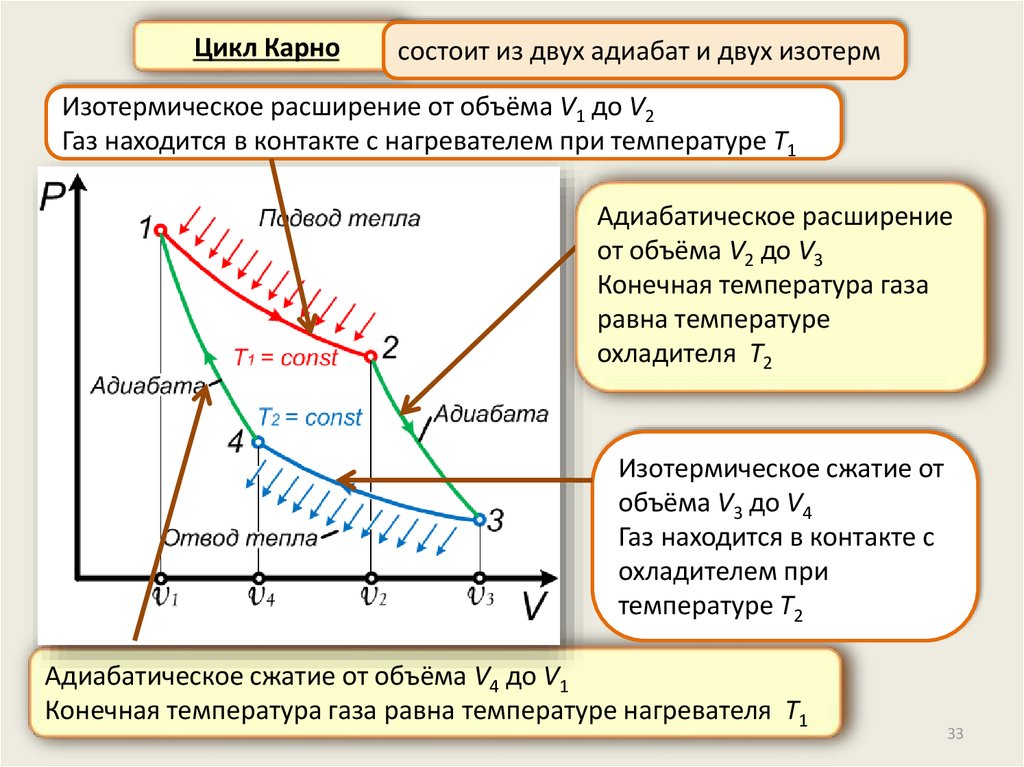
Цикл Карносостоит из двух адиабат и двух изотерм
Изотермическое расширение от объёма V1 до V2
Газ находится в контакте с нагревателем при температуре T1
Адиабатическое расширение
от объёма V2 до V3
Конечная температура газа
равна температуре
охладителя T2
Изотермическое сжатие от
объёма V3 до V4
Газ находится в контакте с
охладителем при
температуре T2
Адиабатическое сжатие от объёма V4 до V1
Конечная температура газа равна температуре нагревателя T1
33
34.
Цикл Карно. КПД цикла КарноV2
Q1 A12 RT1 ln
V1
V3
Q2 A34 RT2 ln
V4
T1V1 1 T2V4 1
T1V2 1 T2V3 1
V2 V3
V1 V4
Q1 Q2
к
Q1
T1 T2
к
T1
к
V2
V
RT2 ln 3
V1
V4
V
RT1 ln 2
V1
RT1 ln
34
35.
Теорема Карно1) КПД цикла Карно не зависит от природы рабочего тела и
определяется только температурами нагревателя и
охладителя:
T T
к
1
2
T1
2) КПД любого обратимого цикла не больше КПД цикла
Карно с теми же температурами нагревателя и охладителя:
T1 T2
обр. К
T1
3) КПД любого необратимого цикла меньше КПД цикла
Карно с теми же температурами нагревателя и охладителя:
T1 T2
необр. К
T1 35
36.
ЭнтропияПонятие энтропии введено Клаузиусом
По определению Клаузиуса, функция состояния системы, дифференциал
которой в обратимом процессе равен отношению теплоты, полученной
системой, к температуре системы , называется энтропией
dS
Q
T
Энтропия – функция состояния системы
Функция состояния – это такая величина, значения которой
однозначно определяются состоянием системы, а изменение функции
состояния при переходе системы из одного состояния в другое
определяется только начальным и конечным состояниями системы и не
зависят от пути перехода
Внутренняя энергия U – тоже функция состояния:
U CV T
U CV T2 T1
36
37.
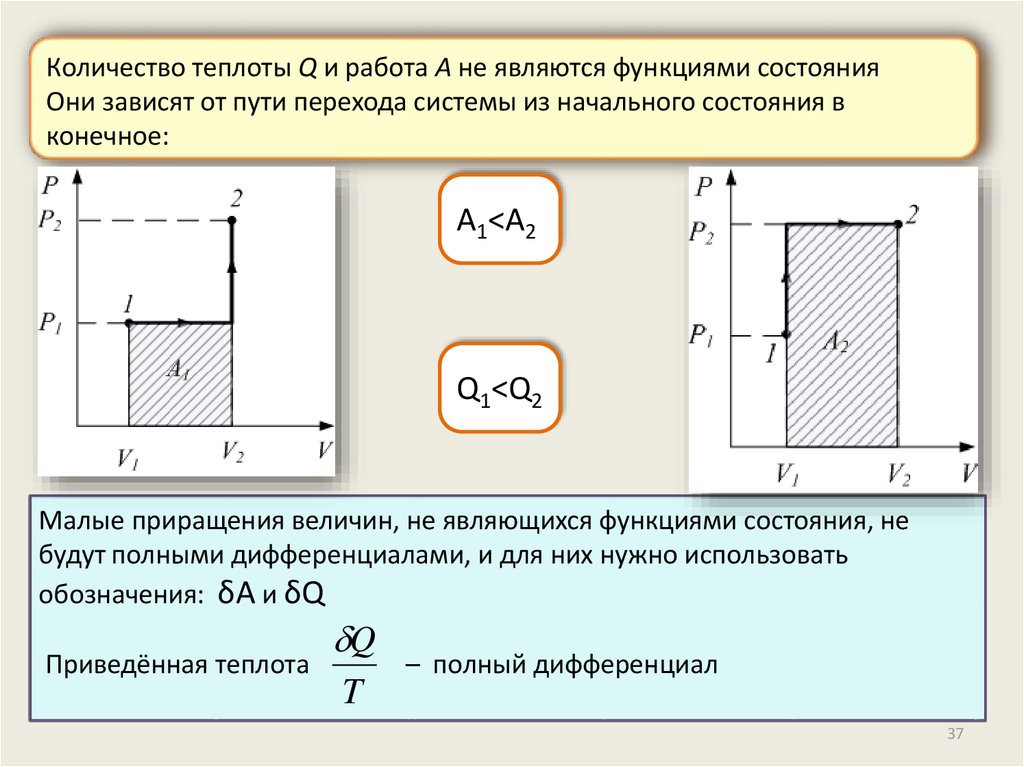
Количество теплоты Q и работа A не являются функциями состоянияОни зависят от пути перехода системы из начального состояния в
конечное:
A1<A2
Q1<Q2
Малые приращения величин, не являющихся функциями состояния, не
будут полными дифференциалами, и для них нужно использовать
обозначения: δA и δQ
Приведённая теплота
Q
T
– полный дифференциал
37
38.
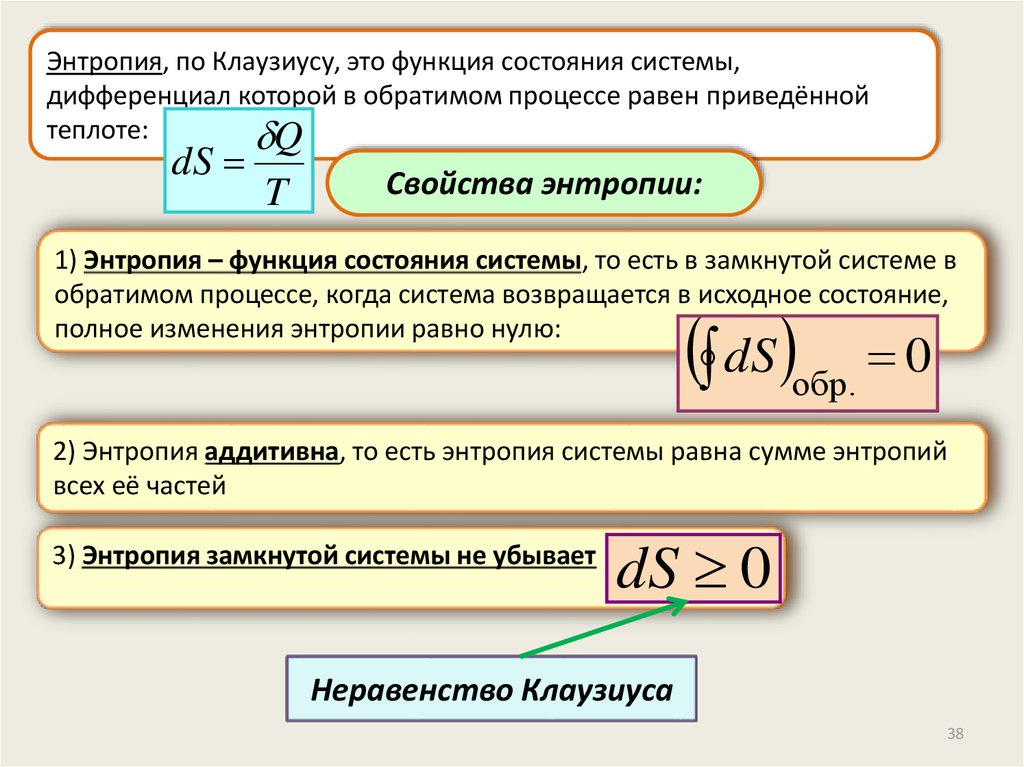
Энтропия, по Клаузиусу, это функция состояния системы,дифференциал которой в обратимом процессе равен приведённой
теплоте:
Q
dS
T
Свойства энтропии:
1) Энтропия – функция состояния системы, то есть в замкнутой системе в
обратимом процессе, когда система возвращается в исходное состояние,
полное изменения энтропии равно нулю:
dS обр. 0
2) Энтропия аддитивна, то есть энтропия системы равна сумме энтропий
всех её частей
3) Энтропия замкнутой системы не убывает
dS 0
Неравенство Клаузиуса
38
39.
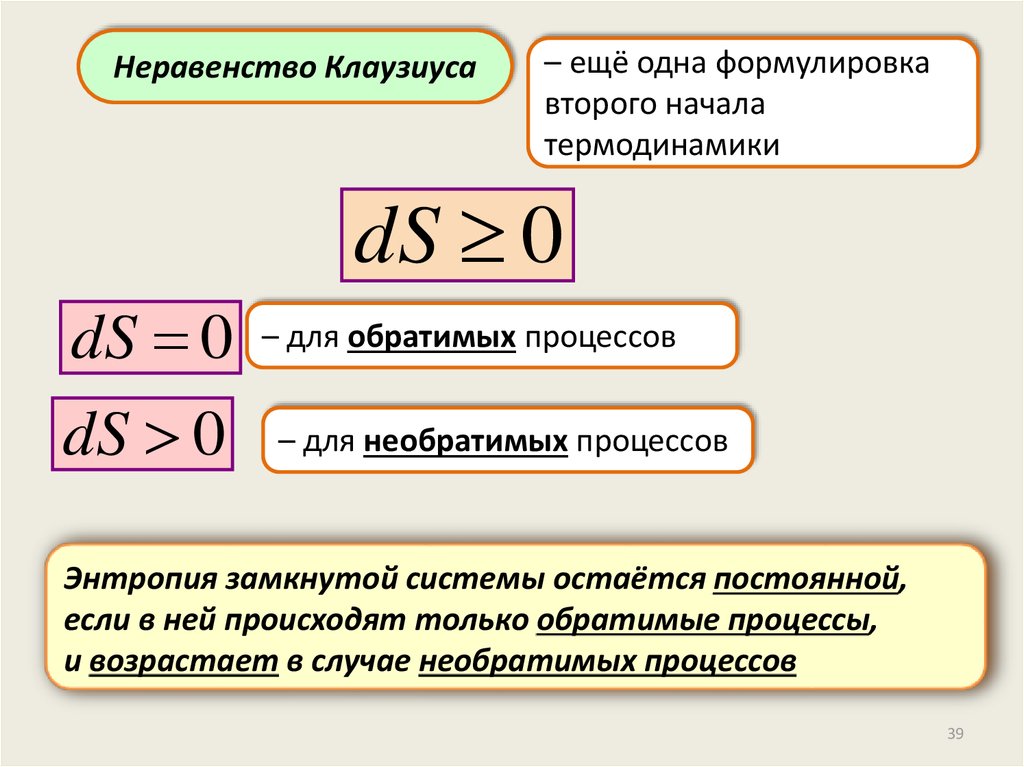
Неравенство Клаузиуса– ещё одна формулировка
второго начала
термодинамики
dS 0
dS 0
dS 0
– для обратимых процессов
– для необратимых процессов
Энтропия замкнутой системы остаётся постоянной,
если в ней происходят только обратимые процессы,
и возрастает в случае необратимых процессов
39
40.
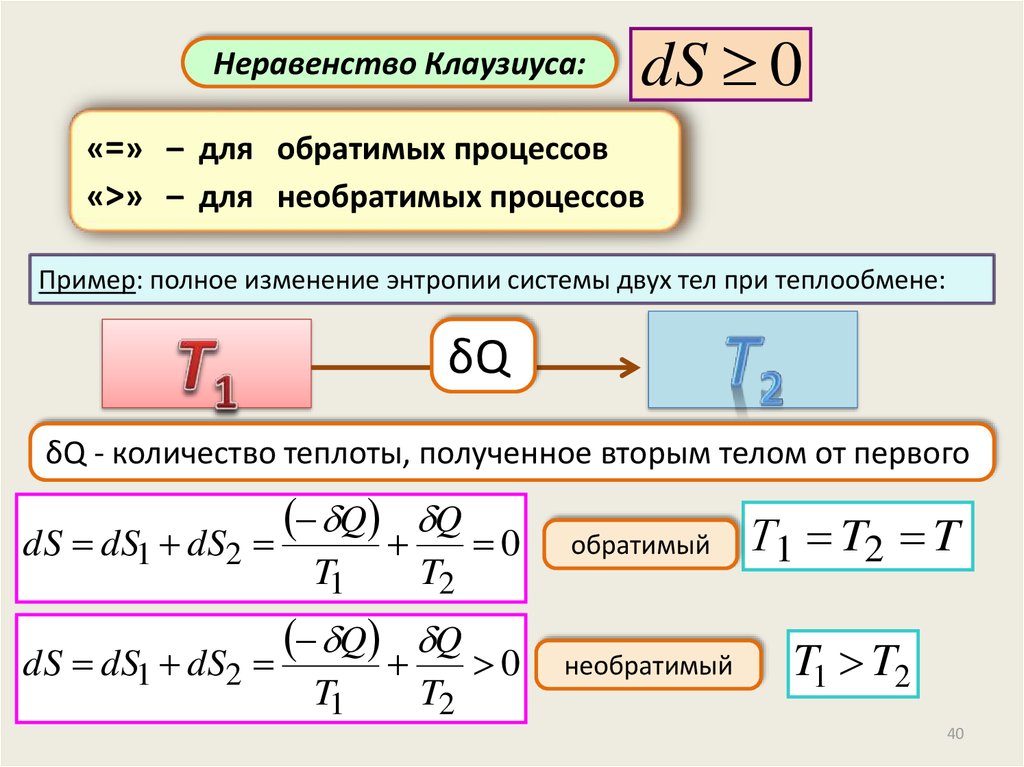
Неравенство Клаузиуса:dS 0
«=» – для обратимых процессов
«>» – для необратимых процессов
Пример: полное изменение энтропии системы двух тел при теплообмене:
δQ
δQ - количество теплоты, полученное вторым телом от первого
dS dS1 dS2
Q Q
0
обратимый
Т1 T2 T
dS dS1 dS2
Q Q
0
необратимый
T1 T2
T1
T1
T2
T2
40
41.
Изменение энтропии при изопроцессах с идеальным газомdS
Q
Q A dU
T
2
1 Q
1
1 T
S dS
2 A dU
1
T
2 A
1T
P R
T V
V2
S
V1
R dV
V
2 dU
1 T
2 PdV
1 T
2 dU
1 T
dU CV dT
2 C dT
V2
T2
V
R ln
CV ln
T
V1
T1
1
Энтропия увеличивается при расширении газа и при его нагревании
41
42.
Изменение энтропии при изопроцессах с идеальным газом1) Изохорный процесс V1 V2 T2 P2 S R ln V2 CV ln T2
V1
T1
T1 P1
T2
p2
S CV ln CV ln
T1
p1
2) Изобарный процесс p1 p2 T2 V2
T1 V1 C P CV R
T2
T2
T2
T2
S R ln CV ln R CV ln C p ln
T1
T1
T1
T1
3) Изотермический процесс T1 T2 V2
V1
V2
P1
S R ln
R ln
V1
4) Адиабатный процесс
P2
Q 0
dS
P1
P2
Q
T
0
S 0
42
43.
44.
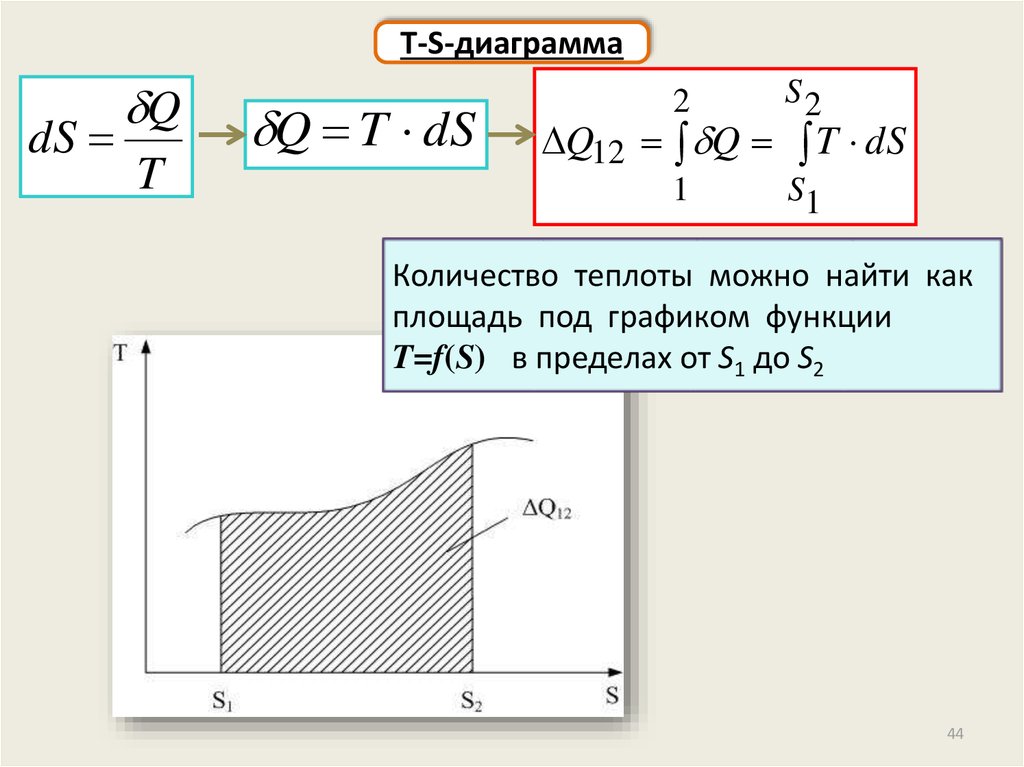
T-S-диаграммаdS
Q
T
Q T dS
2
S2
1
S1
Q12 Q T dS
Количество теплоты можно найти как
площадь под графиком функции
T=f(S) в пределах от S1 до S2
44
45.
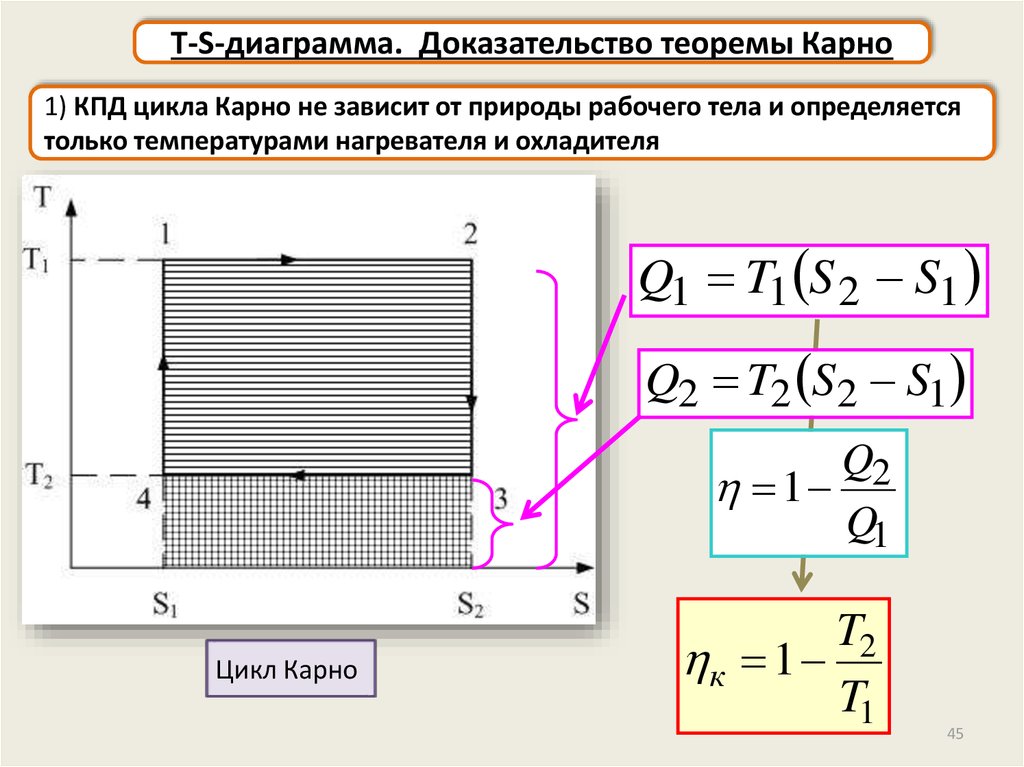
T-S-диаграмма. Доказательство теоремы Карно1) КПД цикла Карно не зависит от природы рабочего тела и определяется
только температурами нагревателя и охладителя
Q1 T1 S 2 S1
Q2 T2 S2 S1
Q2
1
Q1
Цикл Карно
T2
к 1
T1
45
46.
T-S-диаграмма. Доказательство теоремы Карно2) КПД любого обратимого цикла не больше КПД цикла Карно с теми
же температурами нагревателя и охладителя
Рассмотрим произвольный обратимый цикл abcda с температурами
нагревателя и холодильника Т1 и Т2
Площадь под abc
Q1 Q1Карно
Площадь под 1-2
Q2 Карно
Q2
обр. 1
1
к
Q1
Q1Карно
T1 T2
обр. К
T1
Площадь под adc
Q2 Q2Карно
Площадь под 3-4
46
47.
T-S-диаграмма. Доказательство теоремы Карно3) КПД любого необратимого цикла меньше КПД цикла
Карно с теми же температурами нагревателя и охладителя
Рассмотрим произвольный обратимый цикл
с температурами нагревателя и холодильника Т1 и Т2
Из-за необратимости максимальная температура рабочего
тела Т1Р.Т. будет меньше Т1, а минимальная Т2Р.Т. – больше Т2:
Т1Р.Т.<Т1
Т2Р.Т. >Т2
Т 2 Р.Т .
Т2
необр. 1
1
К
Т1Р.Т .
Т1
T1 T2
необр. К
T1
47
48.
Термодинамические функции. Свободная энергияИз второго начала термодинамики вытекает, что не вся внутренняя энергия
нагретого тела может быть превращена в эквивалентную ей работу; иначе
можно было бы создать тепловую машину с КПД, равным 100%
F U T S
– по определению
Свободная энергия F – часть внутренней энергии, которую можно
превратить в работу в изотермическом процессе
dF dU T dS S dT Q T dS
dF dU Q S dT
Q dU A
dF A S dT
В изотермическом процессе dT=0
Работа, совершаемая системой в обратимом изотермическом
процессе, равна убыли свободной энергии системы:
TS – «связанная» энергия (не может быть
превращена в теплоту при постоянной температуре)
dF A
48
49.
Термодинамические функции. Энтальпия.
Энтальпией H называется функция состояния, равная:
H U P V
(по определению)
При постоянном давлении:
Q dU A dU P dV d U P V dH
Физический смысл энтальпии:
Изменение энтальпии системы при постоянном давлении
равно количеству теплоты, сообщённому системе
Q dH
Энтальпия - теплосодержание
49
50.
Термодинамическая вероятность состояния системы(статистический вес)
Понятие энтропии ввёл Клаузиус, а физический смысл её
выяснил Больцман.
Он предположил, что энтропия связана с
термодинамической вероятностью состояния системы
Определение:
Термодинамическая вероятность (статистический вес)
состояния системы w – число микросостояний
(способов), которыми может быть реализовано данное
макросостояние
50
51.
w – число микросостояний (способов), которыми может быть реализованоданное макросостояние
Пример 1:
Рассмотрим ящик, содержащий молекулы. Мысленно разделим его пополам. Если
число молекул в ящике равно N=2, то возможны следующие 4 способа разместить
эти две молекулы по двум одинаковым половинам ящика:
Полное число способов
размещения молекул NСП.=4
Термодинамическая вероятность такого состояния, когда обе молекулы
соберутся в одной (например, левой) половине, равна 1: w1=1; это способ №1
Число микросостояний равномерного распределения молекул равно
wРАВН.=2; это способы №3 и 4
Соответствующие математические вероятности:
p1
2
1
p РАВН.
4
4
51
52.
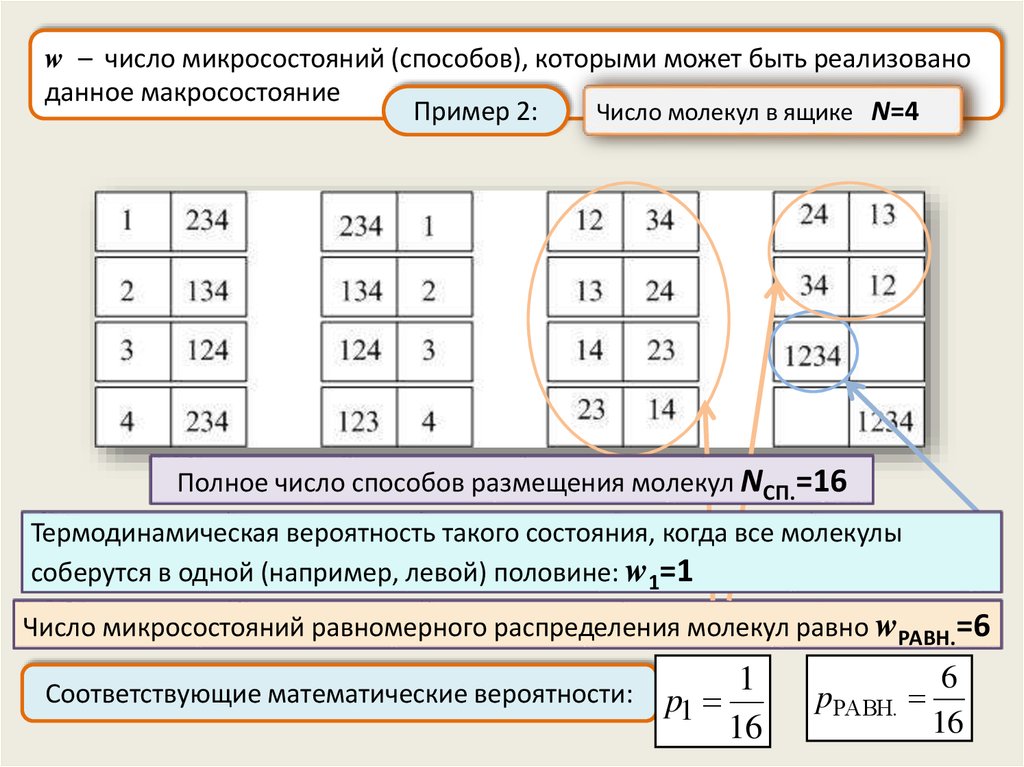
w – число микросостояний (способов), которыми может быть реализованоданное макросостояние
Число молекул в ящике N=4
Пример 2:
Полное число способов размещения молекул NСП.=16
Термодинамическая вероятность такого состояния, когда все молекулы
соберутся в одной (например, левой) половине: w1=1
Число микросостояний равномерного распределения молекул равно wРАВН.=6
Соответствующие математические вероятности:
1
p1
16
pРАВН.
6
16
52
53.
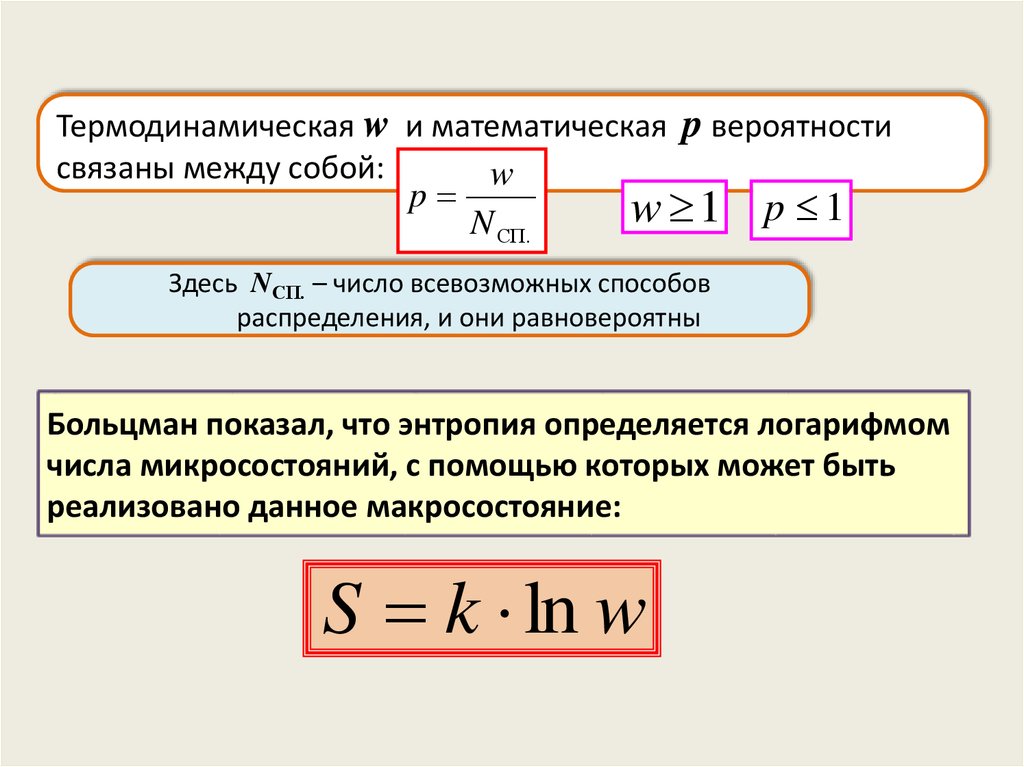
Термодинамическая w и математическая p вероятностисвязаны между собой:
w
p
w 1 p 1
N СП.
Здесь NСП. – число всевозможных способов
распределения, и они равновероятны
Больцман показал, что энтропия определяется логарифмом
числа микросостояний, с помощью которых может быть
реализовано данное макросостояние:
S k ln w
54.
Физический смысл энтропии SБолее вероятное состояние оказывается менее
упорядоченным:
для четырёх молекул
w1=1 (более упорядоченное состояние)
wРАВН.=6
Для большого числа молекул разница окажется гораздо
большей:
менее упорядоченное состояние, когда молекулы
распределяются равномерно, имеет существенно большую
термодинамическую вероятность, чем упорядоченное
состояние, когда все молекулы соберутся в одной половине
ящика
Энтропия – мера неупорядоченности
54
55.
Статистический смысл второго начала термодинамикиПо второму началу термодинамики,
энтропия замкнутых систем не убывает:
S 0
В соответствии с формулой Больцмана S k ln w все реальные
процессы идут в сторону наибольшей термодинамической вероятности;
при обратимых процессах w=const
При малом числе молекул все молекулы могут случайно в какой-то момент
времени в результате теплового движения собраться в одной половине
ящика. Вероятность такого события не мала:
p1
1
16
1
p
1
(N=4) и
4 (N=2)
При малом числе молекул в результате флуктуаций статистический вес
состояния может уменьшиться. Это происходит потому, что второе начало
термодинамики неприменимо к системам с малым числом частиц
Если молекул в ящике много, вероятность того, что все молекулы в
результате теплового движения в какой-то момент времени соберутся
в одной половине, равна нулю
Второе начало термодинамики – статистический закон,
выражающий закономерности большого числа частиц 55
56.
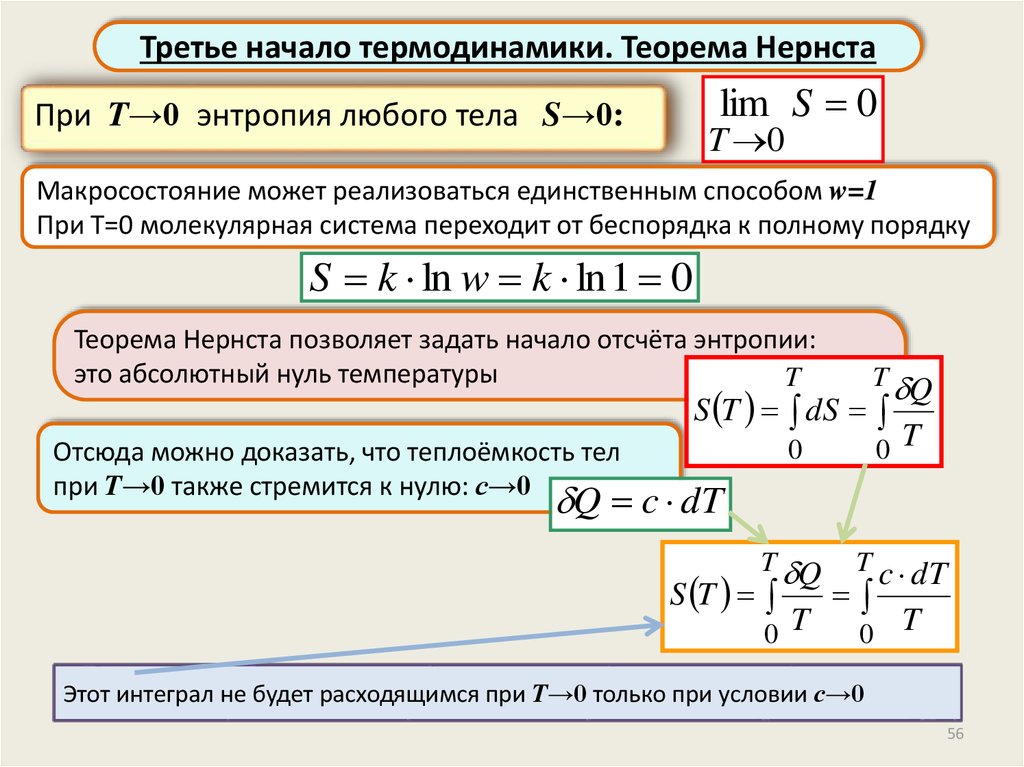
Третье начало термодинамики. Теорема Нернстаlim S 0
При T→0 энтропия любого тела S→0:
T 0
Макросостояние может реализоваться единственным способом w=1
При Т=0 молекулярная система переходит от беспорядка к полному порядку
S k ln w k ln 1 0
Теорема Нернста позволяет задать начало отсчёта энтропии:
это абсолютный нуль температуры
T
T Q
S T dS
0
0 T
T Q
T c dT
Отсюда можно доказать, что теплоёмкость тел
при T→0 также стремится к нулю: с→0
Q c dT
S T
0 T
0
T
Этот интеграл не будет расходящимся при T→0 только при условии с→0
56
57.
Второе начало термодинамикиТеория тепловой смерти вселенной
В связи со вторым началом термодинамики в середине 19 века возникла
теория «тепловой смерти Вселенной».
Рассматривая Вселенную как замкнутую систему, применили к ней второе
начало термодинамики и получили, что энтропия должна достигнуть
максимума, то есть все формы движения перейдут в тепловое
движение.
Температура выровняется, возникнет полное тепловое равновесие.
Всякие процессы, кроме теплового движения, прекратятся
Но вследствие тяготения однородное изотермическое распределение
вещества не соответствует максимуму энтропии
Вселенная не стационарна – она расширяется.
Однородное вещество из-за действия сил тяготения распадается, образуя
звёзды, скопления, Галактики.
Эти процессы происходят с возрастанием энтропии (при расширении
энтропия возрастает), но не приводят к тепловой смерти
57
58.
Второе начало термодинамикиНаправленность физических процессов (стрела времени)
В законах Ньютона можно обратить время, заменив переменную: t→(–t).
Например, при абсолютно упругом ударе скорости до и после удара
меняются ролями, а законы, описывающие их, одни и те же.
Ньютоновская механика детерминирована, то есть, зная начальные
условия (скорости, координаты, силы), можно найти координаты в
любой момент времени (в будущем или в прошлом).
Следовательно, Ньютоновская механика не даёт ответа на вопрос о
направленности физических процессов
Ответ на вопрос о «стреле времени» даёт второе начало термодинамики:
все процессы протекают в сторону увеличения энтропии.
Второе начало термодинамики имеет ещё и философское значение:
отвечает на вопрос, почему так, а не иначе, течёт время: только из
прошлого в будущее, и не наоборот
58
59.
Второе начало термодинамикиЭнтропия и информация
Понятие энтропии S связано с понятием информации I.
Энтропия есть мера недостатка информации о системе.
Пример: при испарении жидкости исчезает макроскопическая
информация о нахождении молекул в определённом объёме
пространства; энтропия возрастает
Информация по определению:
I log 2 p , p – вероятность события
Пример: при бросании монеты есть две возможности;
вероятность выпадения решки p=1/2; следовательно, I=1 бит
Можно измерять энтропию и информацию в одинаковых
термодинамических единицах: I k ln w
Тогда имеет место закон сохранения:
S I const
59
60.
Эволюция открытых системРассмотрим развитие открытых систем с точки зрения термодинамики.
К таким системам относятся живые организмы (человек, в частности).
В равновесных или почти равновесных системах не может происходить
образование новых структур, нет биологического отбора и эволюции
Но в системах, находящихся вдали от равновесия и описывающихся
неравновесной термодинамикой, это возможно.
Такие системы называются диссипативными: в отдельных точках
системы происходят химические превращения, диффузия и другие
процессы переноса (то есть диссипативные процессы). Связь между
соседними элементами объёма происходит за счёт явлений переноса.
Возникающие в неравновесных системах флуктуации (случайные
отклонения параметров от средних значений) в результате
взаимодействия со средой будут усиливаться и в конце концов
приведут к разрушению прежнего порядка и возникновению новой
структуры.
Между элементами системы возникают новые согласованные связи;
структура усложняется
60
61.
Ячейки БенараНагревают снизу плоский слой жидкости.
С ростом теплого потока снизу вверх увеличивается
неравновесность системы.
Пока gradT невелик, механизм переноса тепла
обеспечивается тепловым хаотическим
движением молекул
При дальнейшем нагревании начинается
беспорядочная конвекция.
Если gradT превысит некоторое критическое
значение, то пространственное
распределение встречных потоков
самоорганизуется и возникает выраженная
стабильная структура, состоящая из
шестиугольных ячеек Бенара
62.
Эволюция открытых системВ диссипативных системах порядок и новая структура
возникают благодаря усилению флуктуаций, а они
зависят от интенсивности взаимодействия со средой.
Эволюция – непрерывное взаимодействие среды и
системы
Общие условия развития процессов самоорганизации:
1) Появление неустойчивости в исходной системе
(неравновесность)
2) Открытость системы
62
63.
Эволюция открытых системВ открытой системе возникает стационарное состояние, которое может находиться далеко
от равновесия. Эволюция таких неравновесных динамических систем определяется её
динамическими свойствами и механизмами регуляции, а не статистической
упорядоченностью начального и конечного состояний (согласно классической
термодинамике).
Возникающая структура поддерживается за счёт постоянного притока энергии и вещества
извне и может быть только в открытых системах. Поток энергии и вещества в этих условиях
может упорядочить систему и уменьшить её энтропию.
Система в ходе эволюции производит энтропию, которая рассеивается в окружающей среде.
Вместо неё из среды поступает «негэнтропия» (отрицательная энтропия) вместе с энергией
и веществом. Для открытой системы приращение энтропии dS равно сумме двух вкладов:
dS=diS+deS,
где diS – производство энтропии внутри системы, diS≥0; deS – поток энтропии,
обусловленный обменом веществом и энергией со средой. В стационарном состоянии
должно быть: dS=0, то есть стационарное состояние поддерживается только за счёт
увеличения энтропии среды: deS<0. Производимая в системе энтропия должна уходить во
внешнюю среду, энтропия среды увеличивается.
Шрёдингер: «Организм питается отрицательной энтропией (негэнтропией)».
Отрицательный поток энтропии в систему может компенсировать производство энтропии
внутри системы.
Действие второго закона термодинамики для системы организм+среда сохраняется. Таким
образом, возникновение и развитие жизни на Земле не противоречит второму закону
термодинамики
63
64.
СинергетикаСинергетика – наука о закономерностях самоорганизации
сложных неравновесных открытых систем
Синергетика претендует на то, чтобы объяснить и дать
возможность спрогнозировать поведение самых
разных структур и систем:
рынки акций,
транспортные потоки,
общественное поведение насекомых,
развитие опухоли и погоды и т.д
Выявляются общие законы развития сложных систем,
будь то системы физические, биологические или
социальные
64








































 physics
physics








