Similar presentations:
Термодинамика и теплопередача. Задачи
1.
Учебный курс«Термодинамика и теплопередача»
(Практическое занятие 1)
Для студентов по направлению подготовки
131000 Нефтегазовое дело
(квалификация (степень) «бакалавр»)
Преподаватель: д.т.н., профессор Уразбахтин Фёдор Асхатович
2. Контрольная работа 1.
Задача 1.1. Определить характеристики термодинамического
процесса:
а) универсальную газовую постоянную смеси газов;
б) показатель политропы;
в) теплоту термодинамического процесса;
г) изменение внутренней энергии;
д) изменение энтальпии;
е) работу, совершенную газом.
2. Изобразить процесс сжатия на диаграммах:
а) p-V; б) T-S
Принимаемые допущения:
1) температурной зависимостью теплоемкости можно
пренебречь;
2) смесь считается идеальным двухатомным газом;
3) Вычисление энергетических характеристик процесса
выполнить по первому закону термодинамики.
3. Контрольная работа 1.
Задача 1.Исходные данные:
1) Газовая смесь состоит из газов:
а) водорода Н 2 с массовой долей m1 0 ,04
б) азота N 2 с массовой долей m2 0 ,30
в) кислорода O2 с массовой долей m3 0 ,66
кг
2) Начальная плотность смеси 0 ,9 3
м
3) Сжатие происходит от давления p Н 0 ,10 МПа
до давления pК 290 ,00 МПа
4) Масса газовой смесиm 1,8кг
5) В момент окончания сжатия температура достигает
Т
40
С
значения К
4. Контрольная работа 1.
Решение задачи 1.1. Универсальная газовая постоянная численно равна
работе расширения одного моля газовой смеси в
изобарном процессе при увеличении температуры на 1ºК.
Расчетная формула: R 8314 , Дж
см
см кг К
где см - масса 1 кмоля газа, кг (численно равна
молекулярной массе
газовой смеси).
3
1
r
;
Имеем а) см
б) см
i
i
3
mi
i 1
i 1 i
где i молекулярная масса i-го компонента газа;
ri - объемная доля i-го компонента; m- i - массовая доля
i-го компонента
5. Контрольная работа 1.
Решение задачи 1.Воспользуемся формулой б).
Определяем молекулярные массы компонентов в газовой
смеси:
i xi Ai , где xi - количество атомов в
молекуле; Ai - атомный вес i-го компонента в смеси
газов. Для задачи имеем:
для газа - водород – Н 2
для газа – азот – N 2
x1 2
3 2 16 32
x2 2
А1 2
А2 14
x3 2
А3 16
Имеем: 1 2 1 2 2 2 14 28 3 2 16 32
Из условия задачи имеем: m1 0 ,04 ; m2 0 ,30 ; m3 0 ,66
для газа – кислород - O2
6. Контрольная работа 1.
Решение задачи 1.1
1
Масса 1 кмоля газа см 3
19,4930 кг
0
,
04
0
,
30
0
,
66
mi
2
28
32
i 1 i
Универсальная газовая постоянная равна
Rсм
8314
см
8314
Дж
426,5121,
19,4930
кг К
Показатель политропы – это показатель в уравнении
n
политропного процесса pV const
Связь между основными параметрами рабочего тела в
политропном процессе выражается следующими формулами:
p2 V1
a )
p1 V2
n
T2 V1
б )
T1 V2
n 1
n 1
n
T2 p2
в )
T1 p1
7.
Контрольная работа 1.Решение задачи 1.
Для определения показателя политропы n воспользуемся
n 1
последней формулой T p n
2
T1 p1
2
Параметры начала термодинамического процесса:
Давление: p1 pН 0 ,10 МПа
Температура находится из уравнения
p1V1
состояния: p1V1 RсмT1 ,откуда T1
Дж
Имеем: Rсм 426,5121,
кг К
Откуда
Rсм
m 1,8
V1 2 ,0 м 3
0 ,9
p1V1 0 ,1 106 2 ,0
T1
468,9199 К
Rсм
426,5121
8.
Контрольная работа 1.Решение задачи 1.
Параметры конца термодинамического процесса:
Давление: p2 pК 290 ,00 МПа
T
T
273
,
15
40
273
,
15
313
,
15
К
Температура: 2
K
n 1
n
n 1
290,0 n
Таким образом, имеем T2 p2 313,15
T1 p1
468,92 0 ,1
Откуда показатель политропы получается n=0,9518
Количество теплоты, используемое в процессе с газом
определяется выражением
Q m Cm T2 T1
где
C m - средняя мольная теплоемкость смеси газов в
пределах температур от T1 Т Н до T2 Т К
9.
Контрольная работа 1.Решение задачи 1.
Определение средней мольной теплоемкости смеси газов
3
Cm ri Cmi ,
i 1
где ri объемная доля i-го газа в смеси; Cmi - средняя мольная
теплоемкость i-го газа в смеси.
см
Имеем ri mi
. В нашем случае:
i
Для газа – водород m1 0,04;
1 2;
Для газа – азот m2 0 ,30;
2 28;
Для газа – кислород
m3 0 ,66;
r1 0 ,04
19,9930
0 ,3898
2
r2 0 ,30
3 32;
19,9930
0 ,2082
28
r3 0 ,66
19,9930
0 ,4020
32
10.
Контрольная работа 1.Решение задачи 1.
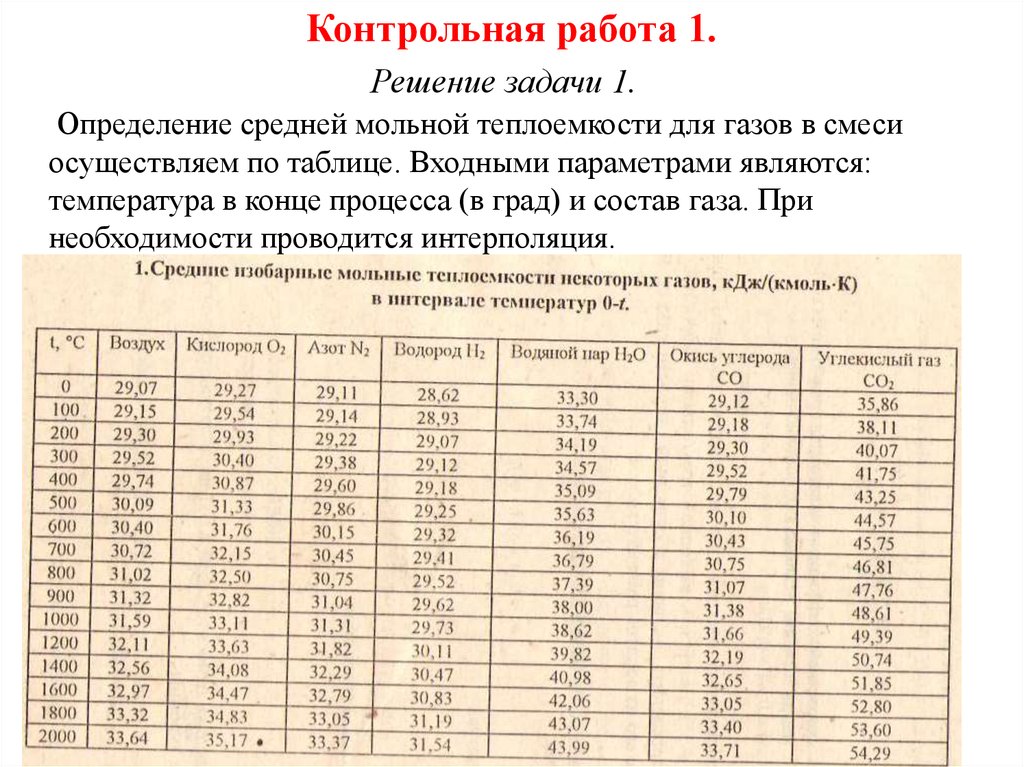
Определение средней мольной теплоемкости для газов в смеси
осуществляем по таблице. Входными параметрами являются:
температура в конце процесса (в град) и состав газа. При
необходимости проводится интерполяция.
11.
Контрольная работа 1.Решение задачи 1.
В нашем случае: температура
t1 T1 273,15 468,93 273,15 195,77 C
Средняя мольная теплоемкость газа в пределах до
температуры t1 195,77 C имеем:
Для газа – водород: С1 29 ,8605
Для газа – азот: С2 29 ,2177
Для газа – кислород: С3 29 ,9160
Средняя 3мольная теплоемкость смеси газов составляет:
Cm ri Cmi 0 ,3898 29,8605 0 ,2082 29,2177 0 ,4020 29,9160
i 1
29,7489
кДж
кмоль К
Количество теплоты, используемое в процессе с газом,
составляет
Q m Cm T2 T1 1,8 29,7489 313,15 468,93
8341,7106кДж
12.
Контрольная работа 1.Решение задачи 1.
Изменение внутренней энергии определяется выражением
u u2 u1 m cV T2 T1
где cV - массовая теплоемкость при постоянном объеме
Поскольку в задаче процесс происходит при постоянном объеме,
то имеем
C
29,7489
кДж
сV
m
см
19,9930
1,4880
кг К
Откуда, изменение внутренней энергии составит
u m cV T2 T1
1,8 1,4880 313,15 468,93 417,2412кДж
13.
Контрольная работа 1.Решение задачи 1.
Изменение энтальпии определяется выражением
i m c p T2 T1
где с p - массовая теплоемкость при постоянном давлении
Теплоемкости
с p сV Rсм
и
связаны между собой соотношениями
- уравнение Майера
Cp
- показатель адиабаты
cV
Rсм
426,5121
1
1,2866
Из них имеем: k 1
cV
1,4880 1000
кДж
с p k cV 1,2866 1,4880 1,9145
кг К
Изменение энтальпии составляет:
k
i m c p T2 T1 1,8 1,9145 313,15 468,92 536,7990кДж
14.
Контрольная работа 1.Решение задачи 1.
Работа, совершаемая газом в политропном процессе,
определяется выражением:
n 1
Rсм pк
l m l0 m
1
n 1
р
н
В нашем случае имеем
n
n 1
n
Rсм pк
l m l0 m
1
n 1
рн
0 ,9518 1
0
,
9518
426,5121 290,0
5288,042 Дж
1,8
1
0 ,9518 1 0 ,1
15.
Контрольная работа 1.Решение задачи 1.
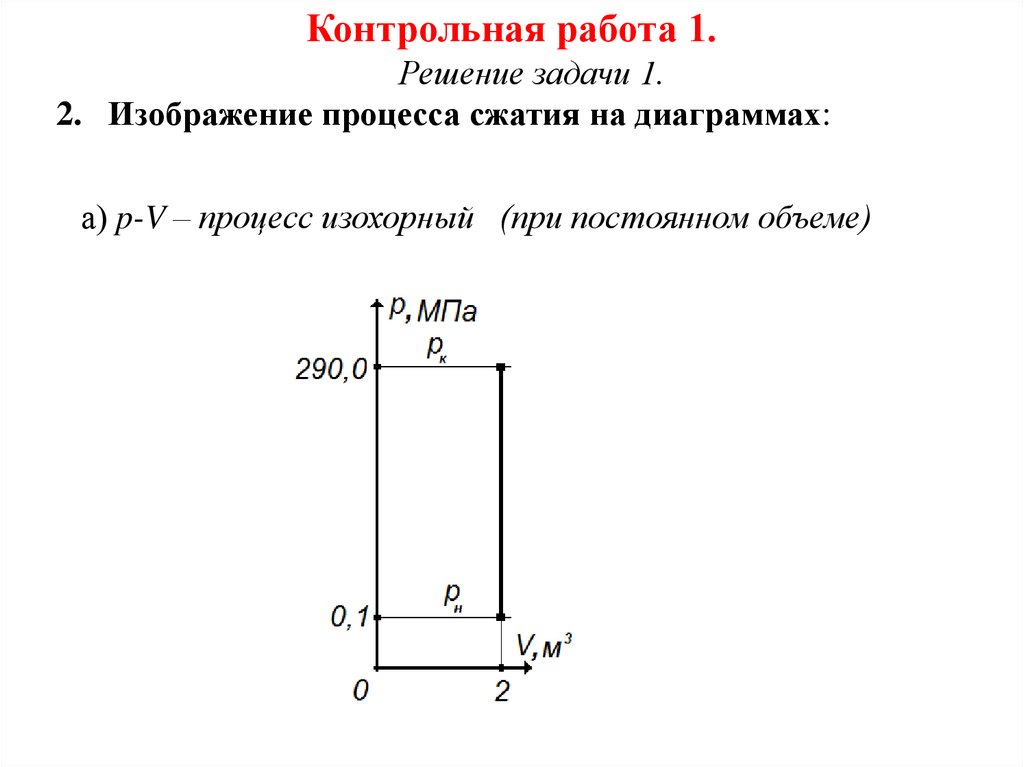
2. Изображение процесса сжатия на диаграммах:
а) p-V – процесс изохорный (при постоянном объеме)
16.
Контрольная работа 1.Решение задачи 1.
б) для изохорного процесса имеем:
T2
S2 S1 cV ln
T1
В нашем случае:
T
T
S S1 cV ln S1 1,4880 ln
468,92
T1
Точка 1: T1 468,92 K ;
S1
Точка 2:
T2 313,15 K ;
S2 S1 0 ,6008
Точка 3:
T3 391,04 K ;
S3 S1 0 ,2703
17.
Контрольная работа 1.Итоги решения задачи 1.
Универсальная газовая постоянная
Дж
Rсм 426,5121,
кг К
Показатель политропы n=0,9518
Количество теплоты
Q 8341,7106кДж
Изменение внутренней энергии
u 417,2412кДж
Изменение энтальпии i 536,7990кДж
Работа, совершаемая газом в политропном процессе
l 5288,042 Дж















 physics
physics








