Similar presentations:
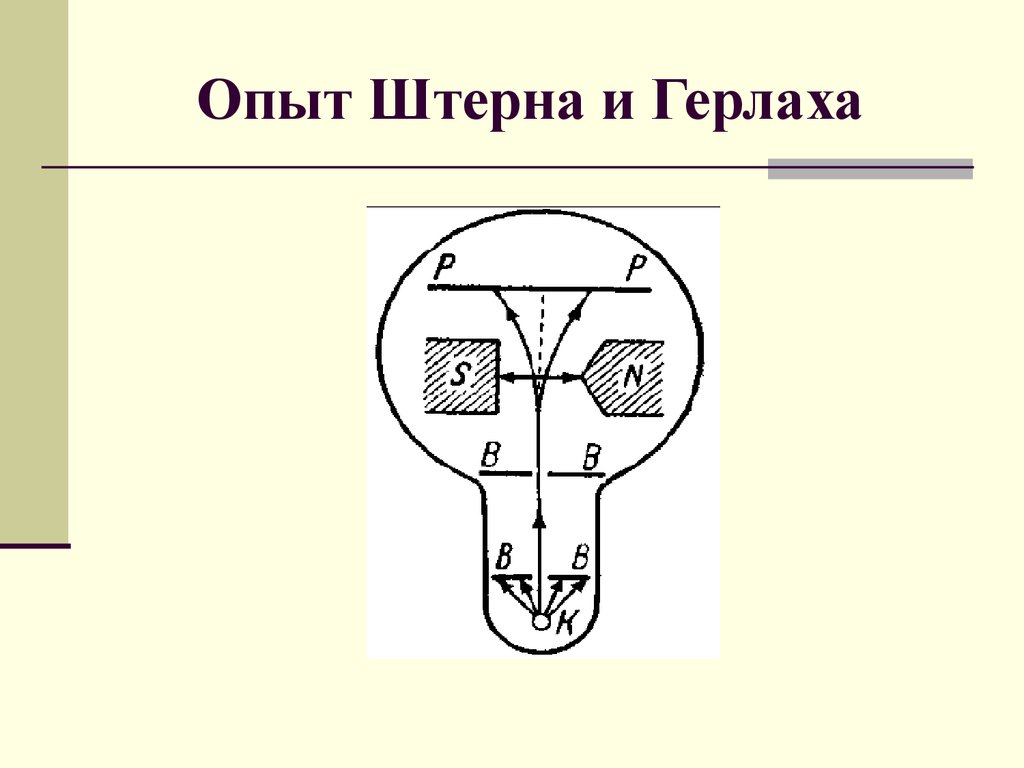
Опыт Штерна и Герлаха
1. Опыт Штерна и Герлаха
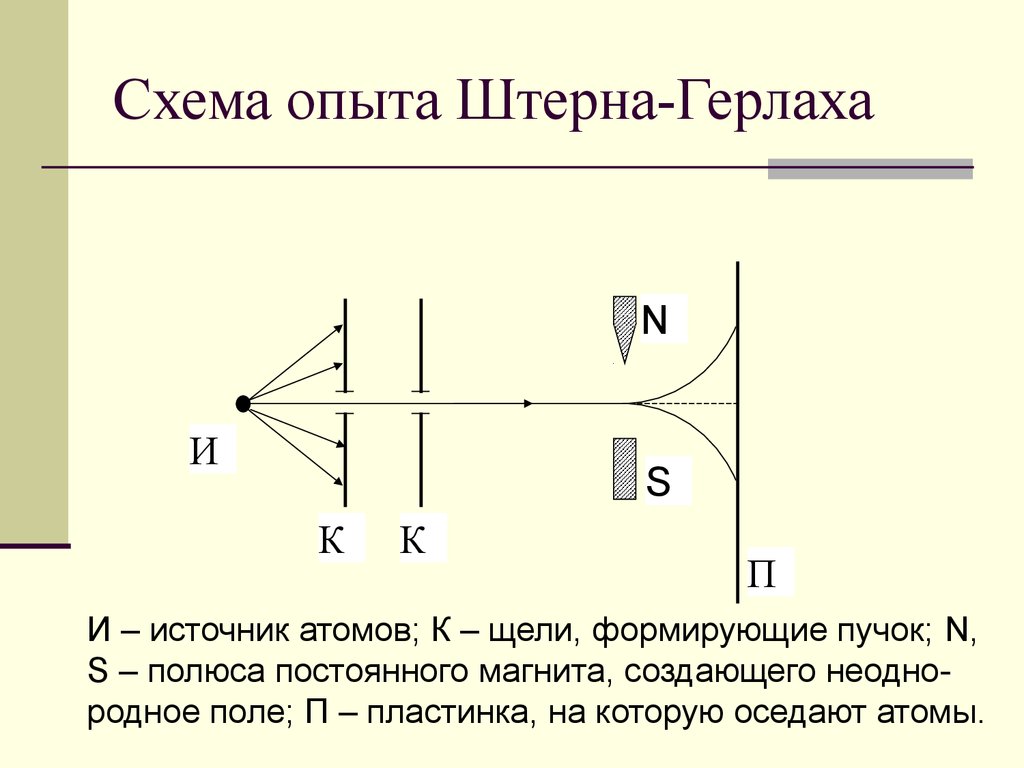
2. Схема опыта Штерна-Герлаха
NИ
S
К
К
П
И – источник атомов; К – щели, формирующие пучок; N,
S – полюса постоянного магнита, создающего неоднородное поле; П – пластинка, на которую оседают атомы.
3. Результаты опыта Штерна-Герлаха
4. Спиновое квантовое число (спин)
Д. Уленбек, С.ГаудсмитСпин - собственный механический момент
импульса электрона
s = ½ — спиновое квантовое число
Проекция спина на внешнее
магнитное поле квантуется
ms = ± ½ - магнитное спиновое квантовое число,
5. Принцип Паули. Распределение электронов в атоме.
Спин электрона6. Состояние электрона в атоме определяется набором квантовых чисел
7. Правила отбора
Переходы между электронными состояниямивозможны только в том случае, если:
1) изменение ∆l орбитального квантового
числа l удовлетворяет условию
∆l = ± 1
2) изменение ∆m магнитного квантового
числа m удовлетворяет условию
∆m = 0, ± 1
8. Принцип Паули
В одном и том же атоме не может быть болееодного электрона с одинаковым набором
четырех квантовых чисел n, l, m, ms .
Z(n, l, m, ms) =0 или 1
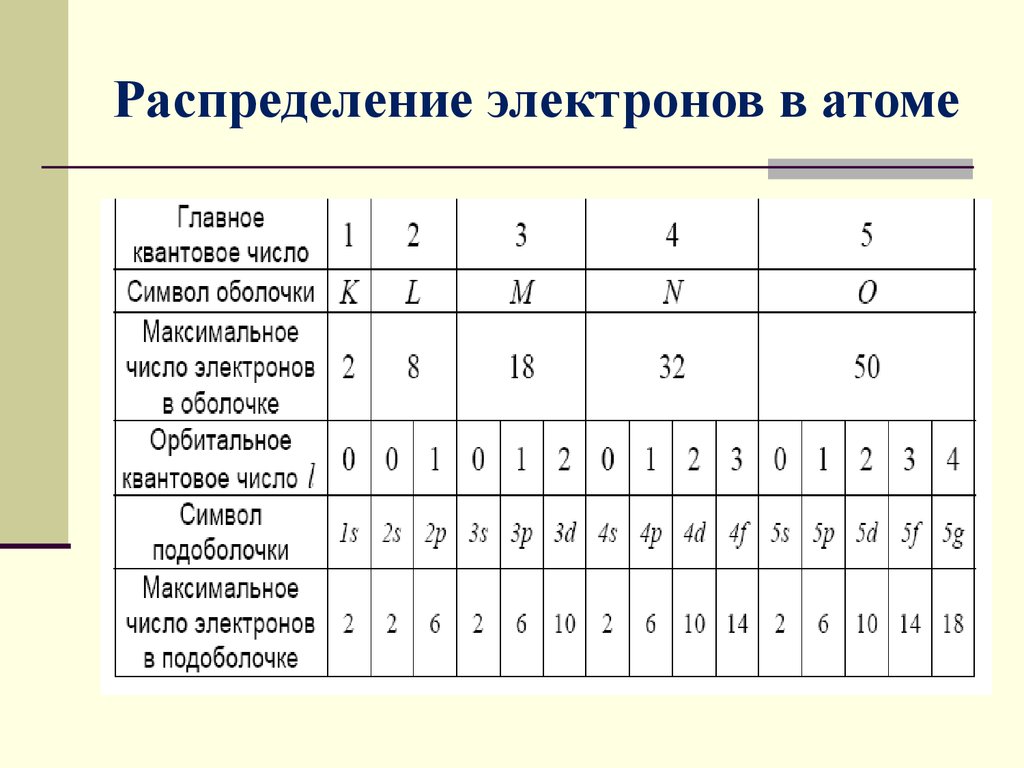
9. Распределение электронов в атоме по состояниям
Совокупность электронов в многоэлектронном атоме,имеющих одно и то же главное квантовое число n ,
называется электронной оболочкой (слой).
Максимальное число электронов, находящихся в
состояниях определяемых данным главным квантовым
числом, равно
В каждой из оболочек электроны распределяются по
подоболочкам, соответствующим данному l
10. Распределение электронов в атоме
11. Линейчатый спектр атома водорода
Швейцарский ученый И. Бальмер (1825—1898) подобралэмпирическую формулу, описывающую все известные
в то время спектральные линии атома водорода в видимой
области спектра:
1
1
R 2 2
n
2
(n 3, 4, 5, ...) ,
12.
В дальнейшем (в начале XX в.) в спектреатома водорода было обнаружено еще
несколько серий.
В ультрафиолетовой области спектра
находится серия Лаймана:
1
1
R 2 2
n
1
(n 2, 3, 4, ...) .
13. В инфракрасной области спектра были обнаружены:
11
R 2 2
n
3
1
1
o серия Брэкета R
42 n 2
o серия Пашена
1
1
o серия Пфунда R 2 2
n
5
1
1
o серия Хэмфри R 2 2
n
6
(n 4, 5, 6 ...) ;
(n 5, 6, 7, ...) ;
(n 6, 7, 8 ...) ;
(n 7, 8, 9, ...) .
14.
Все приведенные выше серии в спектреатома водорода могут быть описаны
одной формулой, называемой
обобщенной формулой Бальмера:
m имеет в каждой данной серии
постоянное значение, m = 1, 2, 3, 4, 5, 6
(определяет серию), n принимает
целочисленные значения начиная с m + 1
(определяет отдельные линии этой серии)
1
1
R 2 2 ,
n
m











 physics
physics








